Альтернативная водородная энергетика как
элемент школьного раздела химии : «Физико-химические свойства водорода»
ОГЛАВЛЕНИЕ
Введение
Глава 1. ОСНОВЫ СОЗДАНИЯ ВОДОРОДНОЙ ЭНЕРГЕТИКИ
1.1. Основные концепции надежности и экологической безопасности объектов энергетики
1.2 Энергетика сегодня
1.2.1 Энергетические потребности, ресурсы и возможности
1.2.2 Экологические проблемы энергетики и пути их решения
1.2.2.1 Парниковый эффект
1.2.2.2.Загрязнение атмосферы
1.2.2.3 Озоновые «дыры»
1.3 Особенности альтернативной водородной энергетики
1.3.1 Назначение, основные функциональные показатели
1.3.2 Область применения
1.3.3.Основания для выбора
1.3.4 Состояние и тенденции развития
1.3.5 Влияние водородной энергетики на окружающую среду
1.3.6 Дополнительные сведения о применении водорода
в бытовых целях
1.3.6 Пути развития водородной энергетики
1.3.7 Пиролиз воды
Глава 2. ЭКОЛОГИЧЕСКИЕ АСПЕКТЫ ПРОБЛЕМЫ СОЗДАНИЯ
ВОДОРОДНОЙ ЭНЕРГЕТИКИ
2.1 Сообщение 1. Суть водородной энергетики
2.2 Сообщение 2. Выполняется учениками, на основе материалов,
предоставленных учителем
2.3 Сообщение 3. Выполняется учениками, на основе материалов, предоставленных учителем
2.4 Сообщение 4. Выполняется учителем
2.5 Сообщение 5. Выполняется учениками, на основе материалов, предоставленных учителем
2.6.Сообщение 6. Выполняется учениками
2.7 Сообщение 7. Выполняется учителем при завершении изучения темы
Глава 3. ОСОБЕННОСТИ ИЗУЧЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТО В СРЕДНЕЙ ШКОЛЕ (НА ПРИМЕРЕ ВОДОРОДА)
3.1. Урок 1. Водород
3.2. Урок 2. Свойства и применение водорода
3. 3. Урок 3. Практическое занятие
3. 4. Урок 4. Контрольная работа
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА
ЗАКЛЮЧЕНИЕ
ВЫВОДЫ
ВВЕДЕНИЕ
Актуальность выбранной темы обусловлена тем, что вопрос о поиске альтернативных видов топлива для защиты окружающей среды от негативных воздействий вызывает интерес. А интерес учащихся к теме – это инструмент педагога, позволяющий намного облегчить усвоение материала и повысить качество знаний. К тому же теоретический анализ проблемы и разработка мероприятий по теме «Альтернативная водородная энергетика» с использованием новых методических приемов позволит решать задачи естественнонаучного образования, а именно формирование экологического и научного мировоззрения [1]. Кроме того, возрастание значимости экологических проблем требует постоянно изыскивать пути, дополнительные резервы повышения уровня преподавания естественнонаучных дисциплин, позволяющего формировать правильное отношение к окружающей среде и понимать закономерности развития природы.
Исходя из актуальности исследования, основной целью
данной дипломной работы являлось:
Рассмотрение возможности экологизации раздела химии: «Физико-химические свойства водорода» путем внедрения темы: «Альтернативная энергетика».
В связи с этим в дипломной работе решались следующие конкретные задачи:
1) разработать обзор сведений о водородной энергетике как альтернативном виде энергии
2) выбор соответствующих форм организации занятий в рамках
«Альтернативная водородная энергетика»;
3) составление тестовых заданий по изучаемой теме;
4) апробация разработанных методик в МОУ СОШ гимназии № 1 г. Нальчика;
Предмет исследования
– возможности введения в практику обучения новых прикладных и экологических аспектов при изучении темы «Альтернативная водородная энергетика».
Объект исследования
– познавательная деятельность учеников девятых классов МОУ СОШ №1 г. Нальчика.
Гипотеза
– разработка и реализация новых методических подходов к изучениютемы «Альтернативная водородная энергетика» с акцентированием на прикладные и экологические аспекты позволит сформировать положительную мотивацию к учению и сделать очередной шаг в процессе формирования экологического мировоззрения учащихся [2, 3].
Глава 1. ОСНОВЫ СОЗДАНИЯ ВОДОРОДНОЙ ЭНЕРГЕТИКИ
1.1 Основные концепции надежности и экологической безопасности объектов энергетики
Не так важно, каково ваше мнение о нуждах энергетики, об источниках энергии, ее качестве и себестоимости. Нам, по-видимому, следует лишь согласиться с тем, что сказал ученый мудрец, имя которого осталось неизвестным: «Нет простых решений, есть только разумный выбор».
Энергетические объекты (топливно-энергетический комплекс вообще и объекты энергетики в частности) по степени влияния на окружающую среду принадлежат к числу наиболее интенсивно воздействующих на биосферу.
Увеличение напоров и объемов водохранилищ гидроузлов, продолжение использования традиционных видов топлива (уголь, нефть, газ), строительство АЭС и других предприятий ядерного топливного цикла (ЯТЦ) выдвигают ряд принципиально важных задач глобального характера по оценке влияния энергетики на биосферу Земли. Если в предыдущие периоды выбор способов получения электрической и тепловой энергии, путей комплексного решения проблем энергетики, водного хозяйства, транспорта и др. и назначение основных параметров объектов (тип и мощность станции, объем водохранилища и др.) проводились в первую очередь на основе минимизации экономических затрат, то в настоящее время на первый план все более выдвигаются вопросы оценки возможных последствий возведения и эксплуатации объектов энергетики.
Это, прежде всего, относится к ядерной энергетике (АЭС и другие предприятия ЯТЦ), крупным гидроузлам, энергокомплексам, предприятиям, связанным с добычей и транспортом нефти и газа и т.п. Тенденции и темпы развития энергетики сейчас в значительной степени определяются уровнем надежности и безопасности (в том числе экологической) электростанций разного типа. К этим аспектам развития энергетики привлечено внимание специалистов и широкой общественности, вкладываются значительные материальные и интеллектуальные ресурсы, однако сама концепция надежности и безопасности потенциально опасных инженерных объектов остается во многом мало разработанной.
Развитие энергетического производства, по-видимому, следует рассматривать как один из аспектов современного этапа развития техносферы вообще (и энергетики в частности) и учитывать при разработке методов оценки и средств обеспечения надежности и экологической безопасности наиболее потенциально опасных технологий.
Одно из важнейших направлений решения проблемы - принятие комплекса технических и организационных решений на основе концепций теории риска.
Объекты энергетики, как и многие предприятия других отраслей промышленности, представляют источники неизбежного, потенциального, до настоящего времени практически количественно не учитываемого риска для населения и окружающей среды. Под надежностью объекта понимается его способность выполнять свои функции (в данном случае - выработка электро- и тепловой энергии) в заданных условиях эксплуатации в течение срока службы. Или наиболее подробно: свойство объекта сохранять во времени в установленных пределах значения всех параметров, характеризующие способность выполнять требуемые функции в заданных режимах и условиях применения.
Под экологической безопасностью понимается сохранение в регламентируемых пределах возможных отрицательных последствий воздействия объектов энергетики на природную среду. Регламентация этих негативных последствий связана с тем, что нельзя добиться полного исключения экологического ущерба.
Отрицательные последствия воздействия энергетики на окружающую среду следует ограничивать некоторым минимальным уровнем, например, социально-приемлемым допустимым уровнем. Должны работать экономические механизмы, реализующие компромисс между качеством среды обитания и социально-экономическими условиями жизни населения. Социально-приемлемый риск зависит от многих факторов, в частности, от особенностей объекта энергетики.
В силу специфики технологии использования водной энергии гидроэнергетические объекты преобразуют природные процессы на весьма длительные сроки. Например, водохранилище ГЭС (или система водохранилищ в случае каскада ГЭС) может существовать десятки и сотни лет, при этом на месте естественного водотока возникает техногенный объект с искусственным регулированием природных процессов - природно-техническая система (ПТС). В данном случае задача сводится к формированию такой ПТС, которая обеспечивала бы надежное и экологически безопасное формирование комплекса. При этом соотношение между основными подсистемами ПТС (техногенным объектом и природной средой) может быть существенно различным в зависимости от выбранных приоритетов - технических, экологических, социально-экономических и др., а принцип экологической безопасности может формулироваться, например, как поддержание некоторого устойчивого состояния создаваемой ПТС.
Другой оказывается постановка задачи оценки возможных последствий для окружающей среды при создании объектов ядерной энергетики. Здесь под экологической безопасностью понимается концепция, согласно которой при проектировании, строительстве, эксплуатации и снятии с эксплуатации АЭС, а также других объектов ЯТЦ предусматривается и обеспечивается сохранение региональных экосистем. При этом допускается некоторый экологический ущерб, риск которого не превосходит определенного (нормируемого) уровня. Этот риск минимален в период штатной эксплуатации АЭС, возрастает при возведении объекта и снятии его с эксплуатации и, особенно - в аварийных ситуациях. Необходимо учитывать влияние на окружающую среду всех основных факторов техногенного воздействия: радиационного, химического теплового (с учетом их возможного нелинейного взаимодействия). Следует иметь в виду и различные масштабы возможных последствий: локальный (тепловое пятно сброса подогретых вод в водоемы и водотоки), региональный (выброс радионуклидов), глобальный (рассеяние долгоживущих радионуклидов по биосферным каналам). Если же создается крупное водохранилище - охладитель, то, как в случае гидроэнергетического объекта, должна ставиться задача об экологически безопасном функционировании сложной ПТС (с учетом отмеченной специфики АЭС).
Аналогичный круг вопросов следует рассматривать при формулировании концепции экологической безопасности объектов теплоэнергетики: учет теплового и химического воздействия на окружающую среду, влияние водоемов-охладителей и т.п. Кроме того, для крупных ТЭС на твердом топливе (уголь, сланцы) возникают проблемы надежной и безопасной эксплуатации золоотвалов - сложных и ответственных грунтовых гидросооружений. И здесь надо ставить задачу о безопасном функционировании ПТС «ТЭС - окружающая среда» [1].
К сожалению, запасы нефти, газа, угля отнюдь не бесконечны. Природе, чтобы создать эти запасы, потребовались миллионы лет, а израсходованы они будут за сотни. Сегодня в мире стали всерьез задумываться над тем, как не допустить хищнического разграбления земных богатств. Ведь лишь при этом условии запасов топлива может хватить на века. Что же произойдет тогда, когда месторождения нефти и газа будут исчерпаны? Происшедшее повышение цен на нефть, необходимую не только энергетике, но и транспорту, и химии, заставило задуматься о других видах топлива, пригодных для замены нефти и газа. Решение этой задачи исследователи ищут на разных путях. Самым заманчивым является использование вечных, возобновляемых источников энергии - энергии текущей воды и ветра, океанских приливов и отливов, тепла земных недр, солнца. Много внимания уделяется развитию атомной энергетики, ученые ищут способы воспроизведения на Земле процессов, протекающих в звездах и снабжающих их колоссальными запасами энергии.
Рождение энергетики произошло несколько миллионов лет тому назад, когда люди научились использовать огонь. Огонь давал им тепло и свет, и был источником вдохновения и оптимизма, оружием против врагов и диких зверей, лечебным средством, помощником в земледелии, консервантом продуктов, технологическим средством и т. д.
На протяжении многих лет огонь поддерживался путем сжигания растительных энергоносителей (древесины, кустарников, камыша, травы, сухих водорослей и т. п.), а затем была обнаружена возможность использовать для поддержания огня ископаемые вещества: каменный уголь, нефть, сланцы, торф.
Прекрасный миф о Прометее, даровавшем людям огонь, появился в Древней Греции значительно позже того, как во многих частях света были освоены методы довольно изощренного обращения с огнем, его получением и тушением, сохранением огня и рациональным использованием топлива.
Сейчас известно, что древесина – это аккумулированная с помощью фотосинтеза солнечная энергия. При сгорании каждого килограмма сухой древесины выделяется около 20 000 кДж тепла, теплота сгорания бурого угля равна примерно 13 000 кДж/кг, антрацита 25 000 кДж/кг, нефти и нефтепродуктов 42 000 кДж/кг, а природного газа 45 000 кДж/кг. Самой высокой теплотой сгорания обладает водород 120 000 кДж/кг.
На наших глазах набирает силу новая отрасль промышленности – водородная энергетика и технология. Потребность экономики в водороде идет по нарастающей. Ведь это простейшее и легчайшее вещество может использоваться не только как топливо, но и как необходимый сырьевой элемент во многих технологических процессах. Он незаменим в нефтехимии для глубокой переработки нефти, без него не обойтись, скажем, в химии при получении аммиака и азотных удобрений, а в черной металлургии с его помощью восстанавливается железо из руд. Такие существующие виды органического топлива, как газ, нефть и уголь, тоже служат сырьем в этих и подобных процессах, но еще полезнее извлечь из них самый экономный и чистый энергоноситель – тот же водород. Водород – идеальный экофильный вид топлива. Очень высока и его калорийность – 33 тыс. ккал/кг, что в 3 раза выше калорийности бензина. Он легко транспортируется по газопроводам, потому что у него очень малая вязкость. По трубопроводу диаметром 1, 5 м с ним передается 20 тыс. Мегаватт мощности. Перекачка легчайшего газа на расстояние в 500 км почти вдесятеро дешевле, чем передача такого же количества электроэнергии по линиям электропередачи. Как и природный газ, водород пригоден на кухне для приготовления пищи, для отопления и освещения зданий. Чтобы продемонстрировать его возможности, американские ученые построили «водородный дом», в котором для освещения использовали водород. Передавать водород в жидком виде – удовольствие очень дорогое, т. к. для его сжижения нужно потратить почти половину энергии, содержащейся в нем самом. Кроме того, температура жидкого водорода очень низка.
Как топливо водород сжигается в двигателях ракет и в топливных элементах для непосредственного получения электроэнергии при соединении водорода и кислорода. Его можно использовать и как топливо для авиационного транспорта.
Водородная энергетика сулит ряд выгод. Поэтому появилось много энтузиастов водородной энергетики, возникли их ассоциации, в том числе международная.
Сейчас в мире получают около 30 миллионов тонн водорода в год, причем в основном из природного газа. Согласно прогнозам за 40 лет производство водорода увеличиться в 20-30 раз. Предстоит с помощью атомной энергетики заменить нынешний источник водорода – природный газ – на более дешевое и доступное сырье – на воду. Здесь возможны два пути.
Первый путь – традиционный, с помощью электрохимического разложения воды.
Второй путь менее известен. Если нагреть пары воды до 3000-3500 °С, то водные молекулы развалятся сами собой.
Оба способа получить водород из воды пока дороже, чем из природного газа. Однако природный газ дорожает, а методы разложения воды совершенствуются. Через какое-то время получать водород из воды станет дешевле. В отдельных случаях и сейчас выгодно получать водород с помощью электролиза в ночные часы, когда имеется лишняя и дешевая электроэнергия.
Водородная энергетика бурно развивается, но недаром все чаще говорят об атомно-водородной энергетике. Требуются большие энергетические расходы для получения водорода. Тандем «ядерный реактор – водородный генератор» - претендует ныне на роль энергетического лидера в экономике нынешнего, XXI, века.
Этапы развития водородной энергетики, изложенные выше, показывают, что она является реальной перспективой альтернативной энергетики. Это диктует подготовку высококвалифицированных специалистов – энергетиков с экологической направленностью. Формирование таких специалистов начинается в школе. С этой точки зрения, прочным фундаментом или одним из кирпичиков такого фундамента может послужить методически правильное и оформленное освоение раздела «Водород» школьного курса химии, сочетающего элементы технологии и экологии водородной энергетики.
1.2 Энергетика сегодня
1.2.1 Энергетические потребности, ресурсы и возможности
На первых этапах развития цивилизации использовались первичные природные энергетические ресурсы - древесина, затем ископаемый уголь. Постепенно начинает использоваться энергия ветра и воды. Примитивные ветряные двигатели (ветряные мельницы) появились еще 2 тысячи лет назад. Природный битум начал использоваться 1 тысячу лет назад. Первые нефтяные скважины появились в ХУН веке, а в середине XIX века началась промышленная добыча нефти и газа. В эпоху индустриализации потребность в энергетических ресурсах резко увеличивается, но расширяются и возможности человечества: началось производство электроэнергии с использованием гидроресурсов, энергии Солнца и атомной энергии. Использование энергетических ресурсов во все времена ограничивалось запасами природных энергоресурсов, возможностями человека извлекать энергию из этих энергоресурсов и последствиями их извлечения и использования.
1.2.2 Экологические проблемы энергетики и пути их решения
Воздействие энергетики на окружающую среду разнообразно и определяется видом энергоресурсов и типом энергоустановок. Приблизительно 1/4 всех потребляемых энергоресурсов приходится на долю электроэнергетики. Остальные 3/4 приходятся на промышленное и бытовое тепло, на транспорт, металлургические и химические процессы. Ежегодное потребление энергии в мире приближается к 22 млрд. т. Теплоэнергетика в основном потребляет твердое топливо. Самое распространенное твердое топливо нашей планеты - уголь. И с экологической и с экономической точки зрения метод прямого сжигания угля для получения электроэнергии - не лучший способ использования твердого топлива. При сжигании жидкого топлива с дымовыми газами в атмосферу воздуха поступают: сернистые ангидриды, оксиды азота, окись и двуокись углерода, газообразные и твердые продукты неполного сгорания топлива, соединения ванадия, соли натрия, и др. С точки зрения экологии жидкое топливо менее вредно, чем уголь. Если уровень загрязнения атмосферы при использовании угля принять за 1, то сжигание мазута даст 0,6, а использование природного газа снижает эту величину до 0,2.
1.2.2.1 Парниковый эффект
Повышение концентрации углекислого газа в атмосфере вызывает так называемый парниковый эффект, который получил название по аналогии с перегревом растений в парнике. Роль пленки в атмосфере выполняет углекислый газ. В последние годы стала известна подобная роль и некоторых других газов (СН4
и N2
О). Количество метана увеличивается ежегодно на 1 %, углекислого газа - на 0,4%, закиси азота - на 0,2%. Считается, что углекислый газ ответственен за половину парникового эффекта.
1.2.2.2 Загрязнение атмосферы
Негативное влияние энергетики на атмосферу сказывается в виде твердых частиц, аэрозолей и химических загрязнений. Особое значение имеют химические загрязнения. Главным из них считается сернистый газ, выделяющийся при сжигании угля, сланцев, нефти, в которых содержатся примеси серы. Некоторые виды угля с высоким содержанием серы дают до 1 т сернистого газа на 1О т сгоревшего угля. Сейчас вся атмосфера земного шара загрязнена сернистым газом. Идет окисление до серного ангидрида, а последний вместе с дождем выпадает на землю в виде серной кислоты. Эти осадки называют - кислотными дождями. То же самое происходит и после поглощения дождем диоксида азота - образуется азотная кислота [2].
1.2.2.3
Озоновые
"дыры"
Впервые уменьшение толщины озонового слоя было обнаружено над Антарктидой.
Этот эффект - результат антропогенного воздействия. Сейчас обнаружены и другие озоновые дыры. В настоящее время заметно уменьшение количества озона в атмосфере над всей планетой. Оно составляет 5-6% за десятилетие в зимнее время и 2-3% - в летнее время. Некоторые ученые считают, что это проявление действия фреонов (хлорфторметанов), но озон разрушается также оксидом азота, которые выбрасываются предприятиями энергетики. Отрицательное влияние атомных электростанций сказывается, прежде всего, на атмосфере. Правда, при нормальной работе АЭС вероятность радиоактивного загрязнения невелика. Но в случае аварии воздействие радиоактивных выбросов носит глобальный характер.
Сегодня глобальная среднегодовая потребность в энергии составляет ~8 трлн. ватт.
Иными словами для обеспечения нужд одного жителя Земли нужно 12 человек обслуживающего персонала.
Если наш образ жизни, будет и дальше так развиваться, как сейчас, то в будущем потребность в энергии станет громадной. Если производство продовольствия будет идти в ногу с ростом населения, то к 2000 г. производство азотных удобрений должно увеличиться в 1 00 раз. Одно лишь это потребует около 20% объёма ныне производимой энергии. Опреснённая вода, которая часто рассматривается как неотъемлемая часть будущего, для своего получения требует громадных затрат энергии.
Среднегодовое потребление энергии увеличивается на 5.7%. Если этот темп сохранится, за следующие 20 лет расход энергии увеличится в 4.5 раза. Основным источником получения энергии в мире дающим 97% её количества является ископаемое топливо, в том числе 38% составляет уголь, 19%-природный газ и 10%- нефть.2% электроэнергии вырабатывается на ГЭС, а другие источники, такие как ядерный распад, древесина и прочие вырабатывают 1 % энергии [3].
Таблица 1.
Энергетические системы, пригодные для использования человеком
| № вида |
Энергетические системы |
ТИП 1
(основаны на возобновляемых источниках энергии)
|
| 1. |
На:
гравитационных силах; молекулярном движении; движении приливов и волн; движении воздуха; геотермальных силах
|
| 2. |
фотосинтезе растений; жизнедеятельности организма |
| 3. |
Фотохимических, фотоэлектрических и
термоэлектрических процессах
|
ТИП 2
(основаны на возобновляемых источниках энергии)
|
| 1. |
На:
сжигании радиационного топлива
|
| 2. |
внутриядерных процессах |
| 3. |
биохимическом преобразовании энергии |
| 4. |
водородном топливе |
Всего сказанного выше достаточно для того, чтобы убедиться в необходимости пере хода человечества на новые виды энергии, не связанные со сжиганием традиционного топлива. Для удобства рассмотрения вопросов поиска новых источников энергии кажется целесообразным, прежде всего, все существующие на земном шаре энергетические системы, использование которых осуществляется или потенциально может осуществляться человеком, разделить условно на два типа:
- системы, основанные на возобновляемых источниках энергии;
- системы, основанные на невозобновляемых источниках.
Каждый тип, в свою очередь, можно подразделить на несколько видов энергетических систем (табл. 1).
Системы, относящиеся к первому виду, малоперспективны, несмотря на их экологическую чистоту. В начале века, по имеющимся оценкам, они смогут удовлетворить мировые потребности лишь на 5 - 10% [4].
Таблица
2
Различные источники энергии, их состояние, экологичность, перспективы развития
| Источник энергии |
Состояние и экологичность |
Перспективы использования |
| Уголь |
Твердое
Химическое загрязнение атмосферы, условно принятое за 1
|
Потенциальные запасы 10125 млрд. т, перспективен не менее чем на 100 лет |
| Нефть |
Жидкое
Химическое загрязгнение атмосферы 0, 6 условных единиц
|
Потенциальные запасы 270-290 млрд. т, перспективен не менее чем на 30 лет |
| Газ |
Газообразное
Химическое загрязгнение атмосферы 0, 2 условных единиц
|
Потенциальные запасы 270 млрд. т, перспективен на 30 - 50 лет |
| Сланцы |
Твердое
Значит. Количество отходов и трудно устраняемые выбросы
|
Запасы более 38400 млрд. т, малоперспективен из-за загрязнений |
| Торф |
Твердое
Высокая зольность и эколог. нарушения в местах добычи
|
Запасы значительны: 150 млрд. т, малоперспективен из-за высокой зольности и экол. нарушений в местах выработки |
| Гидроэнергия |
Жидкое
Нарушение экологич. баланса
|
Запасы 890 млн. т нефт. эквивалента |
| Геотермальная энергия |
Жидкое
Химическое загрязнение
|
Неисчерпаемы, перспективен |
| Солнечная энергия |
Практически неисчерпаем |
| Энергия приливов |
Жидкое
Тепловое загрязнение
|
Практически неисчерпаем |
| Энергия атомного распада |
Твердое |
Запасы физически исчерпаемы, экологически опасен |
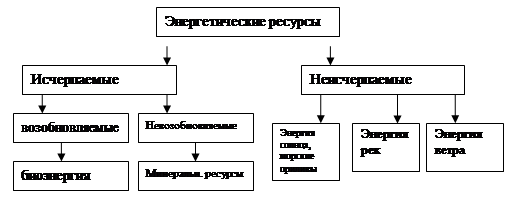
Схема 1 . Энергетические ресурсы и структура использования
Соотношение используемых энергетических ресурсов в истории человечества менялось с развитием цивилизации в зависимости от истощения исчерпаемых энергоресурсов, возможности использования и экологических последствий. За последние 200 лет можно выделить три этапа:
можно выделить три этапа:
·угольный этап охватывающий весь XIX век и первую половину ХХ века, в это время преобладает потребление угольного топлива;
·нефтегазовый этап со второй половины ХХ века до 80-х годов, на смену углю приходит газ и нефть как более эффективные энергоносители чем твердые;
·начиная с 80-х годов начинается постепенный переход от использования минеральных исчерпаемых ресурсов к неисчерпаемым (энергии Солнца, воды, ветра, приливов и т.д.).
Особо следует сказать о ядерной энергетике. С начала мирового энергетического
кризиса роль атомной энергетики возросла. Но уже в начале 80-х годов рост потребления атомной энергии замедлился. В большинстве стран были пересмотрены планы сооружения АЭС. Это было последствием ряда экологических загрязнений при авариях, особенно в результате Чернобыльской катастрофы. Именно в этот период многие страны приняли решение о полном или постепенном отказе от развития атомной энергетики.
1.3 Особенности альтернативной водородной энергетики
Водородная энергетика включает следующие основные направления:
Разработка эффективных методов и процессов крупномасштабного получения дешевого водорода из метана и сероводородсодержащего природного газа, а также на базе разложения воды; технологии хранения, транспортировки и использования водорода в энергетике, промышленности, на транспорте.
1.3.1 Назначение, основные функциональные показатели
Водородная технология позволит остановить прогрессирующий рост загрязнения окружающей среды, исключив или принципиально сократив эмиссию токсикоагентов в тропосферу, в том числе, приземный слой атмосферы.
При получении больших объемов водорода из метана и серо содержащих природных газов может быть использована плазменно-мембранная технология удельной производительностью более чем в 100 раз выше по сравнению с традиционной. Удельные энергозатраты на производство 1 м3
водорода оказываются ниже реализованных в традиционной технологии в 2-3 раза (около 1 кВт/ч).
Производство водорода из воды возможно на новом типе электролизеров на базе катионопроводящей мембраны МФ-4СК, выпускаемой в России и обеспечивающей получение водорода более высокой чистоты с удельными энергозатратами в 1,5 меньшими, чем у традиционных систем. Удельная производительность аппаратов в 10 раз выше, чем у предыдущего поколения.
1.3.2 Область применения
Водородная технология используется для автономного обеспечения различных видов наземного транспорта и жидководородных силовых установок для авиации, стационарных энергосистем с водородным аккумулированием энергии (ветровые, солнечные и другие виды энергоустройств). Применение водорода в химии, газо- и нефтехимии, производстве минеральных удобрений, биотехнологии, металлургии и т.д. позволит отказаться от традиционной организации процесса, повысить его качество и экономичность при ликвидации полного или основного выброса загрязняющих веществ в атмосферу.
1.3.3 Основания для выбора
Технология даст возможность крупномасштабно получать дешевый водород в качестве ценного сырья и реагента при производстве удобрений, метанола, а также в процессах переработки нефти. Ресурсы сырья практически неограниченны. Водород является экологически чистым энергоносителем и его применение в энергетике, промышленности и на транспорте окажет положительное влияние на состояние окружающей среды.
1.3.4 Состояние и тенденция развития
В настоящее время в России создан ряд демонстрационных установок, реализующих новые высокоэффективные технологии получения и использования водорода из метана, природных серосодержащих газов с помощью плазменно-мембранной технологии. При этом исключаются катализаторы и традиционные жидкостные системы газораспределения. Оно осуществляется посредством мембранных аппаратов. Существующие в мире системы имеют вместо этой стадии громоздкий термокаталитический процесс, экологически некорректный, с более высокими энергозатратами (в 2-3 раза) и низкой удельной производительностью.
В настоящее время успешно завершаются исследования и разработки на уровне мощности 200 кВт на площадке ГНЦ "Курчатовский институт" и требуется переход к опытно-промышленной стадии на уровне мощности 1 МВт и производительности 10 м3
/час. Предлагаемая технология не имеет мировых аналогов, к ней проявляет интерес ряд ведущих зарубежных фирм.
Для высокоэффективных электролизеров на основе катионопроводящей мембраны МФ-4СК в настоящее время завершен цикл НИОКР и создано производство электролизеров с улучшенными показателями на базе российской технологии. Типоразмерный ряд доведен до производительности 20 м3/час и необходим завершающий этап по созданию 100 м3/час электролизера. Уровень лучших зарубежных разработок 50 м3/час на базе мембраны "Nafion" по удельным характеристикам близок к основным параметрам, указанным выше [5].
На базе той же отечественной мембраны в России созданы электрохимические генераторы 10-20 кВт, использующие водородо-воздушную смесь и имеющие КПД до 75%, при этом системы эмитируют только чистую воду, токсичные компоненты выброса отсутствуют полностью.
1.3.5 Влияние водородной энергетики на окружающую среду
При рассмотрении основных принципов водородной энергетики и ее влияния на окружающую среду, нельзя ограничиваться лишь загрязнением воздуха, так как это не единственный тип загрязнения. При сравнении различных энергетических источников следует обсудить и другие аспекты. Под этим можно подразумевать эффективность источников энергии, поэтому важно сопоставить водородную энергетику с другими энергетическими системами, такими как уголь - синтетическое топливо, атомная энергия - водород, атомная энергия - электричество и др.
С точки зрения охраны окружающей среды варианты водородной энергетики оцениваются выше старых энергетических систем, использующих ископаемые топлива. Заслуживает внимания тот факт, что, хотя энергетическая система солнечная система - водород самая безопасная по отношению к окружающей среде, все же система солнечная энергия - электричество будет эффективнее, так как в ней используется меньшее количество материалов. Предполагается что система солнечная система - водород будет работать в сочетании с фотогальваническими элементами, в которых расходуется большое количество кремния. Поэтому, если система море-солнце или с ветровой энергией, то влияние на окружающую среду будет меньше, и энергетическая система солнечная система водород будет более приемлемой, чем система солнечная система - электричество [6].
1.3.6
Дополнительные сведения о применении водорода в бытовых целях
Вся энергия, предназначенная для бытовых целей, может быть получена из водорода (освещение, отопление и приготовление пищи). Однако это не самый оптимальный путь применения водорода.
Освещение, отопление и приготовление пищи.
Для освещения не обязательно применять электричество, можно воспользоваться «холодным светом», получаемым при взаимодействии водорода с фосфором. Для приготовления пищи, отопления помещений может быть использован специальный керамический материал. Однако отопление помещений лучше осуществлять с помощью электрических насосов.
Электричество в доме.
По-видимому, при внедрении водородной энергетики уменьшится потребление электроэнергии в жилых домах. Снизятся затраты на работу различных электронных устройств. Однако для снабжения водородом зданий необходимо полностью переоборудовать трубопроводы, горелки и большую часть другого оборудования [1].
1.3.7 Пути развития водородной энергетики
Следует сразу установить, что преимущества водородной энергетики могут быть достигнуты только путем постадийного внедрения этой энергетики (исследование, проектирование, создание опытной установки, небольшая проверка, более крупная проверка и, наконец, полный переход на водородную энергетику). На первой стадии в качестве источника для получения водорода можно использовать уголь, который при нагревании с водой образует смесь СО и Н2
; СО затем будет окислен до СО2
и выброшен в атмосферу, а Н2
доставят по трубопроводу на ближайшую установку. Здесь он может быть использован для получения электричества.
Во второй стадии в качестве источника энергии для получения водорода может быть использована ядерная установка; образующийся водород затем будет доставляться в город и применяться для получения электроэнергии или для работы части транспорта.
На третьей стадии может быть использован маленький город (например, с населением 10 000), где будет построена станция для сбора солнечной энергии. Если это гористая местность, можно установить экспериментальные крупные аэрогенераторы.
Важной является четвертая стадия освоения, на осуществление которой необходимы суммы, исчисляемые миллиардами. На этой стадии следует перевести часть энергетики на водород, например, жилищно-коммунальное хозяйство, транспорт, промышленность.
Экологическая "чистота" водорода не вызывает сомнений, если учесть, что практически единственным продуктом его сгорания является вода и что в этом случае полностью отсутствуют характерные для углеводородных топлив загрязняющие атмосферу соединения типа диоксидов углерода и серы, а также паров углеводородов. Кроме того, водород это и достаточно калорийное топливо. По теплотам сгорания (34 ккал/г) он намного превосходит такие классические виды топлива, как углеводороды (10 ккал/г) и древесина (4 ккa/г).
Конечно, нельзя не учитывать и большие трудности, связанные с решением и ряда дополнительных задач, таких, как:
а) поиск и разработка первичных источников энергии, которые могут быть использованы для синтеза водорода;
б) безопасность хранения, транспорта и больших количеств газообразного и жидкого водорода;
в) эффективное преобразование энергии водорода при решении ряда конкретных энергетических задач.
Если говорить о поисках и разработках первичных источников, которые могут быть использованы для синтеза водорода, то, вероятно, следует начать с простейшего способа, известного каждому, кто хотя бы немного знаком с химией, - взаимодействия кислот и оснований с металлами:
Zn + (2HCl)aq → (ZnC12
)aq
+ H2
↑
Аl + (2NaOH)aq → (NaAIО2
)aq
+ 3/2H2
↑
В плане дальнейшего изложения очень важно подчеркнуть, что перспективными для создания водородной энергетики могут считаться только способы, основанные на использовании воды в качестве исходного сырья. Поэтому в дальнейшем при написании тех или иных уравнений химических реакций индекс "aq", характеризующий водную среду, будет опускаться.
Процесс необратим и для получения металла из образовавшихся оксидов (для повторного их применения) требует значительных затрат энергии.
Заслуживают внимания три варианта получения водорода из органического сырья.
Один из них - паровая конверсия металла, являющегося главным компонентом природного газа:
СН4
+ Н2
О → СО + 3Н2
- 50 ккал
СО + Н2
О → СО + Н2
+ 10 ккал
______________________________
СН4
+ 2Н2
О → СО2
+ 4Н2
- 40 ккал
Второй более совершенный вариант основывается на парокислородной конверсии:
2СН4
+ О2
→ 2СО + 4Н2
+ 16 ккал
СН4
+ Н2
О → СО + 3Н2
- 50 ккал
______________________________
7СН4
+ 3О2
+ Н2
О → 7СО + 15Н2
Последующий процесс, связанный с конверсией СО, протекает, как и в первом варианте. Однако, как следует из уравнений в обоих вариантах, требуется затрата больших количеств дефицитного природного газа как исходного сырья.
Третий вариант основан на использовании процесса газификации угля:
2Ств
+ О2
→ 2СО + 55 ккал
СТВ
+ Н2
О пар → СО + Н2
- 30 ккал
Комбинацией этих двух реакций можно получить смесь СО и Н2
называемую "водяным газом" или «синтез газом». В последнее время метод получения водорода из воды и угля считается одним из наиболее перспективных. Весьма перспективным, по мнению специалистов, является вариант использования водяного пара для восстановления окислов железа при 800-9000
С:
2Fез
О
4
+ СО + Н
2
→
6FеО
+
Н2
О
+ СО2
- 22 ккал
с последующей обработкой FeO водяным паром при 600-700 0
С. После конденсации паров воды можно получить чистый водород:
3
FeO
+
Н2
О→
Fe
з
О4
+ Н2
+ 16ккал
Экономичность процесса здесь возрастает вследствие того, что последняя реакция экзотермична и позволяет некоторое количество выделяющегося тепла использовать для нагрева водяного газа до температур, при которых в соответствии с данной реакцией имеет место восстановление окислов железа. Несмотря на определенные трудности, железопаровой вариант получения водорода привлекает в настоящее время внимание большого числа исследователей во всех странах мира, поскольку связан с возможностью использования дешевых низкосортных углей в качестве восстановителя водяного газа. Казалось бы, самым простым и чистым способом получения водорода должен быть электролизный способ, непосредственно расщепляющий молекулу воды на водород и кислород. Однако этот процесс сам требует много электрической энергии и экономически пока остается невыгодным [2, 4, 5-15].
В электрохимии имеется такое понятие, как перенапряжение. Оно связано с избыточным напряжением, которое нужно приложить к электролитической ванне сверх ее равновесной электродвижущей силы для того, чтобы мог протекать процесс электролиза. При электролизе воды с целью получения водорода на катоде перенапряжение увеличивает необходимое электрическое напряжение и происходит дополнительный расход энергии. При величине напряжения в 0,3 В на каждые 1000 кг водорода требуется дополнительный расход 8300 квт-ч электроэнергии. Большая величина перенапряжения выделения водорода обусловливает то, что стоимость электролизного водорода пока в 2 - 2,5 раза выше стоимости водорода, получаемого из природного газа. В этой связи, однако, заслуживает должного внимания возможность практического осуществления варианта комбинирующего электролиза с прямым пиролизом воды. Последняя реакция (реакция пиролиза воды) сама по себе кажется весьма перспективной и первоначально заслуживает самостоятельного рассмотрения [4, 16-18].
l.3.8 Пuролuз воды
Для того, чтобы получать водород за счет термического разложения воды
2 Н2
О ↔ Н2
+ О2
нужно очень много тепла, т.е. нужно нагревать водяной пар до температур порядка нескольких тысяч градусов. Такой процесс может быть осуществлен только с применением устройств типа дугового плазмотрона. Однако здесь может быть применен принцип так называемых термохимических циклов, сущность которого состоит в том, что сильно эндотермический процесс разложения воды может быть расчленен на ряд последовательно чередующихся эндо - и экзотермических стадий, каждая из которых для своего осуществления требует значительно более низких температур, чем реакция (13). В свою очередь, возможность получения водорода путем термохимических реакций с использованием низкотемпературного тепла (700 - 900 ОС) открывает перспективы широкого использования тепла атомных реакторов. Это тем более заманчиво, что таким образом решаются проблемы получения водорода и утилизации тепла атомных реакторов, которое представляет возможную угрозу тепловому балансу в биосфере. Как правило, экзотермические стадии связаны с образованием неустойчивых продуктов окисления, и в частности кислорода в реакции (13). Совершенно очевидно, что в нашем случае для того, чтобы термохимический цикл не «разомкнулся», нужно, чтобы продукты окисления обладали невысокой термической стабильностью и легко отдавали кислород при умеренном нагревании.
Таким образом, простейший, скажем двухстадийный (в идеале), цикл можно схематически представить следующим образом:
Х + Н2
О → ХО + Н2;
ХО → Х + 1/2 О2.
Здесь первая стадия идет с выделением тепла самопроизвольно или при нагревании до невысоких температур, а вторая стадия протекает с поглощением тепла. Идеальный двухстадийный цикл пока трудно предложить. Более реальны трех-четырехстадийные термохимические циклы, как, например, цикл, именуемый «Марк-9»:
2FeCl2
+ 8Н2
О(г)
→
2Fе2
Оз + 12НСI + 2Н2
О; (15)
2FезО
4
+ ЗСl2
+ 12НСI
→
6FеСlз
+ 6Н2
О (г) +
О2
; (16)
6FеСlз
→
6FeCl2
+ ЗСl2
(17)
Стадия (15) эндотермична: 600 - 700 ºС; стадия (16) экзотермична: 150 - 200 ºС; стадия (17) эндотермична: 400 – 450 ºС. Следует, однако, указать, что в данном термохимическом цикле, равно как и в других разрабатываемых циклах, приходится сталкиваться с многими трудностями технического характера, усложняющими на сегодня практическую реализацию этих вариантов в широких масштабах. По мнению специалистов, значительно ближе к осуществлению варианты термоэлектрохимического разложения воды, комбинирующего термохимические циклы с электрохимическими. Примером может служить сернокислотный цикл, основанный на том, что потенциал окисления сернистой кислоты до серной (0,18 В) существенно ниже потенциала «окисления» воды (1,3 В):
Н2
S
Оз
+
S
О
з
+ 3 Н2
О → 2H
2
S
О
4
+ 2Н2
(18)
2Н2
S
О
4
→ 2Н2
О + 2Н2
, +
SO
2
+ О2
, (19)
где стадия (19) - эндотермическая реакция при 800 – 900 ºС и давлении до 10 атм, а стадия (18) - обычный электролиз водного раствора сернистой кислоты, протекающий при нормальной температуре [3, 4].
Из всего сказанного следует, что у водородной энергетики при условии ее дальнейшего совершенствования есть великолепный шанс внести ощутимый вклад в энергетическую систему мира [19 - 22].
Глава 2. ЭКОЛОГИЧЕСКИЕ АСПЕКТЫ СОЗДАНИЯ ВОДОРОДНОЙ ЭНЕРГЕТИКИ (ДЛЯ УЧАЩИХСЯ СРЕДНЕЙ ШКОЛЫ)
Введение в проблему водородной энергетики для учащихся 9 классов на первом этапе возможно в виде как приведенных ниже выполненных самим учителем докладов, так и небольших сообщений, подготовленных самими учениками [23-24].Первое вводное сообщение выполняется учителем:
2.1 Сообщение 1. Суть водородной энергетики
Водородная энергетика включает следующие основные направления:
Разработка эффективных методов и процессов крупномасштабного получения дешевого водорода из метана и сероводородсодержащего природного газа, а также на базе разложения воды;
технологии хранения, транспортировки и использования водорода в энергетике, промышленности, на транспорте.
Назначение, основные функциональные показатели
Водородная технология позволит остановить прогрессирующий рост загрязнения окружающей среды, исключив или принципиально сократив эмиссию токсикоагентов в тропосферу, в том числе, приземный слой атмосферы.
При получении больших объемов водорода из метана и серосодержащих природных газов может быть использована плазменно-мембранная технология удельной производительностью более чем в 100 раз выше по сравнению с традиционной. Удельные энергозатраты на производство 1 м3
водорода оказываются ниже реализованных в традиционной технологии в 2-3 раза (около I кВт/ч).
Производство водорода из воды возможно на новом типе электролизеров на базе катионопроводящей мембраны МФ-4СК, выпускаемой в России и обеспечивающей получение водорода более высокой чистоты с удельными энергозатратами в1,5 меньшими, чем у традиционных систем. Удельная производительность аппаратов в 10 раз выше,чем у предыдущего поколения.
Область применения
Водородная технология используется для автономного обеспечения различных видов наземного транспорта и жидководородных силовых установок для авиации, стационарных энергосистем с водородным аккумулированием энергии (ветровые, солнечные и другие виды энергоустройств).
Применение водорода в химии, газо- и нефтехимии, производстве минеральных удобрений, биотехнологии, металлургии и т.д. позволит отказаться от традиционной организации процесса, повысить его качество и экономичность при ликвидации полного или основного выброса загрязняющих веществ в атмосферу.
Основания для выбора
Технология даст возможность крупномасштабно получать дешевый водород в качестве ценного сырья и реагента при производстве удобрений, метанола, а также в процессах переработки нефти. Ресурсы сырья практически неограниченны. Водород является экологически чистым энергоносителем и его применение в энергетике, промышленности и на транспорте окажет положительное влияние на состояние окружающей среды.
Состояние и тенденция развития
В настоящее время в России создан ряд демонстрационных установок, реализующих новые высокоэффективные и технологии получения и использования водорода из метана, природных серосодержащих газов с помощью плазменно-мембранной технологии. При этом исключаются катализаторы и традиционные жидкостные системы газораспределения. Оно осуществляется посредством мембранных аппаратов. Существующие в мире системы имеют вместо этой стадии громоздкий термокаталитический процесс, экологически некорректный, с более высокими энергозатратами (в 2-3 раза) и низкой удельной производительностью.
В настоящее время успешно завершаются исследования и разработки на уровне мощности 200 кВт на площадке ГНЦ"Курчатовский институт" и требуется переход к опытно-промышленной стадии на уровне мощности и производительности 10 м3
/ч. Предлагаемая технология не имеет мировых аналогов, к ней проявляет интерес ряд ведущих зарубежных фирм.
Для высокоэффективных электролизеров на основе на основе катионопроводящей мембраны МФ-4СК в настоящее время завершен цикл НИОКР и создано производство электролизеров с улучшенными показателями на базе российской технологии. Типоразмерный ряд доведен до производительности 20 м3
/ч и необходим завершающий этап по созданию 100 м3
/ч электролизера. Уровень лучших зарубежных разработок 50 м3
/ч на базе мембраны «Nation» по удельным характеристикам близок к основным параметрам, указанным выше [30, 11].
На базе той же отечественной мембраны в России созданы электрохимические генераторы 10 – 20 кВт, использующие водородо-воздушную смесь и имеющие КПД до 75%, при этом системы эмитируют только чистую воду, токсичные компоненты выброса отсутствуют полностью.
2.2 Сообщение 2. Выполняется учениками, на основе материалов, предоставленных учителем
Если в конце прошлого века самая распространенная сейчас проблема – энергетическая – играла, в общем, вспомогательную и незначительную в мировом балансе роль, то уже в 1930 году в мире было произведено около 30 миллионов миллиардов киловатт-часов! Гигантские цифры, небывалые темпы роста! И все равно энергии будет мало, потребности в ней растут еще быстрее.
Уровень материальной, а, в конечном счете, и духовной культуры людей находится в прямой зависимости от количества энергии, имеющейся в их распоряжении. Чтобы добыть руду, выплавить из нее металл, построить дом, сделать любую вещь, нужно израсходовать энергию. А потребности человека все время растут, да и людей становится все больше.
Неумолимые законы природы утверждают, что получить энергию, пригодную для использования, можно только за счет ее преобразований из других форм. Вечные двигатели, якобы производящие энергию и ниоткуда ее не берущие, к сожалению, невозможны. А структура мирового энергохозяйства к сегодняшнему дню сложилась таким образом, что четыре из каждых пяти произведенных киловатт получаются в принципе таким образом, что четыре из каждых пяти произведенных киловатт получаются в принципе тем же способом, который пользовался первобытный человек для согревания, то есть при сжигании топлива, или при использовании запасенной в нем химической энергии, преобразовании ее в электрическую на тепловых электростанциях.
Конечно, способы сжигания топлива стали намного сложнее и совершеннее.
Новые факторы – возросшие цены на нефть, быстрое развитие атомной энергетики, возрастание требований к защите окружающей среды – потребовали нового подхода к энергетике.
Хотя в основе энергетики ближайшего будущего по-прежнему останется теплоэнергетика на невозобновляемых ресурсах, структура ее изменится. Должно сократиться использование нефти. Существенно возрастает производство электроэнергии на атомных электростанциях. Начнется использование пока еще нетронутых гигантских запасов дешевых углей, например, в Кузнецком, Канско-Ачинском, Экибастузском бассейнах. Широко будет применяться природный газ, запасы которого в стране намного превосходят запасы в других странах.
Но, к сожалению, запасы нефти, газа, угля отнюдь не бесконечны. Природе, чтобы создать эти запасы, потребовались миллионы лет, а израсходованы они будут за сотни. Сегодня в море стали всерьез задумываться над тем, как не допустить хищнического разграбления земных богатств. Ведь лишь при этом условии запасов топлива может хватить на века. Что же произойдет тогда, когда месторождения нефти и газа будут исчерпаны? Происшедшее повышение цен на нефть, необходимую не только энергетике, но и транспорту, и химии, заставило задуматься о других видах топлива, пригодных для замены нефти и газа. Решение этой задачи исследователи ищут на разных путях. Самым заманчивым, конечно, является использование вечных, возобновляемых источников энергии - энергии текущей воды и ветра, океанских приливов и отливов, тепла земных недр, солнца. Много внимания уделяется развитию атомной энергетики, ученые ищут способы воспроизведения на Земле процессов, протекающих в звездах и снабжающих их колоссальными запасами энергии [31].
2.3 Сообщение 3. Выполняется учениками, на основе материалов, предоставленных учителем
Энергетические потребности, ресурсы и возможности
Человек с момента своего появления нуждался в энергетических ресурсах. На раннем этапе развития онудовлетворял эту потребность через пищу. Но с развитием человечества росли его энергетические потребности и расширялись возможности их удовлетворения. На первых этапах развития цивилизации использовались первичные природные энергетические ресурсы - древесина, затем ископаемый уголь. Постепенно начинает использоваться энергия ветра и воды [13]. Примитивные ветряные двигатели (ветряные мельницы) появились еще 2 тысячи лет назад. Природный битум начал использоваться 1 тысячу лет назад. Первые нефтяные скважины появились в XVII веке, а в середине XIX века началась промышленная добыча нефти и газа. В эпоху индустриализации потребность в энергетических ресурсах резко увеличивается, но расширяются и возможности человечества: началось производство электроэнергии с использованием гидроресурсов, энергии Солнца и атомной энергии. Использование энергетических ресурсов во все времена ограничивалось запасами природных энергоресурсов, возможностями человека извлекать энергию из этих энергоресурсов и последствиями их извлечения и использования.
2.4 Сообщение 4. Выполняется учителем
Глобальные экологические проблемы энергетики
Последствия влияния энергетики на экологию Земли носит глобальный характер. Воздействие энергетики на окружающую среду разнообразно и определяется видом энергоресурсов и типом энергоустановок. Приблизительно 1/4 всех потребляемых энергоресурсов приходится на долю электроэнергетики. Остальные 3/4 приходятся на промышленное и бытовое тепло, на транспорт, металлургические и химические процессы. Ежегодное потребление энергии в мире приближается к 10 млрд. т условного топлива, а к 2000 году оно достигнет, по прогнозам экспертов, 18-23 млрд. т. Теплоэнергетика в основном твердое топливо. Самое распространенное твердое топливо нашей планеты - уголь. И с экологической и с экономической точки зрения метод прямого сжигания угля для получения электроэнергии не лучший способ использования твердого топлива, при сжигании жидкого топлива с дымовыми газами в атмосферу воздуха поступают сернистые ангидриды, оксиды азота, окись и двуокись углерода, газообразные и твердые продукты неполного сгорания топлива, соединения ванадия, соли натрия, и др. С точки зрения экологии жидкое топливо менее вредно, чем уголь. Если уровень загрязнения атмосферы при использовании угля принять за 1, то сжигание мазута даст 0,6, а использование природного газа снижает эту величину до 0,2.
Парниковый эффект.
Повышение концентрации углекислого газа в атмосфере вызывает так называемый парниковый эффект, который получил название по аналогии с перегревом растении в парнике. Роль пленки в атмосфере выполняет углекислый газ. В последние годы стала известна подобная роль и некоторых других газов (CH4
и N2
O). Количество метана увеличивается ежегодно на 1%, углекислого газа - на 0,4%, закиси азота - на 0,2%. Считается, что углекислый газ ответственен за половину парникового эффекта.
Загрязнение атмосферы.
Негативное влияние энергетики на атмосферу сказывается в виде твердых частиц,аэрозолей и химических загрязнений. Особое значение имеют химические загрязнения. Главным из них считается сернистый газ, выделяющийся при сжигании угля, сланцев, нефти, в которых содержатся примеси серы. Некоторые виды угля с высоким содержанием серы дают до 1 т сернистого газа, па К) г сгоревшего угля. Сейчас вся атмосфера земного шара загрязнена сернистым газом. Идет окисление до серного ангидрида, а последний вместе с дождем выпадает на землю в виде серной кислоты. Эти осадки называют - кислотными дождями. То же самое происходит и после поглощения дождем диоксида, азота - образуется азотная кислота [14].Сегодня глобальная среднегодовая потребность в энергии составляет ~8 трлн. Ватт. Иными словами для обеспечения нужд одного жителя Земли нужно 12 человек обслуживающего персонала.Если наш образ жизни, будет и дальше так развиваться, как сейчас, то в будущем потребность в энергии станет громадной. Если производство продовольствия будет идти в ногу с ростом населения, то к 2010 г. производство азотных удобрений должно увеличиться в 100 раз. Одно лишь это потребует около 20% объёма ныне производимой энергии. Опреснённая вода, которая часто рассматривается как неотъемлемая часть будущего, для своего получения требует громадных затрат энергии.
Среднегодовое потребление энергии увеличивается на 5,7%. Если этот темп сохранится, то к 2010 г. расход энергии по сравнению с 1980 г. увеличится в 4,5 раза. Основным источником получения энергии в мире дающим 97% её количества является ископаемое топливо, в том числе 38% составляет уголь, 19%-природньгй газ и 10% -
нефть. 2% электроэнергии вырабатывается на ГЭС, а другие источники, такие как ядерный распад, древесина и прочие вырабатывают 1% энергии [15, 32] (рис. 1).
Нефти хватит еще приблизительно на 80 лет. Все запасы нефти разведаны. Разрабатываемые сейчас новые месторождения в Северном море обладают ограниченными запасами. Эти запасы недостаточны для того, чтобы обеспечить предполагаемый рост потребления энергии в Западной Европе, который удваивается каждые 8-10 лет. 2/3 добываемых запасов сосредоточены в Персидском заливе. Остальные находятся в России, Северной Америке и Африке. Нефтяная проблема еще больше усложняется в результате низкоэффективных способов добычи нефти. Местами из недр земли берется только 30-35% нефти. Поскольку цены на нее растут, экономически эффективной может стать вторичная добыча, что позволит поднять на поверхность 40-45% нефти.
Запасы природного газа более ограничены. Они приблизительно равны запасам энергии оставшихся угольных месторождений. Около 1/5 всех запасов природного газа сосредоточено в Северной Америке, 1/3 в России.
Основным источником энергии ископаемого топлива является каменный уголь. Из всех мировых запасов угля 52% - сосредоточены в России, 20%- в США, 9%- в Китае, 8%- в Канаде, 5%- в Западной Европе, остальное -в Океании, Центральной и Южной Америке (рис. 2).

Рис.2. Распределение залежей мировых запасов угля по странам
Около 97% угля можно извлечь только при помощи сооружения глубоких шахт. Хотя угля и много, он не является дешёвым источником энергии. Перевозки, труд, капиталовложения при строительстве новых глубоких шахт, контроль за загрязнением воды и воздуха - всё это увеличивает стоимость угля. Все сказанное выше достаточно для того, чтобы убедиться в необходимости перехода человечества на новые виды энергии, не связанные со сжиганием традиционного топлива. Для удобства рассмотрения вопросов поиска новых источников энергии кажется целесообразным, прежде всего, все существующие на земном шаре энергетические системы, использование которых осуществляется или потенциально может осуществляться человеком, разделить условно на два типа:
- системы, основанные на возобновляемых источниках энергии;
- системы, основанные на невозобновляемых источниках.
Каждый тип, в свою очередь, можно подразделить на несколько видов энергетических систем.
Таблица 2
Энергетические системы, пригодные для использования человеком
| № вида |
Энергетические системы |
| Тип
I
(основаны на возобновляемых источниках энергии)
|
| 1. |
На: гравитационных силах; молекулярном движении; движении приливов и волн; движении воздуха; геотермальных силах |
| 2. |
фотосинтезе растении; жизнедеятельности организма |
| 3. |
фотохимических, фотоэлектрических и термоэлектрических процессах |
| Тип
II
(основаны на возобновляемых источниках энергии)
|
| 1. |
На: сжигании радиационного топлива |
| 2. |
внутриядерных процессах |
| 3. |
биохимическом преобразовании энергии |
| 4. |
водородном топливе |
Системы, относящиеся к первому виду, малоперспективны, несмотря на их экологическую чистоту. В начале века, по имеющимся оценкам, они смогут удовлетворить мировые потребности лишь на 5 - 10% [14, 29].
2.5 Сообщение 5. Выполняется учениками, на основе материалов, предоставленных учителем
Влияние водородной энергетики на окружающую среду
При рассмотрении основных принципов водородной энергетики и ее влияния на окружающую среду, нельзя ограничиваться лишь загрязнением воздуха, так как это не единственный тип загрязнения. При сравнении различных энергетических источников следует обсудить и другие аспекты. Под этим можно подразумевать эффективность источников энергии, поэтому важно сопоставить водородную энергетику с другими энергетическими системами, такими как уголь - синтетическое топливо, атомная энергия - водород, атомная энергия - электричество и др.С точки зрения охраны окружающей среды варианты водородной энергетики оцениваются выше старых энергетических систем, использующих ископаемые топлива. Заслуживает внимания тот факт, что, хотя энергетическая система солнечная система - водород самая безопасная по отношению к окружающей среде, все же система солнечная энергия - электричество будет эффективнее, так как в ней используется меньшее количество материалов. Предполагается что система солнечная система - водород будет работать в сочетании с фотогальваническими элементами, в которых расходуется большое количество кремния. Поэтому, если система море-солнце или с ветровой энергией, то влияние на окружающую среду будет меньше, и энергетическая система солнечная система - водород будет более приемлемой, чем система солнечная система - электричество [13].
2.6 Сообщение 6. Выполняется учениками
Дополнительные сведения о применении водорода в бытовых целях
Вся энергия, предназначенная для бытовых целей, может быть получена из водорода (освещение, отопление и приготовление пищи). Однако это не самый оптимальный путь применения водорода.
Освещение, отопление и приготовление пищи.
Для освещения не обязательно применять электричество, можно воспользоваться «холодным светом», получаемым при взаимодействии водорода с фосфором. Для приготовления пищи, отопления помещений может быть использован специальный керамический материал. Однако отопление помещений лучше осуществлять с помощью электрических насосов.
Электричество в доме.
По-видимому, при внедрении водородной энергетики уменьшится потребление электроэнергии в жилых домах. Снизятся затраты на работу различных электронных устройств. Однако для снабжения водородом зданий необходимо полностью переоборудовать трубопроводы, горелки и большую часть другого оборудования [12].
Переработка сточных вод.
Обычно сточные воды должны пройти по трубопроводам несколько, прежде чем попадут на специализированные станции по их переработке. Имеются ряд способов переработки мусора и сточных вод с применением метана, который затем может быть использован при вторичном производстве энергии. При подаче по трубопроводу кислорода сточные воды могут быть подвергнуты аэробной обработке: при температуре около 100 °С и взаимодействии с чистым кислородом, образуется СО2
[1].
2.7 Сообщение
7. Выполняется учителем при заключении темы
П
ymu
развития водородной энергетики
Следует сразу установить, что преимущества водородной энергетики могут быть достигнуты только путем постадийного внедрения этой энергетики (исследование, проектирование, создание опытной установки, небольшая проверка, более крупная проверка и, наконец, полный переход на водородную энергетику). На первой стадии в качестве источника для получения водорода можно использовать уголь, который при нагревании с водой образует смесь СО и Н2
; СО затем будет окислом до СО2
и выброшен в атмосферу, а Н2
доставят по трубопроводу па ближайшую установку. Здесь он может быть использован для получения электричества.
Во второй стадии в качестве источника энергии для получения водорода может быть использована ядерная установка; образующийся водород затем будет доставляться в город и применяться для получения электроэнергии или для работы части транспорта.
На третьей стадии может быть использован маленький город (например, с населением 10 000), где будет построена станция для сбора солнечной энергии. Если это гористая местность, можно установить экспериментальные крупные аэрогенераторы.
Важной является четвертая стадия освоения, на осуществление которой необходимы суммы, исчисляемые миллиардами. На этой стадии следует перевести часть энергетики на водород, например, жилищно-коммунальное хозяйство, транспорт, промышленность [8].
Экологическая "чистота" водорода не вызывает сомнений, если учесть, что практически единственным, продуктом его сгорания является вода и что в этом случае полностью отсутствуют характерные для углеводородных топлив загрязняющие атмосферу соединения типа диоксидов углерода и серы, а также паров углеводородов. Кроме того, водород - это и достаточно калорийное топливо. По теплотам сгорания (34 ккал/г) он намного превосходит такие классические виды топлива, как углеводороды (10 ккал/г) и древесина (4 ккал/г). Конечно, нельзя не учитывать и большие трудности, связанные с решением и ряда дополнительных задач, таких, как:
а) поиск и разработка первичных источников энергии, которые могут быть использованы для синтеза водорода;
б) безопасность хранения, транспорта и больших количеств газообразного и жидкого водорода;
в) эффективное преобразование энергии водорода при решении ряда
конкретных энергетических задач.
Если говорить о поисках и разработках первичных источников, кото-
рые могут быть использованы для синтеза водорода, то, вероятно, следует
начать с простейшего способа, известного каждому, кто хотя бы немного
знаком с химией, - взаимодействия кислот и оснований с металлами:
Zn + (2HCl)aq → (ZnC12
)aq + H2
↑
Аl + (2NaOH)aq → (NaAIО2
)aq + 3/2H2
↑
В плане дальнейшего изложения очень важно подчеркнуть, что перспективными для создания водородной энергетики могут считаться только способы, основанные на использовании воды в качестве исходного сырья. Поэтому в дальнейшем при написании тех или иных уравнений химических реакций индекс "
aq
",
характеризующий водную среду, будет опускаться. Процесс необратим и для получения металла из образовавшихся оксидов(для повторного их применения) требует значительных затрат энергии.
Заслуживают внимания три варианта получения водорода из органического сырья. Один из них - паровая конверсия металла, являющегося главным компонентом природного газа:
СН4
+ Н2
О → СО + 3Н2
- 50 ккал
СО + Н2
О → СО + Н2
+ 10 ккал
______________________________
СН4
+ 2Н2
О → СО2
+ 4Н2
- 40 ккал
Второй более совершенный вариант основывается на парокислородной конверсии:
2СН4
+ О2
→ 2СО + 4Н2
+ 16 ккал
СН4
+ Н2
О → СО + 3Н2
- 50 ккал
______________________________
7СН4
+ 3О2
+ Н2
О → 7СО + 15Н2
Последующий процесс, связанный с конверсией СО,
протекает, как и в первом варианте. Однако, как следует из уравнений в обоих вариантах, требуется затрата больших количеств дефицитного природного газа как исходного сырья.
Третий вариант основан па использовании процесса газификации угля:
2Ств
+ О2
→ 2СО + 55 ккал
СТВ
+ Н2
О пар → СО + Н2
- 30 ккал
Комбинацией этих двух реакций можно получить смесь СО
и Н2
,
на-зываемую "водяным газом". В последнее время метод получения водорода из воды и угля считается одним из наиболее перспективных. Весьма перспективным, по мнению специалистов, является вариант использования водяного пара для восстановления окислов железа при 800-900°С:
2Fез
О
4
+ СО + Н
2
→
6FеО
+
Н2
О
+ СО2
- 22 ккал
с последующей обработкой Fe
()
водяным паром при 600-700°С. После конденсации паров воды можно получить чистый водород:
3
FeO
+
Н2
О→
Fe
з
О4
+ Н2
+ 16ккал
Экономичность процесса здесь возрастает вследствие того, что последняя реакция экзотермична и позволяет некоторое количество выделяющегося тепла использовать для нагрева водяного газа до температур, при которых в соответствии с данной реакцией имеет место восстановление окислов железа. Несмотря на определенные трудности, железопаровой вариант получения водорода привлекает в настоящее время внимание большого числа исследователей во всех странах мира, поскольку связан с возможностью использования дешевых низкосортных углей в качестве восстановителя водяного газа. Казалось бы, самым простым и чистым способом получения водорода должен быть электролизный способ, непосредственно расщепляющий молекулу воды па водород и кислород. Однако этот процесс сам требует много электрической энергии и экономически пока остается невыгодным.
Глава 3. ОСОБЕННОСТИ ИЗУЧЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В СРЕДНЕЙ ШКОЛЕ
(НА ПРИМЕРЕ ВОДОРОДА)
В современном мире порой возникают ситуации, которые представляют реальную опасность для человечества. Чаще всего люди сами способствуют их возникновению либо по недомыслию, либо из - за недостатка информации. В одиночку с такими ситуациями не справится, однако правильный выбор действий в критической обстановке обеспечивается наличием определённых знании и умением их использовать. Поэтому, на мой взгляд, важно обсудить вопросы экологии и безопасности человека на уроках. Однако школьная программа и учебники не располагают достаточным объёмом информации. Учитель сам должен через поурочные планирования и внеклассные мероприятия восполнить эти недостатки. Он может применить следующие формы работы на уроках: собеседование, семинар, урок - практикум, ролевая игра, в любом случае учащиеся могут проявить активность, самостоятельность, применить знания, а также углубить их. Подобный подход позволяет учащимся лучше освоить новую тему и формирует у них целостное восприятие окружающего мира.
Уроки разработаны для учащихся 8 классов.
3.1 Водород
Урок 1.
Тема урока:
Водород в природе.
Водород как химический элемент. Получение водорода.
Цель:
1. Познакомить учащихся с элементом водородом и его номенклатурой.
2. Получение водорода разными способами.
3. Рассмотреть водород с экологической точки зрения
Тип урока
: Комбинированный.
Вид
: Изучение нового материала.
Методы:
Словесные, практические.
Оборудование: у
чебник, рисунки в учебнике, оформление доски, таблицы, "периодическая таблица Менделеева"
План урока.
1.1Водород в природе. – 30 мин.
1.2Водород с экологической точки зрения.
1.3Водород как химический элемент.
1. 4. Получение водорода разными способами.
1.42.1 Закрепление. – 5 – 7 мин.
3.1 Домашнее задание. – 3 мин.
Ход урока:
I
.
Организационный момент.
II
.
Новая тема:
1. Водород в природе.
Водород это второй элемент, который мы будем изучать.
Экспресс - опрос класса: "Что вы знаете об этом элементе?"
Водород самый распространенный элемент вселенной, на его долю приходится 92 % всех атомов, он является главной составной частью Солнца и многих звёзд. В земной коре его массовая доля составляет 1 %. Водород самый лёгкий элемент в природе, поэтому его роль определяется не массой, а числом атомов. Доля его атомов в природе составляет 17 %, это второе место после кислорода, которого в природе 52 %. Таким образом, роль водорода в природе также велика, как и кислорода.
2. Водород с экологической точки зрения.
Водород в природе находится весь в связанном состоянии, т. е. в виде химических соединений. Химический знак водорода Н. Формулы основных соединений водорода встречающихся в природе: Н2
О вода, СН4
метан, другие углеводороды СХ
НХ
, H2
S сероводород, NH3
аммиак. Соединение кислорода и водорода - вода является основой жизни. Сероводород - это газ, которыйвыделяется из недр Земли, кроме этого заводские трубы выбрасывают его в атмосферу в больших количествах. Он же соединяясь с водяными парами, вызывает кислотные дожди, которые уничтожают зелёные растения. Аммиак и метан так же вредны для здоровья человека. Но в тоже время метан, по сравнению с другими видами топлива, является более безвредным в экологическом отношении.
Чистый водород получается химическим путём. Он горит с выделением большого количества тела. Водород "топливо будущего" т. к. является экологически чистым, при его сгорании образуются водяные пары не отравляющие атмосферу.
3. Водород как химический элемент можно рассмотреть, используя страницу 62 в учебнике химии.
Решение задачи: Вычислить массовую долю водорода в воде.
W
= Ar
*n/M2
; W
(н) = АГ
(Н) n(Н)/М (Н2
О) = 1*2/18 = 0,11 или 11 %
Сравнить значение массовой доли с атомной долей.
Номенклатура соединений неметаллов с водородом
название металла +... соединения содержащие кислород..+. водород
пример: сероводород Н2
S
сера + кислород + водород
Номенклатура, соединений, металлов с водородом:
гидрид + название металла
гидрид алюминия
гидрид меди
гидрид железа
4. Получение водорода.
Один из способов получения водорода разложение воды под действием постоянного электрического тока:
2H2
O→ 2H2
+ O2
В лаборатории водород получают при взаимодействии некоторых металлов с кислотами. Например: цинка и соляно кислоты. Для этого используется специальный прибор, изображённый в учебнике на рис.41 стр.63. Запишем уравнение реакций:
Zn + 2HCI = ZnCl2
+ H2
цинк соляная к-та хлорид цинка водород
Zn +H2
SO4
= ZnSO4
+ Н2
цинк серная к-та сульфат цинка водород
Водород выделяется также при взаимодействии активных металлов натрия и кальция с водой:
2Na +2HOH = 2NaOH+ Н2
натрий вода гидроксид натрия водород
Са + 2НОН = Са(ОН)2
+ Н2
кальций вода гидроксид кальция водород
Опытным путём установлено, что из молекулы воды вытесняется только один атом водорода и образуется одновалентная группа ОН - гидроксогруппа, которая соединяется с атомом металла. Число гидроксогрупп зависит от валентности металла. Образующиеся соединения относятся к основаниям и называются гидроксидами.
В промышленности водород получают из метана:
СН4
+ 2Н2
О = СО2
↑ + 4Н2
↑
При этом выделяется углекислый газ и водород. Углекислый газ при поступлении в атмосферу загрязняет её, вызывает усиление парникового эффекта. Поэтому необходимо при получении водорода в промышленности улавливать углекислый газ.
2. Закрепление.
3. Домашнее задание. Ученики должны ответить на вопросы 1- 5 в учебнике на стр. 66.
Урок 2.
Тема урока:
Свойства и применение водорода.
Цель:
Рассмотреть физические и химические свойства водорода.
Тип урока:
Комбинированный.
Вид:
Изучение нового материала.
Методы:
Словесные, практические.
Оборудование:
Учебник, рисунки в учебнике, таблицы.
План урока.
2.1. Проверка домашнего задания.- 8 мин.
2.2. Новая тема: физические и химические свойства водорода. Применение.
2.3. Закрепление - 7мин.
2.4. Подведение итогов урока и домашнее задание
Ход урока.
I
.
Организационный момент. Проверка домашнего задания. Опрос. - 8 мин.
II
.
Новая тема.- 25 мин.
Водород.
2. Физические свойства рассмотрим в сравнении с кислородом (таблица на доске).
| Водород |
Кислород |
| 1. без запаха |
1. без запаха |
| 2. без цвета |
2. без цвета |
| 3. мало растворим в воде |
3. мало растворим в воде |
| 4. легче воздуха в 14, 5 раз |
4. тяжелее воздуха |
| 5. tкип
= - 253 ºС |
5. tкип
= - 183 ºС |
| 6. ρ н.у.
(Н2
) = 0, 09 г/л |
6. ρ н.у.
(О2
) = 1, 43 г/л |
Химические свойства водорода:
а) реакции с металлами:
Ti + Н2
= TiH2
Са + Н2
= СаН2
б) реакции с неметаллами:
F2
+ H2
= 2HFH2
+ O2
= 2H2
O
в) реакции со сложными веществами:
СuО + Н2
= Сu + Н2
О WO3
+ ЗН2
= ЗН2
О + W
Отсюда следует вывод, что при обычных условиях водород может вступать в реакцию только с очень активными веществами. Взаимодействует с металлами с образованием гидридов. Взаимодействует с неметаллами. Является восстановителем. Химическая активность его ниже, чем у кислорода. При обычных условиях реагирует только с очень активными металлами и с единственным неметаллом – фтором. С большинством веществ реагирует только при повышенной температуре или другом воздействии.
Применение рассмотреть с помощью схемы 7 в учебнике на стр. 66.
3. Закрепление темы решением расчетной задачи: Один из способов получения водорода в лаборатории взаимодействие цинка с соляной кислотой. Сколько грамм цинка необходимо для получения 10 л водорода?
Х 10 л
Zn + 2HCI = ZnCl2
+ H2
↑
65 г22, 4 л
Составляем пропорцию:
Х/65 г = 10 л/22,4; Х = 65 г * 10 л/22,4 л = 29 г цинка.
4. Домашнее задание: ответы на вопросы 6-11 в учебнике на стр. 67.
Урок 3.
Практическое занятие.
Тема работы:
получение водорода и проведение реакции его с оксидом меди (II).
Цель работы:
1) Получить водород в лабораторных условиях.
2) Провести его реакцию с оксидом меди (II).
3) Изучить горение водорода на воздухе.
4) Изучить продукты взаимодействия Zn с соляной кислотой.
I
.
Выполнение работы.
1. Получение и собирание водорода.
Собрали прибор. В пробирку поместили 3 гранулы цинка, плотно закрыли пробку и через воронку налили соляную кислоту. Наблюдали выделение пузырьков газа, т.е. водорода.
Zn + 2НС1 =ZnCl2
+ Н2
Водород собирали в перевёрнутой пробирке, постепенно вытесняя воду. После того, как пробирка наполнилась, закрыли её пальцем и поднесли её к горелке. Водород загорелся спокойно хлопка не было. Это значит, что собранный водород был чистый.
2. Изучение горения водорода на воздухе.
Подожгли водород лучинкой у конца газовой трубки. Водород загорелся спокойным пламенем. На стеклянной пластинке конденсировалась вода.
2Н2
+ О2
= 2Н2
О.
3.Изучение взаимодействия водорода с оксидом меди (
II
).
В пробирку поместили несколько кусочков оксида меди чёрного цвета. Соединили с прибором для получения водорода. Пропустили ток водорода, никаких изменений не наблюдали. Начали нагревать пробирку с оксидом меди, началась реакция. Наблюдали изменение цвета, чёрный цвет изменился и стал красным. На стенки пробирки конденсировалась вода.
Н2
+ СuО = Сu+ Н2
О.
На данном опыте мы изучили восстановительные свойства водорода. Водород восстанавливает медь из оксида.
4. Изучение продукта реакции цинка с соляной кислотой.
С помощью стеклянной палочки перенесли несколько капель раствора из пробирки с цинком и соляной кислотой на стеклянную пластинку и упарили его. На стекле остался белый порошок хлорида цинка.
Zn + 2HC1 = ZnCl2
+ H2
t. Продукты реакции - хлорид цинка (ZnCl2
) и водород (Н2
).
II
.
Домашнее задание.
Оформить практическую работу.
Урок 4.
Контрольная работа.
Тема урока:
Обобщение и систематизация знаний, умений, навыков учащихся по темам "Кислород", "Водород" "Газообразные вещества".
Цель:
Проверить химические свойства, получение и применение этих элементов.
Ход урока.
I. Организационный момент. Проверка домашнего задания.
Вариант
1.
1. Составить уравнения химических реакций:
а) кислорода с серой. Указать окислитель.
б) водорода с оксидом меди (II). Указать восстановитель.
2. Составить уравнения химических реакций, указать условия их протекания.
О2
→ Н2
О → Н2
→ НС1 хлорид кальция
3. а) дописать уравнения реакции: Н2
О2
→ Н2
О + ? Указать применение этой реакции.
б) Составить уравнение реакции между соляной кислотой и железом. Дать название полученным соединениям.
4. Решить задачу:
Рассчитать объём оксида углерода (IV), полученного в результате сгорания на воздухе 24 г. углерода.
Вариант 2.
1. Составить уравнения химических реакций:
а) водорода с кислородом.
б) кислорода с метаном (СШ).
2.Составить уравнения химических реакций, указать условия их протекания.
СО2
→ О2
→ WO3
→ W
↓
А12
О3
3. а) дописать уравнения реакции: НС1 + Zn →ZnCl2
+ ? С какой цельюиспользуется эта реакция в лаборатории?
б) составить реакцию разложения воды. Указать её применение.
4. Решить задачу: Какой объём кислорода потребуется для окисления 1,5 моль серы?
Вариант 3.
1.
Составить уравнения химических реакций:
а) водорода с кальцием. Дать название продукта.
б) кислорода с ацетиленом.
2. Составить уравнения химических реакций по схеме:
  оксид углерода (IV) + Н2
О озон оксид углерода (IV) + Н2
О озон
+ C2
H5
KMnO4
→кислород→оксид железа (III)
↓ ↓
оксид лития железо
3. а) дописать уравнения реакции: H2
SO4
+ Fe →FeSO4
+ ?
б) составить реакцию взаимодействия водорода с серой. Дать название продукта.
3. Составить и решить задачу по приведённым данным: V(Ca)= 3 моль ; m(СаН2
) - ?
Тестовая контрольная работа.
Вариант 1.
1. Водород реагирует с обоими веществами пары:
а) Н2
О и Са б) Na и NH3
в) Fe2
O3
и О2
г) WO3
и СH4
2. В уравнении реакции горения алюминия запись его правой части:
а) ЗА12
О3
б) А12
О3
в) 2А12
О3
г) 4А12
О3
3. Составить уравнение реакции и указать коэффициент перед формулой восстановителя. Реакция оксида вольфрама с водородом:
а) 1; б) 2; в) 6; г) 3.
4. Объём кислорода, необходимый для окисления 2 моль цинка, составляет (н.у.):
а) 22.4 л; б) 11.2 л; в) 44.8 л; г) 5.6 л;
Вариант 2.
1. Водород реагирует с обоими веществами пары:
а) С12
и РbО б) О2
и HCI в) СuО и Н2
О г) С H4
и Na
2. В уравнении реакции горения этана верная запись его правой части:
а) 2СО2
+ ЗН2
О б) 4СО2
+ 6Н2
в) 2СО2
+ ЗН2
г) 4СО2
+ 6Н2
О
3. Составить уравнение реакции и указать коэффициент перед формулой восстановителя. Реакция оксида олова с водородом:
а) 1; б) 2; в) 3; г) 4.
4. Объём кислорода, необходимый для окисления 1 моля алюминия, составляет (н.у.): а) 22.4 л; б) 16.8 л; в) 11.2 л; г) 5.6 л.
Вариант 3.
1. Водород реагирует со всеми веществами группы:
а) оксид вольфрама, вода, кальций; б) оксид железа (III), азот, кислород;в) метан СН4, калий, углерод; г) оксид меди (II), фтор, хлороводород.
2. В уравнении реакции горения аммиака NH3
верная запись его правой части:a) 2N2
+ 6Н2
О; б) 3N2
+ Н2
О; в) 4N2
+ 6Н2
О; г) N2
+ ЗН2
О.
3. Составить уравнение реакции и указать коэффициент перед формулой восстановителя. Реакция оксида молибдена (VI) с водородом:
а) 2; 6)3; в) 4; г) 6.
4. Составить и решить задачу по приведённым данным:
V(Р) = 2моль; m(Р2
О5
)-?
а) 284 г; б) 142 г; в) 14.2 г; г) 28.4 г. [1]
Для реализации целей школьного экологического образования можно использовать ролевые уроки. Достоинством этих уроков является то, что учащиеся в игровой форме закрепляют и обобщают полученные знания по химии, а также понимают актуальность экологических особенностей связанных с изучаемой темой.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА
В эксперименте принимали участие ученики 9 классов МОУ СОШ-гимназии № 1 г. Нальчик (выборочная совокупность составляла 45 школьников).
В экспериментальных классах при раскрытии темы «Альтернативная водородная энергетика» были проведены разработанные уроки, приведенные в главе 3. Занятия проводились с акцентом на прикладные и экологические аспекты.
Для констатации результата после проведения разработанных занятий были проведены контрольные работы, состоящие из тестов, которые приведены в главе III. Результаты эксперимента в школе приведены в диаграммах, отражающих изменения качества знаний и успеваемости в контрольном (9 г) и экспериментальном (9 в) классах.
Диаграмма 1. Изменение успеваемости учащихся
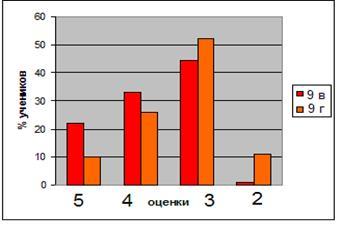
Диаграмма 2. Динамика успеваемости и качества обучения
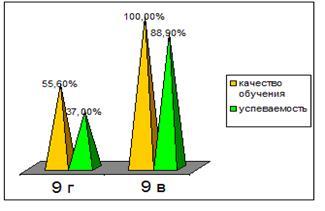
Таким образом, избранная тематика способствовала повышению качества знаний, научного и экологического мировоззрения, а главное вызвала интерес учащихся к более глубокому изучению химии.
ЗАКЛЮЧЕНИЕ
В настоящее время школьный курс химии немыслим без экологической стороны. В течение своей длительной жизни на Земле человечество в значительной степени зависело от солнца как источника энергии. Его потребность в энергии, в основном в пище, прямо или косвенно удовлетворялась фотосинтезом [21].
Только совсем недавно человек попал в сильную зависимость от ископаемого топлива. Поэтому рассмотрение каждой темы должно, так или иначе, иметь точки соприкосновение с экологией. Экологическое воспитание детей становится глобальной проблемой методики обучения химии. В погоне за избытком энергии человек все глубже погружался в стихийный мир природных явлений и до какой-то поры не очень задумывался о последствиях своих дел и поступков. Но времена изменились. Сейчас, в начале 21 века, начинается новый, значительный этап земной энергетики. Появилась энергетика «щадящая», построенная так, чтобы человек не рубил сук, на котором он сидит, заботился об охране уже сильно поврежденной биосферы. Несомненно, в будущем параллельно с линией интенсивного развития энергетики получат широкие права гражданства и линия экстенсивная: рассредоточенные источники энергии не слишком большой мощности, но зато с высоким КПД, экологически чистые, удобные в обращении. Яркий пример тому - быстрый старт электрохимической энергетики, которую позднее, видимо, дополнит энергетика солнечная. Энергетика очень быстро аккумулирует, ассимилирует, вбирает в себя все самые новейшие идей, изобретения, достижения науки. Это и понятно: энергетика, связана буквально со Всем, и Все тянется к энергетике, зависит от нее. Поэтому энергохимия, водородная энергетика, космические электростанции, энергия, запечатанная в антивеществе, кварках, «черных дырах», вакууме, - это всего лишь наиболее яркие вехи, штрихи, отдельные черточки тою сценария, который пишется на наших глазах и который можно назвать Завтрашним Днем Энергетики.
Таинственные переходы, узкие, извилистые тропки. Полные загадок,
препятствий, неожиданных озарений, воплей печали и поражений, кликов радости и побед.
В выбранной нами теме рассматривается решение энергетической проблемы человечества путем внедрение водородной энергетике. Рассказ об энергии может быть бесконечен, как и бесконечны альтернативные формы ее использования, но при условии, что мы должны разработать для этого эффективные и экономичные методы. Не так важно, каково ваше мнение о нуждах энергетики, об источниках энергии, ее качестве, и себестоимости. Нам, по-видимому, следует лишь согласиться с тем, что сказал ученый мудрец, имя которого осталось неизвестным.
«Нет простых решений, есть только разумный выбор»
Конечно, практически ученикам невозможно продемонстрировать весь процесс получение энергии из водорода. Но схематично, с использованием методов сравнения с другими источниками энергии, интересными сообщениями на эту тему можно вполне доступно объяснить суть водородной энергетики. При прохождении темы «Водород» параллельно с изучением способов производства, химических свойств и применения рассматриваются и связь водорода с энергетикой. И конечно выявление таких важных связей химии с промышленностью, с энергетикой заинтересовывает учеников.
Кроме того, на факультативных занятиях по экологии при рассмотрении проблем энергетики важно подчеркнуть актуальность данного вида источника энергии.
ВЫВОДЫ
Можно сделать несколько выводов из рассмотрения проблемы
1. Проблемы экологии. В частности, проблемы энергетики, требуют срочного решения. Остроту этого вопроса необходимо довести до сознания школьников и озадачить их поиском путей решения.
2. При рассмотрении темы «Водород» необходимо подвести учеников к пониманию водородной энергетики как одного из наиболее перспективных методов решения энергетической проблемы.
3. На факультативных занятиях можно рассмотреть основные проблемы, которые возникают при использовании водорода как источника энергии.
ЛИТЕРАТУРА
1. Реймерс Н. Ф. Экология (теория, законы, правила, принципы и гипотезы). // Россия Молодая. 1994. 367 с.
2. Верховский В. Н., Смирнов А. С. Техника химического эксперимента. – М., 1973, 683 с.
3. Кузьменок Н. М., Стрельцов Е. А., Кумачев А. И. Экология на уроках химии. Минск. 1996. 208 с.
4. Экологическая химия. Под. Ред. Ф. Корте. М.: Мир. 1997. 396 с.
5. Багов М. С. Концепции естествознания и основы экологии. Нальчик: «Эльбрус». 1997. 287 с.
6. Нифанов Э. Е. Прикладная направленность изучения химии в средней школе // Ж..Химия в школе, 1994, №4, ст. 18.
7. Назаренко В. М. Экология восхождение к разуму // Ж..Химия в школе, 1995, №4, ст. 10.
8. Экологизированный курс химии от темы к теме // Ж.. Химия в школе, 1996, № 1 ст. 29; 1996, №2 ст. 31; 1996, №4 ст. 36; 1996, №6 ст. 18.
9. Глобальное потепление: Доклад Гринпис / Под. ред. Дж. Леггетта. Пер. с англ. – М.: Изд-во МГУ, 1993. – 272 с.
10.Варшавский И. Л. Энергоаккумулирующие вещества и некоторые принципы их использования для транспорта, энергетики и промышленности. – М.: Наука, 1970. – 51 с.
11.Гринпис / Под. ред. Дж. Леггетта. Пер. с англ. – М.: Изд-во МГУ, 1993. – 272 с.
12.Володин В., П. Хазановский «Энергия, век двадцать первый». А. Голдин «Океаны энергии». Л.С. Юдасин «Энергетика: проблемы и надежды».
13.Буркова И.И. Основы общей экологии и охрана окружающей среды. – Ч. 1. – Норильск, 1977.
14.Охрана окружающей среды. Под ред. С. В. Белова. – М., 1991.
15.Богдановский Г. А. Химическая экология: Учеб. Пособие. – М.: Изд-во МГУ. 1994. – С. 136-137.
16.Малышенко С. П., Институт высоких температур РАН, Журнал «Энергия», №1, 2003.
17.Пехота Ф. Н., Минпромнауки РФ, Журнал «Энергия», №1, 2003, С. 2-8.
18.Химия и жизнь. Часть II. Под. ред. Тарасовой Н. П., РХТУ им. Менделеева. 1997. 351 с.
19.Суровцева Р. П. Химия. 8-9 классы: Методическое пособие. – 5 – е изд., стереотип. – М.: Дрофа, 2001. – 80 с.
20.Алексашина И. К., Л. А. Гольденберг. Из опыта подготовки учащихся к коллективной деятельности на уроке химии. // Химия в школе. 1991. №4, с. 31-34.
21.Планирование по химии // Вечерняя школа. 1989. №4.
22.Кузнецова Н. Е. Формирование систем понятий в обучении химии. – М.: Просвещение, 1989. – 144 с., с. 3-4, 17-22, 25-30.
23.Блонский Л. Л. Избранные педагогические и психологические сочинения: В 2 т. – М.: Педагогика, 1979. – Т. 2. – с. 300.
24.Шаповаленко С. Г. Методика обучения химии. – М.: Учпедгиз, 1963.
25.Архипова В. В. и др. Теоретические основы и практика коллективных занятий. Л., 1991.
26.Зуев А. В. Обучение химии в 9 классе. Пособие для учителя.
27.Общая методика обучения химии. Под. ред. Л. А. Цветкова, М. – Просвещение, 1981, 223 с.
28. Солдатенков И. С. Использование традиционных и технических средств на уроках химии, Минск, 1973, с. 69.
29.J. O.M Bockris, A Solar – Hydrogen Economy, A. N. Z. Book Co., Brook – vale, New South Wales, 1975, Ch. 8.
30.Lawaczek (1930), quoted by R. O. Lingstrom, ASEA Journal, 37 (1): (1964); also quoted by E. W. Justy, Leitungsmechanismus und Energieumwanlung in Felskorpen, Vandehoeck and Ruprecht, gottingen, 1965.
31.J. O.M Bockris, A Solar – Hydrogen Economy, A. N. Z. Book Co., Brook – vale, New South Wales, 1975, Ch. 14.
32.D. P. Greodgy, D. Y. C. Ng, and G. M. Long, in Electrochemistry of Cleaner Environments, J, O. V. Bockris, ed., Plenum Press, New York, 1972.
|