Введение
Важнейшим видом минеральных удобрений являются азотные: аммиачная селитра, карбамид, сульфат аммония, водные растворы аммиака и др. Азоту принадлежит исключительно важная роль в жизнедеятельности растений: он входит в состав хлорофилла, являющегося акцептором солнечной энергии, и белка, необходимого для построения живой клетки. Растения могут потреблять только связанный азот — в форме нитратов, солей аммония или амидов. Сравнительно небольшие количества связанного азота образуются из атмосферного за счет деятельности почвенных микроорганизмов. Однако современное интенсивное земледелие уже не может существовать без дополнительного внесения в почву азотных удобрений, полученных в результате промышленного связывания атмосферного азота.
Азотные удобрения отличаются друг от друга по содержанию в них азота, по форме соединений азота (нитратные, аммонийные, амидные), фазовому состоянию (твердые и жидкие), различают также физиологически кислые и физиологически щелочные удобрения.
Производство аммиачной селитры
Аммиачная селитра, или нитрат аммония, NН4NО3 — кристаллическое вещество белого цвета, содержащее 35% азота в аммонийной и нитратной формах ,
обе формы азота легко усваиваются растениями. Гранулированную аммиачную селитру применяют в больших масштабах перед посевом и для всех видов подкормок. В меньших масштабах ее используют для производства взрывчатых веществ.
Аммиачная селитра хорошо растворяется в воде и обладает большой гигроскопичностью (способностью поглощать влагу из воздуха). Это является причиной того, что гранулы удобрения расплываются, теряют свою кристаллическую форму, происходит слеживание удобрений- сыпучий материал превращается в твердую монолитную массу.
Аммиачную селитру выпускают трех видов:
А и В- используют в промышленности; применяют во взрывчатых смесях (аммонитах, аммониалах)
В- эффективное и наиболее распространенное азотное удобрение , содержащее около 33-34% азота; обладает физиологической кислотностью.
Исходное сырьё
Исходным сырьем в производстве аммиачной селитры является аммиак и азотная кислота.
Азотная кислота
.
Чистая азотная кислота HNO
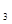 —бесцветная жидкость плотностью 1,51 г/см —бесцветная жидкость плотностью 1,51 г/см
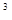 при - 42 °
С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно конце
нтрированной соляной кислоте, «дымит», так как пары ее образуют с '
влагой воздуха мелкие капельки тумана. Азотная кислота не отличается прочностью,
Уже под влиянием света она постепенно разлагается: при - 42 °
С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно конце
нтрированной соляной кислоте, «дымит», так как пары ее образуют с '
влагой воздуха мелкие капельки тумана. Азотная кислота не отличается прочностью,
Уже под влиянием света она постепенно разлагается:
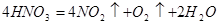
Чем выше температура и чем концентрированнее кислота, тем быстрее ид
ет разложение. Выделяющийся диоксид азота растворяется
в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы Н
 и- NO и- NO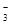 .
Азотная кислота — одно из важнейших соединений азота: в больших количествах она расходуется в произв
одстве,
азотных удобрений, взрывчатых ве
ществ и органических красителей, служи
т окислителем во многих химических процесс
ах, используется в производстве серной кислоты по нитрозному
способу, применяется для изготовления целлюлозных лаков, кинопленки. .
Азотная кислота — одно из важнейших соединений азота: в больших количествах она расходуется в произв
одстве,
азотных удобрений, взрывчатых ве
ществ и органических красителей, служи
т окислителем во многих химических процесс
ах, используется в производстве серной кислоты по нитрозному
способу, применяется для изготовления целлюлозных лаков, кинопленки.
Промышленное получение азотной кислоты
.
Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При« описании свойств аммиака было указано, что он горит в кислороде, причём продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов - окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение
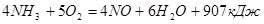
Образовавшийся  легко переходит в легко переходит в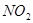 , который с водой в присутствии кислорода воздуха дает азотную кислоту. , который с водой в присутствии кислорода воздуха дает азотную кислоту.
В качестве катализаторов при окислении аммиака используют сплавы на основе платины.
Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют,
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная—98 и 97%, Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали.
Синтез аммиака
Аммиак — ключевой продукт различных азотсодержащих веществ, применяемых в промышленности и сельском хозяйстве. Д. Н. Прянишников назвал аммиак «альфой и омегой» в обмене азотистых веществ у растений.
На схеме показаны основные области применения аммиака. Состав аммиака был установлен К. Бертолле в 1784 г. Аммиак NНз — основание, умеренно сильный восстановительный агент и эффективный комплексообразователь по отношению к катионам, обладающим вакантными связывающими орбиталями.
Физико-химические основы процесса
.
Синтез аммиака из элементов осуществляется по уравнению реакции
N2+ЗН2 =2NНз; ∆H<0
Реакция обратимая, экзотермическая, характеризуется большим отрицательным энтальпийным эффектом (∆Н=-91,96 кДж/моль) и при высоких температурах становится еще более экзотермической (∆H=-112,86 кДж/моль). Согласно принципу Ле Шателье при нагревании равновесие смещается влево, в сторону уменьшения выхода аммиака. Изменение энтропии в данном случае тоже отрицательно и не благоприятствует протеканию реакции. При отрицательном значении ∆S повышение температуры уменьшает вероятность протекания реакции,
Реакция синтеза аммиака протекает с уменьшением объема. Согласно уравнению реакции 4 моль исходных газообразных реагентов образуют 2 моль газообразного продукта. Основываясь на принципе Л е Шателье, можно сделать вывод о том, что в условиях равновесия содержание аммиака в смеси будет больше при высоком давлении, чем при низком.
Характеристика целевого продукта
Физико-химические свойства
Аммиачная селитра (нитрат аммония) NH4NO3 имеет молекулярную массу 80,043; чистый продукт — бесцветное кристаллическое вещество, содержащее 60% кислорода, 5% водорода и 35% азота (по 17,5% в аммиачной и нитратной формах). Технический продукт содержит не менее 34,0% азота.
Основные физико-химические свойства аммиачной селитры
:
| Плотность,т/м^3 |
| Истинная 1,690-1,725 |
| Насыпная при влажности гранулированного продукта 1% и 20С |
| При плотной упаковке 0,164 |
| При неплотной упаковке 0,826 |
| Температура плавления С 169,5 |
| Теплота плавления кДж/кг 73,21 |
| Теплота образования при 25С и 0,101 МПа , кДж/моль 365,6 |
Аммиачная селитра в зависимостиот температуры существует в пяти кристаллических модификациях, термодинамически устойчивых при атмосферном давлении (табл.). Каждая модификация существует лишь в определенной области температур, и переход (полиморфный) из одной модификации в другую сопровождается изменениями кристаллической структуры, выделением (или поглощением) тепла, а также скачкообразным изменением удельного объема, теплоемкости, энтропии и т. д. Полиморфные переходы являются обратимыми — энантиотропными.
Таблица. Кристаллические модификации аммиачной селитры
| Модификации, вид симметрии |
Интервал температур, °С |
Параметры кристаллической решетки, нм |
| а |
6 |
с |
I, кубическая
II, тетрагональная
III, ромбическая
IV, ромбическая
V, тетрагональная
|
169.6-125,8
125,8—84,2
84.2-32.2
32.2-(-16,9)
Ниже —16,9
|
0,440 0,575 0,706 0,575 0.803 |
0,440 0,575 0,766 0.545 0,803 |
0,440 0,495 0,580 0,496 0,983 |
Система NH4NO3—Н2О (рис. 11-2) относится к системам с простой эвтектикой. Эвтектической точке соответствует концентрация 42,4% МН4МОз и температура —16,9 °С. Левая ветвь диаграммы—линия ликвидуса воды отвечает условиям выделения льда в системе НН4МОз--Н20. Правая ветвь кривой ликвидуса — кривая растворимости МН4МОз в воде. Эта кривая имеет три точки перелома, соответствующие температурам модификационных переходов NH4NO3 1=11(125,8 °С), II=III (84,2 °С) и 111 =IV (32,2 "С). Температура плавления (кристаллизации) безводной аммиачной селитры равна 169,6 °С. Она понижается с увеличением влагосодержания соли.
Зависимость температуры кристаллизации NH4NO3 (Tкрист, "С) от содержания влаги {X,
%) до 1,5% описывается уравнением:
tкрист == 169,6— 13,2x
(11.6)
Зависимость температуры кристаллизации аммиачной селитры с добавкой сульфата аммония от содержания влаги {X,
%) до 1,5% и сульфата аммония (У, %) до 3,0% выражается уравнением [10]:
tкрист [NH4NO3+(NH4)2S04]= 169,6— 13,2Х+2,ОУ. (11.7).
Аммиачная селитра растворяется в воде с поглощением тепла. Ниже приведены значения теплот растворения (Q раств) аммиачной селитры различной концентрации в воде при 25 °С [11]:
| C (NH4NO3)% масс
59,69 47.05 38,84 30,76 22,85 15,09 2,17 |
| Qраств кДж/кг. -202,8 -225,82 -240,45 -256,13 -271,29 -287,49 -320,95 |
Аммиачная селитра хорошо растворима в воде, этиловом и метиловом спиртах, пиридине, ацетоне, жидком аммиаке .
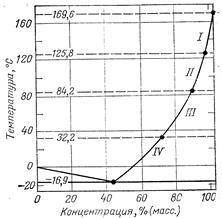
Рис. 11-2. Диаграмма состояния системы
NH
4
N
03—
H
20
Терморазложение.
Аммиачная селитра представляет собой окислитель, способный поддерживать горение. При нагревании ее в замкнутом пространстве, когда продукты терморазложения не могут свободно удаляться, селитра может при некоторыхусловиях взрываться (детонировать). Она может взрываться также под воздействием сильных ударов, например при инициировании взрывчатыми веществами.
В начальный период нагревания при 110°С постепенно происходит эндотермическая диссоциация селитры на аммиак и азотную кислоту:
NH4NO3 ——>
NH3 + НNО3 — 174,4 кДж/моль. (11.9)
При 165 °С потеря массы не превосходит 6%/сут. Скорость диссоциации зависит не только от температуры, но и от соотношения между поверхностью селитры и ее объемом, содержания примесей и др.
Аммиак менее растворим в расплаве, чем азотная кислота, поэтому удаляется быстрее; концентрация азотной кислоты увеличивается до равновесного значения, определяемого температурой. Наличие в расплаве азотной кислоты обусловливает автокаталитический характер терморазложения.
В интервале температур 200—270 °С протекает в основном слабоэкзотермическая реакция разложения селитры на закись азота и воду:
NH4NO3 ——>
N2O+ 2H20+36,8 кДж/моль. (11.10)
Заметное влияние на скорость терморазложения оказывает диоксид азота, который образуется при термическом разложении азотной кислоты, являющейся продуктом диссоциации аммиачной селитры.
При взаимодействии диоксида азота с селитрой образуются азотная кислота, вода и азот:
NH4N03 + 2NO2 ——>
N2 + 2НNО3 + Н2О + 232 кДж/моль.(11.11)
Тепловой эффект этой реакции более чем в 6 раз превышает тепловой эффект реакции разложения селитры на N20 и Н20. Таким образом, в закисленной селитре даже при обычных температурах вследствие значительной экзотермической реакции взаимодействия с диоксидом азота происходит самопроизвольное терморазложение, которое при большой массе аммиачной селитры может привести к ее бурному разложению.
При нагревании селитры в замкнутой системе при 210—220 °С происходит накопление аммиака, концентрация азотной кислоты снижается, поэтому происходит сильное торможение реакции разложения Процесс терморазложения практически прекращается, несмотря на то что большая часть соли еще не разложилась. При более высоких температурах аммиак окисляется быстрее, в системе накапливается азотная кислота и реакция протекает со значительным самоускорением, что может привести к взрыву.
Добавка каммиачной селитре веществ, которые могут разлагаться с выделением аммиака (например, карбамид и ацетамид), тормозит терморазложение. Соли с катионами серебра или таллия значительно увеличивают скорость реакции вследствие образования комплексов с ионами нитрата в расплаве. Ионы хлора оказывают сильное каталитическое действие на процесс терморазложения. При нагревании смеси, содержащей хлорид и аммиачную селитру, до 220—230 °С начинается очень бурное разложение с выделением больших количеств газа. За счет теплоты реакции сильно повышается температура смеси, и разложение заканчивается в течение короткого времени.
Если хлоридсодержащую смесь поддерживать при температуре 150— 200 °С, то в первый период времени, называемый индукционным, разложение будет протекать со скоростью, соответствующей разложению селитры при данной температуре. В этот период помимо разложения будут протекать также другие процессы, результатом которых являются, в частности, увеличение содержания кислоты в смеси и выделение небольшого количества хлора. После индукционного периода разложение протекает с большой скоростью и сопровождается сильным выделением тепла и образованием большого количества токсичных газов. При большом содержании хлорида разложение всей массы аммиачной селитры быстро заканчивается. Ввиду этого содержание хлоридов в продукте строго ограничено.
При эксплуатации механизмов, используемых в производстве аммиачной селитры, следует применять смазки, которые не взаимодействуют с продуктом и не снижают начальную температуру терморазложения. Для этой цели может быть, например, использована смазка ВНИИНП-282 (ГОСТ 24926—81).
Температура продукта, направляемого на хранение насыпью или на упаковку в мешки, должна быть не выше 55 °С. В качестве тары используют мешки из полиэтилена или крафтбумаги. Температуры, при которых начинаются активные процессы окисления аммиачной селитрой полиэтилена и крафтбумаги, составляют соответственно 270—280 и 220—230 °С. Опорожненные полиэтиленовые и крафтбумажные мешки должны быть очищены от остатков продукта и, если не могут быть использованы, то должны быть сожжены.
По энергии взрыва аммиачная селитра в три раза слабее большинства ВВ. Гранулированный продукт может в принципе детонировать, но инициирование капсулем-детонатором невозможно, для этого требуются большие заряды мощных ВВ.
Взрывное разложение селитры протекает по уравнению:
NH4N03 ——>
N2 + 0,502 + 2Н2О + 118 кДж/моль. (IL 12)
По уравнению (11.12) тепло взрыва должно было бы составить 1,48 МДж/кг. Однако вследствие протекания побочных реакций, одна из которых эндотермична (11.9), фактическое тепло взрыва составляет 0,96 МДж/кг и по сравнению с теплом взрыва гексогена (5,45 МДж) мало. Но для такого крупнотоннажного продукта как аммиачная селитра учет его взрывчатых свойств (хотя и слабых) имеет значение для обеспечения безопасности.
Требования потребителей к качеству выпускаемой промышленностью аммиачной селитры отражены в ГОСТ 2-85, согласно которому выпускают товарный продукт двух марок.
Прочность гранул определяют в соответствии с ГОСТ- 21560.2-82 при помощи приборов ИПГ-1, МИП-10-1 или ОСПГ –1М.
Рассыпчатость гранулированной аммиачной селитры,упакованной в мешки, определяют в соответствии с ГОСТ-21560.5-82.

ГОСТ 14702-79-«водоустойчива»
Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства.
Для получения практически неслеживающейся аммиачной селитры применяют ряд технологических приемов. Эффективным средством уменьшения скорости поглощения влаги гигроскопичными солями является их гранулирование. Суммарная поверхность однородных гранул меньше поверхности такого же количества мелкокристаллической соли, поэтому гранулированные удобрения медленнее поглощают влагу из воздуха. Иногда аммиачную селитру сплавляют с менее гигроскопичными солями, например с сульфатом аммония.
В качестве аналогично действующих добавок применяют также фосфаты аммония, хлорид калия, нитрат магния. В основе процесса производства аммиачной селитры лежит гетерогенная реакция взаимодействия газообразного аммиака с раствором азотной кислоты:
NH3+HNO3=NH4NO3
∆H=-144,9 кДж(VIII)
Химическая реакция протекает с большой скоростью; в промышленном реакторе она лимитируется растворением газа в жидкости.Для уменьшения диффузионного торможения большое значение имеет перемешивание реагентов.
Интенсивные условия проведения процесса в значительной мере могут быть обеспечены при разработке конструкции аппарата. Реакцию (VIII) проводят в непрерывно действующем аппарате ИТН (использование теплоты нейтрализации) (рис. 15.16). Реактор представляет собой вертикальный цилиндрический аппарат, состоящий из реакционной и сепарационной зон. В реакционной зоне имеется стакан /, в нижней части которого расположены отверстия для циркуляции раствора. Несколько выше отверстий внутри стакана размещен барботер 2
для подачи газообразного аммиака, над ним — барботер 3
для подачи азотной кислоты. Реакционная парожидкостная смесь выходит из верхней части реакционного стакана; часть раствора выводится из аппарата ИТН и поступает в донейтрализатор, а остальная часть (циркуляционная) вновь идет вниз. Выделившийся из парожидкостной смеси соковый пар отмывается на колпачковых тарелках 6
от брызг раствора аммиачной селитры и паров азотной кислоты 20%-ным растворomселитры, а затем конденсатом сокового пара.
Теплота реакции (VIII) используется для частичного испарения воды из реакционной смеси (отсюда и название аппарата — ИТН). разница в температурах в разных частях аппарата приводит к более интенсивной циркуляции реакционной смеси.
Технологический процесс производства аммиачной селитры включает кроме стадии нейтрализации азотной кислоты аммиаком также стадии упаривания раствора селитры, гранулирования плава, охлаждения гранул, обработки гранул поверхностно-активными веществами, упаковки, хранения и погрузки селитры, очистки газовых выбросов и сточных вод.
На рис. 11-7 приведена схема современного крупнотоннажного агрегата по производству аммиачной селитры АС-72 мощностью 1360 т/сут. Исходная 58—60%-ная азотная кислота подогревается в подогревателе / до 70—80 С соковым паром из аппарата ИТН 3
и подается на нейтрализацию. Перед аппаратами 3
к азотной кислоте добавляют фосфорную и серную кислоты в таких количествах, чтобы в готовом продукте содержалась 0,3—0,5% Р2О5 и 0,05—0,2% сульфата аммония.
В агрегате установлены два аппарата ИТН, работающие параллельно. Кроме азотной кислоты в них подают газообразный аммиак, предварительно нагретый в подогревателе 2
паровым конденсатом до 120— 130 °С. Количества подаваемых азотной кислоты и аммиака регулируют таким образом, чтобы на выходе из аппарата ИТН раствор имел небольшой избыток кислоты (2—5 г/л), обеспечивающий полноту поглощения аммиака.
Азотную кислоту (58—60%-ную) подогревают в аппарате 2
до 80—90 °С соковым паром из аппарата ИТН 8.
Газообразный аммиак в подогревателе 1
нагревается паровым конденсатом до 120—160°С. Азотная кислота и газообразный аммиак в автоматически регулируемом соотношении поступают в реакционные части двух аппаратов ИТН 5, работающих параллельно. Выходящий из аппаратов ИТН 89—92%-ный раствор NH4NO3 при 155—170 °С имеет избыток азотной кислоты в пределах 2—5 г/л, обеспечивающий полноту поглощения аммиака.
В верхней части аппарата соковый пар из реакционной части отмывается от брызг аммиачной селитры; паров HNO3 и NНз 20%-ным раствором аммиачной селитры из промывного скруббера 18
и конденсатом сокового пара из подогревателя азотной кислоты 2,
которые подают на колпачковые тарелки верхней части аппарата. Часть сокового пара используют на подогрев азотной кислоты в подогревателе 2, а основную его массу направляют в промывной скруббер 18,
где смешивают с воздухом из грануляционной башни, с паровоздушной смесью из выпарного аппарата 6
и промывают на промывных тарелках скруббера. Промытую паровоздушную смесь выбрасывают в атмосферу вентилятором 19.
Раствор из аппаратов ИТН 8
последовательно проходит донейтрализатор 4
и контрольный донейтрализатор 5.
В донейтрализатор 4
дозируют серную и фосфорную кислоты в количестве, обеспечивающем содержание в готовом продукте 0,05—0,2% сульфата аммония и 0,3—0,5% P20s. Дозировку кислот плунжерными насосами регулируют в зависимости от нагрузки агрегата.
После нейтрализации избыточной НМОз в растворе аммиачной селитры из аппаратов ИТН и введенных серной и фосфорной кислот в донейтрализаторе 4, раствор проходит контрольный донейтрализатор 5
(куда аммиак автоматически подается только в случае проскока кислоты из донейтрализатора 4)
и поступает в выпарной аппарат 6.
В отличие от агрегата АС-67 верхняя часть выпарного аппарата 6
снабжена двумя ситчатыми промывными тарелками, на которые подают паровой конденсат, отмывающий паровоздушную смесь из выпарного аппарата от аммиачной селитры
Плав селитры из выпарного аппарата 6,
пройдя гидрозатвордонейтрализатор 9
и фильтр 10,
поступает в бак 11,
откуда его погружным насосом 12
по трубопроводу с антидетонационной насадкой подают в напорный бак 15,
а затем к грануляторам 16
или 17.
Безопасность узла перекачивания плава обеспечивается системой автоматического поддержания температуры плава при его упаривании в выпарном аппарате (не выше 190 °С), контролем и регулированием среды плава после донейтрализатора 9
(в пределах 0,1— 0,5 г/л NНз), контролем температуры плава в баке 11,
корпусе насоса 12
и напорном трубопроводе. При отклонении регламентных параметров процесса перекачивание плава автоматически прекращается, а плав в баках 11
и выпарном аппарате 6
при повышении температуры разбавляют конденсатом.
Предусмотрено гранулирование двумя типами грануляторов: виброакустическими 16
и монодисперсными 17.
Более надежными и удобными в работе оказались вибр о акустические грануляторы, которые и эксплуатируются на крупнотоннажных агрегатах.
Плав гранулируют в прямоугольной металлической башне 20
с размерами в плане 8х11 м. Высота полета гранул 55 м обеспечивает кристаллизацию и остывание гранул диаметром 2—3 мм до 90—120°С при встречном потоке воздуха летом до 500 тыс. м∕ч и зимой (при низких температурах) до 300—400 тыс. м∕ч. В нижней части башни расположены приемные конуса, с которых гранулы ленточным конвейером 21
направляют в аппарат охлаждения КС 22.
Аппарат охлаждения 22
разделен на три секции с автономной подачей воздуха под каждую секцию решетки кипящего слоя. В головной его части имеется встроенный грохот, на котором отсеиваются комки селитры, образовавшиеся вследствие нарушения режима работы грануляторов. Комки направляют на растворение. Воздух, подаваемый в секции аппарата охлаждения вентиляторами 23,
подогревают в аппарате 24
за счет тепла сокового пара из аппаратов ИТН. Подогрев производят при влажности атмосферного воздуха выше 60%, а в зимнее время во избежание резкого охлаждения гранул. Гранулы аммиачной селитры последовательно проходят одну, две или три секции аппарата охлаждения в зависимости от нагрузки агрегата и температуры атмосферного воздуха. Рекомендуемая температура охлаждения гранулированного продукта в зимнее время—ниже 27 °С, летом—до 40—50 °С. При эксплуатации агрегатов в южных районах, где значительное число дней температура воздуха превышает 30 °С, третья секция аппарата охлаждения работает на предварительно охлажденном воздухе (в испарительном аммиачном теплообменнике). Количество воздуха, подаваемое в каждую секцию, 75—80тыc.мз
/ч. Напор вентиляторов 3,6 кПа. Отработанный воздух из секций аппарата при температуре 45—60°С, содержащий до 0,52 г/м3
пыли аммиачной селитры, направляют в грануляционную башню, где он смешивается с атмосферным воздухом и поступает на промывку в промывной скруббер 18.
Охлажденный продукт направляют на склад или на обработку ПАВ (диспергатором НФ), а затем на отгрузку навалом или на упаковку в мешки. Обработку диспергатором НФ ведут в полом аппарате 27
с центральнорасположенной форсункой, опрыскивающей кольцевой вертикальный поток гранул, или во вращающемся барабане. Качество обработки гранулированного продукта во всех применяемых аппаратах удовлетворяет требование ГОСТ 2—-85.
Гранулированную аммиачную селитру хранят на складе в буртах высотой до 11 м. Перед отправкой потребителю селитру из склада подают на рассев. Нестандартный продукт растворяют, раствор возвращаютнаупарку. Стандартный продукт обрабатывают диспергатором НФ и отгружают потребителям.
Емкости для серной и фосфорной кислот и насосное оборудование для их дозирования скомпоновано в самостоятельный блок. Центральный пункт управления, электроподстанция, лаборатория, служебные и бытовые помещения расположены в отдельном здании.
|