РЕФЕРАТ
Белки
Белки – это биологические полимеры, состоящие из аминокислот. Ни один из существующих живых организмов – от вирусов до растений и животных – не может существовать без белка. Правда, у растений имеются особые возбудители болезней – вироиды, состоящие из одной нуклеиновой кислоты, однако для их размножения необходимы белки растительной клетки-хозяина.
Белки выполняют в организме множество жизненно важных функций.
Структурная функция
Структурную функцию выполняет, например, белок кератин, из которого состоят шерсть, рога, копыта, верхний отмерший слой кожи. В зависимости от числа поперечных сшивок, скрепляющих белковые молекулы, кератиновые структуры бывают довольно мягкими и гибкими (волосы), а бывают чрезвычайно жесткими и прочными (панцирь черепахи).
В сухожилиях содержится белок коллаген, его фибриллы почти не поддаются растяжению. Благодаря этому мышечное усилие передается костям, к которым крепятся мышцы. При кипячении в воде коллаген образует желатину, часто применяющуюся для приготовления студней и желе. Белок эластин, наоборот, не слишком прочен, но очень эластичен, он содержится в стенках сосудов, легко растягивающихся при увеличении давления.
Белки выполняют структурную функцию не только на организменном, но и на клеточном уровне – в любой эукариотической клетке есть состоящий из белков внутренний цитоскелет. Различают три различных цитоскелетных системы: микротрубочки, микрофиламенты и промежуточные филаменты.
Микротрубочки представляют собой трубчатые образования, состоящие из белка тубулина. По ним, как по рельсам, движутся органеллы от одного участка клетки к другому (другие белки прикрепляют органеллы к наружной стороне «трубы» и обеспечивают движение). Во время митоза они обеспечивают расхождение хромосом к полюсам клетки.
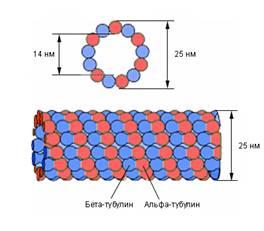 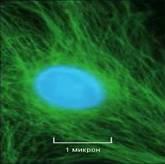
Рис. 1. Слева – строение микротрубочки, справа – цитоскелет, образованный микротрубочками, в клетке соединительной ткани – фибробласте. Микротрубочки окрашены зеленым, ядро – голубым
Микрофиламенты состоят из белка актина. Они образуют сплошную сеть под наружной мембраной клетки, придавая ей упругость и прочность. Пучки микрофиламентов образуются на переднем конце движущейся амебы (и любой клетки с амебоидным движением), именно они выпячивают ложноножку (псевдоподию).
 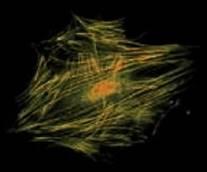
Рис. 2. Слева – строение микрофиламента, справа – цитоскелет, образованный микрофиламентами, в фибробласте. Микрофиламенты окрашены желтым
Промежуточные филаменты в разных клетках состоят из различных белков. В эпителиальных клетках они состоят из кератина, так что волосы представляют собой остатки мертвых ороговевших клеток. По-видимому, эти филаменты просто придают механическую прочность клетке.
Каталитическая функция
Катализатор – это вещество, которое ускоряет реакцию, оставаясь в конце ее неизменным (не расходуясь). Биологические катализаторы называются ферментами, а вещества, участвующие в самой реакции, – субстратами. Почти все ферменты – это белки. В живой клетке может содержаться около 1000 ферментов.
Для живой клетки весьма ценны такие особенности работы ферментов по сравнению с обычными «химическими» катализаторами, как специфичность, высокая эффективность и регулируемость.
Обычно один фермент узнает только «свой» субстрат и ускоряет одну определенную реакцию. Правда, в некоторых случаях специфичность нужна лишь в определенных пределах – так, многие протеазы расщепляют любую пептидную связь белкового субстрата, они неспецифичны к аминокислотным остаткам, составляющим эту связь. Однако они не расщепляют связи между остатками моносахаридов.
Большинство ферментов значительно превосходят по каталитической активности неорганические и простые органические катализаторы. Для эффективной работы небиологических катализаторов, как правило, нужна высокая температура, тогда как в организме человека все ферменты обходятся температурой около 37°С (а у холоднокровных животных – и более низкой).
Еще одно ценное свойство ферментов – это регулируемость, т.е. способность «включаться» и «выключаться». Это относится не ко всем ферментам, некоторые и не надо регулировать.
Однако у ферментов есть и недостатки. Так, они не выдерживают высокой температуры – теряют свою каталитическую активность из-за денатурации (впрочем, у разных белков различная устойчивость к температурным воздействиям – у бактерий-термофилов белки нормально работают при 100 °С).
Многие ферменты нуждаются для своей работы в наличии небольших небелковых соединений – коферментов. Они часто образуются из витаминов – почти все витамины группы В являются предшественниками коферментов. Некоторые коферменты прочно связаны со своими ферментами, тогда как другие легко отделяются от одного белка и присоединяются к другому.
Некоторые ферменты активны только тогда, когда связываются с ионами металлов – магния, марганца, цинка, железа, меди и др.
Двигательная функция
Все известные способы движения живых организмов основаны на работе соответствующих белков. Так, сокращение мышц обеспечивают мышечные белки актин и миозин. В поперечно-полосатых мышцах имеются пучки актиновых и миозиновых нитей, которые называются тонкими и толстыми филаментами. При возбуждении мышцы эти филаменты начинают скользить друг по другу. Толстые филаменты как бы втягиваются в пространство между тонкими, в результате чего мышца сокращается (энергию для такого направленного скольжения дает АТФ).
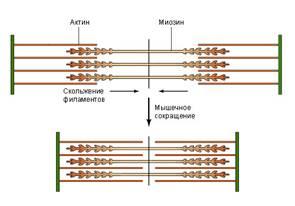
Рис. 3. Скольжение актиновых и миозиновых нитей вызывает мышечное сокращение
Они же делают возможным ползание амебы. На переднем конце амебоидной клетки растут актиновые филаменты, они выпячивают наружную мембрану, образуя ложноножку. Затем ложноножка прикрепляется к поверхности, по которой ползет амеба. Наконец, с помощью миозина вся клетка подтягивается к прикрепленной ложноножке, и процесс повторяется снова.
Другие белки обеспечивают подвижность жгутиков. По окружности жгутика эукариотических клеток располагаются микротрубочки, связанные друг с другом с помощью белка динеина. Этот белок как бы пытается заставить скользить одну микротрубочку по другой (вспомните скольжение нитей при мышечном сокращении). Но микротрубочки скреплены друг с другом специальными белками, поэтому они не могут свободно скользить друг по другу, а могут лишь изгибаться. Этот изгиб распространяется по всему жгутику, он начинает биться как хлыст, вызывая движение всей клетки. Динеин работает на энергии АТФ.
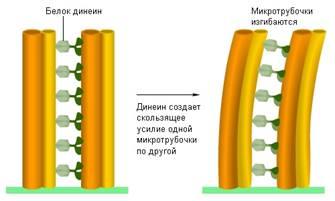
Рис. 4. Механизм движения жгутика эукариотических клеток
Транспортная функция
Классический пример транспортного белка – это гемоглобин крови, который переносит кислород по кровяному руслу (он участвует и в транспорте углекислого газа). Имеются специальные белки, переносящие по организму различные вещества: ионы железа (белок трансферрин), витамин В12 (транскобаламин), жирные кислоты (сывороточный альбумин), стероидные гормоны и т. п.
Специальные белки служат и для транспорта разных веществ через мембрану. Глюкоза является гидрофильным соединением и очень плохо проникает через липидный бислой, поэтому на мембранах различных клеток имеется специальный белок – переносчик глюкозы. Хотя бислой проницаем для воды, все же на мембране есть белки–аквапорины, ускоряющие прохождение воды через нее. Некоторые аквапорины специфично транспортируют только воду, другие могут переносить еще и разные небольшие нейтральные молекулы (глицерин, мочевину).
Питательная или энергетическая функция
Белки можно расщепить, окислить и получить энергию, необходимую для жизни. При окислении 1 г белка выделяется около 4,1 килокалории. Обычно белки идут на энергетические нужды организма человека в крайних случаях, когда исчерпаны запасы жиров и углеводов.
В яйцеклетках содержатся специальные запасные белки (например, яичный альбумин). Когда начинается развитие нового организма из оплодотворенного яйца, они расщепляются и используются как «строительный материал» для синтеза новых белков, а также как источник энергии. Запасные белки содержатся и в семенах растений.
Защитная функция
В крови и других жидкостях содержатся белки, которые могут убивать или помогать обезвреживать микробов. В состав плазмы крови входят антитела – белки, каждый из которых узнает определенный вид микроорганизмов или иных чужеродных агентов, – а также защитные белки системы комплемента. Существует несколько классов антител (эти белки еще называют иммуноглобулинами), самый распространенный из них – иммуноглобулин G. В слюне и в слезах содержится белок лизоцим – фермент, расщепляющий муреин и разрушающий клеточные стенки бактерий. При заражении вирусом клетки животных выделяют белок интерферон, препятствующий размножению вируса и образованию новых вирусных частиц.
Защитную функцию для микроорганизмов выполняют и такие неприятные для нас белки, как микробные токсины – холерный токсин, токсин ботулизма, дифтерийный токсин и т. п. Повреждая клетки нашего организма, они защищают микробов от нас.
Рецепторная функция
Белки служат для восприятия и передачи сигналов. В физиологии есть понятие клетки-рецептора, т.е. клетки, которая воспринимает определенный сигнал (например, в сетчатке глаза находятся клетки-зрительные рецепторы). Но в клетках-рецепторах эту работу осуществляют белки–рецепторы. Так, белок родопсин, содержащийся в сетчатке глаза, улавливает кванты света, после чего в клетках сетчатки начинается каскад событий, который приводит к возникновению нервного импульса и передаче сигнала в мозг.
Белки-рецепторы есть не только в клетках-рецепторах, но и в других клетках. Очень важную роль в организме играют гормоны – вещества, выделяемые одними клетками и регулирующие функцию других клеток. Гормоны связываются со специальными белками – рецепторами гормонов на поверхности или внутри клеток-мишеней.
Регуляторная функция
Многие (хотя и далеко не все) гормоны являются белками – например, все гормоны гипофиза и гипоталамуса, инсулин и др. Еще одним примером белков, выполняющих эту функцию, могут служить внутриклеточные белки, регулирующие работу генов.
Многие белки могут выполнять несколько функций.
Макромолекулы белков состоят из α-аминокислот. Если в состав полисахаридов обычно входит одна и та же «единица» (иногда две), повторяющаяся много раз, то белки синтезируются из 20 разных аминокислот. После того, как молекула белка собрана, некоторые аминокислотные остатки в составе белка могут подвергаться химическим изменениям, так что в «зрелых» белках можно обнаружить более 30 различных аминокислотных остатков. Такое разнообразие мономеров обеспечивает и многообразие биологических функций, выполняемых белками.
α-аминокислоты имеют следующее строение:
 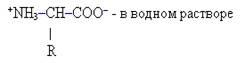
здесь R – различные группы атомов (радикалы) у разных аминокислот. Ближайший к карбоксильной группе атом углерода обозначается греческой буквой α, именно с этим атомом соединена аминогруппа в молекулах α-аминокислот.
В нейтральной среде аминогруппа проявляет слабые основные свойства и присоединяет ион Н+, а карбоксильная – слабо кислотные и диссоциирует с освобождением этого иона, так что хотя в целом суммарный заряд молекулы не изменится, она будет одновременно нести положительно и отрицательно заряженную группу.
В зависимости от природы радикала R различают гидрофобные (неполярные), гидрофильные (полярные), кислые и щелочные аминокислоты.
У кислых аминокислот имеется вторая карбоксильная группа. Она немного сильнее карбоксильной группы уксусной кислоты: у аспарагиновой кислоты половина карбоксилов диссоциирована при рН 3,86, у глютаминовой – при рН 4,25, а у уксусной – лишь при 4,8. Среди щелочных аминокислот самой сильной является аргинин: половина его боковых радикалов сохраняет положительный заряд при рН 11,5. У лизина боковой радикал является типичным первичным амином, он остается наполовину ионизированным при рН 9,4. Самая слабая из щелочных аминокислот – гистидин, его имидазольное кольцо наполовину протонировано при рН 6.
Среди гидрофильных (полярных) также имеются две аминокислоты, способные ионизироваться при физиологических рН – цистеин, у которого SH-группа может отдавать ион Н+ подобно сероводороду, и тирозин, у которого есть слабокислая фенольная группировка. Однако эта способность выражена у них очень слабо: при рН 7 цистеин ионизирован на 8 %, а тирозин – на 0,01 %.
Для обнаружения α-аминокислот обычно используют нингидриновую реакцию: при взаимодействии аминокислоты с нингидрином образуется ярко окрашенный синий продукт. Кроме того, отдельные аминокислоты дают свои специфические качественные реакции. Так, ароматические аминокислоты дают желтое окрашивание с азотной кислотой (в ходе реакции происходит нитрование ароматического кольца). При подщелачивании среды окраска изменяется на оранжевую (подобное изменение окраски происходит и у индикаторов, например, метилоранжа). Эта реакция под названием ксантопротеиновой используется также для детекции белка, поскольку в большинстве белков есть ароматические аминокислоты; желатин не дает этой реакции, поскольку почти не содержит ни тирозина, ни фенилаланина, ни триптофана. При нагревании с плюмбитом натрия Na2PbO2 цистеин образует черный осадок сульфида свинца PbS.
Растения и многие микробы могут синтезировать аминокислоты из простых неорганических веществ. Животные могут синтезировать лишь некоторые аминокислоты, другие же должны получать с пищей. Такие аминокислоты называются незаменимыми. Для человека незаменимыми являются фенилаланин, триптофан, треонин, метионин, лизин, лейцин, изолейцин, гистидин, валин и аргинин. К сожалению, злаковые культуры содержат очень мало лизина и триптофана, зато эти аминокислоты в существенно большем количестве содержатся в бобовых культурах. Не случайно традиционные диеты земледельческих народов обычно содержат как злаки, так и бобовые: пшеница (или рожь) и горох, рис и соя, кукуруза и бобы являются классическими примерами такого сочетания у народов разных континентов.
α-Атом углерода у всех 20 аминокислот находится в состоянии sp3-гибридизации. Все его 4 связи расположены под углом около 109°, так что формулу аминокислоты можно вписать в тетраэдр.
Легко убедиться, что могут существовать два вида аминокислот, которые являются зеркальными отображениями друг друга. Как бы мы ни перемещали и ни поворачивали их в пространстве, совместить их невозможно – они различаются как правая и левая рука.
Такой вид изомерии называется оптической изомерией. Он возможен только в том случае, если у центрального атома углерода (он называется асимметрическим центром) со всех 4 сторон находятся разные группы (поэтому глицин не имеет оптических изомеров, а остальные 19 аминокислот имеют). Из двух разных изомерных форм аминокислот ту, что на рис. 1 расположена справа, называют D-формой, а слева – L-формой.
Основные физические и химические свойства D- и L-изомеров аминокислот одинаковы, однако различаются оптические свойства: их растворы вращают плоскость поляризации света в противоположные стороны. Различна и скорость их реакций с другими оптически активными соединениями.
Интересно, что в состав белков всех живых организмов от вирусов до человека входят только L-аминокислоты. D-формы встречаются в некоторых антибиотиках, синтезируемых грибами и бактериями. Белки могут образовывать упорядоченную структуру лишь в том случае, если в их состав будут входить только изомеры аминокислот одного типа.
Строение белковых молекул
В молекуле белка аминокислотные остатки соединены так называемой пептидной связью. Полная последовательность аминокислотных остатков в такой цепи называется первичной структурой белка. Число остатков в разных белках может колебаться от нескольких штук до нескольких тысяч. Небольшие молекулы с мол. массой менее 10 тыс. дальтон называют пептидами, а крупные – белками. В составе белка обычно имеются как кислые, так и щелочные аминокислоты, так что белковая молекула имеет и положительные, и отрицательные заряды. Значение рН, при котором количество отрицательных зарядов равно количеству положительных, называется изоэлектрической точкой белка.
Обычно белковая цепочка складывается в более сложные структуры. Кислород группы C=O может образовывать водородную связь с водородом группы N–H, расположенной в другой аминокислоте. За счет таких водородных связей формируется вторичная структура белка. Одна из разновидностей вторичной структуры – α-спираль. В ней каждый кислород С=О-группы связан с водородом 4-й по ходу спирали NH-группы. На один виток спирали приходится 3,6 аминокислотных остатка, шаг спирали составляет 0,54 нм.
Во многих белках имеется т. н. β-структура, или β-слой, в ней полипептидные цепочки почти полностью развернуты, их отдельные участки своими группами –СО– и –NH– образуют водородные связи с другими участками той же цепочки или соседней полипептидной цепи.
α-Спиральную структуру имеет белок кератин, из которого состоят волосы и шерсть. При нагревании влажные волосы и шерсть легко поддаются растяжению, а потом самопроизвольно возвращаются к исходному состоянию: при растяжении водородные связи α-спирали разрываются, а затем постепенно восстанавливаются.
β-Структура характерна для фиброина – основного белка шелка, выделяемого гусеницами шелкопряда. В отличие от шерсти, шелк почти нерастяжим – β-структура образована вытянутыми полипептидными цепями, и дальше растягивать ее практически невозможно без разрыва ковалентных связей.
Укладка белков обычно не ограничивается вторичной структурой. Гидрофобные аминокислотные остатки «стремятся» укрыться от водного окружения внутри белковой молекулы. Между боковыми группами кислых и щелочных аминокислот, заряженных, соответственно, отрицательно и положительно, возможно электростатическое взаимодействие. Многие аминокислотные остатки могут образовывать друг с другом водородные связи. Наконец, остатки аминокислоты цистеина, содержащие SH-группы, способны образовывать между собой ковалентные связи –S–S–.
Благодаря всем этим взаимодействиям – гидрофобным, ионным, водородным и дисульфидным – белковая цепочка образует сложную пространственную конфигурацию, называемую третичной структурой.
В составе глобулы у многих белков можно различить отдельные компактные участки размером около 10–20 тысяч дальтон. Они называются доменами. Участки полипептидной цепи между доменами весьма гибки, так что всю структуру можно представить как относительно жесткие бусины доменов, соединенные гибкими промежуточными участками первичной структуры.
Многие белки (их называют олигомерными) состоят не из одной, а из нескольких полипептидных цепочек. Совокупность их образует четвертичную структуру белка, при этом отдельные цепочки называются субъединицами. Четвертичная структура удерживается теми же связями, что и третичная. Пространственная конфигурация белка (т.е. его третичная и четвертичная структура) называется конформацией.
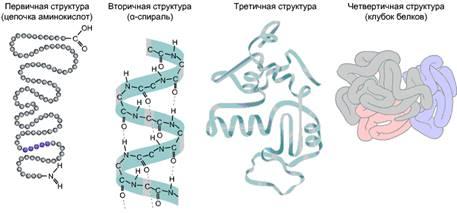
Рис. 4. Различные уровни укладки белковых молекул
Главным методом, позволяющим устанавливать пространственную структуру белков и других биологических полимеров, является рентгеноструктурный анализ. В последнее время большие успехи достигнуты в компьютерном моделировании белковых конформаций.
Водородные, электростатические и гидрофобные связи, с помощью которых создаются вторичная, третичная и четвертичная структуры белка, менее прочны, чем пептидная связь, образующая первичную структуру. При нагревании они легко разрушаются, и хотя у белка сохраняется в целости первичная структура, он не может выполнять своих биологических функций, становится неактивным. Процесс разрушения природной конформации белка, сопровождающийся потерей активности, называется денатурацией. Денатурацию вызывает не только нагревание, но и химические вещества, нарушающие связи вторичной и третичной структур – например, мочевина, которая в высоких концентрациях разрушает водородные связи в белковой глобуле.
Дисульфидные –S–S-связи образуют прочные «скрепы», сшивающие различные участки одной полипептидной цепи или разные цепи. Эти связи имеются, например, в кератинах, причем разные кератины содержат разное количество таких сшивок: волосы и шерсть – немного, рога, копыта млекопитающих и панцири черепах – значительно больше.
Вторичная, третичная и четвертичная структура белка определяется его первичной структурой. В зависимости от последовательности аминокислот в полипептидной цепочке будут образовываться α-спиральные или β-структурные участки, которые затем самопроизвольно «уложатся» в определенную третичную структуру, а у некоторых белков отдельные цепочки еще и объединятся с образованием четвертичной структуры.
Если изменить первичную структуру белка, то может сильно измениться и вся его конформация. Существует тяжелая наследственная болезнь – серповидно-клеточная анемия, при которой гемоглобин становится малорастворим в воде, а эритроциты приобретают серповидную форму. Причина болезни – замена всего лишь одной аминокислоты из 574, входящих в состав человеческого гемоглобина (глютаминовая кислота, расположенная на 6-м месте с N-конца одной из цепей гемоглобина нормальных людей, у больных заменена на валин).
Процесс самопроизвольной ассоциации белковых субъединиц в сложные комплексы, обладающие четвертичной структурой, называется самосборкой. Большинство белковых комплексов с четвертичной структурой образуются именно путем самосборки.
В 1980-е годы было обнаружено, что не все белки и белковые комплексы образуются путем самосборки. Оказалось, что для образования таких структур как нуклеосомы (комплексы белков-гистонов с ДНК), бактериальные ворсинки – пили, а также некоторых сложных ферментных комплексов используются специальные белки–помощники, названные шаперонами. Шапероны не входят в состав образующейся структуры, а только помогают ее укладке.
Шапероны служат не только для организации сложных комплексов, но в некоторых случаях помогают правильно свернуть одну полипептидную цепочку. Так, при воздействии высокой температуры в клетках резко возрастает количество т. н. белков теплового шока. Они связываются с частично денатурированными клеточными белками и восстанавливают их природную конформацию.
Долгое время считалось, что белок может иметь только одну устойчивую конформацию при данных условиях, но в последнее время этот постулат пришлось пересмотреть. Поводом к такому переосмыслению послужило открытие возбудителей т. н. медленных нейрологических инфекций. Эти инфекции встречаются у разных видов млекопитающих. К ним относится болезнь овец «скрепи», заболевание человека «куру» («смеющаяся смерть») и нашумевшее в последнее время «бешенство коров». Они имеют много общего.
Для них характерны тяжелые поражения центральной нервной системы. Так, люди, больные куру, на ранних стадиях болезни испытывают эмоциональную неустойчивость (большинство – часто и беспричинно смеются, но некоторые находятся в состоянии депрессии или немотивированной агрессивности) и легкие нарушения координации движений. На поздних стадиях больные уже не способны не только двигаться, но даже сидеть без поддержки, а также есть.
Заражение обычно происходит пищевым путем (изредка через кровь). Болезнь у животных развивалась после скармливания им костной муки, которая изготавливалась из костей больных особей. Куру – болезнь папуасских людоедов, передающаяся при поедании мозга умерших родичей (поедание друг друга в этом случае – скорее отрасль богослужения, чем кулинарии, оно имеет важное ритуальное значение).
Все эти заболевания имеют очень длительный инкубационный период и развиваются медленно. В головном мозге заболевших отмечается отложение нерастворимого белкового конгломерата. Нерастворимые белковые нити обнаруживаются в пузырьках, расположенных внутри нейронов, а также во внеклеточном веществе. Наблюдается разрушение нейронов в некоторых отделах мозга, особенно в мозжечке.
Долгое время оставалась загадочной природа возбудителей этих заболеваний, и только в начале 80-х годов было установлено, что эти возбудители – особые белки с молекулярной массой около 30 тысяч дальтон. Такие доселе неизвестные науке объекты получили название прионы.
Было установлено, что прионный белок закодирован в ДНК организма-«хозяина». Белок здорового организма содержит ту же последовательность аминокислот, что и белок инфекционной частицы приона, но никаких патологических симптомов не вызывает. Функция прионного белка пока неизвестна. Мыши, у которых генные инженеры искусственно выключили ген этого белка, развивались вполне нормально, хотя и имели некоторые отклонения в работе центральной нервной системы (худшее обучение, нарушения сна). В здоровом организме этот белок обнаружен на поверхности клеток во многих органах, больше всего в головном мозге.
Оказалось, что в инфекционной частице прионный белок имеет иную конформацию, чем в нормальных клетках. Он содержит бета-структурные участки, обладает высокой устойчивостью к расщеплению пищеварительными ферментами и способностью образовывать нерастворимые агрегаты (видимо, отложение таких агрегатов в мозге и является причиной развития нейропатологии).
Самое интересное, что «нормальная» конформация этого белка превращается в «болезнетворную», если клетка контактирует с «болезнетворным» белком. Получается, что «болезнетворный» белок «лепит» пространственную структуру «нормального» по себе. Он направляет его укладку как матрица, вызывая появление все большего числа молекул в «болезнетворной» конформации и, в конце концов, гибель организма.
Как именно это происходит, до сих пор неизвестно. Если смешать в пробирке нормальную и инфекционную форму прионного белка, то никакого образования новых инфекционных молекул не произойдет. По-видимому, в живой клетке имеются какие-то молекулы-помощники (вероятно, шапероны), позволяющие прионному белку делать свое черное дело.
Отложение нерастворимых белковых конгломератов может служить причиной и других неизлечимых нервных заболеваний. Болезнь Альцгеймера не относится к числу инфекционных – она возникает в пожилом и старческом возрасте у людей с наследственной предрасположенностью. У больных наблюдается ухудшение памяти, ослабление интеллекта, слабоумие, и, в конце концов – полная утрата психических функций. Причина развития болезни – отложение в мозгу т. н. амилоидных бляшек. Они состоят из нерастворимого белка – β-амилоида. Он представляет собой фрагмент белка–предшественника амилоида – нормального белка, присутствующего у всех здоровых людей. У больных он расщепляется с образованием нерастворимого амилоидного пептида.
Мутации в разных генах вызывают развитие болезни Альцгеймера. Естественно, ее вызывают мутации в гене белка–предшественника амилоида – измененный предшественник после расщепления образует нерастворимый β-амилоид, формирующий бляшки и разрушающий клетки головного мозга. Но болезнь возникает и при мутации в генах белков, регулирующих активность протеаз, разрезающих белок – предшественник амилоида. Не совсем понятно, как в этом случае развивается заболевание: возможно, нормальный белок предшественник режется в каком-то неправильном месте, что приводит к выпадению в осадок образующегося пептида.
Очень рано болезнь Альцгеймера развивается у больных с синдромом Дауна – у них содержится не две копии 21-й хромосомы, как у всех людей, а три. Больные синдромом Дауна имеют характерную внешность и слабоумие. Дело в том, что ген белка–предшественника амилоида как раз и находится в 21-й хромосоме, увеличение количества гена приводит к увеличению количества белка, а избыток белка–предшественника приводит к накоплению нерастворимого β-амилоида.
Белки часто соединяются с другими молекулами. Так, гемоглобин, переносящий кислород в кровеносной системе, состоит из белковой части – глобина, и небелковой – гема. Ион Fe2+ входит в состав гема. Глобин состоит из четырех полипептидных цепочек. Благодаря наличию гема с железом гемоглобин катализирует окисление перекисью водорода различных органических веществ – например, бензидина. Раньше эта реакция под названием «бензидиновая проба» использовалась в судебно-медицинской экспертизе для обнаружения следов крови.
Некоторые белки химически связаны с углеводами, их называют гликопротеины. Очень многие белки, секретируемые животной клеткой, являются гликопротеинами – например, известные по предыдущим разделам трансферрин и иммуноглобулины. Однако, желатин, хотя и является продуктом гидролиза секретируемого белка коллагена, практически не содержит присоединенных углеводов. Внутри клетки гликопротеины встречаются гораздо реже.
В лабораторной практике используется много методов определения концентрации белка. В самом простом из них применяется биуретовый реактив – щелочной раствор соли двухвалентной меди. В щелочной среде некоторая часть пептидных связей в молекуле белка переходит в енольную форму, которая образует с двухвалентной медью комплексы, окрашенные в красный цвет. Другой распространенной реакцией на белок является окраска по Бредфорду. В ходе реакции молекулы специального красителя связываются с белковой глобулой, что вызывает резкое изменение окраски – из бледно-коричневого раствор становится ярко-синим. Это краситель – «кумасси ярко-синий» – раньше использовался для окраски шерсти (а шерсть, как известно, состоит из белка кератина). Наконец, для определения концентрации белка можно использовать его свойство поглощать ультрафиолетовый свет с длиной волны 280 нм (его поглощают ароматические аминокислоты фенилаланин, тирозин и триптофан). Чем сильнее раствор поглощает такой ультрафиолет, тем больше там содержится белка.
|