1. Литературный обзор
1.1 ОБЩИЕ СВЕДЕНИЯ
Хром — элемент 6-й группы периодической системы элементов Д И- Менделеева. Его атомный номер 24, атомная масса 51,99. До хрома ни один элемент периодической системы не выделяется электролизом из водных растворов.
Физические свойства хрома следующие: температура плавления 1890—1900 °С; температура кипения 2500 °С; плотность (при 20 °С) 6,9— 7,2 г/см3
; температурный коэффициент линейного _ расширения (при 20 °С) 6,6* 10"6
К 1
; удельная теплоемкость 0,46-103
Дж/(кг-К).
Соединения шестивалентного хрома являются сильными окислителями. Хромовый ангидрид при растворении в воде образует смесь полихромовых кислот. В разбавленном растворе образуется Н2
[Сг04
], при средней концентрации — Н2
[СгО3
(СгО4
) ]. При дальнейшем увеличении концентрации образуются Н2
[СгО3
(СгО4
)]2
и Н2[Сг03
(Сг04
)3
]. Все хромовые кислоты относятся к сильным, по мере усложнения их состава степень их диссоциации в разбавленных растворах возрастает. При 25 °С константы диссоциации хромовой кислоты но первой и второй ступеням составляют соответственно 1,8-10-1
и 3,20- 10-7
. Оксид Сг2
О3
обладает амфотерными свойствами. Соединения Сг2+
,обладающие основными свойствами, неустойчивы.
1.2 СТРУКТУРА И СВОЙСТВА ЭЛЕКТРООСАЖДЕННОГО ХРОМА
Структура. Электролитический хром отличается мелкокристаллической структурой. Наименьшими размерами обладают кристаллы блестящего хрома 0,001—0,01 мкм. Кристаллы матового и молочного хрома имеют размеры кристаллов 0,1—10 мкм. Осадки хрома характеризуются слоистостью и образованием на поверхности характерных наростов — микросфероидов (рис. 10), которые наблюдаются при осаждении достаточно толстых покрытий (более 30—50 мкм).
Известны две основные структурные модификации электроосажденногохрома:
а-хром — объемно-центрированный куб с параметром элементарной ячейки а = 2,878 А (0,2878 нм) и плотностью 7,1 г/см3
;
β-хром — гексагональная решетка с параметрами а = 2,717 А (0,2717 нм) и с= 4,419 А (0,4419 нм), плотностью 6,08 г/см5
*. Помимо этих двух модификаций обнаружена также модификация γ-Сr с элементарной ячейкой типа а-Мп, содержащей 58 атомов в элементарной ячейке [а = 8,717 (0,8717 нм], а также хром, имеющий кубическую гранецентрированную решетку.
Структура а-Сr является стабильной, характерной для осадков блестящего типа, т. е. осадков, полученных при высокой температуре.
Структура Р~Сr является метастабильной, характерной для осадков, полученных при низкой температуре, т. е. для матовых осадков. Гексагональный хром представляет собой фазу внедрения водорода в хром или гидрид хрома состава от СrН до СrН2
. Гексагональный хром самопроизвольно переходит в стабильную кубическую структуру (а-Сr), что вызывает сокращение объема осадка примерно на 15—16%, возникновение внутренних напряжений растяжения и растрескивание осадка.
Содержание газов. Электролитически осажденный хром содержит (масс, доля, %) в среднем 0,04—0,05 Н2
и до 0,2—0,5 О2
, а также незначительное количество N2
. Примерное содержание Н2
(масс, доля, %) в осадках, полученных при различных температурах: 32-0,07; 52 - 0,06, 65 -0,03. Водород может быть в различной форме: в составе гидрида, в адсорбированном состоянии, в растворенном состоянии. Кислород попадаетв осадок при захвате частиц катодной пленки, содержащих Сr2
О3
или дру-гие кислородсодержащие соединения, осака. Полагается, что при включение в осадок N2 является основной причиной хруппкости хромовых покрытий.
Включение газов в осадок в значительной мере зависит от температуры электролиза. При повышении температуры в интервале 40—70 °С содержание газов снижается примерно в 2 раза. Увеличение плотности тока приводит к некоторому увеличению содержания газов в хроме.
Термическая обработка после хромирования приводит к удалению водорода из хромового покрытия, причем основная масса водорода выделяется при температуре, близкой к 200 °С.
Внутренние напряжения. В процессе электроосаждения в хромовых покрытиях возникают σвн растяжения. Причина возникновения этих напряжений — структурные превращения, вызывающие сокращение объема осадка при самопроизвольном переходе нестабильной гексагональной структуры в объемно-центрированную кубическую.
В наибольшей степени на величину σвя
оказывает влияние температура электролиза: в интервале получения блестящих и молочных осадков внутренние напряжения σвн
снижаются. При каждой температуре электролиза минимум 0ВН
в осадках обеспечивается при определенной плотности тока, А/дм2
: при 50 °С — 30, при 55 °С — 40. Внутренние напряжения незначительно снижаются при увеличении концентрации СО3
.
При Т, близкой к 90 °С, возможно получение хромовых покрытий, не имеющих сЕН
.
Микротвердость. Твердость покрытий определяется режимом электролиза. При увеличении температуры электролиза твердость снижается, при увеличении плотности тока максимум микротвердости наблюдается при плотности, близкой к 60 А/дм2
. При Т= 35-:-45 °С твердость покрытий, осажденных из разбавленного (150 г/л) и из стандартного электролитов (250 г/л), практически не отличается. При температуре 65—75 С
С твердость осадков из разбавленного электролита выше на 10—20%. Термическая обработка после хромирования приводит к снижению твердости и к увеличению размера зерен покрытия.
Износостойкость. Наиболее износостойкие покрытия, как правило, наносят при режимах электролиза, обеспечивающих получение покрытий на границе областей осаждения блестящих и молочных покрытий. Однако во многих случаях установлено, что с увеличением твердости износостойкость осадков растет. Термическая обработка, осуществляемая после хромирования, влияет на износостойкость покрытий. Наиболее высокой износостойкостью обладают покрытия, термообработанные в интервале 150-200 °С. Термическая обработка при более высокой вызывает существенное снижение износостойкости. Осадки полученные при Т = 70 С более, практически не изменяют износостойкость, в результате термической обработки.
Пористость. Для хромовых покрытий характерна пористость, возникающая в результате растрескивания покрытий под действием ат
. Появление пористости в виде сетки трещин начинается по достижении определенной толщины покрытия.
Пористая структура осадков хрома, полученных при различной температуре хромирования, определяет скорость его разрушения СР в 1 н. НС1 при Т=40°С:
На пористость хрома основное влияние оказывают температура электролиза и соотношение между СгО3
и Н2
5О4
. В качестве количественного критерия пористости выбрано число площадок, образующихся в результате появления на покрытии сетки трещин, приходящееся на мм2
поверхности.
1.3 ТЕХНОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ПРОЦЕССА
Размерное хромирование. При нанесении толстых износостойких покрытий как на новые детали, так и на ранее эксплуатировавшиеся (восстановление) требуется применять специальные подвесные приспособления и аноды. Это необходимо для равномерного осаждения покрытия, ибо электролиты для хромирования обладают низкой РС. Процесс получения равномерных по толщине хромовых покрытий, частично или полностью исключающий оконча тельную механическую обработку де талей, получил название размерного хромирования.
Во многих случаях, например, при хромировании штампов, для размерного хромирования применяют профилированные аноды, воспроизводящие рельеф покрываемой поверхности. При завеске детален в ванну следует учитывать, что при электролизе выделяется обильное количество газов, которые не должны скапливаться внутри детали или внутри подвески.
При хромировании внешней поверхности цилиндрических деталей в случаях, когда не применяются специальные подвесные приспособления с кольцевыми индивидуальными анодами, рекомендуется использовать круглые аноды диаметром 40—80 мм. Аноды располагают таким образом, . чтобы вокруг каждой детали было не менее четырех анодов. Оптимальным межэлектродным расстоянием считается 100-150 мм. При сокращении этого расстояния до 50 мм. Наблюдается при увеличении межэлектродного расстояния свыше 200—250 мм.
При вертикальном завешивании деталей в ванну нижние края деталей должны отстоять от дна более чем на 200 мм. Расстояние от поверхности электролита 100—150 мм.
С целью улучшения равномерности осаждения хрома возможно вести хромирование деталей в горизонтальном положении. При этом необязательно непрерывное вращение деталей. Периодическое вращение осуществляют с помощью специального приспособления (рис. 1).

Рис 1. Подвески для хромирования деталей в горизонтальном положении: а - завешиваемая на две штанги ванны: 1 - траверса; 2 — штанга подвески; 3 — спица ворота для периодического поворота детали; 4 - уплотнительные диски; 5 - экран; 6 — втулки подвески; б — завешиваемая на одну штангу; 1 — рукоятка для поворота; 2 - крючок; 3 — траверса; 4 - винипластовые зубчатые колеса; 5 - штанга; 5 — муфты для крепления деталей
Поворот деталей на угол 90° осуществляют перемещением рукояток-спиц, которые находятся выше уровня электролита. Поворот осуществляют до того момента, когда очередная спица выйдет из электролита. Периодичность вращения зависит от толщины наращиваемого слоя следующим образом:

Периодическое вращение деталей возможно проводить и при иной конструкции подвесного приспособления, когда одновременно осуществляется вращение нескольких деталей.
При горизонтальном положении деталей в электролите хромирование ведут с плоскими анодами, отстоящими от поверхности деталей на 100—150 мм.
1.4 ЭЛЕКТРОЛИТЫ ХРОМИРОВАНИЯ
СТАНДАРТНЫЙ ЭЛЕКТРОЛИТ ХРОМИРОВАНИЯ
Основной электролит для осаждения хрома содержит два компонента: СгО4
и H2
SO4
. Соотношение по массе между этими компонентами должно быть 100 : 1. При этом соотношении достигается наиболее высокий выход по току.
Обычное содержание СгО3
150— 300 г/л, хотя .известны электролиты содержащие 60—80 г/л этого основного компонента. Электролит, содержащий 220—250 г/л, называют стандартным:
| Тип электролита |
Концентрация компонентов, г/л |
Режимы работы |
| СгО3
|
H2
SO4
|
і, А/дм |
t С |
| Стандартный |
220 |
2.25 – 2.5 |
15 - 60 |
45 - 55 |
Разбавленный электролит рекомендуется для получения износостойких покрытий, концентрированный — для защитно-декоративных. Наиболее распространен - стандартный, или универсальный, электролит.
Фторидиые электролиты. F и F-содержащие ионы используются в электролитах холодного хромирования, в том числе ля осаждения покрытий в колокольных и барабанных установках. Однако ряд электролитов этого типа широко используется для износостойкого хромирования.
По сравнению с электролитами, содержащими добавку SO4, фторидные электролиты имеют следующие преимущества:
возможность ведения процесса при комнатной температуре;
лучшую рассеивающую и кроющую способность;
меньшую критическую плотность тока, т. е. возможность вести осаждение хрома при очень низкой tк
(0,5—2 А/дм2
); более высокий выход по току.
Недостатки фторидных электролитов следующие: более высокая агрессивность и формирование на анодах пленки фторида свинца, обладающей высоким электрическим сопротивлением.
В связи с указанной особенностью работы анодов при осаждении хрома из фторидных электролитов применяются только аноды, содержащие Sb или лучше Sn.
Осадки хрома, получаемые из фторидных электролитов, имеют более низкую твердость и более пластичны, чем осадки, полученные из стандартного электролита. Более низки σвп
в хромовых покрытиях.
Фторидные электролиты могут работать и при более высокой температуре. Возможно хромирование из электролитов, содержащих 4—6 г/л одного из следующих соединений: К2
ТiF6
, К2
ZrF6
и Na3
А1F6
, способных быть катализаторами электроосаждения хрома.
Саморегулирующиеся электролиты. Принцип действия электролитов — автоматическое поддержание постоянного соотношения между концентрациями СrO3
и постороннего аниона, которое обеспечивается тем, что указанные анионы вводят в электролит в составе ограниченно растворимых солей. Эти соли вводят в электролит в количествах, превышающих их растворимость. По этому имеющийся осадок на дне (избыток соли) всегда находится в равновесии с ионами, перешедшими в раствор.
В качестве солей-катализаторов, обеспечивающих присутствие в растворе посторонних анионов, используют SrSО4
, К2SiF6 и СаF6
. Растворимость этих солей линейно возрастает в температурном интервале 30—80 С
С. С увеличением концентрации СгО3
максимум растворимости солей отвечает концентрации 250—300 г/л.
Преимущества саморегулирующихся электролитов следующие: стабильность состава, так как концентрация постороннего аниона поддерживается автоматически; более высокая СП по сравнению со стандартным электролитом; практическая независимость ВТ от і'к
(выше 40 А/дм2
) и t(выше 50 С
С); широкий интервал изменения tи tк
, обеспечивающий получение блестящих осадков; более высокая РС по сравнению со стандартным электролитом.
Недостаток саморегулирующихся электролитов — их более высокая агрессивность. Аноды из РЬ—Sn сплава должны содержать 5—10 % 5п.
Перед пуском саморегулирующегося электролита в эксплуатацию следует его прогревать при рабочей / в течение 2—3 ч с одновременным перемешиванием раствора. Это необходимо для насыщения электролита посторонними анионами.
Наиболее широко применяется в практике электролит № 1 (сульфатно-кремнефторидный). Максимальная твердость покрытий, осаждаемых при 60 °С, получается при ік
= 55 А/дм2
, осаждаемых при 50 °С— при ік
= 45 А/дм2
.
Электролит рекомендуется для получения твердых износостойких покрытий при размерном хромировании.
Электролит имеет следующие характерные неполадки:
при снижении tниже 50 °С наблюдается появление шероховатости покрытия;
при уменьшении концентрации СгО3
ниже 200 г/л или при увеличении выше 350 г/л осадки становятся матовыми;
-при недостатке в электролите К2
SiF6
осадки получаются матовыми;
-при недостатке в электролите SrSО4
на поверхности покрытий появляются мелкие черные точки.
"Электролит № 3 (фториднокремне-фторидный) рекомендуется применять для скоростного хромирования.. Осадки хрома получаются слабо-голубого цвета. Электролит обеспечивает получение прочного сцепления покрытия с высоколегироваными и коррозионно-стойкими стялями и специальными сплавами. Состав саморегулирующегося электролита для защитно-декоративных покрытий следующий (г/л):
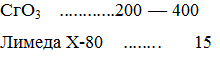
Режим осаждения: ік
= 2 -80 А/дм2
; t=20-60°С; ВТ = = 20 -23 %.
Рекомендуются также электролиты с добавками ДХТИ-10, ДХТИ-11 или ДХТИ-хром-11 в количестве 7—10 г/л.
Сверхсульфатный электролит.
Этот электролит имеет следующий состав (г/л):
СгОа
...........250—300
Н2
SO4
........... 8-10
Сг3
+ (в пересчете на Сг2
О3
) 20—22 Режим осаждения: t> 50-55 С
С; (ік
5=>50-60 А/дм"; ВТ =22-24% при оптимальных условиях электролиза.
Электролит рекомендуется для скоростного осаждения толстых блестящих хромовых покрытий (до 1 мм). Для получения в электролите требуемого количества Сг3+
после растворения СгО3
в электролит вводят Н2
О2
. При этом для получения концентрации Сг2
О3
20 г/л необходимо ввести 80—90 г/л Н2
О2
(30 %). Во избежание разбрызгивания и разогрева электролита Н2
О2
вводят небольшими порциями в разные участки поверхности электролита. На рис. 20 приведена зависимость концентрации Сг2
О3
от количества введенной в электролит Н2
О2
.
Для получения необходимой концентрации Сг2
О3
в электролит могут быть введены и некоторые органические соединения, например, сахар или глюкозу в количестве 4—5 г/л.
При износостойком хромировании в сверхсульфатном электролите возможно применять высокие плотности тока (до 300 А/дм2
). Рекомендуемые сочетания температуры и плотности приведены ниже:
t,C. ......... 50 55 60
і ,A/дм …… 50-80 50-90 50-200
Сверхсульфатный электролит имеет низкую РС. Его рекомендуют применять только для нанесения покрытий на цилиндрические детали (штоки валы, цилиндры и т. д.) при использовании специальных подвесных приспособлений, обеспечивающих конценричное расположение поверхностей детали и анода.
Рекомендуемый состав анодов следующий, %:
Рb..............79-80
Sb...... 4-6
Sn...... 10—15,
Стабильность поддержания заданной концентрации Сг3+
обеспечивается применением ік
> 100 А/дм2
и соотношением S : Sа
в пределах 10—20. Возможно ведение хромирования и при меньшем соотношении указанных поверхностей, но при этом необходима периодическая корректировка электролита Н2
О2
или специальной проработкой .
Содержание Сг2
О3
не должно становиться близким или большим 30 г/л и уменьшаться менее чем до 8 г/л.
Тетрахроматный электролит.Электролит предназначен исключительно для получения защитно-декоративных покрытий. Он обладает высокой рассеивающей способностью. Выход хрома по току составляет >30 %. Основное преимущество электролита — возможность ведения хромирования при комнатной температуре (18—25 °С). Осадки получаются серыми, однако, будучи весьма пластичными (микротвердость 300—500), они полируются до зеркального блеска, характерного для обычных хромовых покрытий. Наиболее легко полируются покрытия толщинойпо 10 мкм.
Хромовые покрытия, полученные из тетрахроматного электролита, практически безпористы. Они рекомендуются взамен трехслойных Сu—Ni—Сг защитно-декоративных покрытий. Толщина такого однослойного блестящего покрытия должна быть не менее 20 мкм. Покрытия, полученные из тетрахроматного электролита, обладают высокими защитными свойствами и сохраняют декоративность в морской атмосфере и в тропических условиях. Высокая рассеивающая способность тетрахроматного электролита способствует его успешному применению для покрытия пресс-форм, для изготовления детален из пластических масс.
Хромовые покрытия из тетрахроматного электролита толщиной 5—10 мкм могут быть применены для местной защиты поверхности стальных деталей при их газовой цементации или нитро-цементации.
Состав тетрахроматного электролита следующий (г/л):
СгО3
......,........................................350—400
ЫаОН ...............................................40—60
Нг
5О4
...........................................2,5 — 2,7
Сг8+
(в пересчете наСг2
О3
)…………… 10—15
В некоторых случаях рекомендуется в электролит добавлять 0,5—10 г/л вольфраматов или солей магния, которые улучшают полеруемость покрытий.
Рекомендуемая плотность тока должна быть в интервале 10—80 А/дм2
. Наиболее легко полируются на обычных войлочных кругах покрытия, полученные при 15—25 А/дм2
.
Электролиты для черного хромирования. Хромовые покрытия черного цвета обладают высокой защитной способностью и широко используются для нанесения защитно-декоративных и специальных слоев на различные детали машиностроительных и приборостроительных отраслей промышленности, медицинский инструмент, панели и т. д.
Черные хромовые покрытия практически не содержат в своем составе металлического хрома. Они представляют собой композицию, в которую входят оксиды и гидроксиды Сг2+
и Сг3+
а также гидрид хрома.
Одним из наиболее эффективных электролитов для черного хромирования является разработанный в СССР электролит Метахром, содержащий 450 г/л СгО3
и две специальные добавки: "А" в количестве 3 г/л и "Б" — 30 г/л. При приготовлении электролита добавка "А" предварительно растворяется при 60_70 °С в небольшом количестве воды. Электролит содержит также препарат Хромин в количестве 5 г/л. Метахром обладает наиболее высокой технологичностью и стабильностью по сравнению с другими известными электролитами. Оптимальная температура электролиза 20—30 °С, плотность тока 15 А/дм2
. Возможен перегрев электролита до 50—60 С
С. Плотность тока может варьироваться в интервале 5-100 А/дм-.
Покрытия, полученные из электролита Метахром, обладают низким коэффициентом отражения света: 2 % в видимой части спектра и <1 % — в инфракрасной.
1.5 АНОДЫ
При хромировании применяют нерастворимые анодов, так как использования для этой цели хрома невозможно по трем причинам. Главная из них- легкость анодного растворения хрома: анодный выход по току превышает катодный примерно в 8 раз. Другие причины – хрупкость металлического хрома и высокая стоимость изготовления массивных электродов.
Наиболее подходящий материал для изготовления анодов – свинец, на поверхности которого облегчен процесс окисления Сг3+
в Сг6
. Одновременно на поверхности анода идет разряд ионов ОН и выделение кислорода. В процессе электролиза на поверхности анодов образуется темно-коричневая пленка PbO2, которая обеспечивает более однородное состояние поверхности анодов и улучшает их работу.
Однако, помимо этого, на анодах, особенно при длительном их перебывании в электролите без тока, образуется желтый слой PbСrO4, оказывающий значительное сопротивление протеканию тока. Периодическое удаление этого слоя осуществляют крацеванием с предварительной обработкой анодов в растворе, содержащем 100г/л NaOH и 100г/л K2CO3. Щелочную обработку, разрыхляющую слой PbСrO4, ведут при температуре 70-80 С˚ и і(анодн.)=10-30 А/дм(кВ.). Вместо щелочной обработки возможно химическое травление в 5%-ом растворе HCl.
При длительном перерыве электролиза аноды должны быть извлечены из электролита и помещены в воду. Наиболее распространены аноды, изготовленный из сплава свинца с 6-8% Sb или 6-8% Sn. Такие аноды более химически стойки и прочны, чем аноды из чистого свинца. Рекомендуется так же применять аноды, содержащие одновременно Sb и Sn в кол-вах, указанных выше, а так же аноды, содержащие помимо Sb и Sn еще 2% Ag.
На рис. 1 представлены типы сборных анодов(а) и подвесок(б) для крепления анодов к штангам.

Рис.2. Типы сборных анодов, подвесок для анодов и анододержалелей.
1.6 НЕПОЛАДКИ ПРИ ХРОМИРОВАНИИ
Помимо специфических неполадок, возможных при осаждении хрома из саморегулирующихся и тетрахроматного электролитов при хромировании возможны другие дефекты, общие для большинства электролитов хромирования (табл. 27).
Удаление некачественных покрытий.
Удаление некачественных покрытий осуществляют химическим или электрохимическим способом.
Химический способ состоит в растворении покрытий в 5—20 %-ном растворе НС! при I= 20-70°С. Для удаления покрытия с меди, латуни, никеля этот метод наиболее часто применим. При удалении хрома со стали необходимо вводить в НСlингибиторы, так как возможно растравливание и наводороживание стали. Скорость растворения хрома в растворе НС1 в зависимости от ее концентрации и температуры колеблется в пределах 100—200 мкм/ч.
После удаления хрома со стальных деталей необходимо проводить обезводороживание в течение 2—2,5 ч при t= 200-250 °С.
Электрохимический способ более безопасен по сравнению с химическим. Он особенно эффективен при снятии толстых хромовых покрытий со стальных деталей. Раствор для снятия покрытий содержит 100—150 г/л NаОН или КОН. Обработку ведут на аноде, используя в качестве катодов стальные пластины. Температура t= 20-35 C, анодная плотность тока іа
= 5-20 А/дм2
. Опасно присутствие в растворе хлоридов, способных вызвать растравливание и потемнение стали.
При удалении хрома с никеля концентрация щелочи должна быть 40— 50 г/л, аt= 18-20 °С.
Для удаления покрытий с цинковых отливок рекомендуется раствор следующего состава (г/л):
Na2
S........... 30
NаОН............. 20
Режимработы: t= 20-25 °С; tа
= 2-З А/дм2
.
Снятие хрома со стальных деталей может быть осуществлено при іа
— = 15-20 А/дм2
в отработанном электролите хромирования.
Из литературного обзора, а также по опыту работы предприятия выбираем сульфатный электролит.
Состав электролита и режим работы:
СгО3
200 – 250 г/л. t – 50 ºC
H2
SO4
2,0 – 2,5 г/л. і – 25 А/дм(кв.)
Из литературного обзора, выбираем сульфатный электролит, состав которого следующий:
СгО3
_____150— 300 г/л,
H2
SO4 _______
2.25 – 2.5 г/л
І _________15 - 60 А/дм
t__________45 – 55 С°
2. Конструктивный расчет
2.1 РАСЧЕТ ОБЪЕМА ПРОДУКЦИИ ПРЕДНАЗНАЧЕННОЙ К РЕАЛИЗАЦИИ ИЛИ ПРОГРАММНАЯ ПРОГРАММА ЦЕХА
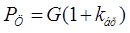
С учетом коэффициента брака  1%: 1%:
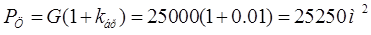
2.2 РАСЧЕТ ФОНДА ВРЕМЕНИ ДЛЯ ПРОИЗВОДСТВ СО СМЕННЫМ ГРАФИКОМ
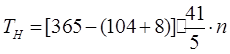
Где n – количество смен.
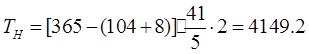
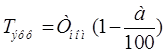
Где a – процент потерь рабочего времени (для автоматизированного оборудования и двусменного раб. дня а=8%)
n – число смен

Производительность рассчитаем по формуле:
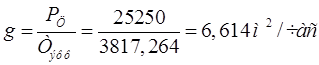
2.3 РАСЧЕТ ПРОИЗВОДИТЕЛЬНОСТИ В ТОКОВЫХ ЕДИНИЦАХ
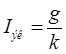 (А) (А)
Реакции на электродах:
К: 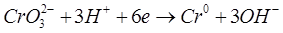
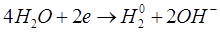

А: 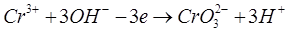
k = 52/6*26.8=0.3234 г/А*час
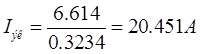
3. Технологический процесс хромирования
3.1 ОПРЕДЕЛЕНИЕ ВРЕМЕНИ ОБРАБОТКИ ПОВЕРХНОСТИ ДЕТАЛЕЙ
Определим время электрохимического осаждения хрома:
 мин. мин.
δ – толщина покрытия, мкм.
 - плотность хрома, г/см(куб.) - плотность хрома, г/см(куб.)
 - катодная плотность тока А/дм(кв.) - катодная плотность тока А/дм(кв.)
Вт – выход по току хрома
 - электрохимический эквивалент, г/Ачас - электрохимический эквивалент, г/Ачас
Загрузочные данные детали:
| Наименование деталей |
Металл |
Характеристика |
Габариты подвески |
Число деталей на подвеске/в агрегате |
Площ. На загр. м (кв.) |
Годов. Произв. |
| габариты, мм |
масса, кг |
S, дм
(кв.)
|
м(кв.) |
С браком м(кв.) |
ЗП в год |
| Кольцо упорное |
30ХГСА |
Ø = 82
L = 12
|
0.09 |
3,73 |
1250×800 |
20 |
0,746 |
25000 |
25250 |
Производственная программа:
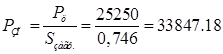 ЗП/год. ЗП/год.
Где 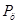 - производственная программа, м(кв.)/год. - производственная программа, м(кв.)/год.
 - загрузка на ванну, м (кв.) - загрузка на ванну, м (кв.)
3.2 КАРТА ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА ХРОМИРОВАНИЯ
| № |
Наименование операций |
Состав раствора |
Концент-рация, г/л |
Режим работы |
| Т,ºС |
I, А/дм(кв.) |
τ, мин |
1.
2.
3.
4.
5.
6.
7.
8.
9.
|
Загрузка – выгпузка
Электрохимическое обезжиривание на катоде и аноде.
Вода техническая проточная
Анодная активация (перед прогреть дет. В теч. 2-3 мин)
Хромирование
Промывка в холодной непроточной воде
Промывка в хол. Воде
Промывка в гор. Воде
Сушка детали
|
Натрий едкий
Хромовый ангадрид технич. ГОСТ 2548-77
H2
SO4
Хромов. Ангидрид
H2
SO4
Вода техн. непроточная
Вода техн. проточная
Вода техн. проточная
|
30 – 50
40-50
200-250
2-2,5
200-250
2-2,5
|
18-35
50
50
60-90
90
|
5,3
20-25
50
20-25
20-25
|
10
1
0,5-1
60
1-2
1-2
1
15
|
3.3 ВЫБОР ОБОРУДОВАНИЯ
3.3.1 Темп выхода подвесок рассчитываем по формуле
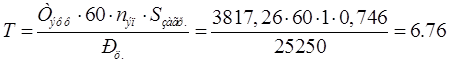
Где  - эффективный фонд рабочего времени. - эффективный фонд рабочего времени.
 - число подвесок в загрузке. - число подвесок в загрузке.
 - общая площадь деталей. - общая площадь деталей.
3.3.2 Количество ванн хромирования
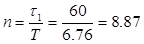
Где τ1 – длительность поцесса, мин.
Т – Темп выхода загрузочного приспособления, мин.
Принимаем n =9 (ванн хромирования).
Коэффициент загрузки ванн:
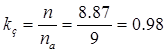
Где n, na – расчетное и принятое количество ванн.
В остальных процессах длительность каждой операции ниже Т, поэтому принимаем по одной ванне.
3.3.3 Рассчитаем кол-во операторов
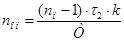
Где  = кол-во позиций в линии (18) = кол-во позиций в линии (18)
k = коэффициент учитывающий обратные и холостые ходы оператора (к=1,5-2,5)
τ2 – время обслуживания оператором одной ванны.
Передвижение подвески из одной ванны в другую включает: вертикальный подъем τв, время выстоя τвыст=5-6сек., горизонтальное перемещение τг, время остановки τост=2сек., Снова вертикальное перемещение τв, время остановки τост=2сек.:
τ2= τв+ τвыст+ τг+ τост+ τв+ τост
Для тельферных автооператоров
Wг – скорость гор. перемещения равно 17-18 м/мин.
Wв - скорость верт. перемещения равно 8 м/мин.
l – расстояние между ваннами равно 1,1 м.
H – высота подъема приспособления равно 2м.
τв = H/ Wв=2/8=0.25мин.
τг = l/ Wг=1,1/17=0,065мин.
τ2 = 0,25+6/60+0,065+2/60+0,25+2/60=0,73мин.
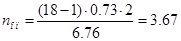
Принимаем 4 автооператора.
Общее время на обработку одной загрузки деталей:
τ=τ1+τ2=51,41+0,73=52,14мин.
Количество загрузочных приспособлений на линии:
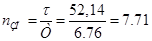
Принимаем 8 загрузочных приспособлений.
4. Конструктивный расчет
4.1 РАЗМЕР ВАННЫ
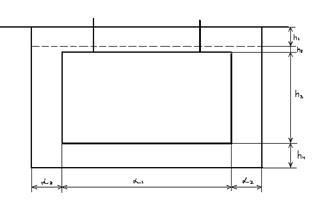 
Длина ванны:
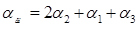
Где  - длина подвески, мм. (1250) - длина подвески, мм. (1250)
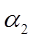 - расстояние между стенкой о подвеской, мм. (150) - расстояние между стенкой о подвеской, мм. (150)
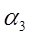 - расстояние между подвесками, мм. - расстояние между подвесками, мм.
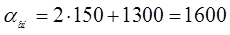 мм. мм.
Принимаем длину ванны 1600мм.
Ширина ванны (внутренняя)
Ввн = 2b1 +b2 =2*100+600=800мм.
Где b1 =100мм. – расстояние между осями анодных штанг до стенки.
b2 = 600мм. – расстояние между осями анодных штанг.
Высота ванны
Определим внутреннюю высоту ванны:
Нвн = h1+h2+h3+h4 =150+50+800+200=1200мм.
Где h1 – 150мм – расстояние от уровня Эл-та до верхнего края ванны.
h2 -20мм. – высота уровня эл-та над подвеской.
h3 – 800мм. – высота подвески.
h4 – 200мм. – расстояние от дна ванны до нижнего края подвески.
Принимаем высоту ванны 1250мм.
Толщина стенок зависит от материала ванны и изоляции. Ванны футерованы кислотостойким пластикатом толщиной 5 мм. Корпус ванны стальной толщиной Ст3, 5мм.
Согласно ГОСТу 23738-79 принимаем размер ванны для промывки и химической обработки 1600*800*1250 мм.
Определим объем эл-та в ваннах хромирования и обезжиривания.
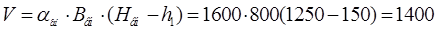 л. =1,4м(куб.) л. =1,4м(куб.)
4.2 РАСЧЕТ ГАБАРИТОВ ЛИНИИ
Определим длину линии
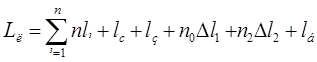 , ,
где n – число ванн одного типоразмера,
 - ширина ванн, мм. (800мм. – для токовых ванн, 630мм. – для бестоковых ванн), - ширина ванн, мм. (800мм. – для токовых ванн, 630мм. – для бестоковых ванн),
 - ширина сушильной камеры, мм. (630мм.) - ширина сушильной камеры, мм. (630мм.)
 - ширина загрузочно-разгрузочной стойки, мм. (600мм.), - ширина загрузочно-разгрузочной стойки, мм. (600мм.),
Δ - зазор между сушильной камерой и загрузочно-разгрузочной стойкой (1000мм.), - зазор между сушильной камерой и загрузочно-разгрузочной стойкой (1000мм.),
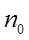 - кол-во ванн без бортовых отсосов, - кол-во ванн без бортовых отсосов,
Δ - зазор между стенками ванн без бортовых отсосов, - зазор между стенками ванн без бортовых отсосов,
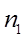 - кол-во односторонних бортовых отсосов, - кол-во односторонних бортовых отсосов,
Δ -зазор между стенками ванн с односторонним бортовым отсосом, мм. (290мм.) -зазор между стенками ванн с односторонним бортовым отсосом, мм. (290мм.)
 - кол-во двусторонних бортовых отсосов, - кол-во двусторонних бортовых отсосов,
Δ -зазор между стенками ванн с двусторонним бортовым отсосом (390мм.) -зазор между стенками ванн с двусторонним бортовым отсосом (390мм.)
 - ширина одностороннего бортового отсоса, мм. (212мм.) - ширина одностороннего бортового отсоса, мм. (212мм.)
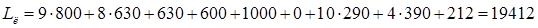
Определение ширины линии
Вл = 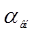 +В1+В2 +В1+В2
где 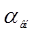 - внутр. длина ванны, мм. (1600мм.) - внутр. длина ванны, мм. (1600мм.)
В1 – Расстояние от внутр. части стенки ванны до наружной плоскости опорной стойки. Принимаем для подвесочных автооператоров 655мм.
В2 - Расстояние от внутр.стенки ванны до наружной плоскости площадки обслуживания, 1165мм.
Вл = 1600+655+1165=3420мм.
4.3 ВЫСОТА ЛИНИИ
Высота линии Н принимается в зависимости от внутренней высоты ванн и способа обработки изделий (линию обслуживает подвесной автооператор).
Для Н ванн – 1250 мм. И подвесного автооператора высота линии принимается 4700мм.
5. Материальный расчет
5.1 РАСХОД ХИМИКАТОВ ДЛЯ ПЕРВОНАЧАЛЬНОЙ ЗАГРУЗКИ ОБОРУДОВАНИЯ

Где с – концентрайия компонента в ванне г/л.
V – объем электролита, л.
В – количество одноименных ванн
N – количество линий
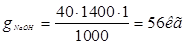
Ванна анодной активации.
С (CrO3)=250г/л.
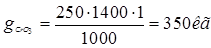
Ванна хромирования.
С (H2
SO4
) = 2,5г/л.
С (CrO3)=250г/л.

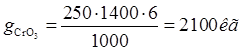
5.2 РАСХОД ХИМИКАТОВ НА ЗАМЕНУ РАСТВОРОВ В ВАННАХ ЗА ГОД
Ванна электрохимического обезжиривания – 1 раз в 2 месяца.(6раз в год)
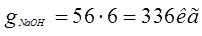
5.3 РАСХОД ХИМИКАТОВ НА ВЫПОЛНЕНИЕ ПРОГРАММЫ
Расход химикатов на выполнение программы складываются из расхода химикатов на замену растворов и потери компонентов электролитов за год
Ванна электрохимического обезжиривания. Норма расхода 0,48л/м(кв.)
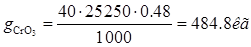
Ванна анодной активации. Норма расхода 0, 48л/м(кв.)
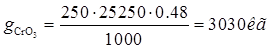
Ванна хромирования
Количество хромового ангидрида, расходуемого для выполнения годовой программы, рассчитывается по формуле:
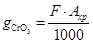
Где F – годовая программа, м(кв.)=25250
 -удельный расход хромового ангидрида -удельный расход хромового ангидрида
 = =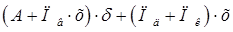
Где А – количество ангидрида, необходимого для покрытия 1 кв. метра поверхности толщиной 1 мкм. Масса хромового покрытия толщиной 1 мкм. На 1 кв. м. поверхности основы составляет 7г. этой массе хрома соответствует 14г. Ангидрида.
Пв – потери Эл-та в вентиляцию – 0,052 г/кв. м.
х – концентрация хромового ангидрида в Эл-те 250г/л.
δ – средняя толщина покрытия – 12 мкм.
Пд – потери эт-та, уносимого деталями 0,095л/кв. м.
Пк - потери эт-та, при коррекутировке – 0,035л/кв. м
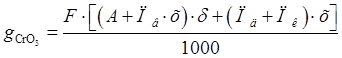
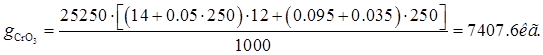
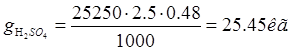
5.4 РАСХОД АНОДОВ
При хромировании применяют свинцовые нерастворимые аноды.
Расход анодов на первоначальный пуск оборудования.
Состав анодов для хромирования:
Свинец – 90%; сурьма- 8%; олово – 2%.
Массу анодов для ванны определяем по формуле
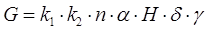
где k1 – отношение суммарной ширены анодов к длине ванны – 0,6
k2 – отношение высоты анодов в глубине ванны – 0,8
n – число анодных штанг - 2
α– длина ванны – 1,6м.
H – высота ванны – 1,25м.
δ- толщина анода – 0,01м.
γ– плотность свинца – 11250 кг/м(куб.)
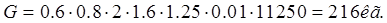
Кол-во анодов для участка
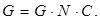
где G – необходимая масса анодов, для одной ванны, кг.
N – кол-во ванн в одной линии.
C – кол-во автоматических линий.
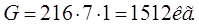
Аналогично рассчитывается расход анодов на первоначальный пуск для ванн электрохимического обезжиривания и активации
Ванна электрохимического обезжиривания:
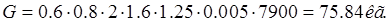
Ванна активации:
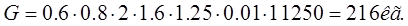
Определение кол-ва анодов в ванне хромирования, активации.

где n – кол-во анодных штанг (2) в ванне
0.6 – коэффициент, определяет отношение суммарной ширины анодов к длине анодной штанги
α – длина ванны – 1,6 м.
b – ширина одного анода – 0,25м.
l – длина анода 750мм.
р – непогруженная часть анода 50мм.
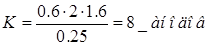
Площадь одного анода S =250*750=187500мм(кв.) = 18,75 дм(кв.). В ванне 8 анодов, тогта общ. S =18,75*8=150дм(кв.)=1,5м(кв.). При хромировании отношение Sa:Sk=2:1, у нас Sк.ср.= 0,87м(кв.), соотношение выдерживается, значит кол-во и размеры анодов рассчитаны правильно.
Кол-во анодов для выполнения программы.
Расход нерастворимых анодов на годовую программу рассчитывается по формуле:
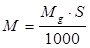
где Mg – норма идеального расхода нерастворимых анодов, г/ м(кв.) (для ТВ. Хромирования анод с составом: свинец – 90%, сурьма – 8%, олово – 2 %, Mg=1.6 г/м(кв.) при толщине 1 мкм. Для электрохим. Обезжиривания анод – сталь никелирования, Mg=1.15 г/м(кв.).
а) Хромирование
 кг кг
б) Анодная активація
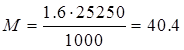 кг кг
в) Электрохимическое обезжиривание
 кг кг
Ведомость расхода анодов.
| Наимен операций |
Наимен. Материала анодов. |
Расход на 1 м(кв.) обрабат. Поверхности,г. |
Обрабатывемая поверхн. |
Расх. мат. на первонач. пуск, кг. |
Расх. мат. На программу, кг. |
Электро
хим. обезж.
|
Сталь никелированная |
1.15 |
25250 |
75.84 |
24.4 |
| Анодная активац. |
Сталь,
Pb-90%
Sb-8%
Sn-2%
|
1.6 |
25250 |
2.16 |
33.94 |
| Хромирование |
Pb-90%
Sb-8%
Sn-2%
|
1.6 |
25250 |
1512 |
407.2 |
5.5 РАСЧЕТ РАСХОДА ПАРА
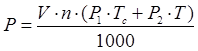
где V – объем раствора – 1,4м(кв.)
n – кол-во ванн данного типаразмера - 6
P1 – удельный расход пара на разогрев до данной температуры – 105кг/м(куб.)ч
Tc – кол-во рабочих суток в году - 253
P2 – удельный расход пара при работе ванны – 13,6кг/м(куб.)ч
T – эффективный часовой фонд времени работы оборудования – 3807 час.
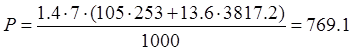 кг. кг.
Расход для ванн горячей прмывки:
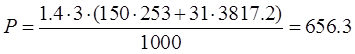 кг. кг.
Суммарный расход:
∑Р = 769,1+656,3=1425,4 кг.
5.6 РАСХОД ВОДЫ НА ПРОМЫВКУ
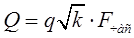
Где q – удельный вынос раствора из ванны поверхностью детали л/м(кв.) –0,2
k – критерий окончательной промывки даталей
Fчас – часовая производительность линии – 5,57м (кв.)/час.
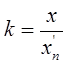
Где х – концентрация основного компонента г/л.
Хn – предельно допустимая концентрация в последней ванне промывки
Если перед промывкой электролит улавливают, то величину удельного выноса раствора уменьшают введением коэффициентов: 0,4 при одной ванне улевливания: 0,15 – при двух ваннах улавливания.
Промывка после ванны обезжиривания. Последовательная двуступенчатая каскадная промывка.
ХNaOH = 40г/л. Хn = 0.1г/л.
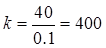
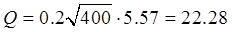
Промывка после ванны хромирования
CrO3 = 250г/л. Хn = 0.01г/л. Хcr = 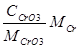 = = г/л. г/л.
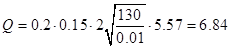
∑Q = (22.28+6.84)3817.2=111160.8 л/год=111,15м(куб.)/год
Расход воды на составление растворов, восполнение испарения, промывку оборудования принимается в размере 15-20% от расхода на промывные воды
Общий расход воды составляет:
Qобщ = 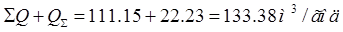
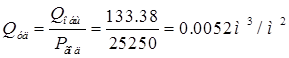
6. ЭНЕРГЕТИЧЕСКИЙ РАСЧЁТ
Электрический расчёт ЭХА сводится к составлению баланса напряжения для данного вида ЭХА. Для электрохимического аппарата, рассматриваемого в данной курсовой работе, баланс напряжения будет иметь вид[4]:
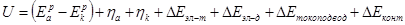 (4.1 ) (4.1 )
где U – напряжение между анодной и катодной штангами, В;
Ep
a
– Ep
k
– равновесные электродные потенциалы анодной и катодной реакции, соответственно, В;
ŋa
и ŋk
– абсолютные значения перенапряжения анодной и катодной реакции, соответственно, В;
ΔEэл-т
– падение напряжения в электролите, В;
ΔЕэл-д
– падение напряжения в электродах, В;
ΔЕтокоподвод
– падение напряжения в ошиновке ванны, анодных и катодных штангах, анодных крючках, В;
ΔЕконт
– падение напряжение в контактах, В.
6.1 РАСЧЁТ РАЗНОСТИ РАВНОВЕСНЫХ ПОТЕНЦИАЛОВ
Электролит электрохимического обезжиривания состава:
NaOH – 40г/л.
іа =ік =5,3 А/дм(кВ.) : t = 18-35 ºCаноды – никелированная сталь.
Катод: 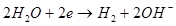
Анод: 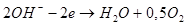
Суммарная: 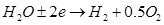
Рассчитаем потенциалы анода и катода по формуле:
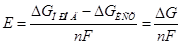
где ΔG – свобдная энергия Гиббса, Дж/моль;
Е – электродвижущая сила системы, В;
n – количество электронов, принимающих участие в реакции;
По справочнику находим величины энергии Гиббса всех участвующих в реакциях веществ:
ΔGH2
=0 кДж/моль;
ΔGH+
=0 кДж/моль;
ΔGO2
=0 кДж/моль;
ΔGH2O
=-237,23 кДж/моль.
ΔGОН
=-157,35 кДж/моль.
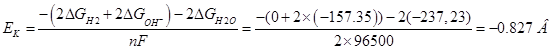 , ,
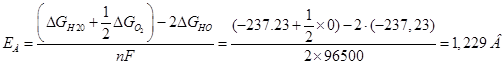
При изменении температуры (от 25 о
С до 100 о
С) можно пользоваться так называемым температурным коэффициентом стандартного электродного потенциала (напряжения разложения) dE/dT. Он показывает, на сколько вольт меняется потенциал при изменении температуры на один градус:
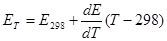
Величины температурного коэффициента стандартного электродного потенциала (напряжения разложения) приводятся в литературе или рассчитываются, как:
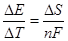
где ΔS – энтропия реакции, Дж/(моль·К); Е – электродвижущая сила системы, В; n – количество электронов, принимающих участие в реакции; F – число Фарадея.
Рассчитаем энтропию реакции:
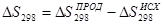
Из справочных данных[16] находим величины энтропии всех участвующих в реакциях веществ:

Отсюда:
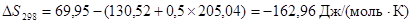
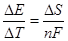 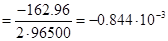
Если активность потенциалопределяющих компонентов в растворе отличается от 1, то потенциал анодной или катодной реакции можно рассчитать по уравнению Нернста:
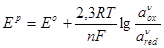
где аox
, аred
– активность окисленной и восстановленной форм вещества, а=Сγ, γ – коэффициент активности; С – концентрация вещества; ν – стехиометрический коэффициент.
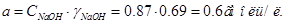
В большинстве случаев электролит в электрохимических производствах представляет собой смесь разных компонентов с различными концентрациями. При этом, на величину коэффициента активности потенциал-определяющих ионов оказывает влияние концентрация всех компонентов. Выражение для равновесного потенйиала катодной реакции при 30 град. Будет:
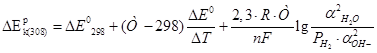
Активность воды определим по закону Рауля:
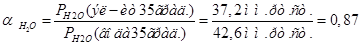
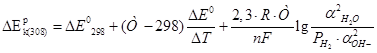

Запишем вырожение для  : :
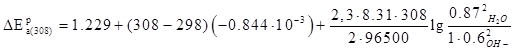

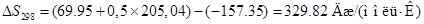
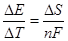 

Разность потенциалов:

6.2 РАСЧЁТ ПОЛЯРИЗАЦИОННОЙ СОСТАВЛЯЮЩЕЙ БАЛАНСА НАПРЯЖЕНИЯ
Расчёт катодной поляризации:
Расчёт поляризаций произведём согласно уравнению Тафеля:

Для щелочного электролита обезжиривания при t=20ºC константы соответственно ровны:
 ; ;

Если температура процесса отличается от 298К, то вводят температурную поправку.


где А~8.
104
Дж/моль - энергия активации[12];
α – коэффициент переноса электрона, примем равным 0,5.
Пересчёт этих величин на температуру процесса Т=308ºК:
На катоде:


Тогда 
Аналогично рассчитываем перенапряжение переноса выделения кислорода на аноде:
 ; ;
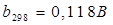


Тогда 
6.3 РАСЧЁТ ПАДЕНИЯ НАПРЯЖЕНИЯ В ЭЛЕКТРОЛИТЕ
Расчёт падения напряжения в электролите производится по формуле:

где I – ток ванны, А;
ρ и æ – удельное сопротивление и удельная электропроводность,
Ом-1
· см-1
и Ом · см, соответственно;
l – расстояние между электродами, см;
S – среднее сечение электролита, см² ;
iср
– средняя плотность тока в электролите, А/см²,
æ – (NaOH)=0.211 1/Ом*См|
За минимальное расстояние принимаем среднее между минимальным и максимальеным расстоянием от анода до детали, т. е.

Так как для электрохимического обезжиривания іа =ік =5,3 А/дм(кВ.), то і(ср.)=5,3А/дм(кВ.)

6.4 РАСЧЕТ ПАДЕНИЯ НАПРЯЖЕНИЯ В ЭЛЕКТРОДАХ
Падение напряжения в анодах складывается из падения напряжения в непогруженой в электролит части и погруженной части:

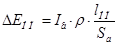 
I – ток ванны, А
ρ – удельное сопротивление материала анода при t=35 ºC Ом*м;
ln – длина погруженной части анода, (750мм.)
lнп – длина непогруженной части анода, (50мм.)
Sa – поперечное сечение всех анодов, м.

Удельное сопротивление анода:

Сечение анодов:

где δа – толщина анода, паринята по ГОСТ 1180-70, (0,01м.)
bа – ширина анода (0,25м.);
na – кол-во анодов в ванне (8шт.)
Тогда


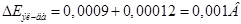
6.5 РАСЧЕТ ПАДЕНИЯ НАПРЯЖЕНИЯ НА КАТОДНЫХ ШТАНГАХ

где ρ – удельное сопротивление металла штанги, 
lшт – длина штанги – 1700мм. Кол-во штанг 2шт.
Sшт – поперечное сечение штанги

Материал штанги – медь
Падение напряжения в анодной штанге составит:

Падение напряжения в катодной штанге составит:

Оющее падение напряжения составит:
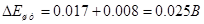
6.6 РАСЧЕТ ПАДЕНИЯ НАПРЯЖЕНИЯ В ПОДВЕСКЕ
Так как большая часть подвески заизолирована, то падение напряжения будет величиной незначительной, ее можно принять Е=0,001В.
6.7 РАСЧЕТ ПАДЕНИЯ НАПРЯЖЕНИЯ В КОНТАКТАХ
Определяют как сумму падений напряжения во все последовательно расположенных контактах на пути прохождения тока ванны от одной клеммы источника к другой. суммарное Еконт.=0,2В.
Общее напряжение на ванне химического обезжиривания составляет:

Баланс напряжения ванны электрохимического обезжиривания:
| № |
Составные баланса |
Величина составляющей, В |
Величина составляющей, % |
| Разница равновесных потенциалов, Ер |
0,843 |
10,57 |
| Поляризация анода, |
0,96 |
12,04 |
| Поляризация катода, |
0,644 |
8,076 |
| Падение напряжения в Эл-те, |
5,3 |
66,46 |
| Падение напряжения в штангах, |
0,001 |
0,012 |
| Падение напряжения в Эл-дах, |
0,025 |
0,313 |
| Падение напряжения в подвеске, |
0,001 |
0,012 |
| Падение напряжения в контактах, |
0,2 |
2,5 |
| Напряжение |
7,974 |
100 |
7. Тепловой расчет ванн хромирования
Техническая характеристика ванны.
| № |
Наименование характеристики |
Еденица измерения. |
Величина |
1
2
3
4
5
6
7
8
9
10
11
12
|
Токовая нагрузка
Напряжение
Время выдержки
Темп выхода подвесок
Состав электролита:
CrO3
H2SO4
Рабочая температура
Рабочий объем
Размер ванны:
длина
ширина
высота
Толщина стальной стенки
Масса подвески с деталями
Поверхность покрытия
Количество одноименных ванн
|
А
В
мин.
мин.
г/л
г/л
ºС
л
мм.
мм.
мм.
мм.
кг.
м(кв.)
|
484
7,974
51,41
6,76
150-200
2,25-2,5
50
1400
1600
800
1250
5
20
0,746
8
|
Определим условие теплового равновесия хромовой ванны и удельного расхода энергоносителя на 1 м(кв.)поверхности.
Составим уравнение теплового баланса за 1 час.

Где 
qкомп – теплота, необходимая для компенсации избытка или недостатка тепла, кДж/час;
qгр – теплота, выделенная в ванне в процессе электролиза, кДж/час.;
qnдетqудет – теплотавносимая м выносимая деталями из ванны при рабочей температуре, кДж/час.
qпр – теплота уносимая продуктами реакции, кДж/час.;
qпот – потери теплоты в окружающую среду, кДж/час.
Электрохимические процессы, протекающие в ванне:
1.  Вт=13% Вт=13%
2.  Вт=77% Вт=77%
3.  Вт=10% Вт=10%
Термодинамические данные участников реакции:
 кДж/моль кДж/моль |
 кДж/моль кДж/моль |
 ,кДж/моль ,кДж/моль |
| ΔНр298 |
-1491,9 |
-286,02 |
-236,1 |
Энтальпия реакции:



7.1 ТЕПЛОТА ВЫДЕЛЯЕТСЯ В ВАННЕ ЗА 1 ЧАС

где I – 484А токовая нагрузка на ванну;
Eb - 7,974В – напряжение на ванне;
Ku – коэффициент использования ванны;
ΔHr – энтальпия реакции, кДж.;
n – число электронов;
F – число Фарадея
Для автооператорных автоматов коэффициент использования ванны рассчитывается по формуле:

Где n – Число одноименных ванн (9);
T – Темп выхода 6,76мин.;
τ1 – время хромирования. 51,41мин.


7.2 ТЕПЛОТА РАСХОДУЕМАЯ НА НАГРЕВ ДЕТАЛЕЙ

Где С- теплоемкость стали – 0,46кДж/кг*град
G – масса подвески с деталями – 20кг.
Nзагр – число загрузок в час:

Где n – число ванн – 8;
T – 6,76 темп выхода

7.3. ТЕПЛОТА УНОСИМАЯ ПРОДУКТАМИ
а) Хромом


I=484 (токовая нагрузка на ванне)
Ссr – Удельная теплоемкость хрома


б) Водородом

Определим удельную теплоемкость водорода:



в) кислородом

Определим удельную теплоемкость кислорода:



Теплота, уносимая всеми продуктами (твердыми и газообразными):

7.4. ОПРЕДЕЛИМ ТЕПЛОВОЙ ПОТОК, УНОСИМЫЙ ПАРАМИ ВОДЫ
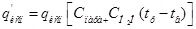
Где Спара – удельная теплота парообразования при рабочей температуре электролита tp=50ºC, Спара=2380кДж/кг
СH2O – средняя удельная теплоемкость воды 1,28кДж/кг.к
tp=50 ºC – рабочая температура;
tв – температура окружающей среды(20град.)
qисп – масса испарившейся воды в еденицу времени с поверхности зеркала электролита. Рассчитаем ее по уравнению Дальтона:

Где Св – коэффициент, зависящий от скорости движения воздуха(0,71)
Sзерк. – площадь зеркала электролита; здесь 1,6м. – длина ванны; 0,8 – ее ширина

Р – 101325Па – армосферное давление;
Р1 – давление насыщенного водяного пара про t-50
Р1=0,1258кгс/см(кв.)*9,81*10^4=12340Па
Р2 – парциальное давление водяного пара при температуре воздуха: Р2=φР’2
где P’2 – давление насыщенного водяного пара при температере воздуха:
P’2=0.0238 кгс/см(кв.)=0,0238*9,81*10^4=2335Па
φ – относительная влажность воздуха (0,8)
Р2=0,8*2335=1868Па
Тогда

Тепловой поток, уносимый парами воды:

7.5 УДЕЛЬНЫЕ ПОТЕРИ ЭЛЕКТРОЛИТА ЗЕРКАЛОМ ЭЛЕКТРОЛИТА ИЗЛУЧЕНИЕМ И КОНВЕКЦИЕЙ
 [2] [2]


7.5. ПОТЕРИ ТЕПЛОТЫ СТЕНКИ ВАННЫ
Потери теплоты стенки ванны путем излучения и конвекции находим, решая систему двух уравнений, приняв температуру внутренней стенки ванны:
 [2] [2]
Для определения температуры наружной стенки ст2, решим 2 уравнения: зависимость теплового потока через стенку при tст1=49град от tст2
 [2] [2]

Где δст и λст – толщина и удельная теплоемкость стали, соответственно, δфут и λфут – толщина и удельная теплоемкость футеровки,
δокал и λокал – толщина и удельная теплоемкость окалины на поверхности стенки
δст = 0,005м λст = 46,5Вт/м К
δфут = 0,0005м λфут = 1,16Вт/м К
δокал = 0,004м λокал – 0,16Вт/м К

При q1=q2 получим:


 ºС ºС
Тогда потери тепла стенками:

7.7 ТЕПЛОВОЙ ПОТОК ПОТЕРЬ ДНИЩЕМ ВАННЫ, ОБРАЩЕННЫМ К НИЗУ БУДЕТ

7.8 ОБЩИЕ ПОТЕРИ ТЕПЛОТЫ ВАННОЙ ЗА 1 ЧАС

Ванна имеет 2 не экранированные стенки:
Sнеэкр=2*1,25*0,8=2м(кв.)
И 2 экранированые:
Sэкр=2*1.6*1.25=4 м(кв.) Коэффициент экранирования Кэ=0,5
 кДж/час кДж/час
7.9 ТЕПЛОТА КОМПЕНСАЦИИ – ПО РАЗНОСТИ МЕЖДУ ПРИХОДОМ И РАСХОДОМ

Ежечасно необходимо отводить 208085,84кДж тепла (избыточного),чтобы поддерживать температуру ванны на заданном уровне. Если же не отводить, то электролит нагреется на:

Где Ср-ра – теплоемкость раствора (3,9кДж/кгК)
m эл-та – масса электролита (кг.)
m крп – масса корпуса (кг.)
Сст - теплоемкость стали (0,46 кДЖ/кгК)
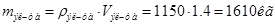

ρ эл-та – плотность эл-та (1150кг/м(куб.))
 чего допускать нельзя! чего допускать нельзя!
7.10 РАСХОД ВОДЫ С НАЧАЛЬНОЙ ТЕМПЕРАТУРОЙ 20ºС И КОНЕЧНОЙ 30 ºС
 [2] [2]
7.11 РАСЧЕТ ЗМЕЕВИКА ДЛЯ ОТВОДА ИЗБЫТОЧНОГО ТЕПЛА
Введем обозначения:
20ºС – температура воды на входе;
30ºС – температура воды на выходе;
gв – массовый поток воды (4978,13кг/час)
W – линейная скорость, м/ч
Змеевик – свинцовая трубка, наружный диаметр 60мм. δ ст=5мм.
Теплопроводность свинца λ=34,9 Вт/мК;
Плотность воды при tср=(30+20)*0,5=997кг/м(куб.)
Коэффициент вязкости воды при 25 град.
μ (25)=902*10^-6Па*с
μ (50)=549*10^-6Па*с
Коэффициент теплопроводности воды
λ =60,0*10^-2 Вт/мК
Критерий Прандтля при 25ºС
Pr = 6.22
Рассчитаем ряд параметров для определения критерия Рейнольдса и коэффициента теплопередачи.
Внутренний диаметр трубы:
dвн=dн-2*δст=60-2*5=50мм.
Площадь поперечного сечения трубы:

Объемная скорость воды в трубе:

Линейная скорость воды в трубе:

Находим критерий Рейнольдса:

Коэффициент теплопередачи для горизонтального расположения трубы:

Рассчитываем коэффициент теплопередачи от электролита к воде по формуле:

Определим поверхность теплопередачи:


Определим длину змеевика для охлаждения:
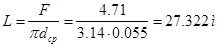
Где dср – (dн+dвн)*0.5=(0.06+0.05)*0.5=0.055м
7.12 РАСЧЕТ ЗМЕЕВИКА ДЛЯ ПРЕДВАРИТЕЛЬНОГО НАГРЕВА

Qнагр – кол-во теплоты, необходимой для нагрева, кДж:
k – коэффициент теплопередачи от пара к раствору,
τ – время разогрева в сек.
Δtср – средняя разность температур пара и раствора, к.

 ,большая разность емператур пара и р-ра ,большая разность емператур пара и р-ра
 ,меньшая разность температур ,меньшая разность температур
Расчет коэффициента теплопередачи от пара к рнаствору через стальную стенку трубой Толиной 5мм. при учете слоев ржавчины со стороны пара и рас-ра толщиной 0,2мм.
 ; ;
Где α1 - коэффициент теплопередачи при конденсации пара в трубках:
α=12000
δ – толщина слоя ржавчины, 0,2мм.
λрж – удельная теплопроводность ржавчины, принимаем 1,16 Вт/м(кв.)К
δст – 5мм.
α 2 – коэффициент теплоотдачи от стенки к раствору, определим по формуле:

l – определяющий размер, диаметр трубы0,05м.;

Где С – теплоемкость раствора 4,19кДж/кгК
λр – удельная теплоемкость раствора, принимаем 0,58
μ – вязкость рас-ра 0,8*10^-3Па

g – 9.81? м/с(кв.);
d – диаметр трубы, принимаем 50мм=0,05м;
β – коэффициент объемного разширения, 0,63*10^-3
 - кинематическая вязкость, м(кв.)/с - кинематическая вязкость, м(кв.)/с


50 – рабочая температура раствора
20 – начальная температура раствора

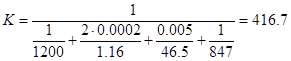
Расход тепла на разогрев электролита(от 20 до 50):

где Сэл-та – теплоемкость Эл-та;
mэл-та – масса Эл-та;
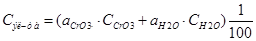
a(CrO3)=12% C(CrO3)=0.762 кДж/кгК
a(H2O)=88% C(H2O)=4.18 кДж/кгК


Vраб – 1.4м(куб.) ρэл-та – 1150кг/м(куб.)
Расход тепла на нагревание Эл-та:

Расход тепла на нагревание корпуса ванны:

Сст – удельная теплоемкость стали 0,46
mкорп = 335кг.
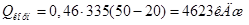
Определим расход теплоты на нагрев:

Определим поверхность нагрева:
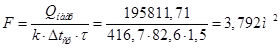
τ – время разогрева 1,5часа
Длина змеевика для нагрева:
 м м
Змеевик размещается по дну ванны.
8. Очистка сточных вод
Гальванотехника – одно из производств, серьезно влияющих на загрязнение окружающей среды, в частности ионами тяжелых металлов, наиболее опасных для биосферы. Главным поставщиком токсикантов в гальванике (в то же время и основным потребителем воды и главным источником сточных вод) являются промывные воды. Объем сточных вод очень велик из-за несовершенного способа промывки деталей, который требует большого расхода воды (до 2 м3 и более на 1 м2 поверхности деталей).
На очистных сооружениях наиболее распространенным методом обезвреживания гальваностоков является реагентный метод, в частности, осаждение металлов гидроксидом кальция, не обеспечивающий доведение содержания ионов тяжелых металлов в стоках до современных ПДК. Основным недостатком этого метода является большое количество шламов, содержащих токсичные соединения тяжелых металлов. Утилизация и переработка образующихся шламов – очень сложное и дорогостоящее производство, а в некоторых случаях шламы не поддаются переработке. В таких случаях возврат химреактивов и металлов в цикл производства практически исключен. Основным методом обезвреживания таких отходов является захоронение их на специальных площадках, если таковые предусматриваются. Однако чаще всего эти шламы либо складируются на территории предприятия, либо неконтролируемо сбрасываются в овраги, водоемы, леса, а в лучшем случае на городские свалки. Лишь часть гальваношламов находит применение в строительстве при производстве строительных материалов.
8.1 АНАЛИТИЧЕСКИЙ ОБЗОР МЕТОДОВ ОЧИСТКИ ХРОМСОДЕРЖАЩИХ СТОЧНЫХ ВОД ГАЛЬВАНОПРОИЗВОДСТВА
Известно большое количество методов извлечения цветных металлов из сточных вод гальванопроизводства. Наиболее используемые методы подразделяются на:
-реагентные,
-биохимические,
-электрохимические,
-мембранные,
-сорбционные,
-комбинированные.
РЕАГЕНТНЫЙ МЕТОД
Наиболее распространенный метод, заключающийся в переводе растворимых веществ в нерастворимые при добавлении различных реагентов с последующим отделением их в виде осадков.
В качестве реагентов используют гидроксиды кальция и
натрия, сульфиды натрия, феррохромовый шлак, сульфат железа(II), пирит [2, 6 - 9]. Наиболее широко для осаждения металлов используется гидроксид кальция, который осаждает ионы металла в виде гидроксидов:
Me n+ + nOH - = Me(OH)n
Наиболее эффективным для извлечения цветных металлов является сульфид натрия, т.к. растворимость сульфидов тяжелых металлов значительно ниже растворимости других труднорастворимых соединений - гидроксидов и карбонатов. Процесс извлечения металлов сульфидом натрия выглядит так:
Me 2+ +S 2- =MeS ;
Me 3+ +S 2- =Me2S3 .
Сульфиды тяжелых металлов образуют устойчивые коллоидные системы, и поэтому для ускорения процесса их осаждения вводят коагулянты и флокулянты.Так как коллоидные частицы сульфидов имеют отрицательный заряд, то в качестве коагулянтов используют электролиты с многозарядными катионами - обычно сульфаты алюминия или трехвалентного железа, также их смеси. Соли железа имеют ряд преимуществ перед солями алюминия:
а) лучшее действие при низких температурах;
б) более широкая область оптимальных значений рН среды;
в) большая прочность и гидравлическая крупность хлопьев;
г) возможность использовать для вод с более широким диапазоном солевого состава.
При использовании смесей Al2(SO4)3 и FeCI3 в соотношениях от 1:1 до 1:2 достигается лучший результат коагулирования, чем при раздельном применении реагентов. Кроме вышеназванных коагулянтов, могут быть использованы различные глины, алюминийсодержащие отходы производства, травильные растворы, пасты, смеси и шлаки, содержащие диоксид кремния. Для ускорения процесса коагуляции используют флокулянты, в основном полиакриламид. Добавка его в количестве 0.01% от массы сухого вещества увеличивает скорость выпадения осадков гидроксидов металлов в 2 - 3 раза [6]. Метод реализован на большинстве предприятий в виде станций нейтрализации. Достоинства метода:
1) Широкий интервал начальных концентраций ИТМ.
2) Универсальность.
3) Простота эксплуатации.
4) Отсутствует необходимость в разделении промывных вод и концентратов.
Недостатки метода
1) Не обеспечивается ПДК для рыбохозяйственных водоемов.
2) Громоздкость оборудования.
3) Значительный расход реагентов.
4) Дополнительное загрязнение сточных вод.
5) Невозможность возврата в оборотный цикл очищенной воды из-за повышенного солесодержания.
6) Затрудненность извлечения из шлама тяжелых металлов для утилизации.
7) Потребность в значительных площадях для шламоотвалов.
Процесс осаждения металлов включает следующие стадии:
1) добавление фосфорной кислоты или ее кислой соли к водному раствору из расчета моль фосфата на моль тяжелого металла;
2) понижение рН до 3 добавлением серной кислоты;
3) добавление коагулянта FeCl3 в концентрации 0.75-1.5 г/л;
4) увеличение рН раствора до 8.5 добавлением гидроксида кальция и получение осадка, включающего скоагулированные фосфаты металлов;
5) обезвоживание осадка.
БИОХИМИЧЕСКИЙ МЕТОД
В последнее время у нас в стране и за рубежом увеличились масштабы проводимых исследований по разработке технологии выделения тяжелых цветных металлов из сточных вод гальванопроизводств биохимическим методом сульфатовосстанавливающими бактериями (СВБ). Однако достигнутое при этом снижение концентраций ионов тяжелых металлов, в частности таких, как хром, составило только 100 мг/л, что нельзя признать оптимальным, исходя из реальных концентраций ионов шестивалентного хрома (200 - 300 мг/л). В мировой практике было исследовано влияние высоких концентраций ионов тяжелых металлов на эффективность их извлечения биохимическим методом. Так, скорость изменения концентрации шестивалентного хрома определяли в стеклянных реакторах, строго выдерживая анаэробные условия протекания процесса. Для развития сульфатвосстанавливающих бактерий в реакторы вводили питательную среду Постгейта. Кроме того, отдельные серии опытов проводили на пилотной установке непрерывного действия, состоящей из биотенка проточного типа и отстойника. В Уфимском нефтяном институте разработан комплексный метод биохимического извлечения хрома. Сущность его заключается в использовании специализированных бактериальных культур, отличающихся высокой стойкостью к отравляющему действию хрома. Хромсодержащие сточные воды подают в соответствующие емкости-накопители, затем - в биотенк, где смешиваются с бактериальными культурами. Из биотенка очищенные воды отводятся в отстойник, после чего направляются в фильтры для доочистки. Очищенная вода поступает на повторное использование. Хромсодержащие осадки, образующиеся в биотенках, отстойниках и фильтрах, подаются в шламонакопитель, обезвоживаются на вакуум-фильтрах и используются в качестве добавок при производстве строительных материалов. Достоинствами этого метода являются высокая эффективность и простота технологического оформления процесса.
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ
В настоящее время электрохимические методы выделения тяжелых цветных металлов из сточных вод гальванопроизводства находят все более широкое применение. К ним относятся процессы анодного окисления и катодного восстановления, электрокоагуляции, электрофлокуляции и электродиализа. Все эти процессы протекают на электродах при пропускании через раствор постоянного электрического тока.
Проведенные исследования по очистке сточных вод гальванического производства в условиях электрохимической неравновесности установили, что восстановительные процессы в сточых водах протекают при взаимодействии сольватированных электронов с гидратированными и связанными в комплексные соединения ионами металлов. Показано, что содержание Zn,Cu,Cd,Mo,Co в сточных водах после обработки в условиях электрохимической неравномерности не превышает, а в ряде случаев значительно ниже ПДК.
7.1.3.1. Метод электрокоагуляции
7.1.3.2. Метод электрофлотации
7.1.3.3 Метод электролиза
7.1.3.4. Метод гальванокоагуляции
МЕМБРАННЫЕ МЕТОДЫ
Методы мембранного разделения, используемые в технологии выделения цветных металлов из сточных вод гальванопроизводства, условно делятся на микрофильтрацию, ультрафильтрацию, обратный осмос, испарение через мембраны, диализ, электродиализ. Наибольшие успехи в отношении эффективности и технологичности выделения цветных металлов достигнуты при использовании обратного осмоса, ультрафильтрации и электродиализа.
Достоинства метода
7.1.4.1. Метод обратного осмоса
1) Возможность очистки до требований ПДК.
2) Возврат очищенной воды до 60% в оборотный цикл.
3) Возможность утилизации ценных компонентов.
4) Отсутствие фазовых переходов при отделении примесей,
что позволяет вести процесс при небольшом расходе энергии.
5) Возможность проведения при комнатных температурах без
применения или с небольшими добавками химических реагентов.
6) Простота конструкций аппаратуры.
Недостатки метода
1) Необходимость предварительной очистки стоков от масел, ПАВ, органики, растворителей, солей жесткости, взвешенных веществ.
2) Значительный расход электроэнергии.
3) Дефицитность и дороговизна мембран.
4) Сложность эксплуатации.
5) Отсутствие селективности.
6) Чувствительность к изменению параметров очищаемых вод
СОРБЦИОННЫЕ МЕТОДЫ
Сорбционные методы являются наиболее распространенными для выделения хрома из сточных вод гальванопроизводства. Их можно условно поделить на три разновидности:
1) сорбция на активированном угле (адсорбционный обмен);
2) сорбция на ионитах (ионный обмен);
3) комбинированный метод..
КОМБИНИРОВАННЫЕ МЕТОДЫ
Наиболее распространенным из всех разновидностей сорбционного метода является комбинированный метод, который заключается в использовании и угля, и ионитов одновременно для извлечения хрома. Суть его такова: сточные воды подаются на гравийно-угольный фильтр, затем последовательно на сильнокислый катионит, слабоосновной анионит и далее - сильноосновной анионообменник. После прохождения всего комплекса выделения хрома через ионообменные колонны, вода имеет высокую степень чистоты и может использоваться повторно. Извлеченный хром может быть направлен на утилизацию в кожевенную промышленность для дубления кож.
Для выделения тяжелых металлов, в том числе и хрома, из сточных вод гальванопроизводства учеными было предложено использовать хелатообразующий реагент с дитиоаминогруппами. Последний получают путем смешения одинаковых количеств органических диаминосоединений и CS2 при пониженной температуре в течение нескольких часов с последующей нейтрализацией щелочным раствором и удалением непрореагировавшего CS2. Образующийся после интенсивного перемешивания в течении 20 - 120 минут осадок хелата хрома удаляют седиментацией или фильтрацией.
Литература
1. Гальванические покрытия в машиностроении. Том 1 под редакцией д-ра техн. наук проф. М.А. Шлугера и канд. техн. наук Л.Д.Тока
2. Гальванические покрытия в машиностроении. Том 2 под редакцией д-ра техн. наук проф. М.А. Шлугера и канд. техн. наук Л.Д.Тока.
3. М.А.Дасоян Техника электрохимических покрытий. Машиностроение, 1989.
4. Б.Н.Байрачный Справочник гальваника – Харьков Прапор, 1988.
5. А.М.Ямпольский, В.А.Ильин. Краткий справочник гальваника 3-е изд. Машиностроение 1981.
|