ИССЛЕДОВАНИЕ ВЛИЯНИЯ ТРИС- (2-КАРБАМОИЛЭТИЛ) АМИНА НА ИНИЦИИРОВАНИЕ ПОЛИМЕРИЗАЦИИ АКРИЛАМИДА
При полимеризации акриламида в щелочных растворах в результате реакции между акриламидом и аммиаком, образующимся при гидролизе амидных групп, происходит образование трис-(2-карбамоилэтил) амина (ТКА) [1], который дает с персульфатами, используемыми в качестве инициаторов полимеризации акриламида, окислительно-восстановительную систему [2], вследствие чего резко меняются кинетика инициирования и, следовательно, параметры всего процесса и свойства полимера. Кроме того, система персульфат — ТКА представляет самостоятельный интерес для инициирования полимеризации в водной среде (ввиду доступности ТКА) [3] и как модель для изучения реакции между третичными аминами и перекисями. В связи с этим представляют интерес установление влияния ТКА на гомолитический распад персульфата в различных условиях и природа веществ, образующихся в рассматриваемой редокс-системе, а также особенности полимеризации акриламида в водных растворах, инициируемой персульфатом калия и специально добавленным ТКА.
Для опытов использовали ТКА с т. пл. 185° (из смеси пропанола-2 и воды), синтезированный из акриламида и аммиака согласно [4]. Персульфат калия (ч.) (ГОСТ 4146-65), КОН (ч.) (ГОСТ 4203-65) и бисульфат калия (ч.) (ГОСТ 4223-65) дополнительной очистке не подвергали. Акриламид трижды перекристаллизовывали из бензола. Во всех опытах применяли бидистиллированную воду.
Концентрацию персульфата калия определяли полярографически по ранее описанной методике [2]. Содержание свободного ТКА в водных растворах контролировали путем потенциометрического титрования ОД н. раствором НС1, используя рН-метр рН-340. О ходе полимеризации судили по убыли в растворе концентрации акриламида, определяемой бромид-броматным методом. Характеристическую вязкость полимеров определяли в 10%-ном водном растворе NaCl при 20±0,05°, используя вискозиметр ВПЖ-2 с диаметром капилляра 0,56 мм.
При установлении природы продуктов взаимодействия персульфата калия и ТКА смешивали по 25 мл водных растворов исходных веществ (0,434 и 0,868 моль/л соответственно) и выдерживали смесь в течение 1 ч при 20°. Далее раствор концентрировали в вакууме при 40-50° до уменьшения объема смеси в ~3 раза по сравнению с первоначальным. Выделившиеся кристаллы (2,98 г) перекристаллизовывали из воды и анализировали на содержание азота (по Кьельдалю) и сульфат-ионов (весовым методом). В маточном растворе бромид-броматным методом определяли содержание непредельных соединений, и с помощью реакции с сернокислым гидроксил-амином и последующего титрования выделившейся серной кислоты определяли концентрацию карбонильных соединений. Качественно присутствие в реакционной смеси карбонильных соединений обнаруживали с помощью реакции с 2,4-динитро-фенилгидразином.
Для исследования кинетики взаимодействия в системе персульфат — ТКА навески исходных веществ растворяли в отдельных порциях воды (20°), после чего сливали их и по ходу реакции отбирали пробы для анализов. Полимеризацию акриламида проводили по методике, описанной в работе [5].
Исходи из данных по предельной степени превращения персульфата калия (ПСК) под действием различных количеств ТКА было показано, что в отсутствие каких-либо добавок ПСК реагирует с ТКА в соотношении 1:2. Однако из кинетических кривых (рис. 1), полученных при разных соотношениях реагентов, видно, что в начальный период ПСК и ТКА расходуются в эквимольном соотношении, а дополнительное количество ТКА вступает в реакцию лишь после того, как значительная часть ПСК уже прореагировала. На основании этих данных можно заключить, что
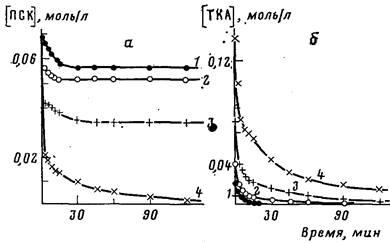
Рис. 1. Кинетические кривые расхода ПСК (а) и ТКА (б) при мольном соотношении реагентов: 1 — 1:0,36; 2-1:0,5; 3-1:1; 4-1:2. [ПСК]=0,069 моль/л, вода, 20°
ТКА приобретает неактивную форму по накоплении в системе продуктов реакции ПСК с ТКА. При изучении солеобразного продукта, выпавшего в осадок после концентрирования реакционной смеси, выявлено отсутствие в нем калия и наличие сульфат-ионов и азота, содержание которых близко к содержанию их в соли ТКА и серной кислоты. Выделенное вещество, так же как и полученный встречным синтезом из ТКА и серной кислоты сульфат ТКА, плавится с разложением при 192—193°. Кроме того, при обработке полученного сульфата едким кали ТКА был выделен в виде свободного основания. Выход соли при взаимодействии ТКА и ПСК в соотношении 2 : 1 в расчете на исходный ТКА составил 49,4%, т. е. половина ТКА превращается в ходе реакции в соль.
Образование сульфата ТКА в реакции ПСК и ТКА сопровождается появлением в маточном растворе соединений, содержащих двойные углерод-углеродные связи и карбонильные группы. Так, в растворе, полученном в результате взаимодействия ПСК и ТКА при начальных концентрациях 0,092 и 0,184 моль/л, обнаружено 0,045 г-экв/л непредельных соединений и 0,046 г-экв/л соединений, содержащих карбонильные группы. Таким образом, на основании приведенных данных и с учетом схемы окисления третичных аминов перекисями, предложенной в работе [6], взаимодействие ТКА с ПСК


происходит через промежуточное образование катион-радикала R3
NT
и радикала KOS02
0 , которые при отсутствии акцепторов радикалов реагируют с образованием енамина, вторичного амина и альдегида, а также бисульфата калия. Последний нейтрализует третичный амин и переводит его в неактивную по отношению к ПСК форму. Очевидно, что и продукты реакции (енамин и вторичный амин) подобно ТКА реагируют с бисульфатом калия и находятся в реакционной смеси в виде солей.
Подтверждением того, что протонированный ТКА не вступает в окислительно-восстановительную реакцию с ПСК, явился опыт с добавкой к смеси указанных веществ бисульфата калия в количестве, достаточном для нейтрализации ТКА, при этом содержание ПСК в смеси не менялось (рис. 2). Напротив, при проведении реакции в щелочной среде (с добавкой эквимольного по отношению к ПСК количества КОН) ход кинетической кривой убыли ПСК (рис. 2) показывает, что до глубоких степеней превращения ПСК взаимодействует с ТКА в соотношении 1 : 1 вследствие нейтрализации бисульфата калия более сильным, чем
ТКА, основанием. В буферном растворе с рН 6,85, где, так же как и в щелочном растворе, нивелируется действие бисульфата калия, реагенты вступают в реакцию в практически эквимольных количествах (рис. 2).
Из приведенных данных вытекает, что система ПСК — ТКА может быть использована для инициирования полимеризации лишь в нейтральных и щелочных средах. Изменяя рН среды, можно регулировать скорость распада ПСК под действием ТКА и, следовательно, скорость полимеризации и среднюю молекулярную массу полимера.
В случае распада ПСК под действием ТКА в системе, содержащей по-лимеризующееся соединение (акриламид), радикал KOSO2
реагирует не только с катион-радикалом R3
N*, отрывая от него атом водорода, но и с молекулой мономера, вызывая его полимеризацию


Обрыв цепи в этой системе, очевидно, основан не только на диспро-порционировании и рекомбинации макрорадикалов, но протекает и в результате взаимодействия макрорадикалов с катион-радикалом R3
N* например, по схеме

Катион R2
N=CHCH2
CONH2
по описанной выше схеме (1) превращается далее в енамин, вторичный амин и альдегид. Образование карбонильного соединения при полимеризации акриламида в присутствии системы ПСК — ТКА подтверждено нами экспериментально.
Увеличение скорости распада персульфатного инициатора под действием ТКА, естественно, приводит к ускорению полимеризации и уменьшению характеристической вязкости [т]] полимера (уменьшение [г]частично обусловлено также и тем, что ТКА является агентом передачи цепи при радикальной полимеризации [1]). Так, при 50° и содержании в воде 4 вес.% акриламида и 0,1 вес.% ПСК в течение 2,5 ч получен полимер с [
Ti]=7,6 дл/г и выходом 96%; при одновременном присутствии 0,035 вес.% ТКА за то же время практически получено 100% полиакриламида с [т]] = =3,7 дл/г. Однако использование системы ПСК — ТКА позволяет понизить температуру синтеза и получить высокомолекулярный полиакриламид с приемлемой скоростью: при 20° под действием одного только ПСК полимеризация акриламида не идет, тогда как при той же температуре в результате полимеризации в водном растворе, содержащем 7 вес.% акриламида, 0,04 вес.% ПСК и 0,035 вес.% ТКА, в течение 2 ч получен полимер с [Л] = = 11,0 дл/г при выходе 96%.
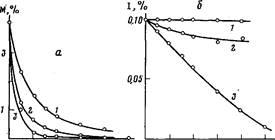
Рис. 3. Кинетические кривые расхода акриламида (а) и персульфата калия (б) в ходе полимеризации без добавок (1), в присутствии 0,035% ТКА (2) и 0,55% аммиака (3). Вода, 50°
ТКА легко образуется insitu при проведении полимеризации акриламида в водно-аммиачных и щелочных растворах, на что указывают данные, приведенные на рис. 3. Видно, что скорости полимеризации и разложения инициатора в значительной степени увеличиваются при введении в систему аммиака. Обращает на себя внимание, что скорость разложения ПСК в течение полимеризации с добавкой аммиака сохраняет практически постоянное значение, несмотря на быстрое понижение концентрации ПСК. Этот эффект может быть объяснен ростом в полимеризационном растворе содержания соединений, способных эффективно восстанавливать ПСК, т. е. ТКА и сопутствующих ему первичного и вторичного аминов; [п] полимера уменьшается от 7,6 дл/г в опыте без аммиака до 1,95 дл/г в его присутствии.
При использовании в процессе полимеризации гидроокиси натрия скорости расхода мономера и инициатора также увеличиваются по сравнению с полимеризацией в нейтральном растворе, причем кинетические кривые изменения концентраций в течение процесса носят S-образный характер. В начальный период полимеризации, когда в системе еще нет аммиака, а значит и аминов, разложение инициатора протекает с небольшой скоростью. По мере накопления аммиака, образующегося при гидролизе амидных групп, в растворе появляются амины, приводящие к увеличению скорости инициирования, что находит отражение в уменьшении [п] полимеров.
ЛИТЕРАТУРА
1.
Громов В. Ф., Шейнкер А. П., Хомиковский Н. М., Абкин А. Д. Высокомолек. соед. А, 1974, т. 16, № 2, с. 365.
2.
Зильберман Е. Н., Абрамова Л. И., Афонъшин Г. Н., Бражкина С. Н. Высокомолек. соед. Б, 1980, т. 22, № 10, с. 774.
|