МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
СЕМИПАЛАТИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ ШАКАРИМА
АГРОЭКОЛОГИЧЕСКИЙ ИНСТИТУТ
КАФЕДРА ХИМИИ И ЭКСПЕРТИЗЫ
Исследование каталитических свойств полимерных комплексов
Выпускная работа студента IV курса
группы Е-412 Говенко П.В.
Научный руководитель
Калияскарова Б.А.
Допущено к защите: « » 2008г
Зав. кафедрой химии к.х.н., доцент
Яшкарова М.Г
СЕМИПАЛАТИНСК-2008
РЕФЕРАТ
Дипломная работа содержит: страниц, рисунок, таблиц, приложений, список литературы включает наименований.
Тема: «Исследование каталитических свойств полимерных комплексов»
Объектом исследования является полимер ПВПД (поливинилпирролидон), являющийся полиоснованием.
Цель работы: получение новых металлполимерных комплексов, исследование их свойств и изучение возможности их практического применения в катализе.
Работа выполнена на кафедре химии и экспертизы Семипалатинского
Государственного университета имени Шакарима. В работе были использованы методы потенциометрического титрования и вискозиметрии.
1. Методами рН-метрического титрования и вискозиметрии обнаружено и доказано комплексообразование в системе поливинилпирролидон-Cd2+
и Co2+
. Обнаружено, что поливинилпирролидон не образует комплексы с железом (II) в данных условиях.
2. Изучено влияние температуры на стабильность образовавшихся комплексов. Было выяснено, что повышение температуры ведет к повышению приведенной вязкости, что свидетельствует о деструкционных процессах полимер-металлических комплексов.
3. Изучено влияние состава растворителя на стабильность металлполимерных комплексов. Обнаружено, что комплекс ПВПД- Cd2+
почти не изменяет приведенной вязкости с увеличением объемных процентов спирта этилового С2
Н5
ОН, что указывает на его прочность к действию органических растворителей. С другой стороны, комплекс ПВПД-Со2+
сохраняет свои характеристики только в водной среде.
4. Изучена каталазная активность полимер-металлических комплексов, и выяснено, что растворы данных комплексов обладают малой каталазной активностью. Обнаружено, что наилучшим соотношением [металл]: [лиганд] является соотношение 1:1 и 1:4.
Содержание
Введение
Перечень сокращений, символов, обозначений
1. Теоретическая часть
1.1. Полимерметаллические комплексы
1.2 Особенности полимер-металлических комплексов
1.3Применение полимер-металлических комплексов
1.4 Комплексы полимеров с простыми веществами и другими низкомолекулярными соединениями
1.5Классификация и виды полиэлектролитов
1.6Интерполиэлектролитные комплексы
1.7 Лекарственные препараты на полимерной основе
1.8 Образование ИПЭК
1.9 Агломерация комплексообразующих молекул в растворах ИПЭК
1.10 Катализ водорастворимыми комплексами полимер — метал
2. Методическая часть
2.1 Получение и очистка исходных веществ
2.2 Методика проведенных экспериментов
3. Практическая часть
3.1 Результаты и обсуждения
Выводы
Список использованных источников литературы
Приложение
Введение
В последнее время наиболее интенсивно развиваются области исследований на стыке различных направлений, например, катализ полимерами, возникший благодаря взаимодействию таких разделов химии, как химия высокомолекулярных соединений, координационная химия, каталитическая химия. С помощью синтетических макромолекул можно конструировать полимерные катализаторы, работающие по принципу ферментов, которые приближаются к ним по активности и избирательности действия. В свою очередь, это позволило бы с большой эффективностью получать промышленно важные продукты в малых реакционных объемах и без существенных энергетических затрат. Также использование таких катализаторов могло бы привести к отказу от использования многих дорогостоящих катализаторов, таких, как платина, палладий и других. В решении важных проблем химической и нефтехимической отраслей промышленности большую роль могут сыграть каталитически активные металлокомплексы. В связи с этим резко возрастает актуальность данного направления вследствие резко возрастающего интереса к таким доступным источникам органического сырья, как нефть, природный газ. Однако применение катализаторов данного типа совершенно не ограничивается только данной областью применения. Синтез новых катализаторов типа металл : полимерный лиганд, лиганд : металл: лиганд, в сочетании с синтезом каталитически активных металлокомплексов, нанесенных на полимерные носители, открывает также огромную область их применения, начиная от простых реакций обмена в неорганической химии, и заканчивая сложнейшими превращениями веществ в биохимии. Данная работа и посвящена синтезу таких металлполимерных комплексов, а также исследованию их каталитических свойств.
Цель работы:
1) получение металлполимерных комплексов состава ПВПД: Cо2+
, ПВПД: Fe2+
, ПВПД: Cd2+
.
2) исследование устойчивости и возможности существования металлполимерных комплексов состава ПВПД: Cо2+
, ПВПД: Fe2+
, ПВПД: Cd2+
.
3) изучение влияния различных факторов (Т°, состав растворителя) на поведение комплексов ПВПД: Cо2+
, ПВПД: Cd2+
.
4) исследование каталитических свойств полученных металлполимерных комплексов.
Научная новизна темы:
Научная новизна данной работы в том, что до этого не проводилось исследований по получению данных металлполимерных комплексов, а также, соответственно, не проводилось изучение их каталитических свойств в растворах.
Достоверность полученных данных:
В работе использовались химически чистые реактивы, для некоторых была применена дополнительная очистка. Растворитель очищался бидистилляцией, и использовалась чистая и высушенная химическая посуда. Используемые методы (потенциометрическое титрование, вискозиметрия) очень чувствительны и точны к образованию металлполимерных комплексов, что доказано предыдущими исследованиями. Используемые приборы были предварительно настроены или градуированы (аналитические весы, иономер).
Практическая значимость:
Синтезированные металлполимерные комплексы могут быть использованы для дальнейших исследований их свойств применительно к конкретным реакциям.
Перечень сокращений, символов, обозначений
БАВ - биологически активное вещество
БПЭ – блокирующий полиэлектролит
ГЛБ - гидрофильно-липофильный баланс
ИПЭК - интерполиэлектролитные комплексы
ИЭТ - изоэлектрическая точка
ЛВ – лекарственное вещество
ЛПЭ – лиофилизирующий полиэлектролит
ПАК – полиакриловая кислота
ПВПД - поли-N-винилпиролролидон
ПВПС - поливиниловый спирт
ПМАК – полиметилакриловая кислота
ПЭГ – полиэтиленгликоль
П4ВП - поли-4-винилпиридин
ТИПЭК - тройные интерполиэлектролитные комплексы
ЯМР – ядерный магнитный резонанс
1. Теоретическая часть
1.1 Полимерметаллические комплексы
Полимерметаллические комплексы образуются в результате взаимодействия между функциональными группами макромолекул и ионами переходным металлов (Cu2+
, Cd2+
, Zn2+
, Ni2+
, Co2+
, Mg2+
, Fe2+
и др.). Обычно связь между ионом металла и полимерным лигандом осуществляется посредством донорно-акцепторного взаимодействия с образованием координационной связи (хелатные комплексы) или замещением протона лиганда ионом металла с образованием ионной связи. Ионы металлов являются акцепторами; атомы O-, -N, -S, -F, -Cl полимерной цепи, предоставляющие пару электронов для образования связи, являются донорами. В низкомолекулярных комплексных соединениях обычно координационное число металла равно 4 или 6. В случае макромолекулярных лигандов могут образовываться координационные центры состава 1:1, 1:2, 1:3 или 1:4. Свободные вакансии координационной сферы ионов переходных металлов занимают молекулы растворителя или других низкомолекулярных веществ. Изменение конформации полимерного лиганда в процессе комплексообразования может значительно влиять на результаты расчетов координационного числа иона металла и константы устойчивости комплексов. Так, до сих пор остается открытым вопрос: имеет место ступенчатое образование комплекса полимер – металл или сразу образуется полимер-металлический комплекс с максимальным координационным числом?
1.2 Особенности полимер-металлических комплексов
Характерной особенностью комплексов полимер – металл в отличие от комплексов низкомолекулярный лиганд – металл является близость всех последовательных констант комплексообразования. Это связано с высокой локальной плотностью активных центров взаимодействия в полимерных цепях, т.е. «полимерный эффект» может играть значительную роль в образовании комплексов полимер – ион металла.
Комплексы полимер – ион металла в воде имеют компактную структуру, стабилизированную внутри- и межцепными координационными «сшивками», которые существенно изменяют размер клубка полилиганда. При добавлении к раствору поли-4-винилпиридина (П4ВП) в метаноле вязкость уменьшается, т.е. происходит сворачивание цепей П4ВП вследствие внутрицепного хелатирования. Сжатие макромолекул различно для разных ионов металла, т.е. структура полимер-металлического комплекса зависит от типа иона металла.
На устойчивость комплексов полимер – ион металла в растворе сильное влияние оказывают такие факторы как конформация и микроструктура полимерных лигандов, природа металлов, степень ионизации, природа противоионов (анионов) металлов, рН среды, ионная сила раствора, природа растворителя, температура, т.е. все те факторы, которые определяют конформационное состояние макромолекул в растворе и их гидродинамические характеристики. Многочисленные исследования систем полимер – металл посвящены установлению влияния этих факторов на свойства и структуру образующихся полимер-металлических комплексов.
Исследована радикальная полимеризация 1-винилазолов (1-винил-имидазол, 1-винилбенз-имидазол, 1-винилбензтриазол) в присутствии солей переходных металлов MgCl2
, NiCl2
, ZnCl2
. Обнаружена спонтанная полимеризация в присутствии ионов Mg2+
, и Zn2+
, в то время как координация макрорадикалов с ионами Ni2+
тормозит реакцию полимеризации.[6]
Исследовано взаимодействие полиакриловой кислоты и сополимера акриловая кислота – малеиновая кислота состава 3:2 соответственно, с различными солями (NaCl, MgCl2
, CaCl2
, SrCl2
, ZnCl2
, Al(NO3
)3
, Fe(NO3
)3
). Обнаружено, что сополимер, как и полимер, взаимодействует со всеми солями. ИК-спектроскопически подтверждена стабилизация заряда полианиона противоионами в результате образования пендатных связей.
Обнаружено, что некоторые типы синтетических полиамфолитов способны связывать ионы металлов при определенных значениях рН и высвобождать их в изоэлектрической точке (ИЭТ).[25,26] Такое поведение полиамфолитов, возможно связано с тем, что в ИЭТ электростатическое притяжение между противоположно заряженными зарядами звеньев полиамфолита является более сильным, чем взаимодействие полимер – металл, что ведет к высвобождению связанных ионов металлов из макромолекулярного клубка.
Возможно образование тройных полимер-металлических комплексов, например, полиэтилен-имин-Cu2+
-полиакриловая кислота или поли-4-винилпиридин-Ni2+
(Co2+
)-полиакриловая кислота. Координационные и ионные связи могут участвовать в стабилизации таких комплексов. ЭПР-спектроскопически показано возможность существования нескольких типов структур тройных полимер-металлических комплексов с различным количеством функциональных групп поликислот и полиоснования в координационной сфере иона металла. Это зависит как от их относительной способности к связыванию с ионами металла, так и от координационных способностей полимер-металлических систем.
1.3 Применение полимер-металлических комплексов
Путем стехиометрических превращений в звеньях полимерной цепи возможна настройка «первичной» структуры макромолекулы на взаимодействие с определенным ионом металла. Так, комплекс линейный полимер – ион металла сшивается сшивающим агентом, и затем металл удаляется действием минеральной кислоты. Полученный сорбент обладает высокой специфичностью и селективностью. Повышенный интерес к полимерметаллическим комплексам, с одной стороны, обусловлен тем, что некоторые ионы металлов (железо, медь кобальт, и др.) играют особо важную роль в живых организмах – участвуют в ферментативных реакциях (металлоэнзимы), мышечных сокращениях, явлениях переноса (например, гемоглобин), мембранных процессах (натрий-каливый насос) и т.д. Другая необходимость изучения комплексов полимер-металл связана с практическими задачами – извлечением редких и благородных металлов из промышленных сточных вод, созданием высокоэффективных гомогенных и гетерогенных полимерных катализаторов, термо- и механостойких полимерных материалов, полупроводников, мембран и т.д. Возрастает роль комплексных соединений полимеров в медицине. Всестороннее исследование процессов комплексообразования с целью определения состава, структуры и констант устойчивости комплексов, кинетики и механизма их формирования, анализ влияния микроструктуры, конформационного состояния макромолекул и хелатного эффекта, в конечном счете, может привести к установлению основных закономерностей комплексообразования и физико-химического поведения координационных соединений в растворах. Помимо органических полимеров должны быть рассмотрены и неорганические макромолекулы, которые обеспечивают лучшую теоретическую и химическую стойкость образующихся полимер-металлических комплексов. Должны быть также рассмотрены надмолекулярные структуры полимер-металлических комплексов, обеспечивающие некоторые свойства материалов на их основе. Взаимодействия макромолекула – ион металла (комплекс, хелат) контролируют не только высокоорганизованную структуру полимер-металлических комплексов, но и их свойства. Полагают возможным обнаружение полимер-металличесими комплексами следующих свойств и соответствующее их применение:
· Извлечение и концентрирование ионов металлов посредством образования комплексов полимер-металл;
· Терапевтические эффекты – лекарства, протолекарства;
· Селективность – газовый транспорт / разделение, сенсоры;
· Ионная проводимость – электрон-улавливающие устройства, батареи;
· Системы переменой валентности – мультиэлектронный переход, катализ, фотокатализ;
· Электронные взаимодействия в твердом состоянии – проводимость, электрокатализ, электрохимия;
· Фотовзаимодействия в твердом состоянии – фотопроводимость, фотогальваника, лазерография, люминесценция, оптическое хранение / переключение;
· Нелинейная оптика – модуляторы, интегрированная оптика;
· Керамика – квантовые устройства.
Наиболее широко взаимодействия полимер – ион металла используются для извлечения и концентрирования ионов металлов.[6]
1.4 Комплексы полимеров с простыми веществами и другими низкомолекулярными соединениями
Молекулярные комплексы полимеров являются продуктами нековалентных взаимодействий, в основном, между неионными полимерами и различными низкомолекулярными соединениями. Это комплексы полиэтиленгликоля (ПЭГ) с резорцином, поли-N-винилпиролролидона (ПВПД) с фенолами; соединения включения полиэтиленгликоля с мочевиной, тиомочевинной, пергидротрифениленом, солями ртути; поливиниловый спирт (ПВПС) – йод и бораты; комплексы гетероатом (O, S, N, P)-содержащих полимеров с ионами щелочных и щелочноземельных металлов.
Интересный и практически важный тип комплексов – это соединения, образующиеся при взаимодействии полиэтиленгликоля с тиоцианатами, иодидами щелочных металлов. Эти комплексы изучены различными методами: ЯМР, кондуктометрии и др. Структура этих комплексов представляется в виде цилиндров (спирали, включающие ионы металла), скрепляемых анионами. Однако роли анионов уделяется недостаточное внимание.
Значительный интерес представляют молекулярные комплексы образующиеся между гетероатомом (O-, N-, S-, P-) содержащими полимерами и ионами щелочных и щелочноземельных металлов. Эти системы весьма перспективны из-за возможности их использования в качестве твердых электролитов для аккумуляторов и батарей и в регистрирующих системах.
Методами электропроводности, вискозиметрии, ЯМР-, ИК- и КР-спектроскопии, рентгеновской дифрактометрии изучено комплексообразование полимерных эфиров и поливинилпиридинов с солями щелочных и щелочно-земельных металлов. Показано большое влияние на процесс комплексообразования как природы макромолекул и их длины, так и строения катиона, аниона, природы среды, предыстории приготовления образца. Установлен, что процесс комплексообразования может идти двумя путями: 1) ион-дипольным взаимодействием неподеленной пары электронов гетероатома полимерной цепи с катионами металлов; 2) образованием водородной связи между концевыми гидроксильными группами полиэфира и анионами соли. В зависимости от условий преобладает тот или иной механизм взаимодействия.
1.5 Классификация и виды полиэлектролитов
Полиэлектролитами называют полимерные соединения, сочетающие в себе определенное количество функциональных групп. В зависимости от характера функциональных групп полиэлектролиты делятся на поликислоты, полиоснования, полиамфолиты и полибетаины.
Поликислотами называют полимерные соединения, сочетающие в себе кислотные группы (например, - СООН). Полиоснованиями называют полимерные соединения, сочетающие в себе основные группы (например, - ОН, - NH2
). Полиамфолитами называют полимерные соединения, сочетающие в себе кислотные и основные группы (например, - ОН и - СООН). Полибетаинами называют полимерные соединения, сочетающие в себе кислотные и основные группы, находящиеся попарно друг около друга и способные образовывать циклические ряды, т.е. подобные органическим аминокислотам (например, - NH2
и - СООН группы, находящиеся попарно друг около друга в звеньях полимерной цепи).
Полиэлектролиты представляют собой большой практический и научный интерес и является одним из немногих классов органических соединений, не существующих в природе, т.е. получить их можно только соответствующими реакциями полимеризации.
В настоящее время применяются как сшитые, так и линейные полимеры, каждые из которых имеют определенные области применения.
Слабосшитые полиэлектролиты, имеющие одну связку на 30 – 70 звеньев полимерной цепи способны поглощать в себя сто, а то и больше тысячи раз от веса растворителя, что значительно превышает способности природных аналогов, таких как мхи и лишайники (в 5 -30 раз больше от своего веса поглощения воды).
При поглощении растворителя слабосшитый полиэлектролит набухает, расстояние между звеньями цепи увеличивается, вместе с тем уменьшается прочность образовавшегося геля. Тем самым исследователи поставили перед собой задачу: найти компромисс между степенью набухания геля, т.е. поглощающей способностью, и его механической прочностью.
Существует несколько способов повышения механической прочности геля, но в настоящее время наиболее часто используют способ внедрения линейного полимера в сетку сшитого. Данный способ подобен образованию органических катенанов и ротоксанов. Внедрение в сетку линейного полимера происходит случайным образом и на сегодняшний момент развития науки и техники не существуют методов управляемого синтеза полимера с заданной структурой, и поэтому в одних и тех же условиях могут получаться полимеры, имеющие различие в некоторых свойствах.
В таких случаях прибегают к упрощению, идеализации объекта, называемого статическим полимером, и вычисляют для него среднее значение кислотности (кислотных групп) или основности (основных групп), а также при вычислении других параметров, т.е. говорят об исследовании образцов.
1.6 Интерполиэлектролитные комплексы
Широкое применение разнообразных химических фармакологических препаратов в сочетании с ухудшением экологической обстановки окружающей среды привело к резкому увеличению чувствительности человека к лекарствам (аллергические заболевания стали настоящим бичом современности), а также к «привыканию» к ним организмов, что снижает эффективность химиотерапии. Все больше ученым приходится задумываться не только над поиском новых лекарств, но и над созданием более совершенных форм уже известных биологически активных препаратов и задачей доставки этих препаратов в организм, регулирования скорости их действия и времени пребывания в организме. Такие лекарственные препараты получили название «препараты направленного и пролонгированного действия». Синтетические и природные полимеры с этой точки зрения представляют уникальную возможность для создания новых лекарственных форм. Наиболее перспективными при создании эффективных лекарственных препаратов являются природные полимеры – хитозан, целлюлоза, коллаген, альгинаты и другие. Широкое применение природных полимеров обусловлено их биосовместимостью, способностью к биодеградации, низкой токсичностью. При использовании природных полимеров, благодаря их собственной физиологической активности, может быть реализован синергический эффект – усиление активности лекарственной основы. Развитие химии полимеров за последние десятилетия привело к тому, что высокомолекулярные соединения с успехом используются в медицине как конструкционные материалы: искусственные органы и ткани, покрытия. В фармацевтической практике полимеры нашли применение в технологии приготовления лекарств в качестве вспомогательных веществ – пролонгаторов, эмульгаторов при получении покрытий для таблеток, основ для мазей.
1.7 Лекарственные препараты на полимерной основе
Интерес к лекарственным препаратам на полимерной основе обусловлен также возможностью разработки новых транспортных форм доставки биологически активного вещества (БАВ) и создания биоактивных систем с контролируемой подачей физиологически активных веществ в организм. Полимерные терапевтические системы позволяют дозировать поступление лекарственного вещества (ЛВ), пролонгировать его действие, предохраняя лекарственное вещество от преждевременного разрушения, а также в значительной степени избегать побочного эффекта.
При разработке полимерных лекарственных препаратов используют насыщение полимерного материала ЛВ на основе сорбционных процессов; ковалентное связывание БАВ с полимерной основой; использование комплекса полимера с лекарственной основой высокомолекулярной природы (двойной комплекс); применение интерполиэлектролитных комплексов с низкомолекулярным посредником – ЛВ (тройной комплекс).
Одной из важнейших проблем, определяющих эффективность лечебного действия полимерных материалов, является пролонгирование скорости перехода ЛВ. Регулирование кинетики выделения БАВ может быть достигнуто при использовании интерполиэлектролитных комплексов (ИПЭК). Пролонгированное высвобождение лекарственной основы в отсутствии ковалентной связи из ИПЭК происходит за счет диффузии низкомолекулярного БАВ в окружающую среду из набухшей полимерной системы и определяется природой используемых полимеров, их молекулярной массой, эффективностью взаимодействия полимеров друг с другом и ЛВ, а также природой окружающей среды.
ИПЭК представляют особый класс полимерных веществ, образующихся в результате соединения противоположно заряженных полиэлектролитов (между парами сильных, парами слабых полиэлектролитов, смешанными парами). Они образуются в результате обратимых кооперативных реакций соединения противоположно заряженных ионов и представляют собой интерполиэлектролитные соли. Кооперативный характер связей между полиионами придает ИПЭК очень высокую стабильность в широком интервале рН среды. Анионо - и катионогенные макромолекулы электростатически комплементарны друг другу, поэтому взаимодействие между ними в термодинамическом аспекте вполне аналогично взаимодействию между комплементарными биополимерами, ответственному за самосборку большинства биологических структур.
1.8 Образование ИПЭК
Простейший способ получения ИПЭК – смешение водных растворов, один из которых содержит полианионный, а другой – поликатионный компонент. Образование ИПЭК происходит в результате очень быстрой обратимой реакции ионного обмена. Процесс заканчивается практически мгновенно даже при очень больших разбавлениях. Реакция между макромолекулами не имеет аналогий в химии низкомолекулярных соединений. Стабильность полимерного продукта определяется энтропийным фактором. Если один из взаимодействующих полиэлектролитов – слабая кислота или слабое основание, то степень завершения реакции можно легко контролировать путем изменения рН среды, т.е. методом потенциометрического титрования.
Нерастворимые ИПЭК выделяются из раствора в виде сравнительно мало сольватированных осадков. Соотношение между противоположно заряженными группами в них составляет 1:1. Нерастворимые ИПЭК нерастворимы ни в одном из известных растворителей. Они способны ограниченно набухать в воде и по свойствам напоминают сшитые гидрогели. Нерастворимые ИПЭК могут служить в качестве уникальных по эффективности связующих для почв и грунтов с целью предотвращения их ветровой и водной эрозии и уже нашли применение при ликвидации последствий аварии на Чернобыльской АЭС. Нерастворимые ИПЭК были использованы в качестве коагулянтов шлаковых отходов металлургических производств, перспективны в качестве биосовместимых покрытий для гемосорбентов и других изделий медицинского назначения, контактирующих с кровью и биологическими жидкостями.
Водорастворимые ИПЭК могут быть получены из большинства пар противоположно заряженных полиэлектролитов, но при соблюдении определенных условий. Необходимые и достаточные условия образования растворимых ИПЭК не связаны прямым образом с химической природой полиэлектролитных комплексов. Если степень полимеризации полиэлектролита, введенного в избытке, превышает или, по крайней мере, не ниже степени полимеризации недостаточного компонента, образуются растворимые продукты. При смешении бессолевых разбавленных водных растворов полиэлектролитов образование растворимых ИПЭК возможно в растворах, содержащих некоторое количество низкомолекулярного электролита.
Растворимые ИПЭК являются продуктами незавершенной реакции. При этом свободные звенья исходных полиэлектролитов, не вступившие в межцепные солевые взаимодействия, выполняют функцию гидрофильных фрагментов, способствуя удерживанию частиц ИПЭК в растворе. Установление факта существования растворимых ИПЭК открыло перед исследователями новый спектр перспективных областей применения, характерных именно для семейства растворимых ИПЭК и касающихся, в первую очередь, биомиметики, биотехнологии и медицины.
Важным этапом исследования ИПЭК было определение их строения. Поскольку растворимые ИПЭК в водных растворах представляют собой индивидуальные устойчивые частицы, для их изучения в водных растворах были использованы такие методы исследования растворов полимеров, как светорассеивание, турбидиметрия, вискозиметрия, гель-хроматография, ультрацентрифугирование и другие. На основании изучения нерастворимых ИПЭК в твердой фазе принято, что в них обе взаимодействующие полимерные цепи располагаются параллельно друг другу и образуют двухтяжные лестничные структуры. Такие структуры представляют собой совокупность кооперативно взаимодействующих противоположно заряженных звеньев цепи, характеризуются повышенной жесткостью и высокой гидрофобностью и приводят к выделению их из раствора. Растворимые ИПЭК представляют собой блок-сополимеры, в которых сочетаются достаточно протяженные гидрофобные и гидрофильные фрагменты.
1.9 Агломерация комплексообразующих молекул в растворах ИПЭК
Явление агломерации комплексообразующих молекул в растворе ИПЭК аналогично процессам мицелообразования. Степень агломеризации мало чувствительна к изменению молекулярных масс ЛПЭ, но определяется соотношением количества звеньев ЛПЭ, включенных в гидрофильные и гидрофобные блоки. Процессы агломеризации и распада агломератов ИПЭК можно контролировать путем изменения состава полимерного комплекса. Существенное влияние на эти процессы оказывает степень ионизации звеньев ЛПЭ, включенных в однотяжные гидрофильные блоки. Если ЛПЭ – слабый полиэлектролит, то уменьшение степени ионизации приводит к прогрессирующей агломеризации частиц растворимого ИПЭК вплоть до их выделения из раствора. Именно поэтому ИПЭК, в которых в роли ЛПЭ выступает поликарбоновая кислота, растворимы в щелочной среде. Если ЛПЭ – полиоснование, поликомплекс приобретает способность растворяться лишь в кислой среде. Степень агломеризации зависит и от степени связывания противоионов со свободными участками ЛПЭ. Помимо состояния окружающей среды способность к агломеризации определяется химическим строение ЛПЭ и БПЭ. Распад агломератов ИПЭК наблюдают при введении свободных ЛПЭ. Фазовое разделение в водных растворах ИПЭК наблюдают также при введении в раствор низкомолекулярного электролита. Низкомолекулярные соли, являющиеся конкурентами в реакции между полиэлектролитами, приводят к разрушению межмолекулярных солевых связей, что сопровождается перегруппировкой участков ЛПЭ и БПЭ в частицах растворимых ИПЭК и образованием очень компактных частиц, имеющих состав, близкий к стехиометрическому. Именно из таких частиц образуются нерастворимые ИПЭК в водно-солевых растворах. Тогда в растворе остаются практически свободные цепи ЛПЭ. Причиной такого фазового разделения является диспропорционирование частиц растворимого ИПЭК, протекающего по механизму полиионного обмена в гомогенных растворах под действием низкомолекулярного электролита.
Таким образом, образование и изменение состава ИПЭК в растворах, обусловленное обратимостью интерполимерной реакции , носит сложный характер и определятся многими факторами, к которым следует отнести природу полиэлектролитов, их молекулярную массу, ММР, ионную силу раствора. Изучение строения ИПЭК требует широкого использования всего известного арсенала методов исследования полимеров.
Создание физиологически активных полимерных препаратов на основе ИПЭК возможно, во-первых, при использовании биологически активных полиэлектролитов, во-вторых, иммобилизацией в ИПЭК низкомолекулярного ЛВ, получившие название трехкомпонентные ИПЭК с низкомолекулярным посредником (ТИПЭК). В качестве физиологически активных полиэлектролитов были использованы биополимеры, такие, как белки, нуклеиновые кислоты, гепарин, ферменты и другие. Отличительными чертами таких лекарственных препаратов являются повышенная термическая стабильность, устойчивость к денатурации, возможность создания саморегулирующихся ферментативных систем и использования их в качестве депо антигепариновых веществ. При включении низкомолекулярного БАВ используют разные по электролитической природе полимеры (полиоснование и поликислота) или одинаковые полиэлектролиты (два полиоснования или две поликислоты). Иммобилизация низкомолекулярного посредника происходит или за счет ионных или водородных связей. На основании ТИПЭК могут быть получены микрокапсулы с размерами наночастиц, что открывает перспективы для разработки новых траспортных форм доставки ЛВ в организм.
1.10 Катализ водорастворимыми комплексами олимер — металл
Ообый интерес к координационным соединениям ионов различных металлов с макромолекулярными лигандами обусловлен тем, что ионы железа, меди, кобальта, цинка и другие играют важную роль в ферментативных реакциях. Наиболее вероятной функцией ионов металлов в энзиматических реакциях является захват и приближение субстрата к активному центру катализатора путем образования тройного комплекса катализатор — ион металла — субстрат. Гомогенные металлополимерные катализаторы отличаются высокой активностью и специфичностью действия, Каталитические процессы в растворе изучаются с помощью обычных физико-химических методов, что позволяет выяснить механизм их действия. Это, в свою очередь, дает возможность использовать ряд найденных закономерностей для более глубокого понимания механизма гетерогенного катализа.
В некоторых работах показана возможность моделирования действия биокатализаторов синтетическими полимерами путем создания тройного комплекса поликарбоксилат — ион металла — низкомолекулярный эфир.
Влияние ионов металлов, по-видимому, можно приписать образованию координационной связи эфир — металл с последующей нуклеофильной атакой карбонильного атома ацетат-ионом. Ускоряющий эффект комплексов ПАК и ПМАК с ионами Cu2+
, Ni3+
, Со2
+, Zn2+
в реакции гидролиза 2,4-динитрофенилизоникотината намного выше, чем мономерного комплекса. Порядок увеличения скорости разложения эфира изменяется в ряду Cua
+
>Ni2+
>Co3+
>Zn2
+ и хорошо согласуется со значениями констант ком-плексообразования этих металлов с поликислотами. Аналогично изменяется каталитическая активность комплексов ионов меди (II) с поливинилпиридинами в реакции окисления аскорбиновой кислоты. Анализ кинетических кривых окисления аскорбиновой кислоты в присутствии катализаторов (ионов меди (II), комплексов медь —полимер, медь — низкомолекулярный лиганд) показывает, что добавление полимера значительно увеличивает каталитическую активность ионов меди. Полимеры в зависимости от природы повышают эффективность ионов меди в 200—1500 раз, но все же активность комплексов полимер — металл в 300 раз меньше, чем фермента — аскорбатоксидазы.
Рассмотрим некоторые примеры каталитического действия комплексов водорастворимых полимеров с ионами переходных металлов в реакциях разложения пероксида водорода, окисления, гидрирования и др.Разложение пероксида водорода служит хорошей иллюстрацией ферментоподобного действия комплексов полимер — металл. Такие комплексы часто проявляют более высокую активность, чем соответствующие низкомолекулярные аналоги. Например, комплексы поли-4-винилпиридина с Со-диметилглиоксимом могут служить моделью витамина В.
Исследование поведения полимеров (в том числе полимерных гидрогелей) в растворах солей металлов представляет собой огромный практический и теоретический интерес. Изучение особенностей такого поведения в растворах солей различной валентности создает базу в решении многих фундаментальных проблем, связанных с механизмом формирования структурированных ансамблей внутри полимера благодаря ионному или координационному связыванию с ионами металлов или их комплексными формами. С теоретической точки зрения это позволит решить проблему негомогенного распределения ионогенных групп, происходящих в таких системах, способствующее моделированию стадий биологической эволюции в свете формирования клеточных мембран и капсул. С практической точки зрения, изучение поведения набухания полимеров в солях металлов важно в разработке технологии извлечения ионов металлов из природных и сточных вод, в создании новых классов гетерогенных катализаторов, биомедицинских препаратов, термо - и механостойких полимерных материалов, полупроницаемых мембран и полупроводников. Существенно возросло значение хелатообразующих полимеров для аналитических целей.
В целом, по специфике влияния ионов металлов на объемные параметры гидрогелей можно выделить две категории их воздействия:
1) ионы металлов, как низкомолекулярный ион, создающий экранирующий фон для заряженных функциональных групп;
2) ионы металлов, как центральный комплексообразующий ион, связывающийся с лигандными гидрогелями, как за счет донорно-акцепторного взаимодействия, так и электростатического связывания. Следует отметить, что механизм комплексообразования может быть варьируемым. Прочная донорно-акцепторная связь может образоваться при условии, что симметрия набора донорных орбиталей лигандов (их линейная комбинация) соответствует симметрии акцепторных орбиталей центрального иона, а энергия близка к энергии заполненных орбиталей лиганда. В зависимости от соотношения этих факторов в комплексе может возникать ионная или донорно-акцепторная связь, а также большое число промежуточных вариантов, то есть, одновременное существование ионного и донорно-акцепторного взаимодействия.
Согласно классификации авторов полимер-металлические комплексы (ПМК) могут быть получены различными путями: 1) в результате внутри- или межмолекулярной "сшивки"; 2) при взаимодействии полимерного лиганда со стабильным комплексом, в котором центральный ион металла замаскирован низкомолекулярным лигандом; 3) полимеризацией пар мономер-металл; 4) путем включения иона металла в сетку полимера, приводящего к образованию паркетоподобных ПМК и т.д.
Среди этого многообразия комплексов наибольший интерес представляют координационные соединения, хорошо растворимые в водной и водно-органических средах. При их исследовании появляется возможность в широких пределах изменять природу полимерного лиганда и его молекулярную массу, гидрофильно-липофильный баланс (ГЛБ) цепных макромолекул, природу иона металла; удается варьировать также ряд внешних факторов, оказывающих влияние на морфологию и структуру комплексов.
Интенсивное развитие методов синтеза и химической модификации полимеров позволяет получать макромолекулы не только нужной длины и заданного строения, но также сочетать различные функциональные группы, необходимые длясоздания сорбционного и каталитического участков в полимерной цепи Это дает возможность придать синтетическимполимерам некоторые важные свойства полимеров биологического происхождения.
2. Методическая часть
2.1 Получение и очистка исходных веществ
В работе был использован поливинилпирролидон с молекулярной массой- марки ч.д.а., использовался без дополнительной очистки.
 [ - CH2
– CH – ] [ - CH2
– CH – ]
       NO NO
Железо (ΙΙ) сернокислое 7-водное FeSO4
*7H2
O, чистое, использовалось после высушивания при 120°С.
Кобальта (ΙΙ) нитрит 6-водный Co(NO2
)2
*6H2
O, чистый, использовался после высушивания при 100°С.
Кадмия (ΙΙ) хлорид CdCl2
, марки ч.д.а., использовался без дополнительной очистки.
Пероксид водорода Н2
О2
-37% (продажный).
Соляная кислота – HCl, 1н., стандартизированная NaOH.
Растворитель – вода бидистиллированная Н2
О, спирт этиловый С2
Н5
ОН, ρ=0,875 г/мл.
Оборудование: иономер универсальный ЭВ-74 со стеклянным и хлорсеребряным электродами, химические стаканы на 50мл., бюретки, пипетки, шкаф сушильный, весы технохимические ВГУ-1, весы аналитические ВЛР-2, мерные колбы на 50мл., вискозиметр Убеллоде, термостат, бюкс, секундомер, прибор для определения каталазной активности(изображен на рисунке №17 в приложении).
2.2 Методика проведенных экспериментов
Изучение процесса комплексообразования проводилось методом рН-метрического титрования. Оно проводилось при помощи иономера с точностью измерения ±0,05 ед. рН со стеклянным и хлорсеребряным электродами при температуре 25°С. В стакан для титрования наливали сначала 10мл. 0,1н. раствора ПВПД, затем титровали 1н. раствором HCl при постоянном перемешивании из пипетки. Измерение рН проводили через каждые 0,1мл. прилитых эквивалентов кислоты. Далее таким же образом титровали смесь 5мл. 0,1н. раствораCdCl2
и 5мл. 0,1н. раствора ПВПД, а также смесь 5мл. 0,1н. раствора Co(NO2
)2
и 5мл. 0,1н. раствора ПВПД, и смесь 5мл. 0,1н. раствораFeSO4
и 5мл. 0,1н. раствора ПВПД. Вязкость исследуемых растворов (вышеперечисленных смесей полимера и солей) измерялась в капиллярном вискозиметре Убеллоде, в термостатируемой камере при 25 + 0,10
С. Удельную вязкость раствора вычисляли по формуле:
ηуд.
= (τ – τ0
)/τ0
.
Приведенную вязкостьрассчитывали по формуле:
ηпр.
= ηуд
/С,
где С - концентрация полимера (г./дл..), τ- время истечения раствора, τ0
- время истечения чистого растворителя, измеренное и равное 248сек.Вискозиметр представляет собой капиллярную трубку, соединенную с измерительным шариком. Вискозиметр погружен в термостат. Раствор засасывается грушей из резервуара вискозиметра в шарик выше верхней метки над измерительным шариком. Измеряется время истечения жидкости междуверхней и нижней метками измерительного шарика. Вязкость каждого раствора измеряется 3раза. Определяется время истечения раствора полимера (t) после каждого разбавления.
Определение каталазной активности полученных катализаторов проводилось на основе реакции разложения перекиси водорода Н2
О2.
Суть определения заключается в следующем. В колбу поместить дистиллированную воду объемом 1,2 мл, затем добавить 10мл. катализатора, поставить на плитку (колба находится на водяной бане) и включить магнитную мешалку. Термометром измеряется температура воды водяной бани. Как только температура начинает приближаться к 400
С, в колбу с катализатором добавить 0,9 мл Н2
О2
, и сразу же закрыть колбу пробкой с трубкой, соединенной с газовой бюреткой. Включить секундомер, и через определенный промежуток времени измерить объем выделяющегося кислорода. После того, как кислород перестал выделяться, установка отключалась, а катализатор оставляли на сутки для проверки стабильности. Через сутки опять добавляли 0,9мл Н2
О2
и точно также измеряли объем выделяющего кислорода.
3. Практическая часть
3.1 Результаты и обсуждения
Цель работы:
1) Исследование комплексообразования ионов железа, кобальта и кадмия с поливинилпирролидоном различными физико-химическими методами;
2) Изучение влияния температуры на поведение полученных полимер-металлических комплексов;
3) Изучение влияния состава растворителя на поведение полученных полимер-металлических комплексов;
4) Изучение каталазной активности полученных полимер металлических комплексов.
При изучении процесса комплексообразования мною был использован метод рН-метрического титрования образовавшегося полимерметаллического комплекса в мольном соотношении [металл] - [лиганд]=1:1.Также было проведено рН-метрическое титрование чистого полимера. В обоих случаях титрование проводилось 1н. раствором HCl, так как ПВПД является полиоснованием. Кривые рН-метрического титрования изображены в виде графика, где по оси абцисс откладывались значения эквивалентов прилитой кислоты, а на оси ординат откладывались значения рН. График рН-метрического титрования 1н. соляной кислотой чистого 0,1н. раствора поливинилпирролидона представлен в приложении на рисунке №1. Плавно убывающая кривая означает течение реакции нейтрализации, и постепенное накопление протонов в растворе, что и объясняет постепенное снижение рН. Кривая рН-метрического титрования 1н. соляной кислотой смеси, состоящей из 5мл. 0,1н. раствора ПВПД и 5мл. 0,1н. раствора CdCl2
также представлена в приложении на рисунке №2, в сравнении с кривыми титрования смесей 5мл. 0,1н. раствора Co(NO2
)2
и 5мл. 0,1н. раствора ПВПД, и смеси 5мл. 0,1н. раствораFeSO4
и 5мл. 0,1н. раствора ПВПД. В самом начале кривая титрования для ионовCd2+
и Co2+
в смеси с полимером имеет резкий скачок при рН от 6,3 до 3,2 и от 4,1 до 2,5 соответственно. Это позволяет с уверенностью сказать об образовании мономолекулярного комплекса. Титрование в этом случае было проведено три раза и было выведено среднее арифметическое значение рН (смотрите таблицу в приложении).Однако, при титровании смеси соли железа (II) с полимером не наблюдалось скачков рН при титровании. Это указывает на то, что металлполимерный комплекс не образовался, как в предыдущих случаях.
Одним из специфических методов исследования полимеров является метод вискозиметрии в разбавленных растворах полимеров. Он позволяет наблюдать изменение вязкости полимера в присутствии различного вида растворителей, а также солей металлов. Таким образом, мной было исследование изменения вязкости полимера в присутствии растворителя-воды и изменение вязкости при добавлении к раствору полимера порций солей металла (FeSO4
, Co(NO2
)2
, CdCl2
).Предположительно, взаимодействие полимера с металлом осуществляется через карбонильный кислород полимера. Также мной изучено действие растворителя и температуры на устойчивость полимерных комплексов. На рисунке №3 показано изменение приведенной вязкости (ось ординат) от разбавления (ось абцисс) в отсутствии ионов металла. Из графика виден рост приведенной вязкости, что объясняется силами электростатического взаимодействия между одинаково заряженными звеньями макромолекулы, а также молекулами воды. На рисунке №4 изображена кривая приведенной вязкости ПВПД в присутствии ионов металлов Fe2+
, Cd2+
, Cо2+
. Ранее методом потенциометрического титрования было доказано отсутствие комплексообразования в системе ПВПД-Fe2+
, однако, мною был проведен подтверждающий эксперимент методом вискозиметрии. На рисунке видно, что высокое значение приведенной вязкости чистого раствора полимера при разбавлении солью металла резко снижается, что можно объяснить связыванием ионов металла с макромолекулами полимера, что, в свою очередь, приводит к уменьшению гидродинамических свойств последних. Такое изменение приведенной вязкости чистого полимера характерно для разбавления его солями Co2+
, Cd2+
. Однако при разбавлении ионами железа наблюдается сильное повышение приведенной вязкости. Это указывает на отсутствие взаимодействия ионов железа с полимером, а приведенная вязкость возрастает из-за сил электростатического взаимодействия звеньев полимера с молекулами растворителя. Таким образом, мною было доказано двумя различными по исполнению методами отсутствие взаимодействия ионов железа (II) с ПВПД и образование комплексов ПВПД-Cd2+
и ПВПД-Co2+
.
Далее мною была исследована прочность полученных металлполимерных комплексов. Изучалось влияние на прочность температуры и состава растворителя.
На рисунке №5 представлены кривые приведенной вязкости комплексов ПВПД-Cd2+
и ПВПД-Co2+
в зависимости от состава растворителя Н2
О:С2
Н5
ОН. Кривая 1 (ПВПД-Co2+
) отображает поведение данного комплекса от состава растворителя. Как видно из рисунка, наблюдается увеличение приведенной вязкости (от 0,1 до 0,37) с увеличением объемных процентов этилового спирта, что свидетельствует о раскручивании полимерного клубка. Кривая 2 (ПВПД-Cd2+
) отображает приведенную вязкость данного комплекса по сравнению с вязкостью комплекса ПВПД-Co2+
. Как видно из кривой, вязкость комплекса имеет низкие значения (от 0,13 до 0,19) вне зависимости от состава растворителя, что указывает на его высокую прочность и устойчивость к растворению органическими растворителями.
Также было проведено изучение изменения вязкости образовавшегося комплекса от температуры. Нужно отметить, что все предыдущие исследования по изменению вязкости проводились при постоянной температуре 25 °C. В данном же случае проведены исследования при 25, 40, 60°С. Как видно из построенного графика (рисунок №6) наблюдается рост приведенной вязкости с повышением температуры в обоих случаях. В перспективе же возможно выпадение осадка или же переход раствора в состояние геля. Именно поэтому при более высоких температурах измерение вязкости металлполимерных комплексов не рекомендуется, так как возможно засорение капилляра вискозиметра.
Далее мною проводились эксперименты по изучению каталазной активности полученных металлполимерных комплексов. Проверялась их ускоряющая способность реакции разложения пероксида водорода. Использовались соотношения металл: лиганд=1:1, 1:2, 2:1, 1:4, 1:6. Данные соотношения были выбраны, исходя из координационных чисел иона-комплексообразователя (у Cd и Co координационные числа могут быть 2, 4, 6). Судя по полученным данным, мы можем сказать, что использование растворов полученных металлполимерных комплексов в качестве катализаторов обоснованно, так как они ускоряют данную химическую реакцию, но нецелесообразно, так как ускорение реакции минимально. Самой высокой каталазной активностью обладают комплексы кадмия в соотношении металл: лиганд=1:1 и 1:4. Комплексы кобальта же проявляют самую малую каталазную активность. Однако, если рассматривать графики №13,14,16 то можно выявить постепенное (и достаточно интенсивное для данного случая) увеличение степени разложения пероксида водорода по времени, что указывает на стабильность полученного катализатора.
Выводы
1. Методами рН-метрического титрования и вискозиметрии обнаружено и доказано комплексообразование в системе поливинилпирролидон-Cd2+
и Co2+
. Обнаружено, что поливинилпирролидон не образует комплексы с железом (II) в данных условиях.
2. Изучено влияние температуры на стабильность образовавшихся комплексов. Было выяснено, что повышение температуры ведет к повышению приведенной вязкости, что свидетельствует о деструкционных процессах полимер-металлических комплексов.
3. Изучено влияние состава растворителя на стабильность металлполимерных комплексов. Обнаружено, что комплекс ПВПД- Cd2+
почти не изменяет приведенной вязкости с увеличением объемных процентов спирта этилового С2
Н5
ОН, что указывает на его прочность к действию органических растворителей. С другой стороны, комплекс ПВПД-Со2+
сохраняет свои характеристики только в водной среде.
4. Изучена каталазная активность полимер-металлических комплексов, и выяснено, что растворы данных комплексов обладают малой каталазной активностью. Обнаружено, что наилучшим соотношением [металл]: [лиганд] является соотношение 1:1 и 1:4.
Список литературы
1. А.А. Берлин, В.Е.Басян. «Основы адгезии полимеров», «Химия». М., 1969г.
2. Я.О.Бикерман. «Высокомолекулярные соединения», «Химия», 1968г.
3. Е.А. Бектуров, Л.А. Бимендина «Интерполимерные комплексы», «Наука Каз. ССР», А.-Ата, 1977г.
4. Е.А.Бектуров, Л.А.Бимендина, Г.К.Мамытбеков. «Комплексы водорастворимых полимеров и гидрогелей», А.-Ата, 2002г.
5. Бектуров Е.А., Бимендина Л.А., Кудайбергенов С.Е. «Полимерные комплексы и катализаторы», Алма-Ата, Наука, 1982г.
6. Л.А. Бимендина, М.Г. Яшкарова, С.Е. Кудайбергенов, Е.А. Бектуров. «Полимерные комплексы», Семипалатинск, 2003г.
7. С.С. Воюцкий. «Адгезия и аутогезия полимеров», «Ростехиздат», М., 1963г.
8. А.Г.Гавриленко, К.С.Тусупова, С.В.Тарасенко. «Оформление курсовых и дипломных работ естественно-научных специальностей», Государственный университет имени Шакарима, Семипалатинск, 2000г.
9. Зезин А.Б., Кабанов В.А. // Успехи химии. 1982.Вып.9.
10. Б.А.Киселев. «Стеклопластики», «Госхимиздат», M., 1961г.
11. В.А. Кабанов. «Физико-химические основы и перспективы применения растворимых интерполиэлектролитных комплексов», М., 1994г.
12. В.А. Кабанов, А.Б. Зезин. «Водорастворимые нестехиометричные полиэлектролитные комплексы – новый класс синтетических полиэлектролитов», Сер. «Органическая химия». М., 1984г.
13. Кабанов Н.М., Кокорин А.И., Рогачева В.Б., Зезин А.Б. «Высокомолекулярные соединения»,1979. Т.А21.
14. Кабанов Н.М.Кожевникова Н.А., Кокорин А.И., Рогачева В.Б., Зезин А.Б., кабанов В.А. // Высокомол.соед.1979.Т.А21.
15. Кабанов Н.М., Хван А.М., Рогачева В.Б., зезеин А.Б., Кабанов В.А. // Высокомол.соед.1979.Т.Б21.
16. Н. А.Кротова. «О склеивании и прилипании», Изд-во АН СССР. М., 1960г.
17. Пирсон Р.Дж. Жесткие и мягкие кислоты и основания. //Успехи химии. 1971. Т.40.
18. Усанович М.И. «Исследования в области теории растворов и теории кислот и оснований». Алматы. «Наука». 1970.
19. И.К.Цитович. «Курс аналитической химии», М., «Высшая школа», 1985г.
20. Nsuchida E., Abe K.// Adv. Polym.Sci/ 1982. V.45.P.1
21. Saegusa T., Kobayashi S., Yfeashi K., Yamada A. //Polym.J. 1978. V.10
22. Guilbaut L.J., Murano M., Harnwood H.J. // J.Macromol. Sci.Chem. 1973. V.7. 23. Nishide H., Tsuchida E. // Macromol.Chem. 1976. B. 177.S.2453
24. Nishide H., Tsuchida E. // Macromol.Chem. 1976. B. 177.S.2295
25. Utkelov B.F., Ergozhin E.E. // Macromok.Chem.Macromol.Sump.1989. V.26.
26. UtkelovB.A., NurachmetovK.N., ErgozhinE.E. //Macromok.Chem.RapidCommun. 1990. V.11.P.1
27. DavankovV.A., SemechkinA.V. // J.Chromatogr. 1977. V.41.P.313
28.TrochimczukA.W. // MMC-7, 7-thIntern.Symp.Macromolecule-Metal Complexes.Leiden.The Netherlands. 1997.
Приложение
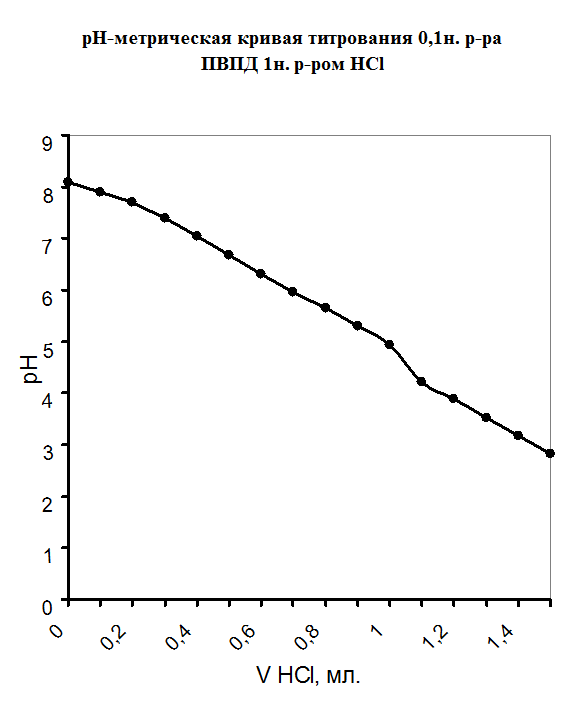
Рисунок №1.
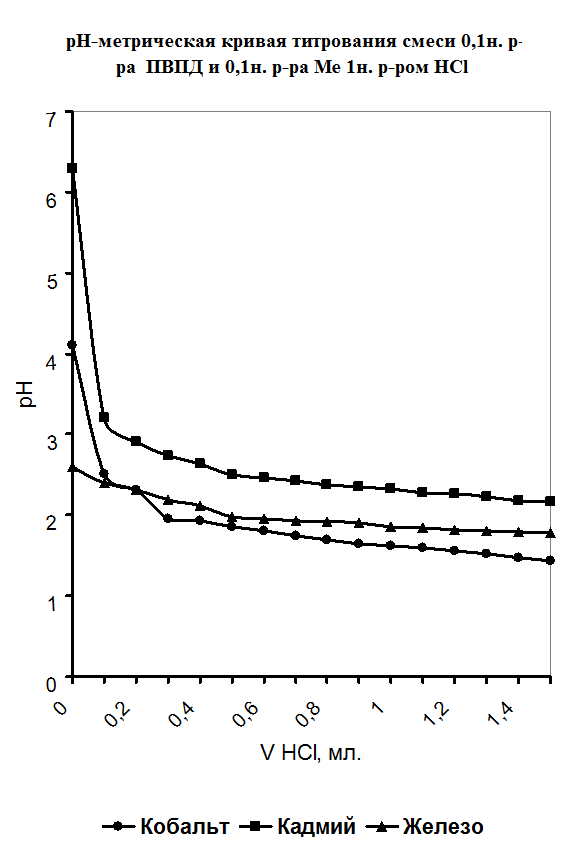
Рисунок №2

Рисунок №3.
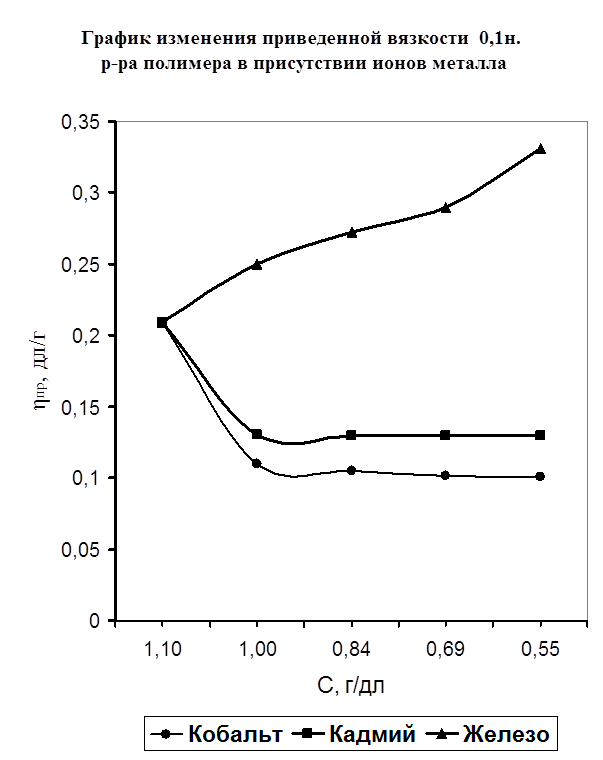
Рисунок №4.
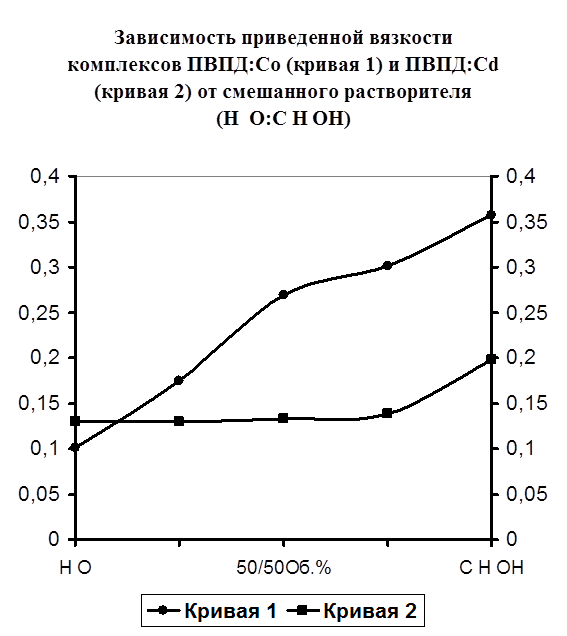
Рисунок №5
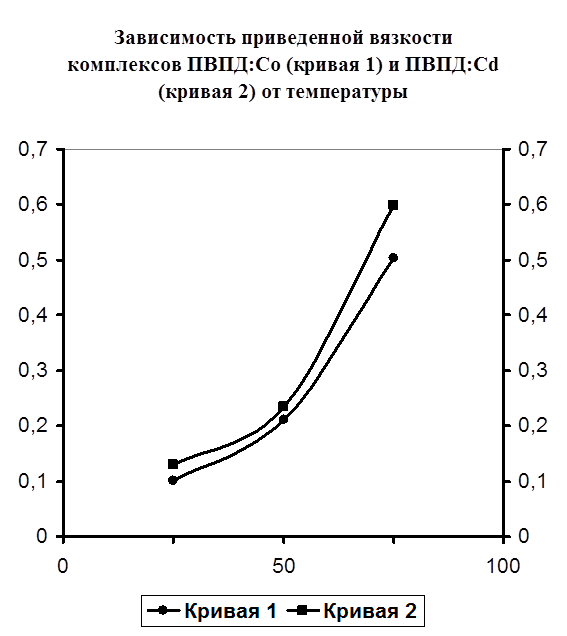
Рисунок №6
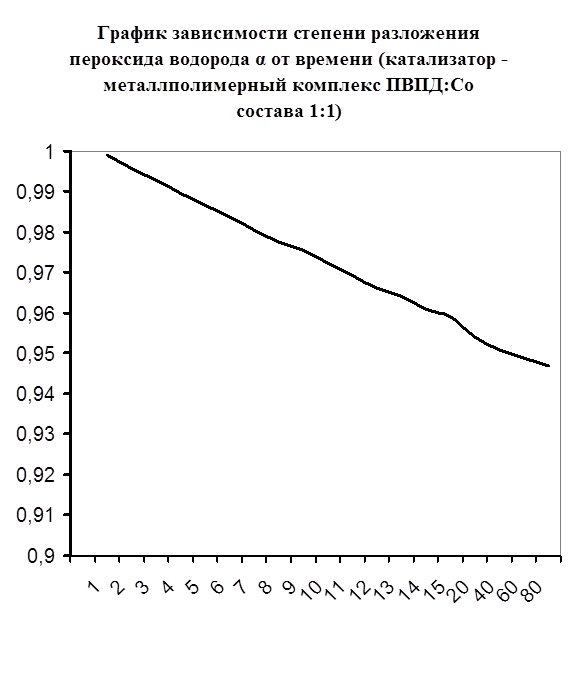 Рисунок №7. Рисунок №7.

Рисунок №8.
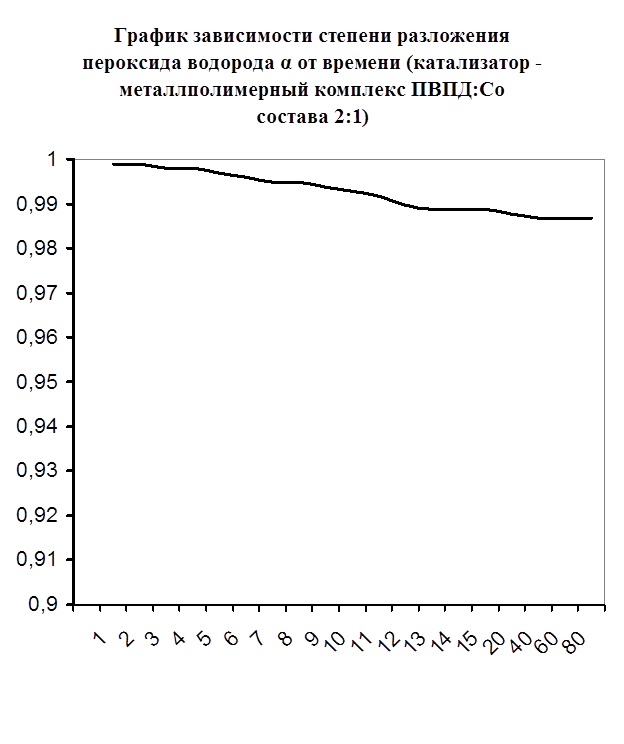 Рисунок №9. Рисунок №9.
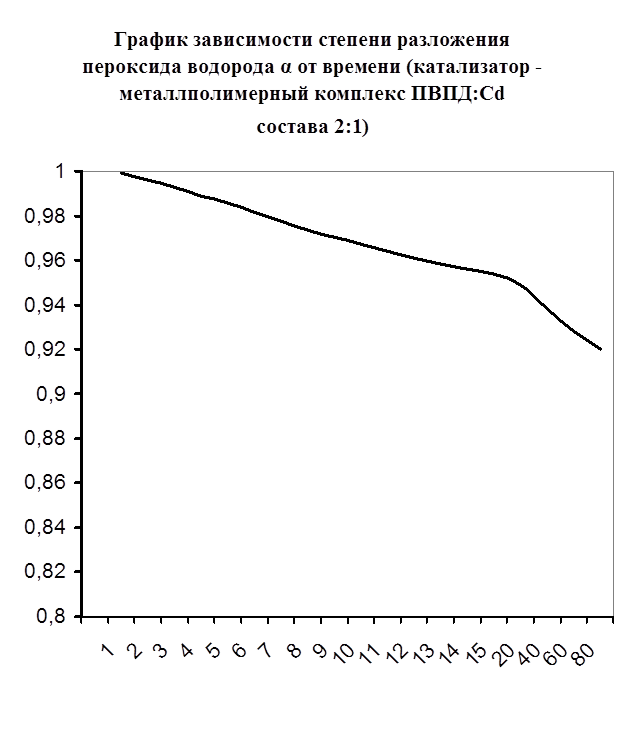 Рисунок №10. Рисунок №10.
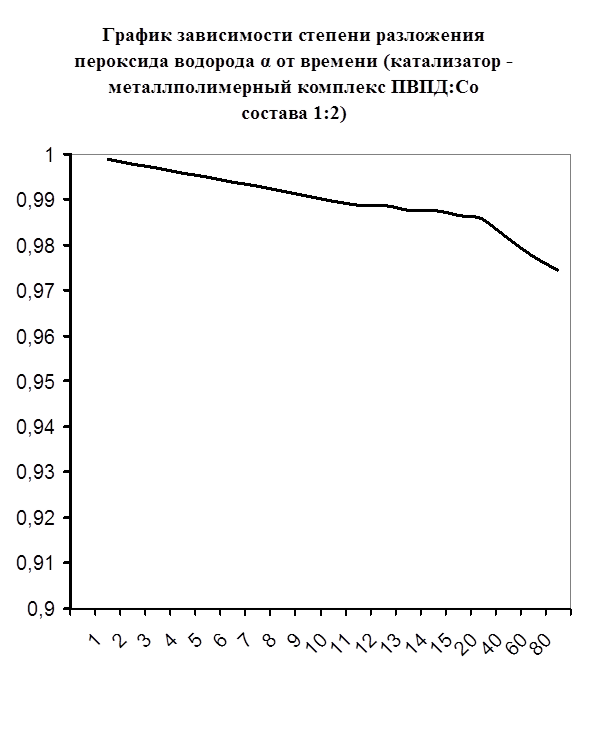 Рисунок №11 Рисунок №11
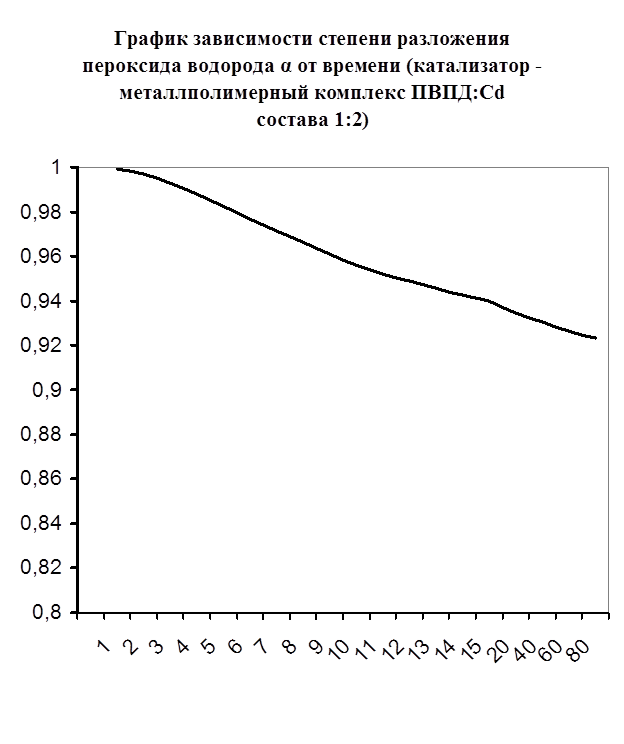 Рисунок №12. Рисунок №12.
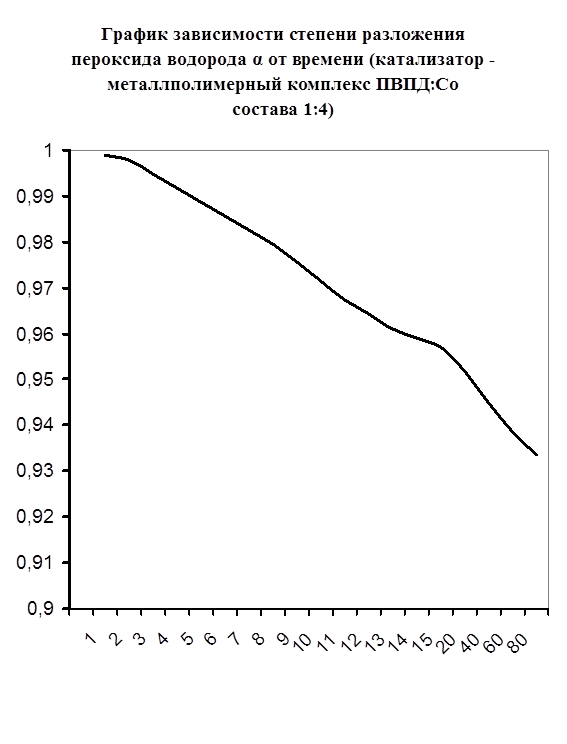 Рисунок №13. Рисунок №13.
 Рисунок №14. Рисунок №14.
 Рисунок №15. Рисунок №15.
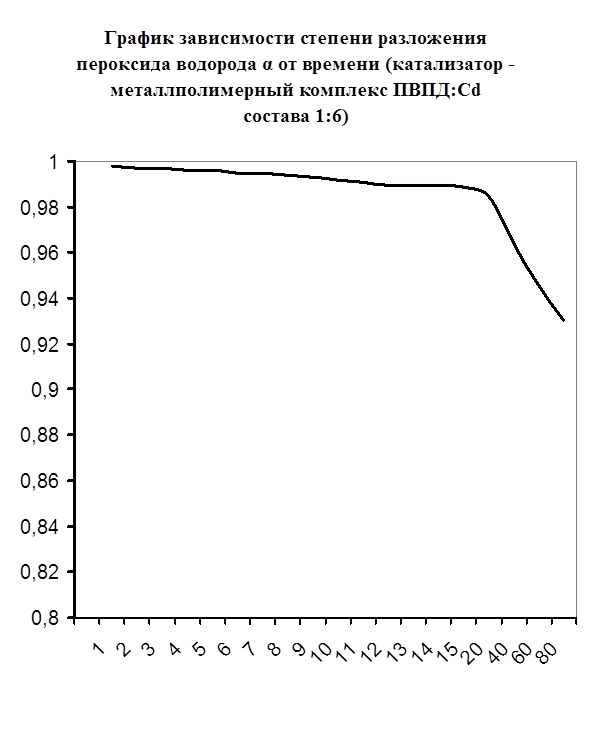 Рисунок №16 Рисунок №16

Рисунок №17
Результаты потенциометрического титрования 0,1н. р-ра ПВПД 1н. р-ром HCl
| Количество прилитого 1н. HCl, мл. |
Значения рН первого титрования |
Значения рН второго титрования |
Значения рН третьего титрования |
Среднее значение рН |
| 0 |
8,1 |
8,1 |
8,1 |
8,1 |
| 0,1 |
7,8 |
7,7 |
7,9 |
7,9 |
| 0,2 |
7,75 |
7,65 |
7,7 |
7,7 |
| 0,3 |
7,42 |
7,38 |
7,41 |
7,4 |
| 0,4 |
7,05 |
7,05 |
7,03 |
7,05 |
| 0,5 |
6,75 |
6,67 |
6,65 |
6,67 |
| 0,6 |
6,31 |
6,31 |
6,3 |
6,31 |
| 0,7 |
6,0 |
5,8 |
6,0 |
5,97 |
| 0,8 |
5,62 |
5,66 |
5,65 |
5,65 |
| 0,9 |
5,3 |
5,31 |
5,3 |
5,3 |
| 1,0 |
4,9 |
4,96 |
4,92 |
4,93 |
| 1,1 |
4,22 |
4,22 |
4,21 |
4,22 |
| 1,2 |
3,87 |
3,88 |
3,9 |
3,89 |
| 1,3 |
3,52 |
3,54 |
3,53 |
3,53 |
| 1,4 |
3,22 |
3,15 |
3,18 |
3,18 |
| 1,5 |
2,8 |
2,8 |
2,82 |
2,8 |
Результаты потенциометрического титрования системы ПВПД Co2+
(1:1) 1н. р-ром HCl
| Количество прилитого 1н. HCl, мл. |
Значения рН первого титрования |
Значения рН второго титрования |
Значения рН третьего титрования |
Среднее значение рН |
| 0 |
4,1 |
4,1 |
4,1 |
4,1 |
| 0,1 |
2,5 |
2,45 |
2,58 |
2,51 |
| 0,2 |
2,3 |
2,38 |
2,25 |
2,31 |
| 0,3 |
2,0 |
1,9 |
1,94 |
1,95 |
| 0,4 |
1,92 |
1,95 |
1,93 |
1,93 |
| 0,5 |
1,86 |
1,84 |
1,86 |
1,85 |
| 0,6 |
1,81 |
1,8 |
1,8 |
1,8 |
| 0,7 |
1,75 |
1,74 |
1,72 |
1,74 |
| 0,8 |
1,7 |
1,7 |
1,69 |
1,7 |
| 0,9 |
1,65 |
1,64 |
1,63 |
1,64 |
| 1,0 |
1,63 |
1,62 |
1,62 |
1,62 |
| 1,1 |
1,6 |
1,59 |
1,59 |
1,59 |
| 1,2 |
1,56 |
1,55 |
1,57 |
1,56 |
| 1,3 |
1,51 |
1,51 |
1,53 |
1,516 |
| 1,4 |
1,47 |
1,46 |
1,47 |
1,47 |
| 1,5 |
1,42 |
1,43 |
1,45 |
1,43 |
Результаты потенциометрического титрования системы ПВПД Cd2+
(1:1) 1н. р-ром HCl
| Количество прилитого 1н. HCl, мл. |
Значения рН первого титрования |
Значения рН второго титрования |
Значения рН третьего титрования |
Среднее значение рН |
| 0 |
6,3 |
6,3 |
6,3 |
6,3 |
| 0,1 |
3,2 |
3,22 |
3,19 |
3,2 |
| 0,2 |
2,9 |
2,95 |
2,89 |
2,91 |
| 0,3 |
2,7 |
2,73 |
2,75 |
2,73 |
| 0,4 |
2,6 |
2,66 |
2,62 |
2,63 |
| 0,5 |
2,5 |
2,51 |
2,5 |
2,5 |
| 0,6 |
2,46 |
2,45 |
2,46 |
2,46 |
| 0,7 |
2,42 |
2,4 |
2,43 |
2,42 |
| 0,8 |
2,38 |
2,36 |
2,37 |
2,37 |
| 0,9 |
2,35 |
2,34 |
2,35 |
2,35 |
| 1,0 |
2,33 |
2,33 |
2,32 |
2,33 |
| 1,1 |
2,29 |
2,28 |
2,28 |
2,28 |
| 1,2 |
2,26 |
2,25 |
2,27 |
2,26 |
| 1,3 |
2,22 |
2,23 |
2,21 |
2,22 |
| 1,4 |
2,18 |
2,18 |
2,19 |
2,18 |
| 1,5 |
2,16 |
2,15 |
2,16 |
2,16 |
Результаты потенциометрического титрования системы ПВПД- e2+
(1:1) 1н. р-ром HCl.
| Количество прилитого 1н. HCl, мл. |
Значения рН первого титрования |
Значения рН второго титрования |
Значения рН третьего титрования |
Среднее значение рН |
| 0 |
2,6 |
2,6 |
2,6 |
2,6 |
| 0,1 |
2,4 |
2,4 |
2,41 |
2,4 |
| 0,2 |
2,3 |
2,31 |
2,31 |
2,31 |
| 0,3 |
2,2 |
2,19 |
2,19 |
2,19 |
| 0,4 |
2,1 |
2,1 |
2,12 |
2,11 |
| 0,5 |
1,98 |
1,98 |
1,97 |
1,98 |
| 0,6 |
1,96 |
1,95 |
1,97 |
1,96 |
| 0,7 |
1,94 |
1,93 |
1,93 |
1,93 |
| 0,8 |
1,92 |
1,92 |
1,93 |
1,92 |
| 0,9 |
1,9 |
1,9 |
1,91 |
1,9 |
| 1,0 |
1,86 |
1,85 |
1,86 |
1,86 |
| 1,1 |
1,84 |
1,84 |
1,85 |
1,84 |
| 1,2 |
1,82 |
1,82 |
1,83 |
1,82 |
| 1,3 |
1,8 |
1,8 |
1,81 |
1,8 |
| 1,4 |
1,79 |
1,79 |
1,8 |
1,79 |
| 1,5 |
1,78 |
1,78 |
1,78 |
1,78 |
Концентрационная зависимость приведенной вязкости полимера (0,1н. ПВПД) от разбавления водой.
t
Vисх. 5мл
|
t1
(+0,5)
|
t2
(+1,0)
|
t3
(+1,5)
|
t4
(+2,0)
|
С, г/дл |
hуд
=
t/t0
-1
|
hуд
/ С, дл/г |
305,0
305,0
305,0
|
322,0
322,0
322,0
|
333,1
333,0
333,0
|
336,0
336,1
336,0
|
338,1
338,1
338,1
|
1,09683
0,9971
0,84371
0,68552
0,5484
|
0,2298
0,2984
0,3427
0,3549
0,3629
|
0,2095
0,2993
0,4062
0,5176
0,6617
|
Концентрационная зависимость приведенной вязкости полимера (0,1н. ПВПД) от разбавления 0,1н. р-ром CdCl2
t
Vисх. 5мл
|
t1
(+0,5)
|
t2
(+1,0)
|
t3
(+1,5)
|
t4
(+2,0)
|
С, г/дл |
hуд
=
t/t0
-1
|
hуд
/ С, дл/г |
305,0
305,0
305,0
|
280,2
280,2
280,1
|
275,2
275,1
275,2
|
270,0
270,0
270,0
|
265,6
265,5
265,6
|
1,09683
0,9971
0,84371
0,68552
0,5484
|
0,2298
0,1298
0,1095
0,08877
0,0708
|
0,2095
0,1302
0,1298
0,1295
0,1292
|
Концентрационная зависимость приведенной вязкости полимера (0,1н. ПВПД) от разбавления 0,1н. р-ром Co(NO2
)2
t
Vисх. 5мл
|
t1
(+0,5)
|
t2
(+1,0)
|
t3
(+1,5)
|
t4
(+2,0)
|
С, г/дл |
hуд
=
t/t0
-1
|
hуд
/ С, дл/г |
305,0
305,0
305,0
|
275,2
275,1
275,2
|
270,0
269,9
270,0
|
265,2
265,2
265,2
|
261,7
261,7
261,7
|
1,09683
0,9971
0,84371
0,68552
0,5484
|
0,2298
0,1098
0,0887
0,0694
0,0554
|
0,2095
0,1101
0,1051
0,1012
0,1010
|
Концентрационная зависимость приведенной вязкости полимера (0,1н. ПВПД) от разбавления 0,1н. р-ром FeSO4
t
Vисх. 5мл
|
t1
(+0,5)
|
t2
(+1,0)
|
t3
(+1,5)
|
t4
(+2,0)
|
С, г/дл |
hуд
=
t/t0
-1
|
hуд
/ С, дл/г |
305,0
305,0
305,0
|
309,7
309,7
309,7
|
304,9
305,0
304,9
|
297,3
297,3
297,2
|
293,1
293,0
293,0
|
1,09683
0,9971
0,84371
0,68552
0,5484
|
0,2298
0,2489
0,2296
0,1987
0,1817
|
0,2095
0,2496
0,2721
0,2899
0,3313
|
Каталазная активность мталлполимерного комплекса ПВПД:Co2+
состава (1:1)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,1 |
1 |
0 |
0 |
0,9989 |
| 2 |
0,4 |
1 |
0,3 |
0,3 |
0,9959 |
| 3 |
0,7 |
1 |
0,3 |
0,3 |
0,9928 |
| 4 |
1,0 |
1 |
0,3 |
0,3 |
0,9897 |
| 5 |
1,3 |
1 |
0,3 |
0,3 |
0,9867 |
| 6 |
1,6 |
1 |
0,3 |
0,3 |
0,9836 |
| 7 |
1,9 |
1 |
0,3 |
0,3 |
0,98057 |
| 8 |
2,2 |
1 |
0,2 |
0,2 |
0,9775 |
| 9 |
2,4 |
1 |
0,3 |
0,3 |
0,97546 |
| 10 |
2,7 |
1 |
0,3 |
0,3 |
0,97239 |
| 11 |
3,0 |
1 |
0,3 |
0,3 |
0,9693 |
| 12 |
3,3 |
1 |
0,3 |
0,3 |
0,96625 |
| 13 |
3,5 |
1 |
0,2 |
0,2 |
0,9642 |
| 14 |
3,8 |
1 |
0,3 |
0,3 |
0,9611 |
| 15 |
4,0 |
1 |
0,2 |
0,2 |
0,9591 |
| 20 |
4,5 |
5 |
0,5 |
0,1 |
0,95398 |
| 40 |
4,8 |
20 |
0,3 |
0,015 |
0,95092 |
| 60 |
5,0 |
20 |
0,2 |
0,01 |
0,94887 |
| 80 |
5,2 |
20 |
0,2 |
0,01 |
0,9468 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+
состава (1:1)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,2 |
1 |
0 |
0 |
0,9979 |
| 2 |
0,9 |
1 |
0,6 |
0,6 |
0,9908 |
| 3 |
1,5 |
1 |
0,5 |
0,5 |
0,9846 |
| 4 |
2,0 |
1 |
0,5 |
0,5 |
0,9795 |
| 5 |
2,5 |
1 |
0,5 |
0,5 |
0,9744 |
| 6 |
3,2 |
1 |
0,7 |
0,7 |
0,9673 |
| 7 |
3,6 |
1 |
0,4 |
0,4 |
0,9632 |
| 8 |
4,1 |
1 |
0,5 |
0,5 |
0,9581 |
| 9 |
4,5 |
1 |
0,4 |
0,4 |
0,9540 |
| 10 |
4,9 |
1 |
0,4 |
0,4 |
0,9499 |
| 11 |
5,4 |
1 |
0,5 |
0,5 |
0,9448 |
| 12 |
5,8 |
1 |
0,4 |
0,4 |
0,9407 |
| 13 |
6,3 |
1 |
0,5 |
0,5 |
0,9356 |
| 14 |
6,8 |
1 |
0,5 |
0,5 |
0,9305 |
| 15 |
7,2 |
1 |
0,4 |
0,4 |
0,9264 |
| 20 |
7,9 |
5 |
0,7 |
0,14 |
0,9192 |
| 40 |
8,8 |
20 |
0,9 |
0,045 |
0,91 |
| 60 |
9,5 |
20 |
0,7 |
0,035 |
0,9028 |
| 80 |
9,7 |
20 |
0,2 |
0,01 |
0,9008 |
Каталазная активность мталлполимерного комплекса ПВПД:Cо2+
состава (2:1)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,1 |
1 |
0 |
0 |
0,9989 |
| 2 |
0,1 |
1 |
0 |
0 |
0,9989 |
| 3 |
0,2 |
1 |
0,1 |
0,1 |
0,9979 |
| 4 |
0,2 |
1 |
0 |
0 |
0,9979 |
| 5 |
0,3 |
1 |
0,1 |
0,1 |
0,9969 |
| 6 |
0,4 |
1 |
0,1 |
0,1 |
0,9959 |
| 7 |
0,5 |
1 |
0,1 |
0,1 |
0,9948 |
| 8 |
0,5 |
1 |
0 |
0 |
0,9948 |
| 9 |
0,6 |
1 |
0,1 |
0,1 |
0,9938 |
| 10 |
0,7 |
1 |
0,1 |
0,1 |
0,9928 |
| 11 |
0,8 |
1 |
0,1 |
0,1 |
0,9918 |
| 12 |
1,0 |
1 |
0,2 |
0,2 |
0,9897 |
| 13 |
1,1 |
1 |
0,1 |
0,1 |
0,9887 |
| 14 |
1,1 |
1 |
0 |
0 |
0,9887 |
| 15 |
1,1 |
1 |
0 |
0 |
0,9887 |
| 20 |
1,2 |
5 |
0,1 |
0,02 |
0,9877 |
| 40 |
1,3 |
20 |
0,1 |
0,005 |
0,9867 |
| 60 |
1,3 |
20 |
0 |
0 |
0,9867 |
| 80 |
1,3 |
20 |
0 |
0 |
0,9867 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+
состава (2:1)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,1 |
1 |
0 |
0 |
0,9989 |
| 2 |
0,4 |
1 |
0,3 |
0,3 |
0,9959 |
| 3 |
0,7 |
1 |
0,3 |
0,3 |
0,9928 |
| 4 |
1,1 |
1 |
0,4 |
0,4 |
0,9887 |
| 5 |
1,4 |
1 |
0,3 |
0,3 |
0,9856 |
| 6 |
1,8 |
1 |
0,4 |
0,4 |
0,9816 |
| 7 |
2,2 |
1 |
0,4 |
0,4 |
0,9775 |
| 8 |
2,6 |
1 |
0,4 |
0,4 |
0,9734 |
| 9 |
2,9 |
1 |
0,3 |
0,3 |
0,9703 |
| 10 |
3,2 |
1 |
0,3 |
0,3 |
0,9673 |
| 11 |
3,5 |
1 |
0,3 |
0,3 |
0,9642 |
| 12 |
3,8 |
1 |
0,3 |
0,3 |
0,9611 |
| 13 |
4,1 |
1 |
0,3 |
0,3 |
0,9581 |
| 14 |
4,3 |
1 |
0,2 |
0,2 |
0,956 |
| 15 |
4,5 |
1 |
0,2 |
0,2 |
0,9539 |
| 20 |
5,0 |
5 |
0,5 |
0,1 |
0,9488 |
| 40 |
6,0 |
20 |
1,0 |
0,05 |
0,9386 |
| 60 |
7,0 |
20 |
1,0 |
0,05 |
0,9284 |
| 80 |
7,8 |
20 |
0,8 |
0,04 |
0,9202 |
Каталазная активность мталлполимерного комплекса ПВПД:Cо2+
состава (1:2)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,1 |
1 |
0 |
0 |
0,9989 |
| 2 |
0,2 |
1 |
0,1 |
0,1 |
0,9979 |
| 3 |
0,3 |
1 |
0,1 |
0,1 |
0,9969 |
| 4 |
0,4 |
1 |
0,1 |
0,1 |
0,9959 |
| 5 |
0,5 |
1 |
0,1 |
0,1 |
0,9949 |
| 6 |
0,6 |
1 |
0,1 |
0,1 |
0,9939 |
| 7 |
0,7 |
1 |
0,1 |
0,1 |
0,9929 |
| 8 |
0,8 |
1 |
0,1 |
0,1 |
0,9919 |
| 9 |
0,9 |
1 |
0,1 |
0,1 |
0,9908 |
| 10 |
1,0 |
1 |
0,1 |
0,1 |
0,9897 |
| 11 |
1,1 |
1 |
0,1 |
0,1 |
0,9887 |
| 12 |
1,1 |
1 |
0 |
0 |
0,9887 |
| 13 |
1,2 |
1 |
0,1 |
0,1 |
0,9877 |
| 14 |
1,2 |
1 |
0 |
0 |
0,9877 |
| 15 |
1,3 |
1 |
0,1 |
0,1 |
0,9867 |
| 20 |
1,4 |
5 |
0,1 |
0,02 |
0,9857 |
| 40 |
1,8 |
20 |
0,4 |
0,02 |
0,9815 |
| 60 |
2,2 |
20 |
0,4 |
0,02 |
0,9775 |
| 80 |
2,5 |
20 |
0,3 |
0,015 |
0,9744 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+
состава (1:2)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,1 |
1 |
0 |
0 |
0,9989 |
| 2 |
0,3 |
1 |
0,2 |
0,2 |
0,9969 |
| 3 |
0,7 |
1 |
0,4 |
0,4 |
0,9928 |
| 4 |
1,2 |
1 |
0,5 |
0,5 |
0,9877 |
| 5 |
1,7 |
1 |
0,5 |
0,5 |
0,9826 |
| 6 |
2,3 |
1 |
0,6 |
0,6 |
0,9765 |
| 7 |
2,8 |
1 |
0,5 |
0,5 |
0,9714 |
| 8 |
3,3 |
1 |
0,5 |
0,5 |
0,9662 |
| 9 |
3,8 |
1 |
0,5 |
0,5 |
0,9611 |
| 10 |
4,3 |
1 |
0,5 |
0,5 |
0,956 |
| 11 |
4,7 |
1 |
0,4 |
0,4 |
0,9519 |
| 12 |
5,0 |
1 |
0,3 |
0,3 |
0,9488 |
| 13 |
5,3 |
1 |
0,3 |
0,3 |
0,9458 |
| 14 |
5,6 |
1 |
0,3 |
0,3 |
0,9427 |
| 15 |
5,9 |
1 |
0,3 |
0,3 |
0,9397 |
| 20 |
6,4 |
5 |
0,5 |
0,1 |
0,9345 |
| 40 |
6,8 |
20 |
0,4 |
0,02 |
0,9305 |
| 60 |
7,2 |
20 |
0,4 |
0,02 |
0,9263 |
| 80 |
7,5 |
20 |
0,3 |
0,015 |
0,9233 |
Каталазная активность мталлполимерного комплекса ПВПД:Cо2+
состава (1:4)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,1 |
1 |
0 |
0 |
0,9989 |
| 2 |
0,2 |
1 |
0,1 |
0,1 |
0,9979 |
| 3 |
0,5 |
1 |
0,3 |
0,3 |
0,9948 |
| 4 |
0,8 |
1 |
0,3 |
0,3 |
0,9918 |
| 5 |
1,1 |
1 |
0,3 |
0,3 |
0,9887 |
| 6 |
1,4 |
1 |
0,3 |
0,3 |
0,9857 |
| 7 |
1,7 |
1 |
0,3 |
0,3 |
0,9826 |
| 8 |
2,0 |
1 |
0,3 |
0,3 |
0,9795 |
| 9 |
2,4 |
1 |
0,4 |
0,4 |
0,9755 |
| 10 |
2,8 |
1 |
0,4 |
0,4 |
0,9714 |
| 11 |
3,2 |
1 |
0,4 |
0,4 |
0,9673 |
| 12 |
3,5 |
1 |
0,3 |
0,3 |
0,9642 |
| 13 |
3,8 |
1 |
0,3 |
0,3 |
0,9611 |
| 14 |
4,0 |
1 |
0,2 |
0,2 |
0,9591 |
| 15 |
4,2 |
1 |
0,2 |
0,2 |
0,957 |
| 20 |
4,7 |
5 |
0,5 |
0,1 |
0,9519 |
| 40 |
5,4 |
20 |
0,7 |
0,035 |
0,9448 |
| 60 |
6,0 |
20 |
0,4 |
0,02 |
0,9386 |
| 80 |
6,5 |
20 |
0,5 |
0,025 |
0,9335 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+
состава (1:4)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,2 |
1 |
0 |
0 |
0,9979 |
| 2 |
0,5 |
1 |
0,3 |
0,3 |
0,9948 |
| 3 |
0,9 |
1 |
0,4 |
0,4 |
0,9908 |
| 4 |
1,4 |
1 |
0,5 |
0,5 |
0,9857 |
| 5 |
2,0 |
1 |
0,6 |
0,6 |
0,9795 |
| 6 |
2,7 |
1 |
0,7 |
0,7 |
0,9724 |
| 7 |
3,3 |
1 |
0,6 |
0,6 |
0,9662 |
| 8 |
3,9 |
1 |
0,6 |
0,6 |
0,9601 |
| 9 |
4,4 |
1 |
0,5 |
0,5 |
0,9550 |
| 10 |
4,9 |
1 |
0,5 |
0,5 |
0,9499 |
| 11 |
5,3 |
1 |
0,4 |
0,4 |
0,9458 |
| 12 |
5,7 |
1 |
0,4 |
0,4 |
0,9417 |
| 13 |
6,1 |
1 |
0,4 |
0,4 |
0,9376 |
| 14 |
6,4 |
1 |
0,3 |
0,3 |
0,9345 |
| 15 |
6,6 |
1 |
0,2 |
0,2 |
0,9325 |
| 20 |
7,4 |
5 |
0,8 |
0,16 |
0,9243 |
| 40 |
8,2 |
20 |
0,8 |
0,04 |
0,916 |
| 60 |
8,6 |
20 |
0,4 |
0,02 |
0,9121 |
| 80 |
8,8 |
20 |
0,2 |
0,01 |
0,91 |
Каталазная активность мталлполимерного комплекса ПВПД:Cо2+
состава (1:6)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,1 |
1 |
0 |
0 |
0,9989 |
| 2 |
0,2 |
1 |
0,1 |
0,1 |
0,9979 |
| 3 |
0,2 |
1 |
0 |
0 |
0,9979 |
| 4 |
0,3 |
1 |
0,1 |
0,1 |
0,9969 |
| 5 |
0,3 |
1 |
0 |
0 |
0,9969 |
| 6 |
0,3 |
1 |
0 |
0 |
0,9969 |
| 7 |
0,4 |
1 |
0,1 |
0,1 |
0,9959 |
| 8 |
0,4 |
1 |
0 |
0 |
0,9959 |
| 9 |
0,5 |
1 |
0,1 |
0,1 |
0,9948 |
| 10 |
0,5 |
1 |
0 |
0 |
0,9948 |
| 11 |
0,6 |
1 |
0,1 |
0,1 |
0,9939 |
| 12 |
0,7 |
1 |
0,1 |
0,1 |
0,9928 |
| 13 |
0,8 |
1 |
0,1 |
0,1 |
0,9918 |
| 14 |
0,9 |
1 |
0,1 |
0,1 |
0,9908 |
| 15 |
1,0 |
1 |
0,1 |
0,1 |
0,9897 |
| 20 |
1,1 |
5 |
0,1 |
0,02 |
0,9887 |
| 40 |
1,4 |
20 |
0,3 |
0,015 |
0,9857 |
| 60 |
1,8 |
20 |
0,4 |
0,02 |
0,9815 |
| 80 |
2,1 |
20 |
0,3 |
0,015 |
0,9785 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+
состава (1:6)
| t , мин. |
V0
, мл |
Δt |
Δ V0
|
Δ V0
/ Δt |
α |
| 1 |
0,2 |
1 |
0 |
0 |
0,9979 |
| 2 |
0,3 |
1 |
0,1 |
0,1 |
0,9969 |
| 3 |
0,3 |
1 |
0 |
0 |
0,9969 |
| 4 |
0,4 |
1 |
0,1 |
0,1 |
0,9959 |
| 5 |
0,4 |
1 |
0 |
0 |
0,9959 |
| 6 |
0,5 |
1 |
0,1 |
0,1 |
0,9948 |
| 7 |
0,5 |
1 |
0 |
0 |
0,9948 |
| 8 |
0,6 |
1 |
0,1 |
0,1 |
0,9939 |
| 9 |
0,7 |
1 |
0,1 |
0,1 |
0,9928 |
| 10 |
0,8 |
1 |
0,1 |
0,1 |
0,9918 |
| 11 |
0,8 |
1 |
0 |
0 |
0,9918 |
| 12 |
0,9 |
1 |
0,1 |
0,1 |
0,9908 |
| 13 |
1,0 |
1 |
0,1 |
0,1 |
0,9897 |
| 14 |
1,0 |
1 |
0 |
0 |
0,9897 |
| 15 |
1,1 |
1 |
0,1 |
0,1 |
0,9887 |
| 20 |
1,5 |
5 |
0,4 |
0,08 |
0,9846 |
| 40 |
3,5 |
20 |
2,0 |
0,1 |
0,9642 |
| 60 |
5,3 |
20 |
1,8 |
0,09 |
0,9458 |
| 80 |
6,8 |
20 |
1,5 |
0,075 |
0,9305 |
|