Министерство образования и науки Украины
Донбасский государственный технический университет
Кафедра ОМД
КОНТРОЛЬНАЯ РАБОТА
по дисциплине Металловедение
Выполнил:
ст. гр. ПМГ-А-08з
Тупорев Р.Л.
Алчевск 2009
1. Диаграммы состояния и кристаллизация металлических сплавов. Методы построения диаграмм состояния. Правило фаз Гиббса
1.1 Диаграммы состояния
Диаграммы состояния, или диаграммы фазового равновесия в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации. Диаграммы состояния строят для условий равновесия (окончательное состояние). Равновесное состояние соответствует минимальному значению свободной энергии. Это состояние может быть достигнуто только при очень малых скоростях охлаждения или длительном нагреве. Однако истинное равновесие достигается редко, наиболее часто системы находятся в метастабильном состоянии (неустойчивом), и под воздействием внешних факторов могут переходить в другие более устойчивые состояния. Метастабильные состояния нередко сообщают сплавам высокие механические и другие свойства.
1.2 Правило фаз
Диаграммы фазового равновесия характеризуют окончательное состояние сплавов, то есть после того как все превращения в них произошли и полностью закончились. Это состояние зависит от внешних условий (Т0
С; Р, МПа) и характеризуется числом и концентрацией образовавшихся фаз. Закономерность изменения числа фаз в гетерогенной системе определяется правилом фаз.
Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз и выражается уравнением
С = К - Ф + 2,
где С - число степеней свободы системы (или вариантность);
К - число компонентов, образующих систему;
2 - число внешних факторов (Т и Р);
Ф - число фаз, находящихся в равновесии.
Под числом степеней свободы (вариантностью системы) понимают возможность изменения температуры, давления и концентрации без изменения числа фаз, находящихся в равновесии.
При нормальных условиях изменяется только один фактор -Т0
С, Р =const, тогда:
С=К - Ф + 1.
Число степеней свободы не может быть меньше нуля, тогда К-Ф+1>0, а Ф<К+1, то есть число фаз в сплаве, не может быть больше чем число компонентов плюс единица. Таким образом, в двойной системе может быть не более трёх фаз.
При С = 0 - существует в равновесии сразу три фазы - имеется нонвариантное равновесие (безвариантное). При таком равновесии сплав может существовать только при условии - постоянная температура и определённый состав всех фаз, находящихся в равновесии. То есть кристаллизация (или превращение) начинается и заканчивается при постоянной температуре. Если С =1 или 2, то кристаллизация или превращение протекает с течением времени в интервале температур.
1.3 Процесс кристаллизации сплавов
В жидком состоянии большинство металлов неограниченно растворяется друг в друге, образуя однородный раствор (исключение: Fe- Pb, Cu- Pb).
Кристаллизация в сплаве начинается только при переохлаждении, с образованием зародышей и их последующего роста.
Любые фазы, образующиеся в сплаве, отличаются по составу от исходного жидкого раствора, поэтому для образования устойчивого зародыша необходимы не только гетерофазные (по плотности) флуктуации, но и флуктуации концентрации (рис.1).
Рисунок 1.
Флуктуациями концентрации называют временно возникающие отклонения химического состава сплава в отдельных малых объёмах жидкого раствора от среднего его состава. Такие флуктуации возникают вследствие диффузионного перемещения атомов вещества.
1.4 Построение диаграмм состояния
Диаграмма состояния показывает изменение состояния сплавов в зависимости от температуры (P= const) и концентрации.
Если в системе имеется два компонента, то диаграмма будет иметь два измерения: первое - температурная шкала, второе - концентрация сплава (рисунок 2).
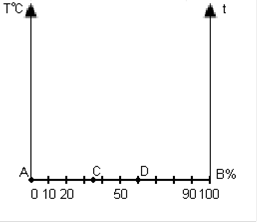
Рисунок 2.
Каждая точка на оси абсцисс соответствует определённому содержанию каждого компонента. Общее содержание компонентов в сплаве - 100%.
Крайние ординаты на диаграмме соответствуют чистым компонентам, а ординаты между ними - двойным сплавам.
Через точку С проходит сплав содержащий 35% компонента В
и, соответственно, 65% компонента А
.
Каждая точка на диаграмме состояния показывает состояние сплава данной концентрации при данной температуре. Каждая вертикаль соответствует изменению температуры определенного сплава. Изменение фазового состояния сплава отмечается на диаграмме точкой.
Линии, соединяющие точки аналогичных превращений, разграничивают на диаграмме области аналогичных фазовых состояний.
Вид диаграммы состояния зависит от того, как реагируют оба компонента друг с другом в твердом и жидком состоянии, то есть, растворимы ли они в жидком и твердом состоянии, образуют ли химические соединения и так далее.
Обычно диаграммы состояния строят, экспериментально используя термический анализ, то есть строят кривые охлаждения и по остановкам и перегибам на этих кривых, вызванным тепловым эффектом превращений, определяют температуры превращений. Эти температуры называют критическими точками.
Температуру металлов измеряют обычно при помощи термопары.
Имея достаточное количество сплавов, и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния.
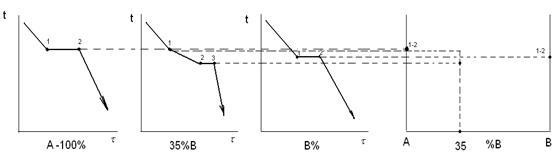
Рисунок 3. Построение кривых охлаждения
Диаграмма состояния показывает, какую структуру будет иметь медленно охлажденный сплав при любой температуре.
2. Кристаллизация сплавов. Диаграммы состояния сплавов с неограниченной растворимостью в твердом состоянии. Кристаллизация твердых растворов. Правило концентраций и отрезков
2.1 Диаграмма состояния сплавов, образующих неограниченные твердые растворы
Диаграмма состояния для случая полной взаимной растворимости компонентов А
и В
в жидком и твердом состояниях в зависимости от концентрации и температуры дана на рис.1.
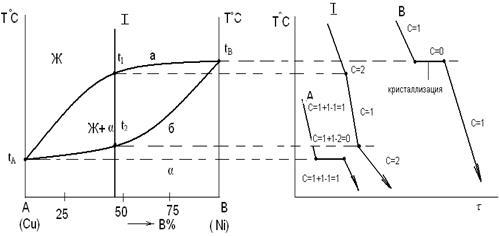
Рисунок 1. Диаграмма состояния с неограниченной растворимостью компонентов
Если два компонента неограниченно растворяются в жидком и твердом состояниях, то возможно существование только двух фаз - жидкого раствора Ж (
L)
и твердого раствора (a). Следовательно, трех фаз быть не может, кристаллизация не наблюдается при постоянной температуре и горизонтальной линии на диаграмме нет.
При температуре выше линии tА
а
tВ
, называемой линией ликвидус, существует только жидкая фаза Ж
. В этой области свободная энергия жидкой фазы Fж ниже свободной энергии твердого раствора Fa
, состоящего из компонентов А
и В
.
В области ниже линии tА
б
tВ
, называемой линией солидус, устойчив a - твердый раствор, так как Fa
< Fж
.
Между линиями ликвидус и солидус в равновесии находятся жидкая фаза и a-твердый раствор.
Диаграмма состояния строится методом термического анализа.
Кристаллизация чистого компонента А
: равномерное понижение температуры до значения tА
(температура плавления компонента А
), при которой компонент А
затвердевает (до tА
- С = 1 + 1 - 1 = 1). На кривой отмечается остановка (горизонтальная линия), так как согласно правилу фаз только при этой температуре одновременно могут существовать две фазы - твердая и жидкая (С=1+1-2=0). После затвердевания (Ф = 1), температура снова равномерно понижается С = 1 + 1 - 1 = 1. Аналогично для компонента В
(рисунок 1).
При охлаждении сплава
I
температура понижается до t1
(C=2+1-1=2), при которой начинается кристаллизация, на кривой охлаждения наблюдается перегиб, связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации.
Начиная от температуры t1
, из Ж
-фазы кристаллизуется твердый раствор. Процесс кристаллизации идет при понижающейся температуре (С=2+1-2=1), существует две фазы: Ж и a.
При достижении t2
сплав затвердевает и при более низких температурах существует только a - твердый раствор.
Если найденные точки перенести на диаграмму, и одноименные точки соединить плавными линиями, то получится диаграмма состояния системы сплавов А
и В
, образующих непрерывный ряд твердых растворов (рисунок 1).
В интервале температур между линиями ликвидус и солидус две фазы - жидкий сплав и a- твердый раствор.
2.2 Кристаллизация твердых растворов
Рассмотрим более подробно процесс кристаллизации сплава, содержащего 60% компонента В. При температуре t1
сплав находится в жидком состоянии. В нем имеется равновесный набор фазовых и концентрационных флуктуаций (отклонение от среднего химического состава). При охлаждении в интервале температур t1
до t2
- количество размер флуктуаций при охлаждении увеличивается по отношению к a- фазе. Ниже т.2, (то есть примем т.3) начинается процесс кристаллизации, критический размер зародыша достигает максимальной величины. Ниже t2
сплав является двухфазным (Ж
и a - кристаллы). Двухфазное состояние существует в интервале температур t2
- t5
(рисунок 2).
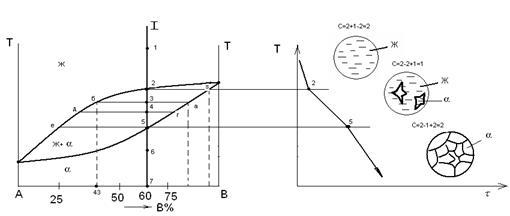
Рисунок 2.
В процессе кристаллизации (при каждой Т0
С) изменяется и концентрация фаз, и количество каждой фазы (при кристаллизации количество твердой фазы увеличивается, а жидкой уменьшается). В любой точке диаграммы, когда существует две фазы, можно определить количество обеих фаз и их концентрацию. Для этого служит правило рычага, или правило отрезков.
2.3 Первое правило отрезков (правило концентраций)
Чтобы определить концентрации компонентов в фазах, через данную точку, характеризующую состояние сплава, проводят горизонтальную линию (коноду) до пересечения с линиями (ликвидус и солидус) ограничивающими данную область; проекции точек пересечения на ось концентраций показывают концентрацию компонентов в фазах (или составы фаз).
Таким образом, химический состав твердой фазы a (для температуры т.3) описывается точкой пересечения коноды с линией солидус, то есть в точке - а
(82% В
, остальное - 18% А
).
Точка встречи коноды и линии ликвидус (т. б
) описывает равновесное состояние жидкости, то есть её химический состав (Ж
-фаза содержит: 43% В
, остальное - 57% А
).
При t4
- жидкость имеет состав точки - д
, а a- твердый раствор имеет состав точки - г
.
При температуре t5
процесс кристаллизации заканчивается.
Таким образом, делаем вывод: состав твердой фазы изменяется по линии солидус (от точки s
до точки t5
), а состав Ж
фазы изменяется по линии ликвидус (от точки t2
до точки е
).
В процессе кристаллизации изменяется не только состав фаз, но и количественное состояние между ними. Для определения количественных соотношений фаз, находящихся в равновесии при данной температуре пользуются вторым правилом отрезков (или рычага).
2.4 Второе правило отрезков (правило рычага)
Для того чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию (коноду). Отрезки этой линии между заданной точкой и точками, определяющими составы фаз, обратно пропорциональны количествам этих фаз.
Для температуры t3
:
точка 3 определяет состояние сплава, точка б
- состав Ж
фазы; точка а
- состав a - твердой фазы, отрезок ба
- определяет всё количество сплава (конода, её длину принимают за 100% объёма сплава); отрезок 3а
характеризует количество жидкой фазы; отрезок б3
определяет количество кристаллов (a - твердой фазы).
aа
= 3б/ба*100%=30/100*100%=30%,
Жб
=3а/ба*100%=70/100*100%=70%,
Жб
=100-aа
=100% -30%=70%.
При t4: aг
=4д/дг*100% = 60/100*100% = 60%,
Жд
=4г/дг*100% = 40/100*100% = 40%,
Жг
=100/дг*100% = 100% -60% = 40%.
Отрезки, примыкающие к жидкой фазе, характеризуют количество твердой фазы. Отрезок коноды, примыкающий к твердой фазе, характеризует количество жидкой фазы.
Окончание затвердевания сплава соответствует температуре t5
. Выделяющиеся кристаллы твердого раствора имеют переменный состав, зависящий от температуры (t2
: as
; t3
: aа
; t4
: aг
; t5
: a5
).
Однако при медленном охлаждении процессы диффузии в жидкой и твердой фазе (объемная диффузия), а также процессы взаимной диффузии между ними (межфазная диффузия) успевают за процессом кристаллизации, поэтому состав кристаллов выравнивается.
В этих условиях сплав после затвердевания будет состоять из однородных кристаллических зерен твердого раствора (рисунок 3), а их состав будет соответствовать исходному составу сплава (точка 6 (рис.2)).
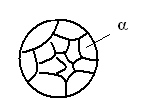
Рисунок 3. Микроструктура сплава
В сплавах может наблюдаться дендритная ликвация: в кристаллах оси первого порядка будут обогащены тугоплавким компонентом (В
), периферийные слои кристалла и межосные пространства, кристаллизующиеся в последнюю очередь, обогащены компонентом легкоплавким (А
), понижающим температуру плавления сплава. Быстрое охлаждение способствует дендритной ликвации.
Литература
1. Лахтин Ю.М., Леонтьева В.П. Материаловедение. М., 1972, 1980.
2. Гуляев А.П. Металловедение. М., 1986.
3. Новиков И.И. Дефекты кристаллического строения металлов. М., 1983.
4. Антикайн П.А. Металловедение. М., 1972.
|