Билет №1
3.Частные реакции на катионы алюминия Al3+
.
Al3+
- амфотерный ион можно определить группой реагентов КОН и NaOH в избытке.
  AlCl3
+ 3NaOH = 3NaCl + Al(OH)3 AlCl3
+ 3NaOH = 3NaCl + Al(OH)3
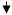 Al3+
+ 3Cl-
+ 3Na+
+ 3OH-
= 3Na+
+3Cl-
+ Al(OH)3 Al3+
+ 3Cl-
+ 3Na+
+ 3OH-
= 3Na+
+3Cl-
+ Al(OH)3
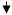 Al3+
+ 3OH-
= Al(OH)3 Al3+
+ 3OH-
= Al(OH)3
Al(OH)3
– осадок белого цвета, при избытке ОН-
растворяется.
Билет №2
3.Задача.
Дано: Решение:
 m(H2
O) = 9г 9г х1 х2 m(H2
O) = 9г 9г х1 х2
 2Н2
О = 2Н2
+ О2 2Н2
О = 2Н2
+ О2
V(Н2
) - ?
V(O2
) - ? Mr (Н2
О) = 18 V(Н2
) = 44.8л V(O2
) = 22.4л
m (Н2
О) = 36
 1) 36г 44.8л (Н2
) 1) 36г 44.8л (Н2
)
 9г х1 х1 = 11.2л (Н2
) 9г х1 х1 = 11.2л (Н2
)
 2) 36г 22.4л (О2
) 2) 36г 22.4л (О2
)
 9г х2 х2 = 5.6л (О2
) 9г х2 х2 = 5.6л (О2
)
Ответ: V(Н2
) = 11.2л, V(O2
) = 5.6л.
Билет №3
3.Частные реакции на катионы меди Сu2+
.
Cu2+
- определяемый ион.
1) реактив ОН-
дает синий осадок.
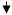  CuSO4
+ 2NaOH = Na2
SO4
+ Cu(OH)2 CuSO4
+ 2NaOH = Na2
SO4
+ Cu(OH)2
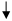 Cu2+
+ SO4
2-
+ 2Na+
+ 2OH-
= 2Na+
+ SO4
2-
+ Cu(OH)2 Cu2+
+ SO4
2-
+ 2Na+
+ 2OH-
= 2Na+
+ SO4
2-
+ Cu(OH)2
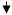 Cu2+
+ 2OH-
= Cu(OH)2 Cu2+
+ 2OH-
= Cu(OH)2
2) реактив S2-
дает черный осадок.
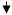 K2
S + CuSO4
= K2
SO4
+ CuS K2
S + CuSO4
= K2
SO4
+ CuS
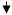 2K+
+ S2-
+ Cu2+
+ SO4
2-
= 2K+
+ SO4
2-
+ CuS 2K+
+ S2-
+ Cu2+
+ SO4
2-
= 2K+
+ SO4
2-
+ CuS
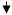 Cu2+
+ S2-
= CuS Cu2+
+ S2-
= CuS
Билет №4
3.Задача.
 Дано: Решение: Дано: Решение:
m(Zn) = 6.5г
Q2
= 34.8кДж 6.5г 34.8кДж
 2Zn + O2
= 2ZnO + Q1 2Zn + O2
= 2ZnO + Q1
Q1
- ? М=65г/моль
Составить термо- m=130г
  химическое урав- 130г х химическое урав- 130г х
 нение реакции. 6.5г 34.8кДж х=696кДж нение реакции. 6.5г 34.8кДж х=696кДж
Ответ: 2Zn + O 2
= 2ZnO + 696 кДж
Билет №5
3.Частные реакции на анионы хлора Сl-
.
Cl-
– определяемый ион, реактив – Ag+
дает белый творожистый осадок.
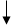  HCl + AgNO3
= HNO3
+ AgCl HCl + AgNO3
= HNO3
+ AgCl
H+
+ Cl-
+ Ag+
+ NO3
-
= H+
+ NO3
-
+ AgCl
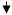 Ag+
+ Cl-
= AgCl Ag+
+ Cl-
= AgCl
Билет №6
 3.Задача. 3.Задача.
Дано: Решение:
v(MgO) = 2моль
 2моль х 2моль х
m(MgSO4
) - ? MgO + H2
SO4
= MgSO4
+ H2
O
M=40г/моль М=120г/моль
1) v=m/M 2=m/40 m=80г
 2) 40г(MgO) 120г (MgSO4
) 2) 40г(MgO) 120г (MgSO4
)
х=240г
 80г(MgO) х 80г(MgO) х
Ответ: m(MgSO4
) = 240г
Билет №7
3.Получить кислород О2
. Доказать опытным путем, что полученный газ – О2
.
В пробирку из тугоплавкого стекла (см. рис.) помещают несколько граммов твердого KMnO 4
, закрывают пробкой с газоотводной трубкой, конец которой помещают либо в пустой стакан (метод собирания кислорода вытеснением воздуха), либо в перевернутую пробирку, заполненную водой (метод собирания кислорода вытеснением воды). Нагревают пробирку на пламени спиртовки и собирают образующийся газообразный кислород.
В стакан, заполненный кислородом, опускают тлеющую лучинку. Она тут же ярко вспыхивает, что подтверждает наличие кислорода в стакане. Кислород способствует горению.
Билет №8
3.Реакции, характерные для серной кислоты.
а) Действие индикатора.
В пробирку поместить несколько капель раствора серной кислоты и добавить 2-3 капли раствора индикатора-метилоранжа. Раствор приобретает розовую окраску, характерную для растворов кислот.
б) Взаимодействие с основаниями (реакция нейтрализации).
В пробирку из опыта а) добавлять по каплям раствор щелочи КОН до перехода окраски с розовой на желтую (момент полной нейтрализации):
H2
SO4
+ 2KOH = K2
SO4
+ 2H2
O
2H+
+ SO4
2-
+ 2K+
+ 2OH-
= 2K+
+ SO4
2-
+ 2H2
O
2H+
+ 2OH-
= 2H2
O
в) Взаимодействие с основными и амфотерными оксидами.
В пробирку поместить небольшое количество твердого оксида цинка ZnO и добавлять по каплям раствор серной кислоты до полного растворения оксида:
H2
SO4
+ ZnO = ZnSO4
+ H2
O
2H+
+ ZnO = Zn2+
+ H2
O
г) Взаимодействие с металлами, стоящими в ряду активности до водорода.
В пробирку поместить гранулу алюминия и добавить 2-3 мл раствора серной кислоты. Наблюдается выделение газа:
3H2
SO4
+ 2Al = Al2
(SO4
)3
+ 3H2
6H+
+ 2Al = 2Al3+
+ 3H2
д) Взаимодействие с солями кислот более слабых, чем серная (например угольная).
В пробирку поместить 1 мл раствора карбоната натрия Na2
CO3
и добавлять по каплям раствор серной кислоты. Наблюдается энергичное выделение газа:
H2
SO4
+Na2
CO3
= Na2
SO4
+ H2
O + CO2
2H+
+ CO3
2-
= H2
O + CO2
Билет №9
 3.Задача.
Решение: 3.Задача.
Решение:
Дано:
m(HCl)=72г 72г 20% х
w(HCl)=20% Zn + 2HCl = ZnCl2
+ H2
 Mr=36.5 V=22.4л Mr=36.5 V=22.4л
m=73г
V(H2
) - ?
1) 20% = m(в-ва) / 72г * 100%
m (в-ва) = 20 % * 72г / 100%
m (в-ва) = 14.4г
  2) 73г 22.4 л 2) 73г 22.4 л
 14.4г х х = 4.4 л 14.4г х х = 4.4 л
Ответ: V(H2
) = 4/4 л
Билет №10
3.Реакции, характерные для соляной кислоты.
а) Действие индикатора.
В пробирку поместить 5-6 капель раствора соляной кислоты и добавить 2-3 капли раствора индикатора-метилоранжа. Раствор приобретает розовую окраску, характерную для растворов кислот.
б) Взаимодействие с основаниями (реакция нейтрализации).
В пробирку из опыта а) добавлять по каплям раствор щелочи NaОН до перехода окраски с розовой на желтую (момент полной нейтрализации):
HCl + NaOH = NaCl + H2
O
H+
+ OH-
= H2
O
в) Взаимодействие с металлами, стоящими в ряду активности до водорода.
В пробирку поместить гранулу цинка и добавить 1-2мл раствора соляной кислоты. Наблюдается выделение газа:
Zn + 2HCl = ZnCl2
+ H2
Zn + 2H+
= Zn2+
+ H2
г) Взаимодействие с основными и амфотерными оксидами.
В пробирку поместить небольшое количество твердого оксида магния MgO и добавлять по каплям раствор кислоты до полного растворения оксида:
MgO + 2HCl = MgCl2
+ H2
O
MgO + 2H+
= Mg2+
+ H2
O
д) Взаимодействие с солями кислот более слабых, чем соляная (например угольная).
В пробирку поместить 1 мл раствора карбоната натрия Na2
CO3
и добавлять по каплям раствор соляной кислоты. Наблюдается энергичное выделение газа:
2HCl + Na2
CO3
= 2NaCl + H2
O + CO2
2H+
+ CO3
2-
= H2
O + CO2
Билет №11
3.Получить и собрать СО2
.Доказать, что полученный газ - СО2
.
В пробирку помещают небольшой кусочек мела СаСО3
и добавляют сверху раствор кислоты НСl. Наблюдается бурное выделение углекислого газа:
СаСО3
+ 2HCl = CaCl2
+ H2
O + CO2
Образующийся газ пропускают с помощью трубки через раствор известковой воды Са(ОН)2
и наблюдается помутнение раствора из-за образования нерастворимого СаСО3
:
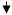 СО2
+ Са(ОН)2
= Н2
О + СаСО3 СО2
+ Са(ОН)2
= Н2
О + СаСО3
Углекислый газ не поддерживает горения. В стакан с углекислым газом опускаем горящую лучинку, она тут же гаснет.
Билет №12
 3.Задача.
Решение: 3.Задача.
Решение:
Дано:
m(H2
O)=100мл w = m(в-ва)/ m(р-ра) * 100%
w(HNO3
)=50%
m(НNO3
)=100г m(HNO3
) = m(р-ра) * w/ 100% = 50%

w(р-ра) - ? m(р-ра)= m(H2
O) + m(в-ва) = 100мл + 50г = 150г
w(р-ра) = 50/150 *100% = 33.3%
Ответ: w(р-ра) = 33.3%
Билет №13
3.Проделать реакции, характерные для глюкозы.
Глюкоза проявляет свойства многоатомных спиртов и альдегидов.
1.Доказать наличие в глюкозе функциональных групп ОН-
можно, проделав реакцию с гидроксидом меди (в избытке щелочи):
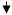 СuSO4
+ 2NaOH = Na2
SO4
+ Cu(OH)2 СuSO4
+ 2NaOH = Na2
SO4
+ Cu(OH)2
К полученному осадку добавьте равный объем раствора глюкозы, смесь взболтайте – раствор становится синим.
2.Если нагреть смесь раствора глюкозы и гидроксида меди (II), то будет наблюдаться выпадение желтого (гидроксид меди (I)), затем красного осадка (оксид меди (I)):
НОСН2
(СНОН)4
– СОН + Сu(ОН)2
= НОСН2
(СНОН)4
– СООН + СuОН
2СuОН = Сu2
О + Н2
О
Билет №14
3.Определить, в какой из пробирок находится NaOH, Na2
SO4
.
В пробирки с растворами добавить 2-3 капли раствора хлорида бария. Та пробирка, в которой образуется белый осадок, содержит соль серной кислоты:
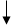 BaCl2
+ Na2
SO4
= 2NaCl + BaSO4 BaCl2
+ Na2
SO4
= 2NaCl + BaSO4
Билет №15
 3.Задача.
Решение: 3.Задача.
Решение:
Дано: 14г 0.5моль х
m(CаО) = 10л CаО + H2
SO4
= CaSO4
+ Н2
О
v(H2
SO4
) = 0.5моль М(CаО) =56г/моль
 М(H2
SO4
)=98г/моль М(H2
SO4
)=98г/моль
m(CaSO4
) - ? М(CaSO4
)=136г/моль
1) v(CаО)= m/Mv(CaO)= 14/56=0.25 моль,
значит масса H2
SO4
дана в избытке.
2) Расчет ведем по веществу, которое дано в недостатке:
 14г (CаО) Х 14г (CаО) Х
 56г (CаО) 136 г Х = 14 * 136 / 56г 56г (CаО) 136 г Х = 14 * 136 / 56г
Х = 34г
Ответ: m(CaSO4
) = 34г
Билет №16
 3.Задача.
Решение: 3.Задача.
Решение:
Дано: 10л х
V (C2
H2
) = 10л С2
Н2
+ 3О2
= 2СО2
+ 2Н2
О
 V=22.4л V=67.2л V=22.4л V=67.2л
  V (O2
) - ? 22.4л(C2
H2
) 67.2л(O2
) V (O2
) - ? 22.4л(C2
H2
) 67.2л(O2
)
 10л (C2
H2
) х х = 30л 10л (C2
H2
) х х = 30л
Ответ: V (O2
) = 30л
Билет №17
 3.Задача.
Решение: 3.Задача.
Решение:
Дано: 165г 120г
 m(C6
H5
-NO2
) = 165г C6
H5
-NO2
+ 3Н2
C6
H5
-NH2
+ 2Н2
О m(C6
H5
-NO2
) = 165г C6
H5
-NO2
+ 3Н2
C6
H5
-NH2
+ 2Н2
О
m(C6
H5
-NH2
) = 120г М=125г/моль М=93г/моль
 Wпрактический 1) 125г 93г Wпрактический 1) 125г 93г
 выход (C6
H5
-NH2
) - ? 165г х х = 122.76г(теоретический выход анилина) выход (C6
H5
-NH2
) - ? 165г х х = 122.76г(теоретический выход анилина)
  2) 122.76г 100% 2) 122.76г 100%
 120 г х х = 97.75% 120 г х х = 97.75%
Ответ: Wпрактический
выход (C6
H5
-NH2
) = 97.75%
Билет №18
3.Частные реакции на сульфат-анионы
SO4
2-
.
 SO4
2-
-
определяемый ион, реактив Ва2+
дает белый осадок. SO4
2-
-
определяемый ион, реактив Ва2+
дает белый осадок.
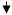 Na2
SO4
+ BaCl2
= 2NaCl + BaSO4 Na2
SO4
+ BaCl2
= 2NaCl + BaSO4
 2Na+
+ SO4
2-
+ Ba2+
+ Cl-
= 2Na+
+ 2Cl-
+ BaSO4 2Na+
+ SO4
2-
+ Ba2+
+ Cl-
= 2Na+
+ 2Cl-
+ BaSO4

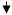 SO4
2-
+ Ba2+
= BaSO4 SO4
2-
+ Ba2+
= BaSO4
Билет №19
 3.Задача.
Решение: 3.Задача.
Решение:
Дано: 150г 20% х
m(H2
SO4
)= 150г Fe + H2
SO4
= FeSO4
+ H2
w(H2
SO4
)=20% m=98г V=22.4л

V(H2
) - ? 1) w = m / M * 100% m = w * M / 100%
m = 150г * 20% / 100%
m = 30 г
  2) 98г(H2
SO4
) 22.4л(H2
) х = 6.86л 2) 98г(H2
SO4
) 22.4л(H2
) х = 6.86л
 30г(H2
SO4
) х 30г(H2
SO4
) х
Ответ: V(H2
) = 6.86л
Билет №20
3.Частные реакции на карбонат-анионы СO3
2-
.
СО3
2-
- определяемый ион, Н+
- ион, используемый для определения.
  СаСО3 + НСl = CaCl2
+ H2
CO3 СаСО3 + НСl = CaCl2
+ H2
CO3
 H2
O CO2 H2
O CO2
Образующийся газ пропускают через раствор известковой воды Са(ОН)2 и наблюдают помутнение раствора из-за образования нерастворимого СаСО3
:
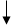 CO2
+ Са(ОН)2
= H2
O + СаСО3 CO2
+ Са(ОН)2
= H2
O + СаСО3
Углекислый газ не поддерживает горения. При опускании горящей лучинки с колбу с CO2
она тут же гаснет.
Билет №21
 3.Задача.
Решение: 3.Задача.
Решение:
Дано:
m(C2
H4
) = 1.2т Составляем схему реакции:
 С2
Н4
+ Н2
О = C2
H5
OH С2
Н4
+ Н2
О = C2
H5
OH
 m (C2
H5
OH) - ? Составим пропорцию: m (C2
H5
OH) - ? Составим пропорцию:
 2.8 г С2
Н4
46г C2
H5
OH 2.8 г С2
Н4
46г C2
H5
OH
 1.2 т С2
Н4
х х = 1.9 т C2
H5
OH 1.2 т С2
Н4
х х = 1.9 т C2
H5
OH
Ответ: m (C2
H5
OH) = 1.9 т
Билет №22
 3.Задача.
Решение: 3.Задача.
Решение:
Дано:
m (CaC2
) = 1 кг CaC2
+ 2Н2
О = Са(ОН)2
+ C2
H2
w (примесей) = 20% m=64г V=22.4л
   V (C2
H2
) - ? 64 г CaC2
22.4 л C2
H2 V (C2
H2
) - ? 64 г CaC2
22.4 л C2
H2
 1000 * 0.8 «CaC2
– х» C2
H2
х = 1000 * 0.8 * 22.4 = 280 л 1000 * 0.8 «CaC2
– х» C2
H2
х = 1000 * 0.8 * 22.4 = 280 л
64
Ответ: 280 л C2
H2.
Билет №23
 3.Задача.
Решение: 3.Задача.
Решение:
Дано:
m (Al4
C3
) =57.6 г Al4
C3
+ 12Н2
О = 3СН4
+ 4Al(OH)3
w (примесей) = 20% Mасса Al4
C3
М = 57.6 * 0.8 = 46.04г
 Составим пропорцию: Составим пропорцию:
 V (воздуха) -? 144 г Al4
C3
67.2 л СН4 V (воздуха) -? 144 г Al4
C3
67.2 л СН4
  46.04 г х х = 46.04 * 67.2 = 21.5 л 46.04 г х х = 46.04 * 67.2 = 21.5 л
144
Реакция горения метана: СН4
+ 2О2
= СО2
+ 2Н2
О
   Составим пропорцию: 1 л СН4
2 л О2 Составим пропорцию: 1 л СН4
2 л О2
  21.5 СН4
х х = 21.5 * 2 = 43 л 21.5 СН4
х х = 21.5 * 2 = 43 л
1
Ответ: V = 43 л
Билет №24
 3.Задача.
Решение: 3.Задача.
Решение:
Дано: 3CaO + 2Al = 3Ca + Al2
O3
m (Ca) = 1 т Cоставим пропорцию:
   2 * 27 кг Al 3 * 40 кг Са 2 * 27 кг Al 3 * 40 кг Са
 m(Al) - ? х Аl 1000 кг Са х = 450 кг m(Al) - ? х Аl 1000 кг Са х = 450 кг
Ответ: m (Al) = 450 кг
Билет №25
 3.Задача.
Решение: 3.Задача.
Решение:
Дано:
 m (C6
H12
) = 840 кг C6
H6
+ 3Н2
= C6
H12 m (C6
H12
) = 840 кг C6
H6
+ 3Н2
= C6
H12
 w (практ. выход)=80% 1) 840 кг 80 % w (практ. выход)=80% 1) 840 кг 80 %
 х 100% х = 1050 кг C6
H12 х 100% х = 1050 кг C6
H12
(теорет. выход)
m (C6
H6
) - ?
 2) 78 г C6
H6
84 г C6
H12 2) 78 г C6
H6
84 г C6
H12
 х 1050 кг C6
H12
х = 975 кг C6
H6 х 1050 кг C6
H12
х = 975 кг C6
H6
Ответ: m (C6
H6
) = 975 кг C6
H6
|