Реакции электрофильного замещения: галогенирование, нитрование, сульфирование, алкилирование, ацилирование. Механизм реакции электрофильного замещения. Понятие о p- и s-комплексах, их строение. Энергетическая диаграмма. Влияние заместителей на направление и скорость электрофильного замещения. Галогенирование и нитрование боковых цепей. Окисление бензола и его гомологов. Озонолиз. Реакции присоединения: гидрирование, галогенирование.
Нафталин: строение, ароматичность, номенклатура. Химические свойства: реакции электрофильного замещения (галогенирование, нитрование, сульфирование, ацилирование); реакции присоединения, гидрирование, галогенирования. Окисление. a- и b-Нафтолы и нафтиламины. Бифенил, трифенилметан. Понятие об устойчивых радикалах.
ХИМИЧЕСКИЕ СВОЙСТВА
В силу строения бензольного кольца для ароматических соединений ряда бензола характерны реакции электрофильного замещения.

Конкуренция между присоединением нуклеофильной частицы и отрывом протона в реакции бензониевого иона.

-реакция 1 не происходит;
-реакция 2 происходит:
В p-комплексе p-электронная система бензола выступает как донор электронов, а электрофильный агент действует как акцептор электронов. Однако образование и диссоциация p-комплекса происходят очень быстро, и образование p-комплекса в большинстве случаев не оказывает существенного влияния ни на скорость реакции, ни на природу подавляющего большинства образующихся соединений.

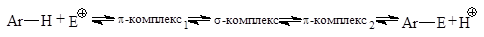
Бензол вступает в следующие реакции:

Нитрование.

Нитрующие агенты HNO3
, HNO3
/H2
SO4
, HNO3
и CH3
COOH, HNO3
/(СН3
СО)2
О, NO2
BF4
и др.
Природа нитрующих агентов:

Условия, температура, концентрация.
Галогенирование.

Одним из наиболее часто используемых катализаторов является безводный хлорид алюминия. Функция катализатора состоит в связывании с галогеном.

Сульфирование.
Для сульфирования часто применяется серная кислота, содержащая избыток SO3
.

кислотно-основное равновесие между двумя молекулами серной кислоты.
Хотя серный ангидрид не несет положительного заряда, но он обладает дефицитом электронов, и, следовательно, является кислотой.


Поскольку бензолсульфокислота - сильная кислота, то она сильно диссоциирует. Реакция сульфирования - обратимая. При взаимодействии бензолсульфокислоты с перегретым паром при 1800
С образуется бензол.

Алкилирование по Фриделю-Крафтсу.
Принято два возможных механизма реакции:

Во втором случае можно предполагать, что электрофилом служит алкильная группа полырного комплекса AlCl3
с алкилгалогенидом.

Реакции окисления.
1). Бензольное кольцо в обычных условиях окисляется с трудом. При действии кислорода воздуха на бензол в присутствии V2
O5
(пятиокись ваннадия) при температуре 4000
С получается малеиновый ангидрид.

2). Окисление алкилпроизводных бензола идет с образованием карбоксилсодержащих бензольных производных:

3). Озонирование.

4). Каталитическое окисление О2
в присутствии медного катализатора.

Правила ориентации в бензольном кольце
Введение заместителя в молекулу бензола требует ответа на два вопроса:
1. Какое влияние оказывает заместитель на скорость реакции - затрудняет или ускоряет?
2. Куда он направляет электрофильную частицу Е+
, в какое положение?

Эти вопросы связаны с перераспределением электронной плотности в бензольном кольце (I-эффект и С-эффект).
Примеры нитрования бензола, нитробензола, толуола.
Рассмотрим два типа заместителей:

+ I-эффект
s, p -гиперконъюгация
сверхсопряжение + С
|

- I-эффект
- С
|

Донор (увеличение электр. плотности)
активизирует
|

Акцептор (уменьшение электр. плотности)
деактивизирует
|


|


|
Рядактивности:
NH2
> OH > OR > Cl > I > Br > CH3
; COOH > SO3
H > NO2
.
Ориентация:

Особенности влияния галогенов.

Галогены являются о-,п-ориентантами, но в то же время дезактивируют кольцо.
Влияние заместителей в ядре на электрофильное замещение.
| орто-, пара- Ориентанты |
мета-Ориентанты |
| Активирующие |
Дезактивирующий |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| Дезактивирующие |
 |
 |
 |
Хотя заместители и подразделяются для удобства на 2 класса - о-, п- и м-ориентанты, однако практически существует очень мало реакций, в которых образовались бы только о-, п- или м-замещенные. Большинство реакций приводит к получению всех трех изомеров, а ориентирующее влияние сказывается просто в том, какой из них образуется в избытке.
В приведенной таблице показано, что большинство заместителей о-, п-направляющих больше дают продуктов пара-замещенных, чем орто, несмотря на то, что орто-положений два. Причиной тому служат стерические факторы.
Распределение изомеров при нитровании производных бензола.

| R |
Распределение продуктов, % |
| орто |
пара |
мета |
 |
58 |
38 |
4 |
 |
12 |
88 |
- |
 |
30 |
70 |
- |
 |
37 |
62 |
1 |
 |
38 |
60 |
2 |
 |
19 |
1 |
80 |
 |
27 |
<3 |
70 |
 |
- |
11 |
89 |
Электрофильное замещение в дизамещенных бензолах
При наличии двух заместителей, действующих несогласованно, разного типа место вступления заместителя определяет активирующий (электронодонорный) заместитель.

Если оба ориентанта одного типа, то место вступления определяет более сильный, а если заместители не очень отличаются по силе, то образуются смеси продуктов.
Ориентация в дизамещенных может быть и согласованной:

|