Тройные соударения и тримолекулярные реакции
В качестве элементарных реакций в газовой фазе тримолекулярные соударения не являются распространёнными, поскольку даже в хаотических броуновских движениях очень мала вероятность одновременных столкновений трёх частиц. Вероятность тримолекулярной стадии резко возрастает, если она протекает на границе раздела фаз, и фрагменты поверхности конденсированной фазы оказываются её участниками. За счёт подобных реакций часто создаётся основной канал изъятия у активных частиц избыточной энергии и их исчезновения в сложных превращениях.
Рассмотрим тримолекулярное превращение вида:
Из-за малой вероятности тримолекулярных соударений целесообразно ввести более реалистичную схему, использующую симметризованный набор бимолекулярных актов. (см. Эмануэль и Кнорре, стр. 88-89.)
4.1. Качественная модель последовательных бимолекулярных соударений:

Основное допущение основано на детальном равновесии на первой стадии:
Квазиравновесный режим образования бимолекулярных комплексов


 
Результирующая константа скорости должна принять вид:
 (7.1) (7.1)

Подобная трактовка тримолекулярных реакций принадлежит Траутцу. Её не следует переоценивать. Это лишь качественная теория. Она не в состоянии объяснить все особенности таких реакций. Это возможно лишь на основе ТАК, которая не ограничена лишь вышеприведенным простейшим выводом, и требует значительно более глубокого анализа на основе статистической механики.
А) Известно всего несколько реакций в газовой фазе с участием оксида азота, кинетика которых соответствует 3-му порядку (Примеры см. у Панченкова и Лебедева). Однако стехиометрические уравнения баланса вовсе не обязаны соответствовать схеме элементарных актов.
Б) Тримолекулярными являются также очень важные реакции рекомбинации валентно-насыщенных частиц в превращениях типа:  , ,
где R1, R2- обладающие свободной валентностью атомы или молекулярные свободные радикалы, а M - любая третья частица. С формально-кинетической точки зрения всякий такой процесс выглядит как процесс второго порядка, и третья частица не учитывается в материальном балансе и не определяет стехиометрию процесса.
Её функция состоит только лишь в отводе избытка энергии от образующейся частицы

Тримолекулярные процессы подобного рода протекают на стенках сосуда, и символом M будут уже обозначены центры соударения на стенке. Их присутствие без специальных приёмов не обнаружимо, и роль этих стадий будет замаскирована в виде концентрационных сомножителей в эффективных константах скоростей. Роль таких стабилизирующих тройных столкновений тем выше, чем более эффективно они способны отводить выделяющуюся избыточную энергию, а она тем выше, чем больше атомов в молекуле третьей частицы M. Это вызвано тем, что с увеличением размера частицы растёт число колебательных степеней свободы, и за счёт именно их возбуждений растёт вероятность отвода энергии на межатомные связи молекулы M от вновь образуемой молекулы продукта.
Цепные неразветвлённые реакции-I.
Пример-1 (классический): Реакция в газе:
H
2
+Br
2
=
2HBr

|
|
Энергии диссоциации участников реакции позволяют качественно оценить последовательность распада их молекул. Здесь «слабое звено» - молекула Br2 , сравнительно легко претерпевающая гомолиз. Эта ре акция была исследована при 200-300oC и оказалась состоящей из пяти элементарных стадий. Принцип Боденштейна приводит к превосходному описанию кинетики процесса. Кинетическое уравнение для целевого продукта выводится из кинетической схемы. Элементарные стадии представлены в таблице1:
| Баланс активных центров |
№
i
|
Элементарные стадии |
На стадии:___
Вошло | Вышло
|
Скорости Стадий |
Классификация
стадий
|
riH,
ккал
|
| 1 |
Br2 |
+ M |
2 Br |
+ M |
- |
|
r1=k1[M] [Br2] |
Зарождение |
-45.2 |
| 2 |
Br |
+ H2 |
H |
+ HBr |
|
|
r2=k2[H2][Br ] |
-16.2 |
| 3 |
H |
+ Br2 |
Br |
+ HBr |
|
|
r3=k3[Br2][H ] |
Продолжение |
+40.5 |
| 4 |
H |
+ HBr |
Br |
+ H2 |
|
|
r4=k4[HBr][H ] |
+16.0 |
| 5 |
2 Br |
+ M |
Br2 |
+ M |
|
- |
r5= k5[M][Br]2 |
Обрыв |
+45.2 |
Реакции 1 и 2 образуют звено цепи. Звено включает минимальный набор стадий, на которых образуется продукт реакции. Обрыв квадратичный, происходит на стенке (стадия 5).
 
Подставляя уравнение 1) в уравнение 2), получаем:
   k1[Br2]= k5 [Br] 2 k1[Br2]= k5 [Br] 2 
Получаем также: а)  Подставляем этот результат в уравнение 1): Подставляем этот результат в уравнение 1):   Получаем: Получаем:
б)  (8.1) (8.1)
Далее простые преобразования, ведущие к целевому продукту:
 (8.2) (8.2)
Конечное уравнение для скорости темновой реакции:
 (8.3) (8.3)
Конечное уравнение для скорости световой реакции:
При фотохимическом протекании реакции изменяется лишь описание 1-й стадии процесса. Инициирование происходит уже под действием фотонов:  . И лишь те молекулы брома, что поглотили фотоны, далее способны участвовать в превращениях. Изменяя закон действующих масс для 1-й стадии, вместо концентрации брома вводим в него концентрацию фотонов. Её размерность эйнштейн (один моль - число Авогадро фотонов), и . И лишь те молекулы брома, что поглотили фотоны, далее способны участвовать в превращениях. Изменяя закон действующих масс для 1-й стадии, вместо концентрации брома вводим в него концентрацию фотонов. Её размерность эйнштейн (один моль - число Авогадро фотонов), и  . Обычно необходимая в кинетическом уравнении, обратная времени, раз мерность входит с константой скорости. В уравнение фотохимической 1-й стадии она появляется вместе с «концентрацией» фотонов, которая есть не что иное, как интенсивность излучения – энергия, доставляемая в реагирующую систему в единицу времени: . Обычно необходимая в кинетическом уравнении, обратная времени, раз мерность входит с константой скорости. В уравнение фотохимической 1-й стадии она появляется вместе с «концентрацией» фотонов, которая есть не что иное, как интенсивность излучения – энергия, доставляемая в реагирующую систему в единицу времени:
 (8.4) (8.4)
Скорость этой реакции не приводится к эффективному выражению степенного вида. Напротив, скорость родственного цепного процесса (H2 +Cl2 =HCl), приводится к более простой форме, и можно видеть, как отдельные стадии сложного цепного процесса формируют эффективную (наблюдаемую) энергию активации.
Отличительная черта большинства цепных процессов состоит в том, что участниками их промежуточных элементарных стадий являются активные частицы – свободные радикалы. Их образование происходит на стадиях зарождения цепи. После образования частиц продукта активные центры из зоны реакции исчезают на стадиях обрыва цепи.
Цепные неразветвлённые реакции-II.
Пример 2: Реакция Cl2 + H 2 = HCl .
Первая стадия - фотохимическое инициирование.
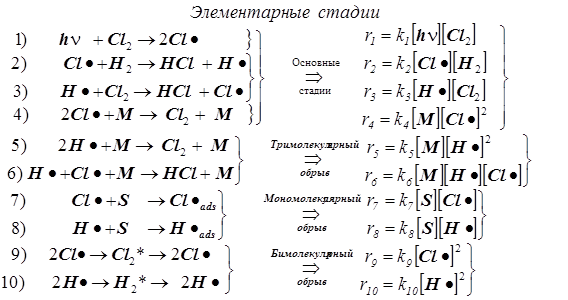
1) Стадия 1 –зарождение цепи.
2) Стадии (2, 3) - продолжение цепи, и вместе они образуют звено цепи.
Суммируя правые и левые части обоих уравнений 2 и 3, находим, что суммарное превращение, протекающее в звене цепи, является основной реакцией...
3) Стадия 4 предполагается основной элементарной реакцией обрыва в силу того, что с её помощью объясняется экспериментально наблюдаемый факт, по которому скорость реакции заметно уменьшается в присутствие примесей.
4) Полный набор стадий обрыва включает в себя и другие элементарные реакции:
тримолекулярные (4, 5, 6), мономолекулярные (7, 8), бимолекулярные (9, 10).
5) За суммарную скорость всей реакции ответственны стадии (1, 2, 3, 4).
6) Прочие стадии малосущественны, т.к. на результирующей скорости суммарной реакции обрыв мономолекулярный и бимолекулярный заметно не сказываются.
7) При выводе скорости r всего процесса используем два уравнения для квазистационарных концентраций свободных валентностей® радикальных частиц® атомов H• и Cl•:
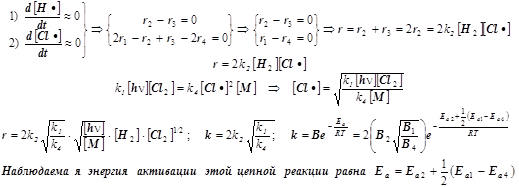
Этот сравнительно простой пример приводит к понятию эффективной энергии активации.
Она является результирующей характеристикой совокупности нескольких стадий сложной реакции. В условиях проведения реального эксперимента наблюдаемые эмпирические активационные параметры очень часто приходится использовать на первых этапах кинетических исследований, пока детали сложного многостадийного механизма превращения остаются ещё невыясненными.
8) Средняя длина цепи определяется как отношение скоростей образования продукта к скорости инициирования (в нашем случае фотохимического) цепи, т.е.: n=r/r1.
Важно! Обратиться к анализу энергий активации (см. книгу под ред.Краснова, стр. 607).
Энергии активации отдельных стадий примерно равны:
- при взаимодействии двух радикалов - нулю.
- при диссоциации молекул хлора - примерно половине энергии связи 238/2 кДж/моль.
- при взаимодействии атома хлора с молекулой водорода примерно 25 кДж/моль.
Получается энергия активации всей реакции, примерно равная 119/2 + 25 = 85 кДж/моль.
|