Частицы и коллектив. Неразличимость и симметрия
Коррекция статистических сумм для трансляции и ротации
Удобно термодинамические аргументы и определённые с их помощью функции состояния представить в виде единого массива взаимосвязанных переменных. Этот способ был предложен Гиббсом. Так, скажем, энтропия, которая по определению есть функция состояния, перемещается в разряд одной из двух естественных калорических переменных, дополняя в этом своём качестве температуру. И если в любых калорических процессах температура выглядит как интенсивная (силовая) переменная, то энтропия обретает статус экстенсивной переменной – тепловой координаты.
Этот массив всегда можно дополнить новыми функциями состояния или по необходимости уравнениями состояния, связывающими между собою аргументы. Число аргументов, минимально необходимое для исчерпывающего термодинамического описания системы, называется числом степеней свободы. Оно определяется из фундаментальных соображений термодинамики и может быть уменьшено благодаря различным уравнениям связи.
В таком едином массиве можно менять ролями аргументы и функции состояния. Этот приём широко используется в математике при построении обратных и неявных функций. Цель подобных логических и математических приёмов (достаточно тонких) одна – достижение максимальной компактности и стройности теоретической схемы.
Характеристические функции. Дифференциальные уравнения Массье
Массив переменных p, V, T удобно дополнить функцией состояния S. Между ними имеется два уравнения связи. Одно из них выражено в виде постулируемой взаимозависимости переменных f(p,V,T) =0. Говоря об "уравнении состояния", чаще всего именно эту зависимость имеют в виду. Однако любой функции состояния отвечает новое уравнение состояния. Энтропия по определению есть функция состояния, т.е. S=S(p,V,T). Стало быть, между четырьмя переменными существует две связи, и в качестве независимых термодинамических аргументов можно выделить всего два, т.е. для исчерпывающего термодинамического описания системы достаточно лишь двух степеней свободы. Если этот массив переменных дополнить новой функцией состояния, то наряду с новой переменной появляется и ещё одно уравнение связи, и, стало быть, число степеней свободы не увеличится.
Исторически первой из функций состояния была внутренняя энергия. Поэтому с её участием можно сформировать исходный массив переменных:
p, V, T, S, U
Массив уравнений связи в таком случае содержит функции вида
f(p,V,T) =0, 2) U=U(p,V,T), 3) S=S(p,V,T).
Эти величины можно менять ролями или формировать из них новые функции состояния, но в любом случае суть дела не изменится, и останутся две независимые переменные. Теоретическая схема не выйдет за пределы двух степеней свободы до тех пор, пока не встанет необходимость учесть новые физические эффекты и связанные с ними новые превращения энергии, и их окажется невозможно охарактеризовать без расширения круга аргументов и числа функций состояния. Тогда может измениться и число степеней свободы.
Состояние изотермической системы с неизменным объёмом целесообразно описывать посредством свободной энергии (функции Гельмгольца). В этих условиях она является характеристической функцией и изохорно-изотермическим потенциалом системы.
Посредством частного дифференцирования из неё далее можно извлечь прочие необходимые термодинамические характеристики, а именно:
 (1) (1)
Построить явный вид функции свободной энергии для некоторых относительно простых систем можно методом статистической термодинамики.
В любом естественно протекающем (самопроизвольном или свободном) процессе свободная энергия системы понижается. При достижении системой состояния термодинамического равновесия её свободная энергия достигает минимума и уже в равновесии далее сохраняет постоянное значение. Из равновесия систему можно вывести за счёт внешних сил, повышая её свободную энергию. Такой процесс уже не может быть свободным - он будет вынужденным.
Микроскопические движения частиц и в равновесии не прекращаются, и в системе, состоящей из огромного числа частиц и подсистем любой природы, возможно множество различных частных вариантов и комбинаций отдельных частей и внутри них, но все они не выводят систему из равновесия.
Термодинамическое равновесие в макросистеме совсем не означает, что и в её микроскопических фрагментах исчезают все виды движения. Напротив, равновесие обеспечивается динамикой именно этих микроскопических движений. Они-то осуществляют непрерывное выравнивание - сглаживание наблюдаемых макроскопических признаков и свойств, не допуская их выбросов и чрезмерных флуктуаций.
Основной целью статистического метода является установление количественной связи между характеристиками механических движений отдельных частиц, составляющих равновесный статистический коллектив, и усреднёнными свойствами этого коллектива, которые доступны для термодинамических измерений макроскопическими методами.
Цель состоит в том, чтобы на основании механических характеристик движений отдельных микроэлементов равновесного коллектива вывести количественные законы для термодинамических параметров системы.
Согласно методу Гиббса термодинамическая система это коллектив - совокупность очень большого числа элементов - однотипных подсистем.
Каждая подсистема в свою очередь может также состоять из очень большого числа иных ещё более мелких подсистем и в свою очередь может играть роль вполне самостоятельной системы.
Все естественные флуктуации внутри равновесной системы равновесия не нарушают, они совместимы с устойчивым макроскопическим состоянием огромного коллектива частиц. Они просто перераспределяют признаки отдельных элементов коллектива. Возникают разные микросостояния, и все они суть версии одного и того же наблюдаемого макросостояния.
Каждая отдельная комбинация состояний элементов коллектива порождает лишь одно из огромного множества возможных микросостояний макросистемы. Все они в физическом смысле равноценны, все приводят к одному и тому же набору измеримых физических параметров системы и отличаются лишь какими-то деталями распределения состояний между элементами …
Все микросостояния совместимы с макроскопическим - термодинамическим равновесием, и числовой разброс отдельных составляющих свободной энергии (её энергии и энтропии) является вполне обычным обстоятельством. Надо понимать, что разброс возникает за счёт непрерывного обмена энергией между частицами – элементами коллектива. У одних элементов она уменьшается, но при этом у других увеличивается.
Если система находится в термостате, то ещё непрерывно осуществляется обмен энергией и с окружающей средой. Происходит естественное энергетическое перемешивание коллектива, за счёт непрерывного обмена между микрочастицами коллектива. Равновесие постоянно поддерживается через тепловой контакт с внешним термостатом. Так в статистике чаще всего именуют окружающую среду.
Поступательная статистическая сумма (на 3 степени свободы) исправляется с учётом делокализации и неразличимости N частиц. Сумма состояний уже для коллектива образуется возведением молекулярной поступательной суммы состояний в степень N и результат уменьшается исключением всех идентичных ситуаций. Это достигается делением на число перестановок неразличимых частиц. Их N!. Это астрономически огромное число, и его вычисляют по приближённой формуле Стирлинга: N! =(2) 1/2(N/e) N "(N/e) N (см. пример в приложении в конце текста)
 ; (2) ; (2)
Дальнейшие несложные преобразования приводят к исправлению поступательной суммы состояний.
 ; (3) ; (3)
1) Вращательная статистическая сумма (на 2 степени свободы) должна быть исправлена с учётом симметрии и неразличимости состояний гомоядерной молекулы при её поворотах на 180o. Эта статистическая сумма сокращается на число симметрии . Для 2-х атомных гомоядерных молекул =2. Для вращения вокруг оси симметрии 3-го порядка =3. Частицы с осью симметрии более высокого порядка в газовой фазе встречаются уже крайне редко.
 ; (4) ; (4)
2) Отсюда можно получить приближённое выражение для статистической суммы и на 1 вращательную степень свободы.
 ; (5) ; (5)
3) Поступательное движение единственное непосредственно зависит от пространственных характеристик системы, и поэтому в статистические расчёты объём встраивается именно через поступательную статистическую сумму. Она одна непосредственно включает в себя объём и число частиц коллектива, и лишь с нею связана такая важная термодинамическая характеристика, как давление.
Удобно представить её в нескольких формах, вводя дополнительные обозначения для сомножителей:
 ; (6) ; (6)
Натуральный логарифм этой величины равен
 ; (7) ; (7)
Если не затрагивать электронных и ядерных характеристик движения и ограничиться лишь его механическими формами, то у одноатомного газа поступательная статистическая сумма совпадает с его результирующей суммой состояний.
 ; (8) ; (8)
 ; (9) ; (9)
Частное дифференцирование функции ln qt оставляет выражение
 ; (10) ; (10)
Последняя формула (10) хорошо известна уже из элементарной кинетической теории. Это уравнение состояния идеального газа, отнесённое к одной частице газа.
Давление – эффект коллективный и не следует понимать дело так, что удалось описать одну-единственную частицу. Речь идёт о "пробной - среднестатистической" частице. Как около всякого среднестатистического объекта изучения вокруг значений её механических параметров (импульса) существует разброс.
Переход от частицы к молю получается умножением результата слева на число Авогадро, и константа Больцмана заменяется универсальной газовой постоянной: R=kNA.
 ; (11) ; (11)
3.1) Отличие свободной энергии A от энергии Гиббса G вызвано также лишь поступательным движением. Энергия Гиббса, приходящаяся на одну частицу коллектива равна:
 ; (12) ; (12)
 ; (13) ; (13)
Выражение  отличается от статистической суммы поступательного движения тем, что в нём исчезло число e - основание натурального логарифма, словно бы частично было скомпенсировано одно из качеств делокализованной системы. Отсюда и верхний индекс loc этой немного изменённой поступательной суммы. отличается от статистической суммы поступательного движения тем, что в нём исчезло число e - основание натурального логарифма, словно бы частично было скомпенсировано одно из качеств делокализованной системы. Отсюда и верхний индекс loc этой немного изменённой поступательной суммы.
Умножая последнее выражение на число Авогадро, получаем мольный химический потенциал одноатомного газа.
3.2) Это же выражение получается и непосредственно частным дифференцированием мольной свободной энергии.
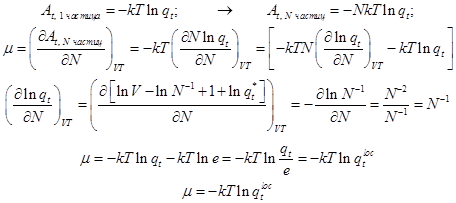 ; (14) ; (14)
Вывод в формулах (19.13) построен на мольной (коллективной) свободной энергии. Однако химический потенциал здесь также получен для одной частицы. Об этом говорит характер частного дифференицирования по числу частиц.
Учитывая остальные молекулярные движения, поступательную сумму состояний молекулы следует заменить полной молекулярной суммой, в которую вместе с поступательной суммой вклады дают и прочие движения.
 ; (15) ; (15)
Разумеется, эту формулу можно представить разными способами, в том числе, и в аддитивном виде как сумму вкладов отдельных движений.
4) Все приведённые окончательные формулы и величины (включая объём) пока что были отнесены к одной частице. Переход к коллективу частиц потребовался в тех двух случаях, где необходим явный учёт свойств коллектива. Во-первых, это было сделано при учёте неразличимости частиц в объёме вследствие поступательного движения. Во-вторых, при альтернативном выводе (3.2) химического потенциала из свободной энергии.
Во всех прочих случаях мы имели дело со свойствами одной пробной частицы – статистического элемента коллектива-системы.
5) Стандартная поступательная сумма и стандартный химический потенциал.
Принятая в термодинамике стандартизация состояний связана с давлением и скажется только на поступательной сумме состояний, поскольку лишь в ней представлен объём, и, следовательно, лишь она связана с давлением.
Её стандартное значение при некоторой температуре T получается при p=po =1 атм = 101325 Па.
Стандартный объём зависит от температуры:
Vo=RT/p o; (16)
Подставляя его в формулу (19.3) получаем выражение для стандартной поступательной суммы состояний.
 ; (17) ; (17)
Отсюда легко получается формула стандартного химического потенциала
 ; (18) ; (18)
Эти формулы играют основную роль в расчётах константы химических равновесий статистическим методом
6) Молекулярная сумма состояний.
Результирующая молекулярная сумма состояний образуется из молекулярных поступательной, вращательной, колебательной, электронной и ядерной сумм.
 ; (19) ; (19)
Поступательных степеней свободы движения у частицы всего три, и свойства этого вида движения отражены в поступательной сумме состояний. Вращательных и колебательных степеней свободы в многоатомной молекуле уже несколько. Вращения могут быть как молекулы в целом, так и связанные со взаимной подвижностью её отдельных структурных фрагментов.
Каждой степени свободы отвечает своя собственная сумма состояний.
Результирующие статистические суммы видов движений являются произведением статистических сумм по всем степеням свободы данного вида движения.
 ; (20) ; (20)
Мольные суммы состояний отличаются от молекулярных сумм степенью NA.
Мольные термодинамические функции получаются умножением молекулярных величин для пробной частицы на NA.
В нашем курсе мы не располагаем возможностью для применения расчётов для сложных многоатомных молекул, и потому эту тему далее не обсуждаем.
Теория предсказывает, что анализе химического равновесия в смеси идеальных газов вид молекулярных сумм состояний очень немного видоизменяется.
7) Химическая реакция в смеси идеальных газов.
Рассмотрим пробег химической реакции между несколькими частицами:
 (21) (21)
Следуя правилам IUPAC, стехиометрические коэффициенты представим в виде массива
ni Î (-a, - b,… +k, +m, …); (22)
Стандартное сродство (стандартное приращение энергии Гиббса) определяется через стандартные химические потенциалы реагентов и продуктов и изотермой Вант-Гоффа связано с безразмерной термодинамической константой равновесия Kp:
 ; (23) ; (23)
Это и есть основание для расчёта константы химического равновесия.
Применяя правило ИЮПАК для стехиометрических коэффициентов, формулу (21.3) легко записать в общем виде
 ; (24) ; (24)
Введём стандартные химические потенциалы  веществ i. веществ i.
 . (25) . (25)
Стандартное сродство реакции принимает вид
 ; (26) ; (26)
Сокращая на RT=NkT, получаем
 ; (27) ; (27)
|