«Электрохимические методы анализа и их современное аппаратурное оформление: обзор WEB–сайтов фирм–продавцов химико-аналитического оборудования»
Содержание
Введение
Глава 1. Классификация электрохимических методов
1.1 Вольтамперометрия
1.2 Кондуктометрия
1.3 Потенциометрия
1.4 Амперометрия
1.5 Кулонометрия
1.6 Другие электрохимические явления и методы
1.7 Прикладная электрохимия
Глава 2. Электрохимические методы анализа и их роль в охране окружающей среды
Глава 3. Приборы на основе электрохимических методов анализа
Глава 4. Обзор WEB – сайтов фирм – продавцов химико-аналитического оборудования
Литература
ВВЕДЕНИЕ
Электрохимические методы анализа (электроанализ), в основе которых лежат электрохимические процессы, занимают достойное место среди методов контроля состояния окружающей среды, так как способны обеспечить определение огромного числа как неорганических, так и органических экологически опасных веществ. Для них характерны высокая чувствительность и селективность, быстрота отклика на изменение состава анализируемого объекта, легкость автоматизации и возможность дистанционного управления. И, наконец, они не требуют дорогостоящего аналитического оборудования и могут применяться в лабораторных, производственных и полевых условиях. Непосредственное отношение к рассматриваемой проблеме имеют три электроаналитических метода: вольтамперометрия, кулонометрия и потенциометрия.
ГЛАВА 1. КЛАССИФИКАЦИЯ ЭЛЕКТРОХИМИЧЕСКИХ МЕТОДОВ
Электрохимические методы анализа (ЭМА) основаны на исследовании процессов, протекающих на поверхности электрода или в приэлектродном пространстве. Аналитическим сигналом служит электрический параметр (потенциал, сила тока, сопротивление и др.), функционально связанный с концентрацией определяемого компонента раствора и поддающийся правильному измерению.
Классификация ЭМА, предлагаемая ИЮПАК, за последние десятилетия претерпела определенные изменения, в нее внесены уточнения (пояснения) и дополнения.
Существенное внимание уделяется электрохимическим ячейкам и датчикам аналитического сигнала (электродным системам, различным электрохимическим сенсорам), именно эти первичные электрохимические преобразователи определяют аналитические возможности любого метода. В настоящее время не представляет проблемы самая совершенная и быстрая обработка сигнала от датчика, расчет статистических характеристик как исходного сигнала, так и результатов всего анализа в целом. Именно поэтому важно получить достоверный исходный сигнал, чтобы прокалибровать его в единицах концентрации.
Согласно общей классификации, предложенной
ИЮПАК, ЭМА подразделяются на методы, в которых возбуждаемый электрический сигнал постоянен или равен нулю и на методы, в которых возбуждаемый сигнал меняется во времени. Эти методы классифицируются следующим образом:
вольтамперометрические – voltammetry,
I
≠ 0;
E = f(t)
;
потенциометрические
– potentiometry, (
I
= 0);
амперометрические
– amperometry (
I
≠ 0;
E =
const);
хронопотенциометрические,
E = f(t)
;
I =
const;
импедансные,
или кондуктометрические
— измерения, использующие наложение переменного напряжения малой амплитуды; другие, комбинированные
(например, спектроэлектрохимические).
1.1 ВОЛЬТАМПЕРОМЕТРИЯ
ВОЛЬТАМПЕРОМЕТРИЯ - совокупность электрохимических методов исследования и анализа, основанных на изучении зависимости силы тока в электролитические ячейке от потенциала погруженного в анализируемый раствор индикаторного микроэлектрода, на котором реагирует исследуемое электрохимически активное (электроактивное) вещество. В ячейку помещают помимо индикаторного вспомогательный электрод со значительно большей поверхностью, чтобы при прохождении тока его потенциал практически не менялся (неполяризующийся электрод). Разность потенциалов индикаторного и вспомогательного электродов Е описывается уравнением Е = U — IR, где U - поляризующее напряжение, R-сопротивление раствора. В анализируемый раствор вводят в большой концентрации индифферентный электролит (фон), чтобы, во-первых, уменьшить величину R и, во-вторых, исключить миграционный ток, вызываемый действием электрического поля на электроактивные вещества (устар. - деполяризаторы). При низких концентрациях этих веществ омическое падение напряжения IR в растворе очень мало. Для полной компенсации омического падения напряжения применяют потенциостатирование и трехэлектродные ячейки, содержащие дополнительно электрод сравнения. В этих условиях
В качестве индикаторных микроэлектродов используют стационарные и вращающиеся - из металла (ртуть, серебро, золото, платина), углеродных материалов (напр., графит), а также капающие электроды (из ртути, амальгам, галлия). Последние представляют собой капилляры, из которых по каплям вытекает жидкий металл. Вольтамперометрия с использованием капающих электродов, потенциал которых меняется медленно и линейно, наз. полярографией (метод предложен Я. Гейровским в 1922). Электродами сравнения служат обычно электроды второго рода, напр. каломельный или хлоросеребряный (см. Электроды сравнения). Кривые зависимости I =f(E) или I =f(U) (вольтамперограммы) регистрируют специальными приборами - полярографами разных конструкций.
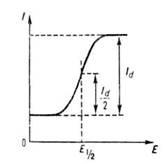
Вольтамперограммы, полученные с помощью вращающегося или капающего электрода при монотонном изменении (линейной развертке) напряжения, имеют вид, схематически представленный на рисунке. Участок увеличения тока наз. волной. Волны м. б. анодными, если электроактивное вещество окисляется, или катодными, если оно восстанавливается. Когда в растворе присутствуют окисленная (Ох) и восстановленная (Red) формы вещества, достаточно быстро (обратимо) реагирующие на микроэлектроде, на вольтамперограмме наблюдается непрерывная катодно-анодная волна, пересекающая ось абсцисс при потенциале, соответствующем окислительно-восстановитановительному потенциалу системы Ox/Red в данной среде. Если электрохимическая реакция на микроэлектроде медленная (необратимая), на вольтамперограмме наблюдаются анодная волна окисления восстановленной формы вещества и катодная волна восстановления окисленной формы (при более отрицат. потенциале). Образование площадки предельного тока на вольтамперограмме связано либо с ограниченной скоростью массопереноса электроактивного вещества к поверхности электрода путем конвективной диффузии (предельный диффузионный ток, Id
), либо с ограниченной скоростью образования электроактивного вещества из определяемого компонента в растворе. Такой ток называется предельным кинетическим, а его сила пропорциональна концентрации этого компонента.
Форма волны для обратимой электрохимические реакции описывается уравнением:

где R-газовая постоянная, Т-абсолютная температура, E1/2
-потенциал полуволны, т.е. потенциал, соответствующий половине высоты волны (Id
/2;). Значение E1/2
характерно для данного электроактивного вещества и используется для его идентификации. Когда электрохимические реакции предшествует адсорбция определяемого вещества на поверхности электрода, на вольтамперограммах наблюдаются не волны, а пики, что связано с экстремальной зависимостью адсорбции от потенциала электрода. На вольтамперограммах, зарегистрированных при линейном изменении (развертке) потенциала со стационарным электродом или на одной капле капающего электрода (устар. - осциллографич. полярограмме), также наблюдаются пики, нисходящая ветвь которых определяется обеднением приэлектродного слоя раствора электроактивным веществом. Высота пика при этом пропорциональна концентрации электроактивного вещества. В полярографии предельный диффузионный ток (в мкА), усредненный по времени жизни капли, описывается уравнением Ильковича:

где n-число электронов, участвующих в электрохимической реакции, С-концентрация электроактивного вещества (мМ), D-eгo коэффициент диффузии (см2
/с), время жизни ртутной капли (с), m-скорость вытекания ртути (мг/с). время жизни ртутной капли (с), m-скорость вытекания ртути (мг/с).
С вращающимся дисковым электродом предельный диффузионный ток рассчитывают по уравнению:

где S-площадь поверхности электрода (см2
), -круговая частота вращения электрода (рад/с), v-кинематическая вязкость раствора (см2
/с), F-число Фарадея (Кл/моль). -круговая частота вращения электрода (рад/с), v-кинематическая вязкость раствора (см2
/с), F-число Фарадея (Кл/моль).
Циклическая вольтамперометрия (вольтамперометрия с относительно быстрой треугольной разверткой потенциала) позволяет изучать кинетику и механизм электродных процессов путем наблюдения на экране осциллографической трубки с послесвечением одновременно вольтамперограмм с анодной и катодной разверткой потенциала, отражающих, в частности, и электрохимические реакции продуктов электролиза.
Нижняя граница определяемых концентраций Сн
в методах В. с линейной разверткой потенциала составляет 10-5
-10-6 М. Для ее снижения до 10-7
-10-8 М используют усовершенствованные инструментальные варианты - переменно-токовую и дифференциальную импульсную вольтамперометрию.
В первом из этих вариантов на постоянную составляющую напряжения поляризации налагают переменную составляющую небольшой амплитуды синусоидальной, прямоугольной (квадратноволновая вольтамперометрия), трапециевидной или треугольной формы с частотой обычно в интервале 20-225 Гц. Во втором варианте на постоянную составляющую напряжения поляризации налагают импульсы напряжения одинаковой величины (2-100 мВ) длительностью 4-80 мс с частотой, равной частоте капания ртутного капающего электрода, или с частотой 0,3-1,0 Гц при использовании стационарных электродов. В обоих вариантах регистрируют зависимость от U или Е переменной составляющей тока с фазовой или временной селекцией. Вольтамперограммы при этом имеют вид первой производной обычной вольтамперометрической волны. Высота пика на них пропорциональна концентрации электроактивного вещества, а потенциал пика служит для идентификации этого вещества по справочным данным.
Пики различных электроактивных веществ, как правило, лучше разрешаются, чем соответствующие вольтамперометрические волны, причем высота пика в случае необратимой электрохимической реакции в 5-20 раз меньше высоты пика в случае обратимой реакции, что также обусловливает повышенную разрешающую способность этих вариантов вольтамперометрии. Например, необратимо восстанавливающийся кислород практически не мешает определению электроактивных веществ методом переменно-токовой вольтамперометрии. Пики на переменно-токовых вольтамперограммах отражают не только электрохимические реакции электроактивных веществ, но и процессы адсорбции - десорбции неэлектроактивных веществ на поверхности электрода (пики нефарадеевского адмиттанса, устар. - тенсамметрич. пики).
Для всех вариантов вольтамперометрии используют способ снижения Сн
, основанный на предварительном электрохимическом, адсорбционном или химическом накоплении определяемого компонента раствора на поверхности или в объеме стационарного микроэлектрода, с последующей регистрацией вольтамперограммы, отражающей электрохимическую реакцию продукта накопления. Эту разновидность вольтамперометрии называют инверсионной (устар. название инверсионной В. с накоплением на стационарном ртутном микроэлектроде - амальгамная полярография с накоплением). В инверсионной вольтамперометрии с предварительным накоплением Сн
достигает 10-9
-10-11 М
. Минимальные значения Сн
получают, используя тонкопленочные ртутные индикаторные электроды, в т.ч. ртутно-графитовые, состоящие из мельчайших капелек ртути, электролитически выделенных на подложку из специально обработанного графита.
Для фазового и элементного анализа твердых тел используют инверсионную вольтамперометрию с электроактивными угольными электродами (т. наз. минерально-угольными пастовыми электродами). Их готовят из смеси угольного порошка, исследуемого порошкообразного вещества и инертного связующего, напр. вазелинового масла. Разработан вариант этого метода, который дает возможность проводить анализ и определять толщину металлических покрытий. В этом случае используют специальное устройство (прижимная ячейка), позволяющее регистрировать вольтамперограмму, пользуясь каплей фонового электролита, нанесенного на исследуемую поверхность.
Применение
Вольтамперометрию применяют: для количественного анализа неорганических и органических веществ в очень широком интервале содержаний - от 10-10
% до десятков %; для исследования кинетики и механизма электродных процессов, включая стадию переноса электрона, предшествующие и последующие химические реакции, адсорбцию исходных продуктов и продуктов электрохимических реакций и т. п.; для изучения строения двойного электрического слоя с, равновесия комплексообразования в растворе, образования и диссоциации интерметаллических соединений в ртути и на поверхности твердых электродов; для выбора условий амперометрического титрования и др.
1.2 Кондуктометрия
Кондуктометрия - основана на измерении электропроводности раствора и применяется для определения концентрации солей, кислот, оснований и т.д. При кондуктометрических определениях обычно используют электроды из одинаковых материалов, а условия их проведения подбирают таким образом, чтобы свести к минимуму вклад скачков потенциала на обеих границах раздела электрод/электролит (например, используют переменный ток высокой частоты). В этом случае основной вклад в измеряемый потенциал ячейки вносит омическое падение напряжения IR, где R – сопротивление раствора. Электропроводность однокомпонентного раствора можно связать с его концентрацией, а измерение электропроводности электролитов сложного состава позволяет оценить общее содержание ионов в растворе и применяется, например, при контроле качества дистиллированной или деионизованной воды. В другой разновидности кондуктометрии – кондуктометрическом титровании – к анализируемому раствору порциями добавляют известный реагент и следят за изменением электропроводности. Точка эквивалентности, в которой отмечается резкое изменение электропроводности, определяется из графика зависимости этой величины от объема добавленного реагента.
1.3 Потенциометрия
Потенциометрия - применяется для определения различных физико-химических параметров исходя из данных о потенциале гальванического элемента. Электродный потенциал в отсутствие тока в электрохимической цепи, измеренный относительно электрода сравнения, связан с концентрацией раствора уравнением Нернста. В потенциометрических измерениях широко применяются ионоселективные электроды, чувствительные преимущественно к какому-то одному иону в растворе: стеклянный электрод для измерения рН и электроды для селективного определения ионов натрия, аммония, фтора, кальция, магния и др. В поверхностный слой ионоселективного электрода могут быть включены ферменты, и в результате получается система, чувствительная к соответствующему субстрату. Отметим, что потенциал ионоселективного электрода определяется не переносом электронов, как в случае веществ с электронной проводимостью, а в основном переносом или обменом ионов. Однако уравнение Нернста, связывающее электродный потенциал с логарифмом концентрации (или активности) вещества в растворе, применимо и к такому электроду. При потенциометрическом титровании реагент добавляют в анализируемый раствор порциями и следят за изменением потенциала. S-образные кривые, характерные для такого типа титрования, позволяют определить точку эквивалентности и найти такие термодинамические параметры, как константа равновесия и стандартный потенциал.
1.4 Амперометрия
Метод основан на измерении предельного диффузионного тока, проходящего через раствор при фиксированном напряжении между индикаторным электродом и электродом сравнения. При амперометрическом титровании точку эквивалентности определяют по излому кривой ток – объем добавляемого рабочего раствора. Хроноамперометрические методы основаны на измерении зависимости тока от времени и применяются в основном для определения коэффициентов диффузии и констант скорости. По принципу амперометрии (как и вольтамперометрии) работают миниатюрные электрохимические ячейки, служащие датчиками на выходе колонок жидкостных хроматографов. Гальваностатические методы аналогичны амперометрическим, но в них измеряется потенциал при прохождении через ячейку тока определенной величины. Так, в хронопотенциометрии контролируется изменение потенциала во времени. Эти методы применяются главным образом для изучения кинетики электродных реакций.
1.5 Кулонометрия.
В кулонометрии при контролируемом потенциале проводят полный электролиз раствора, интенсивно перемешивая его в электролизере с относительно большим рабочим электродом (донная ртуть или платиновая сетка). Полное количество электричества (Q, Кл), необходимое для электролиза, связано с количеством образующего вещества (А, г) законом Фарадея:

где M – мол. масса (г/моль), F число Фарадея. Кулонометрическое титрование заключается в том, что при постоянном токе электролитически генерируют реактив, вступающий во взаимодействие с определяемым веществом. Ход титрования контролируют потенциометрически или амперометрически. Кулонометрические методы удобны тем, что являются по своей природе абсолютными (т.е. позволяют рассчитать количество определяемого вещества, не прибегая к калибровочным кривым) и нечувствительны к изменению условий электролиза и параметров электролизера (площади поверхности электрода или интенсивности перемешивания). При кулоногравиметрии количество вещества, подвергшегося электролизу, определяют взвешиванием электрода до и после электролиза.
Существуют и другие электроаналитические методы. В переменно-токовой полярографии на линейно меняющийся потенциал налагают синусоидальное напряжение малой амплитуды в широкой области частот и определяют либо амплитуду и фазовый сдвиг результирующего переменного тока, либо импеданс. Из этих данных получают информацию о природе веществ в растворе и о механизме и кинетике электродных реакций. В тонкослойных методах используются электрохимические ячейки со слоемэлектролита толщиной 10–100 мкм. В таких ячейках электролиз идет быстрее, чем в обычных электролизерах. Для изучения электродных процессов применяют спектрохимические методы со спектрофотометрической регистрацией. Для анализа веществ, образующихся на поверхности электрода, измеряют поглощение ими света в видимой, УФ- и ИК-областях. За изменением свойств поверхности электрода и среды следят с помощью методов электроотражения и эллипсометрии, которые основаны на измерении отражения излучения от поверхности электрода. К ним относятся методы зеркального отражения и комбинационного рассеяния света (рамановская спектроскопия), спектроскопия второй гармоники (фурье-спектроскопия).
1.6 Другие электрохимические явления и методы
При относительном движении электролита и заряженных частиц или поверхностей возникают электрокинетические эффекты. Важным примером такого рода является электрофорез, при котором происходит разделение заряженных частиц (например, молекул белка или коллоидных частиц), движущихся в электрическом поле. Электрофоретические методы широко используют для разделения белков или дезоксирибонуклеиновых кислот (ДНК) в геле. Электрические явления играют большую роль в функционировании живых организмов: они отвечают за генерацию и распространение нервных импульсов, возникновение трансмембранных потенциалов и т.д. Различные электрохимические методы применяются для изучения биологических систем и их компонентов. Представляет интерес и изучение действия света на электрохимические процессы. Так, предметом фотоэлектрохимических исследований являются генерация электрической энергии и инициация химических реакций под действием света, что весьма существенно для повышения эффективности преобразования солнечной энергии в электрическую. Здесь обычно используются полупроводниковые электроды из диоксида титана, сульфида кадмия, арсенида галлия и кремния. Еще одно интересное явление – электрохемилюминесценция, т.е. генерация света в электрохимической ячейке. Оно наблюдается, когда на электродах образуются высокоэнергетические продукты. Часто процесс проводят в циклическом режиме, чтобы получить как окисленную, так и восстановленную формы данного соединения. Взаимодействие их между собой приводит к образованию возбужденных молекул, которые переходят в основное состояние с испусканием света.
1.7 Прикладная электрохимия
Электрохимия имеет много практических применений. При помощи первичных гальванических элементов (элементов одноразового действия), соединенных в батареи, преобразуют химическую энергию в электрическую. Вторичные источники тока – аккумуляторы – запасают электрическую энергию. Топливные элементы – первичные источники тока, которые генерируют электричество благодаря непрерывной подаче реагирующих веществ (например, водорода и кислорода). Эти принципы лежат в основе портативных источников тока и аккумуляторов, применяющихся на космических станциях, в электромобилях и электронных приборах.
На электрохимическом синтезе основано крупнотоннажное производство многих веществ. При электролизе рассола в хлорщелочном процессе образуются хлор и щелочь, которые затем применяются для получения органических соединений и полимеров, а также в целлюлозно-бумажной промышленности. Продуктами электролиза являются такие соединения, как хлорат натрия, персульфат, перманганат натрия; электроэкстракцией получают важные в промышленном отношении металлы: алюминий, магний, литий, натрий и титан. В качестве электролитов лучше использовать расплавы солей, поскольку в этом случае, в отличие от водных растворов, восстановление металлов не осложняется выделением водорода. Электролизом в расплаве соли получают фтор. Электрохимические процессы служат основной для синтеза некоторых органических соединений; например, гидродимеризацией акрилонитрила получают адипонитрил (полупродукт в синтезе найлона).
Широко практикуется нанесение на различные предметы гальванических покрытий из серебра, золота, хрома, латуни, бронзы и других металлов и сплавов с целью защиты изделий из стали от коррозии, в декоративных целях, для изготовления электрических разъемов и печатных плат в электронной промышленности. Электрохимические методы используются для высокоточной размерной обработки заготовок из металлов и сплавов, особенно таких, которые не удается обрабатывать обычными механическими способами, а также для изготовления деталей сложного профиля. При анодировании поверхности таких металлов, как алюминий и титан, образуются защитные оксидные пленки. Такие пленки создают на поверхности заготовок из алюминия, тантала и ниобия при изготовлении электролитических конденсаторов, а иногда в декоративных целях.
Кроме того, на электрохимических методах часто базируются исследования коррозионных процессов и подбор материалов, замедляющих эти процессы. Коррозию металлических конструкций можно предотвратить с помощью катодной защиты, для чего внешний источник подсоединяют к защищаемой конструкции и аноду и поддерживают такой потенциал конструкции, при котором ее окисление исключается. Исследуются возможности практического применения других электрохимических процессов. Так, для очистки воды можно использовать электролиз. Весьма перспективное направление – преобразование солнечной энергии с помощью фотохимических методов. Разрабатываются электрохимические мониторы, принцип действия которых основан на электрохемилюминесценции.
Электрохимические методы анализа (электроанализ), в основе которых лежат электрохимические процессы, занимают достойное место среди методов контроля состояния окружающей среды, так как способны обеспечить определение огромного числа как неорганических, так и органических экологически опасных веществ. Для них характерны высокая чувствительность и селективность, быстрота отклика на изменение состава анализируемого объекта, легкость автоматизации и возможность дистанционного управления. И наконец, они не требуют дорогостоящего аналитического оборудования и могут применяться в лабораторных, производственных и полевых условиях. Непосредственное отношение к рассматриваемой проблеме имеют три электроаналитических метода: вольтамперометрия, кулонометрия и потенциометрия.
ГЛАВА 2. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА И ИХ РОЛЬ В ОХРАНЕ ОКРУЖАЮЩЕЙ СРЕДЫ
Краткая историческая справка
. Начало развития электроанализа связывают с возникновением классического электрогравиметрического метода (около 1864 года, У. Гиббс). Открытие М. Фарадеем в 1834 году законов электролиза легло в основу метода кулонометрии, однако применение этого метода началось с 30-х годов ХХ века. Настоящий перелом в развитии электроанализа произошел после открытия в 1922 году Я. Гейровским метода полярографии. Полярографию можно определить как электролиз с капающим ртутным электродом. Этот метод остается одним из основных методов аналитической химии. В конце 50-х - начале 60-х годов проблема охраны окружающей среды стимулировала бурное развитие аналитической химии, и в частности электроаналитической химии, включая полярографию. В результате были разработаны усовершенствованные полярографические методы: переменнотоковая (г. Баркер, Б. Брейер) и импульсная полярография (г. Баркср, А. Гарднср), которые значительно превосходили по своим характеристикам классический вариант полярографии, предложенный Я. Гейровским. При использовании твердых электродов из различных материалов вместо ртутных (используемых в полярографии) соотвстствуюшие методы стали называться вольтамперометрическими. В конце 50-х годов работы В. Кемули и 3. Кублика положили начало методу инверсионной вольтамперометрии. Наряду с методами кулонометрии и вольтамперометрии развиваются методы, основанные на измерении электродных потенциалов и электродвижущих сил гальванических элементов, - методы потенциометрии и ионометрии (см. [9]).
Вольтамперометрия
. Это группа методов, основанных на изучении зависимости силы тока в электролитической ячейке от величины потенциала, приложенного к погруженному в анализируемый раствор индикаторному микроэлектроду. Эти методы основаны на принципах электролиза; присутствующие в растворе определяемые вещества окисляются или восстанавливаются на индикаторном электроде. В ячейку помещают помимо индикаторного еще электрод сравнения со значительно большей поверхностью, чтобы при прохождении тока его потенциал практически не менялся. В качестве индикаторных микроэлектродов наиболее часто используют стационарные и вращающиеся электроды из платины или графита, а также ртутный капающий электрод, представляющий собой длинный узкий капилляр, на конце которого периодически образуются и отрываются небольшие ртутные капли диаметром 1-2 мм (рис. 1). Качественный и количественный составы раствора могут быть установлены из вольтамперограмм.

Рис. 4. Электрохимическая ячейка с капающим ртутным электродом: 1 - анализируемый раствор, 2 - ртутный капающий электрод, 3 - резервуар с ртутью, 4 - электрод сравнения
Вольтамперометрические методы, особенно такие чувствительные варианты, как дифференциальная импульсная полярография и инверсионная вольтамперометрия, постоянно используются во всех областях химического анализа и наиболее полезны при решении проблем охраны окружающей среды. Эти методы применимы для определения и органических и неорганических веществ, например для определения большинства химических элементов. С помощью метода инверсионной вольтамперометрии чаще всего решают проблему определения следов тяжелых металлов в водах и биологических материалах. Так, например, вольтамперометрические методики одновременного определения Си, Cd и РЬ, а также Zn и РЬ или ТI в питьевой воде включены в стандарт ФРГ.
Важным достоинством вольтамперометрии является возможность идентифицировать формы нахождения ионов металлов в водах. Это позволяет оценивать качество воды, так как разные химические формы существования металлов обладают разной степенью токсичности. Из органических веществ можно определять соединения, обладающие группами, способными к восстановлению (альдегиды, кетоны, нитро -, нитрозосоединения, ненасыщенные соединения, галогенсодержащие соединения, азосоединения) или окислению (ароматические углеводороды, амины, фенолы, алифатические кислоты, спирты, серусодержашие соединения). Возможности определения органических вешеств методом инверсионной вольтамперометрии существенно расширяются при использовании химически модифицированных электродов. Модификацией поверхности электрода полимерными и неорганическими пленками, включаюшими реагенты со специфическими функциональными группами, в том числе и биомолекулы, можно создать для определяемого компонента такие условия, когда аналитический сигнал будет практически специфичным. Использование модифицированных электродов обеспечивает избирательное определение соединений с близкими окислительно-восстановительными свойствами (например, пестицидов и их метаболитов) или электрохимически неактивных на обычных электродах. Вольтамперометрию применяют для анализа растворов, но она может быть использована и для анализа газов. Сконструировано множество простых вольтамперометрических анализаторов для работы в полевых условиях.
Кулонометрия
. Метод анализа, основанный на измерении количества электричества (Q), прошедшего через электролизер при электрохимическом окислении или восстановлении вещества на рабочем электроде. Согласно закону Фарадея, масса электрохимически превращенного вещества (Р) связана с Q соотношением:
P
=
QM
/
Fn
,
где М - молекулярная или атомная масса вещества, п - число электронов, вовлеченных в электрохимическое превращение одной молекулы (атома) вещества, р - постоянная Фарадея.
Различают прямую кулонометрию и кулонометрическос титрование. В первом случае определяют электрохимически активное вещество, которое осаждают (или переводят в новую степень окисления) на электроде при заданном потенциале электролиза, при этом затраченное количество электричества пропорционально количеству прореагировавшего вещества. Во втором случае в анализируемый раствор вводят электрохимически активный вспомогательный реагент, из которого электролитически генерируют титрант (кулонометрический титрант), и он количественно химически взаимодействует с определяемым веществом. Содержание определяемого компонента оценивают по количеству электричества, прошедшего через раствор при генерировании титранта вплоть до момента завершения химической реакции, который устанавливают, например, с помощью цветных индикаторов. Важно, чтобы при проведении кулонометрического анализа в исследуемом растворе отсутствовали посторонние вещества, способные вступать в электрохимические или химические реакции в тех же условиях, то есть не протекали побочные электрохимические и химические процессы.
Кулонометрию используют для определения как следовых (на уровне 109-10 R моль/л), так и весьма больших количеств веществ с высокой точностью. Кулонометрически можно определять многие неорганические (практически все металлы, в том числе тяжелые, галогены, S, NОз
, N02
) и органические вещества (ароматические амины, нитро- и нитрозосоединения, фенолы, азокрасители). Автоматические кулонометрические анализаторы для определения очень низких содержаний (до 104 %) газообразных загрязнений (S02' Оз, H2
S, NO, N02
) в атмосфере успешно зарекомендовали себя в полевых условиях.
Потенциометрия.
Метод анализа, основанный на зависимости paвновесного электродного потенциала Е от активности а компонентов электрохимической реакции: аА + ЬВ + пе = тМ + рР.
При потенциометрических измерениях составляют гальванический элемент из индикаторного электрода, потенциал которого зависит от активности одного из компонентов раствора, и электрода сравнения и измеряют электродвижущую силу этого элемента.
Различают прямую потенциометрию и потенциометрическое титрование. Прямая потенциометрия применяется для непосредственного определения активности ионов по значению потенциала (Е) соответствующего индикаторного электрода. В методе потенциометрического титрования регистрируют изменение Е в ходе реакции определяемого компонента с подходящим титрантом.
При решении задач охраны окружающей среды наиболее важен метод прямой потенциометрии с использованием мембранных ионоселективных электродов (ИСЭ) - ионометрия. В отличие от многих других методов анализа, позволяющих оценить лишь общую концентрацию веществ, ионометрия позволяет оценить активность свободных ионов и поэтому играет большую роль в изучении распределения ионов между их различными химическими формами. Для контроля объектов окружающей среды особенно важны методы автоматизированного мониторинга, и использование ИСЭ очень удобно для этой цели.
Одним из основных показателей при характеристике состояния окружающей среды является значение рН среды, определение которого обычно проводят с помощью стеклянных электродов. Стеклянные электроды, покрытые полупроницаемой мембраной с пленкой соответствующего электролита, используют в анализе вод и атмосферы для контроля загрязнений (NНз
, SO2
NO, NO2
, СO2
, H2
S). ИСЭ применяют обычно при контроле содержания анионов, для которых методов определения традиционно значительно меньше, чем для катионов. К настоящему времени разработаны и повсеместно применяются ИСЭ для определения F, СI , Вг , I , С1O4
, CN , S2
, NO] и NO2
, позволяющие определять перечисленные ионы в интервале концентраций от 10-6
до 10 -1
моль/л.
Одной из важных областей применения ионометрии являются гидрохимические исследования и определение концентрации анионов и катионов в разных типах вод (поверхностных, морских, дождевых). Другая область применения ИСЭ - анализ пищевых продуктов. Примером может служить определение NO –
3
и NO2
-
в овощах, мясных и молочных продуктах, продуктах детского питания. Создан миниатюрный ИСЭ в форме иглы для определения NO -
3
непосредственно в мякоти плодов и овощей.
Широко используется ионометрия и для определения различных биологически активных соединений и лекарственных препаратов. В настоящее время уже можно говорить, что существуют носители, селективные практически к любому типу органических соединений, а это означает что возможно создание неограниченного числа соответствующих ИСЭ. Перспективным направлением является использование ферментных электродов, в мембрану которых включены иммобилизованные ферменты. Эти электроды обладают высокой специфичностью, свойственной ферментативным реакциям. С их помощью, например, удастся определять ингибирующие холинэстеразу, инсектициды (фосфорорганические соединения, карбаматы) при концентрациях -1 нг/мл. Будущее метода связано с созданием компактных специфичных сенсоров, представляющих собой современные электронные устройства в cочетании с ионоселективными мембранами, которые позволят обходиться без разделения компонентов проб и заметно ускорят проведение анализов в полевых условиях.
Анализ сточных вод
Электроаналитические методы, которые обычно применяют в анализе воды для определения неорганических компонентов, часто уступают по чувствительности методам газовой и жидкостной хроматографии, атомно-адсорбционной спектрометрии. Однако здесь используется более дешевая аппаратура, иногда даже в полевых условиях. Основными электроаналитическими методами, применяемыми в анализе воды, являются вольтамперометрия,
потенциометрия и кондуктометрия.
Наиболее эффективными вольтамперометрическими методами являются дифференциальная импульсная полярография (ДИП) и инверсионный электрохимический анализ (ИЭА). Сочетание этих двух методов позволяет проводить определение с очень высокой чувствительностью - приблизительно 10-9
моль/л, аппаратурное оформление при этом несложно, что дает возможность делать анализы в полевых условиях. На принципе использования метода ИЭА или сочетания ИЭА с ДИП работают полностью автоматизированные станции мониторинга. Методы ДИП и ИЭА в прямом варианте, а также в сочетании друг с другом используют для анализа загрязненности воды ионами тяжелых металлов, различными органическими веществами. При этом часто способы пробоподготовки являются гораздо более простыми, чем в спектрометрии или газовой хроматографии. Преимуществом метода ИЭА является (в отличие от других методов, например, атомно-адсорбционной спектрометрии) также способность “отличать” свободные ионы от их связанных химических форм, что важно и для оценки физико-химических свойств анализируемых веществ, и с точки зрения биологического контроля (например, при оценке токсичности вод). Время проведения анализа иногда сокращается до нескольких секунд за счет повышения скорости развертки поляризующего напряжения.
Потенциометрия
с применением различных ионоселективных электродов используется в анализе воды для определения большого числа неорганических катионов и анионов. Концентрации, которые удается определить таким способом, 100
-10-7
моль/л. Контроль с помощью ионоселективных электродов отличается простотой, экспрессностью и возможностью проведения непрерывных измерений. В настоящее время созданы ионоселективные электроды, чувствительные к некоторым органическим веществам (например, алкалоидам), поверхностно-активным веществами и моющим веществам (детергентам). В анализе воды используются компактные анализаторы типа зондов с применением современных ионоселективных электродов. При этом в ручке зонда смонтирована схема, обрабатывающая отклик, и дисплей.
Кондуктометрия
используется в работе анализаторов детергентов в сточных водах, при определении концентраций синтетических удобрений в оросительных системах, при оценке качества питьевой воды. В дополнение к прямой кондуктометрии для определения некоторых видов загрязнителей могут быть использованы косвенные методы, в которых определяемые вещества взаимодействуют перед измерением со специально подобранными реагентами и регистрируемое изменение электропроводности вызывается только присутствием соответствующих продуктов реакции. Кроме классических вариантов кондуктометрии применяют и ее высокочастотный вариант (осциллометрию), в котором индикаторная электродная система реализуется в кондуктометрических анализаторах непрерывного действия.
Глава 3. Приборы на основе электрохимических методов анализа
Вольтамперометрический метод анализа сегодня считается одним из наиболее перспективных среди электрохимических методов, благодаря его широким возможностям и хорошим эксплутационным характеристикам.
Современная инверсионная вольтамперометрия, заменившая классическую полярографию, - высокочувствительный и экспрессный метод определения широкого круга неорганических и органических веществ, обладающих окислительно-восстановительными свойствами.
Это один из наиболее универсальных методов определения следовых количеств веществ, который с успехом применяется для анализа природных гео- и биологических, а также медицинских, фармацевтических и иных объектов.
Вольтамперометрические анализаторы делают возможным одновременное определение нескольких компонентов (до 4 - 5) в одной пробе с довольно высокой чувствительностью 10-8
- 10-2 М (а инверсионная вольтамперометрия - до 10-10
- 10 -9 М).
Наиболее перспективной в аналитической химии сегодня считается адсорбционная инверсионная вольтамперометрия, основанная на предварительном адсорбционном концентрировании определяемого элемента на поверхности электрода и последующей регистрации вольтамперограммы полученного продукта. Таким образом можно концентрировать многие органические вещества, а также ионы металлов в виде комплексов с органическими лигандами (особенно азот - и серусодержащими). При времени последовательного накопления 60 с и использовании дифференциального импульсного режима регистрации вольтамперограммы удается достичь пределов обнаружения на уровне 10-10
- 10-11
моль/л (10-8
- 10-9
г/л или 0,01 - 0,001 мкг/дм3
).
Вольтамперометрический комплекс анализа металлов «ИВА - 400МК» (НПКФ »Аквилон», Москва)
предназначен для анализа 30 элементов (Cu, Zn, Pb, Cd, As, Co, Ni, Cr, и др. металлы), чувствительность 0,1 - 10-3
мкг/дм3
.
Вольтамперометрический анализатор с УФ-облучением проб - ТА-1М (Томск)
, который, помимо ионов металлов, позволяет определять целый ряд органических соединений. Для прибора характерны следующие особенности:
· одновременный анализ в трех электрохимических ячейках,
· малая навеска пробы (0,1 - 1,0 г),
· низкая стоимость пробоподготовки и анализа.
В Санкт – Перебурге НФТ «Вольта»
выпускает вольтамперометрический комплекс «АВС-1» с вращающимся дисковым стеклоуглеродным электродом, который позволяет проводить анализ токсичных элементов в водах, пищевых продуктах и различных материалах. Предел обнаружения без концентрирования пробы составляет: 0,1 мг/л для Pb, 0,5 мг/л для Cd, 1,0 мкг/л для Cu. Объем пробы - 20 мл, время получения вольтамперной кривой не более 3 мин.
«АЖЭ - 12» (Владикавказ
) предназначен для экспресс-анализа ионного состава сточных и оборотных вод. В анализаторе используется традиционный ртутный электрод. Контролируемые компоненты - Cu, Zn, Pb, Cd, In, Bi, Tl, Sb, As, Co, Ni, Cr, CN-
, Cl-
, S2-
. Анализатор позволяет проводить измерения без пробоподготовки.
«Экотест-ВА» («Эконикс», Москва
) - портативный вольтамперометрический анализатор. Выполнен на современной микропроцессорной элементной базе и оснащен целым комплексом электродов - графитовым, стеклоуглеродным, микроэлектродами из благородных металлов и ртутным капающим электродом.
Приборы этой серии предназначены для определения металлов Cu, Zn, Pb, Cd, As, Bi, Mn, Co, Ni, Cr, а также ацетальдегида, фурфурола, капролактама и др. веществ в пробах питьевой, природной, сточной воды, почве, а после соответствующей пробоподготовки - в пищевых продуктах и кормах.
Возможности многих аналитических методов анализа вод могут значительно расшириться при применении в процессе пробоподготовки проточно-инжекционных концентрирующих приставок, работающих в автоматическом режиме - например, типа БПИ-М и БПИ-Н.
БПИ-М -
предназначен для автоматизированной пробоподготовки, в его состав входят микроколонки с высокоэффективными сорбентами. Производительность блока - 30-60 анализов в день при полной автоматизации процесса. Применение блока позволяет повысить чувствительность в 20 раз за минуту концентрирования. Блок наиболее хорошо работает в сочетании с атомно-абсорбционным детектированием, а также с рентгено-флуоресцентным, атомно-абсорбционным и электрохимическими методами.
БПИ-Н
- предназначен для концентрирования ионов металлов на избирательных сорбентах одновременно в четырех микроколонках с ДЭТАТА - сорбентом или на 4 тонкослойных сорбционных ДЭТАТА - фильтрах. Возможно его использование с рентгено-флуоресцентным, атомно-абсорбционным, атомно-эмиссионным, электрохимическим методами.
Анализаторы на основе вольтамперометрии
Приборы на принципе инверсной вольтамперометрии пользуются в последнее время особым спросом. В них селективность и высокая чувствительность сочетаются с простотой анализа.
В отношении определения элементного состава (например, по тяжелым металлам) эти приборы успешно конкурируют с атомно-абсорбционными спектрофотометрами, так как не уступают им по чувствительности, но значительно более компактны и дешевы (примерно в 5 - 10 раз). Они не требуют дополнительных расходных материалов, а также дают возможность одновременного экспрессного определения нескольких элементов.
Полярограф АВС - 1.1 (НТФ «Вольта» Спб).
Пределы обнаружения металлов без концентрирования пробы составляют (мг/л): Cd, Pb, Bi - 0,0001, Hg - 0,00015, Cu - 0,0005, Zn, Ni - 0,01. Стоимость 1700$.
Анализаторы на кондуктометрическом принципе предназначены для количественного определения суммарного содержания солей в воде. «ЭКА-2М» (Санкт-Петербург) измеряет солесодержание в широком интервале значений от 0,05 до 1000 мкСм/см (900$). «АНИОН», «МАРК», КСЛ (от 330 до 900 $), ХПК - анализаторы (750 $).
Газоанализаторы вредных веществ
Автоматический газоанализатор представляет собой прибор, в котором отбор проб воздуха, определение количества контролируемого компонента, выдача и запись результатов анализа проводится автоматически по заданной программе без участия оператора. Для контроля воздушной среды используют газоанализаторы, работа которых основана на различных принципах.
Термокондуктометрические газоанализаторы.
Принцип работы основан на зависимости теплопроводности газовой смеси от ее состава. Чувствительным элементом анализаторов этого типа являются тонкие платиновые нити. В зависимости от состава газа меняется температура чувствительного элемента, возникает ток, сила которого пропорциональна концентрации контролируемого компонента.
Кулонометрические газоанализаторы
.
Принцип работы основан на измерении предельного электрического тока, возникающего при электролизе раствора, который содержит определяемое вещество, являющееся электрохимическим деполяризатором. Анализируемая смесь, содержащая, например, диоксид серы, подается в электрохимическую ячейку. Он реагирует с иодом до образования сероводорода, который затем электороокисляется на измерительном электроде. Электрический ток является мерой концентрации определяемого компонента.
ГЛАВА 4. ОБЗОР
WEB
–САЙТОВ ФИРМ–ПРОДАВЦОВ ХИМИКО – АНАЛИТИЧЕСКОГО ОБОРУДОВАНИЯ
"AGILENT.RU"
Современное тестовое, измерительное и мониторинговое оборудование для разработки, изготовления и внедрения новых электронных приборов и технологий...
http://www.agilent.ru
"АКАДЕМЛАЙН", ЗАО, Москва
Поставляет широкую номенклатуру измерительного химико-аналитического оборудования...
http://www.academline.com/
"АКТАКОМ"
Зарегистрированная торговая марка АКТАКОМ объединяет в себе широкий спектр контрольно-измерительной аппаратуры мирового класса. Все лучшее от зарубежных и отечественных производителей...
http://www.aktakom.ru
"АНАЛИТПРИБОР"
Предлагает газоанализаторы
http://www.analytpribor.ru
"ВАТСОН", АО, Мытищи Московской обл.
Приборы и средства измерений;
http://www.watson.ru/
"ДИПОЛЬ", НПФ, Санкт-Петербург
http://www.dipaul.ru/
"ЕвроЛаб СПб", ООО, Санкт-Петербург
Приборы спектрального анализа, хроматографы.
http://www.eurolab.ru
"IZME.RU"
http://www.izme.ru/
"ИНСОВТ", ЗАО
Разработка и производство газоанализаторов
http://www.insovt.ru
"Институт информационных технологий", Минск, Беларусь
Специализируется на разработке и производстве измерительных приборов для волоконной оптики...
http://www.beliit.com/
"КИПАРИС", ООО, Санкт-Петербург
http://www.kiparis.spb.ru/
"КОНТИНЕНТ", Гомель
http://www.continent.h1.ru
"Контрольно-измерительные приборы и оборудование", Волгоград
http://www.oscilloscop.ru
"Контур", ИТЦ, ООО, Новосибирск
http://www.kip.ru/
"КрайСибСтрой", ООО, Красноярск
http://www.kipkr.ru/
"Крисмас+", ЗАО, Санкт-Петербург
http://www.christmas-plus.ru
"КУРС", ООО, Санкт-Петербург
http://www.kypc.spb.ru
"ЛЮМЭКС", Санкт-Петербург
http://www.lumex.ru/
"МЕТТЕК"
http://www.mettek.ru
"МЕТТЛЕР ТОЛЕДО"
http://www.mt.com
"МОНИТОРИНГ", НТЦ, Санкт-Петербург
http://www.monitoring.vniim.ru
"Научные приборы", ОАО, Санкт-Петербург
http://www.sinstr.ru
"НеваЛаб", ЗАО, Санкт-Петербург
http://www.nevalab.ru
"ОВЕН", ПО, Москва
http://www.owen.ru/
"ОКТАВА+", Москва
http://www.octava.ru/
"ОПТЭК", ЗАО, Санкт-Петербург
Разрабатывает и производит газоанализаторы и аналитические системы различного назначения для использования в экологии, промышленности и научных исследованиях...
http://www.optec.ru
"ПОЛИТЕХФОРМ", Москва
http://www.ptfm.ru
"Практик-НЦ", ОАО, Москва, Зеленоград
http://www.pnc.ru/
"ПРИБОРЫ И АНАЛИТИЧЕСКАЯ ТЕХНИКА"
Приборы для химического анализа.
http://www.zhdanov.ru/
"Сартогосм", ЗАО, Санкт-Петербург
http://www.sartogosm.ru
"Специал", ЗАО, Москва
http://www.special.ru
"ТКА"
http://www.tka.spb.ru/
"ТСТ", ЗАО, Санкт-Петербург
http://www.tst-spb.ru
"ЭКОПРИБОР", НПО, Москва
Предлагает газоанализаторы и газоаналитические системы...
http://ecopribor.ru
"ЭКОТЕХ", МСП, Украина
http://ecotech.dn.ua
"ЭКОТЕХИНВЕСТ", НПФ, Москва
http://ecotechinvest.webzone.ru
"Эксис", ЗАО, Москва, Зеленоград
http://www.eksis.ru/
"ЭЛИКС"
http://www.eliks.ru/
"ЭМИ", ООО, Санкт-Петербург
Производство оптических газоанализаторов, анализаторов нефтепродуктов.
http://www.igm.spb.ru
"ЭНЕРГОТЕСТ", ЗАО, Москва
http://www.energotest.ru, http://www.eneffect.ru
ХИММЕД
Аналитические приборы и хроматография
е
-mail: [email protected]
ЛИТЕРАТУРА
1. Гейровский Я., Кута Я., Основы полярографии, пер. с чеш., М., 1965;
2. Га л юс 3., Теоретические основы электрохимического анализа, пер. с польск., М., 1974;
3. Каплан Б. Я., Импульсная полярография, М., 1978;
4. Брайнина X. 3., Нейман Е. Я., Твердофазные реакции в электроаналитической химии, М., 1982;
5. Каплан Б. Я., Пац Р. Г., Салихджанова Р. М.-Ф., Вольтамперометрия переменного тока, М., 1985.
6. Плэмбек Дж. Электрохимические методы анализа. / Пер. с англ. М.: Мир, 1985. 496 с.
7. Краткая химическая энциклопедия. М.: Советская энциклопедия, 1964. Том 1. А–Е. 758 c.
8. Классификация и номенклатура электрохимических методов // Журн. аналит. химии. 1978. Т. 33, вып. 8. С. 1647–1665.
9. Recommended Terms, Symbols and Definitions for Electroanalytical Chemistry // Pure & Appl. Chem. 1979. Vol. 51. P. 1159–1174.
10. Об использовании понятия «химический эквивалент» и связанных с ним величин: Журн. аналит. химии. 1989. Т. 44, вып. 4. С. 762–764; Журн. аналит. химии. 1982. Т. 37, вып. 5. С. 946; Журн. аналит. химии. 1982. Т. 37, вып. 5. С. 947.
11. Нейман Е.Я. Терминология современной аналитической химии и ее формирование // Журн. аналит. химии. 1991. Т. 46, вып. 2. С. 393–405.
12. Представление результатов химического анализа (Рекомендации IUPAC 1994 г.) // Журн. аналит. химии. 1998. Т. 53. № 9. С. 999–1008.
13. Compendium of Analytical Nomenclature (Definitive Rules 1997). 3rd ed., IUPAC, Blackwell Science, 1998. 8.1–8.51 (Electrochemical Analysis).
|