ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТОМСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ» (ТГПУ)
Биолого-химический факультет
Кафедра органической химии
ЭЛЕКТРОХИМИЧЕСКОЕ ПОВЕДЕНИЕ ГЕРМАНИЯ
(Выпускная (дипломная) работа)
Исполнитель: Студентка 102 группы
Капустина Ю.А
Руководитель: д.н.х., профессор кафедры
органической химии
Гладышев В. П.
Работу студентки Капустиной Ю.А.
к защите допустить
Заведующий кафедрой органической химии,
д.х.н., профессор
Полещук О.Х.
Декан биолого-химического факультета
к.х.н., доцент химии Минич А.С.
Томск – 2005
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ
ГЛАВА 1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ГЕРМАНИЯ И ЕГО СОЕДИНЕНИЙ
ГЛАВА 2. ЭЛЕКТРОХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ГЕРМАНИЯ
2.1. Электродные потенциалы германия в водных растворах
2.2. Электроосаждение германия и его сплавов
2.3. Получение гидрида германия
2.4. Электрохимическое поведение соединений германия (II) и (IV)
2.5. Растворимость германия в ртути
ВЫВОДЫ
ЛИТЕРАТУРА
ВВЕДЕНИЕ
Германий является рассеянным элементом и распространен в природе только в виде соединений в различных минералах. Такие минералы встречаются редко и содержат мало Ge. Наиболее распространенные минералы германия – германит (Cu3
(Ge,Fe)S4
) - 6-10% и реньерит (Сu3
(Fe,Ge)S4
) – 5,5-7,7%. Содержание в земной коре 7,0 • 10-4
вес. % [1].
Германий содержится почти во всех силикатных породах, в нефти, угле, листьях, корнях некоторых растений, в золе морских водорослей, в некоторых минеральных водах, в различных микроорганизмах, в крови и некоторых органах человека.
В настоящее время германий еще не отнесен к жизненно важным элементам. Однако во многих растениях (в том числе и целебных: женьшень, алоэ, чеснок, бамбук) он сконцентрирован в значительных количествах. Анализ пищи животного и растительного происхождения показывает, что почти во всех ее видах германий содержится в количествах (более 3 мкг/г в томатном соке, бобах, рыбах), достаточных для постановки вопроса о его возможном значении, токсичности или инертности по отношению к организму человека и животных.
Раньше свойства германия как полупроводника не были известны и его получали в очень ограниченных количествах, главным образом для исследовательских целей. В настоящее время он получил широкое и разнообразное применение.
Металлический германий применяют для изготовления полупроводников, используемых в электронике и электротехнике, также применяют фотоэлементах и солнечных элементах. Основные преимущества германия перед другими полупроводниками заключаются, во-первых, в возможности сравнительно несложного получения его в виде полупроводникового материала с заданными свойствами (легкость химической и физической очистки от большинства примесей) и, во-вторых, в благоприятных электрофизических параметрах. Вследствие этого германий является одним из наиболее ценных материалов в современной полупроводниковой технике.
Имеются данные о стимуляции германийорганическими соединениями роста растений и экспериментальных животных, влиянии на заживлении ран и функциональную активность тромбоцитов.
Интенсивное развитие биоэлементорганической химии создало предпосылки для создания новых противоопухолевых препаратов на основе германийорганических соединений, которые выгодно отличаются по своим токсикологическим характеристикам. В США разрешено к применению первое германийорганическое соединение «спирогерман» для лечения рака молочной и предстательной железы, а также лимфосаркомы:
CH2
-CH2
CH2
-CH2
(C2
H5
)2
Ge C
CH2
-CH2
CH2
- N(CH2
)3
N(CH3
)2
С каждым годом растет число публикаций, посвященных синтезу германийорганических соединений, обладающих различными противоопухолевыми свойствами. Интерес к биологической активности германийорганических соединений возник лишь в последнее десятилетие. Это обусловлено как их малой токсичностью (LD50
>1500мг/кг), так и широким спектром биологического действия: препараты оказывают благоприятное действие при сердечно-сосудистых болезнях, хронических респираторных заболеваниях, старческой пневмонии, психоневрологических расстройствах, нарушении обмена веществ, некоторых формах аллергии, болезнях почек, печени, органов пищеварения, гипертонии и катаракте [2].
Для исследования и анализа соединений германия используют электрохимические методы, которые совершенствуются по настоящее время.
Целью работы является обзор и систематизация данных по электрохимическому поведению германия и его соединений.
В задачи исследования входило обобщение литературных данных по:
1. электроосаждению германия и его сплавов;
2. электрохимическому получению германа;
3. электрохимическому поведению Ge (II) и Ge (IV);
4. растворимости германия в ртути.
Практическая значимость работы. Результаты работы могут быть использованы при разработке метода синтеза германа и исследованию механизмов электрохимических реакций с участием германия.
1. Физико-химические свойства германия и его соединений
Свойства германия и его соединений рассмотрены в [1,3,4]
Германий – серебристо-белый металл. Полученный в виде тонкой пленки на подложке термическим разложением моногермана имеет темный буро-красный цвет. Кристаллическая решетка германия – кубическая гранецентрированная типа алмаза. Как и все вещества с такого рода кристаллическими решетками и гомеополярной связью, германий очень хрупок и при комнатной температуре легко превращается в порошок. Твердость металла по шкале Мосса примерно 6-6,5 (табл.1). Обычным методом вдавливания твердость германия определить не удается из-за хрупкости. Методом микротвердости для германия было найдено значение 385 кг/мм2
. Такая высокая твердость в сочетании с хрупкостью делает невозможным механическую обработку германия. С повышением температуры твердость его падает, и выше 650 C чистый германий становиться пластичным [3].
Таблица 1
Физические свойства германия
| Плотность при 25о
г/см3
|
5,32 -5,36 г/см3
|
| Твердость по шкале Мосса |
6,25 |
| Температура плавления |
937,2 о
С |
| Температура кипения |
2852-2960 о
С |
При плавлении германий уменьшается в объеме примерно на 5,6 % (подобно галлию и висмуту).
Более наглядно химическая активность металлического Ge показана на схеме:
на воздухе или в кислороде → GeO2
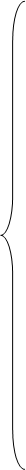 c водой →GeO2 c водой →GeO2
с галогенами →GeХ4
(Х = Cl-
, Br-
, I-
)
с серой → GeS2
и GeS
c cеленом → GeSe и GeSe2
с H2
S(газ)
→ GeS2
и GeS
с NH3(газ)
→ Ge3
N4
Ge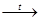 c HCl(газ)
→GeHCl3 c HCl(газ)
→GeHCl3
с HCl(конц.)
→GeCl4
с HNO3(конц.
) или H2
SO4(конц.)
→GeO2 · nH2
O
в царской водке → GeCl4
с фосфором → GeP
с мышьяком → GeAs и GeAs2
при расплавлении с перекисями, щелочами, нитратами или карбонатами щелочных металлов → растворимые германаты
При комнатной температуре германий не окисляется на воздухе. Выше 700о
С начинает взаимодействовать с кислородом воздуха. Выше температуры плавления испаряется и сгорает с образованием диоксида. При нагреве порошкообразного германия в токе азота или аргона, содержащие небольшие количества кислорода (менее 1 %), наблюдается интенсивная возгонка при 800 – 850о
C. Сублимат – оксид GeO с примесью азотистых соединений.
Вода совершенно не действует на германий. Он вполне устойчив по отношению к соляной кислоте и разбавленной серной кислоте. Концентрированная серная, а также плавиковая кислоты взаимодействуют с ним при нагревании. Азотная кислота окисляет его с поверхности. Растворяется в царской водке и 3%-ном щелочном растворе пероксида водорода. Под действием 10%-ного раствора едкого натра тускнеет, тогда как концентрированные растворы щелочей на него не действуют. Расплавленные щелочи, напротив, быстро растворяют германий.
Германий при нагревании легко  соединяется с галогенами и серой. В атмосфере аммиака при 600 – 700о
образуется нитрид германия. Водород и азот на него не действуют. С углеродом не взаимодействует, поэтому графит является наиболее часто применяемым материалом тиглей для плавки германия. Сплавляется почти со всеми металлами и с большинством из них дает довольно легкоплавкие эвтектики. Германий образует окиды, сульфиды, нитриды, гидриды, многочисленные интерметаллиды и металлоорганические соединения. соединяется с галогенами и серой. В атмосфере аммиака при 600 – 700о
образуется нитрид германия. Водород и азот на него не действуют. С углеродом не взаимодействует, поэтому графит является наиболее часто применяемым материалом тиглей для плавки германия. Сплавляется почти со всеми металлами и с большинством из них дает довольно легкоплавкие эвтектики. Германий образует окиды, сульфиды, нитриды, гидриды, многочисленные интерметаллиды и металлоорганические соединения.
В своих соединениях германий бывает двух- и четырехвалентным. Соединения германия (II) неустойчивы и легко окисляются до соединений германия(IV).
Оксид германия (II) выделяется в виде черных кристаллов путем нагревания Ge в токе CO2
при 800-900о
С:
Ge + СО2
→ GeO + СО
При 500о
С оксид германия разлагается на оксид германия (IV) и германий. При комнатной температуре GeO вполне устойчив как в сухом, так и во влажном воздухе. При нагревании в кварцевом тигле до температуры 800о
С образуется желтая глазурь. С Cl2
и Br2
GeО взаимодействует при 250о
С с образованием GeCl4
или GeBr4
и GeO2
. С соляной кислотой – при 175о
С с образованием GeHCl2
и Н2
О. Окисляется дымящей НNO3
, KMnO4
и хлорной водой, образуя, по-видимому, растворы диоксида германия. В воде практически не растворяется, но медленно растворяется в НCl и H2
SO4
, причем уже при комнатной температуре происходит частичное окисление кислородом воздуха двухвалентного германия до четырехвалентного [4].
Оксид германия (IV) существует в виде двух кристаллических модификаций - гексагональной, так называемой «растворимой» (альфа-GeO2
), и тетрагональной «нерастворимой» (бетта-GeО2
). Растворимая форма образуется при гидролизе тетрагалогенидов германия или германатов щелочных металлов. Нерастворимая форма образуется при прокаливании до 200-500о
С двуокиси германия (GeO2
), содержащей небольшие количества солей или гидроокисей щелочных металлов [3]. Свойства GeO2
представлены в таблице 2.
Таблица 2
| Растворимая |
Нерастворимая |
Стекловидная |
| g, г/мл, 25о
С |
6,239 |
4,228 |
3,637 |
| Tпл
, о
С |
1116 |
1086 |
- |
| Tкип
, о
С |
1870 |
- |
- |
| Растворимость, г/л |
4,53 (25о
С) |
0,0023 (25о
С) |
5,184 (30о
С) |
| Действие HF |
растворяет |
Почти не действует |
Легко растворяет |
| Действие HСl |
растворяет |
Почти не действует |
Легко растворяет |
| Действие 5N NaOH |
растворят |
Растворяет очень медленно |
_ |
Свойства диоксида германия
GeO2
+ 6HF = H2
GeF6
+ 2H2
O
GeO2
+ 4HCl(конц)
= GeCl4
+ 2H2
O
GeO2
+ 2NaOH = Na2
GeO3
+ H2
O
Винная, щавелевая и ряд других органических кислот растворяют оксид германия (IV).
При нагревании до 1000-1100о
С GeO2
практически не испаряется и не диссоциирует на Ge и O2
или GeO2
и ½ О2
. В парах происходит диссоциация
GeO2(газ)
⇆ GeO(газ)
+ ½ O2
При 900-1100о
С равновесие сильно сдвинуто вправо.
Помимо кристаллических модификаций GeO2
существуют в виде аморфной кристаллической массы, растворимой в воде. Эта масса образуется, если резко охладить расплав оксида германия (IV).
Гидроксид германия(II) имеет цвет от желтого до красно-бурого в зависимости от способа получения и степени гидратации. Растворяется в галоидоводородных кислотах с образованием комплексных галогенидов двухвалентного германия. Обладает слабыми основновными свойствами и совсем не имеет кислотных свойств [3]
Германий образуют с водородом соединения типа Gen
H2n+2
, а также GeH2
, (GeH2
)x
, GeH и (GeH)x
(гидриды). Соединения типа GenH2n+2
по аналогии с углеводородами могут быть названы насыщенными германоводородами (германами), а остальные гидриды – ненасыщенными германоводородами (герменами).
Гидрид германия (моногерман), GeH4
, получают действием цинка на сернокислый раствор двуокиси германия. Вместо цинка можно применять магний или амальгаму натрия или вести восстановление щелочного раствора германата натрия водородом, выделяющимся при действии щелочи на металлический алюминий. Во всех этих реакциях кроме GeH4
образуются в небольшом количестве и его гомологи. Весьма удобно получать германоводороды взаимодействием германида магния (Mg2
Ge) c разбавленной соляной кислотой. Весьма чистый GeH4
получается в результате действия газообразного GeCl4
на LiAlH4
. Смесь гидридов получается так же в результате взаимодействия германида магния с бромистым аммонием в жидком аммиаке при температуре -40о
С.
Mg2
Ge + 4HCl(разб)
= GeH4
+ 2MgCl2
GeCl4
+ LiAlH4
= GeH4
+LiCl + AlCl3
Mg2
Ge + 4NH4
Br = GeH4
+ 2MgBr2
+ 4NH3
Моногерман, напоминающий по свойствам аналогичные соединения кремния и углерода, - бесцветный газ, устойчивый на воздухе. При нагревании и длительном хранении разлагается на германий и водород. При термическом разложении, подобно гидридам мышьяка и сурьмы, образует германиевое зеркало. С водой не реагирует.
Дигерман, Ge2
H6
, - бесцветная жидкость, затвердевающая при -109о
С, температура кипения 29о
С, выше 220о
С разлагается, неустойчив в воде и растворам щелочей уже на холоде.
Тригерман, Ge3
H8
, - бесцветная жидкость с плотностью 2,20 г/см3
, температура затвердевания – 105,6о
С, температура кипения 110,5о
С. Выше 194о
С разлагается.
Дисульфид германия GeS2
существует в двух модификациях: кристаллической, которая получается при нагревании двуокиси германия в парах серы или токе сероводорода, и аморфной, получаемой при действии сероводорода на сильнокислые растворы GeO2
. Образуется так же при разложении тиогерманата аммония серной кислоты и при нагревании двуокиси германия с пиритом.
GeO2
+ 2H2
S = GeS2
+ 2H2
O
Аморфный GeS2
– порошок белого цвета, плохо смачивающийся водой, кристаллический представляет собой чешуйки с перламутровым блеском и жирными на ощупь. В парах GeS2
заметно диссоциираван на GeS и S2
.
Дисульфид германия в воде на холоду медленно гидролизуется, гидролиз полный при кипячении. Соединение устойчиво к действию концентрированных соляной и серной кислот, а концентрированной азотной кислотой окисляется до GeO2
и SO2
. Растворяется в щелочах, особенно в присутствии водорода, аммиаке, в растворах сернистого аммония и сульфидов щелочных металлов. Из таких растворов были получены тиогерманаты типа Na6
Ge2
S7
· 9H2
O. Тиогерманаты щелочных металлов и аммония в воде растворимы, тиогерманаты тяжелых металлов – нерастворимы.
Моносульфид германия получается нагреванием смеси GeS2
и металлического германия, нагреванием GeS2
в токе водорода при 700-800о
С и осаждением H2
S из солянокислого раствора GeCl2
. GeS образуется так же во время сжигания при недостатке кислорода органических или углистых веществ, содержащих германий и серу. В зависимости от способов моносульфид получается в виде черных кристаллов (g = 4,012 г/мл), аморфного коричневого или темно-красного порошка (g = 3,31 г/мл).
Аморфная и кристаллическая модификации сходны по химическим свойствам, хотя последняя и характеризуется меньшей реакционной способностью.
При нагревании на воздухе выше 350о
С моносульфид окисляется до GeO2
и SO2
GeS + 2O2
= GeO2
+ SO2
восстанавливается водородом до металлического германия
GeS + H2
⇆Ge(тв)
+ H2
S
При нагревании в газообразном хлористом водороде образует германохлороформ (GeHCl4
) и сероводород. Кристаллический моносульфид трудно растворим в кислотах, щелочах, в растворах аммиака и сульфида аммония, а аморфный - легко растворим в соляной кислоте с выделением сероводорода, в разбавленной азотной кислоте при нагревании до двуокиси и растворах едких щелочей и сульфидов щелочных металлов.
Галогениды. Наиболее изучены галогениды двух- и четырехвалентного германия. Существование моногалогенидов установлено, но не они не выделены. Дигалогениды – хлорид, бромид, иодит – легко гидролизующиеся на воздухе вещества с сильными восстановительными свойствами. При нагревании диспропорционируют на GeHal4
и Ge. Растворяются в соответствующих галогенводородных кислотах с образованием комплексных кислот HGeHal3
.
Тетрагалогениды германия – неполярные соединения, растворимые в органических растворителях, легко гедролизующиеся водой с образованием двуокиси германия.
Германиевые кислоты. Диоксид германия растворяется в воде. Его растворы в воде имеют слабокислую реакцию из-за образования метагерманиевой кислоты H2
GeO3
. В растворах существует равновесие между анионами метагерманиевой кислоты и полимеризованными ионами пентагерманиевой и гептагерманиевой кислот
HGeO3-
⇆ Ge5
O11
2-
⇆ H2
Ge7
O16
2-
При pH = 6 в растворах присутствуют в основном неполимеризованные ионы, при pH > 11 – обнаруживаются ионы Ge(OH)6
2-
, при pH = 1 – наряду с анионами германиевых кислот присутствуют и катионы германия. C повышением концентрации германия равновесие сдвигается вправо. Пентагерманиевая кислота более сильная, чем метагерманиевая.
Формулы гидратированного оксида германия (IV) и германиевых кислот можно представить следующим образом:
GeO2
·H2
O, или H2
GeO3
– метагерманиевая кислота
GeO2
· 2H2
O, или H4GeO4
– ортогерманиевая кислота
2GeO2
· H2
O, или H2
Ge2
O5
– дигерманиевая кислота
4GeO2
· H2
O, или H2
Ge4
O9
– тетрагерманиевая кислота
5GeO2
· H2
O, или H2
Ge5
O11
– пентагерманиевая кислота
7GeO2
· 2H2
O, или H4
Ge7
O16
– гептагерманиевая кислота
2.ЭЛЕКТРОХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ГЕРМАНИЯ
2.1. Электродные потенциалы германия в водных растворах
Нормальные обратимые потенциалы германия не измерены. Из-за исключительно малой растворимости его соединений в воде и вследствие необратимых химических реакций, протекающих на поверхности германия, удается экспериментально определить лишь стационарные потенциалы [5].
Вопрос о месте германия в ряду напряжений послужил предметом широкой дискуссии. Так, Холл обнаружил, что германий вытесняет Ag из AgNO3
, но не вытесняет Sn и Bi из растворов их солей. Измеренный им в 1NZnSO4
и 1NH2
SO4
стационионарный потенциал Ge оказался равным 0,28 В (н.в.э). В противоположность этому, Эйнеке считает, что германий находится в ряду напряжений между Zn и Sn и должен вытеснять из растворов его солей. Джеф помещает его ниже водорода, а Ленд – между серебром и медью. Все авторы отмечают плохую воспроизводимость своих экспериментальных результатов. Причины такого расхождения в значительной степени связаны с тем, что величина германиевого электрода сильно зависит от количества растворенного в воде кислорода. Удаление кислорода из раствора электролита изменяет стационарный потенциал от -0,05 В до -0,15 В (н.в.э.) [5].
Теоретический расчет потенциалов по изменению свободной энергии выполнен Ловречеком и Бокрисом. Полученные ими значения потенциалов электрохимических реакций приводятся в таблице 2.1 [4,5]
На рис.2.1 представлена диаграмма E-pH для германия и его соединений, а в таблице 2.1 даны равновесные потенциалы систем германий-соединения Ge (II) и Ge (IV) по данным [6]
Экспериментальные исследования Ловречека и Бокриса, выполненные в тщательно очищенных от следов примесей растворах, показали, что стационарный потенциал германия практически не зависит от типа проводимости кристалла, его кристаллографической ориентации, а так же от содержания растворенного в электролите водорода. Стационарный потенциал германиевого электрода чрезвычайно чувствителен к следам содержащегося в электролите кислорода, а также к pH раствора [5]. При увеличении pH стационарный потенциал германиевого электрода приобретает более отрицательное значение.
Детальное изучение влияния различных факторов (перемешивание, температуры, pH и т.д) на потенциал германиевого электрода, а также экспериментальное определение тока саморастворения и токов обмена отдельных сопряженных реакций позволили заключить, что стационарный потенциал германия определяется двумя процессами:
анодной реакцией
Ge + H2
ODGeOкоричн.
+ 2Н+
+ 2e
Ge + H2
OD GeOжелт
.
+ 2Н+
+ 2e
и катодной реакцией выделения водорода. При этом в кислом растворе (pH от 0 до 4) анодная реакция проходит с образованием GeOкоричн.
, а в растворе с pH 6-12 с образованием GeOжелт
. При очень высоких значениях pH ( ≥ 12,5) возможно протекание также анодной реакции, в результате которой образуются соединения четырехвалентного германия [5].
2.2. Электроосаждение германия и его сплавов
Германий стоит в ряду напряжений правее цинка, а перенапряжение водорода на нем примерно такое же, как на цинке. Поэтому остается непонятным, почему путем электролиза водных растворов, содержащих германий, не удается получить металлический германий в виде плотного осадка с высоким выходом. Неясно также, почему в результате этого процесса сравнительно легко выделяются сплавы германия с некоторыми элементами и почему получению этих сплавов благоприятствует присутствие веществ, образующих с германием комплексы.
Первые опыты по осаждению Ge были проведены Винклером, открывшим этот элемент. Ему удалось осадить Ge на платиновом катоде в виде тонкой пленки. Электролитом служил водный раствор виннокислого аммония, содержащий некоторое количество солей германиевых кислот. Холл получил тонкий осадок Ge на медном катоде при электролизе 0, 025 М раствора GeO2
в 3 N КОН при i = 0,2 А/дм2
и 70-90о
С. Однако уже после образования тонкой пленки выделение Ge прекращалось и начиналось выделение водорода. Автор объясняет это тем обстоятельством, что на меди потенциал выделения водорода выше, чем потенциал осаждения Ge, а на германии, наоборот, процесс выделения водорода протекает легче [5].
Тонкие пленки Ge осаждаются из кислых растворов, содержащих соли германиевой кислоты и фосфаты, тартраты или оксалаты щелочных металлов.
Хорошие результаты дает электролит состава: 10 г KH2
PO4
+ 0,5 г Na2
GeO3
в 150 см3
раствора (t = 70o
C; перемешивание 600 об/мин). Однако и в данном случае удается осадить лишь в виде тонкой черной пленки, плохо сцепленной с основой. Аналогичные по характеру осадки получались из щелочных электролитов, содержащих K2
C2
O4
, KOH и Na2
GeO3
в широких интервалах концентраций [4] (табл. 2.2).
Таблица 2.2
Электроосаждение германия и его сплавов [4]
Электролит
г/л
|
Условия осаждения |
Примечание |
| 1. |
0,025 н. GeO2
в 3М KOH
|
i=0,2 А/дм2
|
После образования тонкой плёнки выделение Ge прекращается и начинается выделение H2
|
| 2. |
а). 10г KH2
PO4
0,5г Na2
GeO3
б).70г KH2
PO4
3,5г Na2
GeO3
|
T=700
C
|
Тонкая чёрная плёнка, плохо пристающая к поверхности электрода |
| 3. |
40г KOH
12г Na2
S
20г CeS2
|
T=300
C
i=2,5 А/дм2
|
В виде тонкой плёнки |
| 4. |
0,20г Sn2+
0,105г GeO2
10г K2
C2
O4
25г KOH
|
T=85-900
C
Kat - лужный медный стержень
|
Сплав Ge-Sn в виде плотных чешуек |
| 5. |
3г/л GeO2
7г/л CuCN
40г/л KCN
40г/л KOH
|
T=250
C
i=2 А/дм2
|
Плёнка в виде Cu3
Ge. Плёнка плотно прирастает к Cu, Ni, Zn – катодам. Выход Cu3
Ge по току – 90-95% |
| 6. |
5г/л (NH4
)2
C2
O4
4г/л (NH4
)2
SO4
20см3
NH4
OH (30%)
Ni+
GeO2
|
Ge:Ni ≤ 5:1 присутствие ионов аммония |
Сплав Ge-Ni. Выход Ge по току 60%. При малых значениях исходных отношений Ge:Ni величина их в сплаве несколько больше, чем в растворе. С повышением T0
C и i состав сплавов не изменяется, а физические свойства улучшаются. |
| 7. |
(NH4
)C2
O4
NH4
Cl
NaS2
O5
(0,2-0,3г)-добавка
|
Сплав Co-Ge. Выход Ge по току 50%.. |
| 8. |
180г NaOH
100г Na2
S
10г Sb2+
5г Ge2+
|
T=600
C
i=1 А/дм2
|
Сплав Ge-Sb высокачественное легко полирующееся покрытие |
| 9. |
а). 0,5г GeI4
этиленгликоль
б). 2,5г GeI4
этиленгликоль
в). 5г GeI4
этиленгликоль
|
i=2,5 А/дм2
Анод - Ge
T=100-1500
С
|
Выход Ge по току:
а). 10,8%
б). 47%
в). 43,5%
Если концентрация GeI4
больше 5г, происходят потери от испарения, следовательно температура выше1500
не желательно поднимать
|
| 10. |
50-55г GeCl4
70-100г
сульфаминовая кислота 70-100г
этиленгликоль – до 1л
|
T=59-600
C
i=10 А/дм2
An – графит
Kat – медная фольга
|
Поскольку из водных растворов Ge осаждается только в виде очень тонких пленок, внимание исследователей привлекли неводные электролиты. Толстые, хорошо сцепленные с основой осадки с высоким выходом по току, удалось получить из растворов GeI4
в этиленгликоле, диэтиленгликоле и глицерине при температатурах 60-150о
С. Электролит содержит от 0,5 до 5 г GeI4
на 50 см3
этиленгликоля. Если концентрация GeI4
выше 5 г/л, становятся заметными потери от испарения (выше 150о
С поднимать температуру ванны нежелательно из-за быстрого испарения этиленгликоля). В качестве анода использовался германий [4,5]
Предложен электролит, содержащий GeCl4
и этиленгликоль, в который с целью повышения стабильности электролита дополнительно вводят сульфаминовую кислоту. Процесс осаждения проводят при 59-60о
С и i = 10 А/дм2
. В качестве анода используется графит, а в качестве катода- медная фольга. Катод взвешивают [4].
Из растворов GeCl4
в этиленгликоле осадки хорошего качества получаются при содержании H2
O≤0,3 мл на 1 мл растворителя. С увеличением влажности растворителя осадки темнеют, и выход германия по току уменьшается. Результаты также зависят от концентрации GeCl4
и температуры. При содержании GeCl4
, равном 1-1,4 об.% и 18-60о
С, образуется лишь небольшое количество черного мажущего осадка и обильно выделяется водород. С увеличением концентрации GeCl4
улучшается свойство осадка и повышается его чистота, но количество его не изменяется, а с повышением температуры - увеличивается и выход по току. С другой стороны, с повышением концентрации GeCl4
и температуры увеличивается испарение тетрахлорида. В оптимальных условиях (3-4 об.% GeCl4
; 50-60о
С; 0,2 А/дм2
, медные электроды) выход Ge по току составляет примерно 0,5% [5].
Лучшие результаты получаются, если в качестве растворителя применять меньше поглощающий влагу пропиленгликоль. При содержании в пропиленгликоле GeCl4
, равном 7 об.%, 59-60о
С и 0,2-0,4 А/дм2
образуется блестящий осадок германия толщиной до 120 мк и выход по току около 0,8% [5].
Гораздо легче, чем металлический германий, при электролизе водных растворов выделяются сплавы его с медью, серебром, кобальтом, никелем, оловом, сурьмой, галлием. Для осаждения сплава Cu-Ge (соединение Cu3
Ge) предложен электролит следующего состава: 3 г/л GeO2
, 7 г/л CuCN, 40г/л KOH (t = 25o
C, i = 2 А/дм2
). Если содержание CuCN в электролите таково, что отношение Cu/Ge < 3,9, то никакого осадка не образуется; если Cu/Ge > 11,9, то на катоде осаждается чистая медь. Чистая медь осаждается из данного электролита также и в том случае, если концентрация GeO2
настолько мала, что отношение Cu/Ge становится больше 10.
Сплав Cu3
Ge можно получить также из нейтральных и щелочных виннокислых ванн. Сплав германия с серебром был осажден из цианистой ванны, в которой на 5 атомов серебра приходится 1 атом германия. Содержание германия в осадке 12% [7].
Сплав Ge-Ni (максимум 60% Ge) осаждается из электролита, в котором содержание соли никеля и оксида германия (IV) можно варьировать в широких пределах. Кроме этих солей, электролит содержит 5г/л (NH4
)2
C2
O4
, 4г/л (NH4
)2
SO4
, 20см3
NH4
OH (30%). Аналогичные результаты отмечаются при электролизе аммиачных винно- или лимоннокислых растворов. Очевидно, необходимым условием выделения сплавов Ge-Ni является присутствие ионов аммония, поскольку ни никель, ни германий не осаждаются электролитически из растворов оксалатов, тартратов или цитратов щелочных металлов. Медленно осаждаются сплавы германия с никелем из пирофосфатных сред [4].
В работе [7] приведены результаты исследования систем CH3
OH – H2
O и CH3
OH – GeCl4
методами денсиметрии, вискозиметрии, кондуктометрии и вольтамперометрии при 25о
С. Показано, что смешанный растворитель CH3
OH – H2
O обладает удовлетворительной электрохимической устойчивостью в широком диапазоне поляризации и может быть использован для приготовления растворов электролитического германирования.
Методом вольтамперометрии исследованы электродные процессы в системе GeCl4
-(CH2
OH)2
– H2
O (I) на Ni – катоде (с германиевым анодом). Показано, что смешанный растворитель (CH2
OH)2
-H2
O обладает высокой электрохимической устойчивостью в широком диапазоне поляризации и поэтому может применять в качестве растворителя для приготовления раствора германирования [8].
Пока еще не ясно, почему из водных растворов нельзя получить толстые осадки Ge. Считать причиной этого низкую величину перенапряжения водорода на Ge неправильно, так как в настоящее время установлено, что перенапряжение водорода на Ge велико и близко по своему значению к величине перенапряжения на цинке и кадмии. Вопрос о механизме электроосаждения германия остается открытым и требует своего решения.
2.3. Получение гидрида германия.
Одним из перспективных методов получения германия высокой частоты является гидридный метод, основанный на синтезе германа, его глубокой очистке и термическом разложении.
Химические методы получения германа обладают рядом недостатков, основным из которых является внесение примесей в систему с реагентами-восстанивителями и сложность регулирования скорости процесса [9].
Гидрид германия выделяется на катодах с высоким перенапряжением водорода в том случае, если германий присутствует в электролите. На ртутном катоде в растворах NaOH с добавкой GeO2
зависимость iGeH
4
от Е катода (определенная по анализам отходящего газа) выражается прямой линией с коэффициентом наклона b = 56 мВ. По данным [4] электрохимическая реакция протекает по уравнению:
GeO3
2-
+ 7H2
O + 8e → GeH4
+ 10 OH‾
Полученное значение коэффициента наклона b не дало возможности установить, проходит ли на катоде непосредственное восстановление GeO3
2-
до GeH4
или же атомарный водород является промежуточным продуктом реакции. Оба варианта приводят к одинаковому значению коэффициента b. Как правило, одновременно на ртутном катоде выделяются металлический германий и водород.
На свинцовом катоде GeH4
образуется при электролизе растворов GeO2
в H2
SO4
. Наилучшие результаты дают электролиты следующего состава: 1.5 GeO2
в 200 см3
40%-ного раствора H2
SO4
[5].
В работе [9] изучено влияние различных факторов на процесс восстановления германия (IV) до германа в щелочных электролитах на никелевом катоде. Рабочая поверхность катода равна 0,005 м2
. Анодное и катодное пространства электролизера разделяли ионообменными мембранами марки МБ-1 или МК-40. Электролит готовили из оксида германия (IV) в электролите состава 20 г/л. Установлено, что электросинтез германа нужно вести при плотности тока порядка 6 кА/м2
. Концентрация фонового электролита должна быть 2,5 моль/л, дальнейшее повышение NaOH нецелесообразно в связи с уменьшением растворимости оксида германия (IV). Выход германа 50-55%.
В работе [10] описан электрохимический синтез особо чистого германа электролизом 2,5 моль/л NaOH, содержащего 20 г/л оксида германия (IV). Рассмотрено влияние катода (сталь, медь, свинец, никель, олово) на выход германа. Показано, что наибольший выход наблюдается на никелевом и оловянном катодах.
Предполагается, что выделение германа происходит по уравнению реакции:
GeO3
2-
+ 7H2
O + 8e → GeH4
+ 10 OH‾
Максимальный выход GeH4
наблюдается при плотности тока 1,3- 1,4 А/см2
. Исследования температурной зависимости концентрации германа при плотности тока равной 1 А/см2
показало, что максимум концентрации приходится при 100-105о
С (никель- катод).
2.4. Электрохимическое поведение соединений германия (II) и (IV)
Двухвалентный германий в солянокислом растворе восстанавливается на капельном ртутном катоде до металла [3]. Восстановление необратимо. Предельный диффузионный ток восстановления хорошо выражен, величина его пропорциональна концентрации германия, начиная от 1 мкг/мл германия. Потенциал полуволны восстановления Ge (II) в 6 М HCl изменяется от -0,45 до 0,50 В (нас.к.э.) при концентрации 1•10-4
моль/л германия. С уменьшением концентрации соляной кислоты потенциал восстановления сдвигается в более положительную сторону.
В растворе фосфорноватистой кислоты потенциал полуволны восстановления германия (II) несколько сдвинут в отрицательную сторону по сравнению с солянокислым раствором, что объясняется большей склонностью к комлексообразованию Ge2+
с H3
PO2
, чем с HCl.
Изучено полярографическое поведение германия (II) в щелочном растворе. Предельный диффузионный ток восстановления в 1М NaOH также как и в кислых растворах пропорционален концентрации германия. Восстановление необратимо. Потенциал полуволны восстановления изменяется от -0,9 до -0,96 В (нас. к. э.) с изменением концентрации NaOH от 0,2 до 2 М [3].
В работе [11] авторы, изучая полярографическое поведение германия (II) в гипофосфитно-солянокислых электролитах, установили, что процесс восстановления носит диффузионный характер. Наклон кривой Е – lg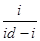 составляет 26-30 мВ, что соответствует обратимому электродному процессу с участием двух электронов. Было найдено, что потенциал полуволны восстановления германия (II) сдвигается в сторону отрицательных значений при увеличении концентрации в растворе как гипофосфита натрия, так и соляной кислоты (табл. 2.3). Это явление объяснено способностью ионов составляет 26-30 мВ, что соответствует обратимому электродному процессу с участием двух электронов. Было найдено, что потенциал полуволны восстановления германия (II) сдвигается в сторону отрицательных значений при увеличении концентрации в растворе как гипофосфита натрия, так и соляной кислоты (табл. 2.3). Это явление объяснено способностью ионов
Таблица 2.3
Электрохимическое определение Ge (II) и Ge (IV) методом КП на РКЭ [3]
| Фоновые электролиты |
E½
(нас.к.э), В
|
Примечание |
| Определение
Ge
(
II
)
|
| 1. |
6NHCl |
-0,45 до
-0,50
|
Концентрация Ge(II) = 1·10-4
М. При понижении концентрации HCl потенциал восстановления сдвигается в более положительную сторону. |
| 2. |
1,85 MHCl |
-0,13
|
При повышении концентрации HCl в растворе равновесие между Ge2+
и GeCl-
3
сдвигается в сторону образования последнего. |
| 3. |
1,09 NH3
PO2
|
-0,52
|
E½
сдвинут в отрицательную сторону по сравнению с HCl, что объясняется большей склонностью к комлексообразованию Ge2+
с H3
P |
| 4. |
0,2 –2М NaOH
|
-0,90 до -0,96 |
E½
восстановления изменяется от
- 0,90 до -0,96% с изменением концентрации NaOH от 0,2 до 2M
|
| 5. |
NaH2
PO4
•H2
O М
1M HCl
|
-0,24 до -0,27 |
Потенциал E½
сдвигается в сторону отрицательных значений при увеличении концентрации гипофосфита натрия и HCl |
| Определение
Ge
(
IV
)
|
| 1. |
0,1M NH3
۠∙H2
O
0,1M NH4
Cl
|
-1,4
|
В буф. растворе наблюдается 2 волны восстановления. |
| 2. |
0,1M NaCl |
-1,54
|
При pH 10,2 определению даже не мешает H2
SiO3
|
| 3. |
0,1MNH3
·H2
O
0,1MNH4
Cl
и 0,01% желатина
|
-1,45
|
| 4. |
0,05M KCl
0,1M H3
BO3
0,1M NaOH
|
-1,5
|
| 5. |
NH4
OH+NH4
Cl |
-1,56 |
pH 8-9 |
| 6. |
0,25MH3
BO3
и KOH |
-1,66 |
pH до 8 |
| 7. |
0,25M H3
BO3
,
2M KCl и KOH
|
-1,44
|
pH до 8 |
| 8. |
0,13MLiOH |
-1,77до 1,79 |
pH 11,5 – 11,6 |
| 9. |
0,005 – 0,01M
LiOH
а). KCl или NH4
Cl
б). NH4
Cl+NH4
OH
|
-1,62 ± 0,02
-1,6
|
pH 10 – 11,8
а). pH 6
б). pH 8,5 – 10,5
необратимый катодный пик
|
| 10. |
1MNH4
Cl
+комплексон III
|
-1,6
|
pH 8,3 – 9,3. Высота пика пропорциональна концентрации в интервале 5·10-5
-10-3
М |
двухвалентного германия к образованию комплексов с гипофосфит- и хлорид-ионами.
В работе [12] методами классической и переменно-токовой полярографии изучено поведение германия (II) в гипофосфитно-солянокислых электролитах с целью определения кинетических параметров электродного процесса и уточнения состава комплексов германия (II) в этих растворах. Константы скорости k и токи обмена (i0
) электродного процесса рассчитаны по данным переменно-токовой полярографии. С ростом концентрации HCl от 1 до 10 М значения обоих параметров увеличиваются и изменяются в пределах: k от 1,4•10-2
до 6,0•10-2
см/с, а i0
от 0,68•10-2
до 2,90•10-2
А/см2
. Полученные результаты подтверждают обратимый характер процесса восстановления германия (II) на ртутном капающем электроде в хлоридно-гипофосфитных растворах.
Число координированных лигандов в комплексе германия (II) равно трем. Константы устойчивости комплексных ионов [GeCl3
]‾
и [Ge(H2
PO2
)3
]‾ равны 5•1012
и 1•1021
соответственно [12].
В [13] исследовано полярографическое поведение германия (II) и (IV) на РКЭ. В области концентраций 1∙10-5
- 1∙10-4
М германий (II) наблюдается одна волна восстановления с Е = -0,25 В (н.в.э) (рис.2.2). Константы скорости электродного процесса рассчитанные из данных ПТП для этой области концентраций Ge (II) составляют (1,4 – 6,0)∙10-2
см/с, что свидетельствует об обратимости процесса. При концентрации Ge (II) более 1∙10-4
полярографическая волна приобретает форму пика, а при концентрации более 1∙10-3
М на полярограмме появляется вторая волна с максимумом при
–0,31 В. При дальнейшем повышении концентрации Ge (II) высота первой волны остается практически постоянной, а второй – увеличивается.
Авторы [13] объясняют наблюдаемые эффекты низкой растворимостью германия в ртути (3∙10-6
% при 20о
С) в результате чего сначала происходит образование гомогенной амальгамы, содержащей
(2-7)∙10-5
% германия. На поверхности последней амальгамы появляются кристаллы германия в виде отдельной фазы, что приводит к росту поверхности электрода, а, следовательно, и росту рока и появлению первого максимума. После полного покрытия электрода пленкой элементного германия, начинается разряд Ge (II) на германии, чему соответствует второй пик тока.
Восстановление германия (IV) в щелочном растворе 1М H2
SO4
+ LiOH (pH = 11) также сопровождается появлением двух волн с Е = -1,35 и –1,60 В соответственно. Зависимости I пред от концентрации германия (II) и германия (IV) имеют одинаковую форму (рис.2.2) и соответствуют следующим процессам:
1) образование гомогенной амальгамы германия по реакциям:
Ge (II) + 2e → Ge(Hg)гомоген
(участок а)
Ge(IV) + 4e → Ge(Hg)гомоген
2) выделение германия на поверхности гетерогенной амальгамы (участок б)
3) выделение германия на германиевой пленке (участок в)
Четырехвалентный германий в умереннокислых растворах не дает волны восстановления [3].
Восстановление на капающем ртутном катоде в буферном растворе происходит при pH ≥ 5. Наиболее высокая и четкая волна восстановления наблюдается при оптимальном значении pH, равном 8-9. В аммиачно-хлоридно-аммонийном буферном растворе наблюдается две волны восстановления с Е1/2
= -1,45 и 1,7 В. Из них лишь первая является волной дифуззионного тока восстановления германия, вторая соответствует каталитическому выделению водорода.
В небуферных растворах (NaClO4
) восстановление происходит при pH≥4, при pH < 4 волна германия перекрывается волной водорода, при pH > 9 высота волны падает, доходя до нуля при pH 11-12. Восстановление германия (IV) проходит с участием четырех электронов и необратимо. В буферных растворах [3] в области pH 6 - 12 потенциал полуволны восстановления и высота волны предельного диффузионного тока зависят от pH, что связывается с существованием равновесия между ионами метагерманиевой и полигерманиевых кислот. Если при этом в растворе присутствует соль этилендиаминтетрауксусной кислоты (например комплексон III), значение Е1/2
восстановления при pH 5-9 практически постоянно.
Восстановление германия (IV) на ртутном капающем электроде происходит в растворах различных электролитов, многие из которых предложены в качестве полярографических фонов. Значения Е1/2
германия (IV) на различных фонах приведены в таблице 2.3.
Ловречек и Дуич [11] изучали поведение германия на ртутном электроде полярографическим методом снятия гальваностатических кривых на стационарной ртутной капле. Исследованы буферные растворы с pH 1,7-12,6. Авторы показали, что при pH ниже 3,1 волн восстановления германия не наблюдается, при pH 3,7–10,6 получается две волны восстановления Ge(IV). В растворах с pH > 10,6 наблюдается одна волна. Такое изменение вида полярограмм авторы объясняют наличием в растворе различных видов германиевых кислот в зависимости от pH раствора: пентагерманиевой кислоты при pH ниже 4, равновесной смеси пентагерманиевой кислоты и мономера при pH 4-5, которые восстанавливаются при различных потенциалах. При дальнейшем увеличении щёлочности раствора весь пентамер диссоциирует и одновременно в растворе появляются ионы бигерманата, которые восстанавливаются при более отрицательных потенциалах, чем молекулы германиевой кислоты. На полярограмме в этих пределах pHнаблюдается также две волны. При pH больше 10,6 весь германий находится в виде анионов и дает одну волну восстановления, соответствующую разряду ионов бигерманата. Германат-ион, по мнению авторов, не разряжается на ртутном катоде при потенциалах менее отрицательных, чем потенциал выделения водорода в этих растворах.
В работе [14] показано, что ионы четырехвалентного германия восстанавливаются в небуферированных щелочных и нейтральных растворах. По мнению авторов, лимитирующей стадией процесса является отщепление воды от иона ортогерманиевой кислоты:
Ge(OH)6
2-
⇆GeO3
2-
+ 3H2
O
Показано, что вторая волна, наблюдаемая при восстановлении германия (IV) в щелочных и нейтральных растворах, обусловлена восстановлением водорода на поверхности германия, покрывающего ртутный электрод. Сопоставление величины потенциалов полуволн, полученных экспериментально и стандартного потенциала системы Ge4+
/Ge в щелочной среде:
HGeO3
‾ + 2H2
O + 4e = Ge + 5OH‾ , Ео
= -1,0 В (н.в.э.)
показывает, что восстановлению ионов четырехвалентного германия происходит с большим перенапряжением. Перенапряжение при восстановлении четырехвалентного германия на ртутном электроде может быть, очевидно, объяснено тем, что он находится в растворе в виде анионов германиевой кислоты, которые в значительной мере гидратированы. Вследствие этого разряд их затруднен и скорость его лимитируется процессом дегидратации ионов в приэлектродном слое [14].
В литературе имеется ряд работ, в которых определение германия с высокой чувствительностью достигается за счет использования метода адсорбционной вольтамперометрии после накопления комплексов Ge (IV) с пирокатехином, пирогаллолом и молибдат-ионом. Молибдогерманиевая гетерополикислота (а-МГК) относится к числу электроактивных комплексов [15]. Установлено, что при концентрации а-МГК 4•10-5
моль/л адсорбция аниона H3
GeMo12
O40
‾ монотонно увеличивается от 1,87•10‾10
до 4,86•10‾10
моль/см2
при изменении потенциала электрода от -0,2 до 0,1 В. Пик тока с
Еn
= 0,15 В является адсорбционным. Адсорбция а-МГК максимальна на угольно-пастовом электроде (УПЭ). Наименьшей способностью адсорбировать кислоту обладает стеклоуглерод. На УПЭ минимально определяемая концентрация а-МГК составляет 1,7•10‾9
моль/л.
В [16] исследовано вольтамперометрическое определение молибденовых гетерополисоединений кремния и германия на РКЭ и стационарных электродах: ртутном типа висячей капли (с.р.э), стеклоуглеродном (СУ), графитовом (ГР), импрегнированным парафином и угольном пастовом элктроде (УПЭ). На циклических вольтамперограммах а-МГК на РКЭ и углеродных электродах зарегестрированы три катодных и три соответсвующих, но менее четких анодных пиков.
Установлено, что пик 1 – адсорбционный, а два других – диффузионные, осложненные адсорбцией. Симметричные по форме катодно-анодные пики I и II для углеродных электродов, высоты которых пропорциональны скорости развертки потенциала 0,1-2,0 В/с, характерны для равновесных адсорбционно-десорбционных процессов на поверхности электрода. На электрохимическое поведение а-МГК существенно влияет концентрация ионов водорода. Потенциалы всех четырех пиков на синусоидальных переменно-токовых полярограммах с повышением pH в интервале от 1,0 до 4,5 смещаются на 60-65 МВ/pH в области более отрицательных значений, что близко к теоретическому значению 58 МВ/pHи подтверждает участие в электрохимической реакции равного числа протонов и электронов. Принимая во внимание тот факт, что в электрохимической реакции принимает участие 2 электрона, можно записать:
[GeMo12
O40
]4‾
+ 2nH+
+ 2ne D [H2n
Mo2n
Mo12-2n
O40
]4
‾ ,где n = 1-4
Предложенный механизм электродного процесса подтвержден зависимостью Еn
и In
от температуры. С повышением температуры от 18 до 52о
С для 5•10‾6
М растворов пики I, III и IV на ПТП полярограммах уменьшаются и полностью исчезают при 42о
С. Соответствующие значения кажущейся энергии активации и температурные коэффициенты отрицательны. Это указывает на адсорбционную природу указанных пиков. Значения Еn
для пиков I и III практически не изменяются с повышением температуры, что подтверждает преимущественную адсорбцию кислоты.
В [17] показана возможность вольтамперометрического определения германия в полупроводниковых материалах Pb1-х
Geх
Te с использованием реакций образован догерманиевой гетерополикислоты и её адсорбционного концентрирования на поверхности угольного пастового электрода. Методика позволяет анализировать миллиграммовые навески пробы.
В [18] исследовано осциллополярографическое определение Ge (IV) в концентрированных кислых растворах, предел обнаружения 1•10‾6
М в присутствии многих ионов ( Sn(II), Zn(II), Cd(II), Cu(II), Ni(II), Co(II), Mn(II), As(III), Sb(III), Cr(III), Ga(III), Fe(III), Bi(III), Mo(VI), W(VI) ) достигнут в концентрированных HCl, HBr, HClO4
, или NH4
NCS.
Анализ литературы по электрохимическому поведению германия и его соединений показал, что этот элемент мало изучен, механизмы реакций с его участием до конца не установлены.
2.5. Растворимость германия в ртути
В работе [13] из данных полярографии кулонометрическим методом рассчитаны стационарные концентрации германиевых амальгам при регулярных концентрациях германия (II) в растворе (табл. 2.4)
Таблица 2.4
Стационарные концентрации германия в ртути
(6 М HCl + 0,5 М NaH2
PO4
)
СGe(II)
∙104
, М
|
Концентрация Ge в амальгаме
С∙106
, %
|
СGe(II)
∙104
, М
|
Концентрация Ge в амальгаме
С∙106
, %
|
0,15
0,37
0,60
0,85
1,1
|
0,34
0,40
0,45
0,51
0,55
|
3,7
2,7
3,0
4,6
|
2,15
9,8
18,5
20,20
|
Из этих данных авторы (14) сделали вывод, что стационарная концентрация гомогенной амальгамы составляет 5,5∙10-6
%, что значительно меньше, чем указанная в литературе величина 1∙10-4
мас.%.
В работе [19] методом амальгамной полярографии с накоплением (АПН) определена растворимость германия в ртути. Авторы отмечают, что в литеретуре по этому вопросу имеются противоречивые мнения. Имеется ссылка на Козина Л. Ф., согласно которому эмпирически определенная величина составляет 1,3•10‾18
ат.%. Однако эта величина не отвечает результатам определения германия методом АПН. Сначала германий накапливали в поверхностном слое ртутной капли при -1,8 В (нас.к.э.) в течение 600 с. Для этих условий проведения электролиза для германия достигается предельный диффузионный ток. Сделано предположение, что металл распределен равномерно по всему объему ртути. Затем снимали зависимость анодного тока пика от концентрации германия в растворе. Затем, зная количество электричества, прошедшее через электрод в анодном цикле (площадь под пиком в Кулонах), рассчитывали концентрацию атомов Ge в ртутной капле по формуле:
С2
= 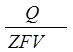 , ,
где Q – количество электричества;
Z – число электронов, участвующих в реакции;
Vk
– объем ртутной капли.
Растворимость германия в ртути составляет 1•10‾4
мас.%.
В [20] растворимость германия в ртути определена на основании полярографических данных. Отмечено, что на основании измерений электропроводности амальгамы Эдвардс оценил растворимость его в ртути в 0,027 мас.% при 300о
С, методом меченых атомов на основании хода кинетических кривых старения растворимость Ge в ртути оценена в 3•10‾6
мас.%.
Восстановление Ge (II) проводили на фоне 1-10 М HCl +0,5 М NaH2
PO2
на РКЭ. Концентрация Ge (II) в растворе составляла 1•10‾5
-1•10‾2
М. предел растворимости определяли по раздвоению поллярографической волны, то есть, когда в поверхностном слое РКЭ образуется гетерогенная амальгама, появляется вторая волна восстановления Ge (II) на гетерогенной амальгаме. Максимальная концентрация германия в гомогенных амальгамах составляет 5,1•10‾5
мас.%. Эта величина находится в соответсвии с растворимостью, найденной методом меченых атомов (3•10‾6
мас.%) и значительно ниже, чем определенная в работе [19]. Объяснением этому может быть тот факт, что при использовании стационарной ртутной капли образуется амальгама, являющая квациравновестной.
ВЫВОДЫ
1. Из анализа работ по электроосаждению германия не ясно, почему из водных растворов не удается получить плотные осадки. Считать причиной этого низкую величину перенапряжения водорода на Ge неправильно, так как в настоящее время установлено, что перенапряжение водорода на Ge велико и близко по своему значению к величине перенапряжения на цинке и кадмии.
2. Причиной низкого выхода германа по току является близость потенциалов выделения германа и водорода на германии.
3. Низкая растворимость германия в ртути (3•10‾6
мас.%) приводит к тому, что при восстановлении соединений Ge (II) и Ge (IV) возможно модифицирование поверхности ртутного электрода, который превращается в многослойную систему:
Hg – Ge(Hg)n
– Ge(Hg)n
– Ge
гомогенная гетерогенная
система система
Это приводит к усложнению вольтамперных кривых, так как выделение германия на ртути и на германии протекает при разных потенциалах.
ЛИТЕРАТУРА
1. Рипан Р., Четяну Н. Неорганическая химия.- М.: Мир, 1971. Т.1 с.155-170
2. Игнатенко М. А. Противоопухолевая активность кремний- и германийорганических соединений (обзор) // Хим.-фарм. журнал. 1987. Т.21. №1. с.402-408.
3. Назаренко В. А. Аналитическая химия германия.- М.: Наука, 1973. с.7-29, 156-162.
4. Тананаев И. В., Шпирт М. Я. Химия германия.- М: Химия, 1967. 451с.
5. Ефимов Е. А., Ерусалимчик И. Г. Электрохимия германия и кремния.- М.: Госхимиздат, 1963. 180с.
6. Zoubov P. N., Deltombe E., Vanleugenhaghe, Pouzbaix. Germanium.- Sn.: Atlas d equiilibres electrochimiques – Paris. 1963. p.464-474.
7. Калугина Д. В., Корнева Е. В., Науменко Т. А., Святская Т. Н. Физико-химический анализ и вольтамперометрия воднометатанальных электролитов для осаждения металлического германия. Тез. Докл. 2 обл. межотраслев. научн.-техн. конф. Безотходн. технология хим., нефтехим., гальван. пр-в и в стройиндустр. – Куйбышев. 1990. с.25.
8. Калугина Д. В., Святская Т. Н., Науменко Т. А. Электроосаждение Ge из этиленгликолевых растворов. Тез. Докл. Т.2. Химия и применение невод. Р-ов. - Харьков. 1989. с.93.
9. Гладышев В. П., Сыроежкина Т. В., Сариева А. К., Тулебаев А. К., Колмыков В. И. Электросинтез германоводорода высокой частоты. – В сб.: Сборник работ по химии КазГу. – Алма-Ата. 1980. вып.6. с.193-199.
10. Девятых Г. Г., Воротынцев В. М., Балабанов В. В., Абдрахманов Р. Р., Дягилев В. А. Высокочистые вещества. –М. 1988. №2. с.60-64.
11. Гладышев В. П., Тембер Г. А. Электрохимическое поведение германия на ртутном электроде. – Тр. ин-та хим. наук АН Каз ССР. Электроды и электролиты. 1976. Т.15. с.82-99.
12. Гладышев В. П., Сыроежкина Т. В., Сариева А. К., Тембер Г. А. Полярографическое поведение германия (II) в хлоридногипофосфитных электролитах // Журн. аналит. жимии. 1978. Т.33. Вып.10. с.1945-1948.
13. Гладышев В. П., Сыроежкина Т. В., Сариева А. К., Особенности полярографического поведения германия // Журн. аналит. химии. 1979. Т.34. №2. с.296- 299.
14. Гладышев В. П., Киселева Г. Г. К полярографии германия.-Тр. ин-та хим. наук Каз ССР. Электролиз и цементация на твердых и жидких электродах. 1960. Т.6. с.184-195.
15. Прохорова Г. В., Осипова Е. А., Гуренцова О. И и др. Адсорбция молибдогерманиевой гетерополикислоты на ртутных и графитовых электродах // Журн. аналит. химии. 1991. Т.46. Вып.10. с.1921-1928.
16. Прохорова Г. В., Осипова Е. А., Гуренцова О. И. Адсорбционная инверсионная вольтамперометрия молибденовых гетерополисоединений кремния и гармания // Журн. Аналит. химии. 1993. Т.48. №10. с.1621-1630.
17. Осипова Е. А., Прохорова Г. В., Гуренцова О. И., Копытова Н. Е. Определение германия в полупроводниковых материалах методом адсорбционной инверсионной вольтамперометрии // Завод. лаб. 1994. Т.60. №2. с.5-7.
18. H. Albaro J., G. Donoso N., O. Plattean V. Oscillopolarographic determination of geranium // Anal. Chem. Acta. 1969. Vol.45. №2. p.360-363.
19. Степанова О. С., Захаров М. С. К вопросу об определении растворимости германия в ртути методом амальгамной полярографии с накоплением // Электрохимия. 1966. Т.2. №7. с.777-779.
20. Гладышев В. П., Сыроежкина Т. В., Сариева А. К. Растворимость германия в ртути // Изв. Вузов.
|