Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра ТООНС
Контрольная работа по курсу:
«Основы технологии органического синтеза»
на тему:
Этиленгликоль
Казань
2007
Содержание:
Введение
Физические свойства
Химические свойства
Способы получения этиленгликол
Технологическая схема получения этиленгликоля гидратацией окиси этилена
Технологическая схема совместного получения этиленгликоля и окиси этилена в стационарном слое катализатора
Применение этиленгликоля
Список литературы
Введение
Этиленгликоль — простейший двухатомный спирт ряда гликолей, впервые синтезированный Вюрцем в 1859 г. В промышленных масштабах эти-ленгликоль начали получать в Германии в период первой мировой войны. В настоящее время этиленгликоль (а также диэтиленгликоль и полиэтиленгликоли) вырабатывают в очень больших количествах и используют в различных отраслях народного хозяйства.
Будучи весьма гигроскопичным, этиленгликоль в то же время хорошо растворяет смолы, красители и некоторые вещества растительного происхождения. Благодаря сочетанию этих свойств этиленгликоль применяется при крашении тканей, в ситцепечатании, для приготовления штемпельных красок и косметических препаратов, для увлажнения табака и т. д. Этиленгликоль является также важным полупродуктом в производстве синтетических смол, растворителей, взрывчатых веществ и пр.
Состав этиленгликоля: С2
Н6
О2
.
Структурная формула:
Н Н
׀ ׀
Н – С – С - Н
׀ ׀
ОН НО
Физические свойства
Этиленгликоль СН2
ОН—СН2
ОН — вязкая бесцветная жидкость со слабым запахом и сладким вкусом. Температура кипения 197° С. Температуры кипения гликолей значительно выше температуры кипения спиртов, что является следствием усиления ассоциации молекул (образования водородных связей) из-за наличия в гликолях двух гидроксильных групп. Температура плавления —11,5° С. Плотность 1,11г/см3
; теплота парообразования 191 ккал/кг. Смешивается во всех отношениях с водой, глицерином, одноатомными алифатическими спиртами, ацетоном, ледяной уксусной кислотой, пиридином и фурфуролом; не смешивается с бензолом, ксилолом, толуолом, хлорбензолом, хлороформом, четыреххлористым углеродом. Этиленгликоль обладает токсическим действием, сходным с действием метилового спирта.
Этиленгликоль сравнительно устойчив при высокой температуре — не разлагается при пропускании над пемзой, нагретой до 400°С. Разложение гликоля начинается при 500 - 520°С, а при 550°С происходит уже со значительной скоростью; но даже при этой температуре до 36% этиленгликоля не подвергается разложению.
Важным свойством этиленгликоля является его способность сильно понижать температуру замерзания воды. Водный раствор, содержащий 40 объемных % этиленгликоля, замерзает при —25°С, а 60%-ный водный раствор при — 40°С. Поэтому этиленгликоль с успехом применяется для приготовления антифризов.
Химические свойства
Химические свойства этиленгликоля, как и других гликолей аналогичны свойствам одноатомных спиртов. Однако у гликолей могут вступать в реакции как одна, так и обе гидроксильные группы.
1. С щелочными металлами гликоли образуют полный и неполный гликоляты: CH2
ONa — CH2
ONa, CH2
OH — CH2
ONa.
Гликоляты образуются не только со щелочными металлами, но и с оксидами некоторых других металлов, например с гидроксидом меди. При действии щелочи на сульфат меди (II) образуется голубой осадок гидроксида меди (II). Этот осадок не растворяется в спирте, но очень легко на холоде растворяется в гликоле вследствие образования комплексного гликолята меди:
Н
׀
  СН2
ОН СН2
- О О – СН2 СН2
ОН СН2
- О О – СН2
 2 ׀ + Cu (OH)2
→׀Cu׀ + 2 H2
O 2 ׀ + Cu (OH)2
→׀Cu׀ + 2 H2
O
 СН2
ОН СН2
- О О – СН2 СН2
ОН СН2
- О О – СН2
׀
Н
2. С минеральными и органическими кислотами получаются полные и неполные эфиры. Например, в приведенной реакции образуются неполный и полный эфиры этиленгликоля и азотной кислоты — нитраты:
СН2
ONO2
  СН2
ОН +НО
NO
2
Н2
О + ׀ СН2
ОН +НО
NO
2
Н2
О + ׀
 _ СН2
OH _ СН2
OH
+2HONO2
СН2
ONO2
 СН2
ОН 2Н2
О + ׀ СН2
ОН 2Н2
О + ׀
СН2
ONO2
Соответственно можно получить полные и неполные простые эфиры, например диэтиловый эфир этилен гликоля C2
Н5
ОСН2
– СН2
ОС2
Н5
и моноэтиловый эфир СН2
ОН — СН2
ОС2
Н5
. Последний под названием этилцеллозольв
применяется как растворитель в производстве нитролаков, бездымного пороха (пироксилина), ацетатного шелка и других производных целлюлозы.
С двуосновными кислотами этиленгликоль ступает реакцию поликонденсации, образуя высокомолекулярные полиэфиры
    HO – C = OOO HO – C = OOO
Н2
С – ОН ׀ ׀׀ ׀׀
n
׀ + n
R → – OCH2
– CH2
– O – C – R – C – + 2n
H2
O
Н2
С – ОН ׀
  HO – C = On HO – C = On
3. Окисление гликолей проходит сложно, ступенчато:
О
׀׀
О СН2
OH – СООН → НООС – С - Н
  СН2
ОН ׀׀ ↓ СН2
ОН ׀׀ ↓
  ׀ → С О О СООН ׀ → С О О СООН
СН2
ОН ׀ Н ׀׀ ׀׀ ׀
 СН2
OH С - С СООН СН2
OH С - С СООН
׀׀
ֽ ֽ
4. Отщепление воды от этиленгликоля может иметь внутримолекулярный и межмолекулярный характер. Направление отщепления воды зависит от условий реакции. Пример внутримолекулярного выделения воды:
СН2
ОН - СН2
ОН → [СН2
= СНОН] → СН3
– СНО
Межмолекулярное выделение воды приводит к образованию оксиэфиров (спиртоэфиров) или циклических простых эфиров:
СН2
– СН2
СН2
ОН НО – СН2
СН2
– О – СН2
׀ ׀
׀ + ׀ → ׀ ׀ → О О
СН2
ОН СН2
ОН СН2
ОН СН2
ОН ׀׀
СН2
– СН2
При межмолекулярной дегидратации этиленгликоля могут быть получены зависимости от условий диэтиленгликоль или диоксан:
СН2
– СН2
׀ ׀
2НОСН2
– СН2
ОН → НОСН2
– СН2
–О-СН2
– СН2
ОН → О О
׀ ׀
СН2
– СН2
Способы получения этиленгликоля
В промышленном масштабе этиленгликоль получают главным образом гидратацией окиси этилена:
   Н2
С – СН2
+Н2О
СН2
ОН – СН2
ОН Н2
С – СН2
+Н2О
СН2
ОН – СН2
ОН
О
При гидратации окиси этилена, кроме этиленгликоля, образуются ди-, три-, тетра- и полиэтиленгликоли. Чтобы уменьшить образование полигликолей, гидратацию проводят с большим избытком воды (на 1 моль
окиси этилена берут от 10 до 22 моль
воды) и добавляют к водному раствору окиси этилена 0,1—0,5% кислоты. В этих условиях получается этиленгликоль, содержащий лишь немного диэтиленгликоля и следы высших полиэтиленгликолей.
Процесс проводят в жидкой фазе в присутствии катализаторов (небольшое количество кислоты — серной, фосфорной или щавелевой) при 50—100°С и атмосферном давлении или без катализатора — при 10 ат
и 190—200° С.
Гидратацию окиси этилена при атмосферном давлении можно проводить, обрабатывая раствором кислоты контактные газы процесса прямого окисления этилена. Получаемый разбавленный раствор этиленгликоля нейтрализуют, отгоняют большую часть воды и далее фракционной перегонкой удаляют остатки воды и высшие гликоли.
В отсутствие катализаторов гидратацию окиси этилена проводят обычно под давлением 10 ат.
при мольном соотношении окиси этилена и воды примерно 1 : 16; продолжительность контакта 30 мин.
Раствор гликолей упаривают в многокорпусном выпарном аппарате до содержания воды около 15% и далее подвергают ректификации. Соковый пар из последнего аппарата конденсируют и конденсат, содержащий 0,5—1,0% этиленгликоля, возвращают на гидратацию свежей окиси этилена. На 1 т
этиленгликоля получается примерно 120 кг
диэтиленгликоля и 30 кг
триэтилен- гликоля.
Общий выход гликолей (считая на окись этилена) при получении их методом гидратации превышает 90%.
Технологическая схема получения этиленгликоля гидратацией окиси этилена
Процесс проводят без катализаторов при температуре 200°С под давлением, обеспечивающим сохранение смеси в жидком состоянии. Исходную шихту готовят из свежего и оборотного водного конденсата и оксида этилена, причем концентрация оксида 12—14% (масс.), что соответствует примерно 115-кратному мольному избытку воды по отношению к α-оксиду.
Оксид этилена, свежий и оборотный конденсат подают под давлением в смеситель 1
и затем в паровой подогреватель 2
. Там шихта нагревается до 130—150°С и поступает в реактор 3
адиабатического типа. Смесь проходит вначале по нейтральной трубе аппарата и дополнительно подогревается горячей реакционной массой, находящейся в объеме реактора, где и протекает образование продуктов. Кроме этиленгликоля, ди- и триэтиленгликоля, побочно получаются ацетальдеги (за счет изомеризации оксида этилена) и продукты его уплотнения. По выходе из реактора жидкость, нагретую до 200°С, дросселируют до атмосферного давления, причем часть воды испаряется, а жидкость охлаждается до 105—110°С.
Смесь поступает в аппарат 4,
являющийся первой ступенью многокорпусной выпарной установки, следующие ступени которой работают при все более глубоком вакууме (вплоть до 133 Па) и обогреваются за счет сокового пара с предыдущей стадии [на схеме показана, кроме первой (в аппарате 4),
только последняя ступень выпаривания аппарате 5
]. Выходящую из аппарата 5 кубовую жидкость для отделения остатков воды подвергают ректификации ввакуумной колонне 7, причем все водные конденсаты объединяют и возвращают на приготовление исходной шихты и затем на реакцию. Смесь гликолей из колонны 7 поступает в вакуумную колонну 8, где отгоняют достаточно чистый этиленгликоль, а в кубе остается смесь ди- и триэтиленгликоля. Эти продукты также представляют большую ценность, и их разделяют на дополнительной вакуум-ректификационной установке.
Рисунок 1.
Технологическая схема получения этиленгликоля
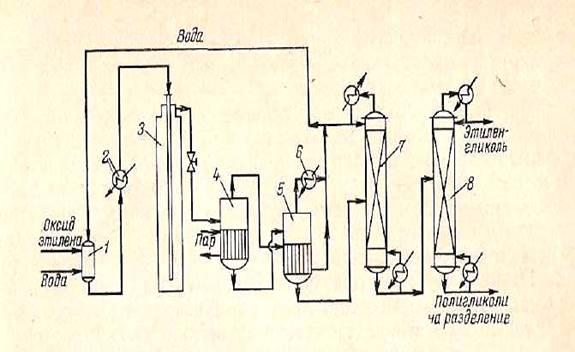
1 – смеситель; 2 – паровой подогреватель; 3 – реактор; 4, 5 – выпарные аппараты; 6 – конденсатор; 7,8 – ректификационные колонны.
Реакционный узел
Реакция производства этиленгликолей и диэтиленгликоля осуществляется при большом избытке второго реагента (т. е. при недостатке α-оксида), Теплота реакции воспринимается избыточным реагентом, за счет чего температура реакционной массы повышается всего на 40 — 50° С. Это дает возможность осуществлять процесс в адиабатических и полностью гомогенных условиях, т. е. с заранее приготовленным раствором α-оксида в воде или спирте. Для поддержания реакционной массы в жидком состоянии при 150 — 200 °С необходимо давление ≈ 2 МПа.
Для таких процессов используют непрерывно действующие реакционные колонны, не имеющие поверхностей теплообмена (рисунок 2). Исходная смесь, предварительно подогретая паром, подается сверху и поступает в низ колонны по центральной трубе, в которой она подогревается реакционной массой. Продукты реакции выходят сверху. Время контакта при получении гликолей в отсутствие катализаторов составляет 20 — 30 минут, что обусловливает наличие в таких аппаратах значительного продольного перемешивания, снижающего селективность.
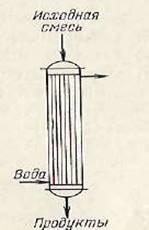
Для непрерывного осуществления таких реакций, но в более интенсифицированном режиме (синтез гликолей при катализе фосфорной кислотой, получение этаноламинов под давлением), наиболее подходят кожухотрубные реакторы (рисунок 3).
В них обратное перемешивание незначительно, и процесс протекает с более высокой селективностью.
Рисунок 2.
Адиабатический реактор
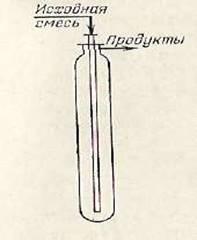
Рисунок 3.
Кожухотрубный реактор
Технологическая схема совместного получения этиленгликоля и окиси этилена в стационарном слое катализатора
В трубчатый реакционный аппарат 2
подают смесь этилена, оборотного газа и кислорода. Тепло экзотермической реакции окисления этилена отбирается кипящим в межтрубном пространстве аппарата 2
теплоносителем. Тепло конденсации паров теплоносителя используется в котле-утилизаторе 1
для получения водяного пара.
Продукты реакции из нижней части реактора 2
через теплообменник 8
поступают в абсорбер 5
, где окись этилена поглощается водой. Непоглощенные газы компримируют и разделяют на три потока: один поток возвращают в реактор 2,
другой направляют в колонну 3
через абсорбер 4
для отгонки СО2
и третий выводят из производственного цикла. Благодаря этому в системе поддерживается высокая концентрация этилена и предотвращается накопление в газах инертных примесей, главным образом двуокиси углерода.
Из нижней части абсорбера 5 водный раствор окиси этилена через теплообменник 8
направляют в колонный аппарат 9,
где окись этилена отгоняют от воды, возвращаемой в абсорбер для абсорбции окиси этилена. В колонне 10
окись этилена отделяют от легколетучих примесей (СО2
, N2
, С2
Н4
) и либо направляют на обезвоживание в колонну 12
для получения товарной окиси этилена, либо подвергают гидратации в этиленгликоли (реактор 11
); последние концентрируют в аппарате 13
и разделяют в колонне 14.
Рисунок 4
Технологическая схема совместного производства окиси этилена и этиленгликолей:
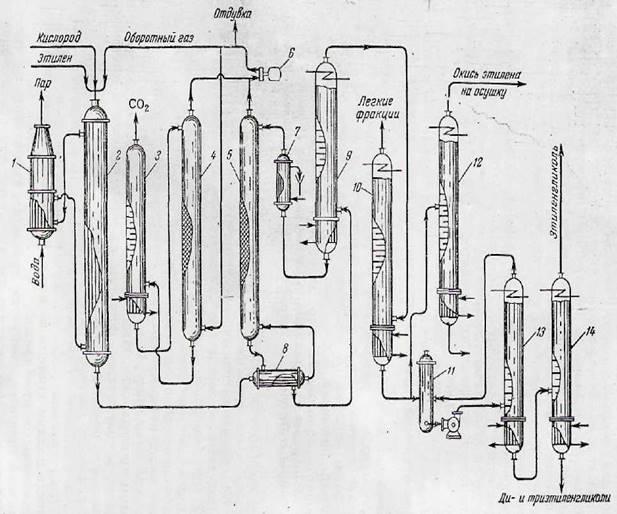
1 — котел-утилизатор; 2 — реактор; 3 — колонна для отгонки СО2
; 4 — абсорбер СО2
; 5 — абсорбер окиси этилена; б — компрессор; 7—холодильник; 3 — теплообменник; 9 — колонна для отгонки окиси этилена; 10 — колонна для отгонки легких компонентов; 11 — реактор для синтеза гликолей; 12 — колонии для обезвоживания окиси этилена; 13 — дегидрагатор; 14 — гликолевая колонна.
Применение этиленгликоля
При отщеплении молекулы воды от этиленгликоля путем его нагревания в присутствии водоотнимающих средств должна была бы образоваться окись этилена. Однако практически в зависимости от условий реакции (катализатор, температура) образуются полигликоли, а также диоксан или ацетальдегид.
При нитровании этиленгликоля концентрированной азотной кислотой в присутствии концентрированной серной кислоты образуется динитрат гликоля
по взрывчатым свойствам равноценный нитроглицерину. На основе динитрата гликоля изготовляют динамиты, замерзающие при низкой температуре (—23°С). В качестве взрывчатых веществ применяют также продукты нитрования диэтиленгликоля альдегидами и кетонами этиленгликоль вступает в реакции, характерные для соединений, содержащих гидроксильную группу. Например, с ацетальдегидом он образует 2-метил-1, 3-диоксолан.
С двухосновными кислотами этиленгликоль образует линейные высокомолекулярные полиэфиры. Такие полиэфиры применяются как пленкообразующие вещества для лаков и красок, и особенно для производства синтетических волокон. Так, из этиленгликоля и диметилового эфира терефталевой кислоты получают полиэтилентерефталаты, из которых изготовляется волокно лавсан.
Будучи весьма гигроскопичным, этиленгликоль в то же время хорошо растворяет смолы, красители и некоторые вещества растительного происхождения. Благодаря сочетанию этих свойств этиленгликоль применяется при крашении тканей, в ситцепечатании, для приготовления штемпельных красок и косметических препаратов, для увлажнения табака и т. д. Так же этиленгликоль с успехом применяется для приготовления антифризов.
Список литературы:
1. Краткая химическая энциклопедия. Ред. кол. И.Л. Кнунянц (отв. ред) и др., т. 5 – М.. «Советская энциклопедия». 1961.
2. Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза. 3-е изд., перераб. – М.: Химия, 1981 г. – 608с.
3. Писаренко А. П., Хавин З. Я. Курс органической химии. Учебник для вузов. Изд 3-е, перераб. И доп. М., «Высш. Школа», 1975. – 507с.
4. Петров А. А., Бальян Х.В., Прощенко А.Т. Органическая химия: Учебник для вузов. // Под ред. Стадничука М.Д. – 5-е изд., перераб и доп. – СПб.: «Иван Федоров». 2002. – 624с.
5. Юкельсон И.И. Технология органического синтеза – М.: Химия 1968 г. – 625с.
|