Общие свойства МО хюккелевских УВ:
Альтернантность. Теорема парности.
Свойства корней векового детерминанта.
Матрица коэффициентов (составы МО).
Свойства коэффициентов.
Правило знаков.
Выравнивание зарядов в пи-системе.
Пучности и узлы пи-МО. Число узлов.
Хюккелевские циклы. Устйчивость
Ароматичность.
Правило Хюккеля 4n+2:1,(2
),3,4,5,6,7,8,9.
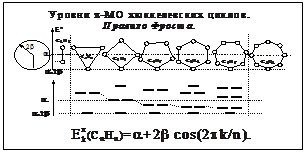
Моноциклические полиены
Циклы, граничные МО, электронные конфигурации, ароматичность.
Уровни МО: E=+2´[cosk (2/n)], "kÎ{0,1,2,n}. Правило ароматичности Хюккеля:
«В устойчивой ароматической оболочке число связывающих электронов равно
4n+2, "nÎ{0,1,2,n}» Этому правилу подчиняются соединения:
C5
H5
-
; C6
H6
; C14
H14
; C18
H18
([18]-аннулен). Ароматичность проявляется в склонности к реакциям замещения, а не присоединения... . При 4<
n
<18
внутрь цикла попадают атомы H
, которые искажают геометрию, и соединения уже неплоские.
Не ароматичны трёх- и четырёхчленные циклы. ЦИКЛОБУТАДИЕН не ароматичен!
Электронные конфигурации хюккелевских циклов:
| C3H3· |
·C4H4· |
C5H5· |
C6H6 |
C7H7· |
·C8H8· |
C14H14 |
C18H18 |
| Основная |
a2e1 |
a2e2 |
a2e3 |
a2e4 |
a2e4(e*)1 |
a2e4(e*)2 |
| C3H3+ |
C4H4 |
C5H5- |
C6H6 |
C7H7+ |
C8H8 |
C14H14 |
C18H18 |
| Устойчивая |
a2 |
(a2e2) |
a2e4 |
a2e4 |
a2e4 |
цикл.
катион
|
неаром |
аром.
анион
|
аром |
аром.
катион
|
Неаром |
аром |
аром |
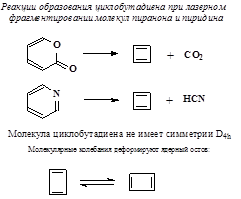
[14]-Аннулен плоский лишь при температуре t<-60oC [18]-Аннулен плоский даже при комнатной температуре. Он менее стабилен, чем бензол, но значительно стабильнее ациклического полиена (нонаена) C18H20. Гидрирование бензола – довольно жёсткий каталитический процесс
Напротив, известна реакция Зелинского. Тримеризация этина (ацетилена): 3 C2H2 ® C6H6. Механизмы электронного распределения в системах сопряжения. Классические валентные структуры. Уровни и электронная плотность.
Донорно-акцепторные соединения. Изоэлектронные неорганические (изоструктурные) аналоги органических структур. Соединения на основе нитрида бора. Связь BN.
Неорганические этан, этен и бензол. Боразол и боразон -аналоги бензола и алмаза.
Боразон-аналог алмаза (B¬N)n. Эти молекулы – изоэлектронные аналоги углеводородов:
H3B¬NH3 (аналог C2H6);
H2B¬NH2(аналог C2H4); цикл-(-HB¬NH-)3 (аналог C6H6).
Электронные распределения в системах:

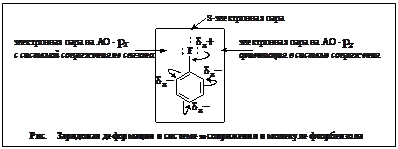
Замещение в ароматическом ряду Дезактивирующие ориентанты 1-го рода.
Сопряжение и зарядовая асимметрия. Обратное связывание в органической химии. Пример: пара-нитрофторбензол.
Треугольные циклы в методе МО ЛКАО. Симметрия и вырождение уровней.
Треугольные молекулярные циклы +C3H3; ·C3H3.
Наиболее глубоко располагаются уровни -МО. Над ними уровни -МО Вековой детерминант и диаграмма уровней. Хюккелевский детерминант треугольного цикла.
  X 1 1 X 1 1
1 X 1 = 0; ® X3+2-3X=0; ® X1,2,3= -2; +1; +1; ® E1,2,3=+2
1 X два решения одинаковы – уровень дважды вырожден
Молекулярные орбитали дважды-вырожденного уровня треугольного цикла. Базисные АО =2p(C)
j1=(p1+p2+p3)/31/2 невырожденный уровень AСвязывающий основной
j2=(p1+p2-2p3)/61/2
j3=(p1-p2)/21/2 дважды вырожденный уровень EРазрыхляющий
О номенклатуре МО. Символика МО:
-Порядковый номер уровня (энергетическое квантовое число)
-Символы вырожденности a,b,e,t
-Символ разрыхления
-Символы чётности g,u
-Символы симметрии относительно плоскости .
Молекулярные ионы H3+; D3+; H3*; D3* (Томсен, Герцберг) построены подобно C3H3. Замена базиса: =2pz(C) ®=1s(H) даёт аналогичные МО циклов C3H3 ®H3.
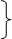 j1=(s1+s2+s3)/31/2 невырожденный уровень A Связывающий основной j2=(s1+s2-2s3)/61/2 j1=(s1+s2+s3)/31/2 невырожденный уровень A Связывающий основной j2=(s1+s2-2s3)/61/2
j3=(s1-s2)/21/2 дважды вырожденный уровень E Разрыхляющий
Уровни H3+ ab initio-базис 6-31G**(большой базис) E EМО
E (1A2’) = 33.238800 эВ
E (2E’) = 19.651634 эВ
E (2A1’) = 7.573212 эВ
E (1E’) = - 4.786128 эВ
E (1A1’) = -33.239368 эВ
Задача может быть решена и чисто симметрийным способом. Но в нашем курсе это не доступно. Основное: Треугольный цикл является удобной заготовкой для построения более сложных молекул с треугольной симметрией. Эквивалентные атомы (лиганды) рассматриваются в таких случаях совместно, а вид их коллективных орбиталей тот же, что и у изолированного цикла
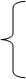 jA =(s1+s2+s3)/31/2 невырожденный уровень A jA =(s1+s2+s3)/31/2 невырожденный уровень A
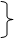 jE’ =(s1+s2-2s3)/61/2 дважды вырожденному уровню E jE’ =(s1+s2-2s3)/61/2 дважды вырожденному уровню E
jE” =(s1-s2)/21/2 соответствуют 2 орбитали
Пример (кратко о бутадиене):
Корни ВД и уровни -МО: X1,2,3,4
= ± (1 ± 51/2
)/2.
(E1,4
, E2,3
)=(±=±).
Матрица нормированных составов МО построена всего из двух чисел:
(0.3717; 0.6015)
Профильные диаграммы амплитуд МО.
Уровни. Конфигурация. Числа заполнения.
Минимальное понятие о топологии молекулярной структуры: центры-атомы, рёбра-связи. Индексы электронной структуры:
Атомные
: Заселённости АО парциальные и полные.
Для связей
: Заселённости связей (порядки связей) парциальные и полные. Полные порядки пи-связи равны (2´2´ab; 2´(a2
-b2
);)=(0.894; 0.263) » (0.9; 0.3) Хюккелевские порядки связей. Порядок связи и длина (корреляия).
| |CC|, Ao
|
p
p
|
Молекула
|
Примечание |
| 1.54 |
0 |
Этан
|
| 1.45 |
0.5 |
Графит
|
Экстрапол. по –C< |
| 1.397 |
2/3 |
Бензол
|
| 1.33 |
1 |
Этен
|
| 1.22 |
2 |
Этин
|
Свободные валентности
Индекс свободной валентности (у бутадиена): F1,4
=31/2
-0.9»0.8; F2,3
=31/2
-0.9-0.3»0.5.
Альтернантные УВ и две теоремы об АУВ: 1) Уровни. 2) Заселённости АО. Сопряжение и Ароматичность. Алкены. Арены. Алкины. Длина связи CC.
Двухатомные гомоядерные молекулы. Гибридизация орбиталей: -модельный случай у плоского ротатора. Кривая зависимости ПИ(Z) для 2s-2p АО и гибридизация (s±p)-АО у атомов элементов 2-го периода. Пиктограммы гибридных АО.
Две корреляционные схемы уровней АО-
МО у элементов 2-го периода
(атомы и 2-х атомные молекулы).
Схема А: Вариант с гибридизацией АО,
Схема Б: Вариант без гибридизации АО.
Последовательности уровней МО:
Схема А:1g
<1u
<2g
<2u
<1
u
<3
g
<1g
<3u
Схема Б: 1g
<1u
<2g
<2u
<3
g
<1
u
<1g
<3u
Конфигурации и параметры 2-х атомных молекул и молекулярных ионов.
Дистанции E(2s)-E(2p) у элементов 2-го Периода Системы Менделеева
| H
|
Li
|
Be
|
B
|
C
|
N
|
O
|
F
|
Ne
|
| Z
|
1
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
| 1-й ПИ
, эВ |
13.62
|
5.377
|
9.281
|
8.28
|
11.23
|
14.48
|
13.57
|
17.37
|
21.509
|
| ЭС, эВ |
0.747
|
0.82
|
-0.19
|
0.38
|
2.1;1.12
|
0.05
|
1.465
|
3.58;3.50
|
-
|
| E
2s2p
, эВ |
теор.
|
1.85
|
3.36
|
5.76
|
8.77
|
12.39
|
16.53
|
21.54
|
График этой зависимости имеет вид гладкой функции.
Она очень неплохо аппроксимируется параболой: E=A+BZ+CZ2

ПРОБЛЕМЫ: Связь и разрыхление. Длины связей. Энергии связи. Силовые постоянные собственных колебаний. Устойчивость конфигураций. Баланс «связь-разрыхление» и кратность связи по Герцбергу: PГ
=(1/2)´ (n-n*).
Свойства гомоядерных двухатомных молекул элементов 2-го периода Системы Менделеева
| P
Г
|
R0
, Ао
|
D, эВ |
D, кДж/моль |
Терм |
k´10-5
,
дн/см
|
k´10-2
,
н/м
|
| H2
+
|
(1g
)1
|
1/2
|
1.058
|
2.798
|
268.19
|
2
g
+
|
1.56
|
1.56
|
| H2
|
(1g
)2
|
1
|
0.742
|
4.4746
|
432
|
1
g
+
|
5.60
|
5.60
|
| He2
+
|
(1g
) 2
(1u
)1
|
1/2
|
1.080
|
2.5
|
241
|
3
g
+
|
3.13
|
3.13
|
| He2
|
(1g
)2
(1u
)2
|
0
|
-
|
-
|
1
g
+
|
-
|
-
|
| Li2
|
[He2
](2g
) 2
|
1
|
2.673
|
1.14
|
110
|
1
g
+
|
0.25
|
0.25
|
| Be2
|
[He2
](2g
) 2
(2u
)2
|
0
|
-
|
-
|
1
g
+
|
-
|
-
|
| B2
|
[Be2
] (1u
) 2
|
1
|
1.589
|
3.0
±
0.5
|
289
.5
|
3
g
-
|
3.60
|
3.60
|
| C2
|
[Be2
] (1u
)3
(3g
)1
|
2
|
1.242
|
6.36
|
613.8
|
3
u
|
9.55
|
9.55
|
| N2
+
|
[Be2
] (1u
)4
(3g
)1
|
5/2
|
1.116
|
8.86
|
855
|
2
g
+
|
20.1
|
20.1
|
| N2
|
[Be2
] (1u
)4
(3g
)2
|
3
|
1.094
|
9.902
|
955.6
|
1
g
+
|
23.1
|
23.1
|
| O2
+
|
[Be2
] (3g
)2
(1u
)4
(1g
)1
|
5/2
|
1.1227
|
6.77
|
653.3
|
2
g
|
16.6
|
16.6
|
| O2
|
[Be2
] (3g
)2
(1u
)4
(1g
)2
|
2
|
1.2074
|
5.213
|
503
|
3
g
-
|
11.8
|
11.8
|
| F2
|
[Be2
] (1u
)4
(3g
)2
(1g
)4
|
1
|
1.435
|
1.34
|
129.3
|
1
g
+
|
4.45
|
4.45
|
Изоэлектронность химических структур. Принцип изоэлектронности качественный.
Его можно сформулировать в виде : «Изоэлектронные структуры обладают близкими электронными свойствами. Их спектры МО подобны».
Физические свойства веществ, образованных изоэлектронными частицами могут заметно различаться Изоэлектронные двухатомные гетероядерные молекулы.
Роль электроотрицательности и гибридизации. 10-электронные оболочки и конфигурации. Молекула CO.
Уровни МО и конфигурация.
Уровни МО молекулы СО в различных приближениях метода МО ЛКАО
| МО |
Ab
initio, эВ
|
PM3, эВ
|
MNDO, эВ
|
CNDO, эВ
|
| 1 |
-562.513672
|
| 2 |
-309.039368
|
| 3 |
-41.615940
|
-40.028755
|
-44. 932140
|
-43.969006
|
| 4 |
-21.708000
|
-20.684595
|
-20.990582
|
-24.385288
|
| 1 |
-17.394398
|
-16.153131
|
-15.736658
|
-20.043474
|
| 5n
|
-14.849416
|
-13.027870
|
-13.426928
|
-17.534723
|
| 2 |
4.576420
|
1.000063
|
1.155621
|
4.463773
|
| 6 |
11.192607
|
6.081843
|
6.802823
|
12.847558
|
| 3 |
19.956134
|
| 7 |
21.060755
|
Свойства изоэлектронных молекул
| BF
|
N2
|
CO
|
NO+
|
CN-
|
·
NO
|
| D, эВ
|
8.03
|
9.90
|
11.14
|
11.52
|
® (N+
, O) |
6.643
|
| 10.72
|
® (N, O+
)
|
| R0
, Ao
|
1.26
|
1.116
|
1.1282
|
1.151
|
| , D
|
-0.112
|
| (*)
|
(*)
димер N
2
O
2
не существует, хотя у молекулы ·NO
имеется неспаренный электрон, но он находится на разрыхляющей МО.
Физические свойства
1 дебай = 10-18
см ед.Q в
СГСЕ= (1/3) ´ 10-29
Кл´м (в СИ)
|