.
Компоненты карбоксильной группы имеют следующие названия:
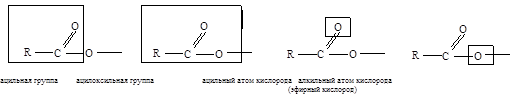
Кислотные радикалы RCO- (ацилы) имеют следующие названия:
| радикал муравьиной кислоты |
формил |
HCO- |
| радикал уксусной кислоты |
ацетил |
CH3
CO- |
| радикал пропионовой кислоты |
пропионил |
CH3
CH2
CO- |
| радикал масляной кислоты |
бутирил |
CH3
CH2
CH2
CO- |
| радикал валериановой кислоты |
валерил |
CH3
CH2
CH2
CH2
CO- |
Промышленные способы получения карбоновых кислот
1. Окисление углеводородов
Имеются два направления: окисление низших алканов С4
-С8
преимущественно в уксусную кислоту и окисление твердого парафина в так называемые синтетические жирные кислоты (СЖК) с прямой цепью углеродных атомов С10
-С20
, являющихся сырьем для синтеза ПАВ.
Процесс протекает в жидкой фазе - термически или в присутствии катализаторов. При окислении алканов происходит деструкция по связям между вторичными углеродными атомами, поэтому из н-бутана образуется главным образом уксусная кислота, а в качестве побочных продуктов - метилэтилкетон и этилацетат.
2. Синтезы на основе оксида углерода
Карбоновые кислоты получают на основе оксида углерода реакциями карбоксилирования и карбонилирования:
CH2
=CH2
+ CO + H2
O ® CH3
CH2
COOH
CH3
CH2
OH + CO ® CH3
CH2
COOH
Присоединение водорода и карбоксильной группы по двойной связи при кислотном катализе всегда протекает по правилу Марковникова, вследствие этого только из этилена получается неразветвленная кислота, а из его гомологов - a-метилзамещенные кислоты. Особый интерес данный метод представляет для синтеза третичных кислот (неокислот) из изоолефинов (реакция Коха):
(CH3
)2
C=CH2
+ CO + H2
O ® (CH3
)3
CCOOH
изобутилен триметилуксусная кислота
Механизм реакции состоит в предварительном протонировании алкена кислотой с образованием иона карбония, его взаимодействия с СО с получением ацилий-катиона и реакции последнего с водой с образованием карбоновой кислоты:
RCH=CH2
+ H+
« RC+
HCH3
+ CO « RCH(CH3
)C+
O + H2
O « RCH(CH3
)COOH + H+
Неокислоты и их соли обладают очень высокой растворимостью и вязкостью, а их сложные эфиры - стабильностью к гидролизу, что обеспечивает им широкое применение в ряде отраслей.
Карбонилирование спиртов катализируется комплексами металлов (Ni, Co, Fe, Pd). Процесс реализован в промышленности для синтеза уксусной кислоты из метанола и характеризуется высокими экономическими показателями.
Кислоты также получают окислением альдегидов (продукт оксосинтеза).
Лабораторные способы получения карбоновых кислот
1. Окисление первичных спиртов см. Лекцию№21
2. Окисление альдегидов и кетонов
Альдегиды окисляются значительно легче, чем кетоны. Кроме того, окисление альдегидов приводит к образованию кислот с тем же числом углеродных атомов, в то время как окисление кетонов протекает с разрывом углерод-углеродных связей (образуются две кислоты или кислота и кетон):
CH3
CHO + O2
® CH3
COOH + H2
O
CH3
CH2
COCH2
CH3
+ O2
® CH3
COCH3
+ CH3
CH2
COOH
Окислителями служат перманганат калия или бихромат. Окисление кетонов требует более жестких условий, чем альдегиды.
3. Гидролиз нитрилов
Нитрилы получают взаимодействием галогеналканов с цианистым калием, а затем подвергают их гидролизу водными растворами кислот или щелочей. В кислой среде азот выделяется в виде соли аммония:
CH3
CN + 2 H2
O + HCl®CH3
COOH + NH4
Cl
R-CºN+H+
®R-C+
=NH+H2
O®RC(O+
H2
)=NH«H+
+ RC(OH)=NH«RCONH2
RCONH2
+ HX + H2
O ® RCOOH + NH4
X;
в щелочной - в виде гидроксида аммония, кислота же получается в виде соли:
CH3
CN + 2 H2
O + KOH®CH3
COOK + NH4
OH
RCºN + -
OH®RC(OH)=N- + H2
O® -OH + RC(OH)NH«RCONH2 + NaOH®RCOONa + NH3
4. Синтез Гриньяра
При взаимодействии магнийорганических соединений с диоксидом углерода образуются соли карбоновых кислот:
CH3
CH2
MgBr + CO2
®CH3
CH2
COO-
Mg+
Br
Под действием сильной кислоты (обычно HCl) соль превращается в кислоту:
CH3
CH2
COO-
Mg+
Br + HCl ® CH3
CH2
COOH + MgBrCl
5. Гидролиз жиров
Жиры и масла - сложные эфиры глицерина и высших жирных кислот. Как все сложные эфиры, жиры могут быть подвергнуты гидролизу (омылению) действием водных растворов щелочей, минеральных кислот или водяным горячим паром под давлением
химические свойства
Карбоновые кислоты, как и спирты, способны образовывать водородные связи. Если акцептором является достаточно сильное основание, образование водородной связи предшествует полному переносу протона к основанию. В этом случае донор водородной связи считают «кислотой». Будет ли данное соединение «донором водородной связи» или «кислотой», зависит от природы «акцептора водородной связи» или «основания». Чем сильнее основание, тем больше вероятность того, что данное соединение будет вести себя по отношению к нему как кислота:
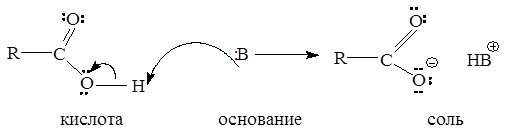
Межмолекулярные водородные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии значительная часть молекул существует в виде димеров:
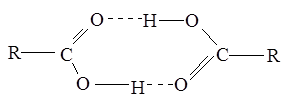
С ростом углеводородной цепи способность кислот к образованию водородных связей уменьшается.
Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты, из-за стабилизации карбоксилат-аниона, вызванной делокализацией p-электронов. Другими словами, карбоксилат-ион стабилизирован вследствие резонанса:
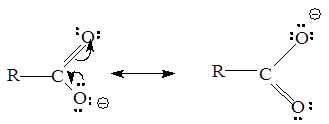
Степень делокализации изменяется в ряду RCOO-
>>RCOOH >> ROH, RO-
.
 RO-
+ +
BH RO-
+ +
BH
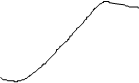 Энергия Энергия
 RO-H + B RO-H + B
RO-H + :B « RO-
+ +
BH
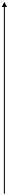 координата реакции координата реакции
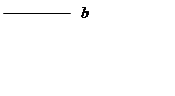   Энергия Энергия
 RCOOH + :B«RCOO-
+ +
BH RCOOH + :B«RCOO-
+ +
BH
координата реакции
Энергия а - стабилизация, вызванная делокализацией в RCOOH; b - стабилизация, обусловленная делокализацией в RCO-
; 1 - гипотетическая кривая, делокализация отсутствует; 2 - истинная кривая, имеется делокализация.
Кислотность выражают количественно через константу кислотности (называемую также константой диссоциации) Ка
или через рКа
:
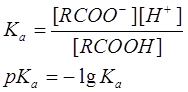
Константы кислотности большинства карбоновых кислот составляют около 10-5
(например, для уксусной кислоты 1,8×10-5
), что свидетельствует о довольно высокой концентрации неионизированной формы кислоты. Поэтому большая часть карбоновых кислот относится к слабым кислотам. Кислотность больше для тех кислот, в молекуле которых имеется заместитель, стабилизирующий карбоксилат-ион. К таким заместителям относятся галогены и прочие электроотрицательные группы. Влияние заместителей на кислотность показано в Таблице.
| Кислота |
рКа
|
| CH3
COOH |
4,8 |
| ClCH2
COOH |
2,9 |
| Cl2
CHCOOH |
1,3 |
| Cl3
CCOOH |
0,7 |
| FCH2
COOH |
2,6 |
| CH3
CH2
CH2
COOH |
4,8 |
| F3
CCOOH |
0,2 |
1. Образование солей
Органические кислоты образуют соли с металлами, их оксидами, карбонатами, гидрокарбонатами и щелочами, например:
CH3
COOH + NaOH®CH3
COONa + H2
O
2. Образование галогенангидридов
Под действием галогенидов фосфора карбоновые кислоты образуют ангидриды (гидроксил замещается на галоген):
CH3
COOH + PCl5
®CH3
COCl + POCl3
+ HCl
Хлорангидриды могут также быть получены действием на карбоновые кислоты тионилхлорида:
CH3
COOH + SOCl2
® CH3
COCl + SO2
+ HCl
3. Восстановление
Карбоновые кислоты можно восстановить только с помощью очень сильных восстановителей, поэтому в качестве продуктов реакции всегда образуются первичные спирты (а не альдегиды):
CH3
COOH + LiAlH4
®CH3
CH2
OH
4. Декарбоксилирование
Карбоновые кислоты очень легко теряют диоксид углерода. Как правило, при этом образуется углеводород. Алифатические карбоновые кислоты декарбоксилируют в присутствии различных катализаторов, содержащих медь. CH3
CH2
COOH®CH3
CH3
+ CO2
.
К реакциям декарбоксилирования относится и синтез Кольбе (см. Лекцию №2).
5. Этерификация
В присутствии сильной кислоты (например, серной) карбоновые кислоты дают со спиртами сложные эфиры:
CH3
COOH + CH3
CH2
OH«CH3
COOCH2
CH3
+ H2
O
В результате реакции образуется равновесная смесь. Чтобы сместить равновесие в сторону образования продукта, используют большой избыток спирта или удаляют воду по мере ее образования.
Механизм этерификации представляет собой реакцию присоединения – отщепления (нуклеофильное ацильное замещение) Протон, являющийся катализатором, облегчает атаку карбонильной группы нуклеофилом:
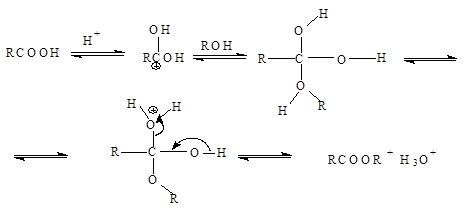
Отдельные представители
Муравьиная кислота. Получают из ее натриевой соли (формиата), которая образуется при пропускании оксида углерода через 25-30% раствор щелочи:
NaOH + CO®HCOONa
Суспензию формиата натрия затем разлагают муравьиной кислотой.
Муравьиная кислота применяется для приготовления катализаторов, в медицине и в ряде синтезов. Из ее производных наибольшее значение имеет N,N-диметилформамид HCON(CH3
)2
. Он является селективным растворителем при выделении ацетилена из газовых смесей и при абсорбции HCl, SO2
, CO2
и некоторых других газов.
Муравьиная кислота обладает многими химическими свойствами кислот, но ей присущи и некоторые специфические особенности:
1. является хорошим восстановителем (легко окисляется):
HCOOH + HgCl2
®Hg + CO2
+ 2 HCl
Восстановительные свойства муравьиной кислоты объясняются тем, что она в одно и то же время является кислотой и оксиальдегидом, что видно из ее формулы.
2. при нагревании с концентрированной H2
SO4
распадается с образованием воды и СО:
HCOOH®H2
O + CO
3. соли щелочных металлов при сплавлении распадаются с образованием солей щавелевой кислоты (оксалаты):
2 HCOONa®H2
+ NaOOC-COONa
Уксусная кислота. Широко применяется для получения сложных эфиров, уксусного ангидрида, винилацетата, а также в производстве красителей, лекарственных и душистых веществ. Большое практическое значение имеют и соли уксусной кислоты - натрия, алюминия, хрома, железа, меди, свинца и др. В промышленности уксусная кислота получается рядом способов:
1. окисление алканов;
2. окисление этанола;
3. гидратация ацетилена и окисление получаемого ацетальдегида;
4. уксуснокислое брожение сахарсодержащих растворов.
|