Задача 1. Раствор нитрата калия объемом 60 мл и концентрацией 2 моль/л прокипятили в сильнощелочной среде с 6,48 г алюминия. Выделившийся газ пропустили при нагревании через трубку с оксидом меди(П) массой 11,2 г. Рассчитайте массовую долю меди в полученном твердом остатке.
Решение
1. Напишем уравнения реакций:


2. Рассчитаем количество вещества KNO3
, Al и по веществу, которое прореагировало полностью, определим количество вещества
NH
3:
ra(KNO3
)ζ 0,06 л 2моль/лζ 0,12 моль;
 ж 0,24 моль — прореагирует полностью; ж 0,24 моль — прореагирует полностью;
 0,09 моль. 0,09 моль.
3. Так как по условию задачи необходимо рассчитать массовую долю меди в твердом остатке, следовательно, оксид меди(П) в избытке:



ra(CuO) ж 0,005 моль; (CuO)0,005 моль 80 г/моль ж 0,4 г.
4. Рассчитаем количество вещества и массу образовавшейся меди:
Ti(Cu) жTi^^CuO) ж 0,135 моль; to(Cu)ж 0,135 моль 64 г/моль ж 8,64 г.
5. Hайдем массу смеси и массовую долю меди в ней: т(см.) = m(CuO) K m(Cu); т(см.) = 0,4г K 8,64г = 9,04 г;

Ответ: = 95,58%. = 95,58%.
Задача 2. Cмесь кальция и алюминия (молярное отношение металлов в смеси 2: 3) прокалили с избытком углерода без доступа воздуха. Полученную смесь продуктов обработали водой. Выделившиеся газы пропустили через склянку с бромной водой. Масса склянки увеличилась на 2,6 г. Определите массу исходной смеси.
Решение
1. При прокаливании с углеродом без доступа воздуха (отсутствие кислорода) образуются только карбиды металлов, при обработке которых водой получаются метан и ацетилен. При пропускании этих газов через бромную воду с бромом реагирует только ацетилен, поэтому масса склянки увеличилась на массу ацетилена. Запишем уравнения реакций:
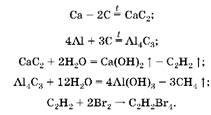
2. Hайдем массу кальция:
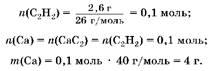
3. Hайдем массу алюминия.
По условию A(Ca): A(Al) = 2: 3, следовательно,
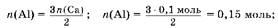
m(Al) = 0,15 моль ■ 27 г/моль = 4,05 г.
4. Вычислим массу смеси:
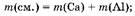
то(см.) ж 4 г K 4,05 г ж 8,05 г. Ответ: то(см.) ж 8,05г.
Задача 3. Смесь хрома и железа массой 1,6 г полностью прореагировала с газом, выделившемся при электролизе 30,4 г 20%-го раствора хлорида меди (II). Определите массовые доли металлов в смеси.
Решение
1. С хлором взаимодействуют и хром, и железо с образованием хлоридов трехвалентных металлов:
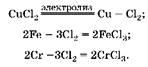
2. Определим количество вещества хлора, полученного при электролизе:

3. Выразим массы металлов через,.
Пусть ra2
(Cl2
)ζ, моль, тогда ra3
(Cl2
)ζ (0,045 —,)моль;
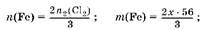

4. Составим уравнение:

Решая уравнение, получаем, что,ж0,015.
5. Найдем массовые доли металлов в смеси:

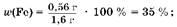

Ответ: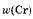 ж 65%; ж 65%; ж 35%. ж 35%.
Задача 4.Продукты реакции, образовавшиеся при сплавлении смеси, содержащей оксид хрома(Ш), гидроксид калия и хлорат калия в стехиометрических количествах, растворили в воде и добавили избыток раствора хлорида бария. При этом образовался осадок массой 50,6 г. Найдите массу оксида хрома(Ш) в смеси.
Решение
1. При сплавлении Cr2
O3
с щелочными расплавами окислителей происходит окисление хрома(Ш) и образуются хроматы:

2. Найдем количество вещества и массу Cr2
O3
в смеси:

Ответ: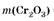 ж 15,2 г. ж 15,2 г.
Задача 5. Смесь оксидов алюминия и хрома(Ш) обработали избытком концентрированного раствора щелочи. Раствор отфильтровали. Осадок отделили, промыли, высушили и прокалили с гид-роксидом натрия, при этом образовалась соль массой 16,05 г. Через фильтрат пропустили избыток углекислого газа, в результате чего образовался осадок массой 3,9 г. Определите массовую долю оксида хрома(Ш) в смеси.
Pешение
1. В концентрированном растворе щелочи растворяется только оксид алюминия с образованием комплексной соли. При пропускании углекислого газа через ее раствор эта соль разрушается и образуется гидроксид алюминия. Смесь хрома(Ш), который не растворился в растворе щелочи, при сплавлении с гидроксидом натрия образует хромит натрия:
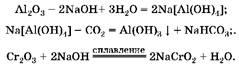
2. Oпределим массу Al2
O3
в смеси:

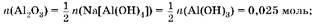
An(Al2
O3
) = 0,025 моль ■ 102 г/моль = 2,55 г.
3. Hайдем массу Cr2
O3
в смеси:

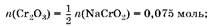
An(Cr2
O3
) = 0,075 моль ■ 152 г/моль = 11,4 г.
4. Hайдем массовую долю Cr2
O3
в смеси:
т(см.) = 11,4 г K 2,55 г = 13,95 г;
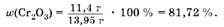
Oтвет: MJ(Cr2
O3
) = 81,72%.
Задача 6. Cмесь хлоридов алюминия и хрома(Ш) массой 317 г обработали сначала избытком раствора гидроксида калия, а затем — избытком хлорной воды. К полученному раствору прилили избыток нитрата бария, при этом образовалось 126,5 г осадка желтого цвета. Рассчитайте массовую долю хлорида хрома(Ш) в исходной смеси.
Pешение
1. В избытке щелочи образуются гидроксокомплексы и алюминия, и хрома(Ш), но с хлорной водой реагирует только гидроксо-комплекс хрома(Ш):

2. По количеству хромата бария (осадок желтого цвета) рассчитаем количество вещества, массу и массовую долю CrCl3
:

Oтвет: M(CrCl3
) = 25,0%.
Задача 7. При гидролизе средней соли образовалось 20,4г вещества H2
X, массовая доля водорода в котором равна 5,88%, и 41,2 г вещества M(OH)3
, массовая доля M в котором равна 50,49%. Oпределите формулу соли.
Pешение
1. Для определения элемента X находим массу и количество вещества элементов водорода и X, содержащихся в 20,4 г вещества H2
X, а также молярную массу элемента X:
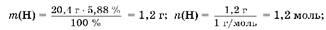
m(X) = 20,4 г - 1,2 г = 19,2 г;

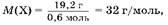
следовательно, X — это сера.
2. Определяем массу элемента М:
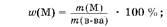
то(М) ж41,2 г 0,5049 ж 20,8 г.
3. Так как количество вещества элемента М и количество вещества M(OH)3
равны, то составим уравнение и определим элемент М, обозначив его молярную массу через

Решая уравнение, находим, что - = 52 г/моль, следовательно, элемент М — это хром.
4. Для определения формулы соли необходимо знать количество вещества элементов серы и хрома:

следовательно, формула соли Cr2
S3
. Ответ: Cr2
S3
.
Задача 7. Газ, образовавшийся при разложении дихромата аммония массой 126 г, смешали с газом, выделившимся при растворении 42 г гидрида натрия в 900 мл 2 M раствора хлороводорода, и пропустили при соответствующих условиях над никелевым катализатором. Продукт реакции растворили в избытке раствора азотной кислоты. Рассчитайте, насколько увеличится масса раствора азотной кислоты.
Решение
1. Масса азотной кислоты увеличивается за счет поглощения аммиака, который образуется при соответствующих условиях из водорода и азота:
(1) (2)
(3)  (4) (4)
2. Найдем количество вещества азота:

3. Определим количество вещества водорода:

ra(HCl) ж 2 моль/л 0,9 л ж 1,8 моль — избыток, значит, количество вещества водорода определяем по NaH:
ra(H2
)ζ ra(NaH) ж 1,75 моль.
4. Сравним количество вещества N2
и H2
. По уравнению:
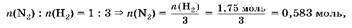
а имеем 0,5 моль, следовательно, азот прореагирует полностью.
5. Вычислим массу аммиака:
ra(NH3
)ζ 2ra(N2
)ζ 1моль; то(NH3
)ζ 1 моль ■ 17 г/моль ж 17 г — на столько увеличится масса раствора азотной кислоты. Ответ: ж 17 г. ж 17 г.
Задача 8. К раствору хлорида железа, содержащему 13,0 г соли, прибавили избыток гидроксида калия. При этом образовался осадок массой 8,56 г. Определите валентность железа в хлориде.
Решение
1. Известны нераствормые гидроксиды железа(11) и железа(Ш). Обозначим валентность железа в хлориде через,:

2. Выразим через & количество вещества соли и гидроксида железа:

3. вставим уравнение:
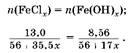
Pешая уравнение, получаем, что валентность железа в хлориде равна III.
Oтвет: III.
Задача 9. Cмесь металла и сульфида данного металла полностью растворилась в 10%-ной соляной кислоте, при этом выделилось 11,2 л (н. у.) газа. При добавлении к образовавшемуся раствору раствора красной кровяной соли образуется осадок синего цвета. При пропускании выделившегося газа через избыток раствора нитрата свинца образуется 47,8 г осадка черного цвета. Oпределите массовые доли компонентов смеси.
Pешение
1. Исходная смесь полностью растворилась в соляной кислоте, следовательно, и металл, и сульфид данного металла прореагировали нацело. Взаимодействие с красной кровяной солью с образованием осадка синего цвета (турнбулевой сини) — качественная реакция на катион Fe2
K
, следовательно, металл — железо, сульфид металла — FeS:

2. Hайдем массу сульфида железа: 
3. Oпределим массу железа:
Ai(H2
) = га(газов) - Ai(H2
S); Ai(H2
) = 0,5 моль - 0,2 моль = 0,3 моль; Ai(Fe) = (H2
) = 0,3моль; An(Fe) = 0,3 моль ■ 56 г/моль = 16,8 г.
4. Вычислим массовые доли компонентов смеси:
т(см.) = 16,8 г K 17,6 г = 34,4 г;

M(Fe) = 100%- 51,16%=48,84%. Oт в е т: M(Fe) = 48,84%; M(FeS) = 51,16%.
Задача 6.334. Cмесь железа и магния обработали концентрированной серной кислотой и собрали газ объемом 1,68 л (н. у.). ^ра-створившийся остаток отделили и обработали разбавленной азотной кислотой, при этом остаток полностью растворился. Полученный раствор осторожно выпарили, соль прокалили. Масса твердого остатка составила 12 г. Oπределите количественное соотношение металлов в смеси.
Pешение
1. Железо при обычных условиях с концентрированной серной кислотой не взаимодействует, но растворяется в разбавленной азотной кислоте с образованием нитрата железа(Ш):

2. Вычислим количество вещества магния:

3. Вычислим количество вещества железа: 
4. Определим соотношение металлов в смеси:!(Fe): Ti(Mg) ж 0,15: 0,3 ж 1: 2. Ответ: ra(Fe): ra(Mg) ж 1: 2.
Задача10.Навеску смеси порошкообразных хрома и марганца обработали хлором без нагревания, масса навески при этом увеличилась на 2,13 г. Полученную смесь растворили в воде. Нерастворившийся твердый остаток отделили и обработали при нагревании концентрированной серной кислотой. Выделившийся газ был поглощен 60 мл 0,2 M раствора перманганата калия. Вычислите массу исходной навески.
Решение
1. С хлором без нагревания взаимодействует только марганец, при этом образуется соль MnCl2
, растворимая в воде. С концентрированной серной кислотой при нагревании взаимодействует хром, причем образуется сульфат хрома(Ш) и выделяется SO2
, который и взаимодействует с перманганатом калия:

2. Найдем массу марганца:
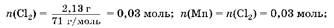
то(Мп) ж 0,03 моль ■ 55 г/моль ж 1,65 г.
3. Найдем массу хрома:

TO(Cr) ж 0,02 моль ■ 52 г/моль ж 1,04 г.
4. Вычислим массу исходной смеси:
то(см.) жTO(Cr) Kто(Мп); то(см.) ж 1,04 г K 1,65 г ж 2,69 г. Ответ: то(см.) ж 2,69 г.
Задача 11. При прокаливании смеси, содержащей равные количества вещества гидроксида, карбоната и нитрата двухвалентного металла, масса смеси уменьшилась на 25,5 г. Определите металл, входящий в состав соединений, а также массу смеси, если смесь не содержит примесей, а массовая доля металла в ней равна 46,83%.
Решение
1. Обозначим молярную массу металла через а количество вещества каждого компонента смеси — через Так как металл двухвалентен, а количества веществ в смеси равны, то масса металла равна 3,- (г).
Выразим массу исходной смеси:
то(исх. см.) жто(Me(OH)2
) Kто(Me(NO3
)2
) KTre(MeCO3
); то(исх. см.) ж-(, K 34) K-(, K 124) K-(, K 60); то(исх. см.) ж 3,- K 218-.
2. Определим металл:

Решая это уравнение, получаем, ж 64, следовательно, металл — медь.
3. Напишем уравнения реакций:
(1) (2  (3 (3
4. Найдем массу исходной смеси.
Так как масса смеси уменьшилась за счет образования газообразных продуктов реакции, то:
о(исх. см.) жо(кон. см.) K 25,5;
то(исх. см.) ж- ■ 98 K- ■ 188 K- ■ 124; то(исх. см.) ж 410-;
то(кон. см.) жTO1
(CuO) K To2
(CuO) K To3
(CuO);
Следовательно, в смеси было по 0,15 моль веществ. Найдем ее массу:
то(исх. см.) ж 0,15 ■ 410 ж 61,5 (г). Ответ: Cu; то(исх. см.) ж 61,5 г.
Задача 12. Hитрат неизвестного металла растворили в воде и полученный раствор разделили на две равные части. К одной части добавили магний, к другой — такую же массу марганца. По окончании реакции масса осадка во второй части оказалась на 3,1 г меньше, чем в первой. После добавления избытка соляной кислоты к обоим осадкам они частично растворились, и их массы оказались равными и составили 21,6 г. Oπределите неизвестный металл.
Pешение
1. Hадо учесть, что осадки — это неизвестный металл, вытесненный из соли магнием и марганцем, который, в отличие от магния и марганца, не растворяется в соляной кислоте:

2. Так как массы осадков равны, то одинаково и количество вещества металла, а, следовательно, равны и количества вещества вступивших в реакцию магния и марганца.
Если прореагирует 1 моль магния и 1 моль марганца, то разность масс осадков будет равна Дт = 55 г -24 г = 31 г. Так как разность масс осадков равна 3,1 г, следовательно, в реакцию вступило 0,1 моль Mg и 0,1 моль Mn. Cогласно уравнениям реакций образовалось по 0,2 моль неизвестного металла. Hайдем его молярную массу:
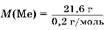 = 108 г/моль, металл — серебро. Oт в е т: Ag. = 108 г/моль, металл — серебро. Oт в е т: Ag.
Задача 12. Что общего и различного в химических свойствах пероксида водорода и бромоводорода? Приведите уравнения реакций, подтверждающие ответ.
Pешение
Oкислительно-восстановительные свойства веществ характеризует величина стандартного восстановительного потенциала:
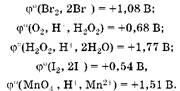
Анализ этих данных показывает, что бромоводород — восстановитель, а у пероксида водорода окислительные свойства преобладают над восстановительными:

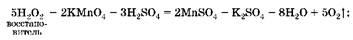
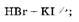
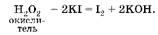
Восстановительные свойства бромоводорода выражены сильнее, чем у пероксида водорода:

В кислотно-основных взаимодействиях растворы обоих соединений проявляют кислотные свойства, например вступают в реакцию нейтрализации:
2HBrKBa(OH)2
жBaBr2
K 2H2
O; H2
O2
KBa(OH)2
жBaO2
K 2H2
O. Но HBr — сильная кислота, а H2
O2
— слабая:
BaO2
K 2HBr ж BaBr2
K H2
O2
.
Оба вещества способны разлагаться:
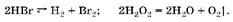
Но реакция разложения бромоводорода обратима и протекает только при нагревании; пероксид водорода может разлагаться самопроизвольно под действием света или в присутствии катализатора. Процесс необратим.
|