ВВЕДЕНИЕ
Электролизеры для производства хлора и щелочи, в которых используется ртутная амальгама, находят широкое применение благодаря возможности получения концентрированных растворов щелочи. Однако в отходящих сточных водах таких электролизеров содержатся примеси ртути, что создает серьезные экологические проблемы.
Глава 1. ЭЛЕКТРОХИМИЧЕСКОЕ ПРОИЗВОДСТВО ХЛОРА, ЩЕЛОЧИ И ГИПОХЛОРАТА НАТРИЯ
Производство хлора и щелочи относится к числу крупнотоннажных электрохимических производств. Подавляющее количество хлора получают электрохимическим методом — электролизом водных растворов хлорида натрия.
Суммарная реакция, протекающая в электролизере, может быть выражена следующим уравнением:
2NaCl + 2H2
O → Cl2
+ 2NaOH + H2
Одновременно с хлором образуется соответствующее количество едкого натра (каустической соды) и водорода.
Основным потребителем хлора является промышленность органического синтеза. Хлор расходуется в производстве хлоридов тяжелых металлов, хлорной извести, для очистки воды. Второй продукт, получаемый одновременно с хлором — едкий натр — используется в целлюлозно-бумажной промышленности, в технологии искусственных волокон, в нефтехимической промышленности.
1.1 Теоретические основы электролиза растворов хлоридов
Получение хлора и щелочи основано на электролизе водных растворов хлоридов щелочных металлов двумя методами: с твердым катодом (диафрагменный) и с ртутным катодом.
На аноде во всех способах электрохимических производств хлора могут протекать две электрохимические реакции — выделение хлора и кислорода:
2Cl-
- 2 →Cl2
(8.б)
2H2
O — 4 → O2
+ 4H+
(8.в)
Выход хлора по току определяется соотношением долей тока, расходуемых на выделение хлора и кислорода. По закону Фарадея при прохождении 1 А/ч электричества при электролизе выделится 1, 232 г хлора, 1,492г гидроксида натрия и 0,0376 г водорода. Вследствие протекания побочных электрохимических реакций на электродах и химических реакций в объеме раствора выход по току продуктов реакции всегда меньше 100%.
Обратимый потенциал разряда ионов хлора в растворе с содержанием 4,53 моль/л NaCl, при температуре 25°С равен 1,325 В; обратимый потенциал выделения кислорода в результате окисления молекул воды, рассчитанный по уравнению Нериста, при 25°С равен 1,23 В. Следовательно, хлор на аноде выделяется при электролизе водных растворов хлоридов за счет более высокого перенапряжения выделения кислорода.
На твердых катодах при электролизе растворов хлоридов щелочных металлов протекает реакция выделения водорода и образуется щелочь по реакции:
2Н2
О + 2 → 2ОН-
+ Н2
(8.г)
С целью снижения перенапряжения на электролизере стремятся уменьшить потенциал выделения водорода. В качестве твердого электрода обычно используют сталь. Потенциал выделения водорода зависит от состояния поверхности катода, плотности тока, температуры и состава раствора.
Обратимый потенциал выделения водорода в растворе, содержащем хлорид натрия и едкий натр при соотношении, реально существующем в условиях электрохимического производства, составляет — 0,845В (отн. н.в.э). Перенапряжение водорода на стальном катоде при электролизе растворов хлорида с твердым катодом составляет 0,3В. Перспективным, вероятно, является снижение потенциала в результате деполяризации катода кислородом. При подаче к поверхности катода кислорода или воздуха протекает реакция:
О2
+ 2Н2
О + 4 → 4ОН-
, (8.д)
которой соответствует потенциал, более положительный, чем потенциал выделения водорода. При использовании пористого графитового катода, подвергнутого предварительной гидрофобизации путем пропитки полимерным соединением, потенциал катода может быть снижен до 0,3 — 0,4В.
Суммарный процесс разложения хлорида натрия выражается следующим химическим уравнением:
2Н2
О + 2 → Н2
+ 2ОН-
2Cl-
→ Cl2
+ 2
2H2
O + 2Cl-
→ Cl2
+ H2
+ 2OH-
или 2H2
O + 2NaCl → Cl2
+ H2
+ 2NaOH
Напряжение разложения в стандартных условиях для этой реакции составляет 2,17В и теоретический расход энергии на 1 т хлора 1640 кв/ч.
Выход по току зависит от степени совершенства разделения катодных и анодных продуктов и от растворимости хлора в анолите. Растворимость хлора в растворе хлорида натрия уменьшается с ростом температуры и концентрации NaCl. Следовательно, побочные реакции, в основе которых лежит растворенный хлор, будут уменьшаться с увеличением концентрации хлорида натрия и температуры.
1.2 Электролиз с твердым катодом и фильтрующей диафрагмой
В первых конструкциях промышленных электролизеров неподвижный электролит разделялся пористой диафрагмой на катодное и анодное пространство. Такая электрохимическая система не дает возможности осуществить производства хлора, каустической соды со стабильными выходами по току, т.к. в этом случае невозможно предотвратить диффузию и электроперенос гидроксильных ионов, накапливающихся в катодном пространстве, в анодное, что приводит к падению выхода по току.
Предотвращение этих потерь может быть обеспечено при электролизе с пористой диафрагмой и твердым катодом при осуществлении принципа противотока, т.е. непрерывной подачи электролита в анодное пространство и фильтрации его через диафрагму в катодное пространство навстречу гидроксид-ионам.
При этом направление движения электролита в порах диафрагмы будет противоположным направлению движения ионов ОН-
, скорость подачи электролита в электролизер (скорость противотока) равна или больше скорости электролитического переноса и диффузии ионов гидроксила из катодного пространства
Условия электролиза. Аноды для хлорных электролизеров должны обладать высокой химической стойкостью. Этому требованию удовлетворяют магнетит, диоксид марганца, уголь, графит, платина.
В производстве хлора используются аноды из графита или окисно-рутениево-титановые аноды (ОРТА). До 70 -годов XX века графит служил основным материалом для изготовления анодов. Недостатком таких анодов является их значительный износ, составляющий 3,5 — 6,0 кг/т хлора, приводящий к возрастанию напряжения на электролизе из-за увеличения межэлектродного расстояния. Диоксид углерода, образующийся вследствие химического износа, загрязняет хлор. Срок службы графитовых анодов не превышает 12 — 14 мес.
В последние годы графитовые аноды вытесняются ОРТА — титановыми анодами, покрытыми слоем оксидов рутения и титана толщиной в несколько микрон. Износ таких анодов составляет 0,1 г/т хлора, что обеспечивает эксплуатацию в течение 4 — 6 лет.
В настоящее время практически все новые электрохимические производства хлора и щелочи по методу электролизера с твердым катодом и фильтрующей диафрагмой оснащены электролизерами с малоизнашивающимися металлическими анодами. Катоды для них изготавливают из малоуглеродистой стали.
Плотность тока зависит от природы материала анода, применяемого в хлорном производстве. При использовании графитовых анодов максимальная плотность тока составляет 1,0 — 1,5 кА/м2
. Применение ОРТА позволяет повысить плотность тока до 2,5 — 3,0 кА/м2
без увеличения напряжения и расхода электроэнергии, т.е. интенсифицировать процесс в 2 раза.
Основным сырьем для производства хлора и каустической соды служит поваренная соль, в небольших масштабах используется также хлорид калия.
Состав раствора характеризуется начальной концентрацией исходного хлорида, рН анолита, концентрацией щелочи и хлорида в электролите. Зависимость выхода по току от концентрации едкого натра в электролитической щелочи представлена на рис. 8.2.
Величина рН прианодного слоя рассола определяет соотношение между выходами по току хлора и кислорода. Выход кислорода по току для ОРТА, представляющего практический интерес в качестве анода в производстве хлора, повышается при рН > 3,5. При понижении рН уменьшается износ графитовых анодов и падает растворимость хлора в анолите.
Примеси некоторых металлов, которые присутствуют в исходном электролите, влияют на процесс электролиза с фильтрующей диаграммой. В порах диафрагмы происходит взаимодействие растворимых солей кальция и магния со щелочью и карбонатами с образованием нерастворимых осадков.
Для очистки рассола от примесей кальция и магния при электролизе с диафрагмой применяют содово-каустический метод, основанный на образовании малорастворимых осадков СаСО3
и Мg(ОН)2
.
В промышленных электролизерах разделение электродных пространств осуществляется с помощью фильтрующей диафрагмы. Диафрагма изготавливается из асбестового волокна, которое осаждается из пульпы, содержащей асбест хлорид натрия, и едкий натр, на катодную сетку.
В последнее время в производстве хлора широко применяют модифицированные полимерным веществом асбестовые осажденные диафрагмы, имеющие более длительный срок службы.
Соль растворяют в горячей воде и подают в нагреватель 2, где температура неочищенного рассола повышается до 50°С. Далее рассол поступает в аппарат непрерывной очистки — осветлитель 3.
Осветленный рассол собирается в баке 5, откуда подается на фильтры 6, где освобождается от механических примесей. Далее рассол поступает на нейтрализацию соляной кислотой в бак 7.
Рассол из напорного бака 9 подается в электролизер 10. Хлор, отводимый из электролизера при повышенной температуре, насыщен парами воды, и поступает на сушку, состоящую из двух стадий — охлаждение водой в колонне 11 и обработка серной кислотой в башне 12. После этого хлор поступает потребителю, либо на сжижение.
Глава 2. ЭЛЕКТРОЛИЗ С РТУТНЫМ КАТОДОМ
Хотя доля хлора, каустической соды и водорода, получаемая при электролизе с ртутным катодом за последнее время уменьшается, но она еще остается значительной.
В способе с ртутным катодом процесс разделен на две стадии. В собственно электролизере идет получение хлора и амальгамы. Последняя из электролизера поступает в другой аппарат разлагатель, где разлагается водой. При этом образуется щелочь, водород и регенерируется ртуть (рис. 8.1б). Катодом в ванне является ртуть — на ней идет разряд ионов натрия, аноды графитовые. Диафрагма не требуется, так как в электролизере выделяется только один газ — хлор.
Анодный процесс в ваннах с ртутным катодом ничем не отличается от анодного процесса в ваннах с твердым катодом.
На ртутном катоде протекает иная электрохимическая реакция, чем при электролизе с твердым катодом. На ртутном катоде происходит разряд ионов натрия с образованием сплава натрия с ртутью — амальгамы:
Na+
+ nHg + → NaHgn
К побочным процессам, протекающим на ртутном катоде, следует отнести выделение водорода и разложегние амальгамы с образованием щелочи и водорода. На ртутном катоде также возможно восстановление молекулярного хлора:
Cl2
+ 2 → 2Cl-
Процесс разложения амальгамы является второй стадией производства хлора, щелочей по методу электролиза с ртутным катодом. Процесс разложения амальгамы проводят в отдельном аппарате, называемом разлагателем. Электрохимическая реакция протекает в короткозамкнутом гальваническом элементе, в котором амальгама является отрицательным электродом.
Условия электролиза. В промышленности используют электролизеры с горизонтальным расположением ртутного катода. Соответственно горизонтально располагаются и аноды. В качестве материала для изготовления анодов используется графит, а также применяются ОРТА. Износ графитовых анодов составляет 4 кг/т хлора. В результате износа расстояние между электродами увеличивается, что приводит к возрастанию напряжения на электролизере. Для предотвращения этого нежелательного явления имеется устройство для опускания графитовых анодов по мере их срабатывания. В современных электролизерах применяют групповое автоматизированное опускание анодов. Графитовые аноды постепенно вытесняются малоизнашиваемыми ОРТА.
Плотность тока. Электролиз с ртутным катодом происходит при более высоких электродных плотностях тока, чем электролиз с фильтрующей диафрагмой и с твердым катодом. Повысить плотность тока при электролизе с графитовыми электродами до 10 кА/м2
(1 А/см2
) удается путем создания и совершенствования системы регулирования межэлектродного расстояния и перфорации анодов, обеспечивающей эффективное удаление пузырьков газа. Электролизеры, оснащенные ОРТА могут работать при плотностях тока до 14 — 15 кА/м2
.
Состав раствора. Концентрация исходного хлорида натрия, поступающего на электролиз с ртутным катодом, не отличается от концентрации электролита, подаваемого в электролит с твердым катодом и фильтрующей диафрагмой. Однако коэффициент разложения хлорида при электролизе с ртутным катодом значительно ниже и не превышает 0,17. Это обусловлено зависимостью потенциала разряда ионов натрия и хлора от их активности в растворе.
Для уменьшения гидролиза хлора и снижения его содержания в растворе рН электролита должен быть не менее 3. Содержание примесей кальция может быть не более 1 г/л, магния — 0,005 г/л.
Температура. Повышение температуры при электролизе с ртутным катодом целесообразно, с точки зрения снижения напряжения на электролизере за счет уменьшения перенапряжения выделения хлора, а значит падения напряжения в электролите.
Однако с повышением температуры понижается перенапряжение выделения водорода и увеличивается скорость разложения амальгамы в электролизере. Поэтому при повышении температуры необходимо увеличивать и катодную плотность тока.
2.1 Перспективы развития хлорной промышленности
До начала 70-х годов около 60% хлора и каустической соды производили электролизом с ртутным катодом, 40% - электролизом с твердым катодом и фильтрующей мембраной. По первому методу получают чистую каустическую соду, не содержащую хлоридов. Однако в связи с тем, что ртуть неизбежно попадает в окружающую среду, в ряде стран электролиз с ртутным катодом интенсивно сокращается. Перспективен метод электролиза с ионообменной мембраной, позволяющий получать щелочь, не отличающуюся по качеству от продукта, образующегося при разложении электролитической амальгамы натрия.
Особенностью современного этапа развития хлорной промышленности является широкое применение металлических анодов. Современные электролизеры оснащены ОРТА. В связи с заменой графитовых анодов на последние усиливается тенденция к повышению электродных плотностей тока до 2 — 3 кА/м2
в диафрагменных электролизерах и до 10 — 14 кА/м2
(1 — 1,4 А/см2
) — в электролитах с ртутным катодом. Освоены в промышленности фильтр-прессные биполярные электролизеры большой мощности.
2.2 Электросинтез гипохлорита натрия
Гипохлорит натрия (NaOCl) является достаточно сильным окислителем и находит применение при очистке от примесей сточных вод, а также как эффективное антисептическое средство. Гипохлорит натрия получают электролизом водного раствора хлорида натрия без диафрагмы. Суммарная реакция образования гипохлорита натрия в электролизере может быть записана следующим образом:
NaCl + H2
O → NaOCl + H2
(8.и)
Побочными электрохимическими реакциями являются:
на аноде 48OCl-
+ 24H2
O → 16ClO3
-
+ 32Cl-
+ 3O2
+ 48H+
+ 48 на катоде OCl-
+ H2
O + 2 → Cl-
+ 2OH-
Условия электролиза. В производстве гипохлорита натрия используют различные материалы для изготовления анодов — графит, магнетит, титан с осажденной на поверхность платиной, ОРТА. Наибольший интерес в настоящее время представляют ОРТА.
Выход гипохлорита по току зависит от потенциала ОРТА. Максимальный выход по току (98,0%) достигается при потенциале анода 1,6 В (отн. нас. каломельного электрода).
Плотность тока зависит от материала анода. При использовании графитовых анодов электролиз можно провести при плотностях тока до 1,4 кА/м2
. На платино-титановых анодах выход гипохлорита натрия по току практически не изменяется до достижения плотности тока 4 кА/м2
(0,4 А/см2
). Оптимальной плотностью тока при электролизе с ОРТА является 1,5 — 2 кА/м2
(0,15 — 0,2 А/см2
). При повышении анодных плотностей тока выход по току гипохлорита натрия несколько снижается, а хлората натрия - возрастает.
Для практического использования пригодны разбавленные растворы гипохлорита, применять концентрированные исходные растворы хлорида натрия экономически нецелесообразно. Обычно элеткролизу подвергают растворы, содержащие 50 — 100 г/л NaCl, а в некоторых случаях — морскую воду.
Оптимальное значение рН раствора
В отходах действующих российских предприятий по производству хлора и каустика, складированных на свалках и в шламохранилищах, содержится до 1200 т ртути. В отвалах и шламохранилищах, расположенных в районе производств хлора и каустика, выведенных из эксплуатации (в основном во 2-й половине 1990-х гг.), содержится до 1300 т ртути. В почвогрунтах в окрестностях закрытых и действующих отечественных предприятий по производству хлора и каустика количество аккумулированной ртути (в результате ее технологических потерь) оценивает более чем в 4000 т; несколько сотен тонн ртути накоплено в донных отложениях водных объектов, расположенных в зонах влияния некоторых из указанных предприятий. По оценкам, в отходах Новосибирского завода химконцентратов, размещенных на свалках и в шламохранилищах, количество ртути составляет от 100 до 500 т. В окрестностях данного предприятия следует ожидать очень высокий уровень загрязнения почвогрунтов ртутью. Судя по всему, все выше приводимые оценки являются минимальными. Например, есть сведения, что в Иркутской области в почвах промышленных предприятий, производящих хлор и каустик, аккумулировано более 1000 т ртути и еще более 2000 т металла находится в шламонакопителях.
Безусловно, во всех отраслях отечественной промышленности, где использовалась или используется ртуть (включая предприятия оборонной промышленности), требуется организация ее максимально полного рециклинга. Это определяет необходимость внедрения строгой статистической отчетности о наличии и(или) потреблении (балансе потребления) металлической ртути, о ее распределении в ходе технологических процессов, о накопленных и вновь образующихся ртутьсодержащих отходах и их утилизации. Следует нормативно запретить вывоз на полигоны (на временное захоронение) и тем более на свалки всех видов ртутьсодержащих отходов; они должны в обязательном порядке перерабатываться и обезвреживаться с получением вторичной ртути.
Особое внимание должно быть уделено организации системы сбора и последующей утилизации широко используемых в промышленности и быту ртутьсодержащих приборов и изделий (ртутных термометров, ртутных ламп и т. д.). В частности, в России в 1998-2002 г. ежегодно использовалось (разбивалось и т. д.) до 9 млн. ртутных термометров, содержащих порядка 18 т металлической ртути [59]. Из этого количества примерно 1 т ртути в той или иной мере утилизировалась (с получением вторичной ртути), а остальная ртуть – 17 т – в конечном счете оказывалась на свалках отходов и в канализационной сети (что характерно для городов и крупных поселков), в почве (особенно в сельской местности), т. е. потенциально способна рассеиваться в окружающей среде, поступая в атмосферу, поверхностные водные системы, грунтовые воды и т. д. В обозримом будущем ртутные термометры будут по-прежнему широко применяться в России в качестве основных средств измерения температуры в самых различных сферах человеческой деятельности и, таким образом, являться существенным источником эмиссии в окружающую среду токсичной ртути. По оценкам, общая масса ртути, присутствующая в эксплуатируемых в настоящее время в России промышленных и медицинских термометрах, составляет не менее 238 т, причем в последние годы на внутренний рынок страны ежегодно поступают ртутные термометры, содержащие порядка 15-16 т ртути (при этом существенная часть металлической ртути, используемой при производстве отечественных термометров, импортируется). Значительное количество ртути (десятки, если не сотни тонн) присутствуют во многих других ртутных и ртутьсодержащих приборах, устройства и изделиях, которые в той или иной мере эффективно (при соблюдении определенных правил) эксплуатируются в различных организациях и на предприятиях страны.
Необходимо отметить, что так называемая ступпа (с содержанием ртути до 50-80%) – продукт переработки ртутьсодержащих изделий и приборов (в основном ртутных ламп), образующаяся на электроламповых заводах и многочисленных демеркуризационных предприятиях страны, насколько известно, практически никогда не поступала на дальнейшую переработку на специализированные предприятия (в частности, в ЗАО «НПП «Кубаньцветмет») с целью получения вторичной ртути. В лучшем случае встречается информация, что ртутная ступпа якобы хранится в специальных емкостях (контейнерах) на станциях (предприятиях) демеркуризации или размещается на свалках-полигонах (в так называемых бункерах временного хранения). Если это действительно так, то к настоящему времени количество ртути в накопленной ступпе составляет – в масштабах страны – около 25 т.
Потенциальными источниками ртути являются предприятия, перерабатывающие и(или) сжигающие каменный уголь (коксохимические заводы, ТЭЦ и т. д.), а также доменное производство и цементная промышленность. Например, в коксохимическое производство страны в 2001-2004 гг. ежегодно (в составе углей) поступало до 3,2-3,4 т ртути, из которых очистными установками улавливалось не более 0,5 т, а около 1,3 т металла выбрасывалось в атмосферу с отходящими газами. В углях, которые ежегодно сжигаются на отечественных предприятиях по выработке электроэнергии и тепла, содержится порядка 15-17 т ртути, из которых 11-13 т эмитирует в атмосферу. Ежегодная эмиссия ртути в атмосферу при производстве доменного чугуна в России в 2001-2004 гг. оценивается в 1,7-1,8 т, при производстве цемента – в 3,1-3,3 т. Определенное количество металла улавливается пылегазоочистными установками. Безусловно, совершенствование систем очистки пылегазовыбросов на указанных промышленных предприятиях позволит не только существенно снизить техногенную эмиссию данного опасного поллютанта в окружающую среду, но и (при утилизации продуктов улавливания) получать вторичную ртуть (до 20-25 т ежегодно).
Глава 3. ИЗВЛЕЧЕНИЕ РТУТИ ИЗ РАСТВОРОВ ПРОИЗВОДСТВА ХЛОРА И ЩЕЛОЧИ
3.1 Извлечение ртути из рассола установок по производству хлора и щелочи
Электролизеры для производства хлора и щелочи, в которых используется ртутная амальгама, находят широкое применение благодаря возможности получения концентрированных растворов щелочи. Однако в отходящих сточных водах таких электролизеров содержатся примеси ртути, что создает серьезные экологические проблемы. Кроме того, потери значительных количеств ртути повышают стоимость производства. Указанные обстоятельства приводят к необходимости извлечения ртути и (или) других ионов тяжелых металлов как из твердых, так и из жидких отходов производства. Процесс извлечения ртути разработан Дж. X. Энтайвислом и предназначен для выделения ртути из рассола, образующегося в электролизерах. Способ включает стадни: осаждение ртути из рассола в виде сульфида ртути при добавлении ионов сульфида или гидросульфида; отделение сульфида ртути на фильтре, у которого в последовательно наложенных слоях материала средний размер частиц уменьшается, а плотность частиц увеличивается от поверхности к нижней части фильтра; удаление сульфида ртути с фильтра путем промывки водой; отделение сульфида ртути от жидкой фазы и обработка сульфида с получением металлической ртути.
Процесс 2 разработанный Е. Н. Балка предусматривает экстракцию ртути из сточных вод с последующим ее выделением путем восстановления в электролизере.
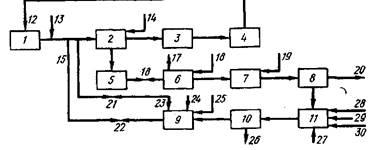
Рис.
1.
Схема процесса выделения и рециркуляции ртути из отходов, образующихся в ртутных электролизерах
Схема этого процесса приведена на рис. 1. Поток рассола 12, прошедший через ртутный электролизер 3, из которого в аппарате 4 удален хлор, насыщается, проходя через слой каменной соли в резервуаре 1. К рассолу добавляют раствор карбоната натрия 13, после чего смесь подают в отстойник 2, в который добавляется раствор гидроксида натрия 14 и где происходит осаждение нерастворимых примесей, которые отводят в сборник 5 вместе с частью рассола (25—50 л/мин). Рассол 12 подается в ртутный электролизер 3, проходит через дехлоратор 4 и снова возвращается для насыщения в резервуар /.
Суспензия из сборника 5 подается в смеситель 6, где она реагирует с отработанной серной кислотой, поступающей со стадии осушки хлора (на схеме не показана). При этом происходит растворение ртути и нейтрализация кислоты. Углекислый газ, образующийся при нейтрализации, выводится по линии 17. Полученную смесь переносят в реактор 7, устанавливают рН = 6,0-=-9,0 и добавляют окислитель 19 в количестве достаточном для окисления всей металлической ртути и нерастворимых ртутных солей до растворимого двухвалентного состояния. В качестве окислителя можно использовать гипохлорит натрия, содержащий свободную NaOH, или газообразный хлор. Во втором случае в смесь вводится дополнительное количество NaOH. Затем суспензию фильтруют на фильтре 8 через полипропиленовую ткань.
Остаток от фильтрования промывают водой и твердый материал 20 удаляют в виде отходов. Фильтрат и промывные воды собирают в резервуаре //, где к ним добавляют другие сточные воды 28, например промывные воды, содержащие растворенную ртуть и воду из отстойников. Для разрушения остатков окислителя добавляют тиосульфат или бисульфат натрия 29. Устанавливают рН раствора 2,5— 6, предпочтительно рН = 3, добавляя раствор соляной кислоты 30, после чего прибавляют избыток NaHS27 для осаждения ртути в виде сульфида. Осадок отфильтровывают через бумажный фильтр 10; для облегчения фильтрования добавляют остатки целлюлозного фильтра.
Фильтрат 26 практически не содержит ртути и сливается в канализацию. Твердый остаток, отделенный на фильтре 10, смешивают с рассолом 23 в резервуаре с мешалкой 9. Можно использовать обычную мешалку, однако для получения наилучших результатов желательно применять специальный дисперсионный миксер с высоким значением действующей поперечной силы. Устанавливают рН полученной суспензии 8—10, предпочтительно рН = 9, добавляя гидроокись натрия 24, а затем вводят окислитель 25.
При использовании гипохлорита натрия количество добавляемого окислителя составляет 3—6 молей на 1 моль сульфида ртути; предпочтительно использовать 5-кратный избыток. Если рН среды намного меньше 8, возможны потери окислителя за счет его реакции с остатками целлюлозного фильтра, а при рН существенно выше 10 может происходить выпадение осадка окиси двухвалентной ртути. Получаемая смесь, содержащая частицы целлюлозного фильтра, диспергированные в растворе хлоридов натрия и двухвалентной ртути, инжектируется в поток рассола между резервуаром / и отстойником 2 (точка 15). Весь процесс выделения ртути может быть изолирован от процесса производства хлора и щелочи путем закрывания вентилей 16, 21 и 22.
В качестве окислителя в данном процессе можно использовать гипохлорит натрия или хлорноватистую кислоту, которая получается при добавлении газообразного хлора в щелочной или кислый рассол. Хлор вводится до тех пор пока его концентрация в растворе не станет достаточной для окисления всей присутствующей ртути.
Экстракция ртути из осадка, образующегося в сборнике 5, проводится при рН среды 6,0—9,0, предпочтительно при рН = 6,0-^-6,5. Описанный процесс позволяет проводить одновременную переработку всех твердых и жидких отходов, образующихся в процессе производства хлора в ртутном электролизере. Основными преимуществами этого процесса по сравнению с известными являются следующие:
1.Он обеспечивает очистку циркулирующего рассола и удаление из него вредных примесей, таких как ионы сульфата.
2.Хорошо применим в случае солей с относительно высоким содержанием примесей (0,5—5 %).
3.Обеспечивает удаление соединений ртути и нейтрализацию отработанной серной кислоты, образующейся при сушке хлора.
4.Позволяет удалять ртуть из всех сточных вод, образующихся в процессе производства, в частности промывных вод и воды из отстойников, без какой-либо их дополнительной обработки.
5.Не требует отдельной стадии очистки растворимых соединений ртути, возвращаемых в рассол.
6.Обеспечивает эффективную экстракцию ртути из остатков, получаемых при отстаивании рассола; при фильтровании получается осадок, который может быть легко отделен и подвергнут дальнейшей переработке.
3.2 Ртуть из шламов процесса производства хлора и щелочи
При производстве хлора и гидроксидов щелочных металлов путем электролиза растворов хлоридов щелочных металлов в электролизерах с ртутным катодом происходит накопление отходов с высоким содержанием гидроксида щелочного металла и металлической ртути; эти отходы представляют собой влажный осадок или шлам.
До настоящего времени эти отходы сбрасываются в специальные карьеры. Такой метод удаления отходов не только является вредным для окружающей среды, но и значительно снижает экономичность процесса электролиза, приводя к потерям сырья и готового продукта. Кроме того этот метод опасен для работающих, поскольку они подвергаются отравляющему действию ртути и могут получить щелочные ожоги. Шламы с высокой концентрацией щелочи имеют высокую температуру замерзания (например, ~10°С для шлама, содержащего 50% NaOH), что создает дополнительные проблемы с оборудованием, используемым для переработки и хранения таких отходов.
Широко распространенным методом переработки отходов, содержащих ртуть, является их нагревание в муфеле, в результате чего выделяется металлическаяртуть. Однако обработка в муфеле щелочных шламов, в частности получаемых при фильтровании концентрированных щелочных растворов или при разложении амальгамы, приводит к значительной коррозии оборудования. Таким образом, существующие способы обработки ртутьсодержащих отходов являются экономически неэффективными и неприемлемыми с точки зрения экологии.
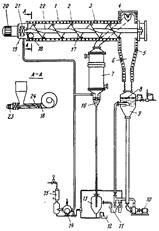
Рис. 1. Аппаратура для удаления ртути из шламов путем нагревания и конденсации
Процесс разработан предназначен для удаления ртути из ртутьсо-держащих шламов и включает предварительную сушку и обжиг шламов при пониженном давлении. Способ обеспечивает высокую эффективность выделения ртути. Схема аппаратуры для проведения этого процесса показана на рис. 1.
Метод по существу осуществляется в две стадии в двух отдельных секциях — печи для непрерывного обжига шлама и в системе конденсации при пониженном давлении.
Печь непрерывного типа нагревается с помощью электрических сопротивлений. Она состоит из горизонтального цилиндрического корпуса /, который снаружи обогревается сопротивлениями 3, независимыми друг от друга, что дает возможность создавать несколько степеней нагрева в зависимости от величины загрузки печи, концентрации воды и ртути.
На одном конце цилиндрического корпуса расположено отверстие 18 для загрузки шлама, а на другом конце имеется колпак 4, через который удаляются газообразные продукты, и выпускное отверстие 5, диаметр которого равен диаметру печи и через которое выводится зола. В разрезе А—А показано устройство типа нажимного винта 24 с уменьшающимся шагом для загрузки шлама. Оно имеет выталкивающую головку с ножами и приводится от электрического мотора с бесступенчатым редуктором 23.
Описанная конструкция позволяет хорошо поддерживать вакуум в системе во время работ. В зависимости от температуры в выходной части печи происходит автоматическое изменение скорости вращения шнекового питателя. Шлам, подаваемый в печь, должен иметь содержание влаги не более 45—50 %; в случае необходимости его подвергают нейтрализации до получения рН = 8-5-9. Внутри цилиндрического корпуса печи вращается вал 22 со шнеком 17 для подачи сырья. Шнек оборудован специальными ножами 2, которые осуществляют перемешивание шлама в процессе обжига и исключают возможность заклинивания шнека.
Шнек вращается электрическим мотором 20, расположенным на конце корпуса печи, с которым он соединен с помощью редуктора 21. Мотор 20 имеет две скорости вращения и передача крутящего момента осуществляется с помощью магнитного детандера, что гарантирует совершенно полное сохранение вакуума. Редуктор 21 может быть расположен в вакуумной камере 19 и отделен от рабочей камеры печи сальником. Работа печи полностью автоматизирована; устройство просто в эксплуатации.
Шлам, загруженный в печь, перемещается с помощью шнека, При этом происходит дегидрирование материала, начинается его обжиг и дистилляция содержащейся в нем ртути. Рабочее давление составляет 6 кПа при 250 °С; при этих условиях вся присутствующая ртуть переходит в парообразное состояние. Указанные условия поддерживаются автоматически за счет изменения скорости подачи сырья, скорости вращения шнекового питателя (2 скорости) и установки нескольких комплектов электрических нагревательных элементов. Зола, образующаяся в результате процесса, совершенно не содержит ртути.
Из системы, работающей в вакууме, непрерывно выводится образующаяся зола и отходящие газы, которые направляют в систему конденсации. Зола, выталкиваемая шнеком, падает в трубу 6, которая также обогревается электрическими сопротивлениями. Затем зола поступает в контейнер 9, который до определенного уровня наполнен водой 8.
Автоматическая система поддерживает температуру этой воды постоянной (~37°С), что несколько выше температуры, соответствующей давлению паров воды при проведении процесса при давлении 6 кПа (35,8 °С). В результате этого при попадании горячей золы в воду образуется водяной пар, количество которого зависит от температуры золы и ее удельной теплоемкости. Образующийся пар перегревается горячими стенками трубы до 250 °С и, двигаясь противотоком к золе, предотвращает конденсацию ртути и таким образом ее потери с золой. Для ускорения растворения золы в воде предусмотрен насос 10, который обеспечивает интенсивную циркуляцию смеси в контейнере 9.
После выпуска растворенной золы система автоматического контроля уровня снова наполняет контейнер 9 водой с заданной температурой до требуемого уровня. Пары, выходящие из печи при температуре 250 °С через колпак 4, содержат перегретый водяной пар, образующийся из воды имевшейся в сырье и при взаимодействии горячей золы с водой, а также пары ртути. Отходящие газы направляют в вертикальный трубчатый конденсатор 7, охлаждаемый водой.
Конденсат собирается в нижней части накопителя 6, оборудованного гидрозатвором, выход которого непосредственно сообщается со сборником 13, находящимся при атмосферном давлении. В состав конденсата входят вода и ртуть: вода стекает по сливной трубе И, а ртуть автоматически выводится из нижней части сосуда по сифону\12.
Паровая фаза из накопителя 16 представляет собой водяной пар, содержащий следы ртути и неконденсируемые фракции; последние практически полностью состоят из воздуха, который был растворен в воде, используемой для обработки золы, или был окклюдирован в сырье. Эти пары удаляются вакуумным насосом 14, который обеспечивает поддержание в системе давления 6 кПа.
Содержание ртути в парах, поступающих в насос, зависит от температуры охлаждающей воды в теплообменнике 7. Для того, чтобы концентрация ртути в газе, выбрасываемом в атмосферу, не превышала 0,1 мг/м3
, пары, выходящие из насоса, поступают в конденсатор 15, где происходит дополнительная конденсация при давлении 0,1—0,3 МПа. В другом варианте процесса, если вакуумный насос не приспособлен для очень больших перепадов давления, охлаждающая жидкость, используемая в конденсаторе 15, также может охлаждаться хотя бы до 4— 6 °С водой, подаваемой из небольшой сепаратной холодильной системы.
В любом случае количеств газа, выбрасываемого в атмосферу, составляет несколько десятых литра в час, а содержание ртути в нем превышает 0,1 мг/м3
при нормальных условиях.
Еще один процесс обработки шламов разработан В. М. Лоо. Он включает стадии смешивания щелочного шлама с жидкостью под давлением с образованием щелочной суспензии, разделение последней на щелочной раствор, металлическую ртуть и остаточный шлам, который направляют на обжиг в муфель, где выделяется более 99 % ртути, содержащейся в остаточном шламе.
Процесс позволяет извлекать ртуть и щелочь и не приводит к загрязнению окружающей среды. Он обеспечивает безопасность работающих и не требует введения химических реагентов, приводящих к образованию нежелательных побочных продуктов и повышению стоимости обработки. Схема процесса приведена на рис. 115.
Щелочной шлам загружают в реактор 1. Жидкость подают через отверстие в нижней части реактора, она поднимается вверх и, проходя через шлам, образует суспензию, содержащую металлическую ртуть, раствор щелочи и твердые частицы. После разделения металлическая ртуть выводится из реактора и поступает в резервуар 2. Щелочной раствор выводится через отверстие в верхней части реактора /. Остаточный шлам подают в сепаратор 3, где происходит отделение остаточного щелочного раствора, который возвращается в реактор /. Твердая фаза из сепаратора 3 подается в муфель 4 для выделения остаточной ртути.
3.3 Ртуть из ртутного скрапа
Практически весь металл может быть регенерирован из ртутных электролизеров, электрических аппаратов и контрольно-измерительных приборов в случае демонтажа установки или оборудования. Основными поставщиками ртутного скрапа являются инструментальное производство, электропромышленность, научно-исследовательские лаборатории и предприятия по производству ртутных аккумуляторных батарей. Одним из важных источников ртути являются амальгамы, применяемые в зубоврачебной практике. В течение последних лет произошло сильное падение цены на ртуть, что делает нецелесообразным извлечение ртути из материалов, в которых ее содержание мало. Однако одновременно возросли требования к удалению ртути из отходов, выбрасываемых в окружающую среду. На многих предприятиях проводится переработка собственного ртутного скрапа и выделяемая ртуть возвращается в процесс производства.
3.4 Ртуть из отработанных катализаторов
Известно, что хлористый винил получают из ацетилена и хлористого водорода в присутствии катализатора — активированного угля, обычно содержащего 10 % (по массе) хлорида двухвалентной ртути. Реакция начинается при температуре 80 °С, в процессе реакции происходит разогрев и температура в реакторе поддерживается 120—150 °С В процессе работы происходит постепенная сублимация хлорида ртути, а также уменьшение поверхности активированного угля в результате накопления продуктов конденсации и полимеризации, которые проникают в поры катализатора.
В большинстве случаев катализатор теряет свою активность через 8—15 мес. работы. В отработанном катализаторе содержится 2,2—5,8 % хлорида ртути. Ее содержание зависит от срока службы катализатора и условий эксплуатации. Неактивный катализатор выгружают из реактора в сосуд с известью. Выброс отработанного катализатора в окружающую среду нежелателен как из экологических, так и из экономических соображений.
Этот процесс разработан А. Якобовски, он предназначен для выделения ртути из отработанного катализатора — хлорида ртути на активированном угле, содержащего примеси, путем сжигания активированного угля при недостатке кислорода или воздуха. В состав образующихся продуктов сгорания входят пары ртути и хлориды одно- и двухвалентной ртути. При охлаждении газообразных продуктов происходит их конденсация, после чего добавляют восстановитель, который переводит хлориды ртути в металлическую ртуть.
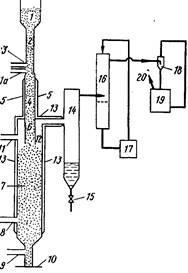
А процесс, разработанный X. Майвальдом предназначен для выделения соединений ртути, в частности хлорида двухвалентной ртути, из отработанных катализаторов, содержащих ртуть. Согласно этому процессу, катализатор нагревают при температуре 270—600 °С, пропуская через него газ-носитель, который затем собирается вместе с содержащимися в нем продуктами десорбции и охлаждается. Процесс в частности включает предварительную обработку отработанного катализатора хлором при 100—300 °С, предпочтительно при 150— 270 °С В ходе процесса не происходит образования сажи, твердых органических продуктов, а также осаждения ртути и нерастворимого хлорида одновалентной ртути. Схема процесса представлена на рис. 115. Отработанный катализатор из накопительного резервуара / по трубопроводу 2 подается в трубу 4, которая нагревается снаружи до температуры 300—500 °С, предпочтительно до 350—450 °С нагревательным устройством 5. В нижней части питательной трубы 2 находится трубка для подачи азота 3. В пространстве между трубкой 3 и зоной предварительного нагрева, находящейся на уровне нагревательного устройства 5, по линии Па подается хлор для предварительной обработки катализатора, которая осуществляется при температуре 100—300 °С, предпочтительно при 150—270 °С Требуемая температура предварительной обработки может поддерживаться путем разбавления хлора инертным газом, например азотом. Разбавление приводит к уменьшению скорости сильно экзотермической реакции хлора с примесями различных органических соединений, присутствующими в катализаторе, что позволяет снизить температуру в реакторе.
Предварительно обработанный катализатор поступает в трубу 6 и по ней в реактор хлорирования 12, в который по линии 11 подается хлор и которая подогревается нагревательным устройством 13. В реактор десорбции 7 по линии 8 подается кислород или воздух, а по линии 9 азот; скорость подачи газов контролируется расходомером 10. Реактор 7 соединен с конденсатором 14, который имеет выгружающее устройство для вывода сконденсировавшегося HgCl2
. Для удаления остаточного HgCla
имеется скруббер 16 с циркулирующим раствором соляной кислоты 17. Азот выводится из скруббера 16 с помощью насоса 18, который рециркулирует разбавленный раствор щелочи 19, и удаляется из системы вентилятором 20.
Процесс, разработанный X. Мюллером предусматривает сжигание активного угля в таком количестве кислорода или воздуха, чтобы обеспечить получение продуктов сгорания, содержащих пары металлической ртути, в состав которых входят 0,5—5 % (объемн.) кислорода и 2—15 % (объемн.) оксида углерода. Продукты сгорания обрабатывают в зоне конденсадии водой, в результате чего происходит отделение присутствующей ртути. Газы, всходящие из зоны конденсации, поступают в скруббер, орошаемый щелочным раствором, а затем выбрасываются в атмосферу.
Аппарат для проведения этого процесса состоит из шахтной печи с решеткой и клапаном в нижней части, а также из башенного скруббера, орошаемого раствором щелочи. В нижней части шахтной печи, над клапаном, имеется трубопровод для подачи катализатора. Между печью и скруббером расположена зона конденсации, в которую подается вода. В верхней части скруббера имеется выходная труба с вентилятором.
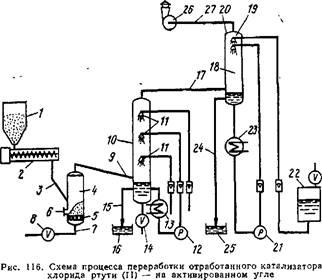
Схема аппарата показана на рис. 2. Отработанный катализатор, содержащий примеси, подается из резервуара / по транспортеру 2 и трубе 3 на решетку 5, расположенную в нижней части шахтной печи 4. Желательно подавать на решетку 5 относительно небольшие количества катализатора. Между решеткой 5 и отверстием трубы 3 расположен клапан 6. В печи 4 имеется также трубопровод для подачи воздуха 7 с запорным вентилем 8 и труба для вывода отходящих газов 9.
Трубопровод 8 соединен с нижней частью конденсатора 10, в котором расположены жиклеры 11. Жидкость из нижней части конденсатора 10 подается насосом 12 через теплообменник 13 в жиклеры 11. В нижней части конденсатора 10 находится вентиль 15 для слива конденсирующейся металлической ртути. Ниже места входа трубы 9 расположена S-образная отводная трубка, соединенная с резервуаром для нейтрализации 16. В верхней части конденсатора 10 находится труба для отходящих газов 17.
По трубопроводу 17 отходящие газы поступают в нижнюю часть скруббера 19, заполненного насадкой 18, в котором имеются жиклеры 20, расположенные в верхней части по центру скруббера один над одним. Насос 21 подает к жиклерам раствор гидроксида натрия из резервуара 22. Насос 21 также обеспечивает рециркуляцию щелочного раствора из Нижней части скруббера через тепллобменник 23 к жиклерам. Ниже места входа трубы 17 находится S-образная отводная трубка 24, которая соединена с резервуаром 25. В верхней части скруббера 19 находится труба 27 с вентилятором 26, который выбрасывает в атмосферу газы с содержанием ртути 1—2 мг/м3
.
|