ОСНОВИ ГОРІННЯ ПАЛИВ ТА ПРОЦЕСИ УТВОРЕННЯ БЕНЗОПІРЕНУ І ПОЛІАРОМАТИЧНИХ ВУГЛЕВОДНІВ
1 Основа горіння та реакції окислення горючих речовин палив
Основу горіння складають реакції окислення горючих речовин (пальне і окислювач) перетворюються в нові з іншими фізичними та хімічними властивостями, які називаються продуктами спалення. Характерною ознакою горіння є швидко протікаючий процес, що супроводжується інтенсивним виділенням теплоти, різким збільшенням температури та утворенням розжарених продуктів з різноманітною ступінню світності.
Для протікання хімічної реакції між горючими речовинами палива та окислювачем поперед всього необхідно утворити фізичний контакт між молекулами взаємодіючих речовин і довести молекули до такого стану, при якому стають можливими хімічні реакції між ними. Перше відбувається в процесі утворення горючої суміші, друге - при її запаленні. Таким чином, горіння є складним фізико-хімічним процесом, що включає низку послідовно та паралельно протікаючих фізичних і хімічних стадій.
Розрізняють горіння без втрат теплоти палива, чи повне, і горіння з втратами теплоти, чи неповне. При повному горінні всі горючі речовини палива беруть участь в окислювальних процесах, при цьому утворюються тільки оксиди - CO2
, SO2
, H2
O.
Реальне горіння, як правило, є неповним. Розрізняють механічну і хімічну неповноту горіння. В першому випадку деяка кількість палива в процесі горіння не бере участі. Хімічні втрати з`являються у випадку хімічно неповноцінного окислення сполук, що вміщують вуглець, з утворенням оксиду вуглецю, а також у випадку, коли частина горючих газоподібних речовин, що отримуються при випарюванні та термічному розкладі рідкого палива (CO2
, H2
, CH4
та ін), залишають камеру спалення до завершення окислювальних процесів.
В якості окислювача при горінні переважно використовується кисень атмосферного повітря, що пояснюється його доступністю і простотою використання.
Процес горіння газоподібного палива можна умовно поділити на дві стадії: перша - утворення горючої суміші (суміші палива та повітря); друга - нагрівання, запалення і горіння горючої суміші. Більш складно протікає горіння рідкого палива. Першою стадією горіння рідкого палива є нагрівання та випарювання пального. Потім пари пального, які утворилися, змішуються з повітрям і відбувається нагрів, запалення і горіння горючої суміші.
В залежності від агрегатних станів пального та окислювача розрізняють гомогенне та гетерогенне горіння. Якщо пальне і окислювач знаходяться в однакових агрегатних станах і між ними відсутня поверхня розділу фаз, то вони утворюють гетерогенну систему. В гетерогенній системі пртікає горіння рідкого палива.
Інтенсивність горіння газу та парів рідкого палива виражається кількістю пального, що визначається на одиницю об`єму за одиницю часу, кг/(м3
с) чи м3
/(м3
с)
 , (1) , (1)
де  - витрати пального, кг/с чи м3
/с; - витрати пального, кг/с чи м3
/с;
 - об`єм реагуючої системи, м - об`єм реагуючої системи, м
В реальних умовах інтенсивність горіння, що визначається за швидкістю витрат і горючих речовин, залежить не тільки від швидкості протікання хімічної реакції, але і від швидкості процесу сумішоутворення, визначним фактором якої є інтенсивність протікання турбулентної та молекулярної дифузії. Результуюча швидкість залежить від швидкості найбільш повільного процесу. В залежності від швидкості хімічної реакції та швидкості сумішоутворення розрізняють кінетичне та дифузійне горіння.
Якщо швидкість протікання хімічної реакції між пальним та окислювачем значно нижче швидкості утворення горючої суміші, то результуюча швидкість процесу горіння лімітується тільки швидкістю хімічної реакції, тобто процесами хімічної кінетики. Таке горіння називають кінетичним. Якщо швидкість підводу окислювача до пального значно менша швидкості хімічної реакції окислення, то сумарна швидкість горіння не залежить від швидкості реакції і лімітується тільки швидкістю процесу сумішоутворення, визначним фактором якого є процеси дифузії кисню до пального. Таке горіння називають дифузійним.
Швидкість протікання хімічних реакцій між молекулами пального і окислювача зі збільшенням температури прогресивно зростає. Разом із тим швидкість сумішоутворення, яка визначається процесами турбулентної та молекулярної дифузії в об`ємі газу, від температури практично не залежать. Швидкість прямої хімічної реакції можна записати в наступному вигляді
 (2) (2)
де  - константа швидкості реакції, що залежить від температури та хімічної природи реагуючих речовин; - константа швидкості реакції, що залежить від температури та хімічної природи реагуючих речовин;
 - відповідні поточні концентрації реагуючих речовин А та В в суміші; - відповідні поточні концентрації реагуючих речовин А та В в суміші;
 - числа молей реагуючих речовин. - числа молей реагуючих речовин.
В свою чергу k значно залежить від температури процесу. Ця залежність має експоненціальний характер і виражається законом Арреніуса
 (3) (3)
де  - передекспоненціальний множник; - передекспоненціальний множник;
 - енергія активації; - енергія активації;
 - газова стала; - газова стала;
 - абсолютна температура процесу. - абсолютна температура процесу.
До реагування здатні так звані активні молекули, які мають енергію, достатню для руйнування внутрішньомолекулярних зв`язків вихідних речовин. Цей рівень енергій називають енергією активації Е. Чим вищій рівень енергії активації, тим складніше проходить руйнування вихідних молекул та повільніше швидкість реакції.
Число активних молекул різко збільшується зі збільшенням температури. Енергія активації залежить не тільки від внутрішньоатомних зв`язків в молекулі, але і від того, з якою речовиною (в якому стані) відбувається реакція. При контакті, наприклад, молекули горючої речовини з часткою, яка має заряд типу ОН-
, Н+
, О2-
, енергія активації суттєво зменшується, а швидкість реагування дуже зростає.
Як правило, максимальна швидкість реакції відповідає стехіометричним концентраціям пального та окислювача.
Існує нижня межа концентрації пального (НМ), нижче якої горіння стає неможливим, та верхня межа (ВМ), коли вже відчувається нестача окислювача для підтримки горіння.
У всьому діапазоні концентрації між цими межами при внесенні в горючу суміш джерела запалення відбувається стійке горіння.
Температура горючої суміші, починаючи з якої суміш здатна до самоприскорення хімічної реакції до стійкого горіння, називається температурою запалення. На рисунку 1 показана залежність швидкості реакції від визначаючих факторів.
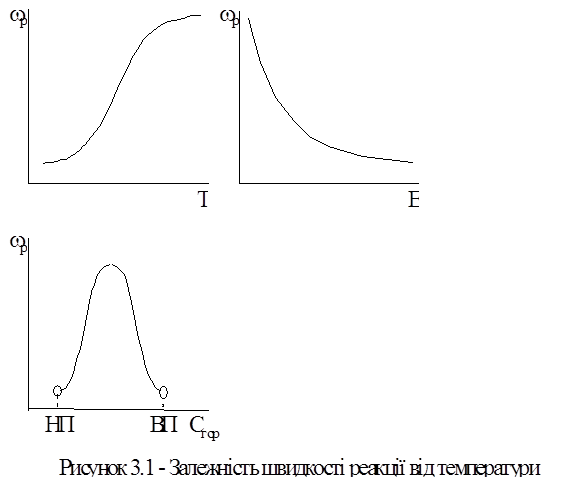
Експериментально встановлено, що швидкості проходження реакції суттєво перебільшують їх розрахункові значення, які отримані з використанням закону Арреніуса. Насправді реакції у речовинах, які знаходяться у парогазовому стані, проходять частіше не між вихідними молекулами пального та окислювача, а через низку проміжних стадій, в яких разом із молекулами беруть участь активні осколки молекул - радикали та атоми, які мають вільні зв`язки, - H, OH, O, CH та інші.
При цьому перехід від вихідних речовин до кінцевих продуктів відбувається через низку проміжних реакцій, які протікають з більшою швидкістю, тому що вони володіють низькою енергією активацій. Такі реакції, відмітною рисою яких є велика швидкість їх протікання, отримали назву ланцюгових.
При горінні газів протікають розгалужені реакції, в процесі яких один активний центр породжує два чи більше число активних центрів. Теорію ланцюгових розгалужених реакцій зробив академік Н.Н. Семенов.
В якості прикладу розгалуженої ланцюгової реакції може подаватися схема спалення водню. Первинними активними проміжними речовинами в цьому випадку є атомарний водень, кисень чи гідроксильна група, початкове утворення яких можливе в результаті дисоціації молекул при високих температурах. У теперішній час вважається, що окислювання водню починається з реакції
H2
+ O2
® OH + OH.
Радикали OH, які утворюються, можуть надалі брати участь у ланцюговій реакції
OH + H2
® H2
O + H
і давати нову активну частку - атом водню.
Шляхом реакції молекули кисню з атомом водню
O2
+ H ® OH + H
Цей атом утворює ще дві активні частки, які можуть реагувати за наведеним вище рівнянням чи за рівняннями:
O + H2
® OH +H
O + H2
O ® OH +OH.
Підсумок одиничного ланцюгового циклу подається рівністю
H + 3H2
+ O2
® 3H + 2H2
O.
Механізм горіння оксиду углерода та вуглеводнів також має характер розгалужених ланцюгових реакцій, при цьому проходження цих реакцій, особливо для вуглеводнів, має більш складний і до кінця ще не з`ясований характер.
2 Утворення екологічно шкідливих речовин при горінні палива
Склад відпрацьованих газів ДВЗ та кількісне співвідношення в них окремих компонентів залежать від властивостей і складу робочої суміші, яка спалюється, а також від ступеня закінченості реакції горіння.
Утворення шкідливих речовин багатостадійне і проходить наступним чином: альдегіди, оксид вуглецю, вуглеводні, сажа, канцерогенні речовини - з`являються внаслідок неповного окислення палива та його піролізу, а також синтезу нових речовин; оксиди азоту утворюються в зоні горіння в результаті реакцій окислення азоту повітря і палива; оксиди сірки утворюються внаслідок окислення сірки палива.
Загальний механізм утворення основних вуглецевовміщуючих токсичних елементів відпрацьованих газів ДВЗ можна представити наступним чином:
    
При спаленні метану:
CH4
+ O2
® HCHO + H2
C,
HCHO + O = CO + H2
O,
HCHO + OH = CO + H2
O + H,
HCHO ® CO + H2
.
Альдегіди є продуктом неповного спалення вуглеводнів. Найбільш суттєвий внесок в токсичність ВГ (серед альдегідів) вносить формальдегід (HCHO), який представляє собою газ з різким неприємним запахом.
Догоряння CO до CO2
:
CO + OH = CO2
+ H.
3. Механізм утворення канцерогенних вуглеводнів
Можна стверджувати, що канцерогенні речовини, що надходять у навколишнє середовище, - продукти повного спалення органічних палив. Незважаючи на багаторідність канцерогенних речовин, які утворюються при горінні палив, присутність їх в продуктах спалення та повітрі завжди оцінюється за наявністю бенз(а)пірену.
Стехіометричне рівняння утворення бенз(а)пірену
C6
H2
+ 3C2
H2
+ 4C2
H = C20
H12
,
де C6
H2
- напіврадикал, який представляє собою зародок сажі;
C2
H2
та C2
H- елементарні будівельні блоки.
Звичайно бенз(а)пірне утворюється в локальних збагачених паливом зонах камери спалення при зменшених температурах. Для зниження рівней утворення бенз(а)пірену та інших канцерогенних вуглеводнів необхідно здійснювати високоякісне розпалювання палив і змішування його з повітрям. При дуже високих температурах бенз(а)пірен та інші канцерогенні ПАВ починають руйнуватися.
|