Как вытекает из самого названия, полярография основана на явлении поляризации электродов при прохождении электрического тока через проводники второго рода (растворы электролитов). Поляризация электродов обусловлена замедленностью электродных процессов. Она складывается в основном из трех видов: электрохимической, концентрационной и омической. Для уяснения сущности электрохимической поляризации рассмотрим следующий опыт.
Предположим, что взят водный раствор СиС12
, в который опущены два платиновых электрода, присоединенные к источнику постоянного электрического тока. Через раствор проходит электрический ток, в результате чего на катоде выделяется медь (Си2+
-{-2е—*Си), а на аноде — хлор (2С1~—2е—>-С12
). Таким образом, в результате электролиза образуется новый гальванический элемент из двух новых электродов (Cu/Cu2
+ и С12
/2С1_
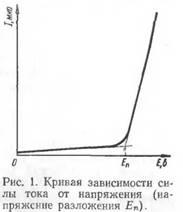
), электродвижущая сила которого направлена против приложенного извне напряжения. В связи с этим сила тока в цепи будет падать, практически приближаясь к нулю. Если напряжение внешней цепи повысить, то сила тока в цепи вновь возрастает, но по мере дальнейшего выделения продуктов электролиза на электродах она снова будет уменьшаться. При повторном повышении напряжения такая закономерность будет повторяться до тех пор, пока величина напряжения, приложенного извне, не будет достигать электродвижущей силы вновь образовавшегося гальванического элемента и на бесконечно малую величину превышать эту силу. После этого сила тока в цепи будет непрерывно расти с повышением напряжения. Кривая зависимости силы тока от приложенного напряжения в такой «цепи приведена на рис. 1.
Если (провести касательную от скачкообразно возрастающей части кривой силы тока / до оси абсцисс Е, то найдем значение электродвижущей силы (э.д.с.) гальванического элемента, который образовался вследствие электролиза. Эта э.д.с, как уже было указано выше, направлена против приложенного напряжения и называется электродвижущей силой поляризации.
В существовании ее нетрудно убедиться, если, выключив во время электролиза источник тока, присоединить проводником электроды к клеммам гальванометра! При этом стрелка гальванометра отклонится в сторону! противоположную той, в которую она отклонялась пол влиянием внешней э. д. с. при электролизе.
То наименьшее напряжение, которое необходимо приложить к электродам для того, чтобы вызвать непрерывный электролиз данного электролита, называется напряжением разложения. Оно должно быть больше, чем э.д.с. электрохимической поляризации.
Причиной поляризации может являться не только возникновение нового гальванического элемента вследствие выделения на электродах продуктов электролиза, но и изменение концентрации ионов в приэлектродном пространстве.
Например, при электролизе раствора CuS04
с медными электродами на аноде медь будет растворяться, а на' катоде осаждаться.
Поэтому в процессе электролиза, несмотря на диффузию ионов в растворе из более концентрированных областей в более разбавленные, концентрация ионов меди у анода несколько увеличится, а у катода уменьшится, и в результате возникнет концентрационный гальванический элемент, э.д.с. которого также направлена против приложенного напряжения (концентрационная поляризация).
Сдвиг потенциала (по сравнению с его равновесным значением при отсутствии тока), происходящий вследствие изменения концентрации потенциалопределяющих ионов у электродов в процессе электролиза, характеризует величину концентрационной поляризации.
Омическая поляризация обусловлена образованием на поверхности электрода тонкой пленки, состоящей из оксидов, гидроксидов металлов или адсорбированных молекул органических веществ (при исследовании растворов органических соединений).
Величина омической поляризации равна RI, где R — электросопротивление пленки, at— сила тока.
Полярографический метод основан на определении зависимости силы тока от потенциала при электролизе) раствора исследуемого вещества в определенных условиях, в специальном электролизере.
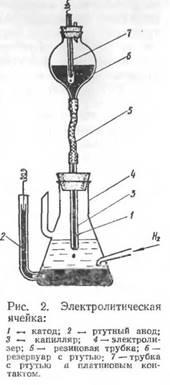
Основная часть полярографа представляет собой электролитическую ячейку, состоящую из сосуда, наполненного раствором анализируемого вещества, и двух ртутных электродов (рис. 2). Анодом является ртуть, заполняющая дно сосуда; катодом — капли ртути образующиеся на конце капиллярной трубки, заполненной ртутью. Под влиянием собственной тяжести капля ртути падает на дно сосуда, после чего образуется новая капля и т.д. Таким образом, катодом является непрерывно возобновляющаяся капля ртути.
При прохождении через раствор даже небольшой силы тока (106
а) благодаря малой поверхности, а следовательно, большой плотности тока на ртутной капле, происходит химическая поляризация катода за счет восстановления ионов или молекул исследуемого вещества на поверхности электрода. В результате электрохимического восстановления на поверхности ртутной капли образуется вещество, при этом потенциал катода ек
определяется соотношением концентраций исходного и восстановленного вещества и является характерным для данной реакции.
Так как площадь ртутного анода большая, а плотность тока на нем мала, то химические явления не способны изменить электродный потенциал анода еа
, поэтому потенциал анода практически сохраняется неизменным.
Таким образом, при прохождении тока через описанную ячейку, когда протекает непрерывный электролиз, возникает электродвижущая сила поляризации, равная £п = еа
— ек, направленная навстречу приложенному напряжению Е. Если учесть омическое сопротивление, то сила тока по закону Ома равна:

отсюда
где R— сопротивление раствора между электродами. Поскольку сопротивление Я раствора обычно не превышает 100 ом, то произведение IRочень мало (Ю-6
-100= =0,1 мв); в таком случае можно считать, что IR^O, следовательно:
Принимая постоянный потенциал анода условно за нуль, получим выражение:
показывающее, что все приложенное напряжение Е уравновешивается потенциалом поляризации катода. Поэтому такой ртутный электрод называют абсолютно поляризующим. Потенциал его зависит от природы восстанавливающегося на нем иона или вещества.
Зависимость «сила тока — потенциал» выражается обычно графически в виде поляризационных кривых (полярограмм). Величины потенциалов в вольтах (или милливольтах) откладываются на оси абсцисс, а соответст-

вуюшие им силы тока в микроамперах — на оси ординат. Общий.вид типичной поляризационной кривой приведен на рис. 3. Так как ртутные капли сменяют друг друга через определенный промежуток времени, то по-лярограммы имеют обычно зубчатый вид, поскольку в момент отрыва капли ток прерывается. Сопротивление раствора должно быть возможно меньшим (<С 1000 ом), поэтому для увеличения электропроводности вводят в раствор добавки электролитов, не вступающих в реакцию с испытуемым раствором и не выделяющихся на электроде при потенциалах восстановления исследуемых веществ. Такие добавки называют фонами (КС1, LiCl, Na2S04
, NH4CI, тетраалкиламмониевые соли и др.).
Значение фона не ограничивается только уменьшением сопротивления раствора и подавлением миграционного тока, образующего максимумы на полярограммах.
В ряде случаев фон позволяет в результате комплек-сообразования с исследуемым веществом раздвинуть потенциалы полуволн определяемых ионов и тем самым сделать возможным их раздельное определение б смеси.
Подбором соответствующих фонов электролитов и рН среды можно также расширить пределы применения ртутного капельного электрода в катодной области и тем увеличить число ионов, которое можно определять поля-рографически.
При низких потенциалах через электролизер проходит очень слабый, почти не меняющийся с ростом потенциала ток (остаточный ток). При определенном, характерном для каждого вещества, потенциале начинается процесс электролиза: растворенное вещество восстанавливается или окисляется на капельном ртутном электроде.
Потенциал, при котором начинается электролиз, называют потенциалом выделения. Начало процесса электролиза характеризуется быстрым ростом силы тока даже при незначительном увеличении потенциала — скачок силы тока (см. рис. 3). Но сила тока возрастает не бесконечно, а достигает некоторого предельного значения, после чего не меняется при дальнейшем увеличении потенциала.
Этот ток называют предельным, или диффузионным, так как он зависит от скорости диффузии восстанавливающегося вещества. В результате на графике получается
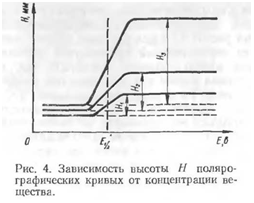 |
характерная кривая с изгибом, которую называют поля- I рографической волной.Образование волны указывает прежде всего на наличие в испытуемом растворе вещества, способного к восстановлению (или окислению, если капельный ртутный электрод служит анодом). Потенциал, при котором наблюдается скачок тока, может служить для целей качественного анализа, а высота волны, то есть отрезок меж-1 ду двумя горизонтальными участками кривой, может служить для целей количественного анализа, так как ток определяется скоростью диффузии ионов к катоду, зависящей от концентрации ионов в растворе. Высота Я волны лолярограммы зависит также от размеров ртутной капли и от времени смены капли. Однако кривые, полученные для различных концентраций определяемого вещества в растворе (рис. 4), симметричны относительно середины волны. Напряжение, соответствующее полуволне, не зависит от концентрации ионов или молекул в растворе, от масштабов диаграммы и от параметров ячейки. Поэтому при качественном анализе пользуются потенциалами 'полуволн Е^г
, так как они характерны для каждого вещества.
Потенциалом полуволны называется то значение потенциала, при котором происходит возрастание силы тока до половины предельного значения.
Потенциал полуволны можно определить с помощью уравнения полярографической волны:

где tap — предельная сила тока; п — число электронов, участвующих в электрохимической реакции.
Если откладывать на оси абсцисс значения Е, а на
оси ординат то построенный график представляет собой прямую, отсекающую на оси абсцисс птпр,!
™ оавный потенциалу полуволны, так как при то построенный график представляет собой прямую, отсекающую на оси абсцисс птпр,!
™ оавный потенциалу полуволны, так как при
 =0 и, следовательно, E=Ei/2
. =0 и, следовательно, E=Ei/2
.
Потенциал полуволны можно определить и другим, более простым способом. Для этого на полярограмме из середины волны опускают перпендикуляр на ось абсцисс. Расстояние от точки пересечения перпендикуляра с осью абсцисс до начала координат ipaBHoEi/t
- Однако э1 от способ определения менее точен.
Остаточный ток. Ток, проходящий через электролизер до скачка силы тока (см. рис. 3), называется остаточным током. В ряде случаев он вызван примесями различных восстанавливающихся веществ, например следами меди и др.
Второй составляющей остаточного тока является так называемый емкостный ток (ток заряжения или конденсаторный ток). Прохождение такого тока наблюдается даже в том случае, если раствор совершенно не содержит восстанавливающихся веществ. Для возникновения отрицательного потенциала необходимо сообщить ртутной капле некоторое количество электричества, причем на ее поверхности возникает двойной электрический слой. Если бы ртутный катод был неподвижным, то ток после образования этого слоя немедленно прекратился бы. Однако ртуть все время вытекает из капилляра, и для сообщения каждой новой капле отрицательного заряда необходимо затратить новые порции электричества. Так возникает емкостный ток.
Емкостный ток обычно невелик и не вызывает каких-либо затруднений при полярографировании. Его следует учитывать в тех случаях, когда концентрация определяемого вещества настолько мала, что диффузионный ток по своей величине становится соизмеримым с емкостным током или меньше. Тогда «нужно принимать особые меры для его устранения.
Максимумы на полярограммах. Во многих случаях вместо нормальной полярограммы, имеющей форму ступени, получается кривая с максимумом

вследствие того, что в некотором интервале напряжения возникает ток, значительно превышающий ток диффузии. При дальнейшем повышении потенциала ток более или менее резко падает (проходя через максимум), достигая значения 'предельного диффузионного тока (рис. 5).
Однако очень часто переход максимального тока к диффузионному происходит постепенно и тогда определение высоты полярографической волны становится очень затруднительным.
По А. Н. Фрумкину, причиной возникновения максимумов является движение поверхности ртутной капли при ее вытекании, вызывающее дополнительное размешивание раствора. Это движение увеличивает поступление восстанавливающегося вещества к катоду, а следовательно, увеличивает силу тока. Максимум на кривой силы тока, возникающий по этой причине, называется максимумом первого рода.
При быстро вытекающих ртутных каплях на фоне концентрированных растворов могут возникать максимумы, которые называются максимумами второго рода. Их появление объясняется тем, что при образовании ртутной капли происходит движение ртути внутри самой капли.
Максимумы как первого, так и второго рода мешают полярографическому анализу. Они могут быть устранены добавлением в раствор поверхностно-активного вещества — желатина, агар-агара, моющих средств ОП-5, ОП-10 и др.
Волна кислорода. Если из исследуемого раствора предварительно не удалить содержащийся в нем растворенный кислород, то на полярографической кривой появляются два максимума. Первый из них возникает при £=0,1—0,2 в и отвечает восстановлению кислорода до пероксида водорода:
02
+ 2Н+ + 2е —> Н2
02
(в кислой среде); 02
+ 2Н2
0 -f- 4е —у 2Н2
02
(в щелочной среде).
Второй максимум при Et/2
= 0,9 в отвечает восстановлению пероксида водорода до воды или ионов гидроксила:
Н2
02
+ 2Н+ + 2е 2Н2
0 (в кислой среде); Н2
02
+ 2е — ->- 20Н " (в щелочной среде).
Эти максимумы затрудняют расшифровки полярограмм.
Для удаления кислорода обычно через раствор (перед измерениями) пропускают инертный газ, например водород, азот или аргон, в течение 10—15 мин.
Преимущества ртутного капельного электрода. Главное преимущество ртутного капельного (капающего) индикаторного электрода заключается в том, что поверхность его непрерывно обновляется. Таким образом, на поверхности такого электрода не накапливается, как на твердых электродах, слой постороннего металла или вещества, изменяющий свойства электрода. Благодаря этому получается хорошая воспроизводимость полярографических кривых /—Е.
Второе важное достоинство ртутного капающего электрода заключается в том, что ввиду малой поверхности капли ртути для получения нужной плотности тока достаточно пропустить очень малую силу тока (порядка 10^е
с). Это означает, что даже при долгом и непрерывном электролизе (полярографировании) концентрация исследуемого вещества в растворе практически не изменяется, и, следовательно, величина предельного тока остается постоянной во времени.
Кроме перечисленных, следует указать еще на одно ценное свойство ртутного электрода, которое заключается в том, что перенапряжение водорода на ртути очень велико, т. е. ионы водорода электролитически разряжаются и выделяются на ртути только при больших отрицательных значениях потенциала. Это дает возможность определять многие металлы и другие вещества в нейтральных и даже кислых растворах без выделения водорода.
Наконец, немаловажным преимуществом ртутного капельного электрода является также то, что непрерывно обновляющаяся поверхность электрода всегда электрохимически активна, на ней не протекают вторичные процессы и она не пассивируется, т.е. не переходит в электрохимически неактивное состояние вследствие покрытия ее поверхности оксидом или адсорбции посторонних веществ.
При полярографировании ионов металлов протекает следующий электрохимический процесс на ртутном капельном электроде, если последний служит катодом, например:
Ме2
+ + 2е —>- Me.
Выделившийся на ртутной капле металл образует амальгаму и, падая -вниз <в ртутный анод, вновь может перейти в раствор в виде прежнего исследуемого соединения. Это способствует тому, что при сколь угодно длительном электролизе концентрация исследуемого вещества в растворе остается практически постоянной.
В случае, когда анодом служит ртуть, но с очень большой по сравнению с капельным катодом поверхностью, падение капли ртути с небольшим содержанием исследуемого металла или другого соединения не может изменить значения потенциала «дна», тем более, что эти соединения сравнительно легко вновь переходят в раствор и поэтому потенциал ртутного анода сохраняет практически постоянную величину.
В таком случае можно считать, что скачок силы тока на полярограмме при непрерывном повышении напряжения обусловлен только электрохимическими процессами, протекающими на катоде.
Недостаток использования «донной» ртути в качестве анода заключается в том, что для выражения потенциала полуволны в абсолютных значениях необходимо часто определять потенциал «дна» (анода) с помощью электрода сравнения потенциометрическим методом. Во избежание этого в последнее время в качестве анода включают в цепь насыщенный каломельный электрод, потенциал которого постоянен и не изменяется в ходе полярографирования (не поляризуется).
Твердые микроэлектроды. При необходимости работать в области потенциалов более положительных, чем +0,3 в
(|В
случае реакций окисления исследуемых веществ на электроде), можно использовать твердые электроды малых размеров, на которых также можно получить диффузионный ток.
Наиболее подходящим для этой цели является платиновый электрод. Перенапряжение водорода на платине невелико, вследствие чего выделение водорода на таком электроде может происходить уже при потенциале 0 1 в. Это ограничивает использование платины в отрицательной области потенциалов. Но зато платина не окисляется при анодной поляризации электрода до потенциала выделения кислорода, т. е. до +1,1 1-1,3 я.
Твердые электроды могут быть неподвижными (стационарными) или вращающимися.
Для того чтобы предельный ток был пропорционален концентрации, толщина диффузионного слоя при электролизе должна сохраняться постоянной. Однако было установлено, что постоянство предельного тока на стационарном (неподвижном) электроде достигается лишь через сравнительно длительное время из-за изменения диффузионного слоя. Это обстоятельство препятствуем широкому применению стационарных электродов в полярографии.
Наиболее часто применяются вращающиеся твердые микроэлектроды. В этом случае жидкость вокруг электрода непрерывно перемешивается и в результате этого около электродного слоя поддерживается высокая концентрация исследуемого вещества. Изменения концентрации вещества, возникающие в результате электролиза, не распространяются в глубь раствора. Таким образом, поддерживается постоянство толщины диффузионного слоя, что является необходимым условием пропорциональности предельного тока концентрации исследуемого вещества.
В полярографии обычно пользуются игольчатыми вращающимися платиновыми электродами.
Преимущество твердых вращающихся электродов заключается в том, что при работе с ними исключается осцилляция. Это увеличивает точность и быстроту отсчетов. Важным достоинством является также и их безвредность по сравнению с ртутным электродом.
Существенный недостаток этих электродов заключается в том, что при работе с ними воспроизводимость измерений хуже, чем при использовании ртутного капельного электрода, так как поверхность твердых электродов трудно сохранить всегда в неизменном состоянии.
|