ПРИЧИНА
ПЕРИОДИЧНОСТИ ПЕРИОДИЧЕСКОГО ЗАКОНА
Клюйков Р.С., Клюйков С.Ф.
Первоначально схема построения конфигурации электронной составляющей атомов не выводилась из каких-либо строгих теоретических (тем более - математических) представлений. Она просто основывалась на наблюдаемых изменениях химических свойств и спектров элементов.
Первое физическое обоснование схема получила лишь методами квантовой механики Н.Бора. Появились представления о внешних электронных оболочках, уровнях, подуровнях, о их периодической повторяемости, которыми обуславливалось периодическое изменение химических свойств элементов. Была найдена физическая причина периодичности Периодического закона.
Многообразие современных моделей строения атомов всё ещё основывается на главном постулате Н.Бора: в атоме существует чёткая последовательность вложенных друг в друга сферических электронных оболочек. Однако этим принципом просто рассматривается сформированная Природой последовательность, не объясняется механизм формирования, не показываются закономерности, использованные Природой.
Последовательность заполнения электронных уровней хорошо описывается мнемоническим правилом В.М.Клечковского. Но, опять же – не определяется им. Исследователи отмечают «размывания периодичности», явные нарушения диктуемых этим правилом чётких границ заполняемых подуровней, начиная с шестого периода. Выпускается из виду большая группа элементов (формально – подчиняющихся правилу, но в действительности – более тонко размывающих периодичность): 24Cr, 29Cu, 41Nb, 42Mo, 44Ru, 45Rh, 46Pd, 47Ag, 78Pt, 79Au, 111Rg.
Строгое количественное объяснение периодичности изменения химических и физических свойств элементов оказалось чрезвычайно сложной задачей. По сей день отсутствует математическая причина периодичности Периодического закона.
Идеальная математика[1-3] обобщает порядки, по которым складывалось всё в Природе. Самый простой порядок – сложение натуральных чисел (1я ступень), затем – умножение целых чисел (2я ступень), и т.д.
Рассмотрим, как Природа использовала эти порядки на примере создания ею химических элементов.
Вначале напомним основные физические условия такого создания.
Согласно Периодическому закону Д.И.Менделеева, элементы усложнялись добавлением одного протона в ядро и одного электрона в оболочку каждого атома. Сосредоточим внимание только на строительстве электронных оболочек.
Электроны в оболочке располагаются уровнями, на которых их энергии очень близки. Энергия электрона определяется его четырьмя квантовыми числами:
n - главное (адрес уровней): 1,2,3,4,5,6,7;
l - вспомогательное (адрес подуровней s,p,d,f): 0,1,2,3;
m - магнитное (адрес орбитали): целые числа от –l до +l;
s - спиновое (спин): +1/2, -1/2.
Согласно принципу Паули в атоме не должно быть двух электронов в одинаковом состоянии. Поэтому «добавленные» электроны должны отличаться разными комбинациями их квантовых чисел. При создании нового элемента изменения всех переменных должны быть минимальными!!!
Соблюдая эти физические условия, Природа создала все химические элементы следующими минимальными усложнениями их электронных оболочек. В обозначении электронных формул опустим уже сформированные подуровни и оставим только последние, ещё формируемые (в круглых скобках – нормальная форма оболочки, об этом - ниже).
1H
1s1
.
2He
1s2
.
3Li
2s1
.
4Be
2s2
.
5B
2s2
2p1
.
6C
2s2
2p2
.
7N
2s2
2p3
.
8O
2s2
2p4
.
9F
2s2
2p5
.
10Ne
2s2
2p6
.
11Na
3s1
.
12Ma
3s2
.
13Al
3s2
3p1
.
14Si
3s2
3p2
.
15P
3s2
3p3
.
16S
3s2
3p4
.
17Cl
3s2
3p5
.
18Ar
3s2
3p6
.
19K
4s1
.
20Ca
4s2
.
21Sc
4s2
3d1
.
22Ti
4s2
3d2
23V
4s2
3d3
24Cr
(4s2
3d4
) 4s1
3d5
25Mn
4s2
3d5
26Fe
4s2
3d6
27Co
4s2
3d7
28Ni
4s2
3d8
.
29Cu
(4s2
3d9
) 4s1
3d10
.
30Zn
4s2
3d10
.
31Ga
4s2
4p1
.
32Ge
4s2
4p2
.
33As
4s2
4p3
.
34Se
4s2
4p4
.
35Br
4s2
4p5
.
36Kr
4s2
4p6
.
37Rb
5s1
.
38Sr
5s2
.
39Y
5s2
4d1
.
40Zr
5s2
4d2
.
41Nb
(5s2
4d3
) 5s1
4d4
.
42Mo
(5s2
4d4
) 5s1
4d5
.
43Tc
5s2
4d5
.
44Ru
(5s2
4d6
) 5s1
4d7
.
45Rh
(5s2
4d7
) 5s1
4d8
.
46Pd
(5s2
4d8
) 5s0
4d10
.
47Ag
(5s2
4d9
) 5s1
4d10
.
48Cd
5s2
4d10
.
49In
5s2
5p1
.
50Sn
5s2
5p2
.
51Sb
5s2
5p3
.
52Te
5s2
5p4
.
53J
5s2
4p5
.
54Xe
5s2
5p6
.
55Cs
6s1
.
56Ba
6s2
.
57La
(6s2
4f1
) 6s2
5d1
.
58Ce
(6s2
4f2
) 6s2
5d1
4f1
.
59Pr
6s2
4f3
.
60Nd
6s2
4f4
.
61Pm
6s2
4f5
.
62Sm
6s2
4f6
.
63Eu
6s2
4f7
.
64Gd
(6s2
4f8
) 6s2
5d1
4f7
.
65Tb
6s2
4f9
.
66Dy
6s2
4f10
.
67Ho
6s2
4f11
.
68Er
6s2
4f12
.
69Tu
6s2
4f13
.
70Yb
6s2
4f14
.
71Lu
6s2
5d1
.
72Hf
6s2
5d2
.
73Ta
6s2
5d3
.
74W
6s2
5d4
.
75Re
6s2
5d5
.
76Os
6s2
5d6
.
77Ir
6s2
5d7
.
78Pt
(6s2
5d8
) 6s1
5d9
.
79Au
(6s2
5d9
) 6s1
5d10
.
80Hg
6s2
5d10
.
81Tl
6s2
6p1
.
82Pb
6s2
6p2
.
83Bi
6s2
6p3
.
84Po
6s2
6p4
.
85At
6s2
6p5
.
86Rn
6s2
6p6
.
87Fr
7s1
.
88Ra
7s2
.
89Ac
(7s2
5f1
)7s2
6d1
.
90Th
(7s2
5f2
) 7s2
6d2
.
91Pa
(7s2
5f3
) 7s2
6d1
5f2
, 7s2
6d2
5f1
.
92U
(7s2
5f4
) 7s2
6d1
5f3
.
93Np
7s2
5f5
.
94Np
7s2
5f6
.
95Np
7s2
5f7
.
96Cm
(7s2
5f8
) 7s2
6d1
5f7
.
97Bk
7s2
5f9
.
98Cf
7s2
5f10
.
99Es
7s2
5f11
.
100Fm
7s2
5f12
.
101Md
7s2
5f13
.
102No
7s2
5f14
.
103Lr
7s2
6d1
.
104Rf
7s2
6d2
.
105Db
7s2
6d3
.
106Sg
7s2
6d4
.
107Bh
7s2
6d5
.
108Hs
7s2
6d6
.
109Mt
7s2
6d7
.
110Ds
7s2
6d8
.
111Rg
(7s2
6d9
)7s1
6d10
.
112Cp
7s2
6d10
.
113Uut
7s2
7p1
.
114Ku
7s2
7p2
.
115Uup
7s2
7p3
.
116Uuh
7s2
7p4
.
117Uus
7s2
7p5
.
118Uuo
7s2
7p6
.
Проанализируем особенности усложнения строения электронных оболочек. Несмотря на исключения логической последовательности усложнения электронных формул, «исправляемые» однако содержимым в скобках (об этом - ниже), соблюдается следующая закономерность.
Вначале самым простым порядком Идеальной математики - сложением 1й ступени (прибавлением единицы, где единицей служит «добавленный» электрон с определёнными значениями его квантовых чисел n,l,m,s - обозначим его a) создается 1H 1s1
. Сложением 1й ступени Идеальной математики требуется «добавлять» следующий электрон, абсолютно подобный электрону a, но принцип Паули запрещает это. Поэтому возможности такого порядка усложнения электронных оболочек, жёстко ограниченные строгими физическими условиями, исчерпываются.
Переходим к более сложному порядку Идеальной математики – умножению 2й ступени. Самое простое из них – это умножение двух одинаковых целых чисел. В нашем случае – это образование орбитали из двух одинаковых электронов aa (не трёх, не четырёх…) и создание 2He 1s2
. Для удовлетворения принципа Паули у двух электронов a с одинаковыми квантовыми числами n,l,m разные спины s. На этом комбинации самого простого умножения исчерпываются, и размеры пространства первого уровня – тоже. Так Природа построила все элементы первого периода.
Во втором периоде, используя минимальное усложнение - увеличение энергии переходом на второй уровень, опять строим: сложением - 3Li 2s1
и умножением - 4Be 2s2
. Размеры пространства второго уровня позволяют использовать для строительства следующий по сложности порядок Идеальной математики – сочетание 3й ступени (минимальное из возможных) «по два из трёх» (ab,ac,bc). То есть, в орбиталях второго уровня возможно добавление комбинаций сочетания по два из трёх электронов (обозначим их a,b,c), разнящихся своими квантовыми числами n,l,m,s. Всего комбинации нового порядка строительства электронных оболочек обеспечивают возможность присоединения ещё шести «добавленных» электронов. Поэтому таким порядком строятся следующие шесть элементов: 5B 2s2
2p1
; 6C 2s2
2p2
; 7N 2s2
2p3
; 8O 2s2
2p4
; 9F 2s2
2p5
; 10Ne 2s2
2p6
. На этом возможности данного порядка, да и пространство второго уровня – исчерпываются. Так Природа построила все элементы второго периода.
При строительстве элементов третьего периода опять, используя минимальное усложнение - увеличение энергии, переходим на третий уровень, и уже на нём начинаем располагать новые «добавленные» электроны: опять сложением - 11Na 3s1
; умножением - 12Ma 3s2
; сочетанием - 13Al 3s2
3p1
, 14Si 3s2
3p2
, ... 18Ar 3s2
3p6
. Так Природа построила все элементы третьего периода.
Для строительства элементов четвёртого периода пространство третьего уровня позволяет располагать другие «добавленные» электроны, но минимальная энергия целого атома заставляет предварительно заполнить начало следующего, четвёртого уровня: опять сложением - 19K 4s1
и умножением - 20Ca 4s2
. И только после этого продолжается заполнение ранее недостроенного третьего уровня на подуровне 3d следующим по сложности порядком Идеальной математики – размещением 4й ступени, опять минимальным: «по два из трёх» (aa,ab,ac,bc,ba,ca,cb,bb,cc). Но на третьем уровне часть комбинаций такого размещения (aa,ab,ac,bc) уже использована для строительства подуровней 3s2
(aa) и 3p6
(ab,ac,bc). Неиспользованными остаются только пять орбиталей для комбинаций (ba,ca,cb,bb,cc) – новый вклад, а их образуют десять «добавленных» электронов. Поэтому таким порядком строятся следующие десять элементов: 21Sc… 30Zn. При этом первые пять элементов от 21Sc 4s2
3d1
до 25Mn 4s2
3d5
образуются по комбинациям (ba,ca и начало cb), зеркально повторяющим комбинации(ab,ac и начало bc) сочетания, по которым строились элементы от 5B до 9F и от 13Al до 17Cl. Поэтому элементы Sc-Mn попадают в аналогичные группы Периодической таблицы Д.И.Менделеева, но по «зеркальным» свойствам выделены голубым цветом. Далее, по комбинациям (конец cb и bb,cc), «зеркально» повторяющим комбинацию (aa), образуется особая группа d-переходных металлов 26Fe 4s2
3d6
, 27Co 4s2
3d7
, 28Ni 4s2
3d8
, а также 29Cu 4s1
3d10
(4s2
3d9
) и 30Zn 4s2
3d10
– все тоже «зеркальные» (например, построенным по комбинации aa: 3Li 1s2
2s1
и 4Be 1s2
2s2
) и потому «голубые».
Четвёртый период таблицы Д.И.Менделеева заканчивается заполнением подуровня 4p обычным сочетанием «по два из трёх» шести элементов: 31Ga 4s2
3d10
4p1
… 36Kr 4s2
3d10
4p6
.
Теперь понятна повторяющаяся логика усложнения электронных оболочек очередных элементов пятого периода: от 37Rb 5s1
до 54Xe 5s2
5p6
.
Начало шестого периода – тоже стандартно: сложением - 55Cs 6s1
и умножением - 56Ba 6s2
. Далее продолжает заполняться четвёртый уровень на подуровне 4f, перебором комбинаций теперь уже следующего порядка Идеальной математики с минимальным усложнением - размещением «по два из четырёх» электронов (обозначим их a,b,c,d), опять разнящихся своими квантовыми числами n,l,m,s. При этом всего возможных комбинаций должно быть (aa,ab,ac,bc,ba,ca,cb,bb,cc,ad,bd,cd,dd,da,db,dc). Но на четвёртом уровне, на подуровнях 4s2
,4p6
,4d10
, уже заполнены комбинации (aa,ab,ac,bc,ba,ca,cb,bb,cc). Осталось заполнить только комбинации (ad,bd,cd,dd,da,db,dc), а в них – четырнадцать «добавляемых» электронов. Поэтому, таким порядком добавления электронов на подуровне 4f строятся следующие четырнадцать элементов: 57La…70Yb. Вот почему они «вывалились» в краткой и полудлинойформах Периодической таблицы (в таблице нет комбинаций, подобных им)в отдельную побочную подгруппу лантаноидов.
Остановимся на явлении «размывания периодичности».
Известно, что наибольшей устойчивостью обладают незаполненные (d0
,f0
), наполовину заполненные (d5
,f7
) и полностью заполненные (d10
,f14
) подуровни. Поэтому «добавляемому» электрону энергетически выгодно перейти на эти устойчивые или близкие к ним подуровни, нарушая, «размывая» периодичность. Поводом для перехода может служить малейшее возбуждение атома. И вариантов перехода может быть больше одного, например - 91Pa (7s2
5f3
) 7s2
6d1
5f2
, 7s2
6d2
5f1
. Но этим сообщением подчёркивается, что в любом наблюдаемом случае «размывания периодичности» всегда имеется задуманная Природой единственная идеальная форма электронной оболочки атома (приведенная в круглых скобках), назовём её – нормальной. Ранее мы обошли вниманием примеры такого отклонения от нормы: уже пройденные 24Cr(4s2
3d4
)4s1
3d5
, 29Cu (4s2
3d9
) 4s1
3d10
, 41Nb(5s2
4d3
) 5s1
4d4
, 42Mo(5s2
4d4
) 5s1
4d5
, 44Ru (5s2
4d6
) 5s1
4d7
, 45Rh (5s2
4d7
) 5s1
4d8
, 46Pd (5s2
4d8
) 5s0
4d10
, 47Ag (5s2
4d9
) 5s1
4d10
и следующие далее 78Pt (6s2
5d8
) 6s1
5d9
, 79Au (6s2
5d9
) 6s1
5d10
, 111Rg(7s2
6d9
) 7s1
6d10
, объединяемые в особую группу общим свойством – переходом «добавляемого» электрона с s-подуровня на более ближний, но более устойчивый вновь создаваемый d-подуровень.
Лантаноиды образуются заполнением 4f подуровня. В то же время совсем рядом расположен незаполненный 5d подуровень, а разница энергий между ними настолько мала, что при незначительном возбуждении один или даже два электрона легко переходят с 4f на 5d и становятся валентными.
Родоначальник группы - 57La (6s2
4f1
)6s2
5d1
– первый пример отклонения от нормы такого рода: его «добавляемый» (первый для 4f) электрон располагается на 5d1
, ради создания более устойчивого 4f0
. Вместе со следующими далее: 58Ce (6s2
4f2
)6s2
5d1
4f1
, 64Gd (6s2
4f8
)6s2
5d1
4f7
, 89Ac (7s2
5f1
)7s2
6d1
, 90Th (7s2
5f2
)7s2
6d2
, 91Pa (7s2
5f3
)7s2
6d1
5f2
,7s2
6d2
5f1
92U (7s2
5f4
)7s2
6d1
5f3
, 96Cm (7s2
5f8
)7s2
6d1
5f7
- эти примеры «размывания периодичности» объединяются в другую особую группу общим свойством – переходом «добавляемого» электрона с f-подуровня на более дальний d-подуровень, ради более устойчивого оставляемого f-подуровня.
За этими исключениями опять следуют нормальные лантаноиды 59Tc 6s2
4f3
…63Eu 6s2
4f7
и 65Tb 6s2
4f9
…70Yb 6s2
4f14
.
Сам 57La (6s2
4f1
)6s2
5d1
справедливо будет поместить первым в верхнем ряду побочной группы, чтобы теперь все 14 лантаноидов (в их нормальной, невозбуждённой форме) были, наконец, вместе рядом, выстроенные по количеству «добавляемых» 4f электронов, от 4f1
до 4f14
. Тогда 64Gd (6s2
4f8
)6s2
5d1
4f7
переместится с последнего в верхнем ряду на почётное для его особого статуса место - первое в нижнем ряду. При такой трансформации таблицы становится очевидной природа условного деления лантаноидов на два семейства: цериево – верхний ряд семи элементов 57La…63Eu, построенных по комбинациям (ad,bd,cd и начало dd); тербиево (чаще - иттриево) – нижний ряд семи элементов 64Gd…70Yb, построенных по комбинациям (da,db,dc и конец dd) . Многие свойства этих семейств «зеркально» изламываются на Gd, например: величины ионных радиусов; кристаллографические данные; тетрад-эффект устойчивости комплексных соединений и др. Причина «зеркальности» 4f подуровня подобна рассмотренной выше «зеркальности» 3d подуровня (сравните соответствующие комбинации).
Несмотря на устоявшееся мнение, что следующий элемент 71Lu 6s2
5d1
тоже относится к лантаноидам и даже размещается вместе с ними (последним) в этой побочной группе, данным сообщением он доказательно исключается из неё. Но, благодаря своим свойствам, очень родственным лантаноидам, он заслуженно размещается в почётной клеточке таблицы, занимаемой прежде самим лантаном. Такое перемещение 71Lu будет справедливым по отношению к 21Sc 4s2
3d1
и 39Y 5s2
4d1
, с которыми лантаноиды образуют особую группу редкоземельных элементов (сравните их комбинации). Теперь все нелантаноиды (Sc,Y,Lu) среди редкоземельных элементов окажутся на таблице в равных условиях.
Далее, аналогично подуровням четвёртого и пятого периодов, в шестом периоде продолжают заполняться: подуровень 5d - размещением «по два из трёх» от 71Lu 6s2
5d1
до 80Hg 6s2
5d10
, образуя особую группу d-переходных металлов Os,Ir,Pt, а также Au и Hg – все «голубые»; подуровень 6p – сочетанием «по два из трёх», образуя элементы от 81Tl 6s2
5p1
до 86Em 6s2
6p6
. Так Природа построила все элементы шестого периода.
Аналогично шестому, усложняются элементы седьмого периода от 87Fr 7s1
до 118Uuo 7s2
7p, только «ещё формируемые» подуровни возрастают на единицу.
Так, на подуровне 5f размещением «по два из четырёх» строятся очередные 14 элементов, вновь образующие отдельную побочную подгруппу – актиноидов.
У актиноидов различие энергетических состояний электронов подуровней 5f и 6d ещё меньше, чем у лантаноидов 4f и 5d. Поэтому «добавленные» электроны первых актиноидов легко переходят на 6d, становясь валентными, повышая общую валентность элемента вплоть до +6. Эта сверхлёгкая возбудимость актиноидов создаёт трудности точного установления их действительных электронных конфигураций. От Th до Am энергии заполняемых орбиталей подуровней 5f, 6d, 7s и 7p очень близки, они способны перекрываться, а энергии перехода электронов между ними лежат в пределах обычных химических связей. Но чётко установленная данным сообщением нормальная форма элементов (в круглых скобках) позволяет выстроить актиноиды по-новому.
Отдельная группа актиноидов должна начинаться с самого 89Ac (7s2
5f1
)7s2
6d1
. Далее идут: 90Th (7s2
5f2
)7s2
6d2
, 91Pa (7s2
5f3
)7s2
6d1
5f2
,7s2
6d2
5f1
, 92U (7s2
5f4
)7s2
6d1
5f3
, 93Np 7s2
5f5
, 94Pu 7s2
5f6
, 95Am 7s2
5f7
– верхний ряд, построенный комбинациями (ad,bd,cd и начало dd); 96Cm (7s2
5f8
) 7s2
6d1
5f7
, 97Bk 7s2
5f9
, 98Cf 7s2
5f10
, 99Es 7s2
5f11
, 100Fm 7s2
5f12
, 101Md 7s2
5f13
, 102No 7s2
5f14
– нижний ряд, построенный комбинациями (da,db,dc и конец dd). «Зеркальный» излом свойств актиноидов - на 96Cm (сравните соответствующие комбинации).
Бывший последним в побочной группе актиноидов 103Lr 7s2
6d1
исключается из неё и помещается в клеточку Периодической таблицы, где был ранее 89Ac. С него начинает заполняться подуровень 6d размещением «по два из трёх» до 112Cp 7s2
6d10
, а потом - подуровень 7p сочетанием «по два из трёх» от 113Uut 7s2
7p1
до 118Uuo 7s2
7p6
, аналогично шестому периоду.
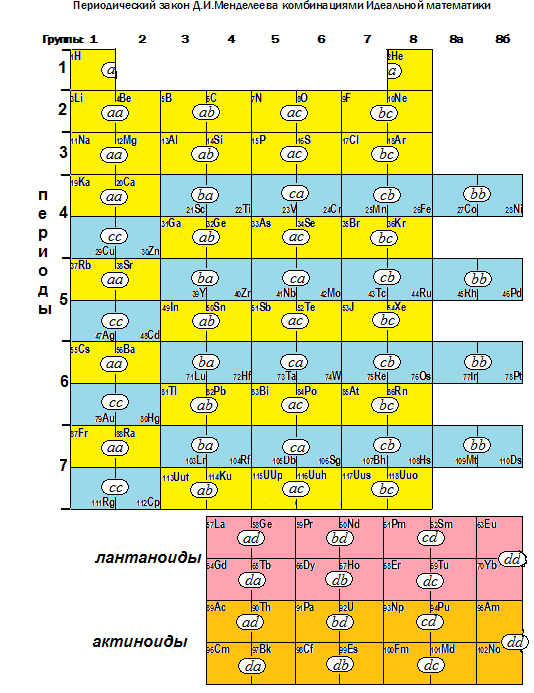
Таким образом, несмотря на отклонения отдельных элементов от задуманной Природой нормальной формы, кажущуюся непоследовательность из-за выполнения жёстких физических условий, наблюдается стабильное, чёткое соблюдение математических операций усложнения электронных оболочек химических элементов в строгой последовательности, начертанной Идеальной математикой:
сложением одной единицы
умножением двух чисел
сочетанием «по два из трёх» чисел
размещением «по два из трёх» чисел
размещением «по два из четырёх» чисел
a
aa
ab,ac,bc
aa,ab,ac,bc,ba,ca,cb,bb,cc
aa,ab,ac,bc,ba,ca,cb,bb,cc,ad,bd,cd,dd,da,db,dc
Чёткое соблюдение последовательности комбинаций математических операций повторялось на каждом следующем периоде (рисунок), неоднократно! Более того, каждая предыдущая операция всеми своими комбинациями постоянно вкладывалась во все последующие. Эта стабильность создала основу повторяемости, преемственности – последовательность комбинаций стала математической причиной периодичности Периодического закона Д.И.Менделеева! Благодаря выявленным комбинациям – периодичность становится очевидной, более наглядной. Именно она позволяет выстраивать таблицу элементов спиралями (следующий виток включает в себя весь опыт предыдущих витков и своё новое) и другими экзотическими пространственно расширяющимися формами.
Комбинаторика Природы ограничилась соединениями только «по два» - не в этом ли причина «двухкомнатных» орбиталей? И этих простейших математических порядков первых четырёх 1й-4й ступеней Идеальной математики хватило для сотворения всего многообразия химических элементов!
Уместен вопрос: есть ли граница натурального ряда химических элементов?
Можно отметить, что образование элементов комбинациями операций Идеальной математики шло следующими этапами.
1й этап. Образуется элемент 1H комбинацией сложения a. Повторением 1го этапа комбинацией умножения aa образуется 1й период.
2й этап. Образуются элементы 2го периода повторением комбинаций всего 1го периода с добавлением новых комбинаций сочетания «по два из трёх» (ab,ac,bc). Повторением комбинаций всего 2го этапа образуются элементы 3го периода.
3й этап. Образуются элементы 4го периода повторением комбинаций всего 2го этапа с добавлением новых комбинаций размещения «по два из трёх» (ba,ca,cb,bb,cc). Повторением комбинаций всего 3го этапа образуются элементы 5го периода.
4й этап. Образуются элементы 6го периода повторением комбинаций всего 3го этапа с добавлением новых комбинаций размещения «по два из четырёх» (ad,bd,cd,dd,da,db,dc). Повторением комбинаций всего 4го этапа образуются элементы 7го периода.
Будет ли следующий 5й этап … «с добавлением новых комбинаций размещения «по два из пяти»»? Или … «с добавлением новых комбинаций размещения «по три из четырёх»»? Очевидно – не будет, так как до сих пор каждое новое усложнение операции Природа повторяла только по два раза! Усложнение операции размещения уже повторилось дважды – предел! Как и завещал Д.И.Менделеев: «В десятом ряду (7м периоде) … есть повод заключить, что здесь мы уже близки к концу возможных форм элементарных соединений (комбинаторики? Авторы)».
Нужно новое усложнение математической операции образования элементов. Идеальная математика подсказывает, что это будет операция её 5й ступени – интегрирование функций.
То есть, следующие (после 118Uuo) усложнения химических элементов должны осуществляться уже не простым численным прибавлением очередных «добавленных» электронов соединениями комбинаторики – все возможные новые комбинации исчерпались! Необходимо организовывать «добавленные» электроны функциональными зависимостями. Новые электронные конфигурации должны выстраиваться определёнными функциональными зависимостями. Но как?
В Идеальной математике слагаемые (интегралы постоянной величины по переменной величине) функциональной зависимости чисел 5й ступени зародились ещё на 4й ступени. Поищем слагаемые усложнения химических элементов 5го этапа на уже пройденных этапах, они должны там проявляться.
Операцию 4й ступени размещение «по два из трёх» Природа впервые использовала в 4м периоде, начиная с 21Sc. И на этом элементе в «долине стабильности», области стабильных нуклонов, закончились лёгкие ядра с A/Z=1. Начиная с Z>20 нуклиды нестабильны к b-распаду в основном состоянии.
С 39Y началось повторное использование операции размещение «по два из трёх». И почти для всех ядер с А>90 выполняется условие возможности их спонтанного деления: потенциальная энергия делящегося ядра превышает сумму масс осколков деления.
С 57La началось использование операции размещение «по два из четырёх». И с этого места таблицы начинается протонная радиоактивность ядер в их основных состояниях.
С 89Ac началось повторное использование операции размещение «по два из четырёх». И отсюда же начинается естественная радиоактивность, нестабильность к a-распаду. 92U – последний из естественных элементов, найденных в Природе. Все более сложные – нестабильны, со всё уменьшающимся полупериодом распада, и давно превратились в более лёгкие, более стабильные элементы.
Таким образом, в формировании электронных оболочек химических элементов очевидна связь математической операции размещение с нестабильностью ядер этих элементов к различного родарадиоактивности, к превращениям элементов. То есть, искомым интегралом дальнейшего (после 118Uuo) усложнения химических элементов на 5м этапе является превращение, видоизменение ядер и их составляющих ядерными реакциями. Ядерные реакции и есть искомые функции 5й ступени Идеальной математики, по которым уже очень давно усложняется далее в Природе мир химических элементов, например – в телах звёзд. Следовательно:
5й этап. Образуются новые химические элементы функциональным складыванием ядерных превращений (ядерные реакции).
6й этап. Образуются новые состояния химических элементов складыванием взаимозависимых ядерных реакций (цепные реакции, мазеры, лазеры).
7й этап. Образуются новые континуумы химических элементов складыванием взаимовлияющих состояний (термоядерные реакции).
8й этап. Образуются новые уровни химических элементов складыванием взаимосвязанных континуумов (атомная бомба, водородная бомба, атомная энергетика).
9й этап. Образуются модели развития химических элементов складыванием их уровней единым направлением по возрастающим критериям (управляемый термоядерный синтез, ТОКАМАК СССР, токамаки других стран).
10й этап. Образуется модель вывода химических элементов складыванием различных их моделей развития единой стратегией по возрастающим приоритетам (международный проект ITER, квантовая телепортация, квантовые компьютеры). И так далее…
Просматривается чёткая дорога, вымощенная операциями Идеальной математики, которой ещё на заре Времён воспользовалась Природа, и по которой следом за ней неосознанно, начиная с Адама и Евы, идут химики и физики к Познанию, к новым открытиям и свершениям.
Не стоит зацикливаться на поиске мифически и магически «стабильных» (Z=126 и 164) элементов. Надо смириться с тем, что таблица Д.И.Менделеева закончилась на 118м элементе, и максимум энергии направить на дальнейшее осознанное совершенствование химии и физики новыми (10й, 11й и т.д.) операциями Идеальной математики, задающей чёткий и абсолютный ритм всему: «…левой! …левой! …». Кто там шагает «правой»?
Литература
1. Клюйков С.Ф. Числа и познание мира.- Мариуполь: Полиграфический центр газеты «ИнформМеню». 1997.- 112с.
2. Клюйков С.Ф. Основи математики системою аксіом, що розширюється // Матеріали IV Міжнародної науково-практичної конференції «Динаміка наукових досліджень '2005». 20-30 червня 2005. Том 26 Математика. – Дніпропетровськ: Наука і освіта. 2005.- С.25-36.
3. Клюйков Р.С., Клюйков С.Ф. Языки программирования и Идеальная математика // Materialy V Miedzynarodowej naukowi-praktycznej konferencji “Naukowa przestzen Europy - 2009”. Volume 17 Matemamyka. Nowoczesne informacyjne technologie.- Przemysl: Nauka i studia. 2009. – 96 str, С 3-16.
|