|
Прогрес людства, розвиток культури і саме життя знаходяться в прямій залежності від запасів, збереження і використання води.
Загальні запаси води на земній кулі за оцінкою М.І. Львовича складають 1455 млн. км3
, з них тільки 28 млн. км3
, або близько 1,9 %, складають прісні води, дебіт яких катастрофічно знижується із-за наростаючого забруднення гідросфери неочищеними стічними водами. Решта вод — солоні, з різним ступенем мінералізації, непридатні без спеціальної обробки для промислового, сільськогосподарського і господарський-питного використання.
От чому охорона і раціональне використання водних ресурсів — одна з глобальних проблем сучасності.
Стрімкий розвиток науково-технічної революції, бурхливе зростання промисловості, транспорту, збільшення чисельності і урбанізація населення, хімізація сільськогосподарського виробництва — ці та інші чинники призводять до підвищеного використання природних ресурсів та діють на стан водного басейну.
Науково-технічна політика в області очищення природних вод на найближчу перспективу передбачає напрям зусиль численних науково-дослідних, проектно-конструкторських і технологічних організацій на подальшу розробку теоретичної бази хімії і технології води, впровадження нових технологічних процесів, створення сучасного водоочисного устаткування, приладів, засобів автоматизації, нових реагентів і матеріалів, що дозволяють підвищити продуктивність праці і економічність виробництва.
В наш час набуває популярності очистка води за допомогою озону. Ця тема вважається досить актуальною, адже має ряд переваг в порівнянні з іншими методами очистки.
Метою цієї роботи є дослідження процесу озонування води та знебарвлення забарвлених розчинів за допомогою озону.
1. Очищення води від органічних сполук
У природних водах до органічних домішок відносять гумусові речовини, що вимиваються з грунтів і торфянників, а також органічні речовини різних типів та їх з'єднання, у тому числі їхні комплекси з залізом.
Наявність у воді органічних речовин антропогенного походження становлять серйозну загрозу здоров'ю людини.
Останнім часом посилилося забруднення поверхневих і підземних джерел водопостачання речовинами антропогенного походження, до яких належать добрива і отрутохімікати, недостатньо очищені стічні води, що містять нафтопродукти, барвники, поверхнево-активні речовини та інші сполуки.
Очищення води від органічних забруднень як правило проводять двома методами:
1. Окислення (руйнування);
2. Сорбція (поглинання)
Очистку води від орагнічних забруднень в якості окислювачів використовують - хлор, озон, кисень, в деяких випадках перманганат калію.
Про чистку води від органічних забруднень також можна здійснювати сорбцією, коагуляцією і мембранними методами.
Окислювальний метод очищення води від органічних забруднень
Хлор є гарним дезинфіктантом і його бактерицидну дію проявляється по відношенню до бактерій і деяких видів вірусів. Знезаражуючий ефект залежить від дози хлору, час його контакту з водою та інших умов. У реакцію взаємодії з хлором можуть вступати різні хімічні сполуки.
Окислення хлором піддаються природні гумінові речовини, що обумовлюють кольоровість води. Є дані, що хлорування порушує стійкість колоїдних частинок водного гумусу, сприяючи їх коагуляції.
Мета прехлорування – попередня обробка води перед очисними спорудами для поліпшення або полегшення подальшого її очищення.
Прехлорування в разі погіршення якості води за бактеріологічними показниками, появи неприємних запахів присмаків повинно проводитися підвищеними дозами, відповідними точці перелому на кривій хлоропоглинанні, або великими.Вільний активний хлор в більшості випадків забезпечує значне поліпшення якості води за рахунок активного окислення органічних речовин.
Постхлорування використовується для знезараження води, яке є завершальним етапом очищення води. Постхлорування проводиться невеликими дозами, що забезпечують наявність залишкового хлору після резервуарів чистої води на рівні вимог ГОСТ 2874-82. надлишок хлору, недопустимий по гігієнічних міркуваннях, перед подачею води населенню має бути видалений.
Для дехлорування питної води використовують сірчистий газ SО2
(ГОСТ 2918) і гіпосульфіт натрію Na2
S2
O3
(ГОСТ 4215),а також гранульоване активоване вугілля і аміак NН3
(ГОСТ 6221). Витрати цих реагентів на 1 мг/л активного хлору наступні: SО2
– 0,9 мг/л; Na2
S2
O3
– 0,8-7,1 мг/л; NН3 – 0,13 мг/л.
Активоване вугілля 1,5-2,5 мм використовується як завантаження фільтрів шаром 2,5 м, швидкість фільтрування досягає 20-30 м/ч. Крім того, запропонований ряд комбінованих методів хлорування води: хлорування з амонізацією, хлорування з мангануванням, хлор-серебряний метод.
2. Хімічні властивості озону
Озон - безбарвний газ із сильним своєрідним запахом, токсичний, вибухонебезпечний, порівняно легко самовільно розкладається. У чистому і сухому повітрі розкладання його відбувається повільніше, ніж у вологому і забрудненому. Численними дослідженнями встановлено, що озон має високу бактерицидну дію. Крім того, відзначено більш сильну дію озону на спорові форми, а також і більш швидке знезаражуючі дії озону в порівнянні з хлором. Разом з тим обробка води озоном має свої особливості, які часто не дозволяють реалізувати його переваги як знезаражуючого реагенту. У зв'язку з цим у практиці іноді разом з обробкою води озоном перед подачею в мережу її піддають додатковому знезараженню хлором.
В останні роки зріс інтерес до озону як речовини, здатного видаляти з води органічні забруднення. Згідно з даними ряду авторів, окилювальну дію озону на органічні речовини може протікати в різних формах: безпосереднє окислення шляхом втрати атома кисню, а також шляхом впровадження молекулярного озону в молекулу речовини (озоналіз); каталітичну дію, збільшуючи окисну роль кисню, що міститься в озонованому повітрі.
В результаті окислення також утворюються шкідливі речовини, які необхідно видаляти, що призводить до ускладнення технологічного процесу і збільшує вартість очищення води.
Озон - це нестійкий трьохатомний кисень, що володіє сильними знезаражувальними властивостями і що є сильним окислювачем. Озон руйнує органічні сполуки і мікроорганізми, при цьому розкладаючись на кисень.
О3
= О2
+ О – 100,56 кДж; (2.1)
О + О3
= 2О2
+ 398,05 кДж; (2.2)
Сумарна реакція:
2О2
= 3О2
+ 297,49 кДж. (2.3)
Озон — алотропна модифікація кисню (О3
). В нижніх шарах атмосфери його вміст незначний. Найбільша його концентрація в стратосфері між висотами 10 і 40 км. Озон значно поглинає ультрафіолетову радіацію.
Проста речовина, алотропна видозміна кисню. Хімічно-активний газ синього кольору з різким запахом, сильний окиснювач. При великих концентраціях розкладається з вибухом. Утворюється з кисню при електричному розряді (наприклад, під час грози). Основна маса озону знаходиться у верхньому шарі атмосфери — озоносфері, на висоті від 10 до 50 км із максимумом концентрації на висоті 20-25 км. Цей шар охороняє живі організми Землі від шкідливого впливу короткохвильової ультрафіолетової радіації Сонця (може викликати рак шкіри). Зараз під впливом хлорфторвуглеців цей шар руйнується, що може негативно вплинути на жителів Землі. У багатьох країнах використання таких речовин, що входять у різні аерозолі, заборонено. У промисловості озон одержують під дією на повітря електричного заряду, його використовують, зокрема, для знезаражування води і повітря.
Температура кипіння озону −112 °C; вага 1 л — 2,14 г. Утворює озоніди (сполуки лужних металів і амонію, які містять аніони О3-
). Легко розкладається (О3
→ О + О2
). Вміст у повітрі: влітку — до 7•10-6
% об'ємних, взимку — 2•10-6
%. На висоті 20-25 км знаходиться прошарок в атмосфері Землі, де концентрація озону найбільша (так званий озоновий прошарок). Саме він захищає Землю від ультрафіолетового випромінювання космосу. У другій половині ХХ ст. зафіксована тенденція до потоншання цього прошарку і навіть утворення «озонових дірок» — областей зі зниженою концентрацією озону в озоновому прошарку. Це явище пов'язують із антропогенним забрудненням атмосфери, зокрема фреонами. Озон утворюється при дії електричного розряду або ультрафіолетового випромінювання на повітря. Використовується у хімічному синтезі, для стерилізації води, для дезинфекції й дезодорації повітря, вибілювання тканин, паперу, мінеральних масел тощо. Бактерицидний засіб. Є мутагеном. Гранично допустима концентрація у повітрі — 1 мг/м3
.
Озон має дуже високу окислювальну здатність (Е0
=+2,07 В; в лужному середовищі Е0
=1,24 В) і за нормальної температури руйнує багато органічних сполук. Під час озонування одночасно відбувається окиснення домішок, знебарвлення, дезодорація, знезараження стічної води та насичення її киснем.
Молекула озону триатомна й має трикутну будову (рисунок.2.1).
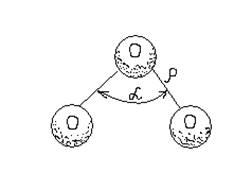
Рисунок 2.1 Будова молекули озону
За тиску 0,1 МПа і 0о
С в 1 дм3
води розчиняється 1,42 г озону, при 10 о
С—1,04 г, при 30 о
С—0,45 г. Розчинність озону у воді залежить від величини рН та кількості домішок у воді. За наявності кислот і солей розчинність озону у воді зростає, за наявності лугів – зменшується. Озон дисоціює на повітрі та у водному розчині, перетворюючись на оксиген. У водному розчині озон дисоціює швидше. Розкладання озону у воді різко зростає в разі підвищення рН та температури. Стійкість озону в нейтральному та кислому середовищах пов’язана з утворенням асоціатів НО3
+
, гідратна оболонка яких уповільнює реакцію:
О3
+ Н2
О = О2
+ О + Н2
О (2.4)
Розкладання озону у воді прискорюється за наявності активованого вугілля, металів змінної валентності (мангану, кобальту, феруму) деяких оксидів (Р2
О5
), пероксиду барію (ВаО2
). Такі матеріали, як фторо- та хлоровмісні пластмаси, скло, деякі матеріали, не вливають на стійкість озону.
В основу промислового одержання озону покладено реакцію розщеплення молекули кисню на атоми під дією тихого або бар’єрного розряду. Висока реакційна здатність озону зумовлена великою надлишковою енергією молекули:
О3
= 3/2 О2
+ 100 кДж/моль (2.5)
Озон реагує з насиченими органічними сполуками з утворенням вільних радикалів. Лімітуючою стадією процесу є вплив озону на зв'язок С-Н
RH + O3
= R.
+ HO.
+ O2
( або R + HO.
3
). (2.6)
Радикали R.
, які утворилися в атмосфері оксисену, переважно перетворюються на пероксид радикали помірної активності. Тому ланцюгова реакція окиснення може виникнути лише за достатньо високої температури, коли швидкість реакції зростання ланцюга перевищує реакцію його обірванця. За невисокої температури окиснення озоном відбувається як не ланцюгова реакція з утворенням гілроксигідропероксидів:
R.
+ О2
= RО2
.;
(2.7)
RО2
.
+ RH = RООH + R.
. (2.8)
Альдегіди в свою чергу, окислюються до надто кислот, які розкладаються в розбавлених водних розчинах до органічних кислот та пероксиду гідрогену. Паралельно може відбуватися реакція окиснення гідроксильного радикалу:
HO.
+ O3
= HO2
.
+ O2
(2.9)
з наступною комбінацією пероксид радикалів:
2HO2
.
= Н2
О2
+ O2.
(2.10)
Проте насправді пероксид гідрогену не накопичується і витрата озону в нейтральному та кислому середовищах відповідає реакції
R-CH2
OH + 2O3
= RCOOH + 2O2
+ H2
O. (2.11)
Мабуть, у момент виділення пероксид гідрогену реагує з озоном:
H2
O2
+ O3
= H2
O + 2O2
. (2.12)
Крім того, можливо, що озон витрачається на розкладання гідрокси – гідроксипероксидів та надкислот. Швидкість реакції за цих умов зростає, що, ймовірно, зумовлено розкладання пероксид гідрогену, гідропероксиду, надкислоти та озону. Одночасне збільшення кількості генерованих первинних радикалів ініціює процес окиснення. Отже для прискорення процесу ініціювання процес окиснення озоном доцільно проводити в лужному середовищі. Для більшості органічних сполук проміжними та кінцевими продуктами окиснення є спирти, альдегіди(кетони) та кислоти [1].
Озон утворюється з кисню. Його синтез може бути здійснений різними методами; найбільш поширеними є: електролітичний, хімічний, фотохімічний і електросинтез. Крім того, озон отримують при іонізуючих випромінюваннях.
1. Електролітичний метод. Синтезу озону відомий давно. Механізм же утворення озону в електролітичних процесах до теперішнього часу до кінця ще не вивчений.
Синтез озону здійснюють в спеціальних комірках, в ролі електролітів використовують розчини різних кислот (H2
SO4
, НС1О4) або їх солі (NaClO4
> КСlO4
і ін.) Кислоти або їх солі, що беруть участь в реакціях електролізу, не віддають свого кисню, а при утворенні озону відбувається розкладання іонів і радикалів:
Н2
О+О2
= Оз
+2Н+
+2е (2.10)
Електролітичним способом можна отримати концентрований озон (30—58%-ний), наприклад при електролізі 40%-ній оксихлоридный кислоти з охолодженими до —65° З платиновими анодами; середня температура електроліту повинна наближатися до температури замерзання (—56° С). Густина струму на аноді —0,13— 2,16 А/дм2
, напруга —8—13 В, загальний тиск над електролітом — в межах 10—100 мм рт. ст. При електролізі розчинів солей утворення озону йде ефективніше, ніж при електролізі розчинів кислот, сам процес стабільніший, максимальний вихід по струму озону досягається за мінімальний час (10 хв), переривання струму не змінює синтезу озону [2].
2. Фотохімічне утворення озону відбувається в основному в природних умовах за рахунок дії сонячної радіації. Проте фотохімічно неможливо отримати озон у високих концентраціях. Основна область фотохімічного здобуття озону в малих концентраціях — це лабораторна практика (вивчення біологічної дії озону, випробування гум, клеїв, озонування повітря у виробничих приміщеннях і ін.).
На практиці озон отримують в спеціальних апаратах – озонаторах, в яких повітря з певною швидкістю пропускається між двома електродами, що з’єднані з джерелом живлення (5 – 20 кВ) [6]. Конструктивно електроди виконані у вигляді двох концентрично розміщених циліндрів різного діаметру (рисунок2.2) або у вигляді двох паралельних пластин (рисунок 2.3).
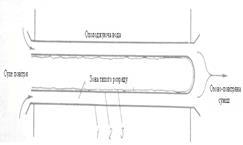
Рисунок 2.2 Розміщення електродів та діалектрика в трубчастому озонаторі
1 – трубка з нержавіючої сталі( електрод низької напруги; 2 – склянна трубка;
3 – фольга( електрод високої напруги).
Для отримання тихого розряду електроди озонаторів розділюють діалектриком с максимально можливим гранично поверхневим опором і
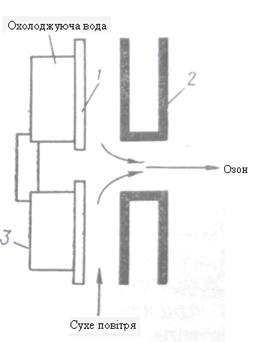
Рисунок 2.3 Розміщення електродів та діалектрика в пластинчастому озонаторі
1 – пластинка звичайного скла (діалектрик); 2 – профільні пластинки; 3 – пола пластинка із листового алюмінію
Для отримання тихого розряду електроди озонаторів розділюють діалектриком с максимально можливим гранично поверхневим опором і діалектричною сталою. Шар такого матеріалу слугує діалектричним бар’єром, що виключає отримання іскрового чи дугового розряду та обумовлює рівномірну структуру тихого розкладу. Одночасно він слугує реактивним буферним опором, що обмежує струм в ланцюгу розряду. В якості діалектриків використовуються звичайне або боросилікатне скло, емаль, пластмаси.
В зв’язку з тим, що 85 – 95% енергії, яку споживає озонатор затрачається на тепловиділення, електродну систему необхідно охолоджувати, бо озон при підвищеній температурі швидко розкладається. Основною величиною, що визначає синтез озону, слугує потужність розряду, віднесена до витрати газу, тобто, кількість енергії, що приходиться на об’єм пропущеного через озонатор газу.
2.1 Сорбційний метод очищення води на активованих вугіллях в поєднанні з озонуванням
Сорбційні методи очищення води засновані на процесах адсорбції та іонного обміну. Вилучення іонів з розчину здійснюється методом іонного обміну. Витяг молекул з розчину здійснюється методом адсорбції [7].
Найбільш поширені адсорбенти - активні (активоване) вугілля різних марок. Активні вугілля є пористі вуглецеві тіла, зернові або порошкоподібні, що мають велику площу поверхні. Неоднорідна маса, що складається з кристалітів графіту та аморфного вуглецю, визначає своєрідну пористу структуру активних вугіль, а також їх адсорбційні та фізико-механічні властивості. Пориста структура активних вугіль(рисунок 2.1.1) характеризується наявністю розвиненої системи пір, які класифікуються за розмірами в такий спосіб:
• вугілля з мікропорами - з розміром до 20 A,
• вугілля з мезопорами - з розміром 20-500 A,
• вугілля з макропорами - з розміром більше 500 A
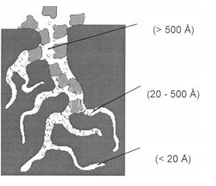
Рисунок 2.1.1 Пориста структура активних вугіль
Адсорбційні властивості активних вугіль оцінюються кількістю модельної речовини, сорбованої одиницею маси вугілля за певних умов, а також часом захисної дії одиниці об'єму вугілля до повного його насичення.
Підвищена окислювальна здатність озону у воді ефективно використовується для розкладання великої кількості органічних речовин, розчинених у виробничих стічних водах (СВ) підприємств текстильною, коксохімічною, целюлозно-паперовою нафтохімічною і інших галузях промисловості.
2.2 Очищення води за допомогою озонування
Озонування стічних вод з метою їх очищення найраціональніше, коли концентрації забруднюючих речовин знаходяться в діапазоні від декількох мг/л до 100-200 мг/л.
Очищення води озонуванням протікає по одній з чотирьох реакцій: прямого окислення, непрямого окислення, каталізу або озоноліза. Окрім хімічної дії, озон проявляє себе і як флокулянта, що дозволяє застосовувати його вже на стадії механічної обробки води для коагуляції зважених часток. В таблиці 2.2.1 приведені дані по окисленню деяких важкокисляємих речовин [6].
Таблиця 2.2.1
Дані по окисненню озоном
| Речовина |
Дані по окисненню озоном |
| Феноли та його похідні |
Всі феноли при озонування з розкриттям бензольного кільця; хлор-, нітро- та аміно- феноли при окиснення відповідно утворюють хлорид та нітрид-іони. Питома витрата озону залежить від вигляду похідних фенолу, величини рН і вагається від 0.4 до 2.5 мг/мг фенолу. Міра очищення складає 97-98%. |
| Гідролізний лігнін та гуміноподіні речовини |
Дані з'єднання містяться в стоках мікробіологічних виробництв (дріжджове, спиртне, гідролізне, лимонної кислоти і ін.). Витрату озону складає всього 10-35 мг/л стічної води. |
| Водорозчинні смоли |
Містяться в стоках підприємств по виробництву деревно-волокнистих і деревно-стружкових плит, виготовлення пластмас і лаків. Дані з'єднання інтенсивно розкладаються озоном, при цьому хінон і гідрохінон не виявляються в стоках. Витрата озону при цьому складає 0.5-1.0 мг/розчиненої смоли. Міра очищення – не нижче 90%. |
| СПАР |
Речовини цього ряду поширені в стоках виробництв синтетичних миючих засобів. СПАВ добре окислюються в будь-яких середовищах при питомій витраті озону 1-20 мг/ мг речовини. |
| Барвники |
Метод озонування є універсальним по відношенню до всіх основних груп фарбників, розчинних у воді. Він дозволяє не лише видалити забарвлення води, але і підвищити її здатність до її подальшому очищенню. |
| Стирол |
При початковій концентрації 50-150 мг/л можлива ефективність очищення до 90%. |
Компанією «ЕЛЕКТРОЕКОЛОГІЯ» розроблена і виготовлена установка озонно-електрокоагуляційної очистки стічних вод «ЕЛОН». Дана установка водоочистки складається з блоку озонування, електрокоагулятора і відстійника[8].
До складу системи очищення входить фільтр для ознепилення вуличного повітря (2), осушувач повітря (3) і генератор озону (4). Вуличне повітря забирається компресором, і після очищення від пилу і вологи - використовується для приготування озоно-повітряної суміші. Електрокоагулятором (6) є контактний апарат, що містить розчинні алюмінієві електроди, куди одночасно подається стічна вода на очищення і підготовлена озоно-повітряна суміш.Розподільний пристрій в апараті забезпечує розчинення на 95-99% озоно-повітряній суміші у воді, що приводить до ефективного розподілу озоно-повітряної суміші по перетину апарату. Поєднання процесу електрокоагуляції і проходження озоноліза сприяє збільшенню ефективності процесу очищення у декілька разів.
Зведені дані випробувань дослідної установки озоно-електролізного очищення води "ЕЛОН" на ОАО "СПБ картонно-поліграфічний комбінат" приведені в таблиці 2.2.2. Витрати на експлуатацію даної установки - вжиток електроенергії і алюмінієві розчинні електроди. При очищенні 2 м3
/ч стічної води споживається 10 електродів в перебігу 1 місяця; енергоспоживання - 10-15 кВт.
Таблиця 2.2.2
Результати аналізу проб стічної води
| Інгредієнти, що визначаються |
Вихідні концентрації, мг/м3
|
Степінь очищення, % |
| ХПК |
160000 |
84,1 |
| Азот нітритів |
0,130±0,017 |
92,3 |
| Азот амонійний |
0,184±0,024 |
75,5 |
| Цвітность, ЗХКШ |
1200±2 |
80,5 |
| Нафтопродуктт |
0,27±0,03 |
81,5 |
| Сульфати |
43,27±7,46 |
89,4 |
| Мідь |
1,14±0,21 |
81,5 |
| Зважені речовини |
11066±5 |
83,8 |
| Мікробіологічні показники |
До установки |
Після установки |
| Загальне мікробне число 220 |
7000 |
1 |
| Число загальних колі формних бактерій, КОЕ/100 мл |
500 |
– |
| Число термотолерантних коліформних бактерій КОЕ/100 мл |
24000 |
– |
| Колі фаги, КОЕ/100 мл |
60 |
– |
3. Принципові технологічні схеми вживання озону і активного вугілля на водоочисних станціях
Залежно від якісного і кількісного складу забруднень вододжерела можливі різні варіанти вживання озону в технологічній схемі очищення води (рисунку 3.1 і 3.2). На рисунку 3.1 представлена традиційна схема очищення води з відстійниками і фільтрами, на рисунку 3.2 - схема з контактними освітлювачами. Одноступінчате озонування: використання озону на стадії попереднього окислення води або після коагуляційного її очищення перед піщаними або вугільними фільтрами. Двоступінчате озонування: попереднє озонування і озонування після коагуляційної обробки води. Триступінчате озонування: попереднє озонування, після коагуляційної обробки і озонування після повного очищення води. Первинне озонування (передозонування) проводиться з метою окислення легкоокислюваних органічних і неорганічних забруднень, поліпшення процесу коагуляції, а також для часткового знезараження води. В цьому випадку вихідна вода обробляється невеликими дозами озону. Вторинне озонування води дозволяє здійснити подальше глибше окислення забруднень, що залишилися, і, крім того, підвищує ефективність сорбційного очищення і подовжує термін служби активного вугілля до регенерації, в даному випадку озон вводиться перед піщаними або вугільними фільтрами. Завершальне озонування очищеної води забезпечує повне знезараження і покращує органолептичні показники води. По числу місць введення озону встановлюються контактні камери, в яких відбувається змішення озоноповітряної суміші з водою. Для міських водоочисних станцій зазвичай використовують барботажні басейни; як диспергатори можуть застосовуватися металло-керамічні труби (або пластани) або спеціальні насадки з нержавіючої сталі, що встановлюються на трубопроводах.
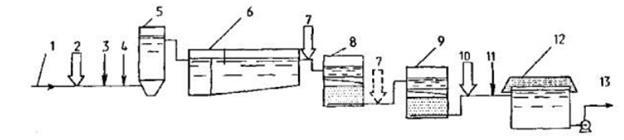 Рисунок 3.1 Застосування озону і активного вугілля на станціях з двоступінчастою схемою очищення води Рисунок 3.1 Застосування озону і активного вугілля на станціях з двоступінчастою схемою очищення води
1 - подача річкової води; 2 - первинне озонування; 3 - первинне хлорування (при необхідності); 4 - введення коагулянта; 5 - змішувач; 6 - відстійник (або освітлювач із зваженим осадом); 7 - вторинне озонування; 8 - піщаний фільтр; 9 - вугільний фільтр; 10 - третинне озонування; 11 - вторинне хлорування; 12 - резервуар чистої води; 13 - подача питної води споживачеві
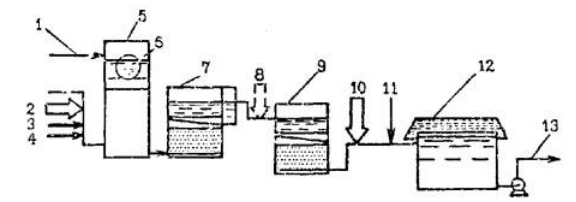
Рисунок 3.2 Застосування озону і активного вугілля для очищення води на станціях з контактними освітлювачами:
1 - подача річкової води; 2 - первинне озонування: 3 - первинне хлорування (при необхідності); 4 - введення коагулянта; 5 - вхідна камера; 6 - сітчастий барабанний фільтр; 7 - контактний освітлювач; 8 - вторинне озонування; 9 - вугільний фільтр; 10 - третинне озонування; 11 - вторинне хлорування; 12 - резервуар чистої води; 13 - подача питної води споживачеві.
Контактні камери можуть працювати як в протиточному, так і в прямоточному режимах, причому при протиточному методі змішення коефіцієнт використання озону підвищується до 0,93 - 0,97. До складу комплекту устаткування озонаторной станції входять: компресори, установки для очищення і осушення повітря, генератори озону, силові енергетичні установки, апарат каталітичного розкладання озону.
4. Технологічна ефективність спільного вживання озону і активного вугілля
Говорити про ефективність будь-якої технології, а тим більше озонуванні і сорбційного очищення води, в загальному вигляді неможливо. В кожному випадку для даного конкретного об'єкту вода природних вододжерел характеризується різними физико-хімічними показниками, різними концентраціями і природою забруднень. Тому судити про ефективність цих методів можна лише для реальних випадків, кожен з яких, до того ж, має і свою схему очищення води[6].
В разі попереднього окислення води озоном можна зменшити концентрацію хлорорганічних з'єднань (ХОЗ). Результати досліджень за визначенням ефективності попереднього озонування води на утворення ХОС (р. Балахна) представлені на рисунок 4.1

Рисунок 4.1 Вплив попереднього озонування води на утворення ХОС в процесі очищення (р. Балахна): 1 - без озонування; 2 - з озонуванням
Як видно з отриманих даних, в результаті попередньої обробки води озоном (доза озону 1,8 мг/л) відбувається окислення (деструкція) деяких органічних сполук - попередників ХОЗ, і концентрація тих, що утворюються при подальшому хлоруванні ХОЗ в очищеній воді істотно менше, ніж в разі обробки хлором неозонованої води. Так, концентрація хлороформу зменшується в середньому на 30–35 %, діхлорбромметана і чотирихлористого вуглецю - відповідно на 80 і 50 %. Крім того, зменшується хлоропоглинаємість озонованої води, у зв'язку з чим знижується (приблизно на 15– 20 %) необхідна для знезараження води доза хлору.
Характерні дані показані на рисунок 4.2, після обробки води, очищеної на фільтрах станції Кемеровського водопроводу. Цими дослідженнями встановлено, що за наявності у воді після фільтру хлороформу в концентрації 0,13 мг/л, його концентрація зменшувалася із збільшенням доз озону і істотно знижувалася після очищення води на вугільному завантаженні.

Рисунок 4.2 Зміна концентрації ХОЗ при обробці води після виробничого фільтру станції озоном і вугіллям (м. Кемерово): 1 - озонована вода; 2 - вода після сорбційного очищення
Дослідження по впливу попереднього озонування на процес подальшої коагуляційної обробки показали, що введення озону зменшує цвітність, каламутність і окислюваність води. Вплив озонування води на протікання процесів коагуляції і освітлення представлений характерними залежностями при очищенні води р. Оки (м. Рязань) на рисунок 4.3. У всіх вивчених випадках після попереднього озонування наголошується істотне зниження потрібної для її очищення дози коагулянту (на 20 - 30 %)

Рисунок 4.3 Вплив попереднього озонування на процес коагуляції і освітлення води (м. Рязань): 1 - без озонування; 2 - з озонуванням (доза озону - 2,5 мг/л)
При встановленні ефективності комплексного очищення води для міст Центральної Європейської частини РФ від різних забруднень: м. м. Ярославль (р. Которосль), Рязань (р. Ока), Володимир (р. Клязьма), Балахна і Котячий (Нижньогородська обл., р. Волга) були розглянуті різні схеми, що включають коагуляцію, попереднє озонування, освітлення води, вторинне озонування і сорбційне очищення.
Було встановлено, що майже у всіх випадках найбільш ефективними по відношенню до таких показників, як каламутність, цвітність, перманганатна окислюваність, ХПК, нафтопродукти, залишковий алюміній, є схеми з двохетапним озонуванням води. Така технологічна схема забезпечувала видалення органічних забрудненні по окислюваності - на 80 - 85 %, по уф-показнику - на 95 - 99 %, по нафтопродуктах - на 90 - 95 %.
Дані по ефективності видалення фенолів води (м. Кемерово) (рис.4.4) Томська, показують, що сорбційне очищення знижувало концентрацію фенолу з 0,009 до 0,0038 мг/л, тобто до рівня близько 4 ГДК. І лише попереднє озонування води дозою 2 - 3 мг/л з подальшим фільтруванням на вугіллі забезпечували повне видалення фенолів. Для видалення з'єднань групи амінів (рисунок 4.4) потрібні підвищені дози озону 5 - 6 мг/л, які з подальшим фільтруванням води через активне вугілля дозволили понизити концентрацію амінів до необхідних величин.
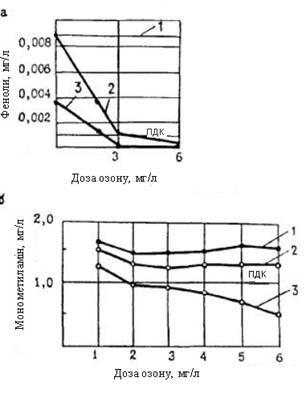
Рисунок 4.4 Видалення фенолів і амінів: 1 - вихідна вода; 2 - озонована вода; 3 - вода після вугільного завантаження
Особливу групу вод складають кольорові води. Вода багатьох північних і сибірських річок (Західна Двіна, Сухона, Вичегда, Олена, Алдан і ін.), ряду озер і водосховищ характеризується малим вмістом суспензії і високою кольоровістю - до 100 - 240 град. Крім того, на території Росії є великі запаси підземних вод (Якутія, Ростовська обл., Краснодарський край), які не використовуються для господарсько-питного водопостачання із-за високої кольоровості.
Останніми роками була досліджена технологія очищення вод середньої і високої цвітності і з використанням спільного вживання процесів озонування і фільтрування через активне вугілля як самостійного методу обробки води. Озонування води дозволяє істотно понизити забарвлення природної води; ефективність озонування представлена на рисунку 4.5 Дози озону, потрібні для очищення води, досить високі і складають 15 - 20 мг/л. При цьому цвітність води після озонування знижується до величини 30 - 35 град, а сорбційне очищення зменшує цвітність до нормованих величин.

Рисунок 4.5 Ефективність очищення кольорових вод озонуванням (р. Приморсько-Ахтарськ Краснодарського краю): 1 - цвітність води; 2 – окислюваність
При озонуванні води постійно перевіряли ефективність її знезараження. Проведені бактеріологічні спостереження, зокрема, в м. Рязані підтвердили високу бактерицидну здатність озону: при дозах озону 3 - 4 міліграми/л колі-індекс в озонованій воді не перевищував 3 (при величині колі-індексу в річковій воді - 100000 - 300000), а середнє мікробне число складало 12 - 15 м. т./мл (у річковій воді - від 1400 до 2300 м. т./мл).
Таким чином, представлені вище приклади, показують найбільш характерні випадки позитивного вживання озону і активного вугілля в технології очищення води, які безумовно не охоплюють всього різноманіття варіантів використання окислювально-сорбційного методу очищення і видалення з води всіх забруднень, що зустрічаються в ній. Проте на практиці наголошуються випадки, коли озонування може привести і до погіршення процесу коагуляції. Так, при очищенні річкової води в р. Калтан (Кемеровська обл.) в період весняного паводку, попереднє озонування погіршувало подальші процеси коагуляції і освітлення, в результаті якість очищеної води не відповідала вимогам стандарту.Отримані результати привели до того, що з схеми очищення було виключено первинне озонування і замінено на введення озону перед фільтрувальними спорудами.При озонуванні деяких вод дози озону істотно впливають на подальші процеси очищення, тобто існує досить вузький діапазон їх оптимальних значень, менше якого озонування неефективне, а при великих дозах наголошується поява суспензії у фільтрованій воді і підвищується концентрація залишкового алюмінію. У ряді випадків озонування води може привести до підвищення концентрації деяких хімічних забруднень, наприклад, фенолів, які можуть утворюватися в результаті неповного окислення ароматичних з'єднань, присутніх у воді. Результати досліджень при озонуванні р. Которосль (м. Ярославль) показують, що концентрація фенолів зменшується або збільшується залежно від якості вихідної води і дози озону.
Крім того, відомо, що в процесі озонування води можливе утворення побічних продуктів, з яких найбільш показним є формальдегід. Тому у всіх дослідженнях по озонуванню постійно контролювали концентрацію формальдегіду в оброблюваній воді, величина якої періодично перевищувала ГДК (0,05 міліграм/л). Проте при подальшому сорбційному очищенні на вугільних фільтрах вміст формальдегіду істотно зменшується.
Необхідно також мати на увазі, що використовувати озон як єдиний знезаражувальний реагент неможливо, оскільки він не володіє пролонгуючою бактерицидною дією. Крім того, при озонуванні води багато органічних забруднень піддаються деструкції, в результаті збільшується кількість біорозкладаних з'єднань, у воді підвищується концентрація так званого «асимільованого органічного вуглецю», який легко засвоюється мікроорганізмами, сприяючи їх життєдіяльності.
Крім того, при озонуванні води багато органічних забруднень піддаються деструкції, в результаті збільшується кількість біорозкладаних з'єднань, у воді підвищується концентрація так званого «асимільованого органічного вуглецю», який легко засвоюється мікроорганізмами, сприяючи їх життєдіяльності. Це створює сприятливі умови для повторного бактерійного забруднення очищеної води у водопровідній мережі.
Тому для надійної роботи водопровідних мереж необхідне остаточне знезараження води проводити хлорвмісними реагентами (хлором, гіпохлоритом натрію - електролітичним або хімічним, хлорамінами) дозами, що забезпечують вміст у воді залишкового хлору на рівні 0,3 - 0,5 мг/л, що гарантує повний знезаражувальний ефект.
Таким чином, завданням цього розділу було показати, що у всіх випадках вживання методів озонування і сорбційного очищення води необхідне проведення передпроектних технологічних досліджень.
Ці дослідження зможуть визначити всі позитивні і можливі негативні моменти вживання озону, і лише вони дозволять встановити ефективність озонування і сорбційного очищення, необхідні дози озону, необхідні місця введення озону, вплив озону на основні процеси очищення води і можливість поєднання озонування з подальшим сорбційним очищенням.
5. Застосування технології озонування і сорбційного очищення води на локальних установках
Останніми роками для малих населених місць, санаторіїв, будинків відпочинку, сільських селищ, гарнізонів і військових містечок знайшли широке вживання установки заводського виготовлення, що випускаються російською та українською промисловістю.
Продуктивність цих установок змінюється в діапазоні від 100 до 10000 м3
/добу.
Для очищення підземних вод від заліза і марганцю використовуються установки типа «Деферит»[7]. Для очищення підземних вод, що містять складніші форми заліза, підвищених концентрацій фтору і солей жорсткості, а також для поверхневих вод використовуються установки «Струмінь-М». Для досить великих комунальних споживачів розроблені і виготовляються водоочисні станції заводського виготовлення типа «Роса» продуктивністю від 1,6 до 1000 м3
/добу
За наявності в джерелах водопостачання хімічних забруднень (фенолів, нафтопродуктів), органічних сполук, а також наявності підвищених концентрацій марганцю і сірководню, всі вказані типи установок можуть бути додатково оснащені блоками озонування і сорбційного очищення води..
При цьому продуктивність озонаторів може змінюватися від 100 г до 2 кг/ч. Для сорбційного очищення слід використовувати додаткові фільтри в кількості меншому в 1,5 - 2 рази, чим піщаних. Для оснащення водоочисних установок вказаним устаткуванням потрібне додаткове конструкторське опрацювання в розробці креслень дообладнання до кожного розміру установок.
6. Експерементальні дослідження
Для встановлення закономірностей очищення води за допомогою деструкційних методів було проведено серії дослідів по вивченню впливу озону на очистку модельних розчинів.
6.1 Визначення масової частки озону в озоно-повітряній суміші (ОПС).
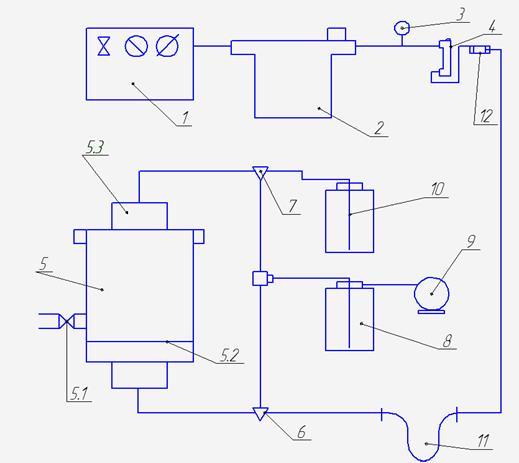
Рисунок. 6.1 Схема установки озонування води
1 – компресор; 2 – фільтр-осушник; 3 – манометр; 4 – система регулювання тиску; 5 – абсорбційна колона; 5.1 – кран відбору проб; 5.2 – пориста перегородка; 5.3 – кришка; 6,7 – трьоходові крани; 8 – дрексель для аналізу; 9 – газовий годиник; 10 – вловлювач озону; 11 – захисна петля; 12 – озонатор.
Визначення озону в ОПС здійснюється об’ємнометричним методом. Для проведення аналізу дрексель 8 заповнюють на 2/3 5÷10% розчином КІ. Вмикають компресор 1 за допомогою системи 4 виставляють витрату ( при чому тиск на манометрі 3 не повинен перевищувати 0,15 МПа). Кран 6 повинен бути в положенні в обхід колони 5. Вмикають озонатор і виставляють напругу в межах 20÷35 кВ, пропускають 5÷10 літрів ОПС, при чому фіксують час, за який ця суміш пройде дрексель 8. Об’єм встановлюють за допомогою газового годинника 9. Розчин з дрекселя 8 кількісно переносять в колбу на титрування (на 500 мл), додають 20 мл 1н H2
SO4
та 5÷10 крапель 1% розчину крохмалу( крохмал має бути свіжоприготовленим).
Титрують отриману суміш, до знебарвлення, розчином Na2
S2
O3
0.005 н попередньо додавши 20 мл 1Н сульфатної кислоти.
Вміст O3
в ОПС визначають за формулою:
X=(V(Na2
S2
O3
)∙K∙0.005∙24)/V, (6.1.1)
де X – вміст O3
в ОПС г/дм3
,
V(Na2
S2
O3
) – об’єм тіосульфату, що пішов на титрування,
К – поправочний коефіцієнт концентрації Na2
S2
O3
,
0,005 – концентрація Na2
S2
O3
,
24 – еквівалент озону,
V - об’єм ОПС.
Далі знаходимо витрату ОПС.
W= V/t; (6.1.2)
де V– витрата ОПС, дм3
/c,
t – час, за який пройшло V літрів газу.
А потім визначаємо концентрацію озону, яку продукує озонатор.
С(O3
) = X∙W; г O3
/ дм3
. (6.1.3)
6.2 Видалення барвників за допомогою озонування
Для проведення досліджень необхідно приготувати 1 дм3
води з концентрацією барвника 40÷200 мг/дм3
. (В якості барвника підійде будь-який барвник органічної природи). 600 см3
отриманого розчину заливають в абсорбційну колону 5, в яку через пористу перегородку 5.2 подається ОПС. Закривають кришку 5.3. В разі коли немає необхідності у визначенні залишкового озону кран 7 переводять у положення 1. При цьому газ після колонки 5 йде на поглинач 10.
Для визначення залишкового озону кран 7 переводять у положення 2 і проводять згідно методики О3
в ОПС.
Для встановлення кінетики видалення барвників кожні 5 хв проводять визначення оптичної густини, пробу для аналізу відбирають через кран 5.1.
Перед початком роботи визначають довжину хвилі для даного барвника та довжину кювети, використовуючи для цього вихідний розчин.
Ступінь освітлення визначають по формулі:
Z=(Aвих
-A)/Aвих
∙100%; (6.2.1)
де Aвих
– оптична густина вихідного розчину;
А – оптична густина розчину після озонування.
Для визначення ефективності очищення води за допомогою озонування були приготовані зразки (імітати) стічних вод, що містять наступні барвники: порціону оливково-зелений, та легко змивний червоний.
Проведені досліди з барвником порціону оливково-зелений.
Проби барвників, що відбиралися через кожні 5 хв хвилі поміщені в окремі склянки, для визначення оптичної густини. Довжина хвилі складала 400 нм, кювета l=20.055 мм, тобто 2 см.
В результаті проведених досліджень були отримані наступні результати.
Дослід 1.
1. Напруга озонатора становить 25 кВ, об’єм газу, який пропускали становить 7 літрів, концентрація барвника 40мг/л.
На титрування розчину КI пішло 7 мл розчину Na2
S2
O3.
Визначимо вміст O3
в ОПС за формулою (6.1.1)
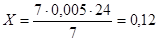 г/дм3
. г/дм3
.
Витрата ОПС відповідно формули (6.1.2) складе
W=7/164=0,0426 дм3
/c
Концентрація озону, яку продукує озонатор згідно формули (6.1.3) складе
С(O3
) =0,12∙00,0426=0,00516 г O3
/ дм3
.
Оптична густина А0
=0,56 (вихідного розчину барвника).
Відповідно після 5, 10, 15, 20, 25 були отримані такі значення оптичної густини: А5
=0,54, А10
=0,5, А15
=0,46, А20
=0,41, A25
=0,40.
Для кожної точки визначаємо ступінь освітлення визначають по формулі (6.2.1)
Z5
=(0,56-0,54)/0,56=3,6%
Z10
=(0,56-0,5)/0,56=10,71%
Z15
=(0,56-0,46)/0,56=17,85%
Z20
=(0,56-0,41)/0,56=26,78%
Z25
=(0,56-0,4)/0,56=28,57%.
За отриманими результатами будуємо графік залежності ступеня освітлення(Z), від часу(t).
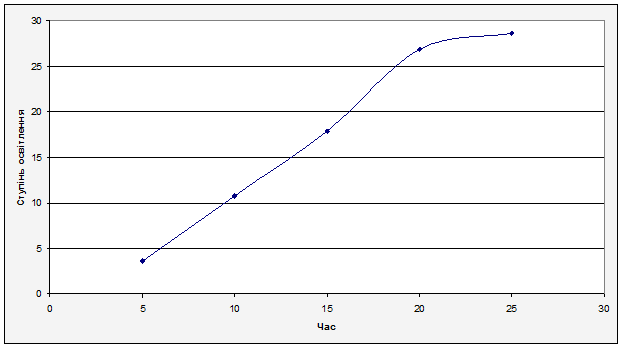 Рисунок 6.2.1 Графік залежності ступеня освітлення(Z), від часу(t). Рисунок 6.2.1 Графік залежності ступеня освітлення(Z), від часу(t).
З графіку можна зробити висновок: максимальна ступінь освітлення відбувається через 25 хвилин, при цьому досягається ступінь освітлення 28,57%.
2. Напруга озонатора становить 25 кВ, об’єм газу, який пропускали становить 5 літрів, концентрація барвника 40мг/л.
На титрування розчину КI пішло 11 мл розчину Na2
S2
O3.
Визначимо вміст O3
в ОПС за формулою (6.1.1)
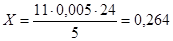 г/дм3
. г/дм3
.
Витрата ОПС відповідно формули (6.1.2) складе
W=5/155=0,0322 дм3
/c
Концентрація озону, яку продукує озонатор згідно формули (6.1.3) складе
С(O3
) =0,264∙0,0322=0,0085 г O3
/ дм3
.
Оптична густина А0
=0,56 (вихідного розчину барвника).
Відповідно після 5, 10, 15, 20, 25 були отримані такі значення оптичної густини: А5
=0,55, А10
=0,52, А15
=0,48, А20
=0,42, A25
=0,40.
Для кожної точки визначаємо ступінь освітлення визначають по формулі (6.2.1)
Z5
=(0,56-0,55)/0,56=1,78%
Z10
=(0,56-0,52)/0,56=7,14%
Z15
=(0,56-0,48)/0,56=14,28%
Z20
=(0,56-0,42)/0,56=25%
Z25
=(0,56-0,4)/0,56=28,65%.
За отриманими результатами будуємо графік залежності ступеня освітлення(Z), від часу(t).
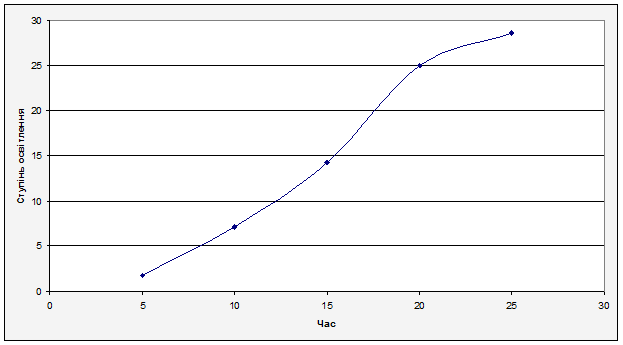 Рисунок 6.2.2 Графік залежності ступеня освітлення(Z), від часу(t). Рисунок 6.2.2 Графік залежності ступеня освітлення(Z), від часу(t).
З графіку можна зробити висновок: максимальна ступінь освітлення відбувається через 25 хвилин, при цьому досягається ступінь освітлення 28,57%. Спираючись на рисунок 6.2.1 можна спостерігати чітку закономірність, та правильність проведених дослідів.
Таким чином було проведено серію дослідів, результати яких повністю співпали з результатами, які наведені вище.
Проведені досліди з барвником легко змивний червоний.
Проби барвників (легко змивного червоного), що відбиралися через кожні 5 хв хвилі поміщені в окремі склянки, для визначення оптичної густини. Довжина хвилі складала 540 нм, кювета l=20.055 мм, тобто 2 см.
В результаті проведених досліджень були отримані наступні результати.
Дослід 2.
1. Напруга озонатора становить 25 кВ, об’єм газу, який пропускали становить 7 літрів, концентрація барвника 20мг/л.
На титрування розчину КI пішло 3,3 мл розчину Na2
S2
O3.
Визначимо вміст O3
в ОПС за формулою (6.1.1)
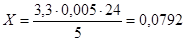 г/дм3
. г/дм3
.
Витрата ОПС відповідно формули (6.1.2) складе
W=5/83=0,06 дм3
/c
Концентрація озону, яку продукує озонатор згідно формули (6.1.3) складе
С(O3
) =0,0792∙0,06=0,0048 г O3
/ дм3
.
Оптична густина А0
=0,7 (вихідного розчину барвника).
Відповідно після 5, 10, 15, 20, 25 були отримані такі значення оптичної густини: А5
=0,62, А10
=0,6, А15
=0,57, А20
=0,55, A25
=0,52.
Для кожної точки визначаємо ступінь освітлення визначають по формулі (6.2.1)
Z5
=(0,7-0,62)/0,7=11,43%
Z10
=(0,7-0,6)/0,7=14,28%
Z15
=(0,7-0,57)/0,7=18,57%
Z20
=(0,7-0,55)/0,7=21,42%
Z25
=(0,7-0,52)/0,7=25,71%.
За отриманими результатами будуємо графік залежності ступеня освітлення(Z), від часу(t).
 Рисунок 6.2.3 Графік залежності ступеня освітлення(Z), від часу(t) Рисунок 6.2.3 Графік залежності ступеня освітлення(Z), від часу(t)
З графіку можна зробити висновок: максимальна ступінь освітлення відбувається через 25 хвилин, при цьому досягається ступінь освітлення 25,71%.
2. Напруга озонатора становить 35 кВ, об’єм газу, який пропускали становить 7 літрів, концентрація барвника 20мг/л.
На титрування розчину КI пішло мл розчину Na2
S2
O3.
Визначимо вміст O3
в ОПС за формулою (6.1.1)
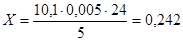 г/дм3
. г/дм3
.
Витрата ОПС відповідно формули (6.1.2) складе
W=5/84=0,059 дм3
/c
Концентрація озону, яку продукує озонатор згідно формули (6.1.3) складе
С(O3
) =0,242∙0,059=0,0144 г O3
/ дм3
.
Оптична густина А0
=0,7 (вихідного розчину барвника).
Відповідно після 5, 10, 15, 20, 25 були отримані такі значення оптичної густини: А5
=0,62, А10
=0,59, А15
=0,57, А20
=0,53, A25
=0,5.
Для кожної точки визначаємо ступінь освітлення визначають по формулі (6.2.1)
Z5
=(0,7-0,62)/0,7=11,43%
Z10
=(0,7-0,59)/0,7=15,71%
Z15
=(0,7-0,57)/0,7=18,57%
Z20
=(0,7-0,55)/0,7=24,28%
Z25
=(0,7-0,52)/0,7=28,57%.
За отриманими результатами будуємо графік залежності ступеня освітлення(Z), від часу(t).
 Рисунок 6.2.4 Графік залежності ступеня освітлення(Z), від часу(t). Рисунок 6.2.4 Графік залежності ступеня освітлення(Z), від часу(t).
З графіку можна зробити висновок: максимальна ступінь освітлення відбувається через 25 хвилин, при цьому досягається ступінь освітлення 28,57%. Спираючись на рисунок 6.2.3 можна спостерігати чітку закономірність, та правильність проведених дослідів.
Таким чином було проведено серію дослідів, результати яких повністю співпали з результатами, які наведені вище.
Дослід 3. Для покращення процесу озонування було застосовано коагуляційний процес. В якості коагулянту використовувався неочищений сульфат алюмінію, що був отриманий за технологією, яка була розроблена на кафедрі ТНР та ЗХТ [5].
Для визначення механізму процесу були зняті спектри поглинання озонованих розчинів. На рисунку 6.2.5 подано спектри поглинання озонованих розчинів.
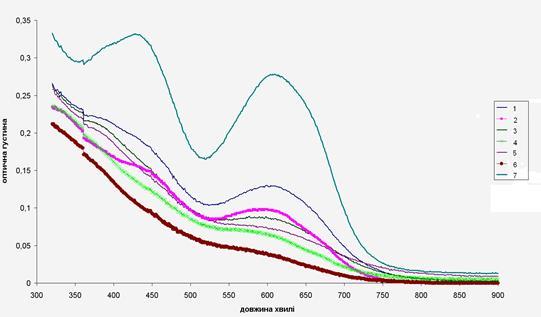
Рисунок 6.2.5 Спектри поглинання озонованих розчинів
1–проба відібрана через 5 хвилин озонування, 2– проба з коагулянтом відібрана через 5 хвилин озонування, 3–проба відібрана через 10 хвилин озонування, 4– проба з коагулянтом відібрана через 10 хвилин озонування, 5– проба відібрана через 15 хвилин озонування, 6 – проба з коагулянтом відібрана через 15 хвилин озонування, 7 – вихідний розчин порціон оливково-зелений з концентрацією 40 мг/л.
Як видно з рисунку 6.2.5 поступове зникнення піку при довжині хвилі 420 нм вказує на руйнування структури барвника. При використанні коагулянту зникнення відбувається вже за 10 хвилин(у випадку озонування через 15 хвилин). Це вказує на те, процес руйнування структури барвника в присутності коагулянту відбувається швидше.
Висновок
За період переддипломної практики було проведено дослідження видалення з води барвників за допомогою озонування. Встановлено, що барвник легко змивний червоний на 28,57% видаляється через 25 хвилин озонування, порціон оливково-зелений на 28,65%.
Встановлено, що поєднання процесів коагуляції покращують видалення порціону оливково-зеленого з водних розчинів. Дане припущення було підтверджене спектроскопічними дослідженнями.
Список використаних джерел
1. Запольский А.К., Баран А.А. Коагулянты и флокулянты в процессах очистки воды: Свойства. Получение. Применение. – Л.: Химия, 1987. – 208 с.
2. Фізико-хімічні основи технології очищення стічних вод / Під ред. А.К. Запольського. – К.: Лібра, 2000. – 552 с.
3. Николадзе Г.И. Технология очистки природных вод. – М.: Высшая школа, 1987. – 480 с.
4. Л.А.Кульский, Строкач П.П. Технология очистки природных вод-Высшая школа, 1986 – 352 с.
5. Патент на корисну модель №32762 МПК(2006) СO1F7/74 авторів Крилець Г.В., Астрелін І.М., Толстопалова Н.М., Супрунчук В.І., Светлейшина О.М. опбл. 26.05.2008 Бюлетень №10.
6. http://www.complexdoc.ru
7. http://garantus.at.ua
8. http://www.ntpo.com
|