Введение. 8
Глава 1. Литературный обзор. 10
1.1. Методы удаления растворимых примесей сточных вод. 10
1.3. Ионообменная сорбция, механизм ионного обмена. 20
1.5. Регенерация ионитов. 33
Глава 2. Методика эксперимента. 39
2.1. Подготовка ионитов и модельной хромсодержащей сточной воды.. 39
2.1.2. Подготовка модельного раствора хромсодержащей сточной воды 39
2.2. Определение содержания хрома (VI) фотоколориметрическим методом 40
2.3. Очистка сточной воды на анионите. 42
2.4. Регенерация СrО2-
4
42
2.5. Нейтрализация стоков, содержащих цианиды.. 42
2.6. Определение содержания цианидов в сточных водах. 43
Глава 3. Результаты и их обсуждение. 45
3.1. Очистка сточных вод от хромат–ионов. 45
3.1.2. Определение концентраций хромат - ионов в промывных растворах. 50
3.1.3. Определение величины адсорбции. 50
3.2. Очистка сточных вод от цианид - ионов. 55
Глава 4. Экономическая часть. 56
Выводы.. 62
Библиографический список. 63
Рост городов, развитие промышленности и сельского хозяйства привели к тому, что располагая гигантскими водными ресурсами, Россия уже испытывает в ряде регионов дефицит воды, а там где его еще нет, качество воды крайне низкое.
Гальванотехника - одно из производств, серьезно влияющих на загрязнение окружающей среды, в частности ионами тяжелых металлов, наиболее опасных для биосферы. Главным поставщиком токсикантов в гальванике (в то же время и основным потребителем воды и главным источником сточных вод) являются промывные воды. Объем сточных вод очень велик из-за несовершенного способа промывки деталей, который требует большого расхода воды (до 2 м3
и более на 1 м2
поверхности деталей).
Сточные воды многих гальванических цехов содержат в своем составе токсические вещества такие, как циан, хром, медь, свинец, кислоту, щелочи и др.
Превышение ПДК может вызвать прямое или косвенное вредное влияние на человека, животных, рыб. Действие хрома (VI), например, выражается в токсическом и канцерогенном проявлении.
Поэтому необходимо максимально уменьшить концентрацию токсикантов в промывных водах.
На машиностроительном предприятии обезвреживание сточных вод в том числе и от хромат-и цианид-ионов производят реагентным методом. Так, Сr (VI) восстанавливают до Cr(III), который менее токсичен, затем производят осаждение. Однако у этого метода есть недостатки. Основным недостатком этого метода является большое количество шламов, содержащих токсичные соединения тяжелых металлов. Утилизация и переработка образующихся шламов - очень сложное и дорогостоящее производство, а в некоторых случаях шламы не поддаются переработке. Основным методом обезвреживания таких отходов является захоронение их на специальных площадках, если таковые предусматриваются. Таким образом, возврат химреактивов и металлов в цикл производства практически исключен.
С учетом этого целью данной работы явилась оценка возможности обезвреживания цианидов реагентным способом и хром содержащих сточных вод методом ионообменной сорбции с последующей регенерацией хромат - ионов.
Удаление растворимых примесей осуществляется экстракцией, сорбцией, нейтрализацией, электорокоагуляцией, эвапорацией, ионным обменом, озонированием и т.п.
Экстракция -
процесс перераспределение примесей сточных вод в смеси двух взаимно нерастворимых жидкостей(сточной воды и экстрагента) в соответствии с коэффициентом экстракции. На машиностроительных предприятиях экстракцию применяют для очистки сточных вод от фенола. Для интенсификации процесса экстракции перемешивание смеси сточных вод с экстрагентом осуществляют в экстракционных колоннах, заполненных насадками типа колец Рашига.
Сорбция
наряду с использованием в процессах очистки газа широко применяется для очистки сточных вод от растворимых примесей. В качестве сорбента используют практически любые мелкодисперсные вещества (зола, торф, опилки, шлаки, глина), наиболее эффективным сорбентом является активированный уголь.
Электрокоагуляцию
применяют для очистки сточных вод гальванических и травильных отделений от хрома и других тяжелых металлов, а также от цианов.
Ионообменные
методы очистки сточных вод находят применение практически в любых отраслях промышленности для очистки от многих примесей, в том числе и шестивалентного хрома. Эти методы позволяют обеспечить высокую эффективность очистки, а также получить выделенные из сточной воды металлы в виде относительно чистых и концентрированных солей. Вредность хрома в сточной воде уничтожается переводом хрома шестивалентного в трехвалентный солями сульфатом железа (II) в кислой среде:[19]
Сr+6
+3Fе+2
—2Сr+3
+3Fе+3
Например для хромового ангидрида и хромпика:
2СrО3
+6FеSО4
+6Н2
SО4
Сr2
(SО4
)3
+3Fе2
(SО4
)3
+6Н2
О
К2
Cr2
О7
+6FеSО4
+7Н2
SО4
→ К2
SО4
+Сr2
(SО4
)3
+3Fе2
(SО4
)3
+7Н2
О
Образовавшиеся трехвалентные соединения хрома переводятся в осадок (оснований).
Сr+3
+3ОН → Сr(ОН)3
Сr2
(SО4
)3
+3Са(ОН)2
→2Сr(ОН)3
+3СаSО4
Рекомендуется брать избыток железного купороса в 1,5 раза и извести в 2,5 раза больше.
Для спуска в канализацию хромовые растворы разбавить водопроводной водой до концентрации хрома около 60 мг/л и добавить известковое молоко 0,3-0,4 г/л и железный купорос 1 г/л.
3. Количество кислоты, необходимой для образования осадка, определяется в зависимости от начальной кислотности раствора (рН=4,2-6,3). Время отстаивания осадка 1 час. Основными реагентами являются 10% растворы извести и сернокислого железа.
4. При смене растворов в травильных и обезжиривающих ваннах необходимо перед спуском в канализацию нейтрализовать соответственно щелочью или кислотой непосредственно в самих ваннах.
5. При смене электролитов в гальванических ваннах обезвреживание должно проводиться в самих ваннах или запасных емкостях.
6. Растворы промывных ванн один раз в неделю направлять в Ц.З.Л. для определения рН; При рН, выходящих из нормы (6,5-8,5), необходимо принять меры к доведению рН до нормы путем увеличения количества промывных ванн для данного (определенного) количества промываемых деталей [9].
7. В канализацию разрешается спускать только воды с рН=6,5-8,5.
8. Производить спуск в канализацию не обезвреженных травильных, обезжиривающих растворов и растворов гальванических ванн цехам завода категорически запрещается.
9. Спуск в канализацию нейтрализованных растворов гальванических ванн цехам разрешается производить только при получении свидетельства ЦЗЛ о содержании ядовитых веществ в нейтрализованном растворе не выше предельно-допустимых норм.
10. Цехам, применяющим в работе масла, растворители, нефтепродукты и смазывающе-охлаждающие жидкости, категорически запрещается сбрасывать в канализацию, их следует собирать в отдельные емкости и сдавать для утилизации.
11. Для организации этих работ на предприятии существует отдел охраны окружающей среды, который занимается контролем качества стоков. Проведение вышеуказанных мероприятий осуществляется на заводских очистных сооружениях.[9]
В состав реагентной установки обезвреживания хромосодержащих и нейтрализации кисло-щелочных сточных вод входит оборудование [10]
Таблица 1
№
п/п
|
Наименование оборудования |
Кол-во |
Технические данные |
| 1. |
Приемный резервуар |
1
|
У=190м3
У=70м3
У=300м3
|
| 2. |
Хром-реактор |
3 |
У=60м3 |
| 3. |
Емкость хранения извести |
1 |
У=60м3 |
| 4. |
Расходная емкость восстановителя |
1 |
У=700л |
| 5. |
Емкость приготовления раствора восстановителя |
1 |
У=6м3 |
| 6. |
Емкость приготовления раствора коагулянта |
1 |
У=6м3 |
| 7. |
Расходная емкость коагулянта |
1 |
У=600л |
| 8. |
Мерник раствора коагулянта |
1 |
У=6л |
| 9. |
Ц/Б насос подачи стоков в реакторы |
2 |
АХ 160/29
Q=160м3/час
Н=29м
N=37кВт
|
| 10. |
Ц/Б насос подачи раствора известкового молока в мешалки |
2 |
ГРК-50
Q=50м3/час
Н=16м
N=10 кВт
|
| 11. |
Ц/Б насос перемешивания и подачи раствора восстановителя в емкости |
2 |
АХ 20/31
Q=20м3/час
Н=31м
N=7,5кВт
|
Продолжение таблицы 1
| 12. |
Ц/Б насос для откачки дренажных вод |
2 |
АХ 20/31
Q=20м3/час
Н=31м
N=7,5кВт
|
| 13. |
Ц/Б насос для циркуляции нейтрализующего раствора насадочной ловушки вытяжной системы реакторов |
2 |
К 20/31
Q=20м3/час
Н=31м
N=4кВт
|
| 14. |
Ц/Б насос подачи сточной воды из реакторов на хим. Анализ
|
3 |
ХМ 8/40
Q=8м3/час
Н=40м
N=2,7кВт
|
| 15. |
Ц/Б насос для перемешивания стоков в реакторе и подачи сточной воды на хим. анализ |
3 |
АХ 30/18
Q=20м3/час
Н=18м
N=4кВт
|
| 16. |
Ц/Б насосы подачи полиакриламида в расходную емкость |
1 |
| 17. |
Эл. вентили дозировки в реакторы полиакриламида |
4 |
d 50 |
| 18. |
Эл. задвижка наполнения реакторов |
3 |
d 200 |
| 19. |
Эл. вентили подачи раствора восстановителя в реакторы |
3 |
d 50 |
| 20. |
Эл. вентили подачи раствора известкового молока в реакторы |
3 |
d 50 |
Цианистые соединения.
Обезвреживание синильной кислоты и её солей (цианидов) основано на реакции перевода циан-солей сернокислым железом в ферроцианид (желтая кровяная соль).
6NаСN+FеSО4
→Nа2
SО4
+Nа4
Fе(СN)6
Образовавшиеся ферроцианиды не ядовиты.
Для нейтрализации цианистых растворов необходимо в ванну добавить смесь, состоящую из 6 весовых частей железного купороса и 3-х весовых частей гашеной извести на 1 весовую часть цианистых соединений. Из данной смеси приготовить 10% раствор, тщательно перемешать и добавить его в ванну.
Смесь приготовить непосредственно перед нейтрализацией. Содержимое ванны после добавления смеси тщательно перемешать в течение 30 мин., дать отстояться для полноты обезвреживания 24 часа, после чего раствор сдать в лабораторию промсанитарии для анализа. В случае содержания циана в растворе более 1 г/л вышеуказанную смесь вновь добавить в ванну, перемешать, дать отстояться и сдать раствор на анализ. При содержании в растворе циана не более 1 г/л довести рН до 11 10-20% раствором щелочи, добавить 10% раствор хлорной извести из расчета на 1 литр раствора 1 литр 10% раствора хлорной извести. Во время нейтрализации в течение 3-4-х часов раствор должен тщательно перемешиваться. Затем раствор сдать на анализ. В случае отсутствия циана в растворе или содержания его до 0,1 мг/л довести рН до 6,5-8,5 фосфорной кислотой, после чего жидкую фазу раствора слить в канализацию, а твердую-вывезти.
Температура в помещении при нейтрализации цианистых растворов не должна превышать 20о
С. В случае, если температура выше 20о
С раствор охладить добавлением в ванну льда или холодной воды [11].
В состав установки обезвреживания циансодержащего сточных вод входит оборудование. Таблица 2
№
п/п
|
Наименование оборудования |
Кол-во
шт.
|
Техническая характеристика |
| 1. |
Приемная емкость |
1 |
V=16м3
|
| 2. |
Ц/б насос Х 20/18 |
2 |
Q=20м3
/час Н=18м |
| 3. |
Реактор с механической мешалкой |
2 |
V=4м3
|
| 4. |
Насос 1х2Р дренажный |
1 |
Q=20м3
/час Н=5атм. |
Циансодержащие сточные воды содержат растворимые соли щелочных металлов NаСN, КСN, соли тяжелых металлов СuСN, Zn(CN)2
и комплексные соединения Сu(СN)3
, Сd(СN)4
.Предельно допустимая концентрация цианидов (СN) для водоемов 0,1м2
/л.
Циансодержащие сточные воды должны всегда иметь щелочную среду. С уменьшением значения рН уменьшается устойчивость соединения циана и возрастает ядовитость сточных вод. Изменение рН от 7,8 до 7,5 ядовитость сточных вод увеличивается в 10 раз.
Реагентный хлорный метод обезвреживания сточных вод заключается в окислении токсичных цианидов (СN-
) до (СNО-
) (токсичность при этом уменьшается в несколько тысяч раз) или до азота N2
и углекислого газа СО2
.
В качестве реагентов могут быть применены:
- хлорная известь СаОСL2
ГОСТ 1692-58
- гипохлорит кальция Са(ОСL)2
ГОСТ 13392-73
- гипохлорит натрия NаОСL ГОСТ 11086-64
- железный купорос FеSО2
*
7Н2
О ГОСТ 6981-75
При взаимодействии реагентов с водой (кроме железного купороса) образуется сильный окислитель-гипохлорит-иона (СNL-
)
2CаОСL2
+2Н2
О=СаСL2
+Са(ОН)2
+2НСLО СаОСL2
→Са2+
+ОСL-
+СL-
При взаимодействии гипохлорит-ионов с цианидами в зависимости от рН сточной воды реакции могут идти по двум направлениям:
а) с образованием цианата
СN-
+ОСL-
→СNО-
+СL-
б) с образованием сильно-токсичного газа летучего газа хлорциана
СN-
+ОСL-
+Н2
О→СLСN+2ОН-
Комплексные соединения (кроме комплекса железа) при обработки хлорным методом реагируют согласно уравнению:
[Сu(CN)3
]2-
+7ОСL-
+2ОН-
+Н2
О→6СNО-
+7СL-
+2Сu(ОН)2
При снижении рН до нейтральной происходит гидролиз ционатов [11]
СNО-
+2Н2
О→СО2-
+NН4
При снижении рН и небольшом избытке активного хлора цианаты окисляются до азота и углекислого газа:
2СNО-
+2ОСL-
→2CО2+N2
+2CL-
Хлорциан при рН=10-11 быстро и полностью переходит в цианаты:
2СNСL+2ОН-
→СNО-
+СL-
+Н2
О
Расход активного хлора составляет 3 весовые части на 1 весовую часть СN -
для окисления до цианата и 7-8 вес. Частей до N2
и СО2
При обработке циансодержащих сточных вод железным купоросом токсичные цианиды переводятся в нетоксичные комплексные соединения, такие как
К4
[Fе(СN)6
]-желтая кровяная соль,
Fе4
[Fе(СN6
)]3
-берлинская лазурь
Реакции протекают медленно и не полностью. Остаточные цианиды находятся в пределах 0,2-0,5м2
/л
Обработка железным купоросом применяется для обезвреживания отработанных растворов, когда концентрация цианидов более 1,0г/л, при аварийных выбросах, нейтрализации стоков, попавших на пол [11].
Купорос применять в смеси с известью 2:1 из 10% процентного раствора железного купороса и 10% процентного раствора гашеной извести.
1.2. Токсические свойства хромат - и цианид - ионов
Хром.
Большинство соединений хрома имеет яркую окраску самых разных цветов. Название происходит от греч. хромос-цвет, окраска.
Хром обнаруживается в растительных и животных организмах. В организме взрослого человека содержится примерно 6г Сr (0,1%). В отличие от большинства микроэлементов уровень хрома в тканях с возрастом снижается. Легкие - единственный орган, в котором содержание хрома по мере старения возрастает. В различных географических местностях отмечались существенные колебания, что связано с региональными различиями поступления хрома в организм с пищей. Содержание хрома в пищевых продуктах существенно колеблется от 0,57 мг/кг в щавеле до 0,01 мг/кг в рисе [3].
Металлический хром нетоксичен, а соединения Сr (III) и Сr (VI) опасны для здоровья. Они вызывают раздражение кожи, что приводит к дерматитам.
Соединения хрома широко используются в различных отраслях народного хозяйства. Они применяются в кожевенной и текстильной промышленностях, используются для хромирования металлических изделий, для производства спичек, красок, кино и фотопленок. В химической промышленности соединения хрома применяются как окислители. Ряд соединений хрома применяется в химических лабораториях в качестве реактивов. Ввиду токсичности соединений хрома они не применяются в медицине [4].
Из соединений хрома, применяемых в различных отраслях народного хозяйства, наиболее ядовитыми являются хроматы и дихроматы. Причем дихроматы более ядовиты, чем хроматы. Хроматы и дихроматы оказывают раздражающее и прожигающее действие на кожу и слизистые оболочки, вызывая изъявления. При отравлении соединениями хрома могут наступить понос и кровавая рвота. Иногда рвотные массы имеют желтую или зеленую окраску. При поступлении в организм больших количеств пыли, содержащей соединения хрома, развивается пневмония.
При острых отравлениях соединениями хрома они накапливаются в печени, почках и эндокринных железах. Соединения хрома выводятся из организма в основном через почки. В связи с этим при отравлении указанными соединениями поражаются почки и слизистые оболочки мочевыводящих путей.
При поражении слизистой носа - промывание водой с мылом и смазывание носовых ходов вазелиновой мазью. При упорном кашле - кодеин с содой, дионин. Для купирования приступов астмы - атропин, платифиллин, адреналин, эфедрин подкожно, эуфиллин в/венно (0,24-0,48г в 20мл 10-20% раствора глюкозы) или внутрь (0,1-0,15г).
При попадании хрома на поврежденную кожу - немедленное промывание водой (15мин) и наложение повязки с нейтральной мазью; в глаза - промыть водой не менее 15 минут, закапать 30% раствор альбуцида, при резких болях - 0,5% раствор дикаина [5].
Цианиды
Циан и его влияние на здоровье
Циановодород вызывает быстрое удушение из-за блокирования дыхательных ферментов и расстройства тканевого дыхания. Так же действу-ют все цианистые соединения, способные отщеплять НСN и образовывать нон СN-. При остром отравлении НСN в первую очередь страдают дыхательный и сосудодвигательный центры (сначала углубление дыхания и повышение кровяного давления, затем паралич дыхания и резкое падение кровяного дав-ления). Цианиды ингибируют окислительное фосфорилирование и энергетические процессы в нервных клетках, а также угнетают ферменты, катализирующие биотрансформацию ряда аминокислот— гистидина, триптофана, тирозина. О резком понижении способности тканей потреблять кислород свидетельствует алая окраска крови в венах. В первый момент отравления решающим является кислородное голодание тканей, в дальней-шем же могут происходить дегенеративные изменения, развивающиеся в ЦНС. При хроническом воздействии НСN в картине отравления важную роль играет угнетение продукции гормона щитовидной железы, вызываемое не НСN, а образующимися из него тиоцианатами. Чувствительность организма к острому действию цианидов связана с уровнем потребления кис-лорода: при низком его уровне (например, при зимней спячке) резко повышается устойчивость к интоксикации, что связано с понижением температуры тела и повышением резистентности к гипоксии вообще.
При высоких концентрациях почти мгновенная потеря сознания; наступает паралич дыхания, а вскоре и паралич сердца. При меньших концентрациях можно различить несколько стадий [4].
Начальная стадия: ощущение царапанья в горле, жгуче-горький вкус во рту, слюнотечение, онемение рта и зева, покраснение конъюнктивы, мышечная слабость, пошатывание, затруднение речи, головокружение, острая головная боль, тошнота, рвота, позывы к дефекации; дыхание несколько учащено, затем делается более глубоким. Прилив крови к голове, сердцебиение. При выходе на свежий воздух в этой стадии все симптомы быстро исчезают. Стадия одышки: постепенно усиливающаяся общая слабость, боли и чувство стеснения в области сердца, редкое и глубокое дыхание, замедление пульса; сильная отдышка, иногда отдельные короткие вдохи, сопровождающиеся длительными выдохами, тошнота, рвота, расширение зрачков, экзофтальм. Стадия судорог: чувство тоски, усиливающаяся одышка, потеря сознания, сильные судороги (чаще титанические). Судорожное сведение жевательной мускулатуры с прикусом языка. Стадия паралича или асфиксии: полная потеря чувствительности и рефлексов, непроизвольные мочеиспускание и дефекация, дыхание уряжается, делается поверхностным, наступает смерть Гигиенические требования:
В воздухе рабочей зоны ПДКр.з. =0,3 мг/м3
В атмосферном воздухе ПДКс.с =0,01 мг/м3
В воде водоисточников ПДКв =0,1 мг/м3
Содержание свободных цианидов в сточных водах не более 0,1 мг/м3; содержание общих цианидов при поступлении на полную биологическую очистку - не более 1,0 мг/м3; при сбросе в водоемы - 0,5 мг/л. Допустимое содержание в сточных водах, используемых для орошения сельскохозяйственных земель, не нарушающее почвенных процессов и не оказывающее токсического действия на растения, выросшие на орошаемых землях, при потреблении этих растений - на животных и человека, рекомендуется на уровне 10 мг/л.
Способы обезвреживания
Обезвреживание тары
Тара, отходы или предметы, загрязненные цианистыми солями погружают с обезвреживающим составом (смесь из 100 % - ных растворов железного купороса и гашенной извести, раствор железного купороса берется в двойном количестве сравнительно с раствором извести ) и тщательно перемешивают в течении 30 минут, затем оставляют стоять еще 3 - 4 часа для полного обезвреживания тары. Обезвреживающий раствор, после получения анализа на отсутствие циана, влить в циановые стоки.
Обезвреживание одежды
Спецодежду необходимо стирать в механической прачечной с хлорной известью или хлорамином, или в малом растворе с марганцовкой. При этом обезвреживается циан. Воду вылить в хозяйственно - бытовую канализацию.
Цианиды (калия, меди, натрия).
Основные симптомы отравления. Раздражение в носу, горле и трахее. Затрудненное дыхание, стеснения в груди. Общая слабость. Сладкий вкус во рту, особенно замечаемый при курении.
Первая помощь при отравлениях. В случае отравления пострадавшему в первой же минуте дать вдыхать 8 капель анилнитрита на ватке, вдыхание повторить через каждые 2 - 3 минуты в течение 15 - 30 секунд. Срочно вынести на свежий воздух. При ослабленном дыхании необходимо сделать искусственное дыхание с одновременным вдыханием кислорода [4].
Ионообменная очистка.
При ионообменной обработке сточных вод, содержащих органические примеси, наряду с ионным обменом протекают процессы хемосорбции и физической адсорбции органических веществ ионитами. Диффузионные затруднения при обмене крупных органических ионов обусловливают целесообразность применения "малосшитых" ионообменных смол. Значительное увеличение в объеме при набухании "малосшитых" смол дает возможность диффундировать в них крупным органическим ионам.
При ионообменном поглощении органических ионов скорость достижения равновесия обычно значительно меньше, чем при обмене неорганических ионов.
Присутствие многовалентных катионов при поглощении органических оснований или многовалентных анионов при поглощении органических кислот приводит к вытеснению органических веществ в раствор и резкому снижению емкости ионитов.[6]
На сорбционную емкость ионитов по органическим соединениям отрицательное влияние могут оказывать другие примеси, растворенные в сточной воде и способные блокировать ионогенные группы смол.
Регенерация ионитов от органических соединений более затруднительна, чем от минеральных солей. Регенерирующий агент выбирается с учетом свойств выделяемого органического вещества и возможности дальнейшего использования регенерационных растворов. Например, для извлечения фенолов и анилина из ионитов используют водные растворы щелочей и кислот, в то время как ПАВ не вытесняются из смол даже концентрированными растворами неорганических щелочей, кислот или солей. Для удаления ПАВ предложено использовать органические растворители или их смеси с небольшими количествами водных растворов электролитов.[6]
Примеры применения метода ионного обмена
.
Метод ионного обмена может использоваться для очистки сточных вод многих химических производств: электрохимических (от ионов тяжелых металлов, цианидов и др.), синтетических волокон (от ионов цинка и др.), азотных удобрений (от аммиака, меди и др.), коксохимических (от тиосульфатов, роданидов и др.), искусственных и естественных изотопов (от радиоактивных веществ) и т.д.
Очистка сточных вод, содержащих соли хромовой кислоты, возможна на сильноосновном анионите. Анионит не изменяет своих свойств (не окисляется) в течение длительного времени при концентрации СrО3
до 1200мг/л. Для анионита, содержащего 6% дивинилбензола, при рН=1,8-6 динамическая обменная емкость составляет 11,5-12% от массы сухой смолы.
Регенерируют анионит 10-15% растворами NаОН. Однако десорбция хроматов протекает эффективнее, если анионит предварительно переводится в хлоридную форму. При регенерации анионита раствором, содержащим 2% NаОН и 6% NаСI, десорбируется 89-99% хроматов (от количества сорбированных). При двухкратном использовании регенерирующих растворов концентрация Сr6+
в элюате составляет 48-54г/л, при трехкратном использовании - 73-79г/л [8].
Полученный при регенерации раствор, содержащий Nа2
СrО4
, NаОН и NaCI, пригоден для получения пассивирующих растворов. Методом Н - катионирования хромат натрия может быть переведен в хромовую кислоту.
Ионообменное извлечение металлов из сточных вод позволяет рекуперировать ценные вещества с высокой степенью извлечения. Ионный обмен - это процесс взаимодействия раствора с твердой фазой, обладающей свойствами обменивать ионы, содержащиеся в ней, на ионы, присутствующие в растворе. Вещества, составляющие эту твердую фазу, называются ионитами. Метод ионного обмена основан на применении катионитов и анионитов, сорбирующих из обрабатываемых сточных вод катионы и анионы растворенных солей. В процессе фильтрования обменные катионы и анионы заменяются катионами и анионами, извлекаемыми из сточных вод. Это приводит к истощению обменной способности материалов и необходимости их регенерации [8].
Наибольшее практическое значение для очистки сточных вод приобрели синтетические ионообменные смолы - высокомолекулярные соединения, углеводородные радикалы которых образуют пространственную сетку с фиксированными на ней ионообменными функциональными группами. Пространственная углеводородная сетка называется матрицей, а обменивающиеся ионы - противоионами. Каждый противоион соединен с противоположно заряженными ионами, называемыми анкерными. Реакция ионного обмена протекает следующим образом:
RSO3
H + NaCL = RSO3
Na + HCL,
при контакте с катионитом, где R - матрица, Н - противоион, SO3
- анкерный ион;
ROH + NaCL = RCL + NaOH,
при контакте с анионитом.
Для извлечения из сточных вод гальванопроизводства катионов трехвалентного хрома применяют Н-катиониты, хромат-ионы CrO3
2 -
и бихромат-ионы Cr2
O7
2 -
извлекают на анионитах АВ-17, АН-18П, АН-25, АМ-п. Емкость анионитов по хрому не зависит от величины рН в пределах от 1 до 6 и значительно снижается с увеличением рН больше 6. При концентрации шестивалентного хрома в растворе от 800 до 1400 экв/л обменная емкость анионита АВ-17 составляет 270 - 376 моль*экв/м3
.
Регенерацию сильноосновных анионитов проводят 8 - 10 %-ным раствором едкого натра. Элюаты, содержащие 40 - 50 г/л шестивалентного хрома, могут быть направлены на производство монохромата натрия, а очищенная вода - использоваться повторно.
Фирмой InovanUmwelttechnikGmbH & CoKG разработана блочно-модульная установка системы REMA, предназначенная для очистки производственных сточных вод от тяжелых металлов. Одинарный блок представляет собой ионообменную колонку, в которой вертикально друг под другом установлены 4 сменные кассеты. В процессе очистки сточные воды последовательно пропускают через эти кассеты снизу вверх. Степень загрязненности ионообменной смолы определяют с помощью индикаторов .
На заводе "Почвомаш" (Киров) внедрен процесс очистки промстоков гальванических производств от ионов хрома волокнистыми материалами. Для сорбции анионов хрома используют материал ВИОН АС-1, имеющий в своем составе сильноосновные винилпиридиниевые группы с СОЕ 1.1 - 1.2 мг*экв/г. Изготовлены две сорбционных колонны из коррозионно-стойкой стали объемом 50 л каждая. Сорбция хрома зависит от его концентрации в исходном растворе. Так, если концентрация составляет до 10 мг/л, то в фильтрате его не обнаруживают. Однако при концентрации аниона хрома 75 мг/л и выше содержание его в фильтрате 0.04 - 0.01 мг/л, что вполне допустимо при замкнутом цикле. Влияние исходной концентрации раствора хрома на его содержание в фильтрате обусловлено высоким ионным радиусом Cr2
O7
2-
,вызывающим стерические затруднения при сорбции на волокнистом хемосорбенте. При высоком содержании хрома следует уменьшить скорость подачи раствора на сорбционную колонну. В этом случае возрастает степень очистки. При достижении насыщения сорбционных колонн их снимают со стенда и транспортируют в отделение гальванохимической переработки для регенерации хемосорбционного материала и утилизации элюата. Регенерацию ВИОН АС-1 проводят раствором Na2
CO3
. При этом в каждую колонну заливают по 50 л раствора и оставляют его на 3 часа. Последующая операция заключается в промывке фильтра водой [20].
Было проведено исследование 8 волокнистых сорбентов, применяемых для очистки сточных вод от ионов тяжелых металлов (Ag, Hg, Cr, Cd, Fe).Установлено, что волокнистые сорбенты ПАН-ПЭА, ПАН-ТТО-МКХК и угольное волокно эффективно очищают сточную воду от ионов тяжелых металлов. Они легко регенерируются путем обработки кислотами и могут многократно использоваться для очистки. Из раствора, полученного после регенерации волокон, можно выделять металлы и использовать их повторно .
Синтезированы ионообменные материалы на основе отходов швейного и трикотажного производства, содержащие полиэфирное, полиакрилонитрильное волокно. Установлено, что синтезированные ионообменные волокна проявляют селективные ионообменные свойства .
В лабораторных условиях исследовано выделение хрома из промывных сточных вод гальванических цехов с помощью ионообменных смол (ионообменные смолы в ОН-форме типа "Wolfatit" (ГДР) марок SWB, SZ, SL, SBK, АД-41 и активированного угля марки AS)и углеродистых сорбентов. Показано, что ионообменные смолы можно использовать для очистки сточных вод в промышленном масштабе [20]
Достоинства метода
1) Возможность очистки до требований ПДК.
2) Возврат очищенной воды до 95% в оборот.
3) Возможность утилизации тяжелых металлов.
4) Возможность очистки в присутствии эффективных лигандов.
Недостатки метода
1) Необходимость предварительной очистки сточных вод от масел, ПАВ, растворителей, органики, взвешенных веществ.
2) Большой расход реагентов для регенерации ионитов и обработки смол.
3) Необходимость предварительного разделения промывных вод от концентратов.
4) Громоздкость оборудования, высокая стоимость смол
5) Образование вторичных отходов-элюатов, требующих дополнительной переработки
Ионный обмен - физико-химический процесс распределения ионогенного вещества между жидкой фазой (раствором электролита) и твердой фазой (ионитом). Этот процесс подобен адсорбции, при которой распределение вещества происходит под действием поверхностных сил на границе раздела фаз, только в случае ионного обмена такими силами являются силы кулоновского взаимодействия. Не случайно твердые фазы обоих процессов имеют общее название - сорбенты. С появлением полимерных ионитов (они также называются ионообменными смолами), зерна которых представляют собой поперечно сшитые клубки полимерных нитей с нанизанными на них ионогенными функциональными группами, "макро - граница" ионитов перестала быть единственным носителем сорбционных центров, и процесс перешел в глубь полимера, стал объемным. В связи с этим важнейшая характеристика ионита - обменная емкость - выражается количеством функциональных групп в единице объема смолы.
Согласно закону Кулона, вблизи функциональных групп в ионите концентрируются ионы противоположного заряда, т.е. функциональными группами анионообменника (или анионита) служат положительно заряженные ионы (катионы), ковалентно связанные с полимером (обычно аммониевые основания); и наоборот, в катионите функциональными группами являются ковалентно связанные с полимером анионы (карбоксильные, фосфорнокислые, сульфогруппы и др.). В зависимости от заряда, размеров, конфигурации ионы с разной силой притягиваются к соответствующим функциональным группам. На количество занятых ионами функциональных групп прямо влияет также их концентрация в растворе [20].
Под сорбентами понимают твердые зернистые или волокнистые механически прочные, нерастворимые и химически устойчивые вещества, используемые для разделения или накопления входящих в систему компонентов. Ионообменные сорбенты (иониты) должны обладать способностью к гетерогенным ионообменным реакциям, т.е. во - первых, иметь ионообменную емкость, во - вторых, их кинетические свойства должны обеспечивать сравнительно полное использование их обменной емкости. Важным свойством ионитов является селективность, зависящая от природы обмениваемых ионов [20].
Обменная емкость.
Способность к ионному обмену обеспечивается наличием в сорбентах химически активных групп с подвижными обмениваемыми ионами. Их концентрацию в мэкв/г (или мэкв/мл) сорбента называют полной обменной емкостью (ПОЕ) ионита. В соответствии со знаками зарядов матрицы различают сорбенты, способные к обмену катионов (катиониты) , и сорбенты, способные к обмену анионов (аниониты). В химическом аспекте по природе функциональных ионогенных групп катиониты соответствуют кислотам (подвижный ион водорода) или их производным (солям); аниониты соответствуют основаниям (подвижный ион гидроксили) или их производным (солевые формы анионитов).
Катиониты и аниониты подразделяют на две группы по степени ионизации функциональных групп, обусловленной их химической природой, что аналогично обычным понятиям сильные и слабые электролиты. Высокоионизованные сильнокислотные катиониты, так называемые универсальные (КУ), например сульфокатиониты, обладают способностью к обмену ионов водорода в растворах с широким интервалом изменения рН; слабоионизованные катиониты КБ (буферные), например карбоксильные, фосфорнокислые, способны к обмену ионов водорода на металл только в щелочных и лишь отчасти в нейтральных растворах.
Аналогично различают высокоионизованные, высокоосновные (например, с четвертичными аммониевыми основаниями) аниониты АВ универсального действия и аниониты низкоосновные АН, способные к обмену ионов гидроксила лишь в кислых и отчасти в нейтральных растворах.
В условиях эксперимента иониты легко различить по основности, проводя определение обменной емкости в растворах различного рН: для катионитов - в щелочных и нейтральных солевых растворах, для анионитов - в кислых и нейтральных солевых растворах.
Эксперименты проводят в стеклянных колонках строго заданных размеров: 25х600 и 16х850мм при полной или частичной регенерации соответственно. В случае полной регенерации используют 0,1М растворы кислоты (щелочи), а для сильноионизованных ионитов - дополнительно 0,01М растворы хлоридов кальция (натрия). В опытах с заданным расходом регенерирующего вещества через колонки катионита в Н+
и Nа+
- формах пропускают 1,75мМ раствор СаCI2
, для Н+
- формы определяют дополнительно ДОЕ по 3,5мМ раствору NаНСО3
. Через низкоосновный анионит в ОН—
форме пропускает 3,5мМ раствор НCI (Н2
SО4
), через высокоосновный анионит - 0,01М раствор NaCI. Во всех случаях строго выдерживают удельные нагрузки (объемные скорости потока). В случае слобоионизованных ионитов растворы в колонку подают снизу вверх. Динамическую обменную емкость выражают в мэкв/л ионита.
Пористость.
Обменная емкость ионитов любой структуры не зависит от размера их зерен, так как весь объем зерна более или менее доступен для ионообменной реакции. Однако во многих случаях пористые иониты имеют существенные преимущества перед массивными, гелевыми. Пористость ионитов является важным фактором, который способствует ускорению процесса ионного обмена во внутридиффузионной области и снижает отравление анионитов органическими примесями [7].
Структура пористых сополимеров обусловлена природой порообразователя и в случае применения спиртов имеет глобулярный характер, что приводит к образованию межглобулярных пор большого размера. Так, при использовании в качестве порообразователя изооктилового спирта средний радиус глобул равен 30-60нм, однако присутствуют поры и существенно меньших размеров. При увеличении числа атомов в изомерном спирте сополимеры получаются с более однородными по размерам порами, а суммарный объем пор уменьшается. Наилучшими порообразователями считаются первичные одноатомные алифатические спирты.
Селективность
. В связи с проблемами прямого избирательного определения элементов в сложной смеси и извлечения металлов при комплексной переработке руд и из технологических растворов в гидрометаллургии возник интерес к селективным сорбентам.
Селективность ионообменных сорбентов определяется двумя факторами. С одной стороны, при обычном типе обмена (например, катионы на катионите) селективность может быть обусловлена точным соответствием размеров пор сорбента размеру гидратированного радиуса иона элемента: ионы с большими радиусами не входят в объем зерна ионита (ситовой эффект), а ионы слишком малых размеров характеризуются меньшей энергией сорбции. Такой эффект проявляется тем более четко, чем меньше набухаемость сорбента [7].
С другой стороны, селективность ионообменных сорбентов может быть обусловлена и химическим взаимодействием компонентов с функциональными группами ионита, например комплексообразованием металлов, появлением помимо ионной дополнительной координационной связи с атомами функциональных групп. Для металлов типа железа, урана, редкоземельных элементов характерно образование комплексных соединений с кислородом в качестве адденда; неслучайно селективными по железу являются иониты с большим числом фенольных групп, а по урану и редкоземельным металлам - карбоксильные и фосфорнокислые катиониты. Кобальт, никель, медь, цинк, образующие в растворах устойчивые аммиакаты, селективно сорбируются анионитами, особенно содержащими первичные аминогруппы.
При синтезе катионитов в качестве кислотных функциональных групп, определяющих катионообменные свойства, в матрицы ионитов обычно вводят сульфогруппы, карбоксильные, фосфорнокислые, мышьяковокислые, сульфогидрильные и другие группы. В качестве сульфирующих агентов для сополимера стирола и ДВБ обычно используют серную кислоту, олеум, хлорсульфоновую кислоту, в последнем случае ионит омыляют горячей (500
С) водой. Во избежание растрескивания зерна сополимера в процессе сульфирования оставляют набухать в растворителях (толуол, тетрахлорэтилен, трихлорэтилен, дихлорэтан).
При синтезе анионитов в качестве основных групп, определяющих анионообменные свойства, в матрицы ионитов обычно вводят первичные, вторичные, третичные аминогруппы, четвертичные аммониевые основания, гетероциклические азотсодержащие соединения. Это во многом определяет силу анионитов как оснований и их селективность. Многообразие конденсационных анионитов, в том числе и по их основности, определяется составом исходных мономеров и конденсирующих агентов [7].
1.4. Характеристики ионитов, требования к ним
Практическое применение для очистки сточных вод получили синтетические ионообменные смолы. Соединения эти состоят из пространственно сшитых нерастворимых в воде углеводородных цепей (матрицы) с фиксированными на них активными ионогенными группами, имеющими заряд, который нейтрализуется расположенными внутри полимера ионами противоположного знака - противоионами, способными вступать в реакции обмена с ионами того же знака, находящимися в растворе. При отрицательном заряде фиксированных групп ионит обменивает катионы (катионит), при положительном - анионы (анионит).
Различают следующие виды ионитов:
1. Сильнокислотные катиониты, содержащие сульфогруппы - SО3
Н или фосфорнокислые группы - РО(ОН)2
, и сильноосновные аниониты, содержащие четвертичные аммониевые основания - N+
(R)3
. К данному виду ионитов относятся, например, катионит и анионит.
Равновесная (статическая) обменная емкость этих ионитов по отношению к различным ионам остается постоянной (максимальной) в широком интервале рН.
2. Слабокислотные катиониты, содержащие карбоксильные - СООН и фенольные ОН группы, диссоциирующие при рН>7, а также слабоосновные аниониты, содержащие первичные - NН2
и вторичные - NН - аминогруппы (например аниониты), диссоциирующие при рН<7.
3. Иониты смешанного типа, проявляющие свойства смеси сильной и слабой кислот или оснований. Так, катионит содержит сульфогруппу и фенольную группу.
4. Иониты, обменная емкость которых постепенно изменяется в широком интервале рН. Они ведут себя подобно смеси кислот и оснований различной силы [6].
Особую группу представляют окислительно-восстановительные полимеры или редокситы, обладающие способностью к окислительно-восстановительным реакциям.
При соприкосновении ионитов с водой происходит их набухание. Обычно применяемые промышленные образцы ионитов увеличивают свой объем при набухании в 1,5-2 раза.
Одной из основных характеристик ионитов является обменная емкость, предельная величина которой определяется числом ионогенных групп. Полная емкость ионита - количество грамм - эквивалентов ионов, находящихся в воде, которое может поглотить 1м3
ионита до полного насыщения. Рабочая емкость ионита - количество грамм - эквивалентов ионов, которое может поглотить 1м3
ионита в фильтре при обработке воды до начала проскока в фильтрат поглощаемых ионов.
Характерной особенностью ионитов, важной для практического использования, является их обратимость, т.е. возможность проведения реакций в обратном направлении. Это дает возможность производить регенерацию ионитов [6].
Катиониты" включает сильнокислотные катиониты КУ-2-8, КУ-2-8чС, КУ-2-20, КУ-1, КУ-23 (в модификациях 10/60, 12/18, 15/100, 30/100) и слабокислотные катиониты КБ-2, КБ-2-4, КБ-4, КБ-4П-2, КБ-4-10П, КБ-2-7П, КБ-2-10П. ГОСТ 20301-74 "Смолы ионообменные. Аниониты" включает высокоосновные аниониты АВ-17-8, АВ-17-8чС, АВ-17П (в модификациях 10П/0,6; 10П/0,8; 12П/1,0), АВ-29-12П, АВ-16ГС и низкоосновные АН-21 (в модификациях 6 и 14), АН-18-8, АН-22-8, АН-221, АН-18П (в модификациях 10П и 12П), АН-31,АН-1, АН-2ФН, ЭДЭ-10П. В обоих ГОСТах содержатся требования и нормы по гранулометрическому составу ионитов (размер зерен, содержание рабочей фракции, эффективный размер зерен, коэффициент однородности), содержанию влаги, удельному объему катионитов в Н+
и Nа+
- формах и анионитов в ОН—
форме, удельной поверхности, полной и равновесной статической обменной емкости (для низкоосновных анионитов только ПСОЕ), динамической обменной емкости (для катионитов - при полной и частичной регенерации), перманганатной окисляемости и рН фильтрата, осмотической стабильности, содержанию железа и хлора; для анионитов дополнительно нормируются содержанию щелочи, карбонатов и обесцвечивающая их способность.
Сильнокислотный катионит КУ-2-8 (ГОСТ 20298-74) имеет структуру геля, содержит только один вид ионообменных групп - сульфогруппу. Катионит получают сульфированием гранульного сополимера стирола с 8% дивинилбензола. Насыпная плотность товарного катионита 0,8т/м3
. Обменная емкость в динамических условиях при полной регенерации 1360 экв/м3
. В Н+
- форме катионит может работать в водных растворах при 110-1200
С. При температуре до 1700
С относительные потери обменной емкости вследствие десульфирования заметно возрастают и через 24ч достигают 19,5%. Катионит отличается высокой химической стойкостью в разбавленных растворах щелочей и кислот, органических растворителях и некоторых окислителях. Кипячение катионита в 5М растворе Н2
SO4
или NаОН, в 1М НNO3
и 10% - ном растворе Н2
О2
не снижает полную обменную емкость в статических условиях [6].
Сильнокислотный катионит КУ-2-8чС (ГОСТ 20298-74) представляет собой модификацию катионита КУ-2-8 и отличается от него особой чистотой. Применяется для глубокого обессоливания воды и разделения смесей различных элементов.
Сильнокислотный катионит КУ-2-20 (ГОСТ 20298-74) имеет гелевую структуру и отличается от КУ-2-8 высоким (20%) содержанием дивинилбензола. Выпускается в Н+
- форме, применяется для очистки растворов гальванических производств.
Сильнокислотный катионит КУ-23 (ГОСТ 20298-74) (химический аналог катионита КУ-2-8) имеет макропористую структуру, содержит только сульфогруппу. Его получают сульфированием гранульного макропористого сополимера стирола с дивинилбензолом. Отличается от катионита КУ-2-8 несколько меньшей обменной емкостью. Макропористая структура катионита обеспечивает его улучшенные кинетические свойства и повышенную осмотическую стабильность.
Высокоосновный анионит АВ-17-8 (ГОСТ 20301-74) имеет гелевую структуру, содержит только один вид ионогенных групп четвертичные аммониевые основания. Получают хлорметилированием сополимера стирола с 8% дивинилбензола с последующим взаимодействием с триметиламином. При комнатной температуре анионит сравнительно устойчив к действию разбавленных кислот, щелочей и окислителей. При кипячении в течение 30мин. в 5М растворах щелочей и серной кислоты обменная емкость в статических условиях снижается соответственно на 14 и 7%, при взаимодействии с 10% - ным раствором Н2
О2
при комнатной температуре в течение 48ч - на 16,4%. Температурные пределы его использования зависят от требований, предъявляемых к обессоленной воде, и составляют 40-450
С при обескремнивании воды (содержание кремниевой кислоты в фильтрате 10-15мкг/кг) и 85-900
С при сорбции анионов минеральных кислот.
Анионит АВ-17-8чС (ГОСТ 20301-74) является модификацией анионита АВ-17-8 и отличается особой чистотой.
Высокоосновный анионит АВ-29-12П (ГОСТ 20301-74) имеет макропористую структуру. Получают суспензионной сополимеризацией стирола и ДВБ в присутствии порообразователя с последующим хлорметилированием, а затем аминированием сополимера диметилэтаноламином. По химической и термической стабильности несколько уступает аниониту АВ-17-8, но обладает более легкой регенерируемостью. Предназначается для процессов водоподготовки при невысоких требованиях к остаточному содержанию анионов кремниевой и угольной кислот и для очистки сточных вод [7].
В 1978г. компания Degremont запантентовала и предложила потребителям противоточную технологию регенерации ионитов под названием UFD. По этой технологии рабочий цикл осуществляется сверху вниз, а регенерация - снизу вверх. Весь внутренний объем фильтра заполняется активной смолой. Наличие инертного материала не является обязательным, и если он применяется, то исключительно для защиты верхнего распределительного устройства от ионитной мелочи (аналогично технологии SCHWEBEBETT). Благодаря такой загрузке фильтра слой ионита всегда находится в зажатом состоянии (как при проведении рабочего цикла, так и при регенерации); обеспечиваются варьирование рабочих скоростей потоков в очень широком диапазоне и возможность чередования технологических остановов с возобновлением рабочего цикла. Конструкция фильтра отличается простотой. Имеются верхнее и нижнее распределительные устройства, а в верхней части фильтра установлен штуцер для гидроперегрузки ионита, который обеспечивает возможность удаления 30…50% ионита во внешнюю емкость для промывки взрыхлением. Оставшийся в фильтре ионит также подтвергается взрыхлению.
Технология UFD позволяет эффективно удалять накопившиеся за время проведения рабочего цикла взвешенные вещества и ионитную мелочь и предотвращать тем самым появление одной из проблем, свойственных противоточным технологиям. Однако возникает другой, более существенный, недостаток (необходимость проведения двойной регенерации после каждого взрыхления), который сводит к нулю преимущества противотока, основанные на экономии реагентов.
Технология UPCOREявляется зарегистрированной торговой маркой компании DowChemical [13].
На первый взгляд, UPCORE идентична SCHWEBEBETT: также практически весь объем фильтра заполнен активной смолой, над которой находится слой плавающего инертного материала. Но за кажущимся внешним сходством скрываются принципиальные отличия. Во - первых, рабочий цикл проводится сверху вниз, а регенерация - снизу вверх. Во - вторых, применяемый для UPCORE инертный материал коренным образом отличается по своим характеристикам от используемого для SCHWEBEBETT. В UPCORE он должен задерживать в фильтре только целые, неразрушенные зерна смолы, обеспечивая возможность свободного перемещения высокодисперсных взвесей и фрагментов зерен, а в SCHWEBEBETT - воспрепятствовать попаданию в технологический тракт любых дисперсий. Простота и удобство эксплуатации, свойственные прямоточной технологии (относительно невысокая стоимость конструкции фильтра, возможность изменения рабочей нагрузки в широком диапазоне, неограниченная степень свободы в чередовании технологических остановов с возобновлением рабочего цикла), также являются неоспоримыми преимуществами и для UPCORE, благодаря абсолютной идентичности рабочего цикла в обеих технологиях.
Взвешенные вещества, поступающие в фильтр с обрабатываемой водой, аккумулируются главным образом на поверхности слоя загрузки (и частично в верхних слоях), откуда они эффективно удаляются при проведении операции "зажатия" слоя на стадии регенерации. Важным достоинством рассматриваемой технологии является возможность удаления из слоя смолы накопленных взвесей непосредственно в рабочем фильтре (т.е. без гидроперегрузки ионита).
Эффективность очистки слоя ионита от взвесей может быть существенно повышена барботажем воздуха [13].
Необходимо отметить, что концентрационная характеристика, используемая в России для оценки количества взвешенных веществ, не является объективной, если требуется определить степень применимости той или иной технологии противоточного ионирования в конкретных условиях эксплуатации. В самом деле, при длительном фильтроцикле количество взвесей, поступающих в ионитный фильтр с обрабатываемой водой (даже если их концентрация и незначительна), может оказаться существенно большим в абсолютном выражении, чем в условиях короткого фильтроцикла (пусть даже и при более высокой исходной концентрации дисперсий).
По UPCORE в настоящее время в мире работает около 700 установок деминерализации и умягчения. При этом исходная вода, поступающая на ионирование имеет рабочие параметры чрезвычайно широкого диапазона:
Солесодержание, мг-экв/л 1..15
Содержание, мг/л:
Органических примесей
(по перманганатной окисляемости) до 120
кремниевые кислоты
(по диоксиду кремния) до 130
взвесей 0,1…15
Эксплуатируемые противоточные фильтры, оснащенные распределительными устройствами в виде как лучевых систем, так и ложных днищ (диаметры 0,5..4м, высота слоя загрузки 1…4м) обеспечивают производительность единичного фильтра в рабочем режиме 5…600м3
/ч. Для регенерации ионитов по UPCORE в зависимости от конкретной области применения с успехом используются растворы соли, щелочи, серной, соляной и азотной кислот.
Данная технология свободна от недостатков, присущих большинству других противоточных технологий, исключительно проста и надежна в эксплуатации. Ее применение позволяет минимизировать объем капитальных затрат при создании (а особенно при реконструкции действующих) ВПУ и эксплуатационные расходы. Технология UPCORE в последнюю четверть прошлого века стала наиболее широко применяемой противоточной регенерацией в мире [13].
Методы противоточного ионирования обычно применяются на ВПУ для умягчения и деминерализации. Выбор технологии SCHWEBEBETT для умягчения воды может оказаться предпочтительным по сравнению с UPCORE в тех случаях, когда:
· вода, подаваемая на умягчение, практически свободна от взвешенных веществ;
· производительность установки постоянна;
· отсутствует необходимость в технологических остановах.
Благодаря тому что регенерация по SCHWEBEBETT проводится сверху вниз и нет необходимости в зажатии слоя, уплотненного под собственным весом, можно снизить линейную скорость подачи концентрированного (8-12%) солевого раствора (например, до 5 м/ч). Это, в свою очередь, позволяет минимизировать потребление соли (доводя его до уровня 120% от стехиометрического соотношения), обеспечивая при этом необходимую длительность контакта реагента с катионитом, одновременно сокращая потребление воды на отмывку и уменьшая объем образующихся солевых стоков. При проведении регенерации по UPCORE (снизу вверх) возможность для подобного снижения расхода потока реагента отсутствует, так как при низкой линейной скорости несущего потока слой ионита разуплотнится и будет перемешиваться. Поэтому, если требуется минимизировать удельный расход соли на регенерацию при реконструкции существующей прямоточной схемы используя UPCORE для умягчения, часто приходится наращивать цилиндрическую часть обечайки фильтра и увеличивать высоту слоя загрузки катионита (а это приводит к дополнительным затратам и возрастанию потребления воды на отмывку).
Необходимо также отметить случаи, когда применять SCHWEBEBETT оказывается целесообразно и для деминерализации воды. Прежде всего это установки малой производительности (до 10…15 м3
/ч) с постоянной рабочей нагрузкой по обессоленной воде [13].
В современных комплексных технологиях водоподготовки сочетают мембранные методы очистки с ионным обменом и (или) электродеионизацией. Использование мембранных технологий (ультра-, нанофильтрации и обратного осмоса) перед ионным обменом гарантирует практически полное отсутствие взвесей в воде, поступающей на ионитные фильтры. Поэтому когда не требуется получать обессоленную воду с остаточной электропроводностью менее 0,1 мкСм/см, применение раздельного Н - ОН - ионирования по SCHWEBEBETT (если производительность установки постоянна и отсутствует необходимость в технологических остановах) является технологически и экономически оправданным даже по сравнению с фильтрами смешанного действия.
Рассматривая проблемы применения противотока, нелязя не обсуждать вопросы выбора используемых технологических схем, оборудования и ионитов, так как именно это определяет возможность достижения максимального положительного эффекта от внедрения противотока. Конструкции фильтров должны быть оптимизированы или, по крайней мере, адаптированы к особенностям конкретной противоточной технологии. Если работоспособность противоточной технологии напрямую не зависит от выбора ионита, то показатели ее эффективности (качество достигаемых результатов, капитальные затраты и издержки при эксплуатации) - зависят непосредственно.
В заключение необходимо отметить, что добиться максимальной эффективности при использовании любой противоточной технологии можно только путем комплексного подхода, в котором оптимальность выбора технологии должна обязательно сочетаться с оптимальными режимными параметрами работы установки, с конструктивными характеристиками основного и вспомогательного оборудования, с грамотным выбором типа и качественных показателей применяемых ионитов и, наконец, при скрупулезном соблюдении положений технологического регламента. Пренебрежение даже одним из перечисленных критериев может снизить эффективность (экономичность) эксплуатации ВПУ, что будет служить дополнительным фактором, подталкивающим потребителей к выбору электродеионизации в качестве альтернативы ионному обмену в процессах деминерализации воды [13].
Колонка для проведения ионного обмена представляла собой стеклянную бюретку на 50мл, закрепленную в штативе. В узкую её часть поместили стекловолокна, а затем заполняли бюретку суспензией анионита АВ-17-8, в ОН - форме, который предварительно замачивали в небольшом количестве дистиллированной воды для набухания. Легким постукиванием уплотняли анионит в колонке.
Модельный раствор промстока с содержанием Сr(VI) 100 мг/л и рН=2 (кислая среда)
Приготовление: 58 мл 0,1н раствора К2
Cr2
О7
и 100 мл 0,1н раствора Н2
SO4
разбавили в мерной колбе до 1 литра дистиллированной водой (исходный 0,1н раствор К2
Сr2
О7
готовили из фиксанала).
Модельный раствор промстока с содержанием Сr(VI) 200 мг/л и рН=2 (кислая среда)
Приготовление: 116 мл 0,1н раствора К2
Сr2
О7
и 200 мл 0,1н раствора Н2
SO4
разбавили в мерной колбе до 1 литра дистиллированной водой.
Модельный раствор промстока с содержанием Сr(VI) 300 мг/л и рН=2 (кислая среда)
Приготовление: 174 мл 0,1н раствора К2
Сr2
О7
и 300 мл 0,1н раствора Н2
SO4
разбавили в мерной колбе до 1 литра дистиллированной водой.
Модельный раствор промстока с содержанием Сr(VI) 100 мг/л и рН=7 (нейтральная среда)
Приготовление: 58 мл 0,1н раствора К2
Сr2
О7
разбавили до 1 литра дистиллированной водой в мерной колбе.
Модельный раствор промстока с содержанием Сr(VI) 200 мг/л и рН=7 (нейтральная среда)
Приготовление: 116 мг/л 0,1н раствора К2
Сr2
О7
разбавили до 1 литра дистиллированной водой в мерной колбе [15].
Модельный раствор промстока с содержанием Сr(VI) 300мг/л и рН=7 (нейтральная среда)
Приготовление: 174 мг/л 0,1н раствора К2
Сr2
О7
разбавили до 1 литра дистиллированной водой в мерной колбе.
Модельный раствор промстока с содержанием Сr(VI) 300 мг/л и рН=9 (щелочная среда)
Приготовление: 174 мл 0,1н раствора К2
Сr2
О7
разбавили в мерной колбе до 1 литра дистиллированной водой. По каплям добавляли NaOH до достижения рН=9 (рН измеряли на рН - метре "SevenEasy").
Модельный раствор промстока с содержанием Сr(VI) 300мг/л и хлорид - ионы
Приготовление: 174 мл раствора К2
Сr2
О7
разбавили до 1 литра дистиллированной водой и добавляли около 10 мл NaСI [15].
Фотоколориметрический метод основан на законе светопоглощения Бугера - Ламберта - Бера.
I=I0
-10-
ε
λ
С L
Где: I - слой вещества
I0
- интенсивность падающего светового потока
ελ
- величина молярного коэффициента поглощения
С - концентрация поглощающего вещества
L - толщина слоя раствора
Величина молярного коэффициента поглощения 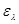  зависит от длины волны проходящего света, температуры раствора и природы растворенного вещества. зависит от длины волны проходящего света, температуры раствора и природы растворенного вещества.
Молярный коэффициент поглощения отражает индивидуальные свойства окрашенных соединений и является их определяющей характеристикой [16].
Определение хромат - ионов основано на реакции с дифенилкарбазидом, в результате которой образуется соединение ярко-розового цвета. Измерение оптической плотности проводили на фотоэлектроколориметре КФК-2-УХЛ 4.2 при длине волны 540НМ, толщина кювет 30мм, используя метод калибровочного графика [15].
Построение калибровочного графика. Для построения калибровочного графика готовили растворы К2
Сr2
О7
следующих концентраций: 0,00004; 0,0001; 0,0002; 0,0003; 0,0004; 0,0006; 0,0008; 0,001 мг/мл.
В мерные колбы емкостью 100 мл отмерили с помощью бюретки 0 (холостая проба), 2,5,10,15,20,30,40,50 мл стандартного раствора (1 мл стандартного раствора содержит 0,002 мг Сr(VI)). В каждую колбу добавляли дистиллированную воду до 50 мл, затем с помощью мерных цилиндров приливали 1 мл Н2
SO4
(1:1), 3 мл Н3
РО4
(1:1) перемешивали и добавляли пипеткой 2 мл дифенилкарбазида. Доводили объем дистиллированной водой до 100 мл, перемешивали и через 5-10 минут измеряли оптическую плотность (Д). По результатам измерения оптической плотности построили калибровочный график в координатах Диссл
, С(концентрация)
Сr(VI) [15].
Очистку проводили на анионите АВ-17-8, пропуская по 300 мл модельных стоков (п.2.1.2) через колонку с анионитом со скоростью 13 мл/с. Масса сухого анионита составляла 10г; объем набухшего анионита в колонке=38,5 мл. В очищенной воде определили концентрацию СrO4
2 -
по измерению оптической плотности нашли по калибровочному графику, чему равна концентрация.
После пропускания через анионитную колонку модельных стоков, ее промывали несколько раз дистиллированной водой и 5% NaOH, до значения рН=10-11. Затем собирали промывной раствор для определения (оптической плотности и концентрации СrО4
2 -
в нем.
Для контроля за содержанием регенерированного СrО2-
4
отбирали с помощью пипетки 1 мл промывного раствора и добавляли в него 1мл Н2
SO4
(1:1), 3мл Н3
РО4
(1:1) перемешивали и добавляли пипеткой 2мл дифенилкарбазида. Доводили объем дистиллированной водой до 100 мл и через 10-15 минут определяли оптическую плотность (Д).
Нейтрализация заключается в окислении цианидов до цианатов газообразным хлором:
СN -
+ 2 ОН -
+ Cl2
→ СNО -
+ 2Cl -
+ Н2
О.
После подачи 10%-го раствора щелочи NaOH (доводят рН до 13¸14) в резервуар подают газообразный хлор. После перемешивания для завершения реакции стоки сохраняются в спокойном состоянии 40-45 минут. В обезвреженных промстоках производится анализ на цианиды и остаточный хлор в химлаборатории. Содержание остаточного хлора должно быть не больше 20 мг/л.
В случае обнаружения остатков циана к стокам в реактор вновь добавляется хлор, производится перемешивание и отстаивание. После повторного анализа, при условии отсутствия цианидов, стоки перекачиваются насосами в смеситель теми же насосами, что перекачивают нейтрализованные хромовые стоки.
В процессе подачи хлора особо следует следить за рН стоков, так как при снижении рН при хлорировании возможно образование чрезвычайно ядовитого хлорциана:
СN+Сl= СNСl.
Такая реакция возникает при наличии побочных продуктов, например гипосульфита натрия. Для гарантии от образования опасного хлорциана рекомендуется процесс нейтрализации производить при рН=13¸14 [11].
Фотометрический метод определения массовой концентрации цианидов основан на превращении цианида в хлорциан и взаимодействии последнего с пиридином и барбитуровой кислотой [12].
Методика определение цианидов
Нужно взять 5 мл испытуемой воды и параллельно сделать холостую пробу при рН=5¸8. Добавить 0,2 мл хлорамина Т 0,1 % и 0,6 мл смешанного реактива (15см3
пиридин и 3г барбитуровой кислоты, 3см3
HClк
в колбе емкостью 50 см3
). Пробу выдержать 10 мин и затем измерить оптическую плотность на фотоколориметре.
Построение калибровочного графика
Измерение проводят приl=540 нм, толщина кюветы 10 мм, холостая проба - вода.
Для построения калибровочного графика готовят стандартный раствор. 1мл стандартного раствора содержит 0,5 мкг/дм3
цианидов.
Расчет полной обменной емкости.
На доведение рН р-ра до 10-11было израсходовано раствора NaCI 10 мл
а) Затрачено на титрование 6мл 0,1 н р-ра НСl
б) Затрачено на титрование 6,5 мл НСl
Средний объем равен 6,25 мл
СNaOH
= CHCl
· VHCl
/ VNaCI
= 0,1 · 6,25/10 = 0,0625 моль/л
ПОЕ = Vобщ · СNaOH
/ m анионита
где: Vобщ - суммарный объем раствора, содержащий вытесненную из смолы щелочь, л
С - концентрация щелочи, моль/л
ПОЕ = 88 · 0,0625/10 = 0,55 ммоль/г
Построение калибровочного графика
Таблица 3
№ пробы
(мл)
|
Оптическая плотность, D |
Концентрация, С мг/л |
| 2 |
0,07 |
0,04 |
| 5 |
0,16 |
0,1 |
| 10 |
0,31 |
0,2 |
| 15 |
0,485 |
0,3 |
| 20 |
0,64 |
0,4 |
| 30 |
0,95 |
0,6 |
| 40 |
1,3 |
0,8 |
| 50 |
1,5 |
1,0 |
 Рис.1. Калибровочный график. Зависимость оптической плотности от концентрации СrО2-
4
. Рис.1. Калибровочный график. Зависимость оптической плотности от концентрации СrО2-
4
.
1.1. Определение концентрации Сr(VI) в модельном стоке после очистки.
По данным измерительной оптической плотности строим калибровочный график по нему определяем концентрацию после очистки.
Концентрацию рассчитывали по формуле:
С(Сr(VI)) = С · 1000 / V
где: С - содержание Сr(VI), найденное по калибровочному графику, мг/л
V - объем пробы, взятый для анализа, мл.
Определение концентрации модельного раствора с начальным содержанием Сr(VI) 100 мг/л и рH= 2 (кислая среда)
С(Сr(VI)) = 0,04 · 1000 / 40 = 1,0 мг/л
С(Сr(VI)) = 0,05 · 1000 / 50 = 1,0 мг/л
Определение средней концентрации
Сср(Сr(VI)) = (1,0 + 1,0) / 2 =1,0 мг/л
Определение концентрации модельного раствора с начальным содержанием Сr(VI) 200 мг/л и рН = 2 (кислая среда)
С(Сr(VI)) = 0,1 · 1000 / 40 = 2,5 мг/л
С(Сr(VI)) = 0,13 · 1000 / 50 = 2,6 мг/л
Определение средней концентрации
Сср(Сr(VI)) = (2,5 + 2,6) / 2 = 2,55 мг/л
Определение концентрации модельного раствора с начальным содержанием Сr(VI) 300 мг/л и рН = 2 (кислая среда)
С(Сr(VI)) = 0,14 · 1000 / 40 = 3,5 мг/л
С(Сr(VI)) = 0,18 · 1000 / 50 = 3,6 мг/л
Определение средней концентрации
Сср(Сr(VI)) =(3,5 + 3,6) / 2 = 3,55 мг/л
Определение концентрации модельного раствора с начальным содержанием Сr(VI) 100 мг/л и рН = 7 (нейтральная среда)
С(Сr(VI)) = 0,03 · 1000 / 40 = 0,75 мг/л
С(Сr(VI)) = 0,04 · 1000 / 50 = 0,8 мг/л
Определение средней концентрации
Сср(Сr(VI)) = (0,75 + 0,8) / 2 = 0,775 мг/л
Определение концентрации модельного раствора с начальным содержанием Сr(VI) 200 мг/л и рН = 7 (нейтральная среда)
С(Сr(VI)) = 0,07 · 1000 / 40 = 1,75 мг/л
С(Сr(VI)) = 0,08 · 1000 / 50 = 1,6 мг/л
Определение средней концентрации
Сср(Сr(VI)) = (1,75 + 1,6) / 2 = 1,675 мг/л
Определение концентрации модельного раствора с начальным содержанием Сr(VI) 300 мг/л и рН = 7 (нейтральная среда)
С(Сr(VI)) = 0,37 · 1000 / 40 = 9,25 мг/л
С(Сr(VI)) = 0,47 · 1000 / 50 = 9,4 мг/л
Определение средней концентрации
Сср(Сr(VI)) = (9,25 + 9,4) / 2 = 9,325 мг/л
Определение концентрации модельного раствора с начальным содержанием Сr(VI) 300 мг/л и рН = 9 (щелочная среда)
С(Сr(VI)) = 0,02 · 1000 / 40 = 0,5 мг/л
С(Сr(VI)) = 0,15 · 1000 / 50 = 3 мг/л
Определение средней концентрации
Сср(Сr(VI)) = (0,5 + 3) / 2 = 1,75 мг/л
Определение концентрации модельного раствора с начальным содержанием Сr(VI) 300 мг/л в присутствии хлорид ионов
С(Сr(VI)) = 0,15 · 1000 / 40 = 3,75 мг/л
С(Сr(VI)) = 0,17 · 1000 / 50 = 3,4 мг/л
Определение средней концентрации
Сср(Сr(VI)) = (3,75 + 3,4) / 2 = 3,575 мг/л
Степени очистки рассчитывали по формуле:
Ст.оч. = ((С0
- СК
) / С0
) · 100%
где: С0
- начальная концентрация СrО4
2–
СК
- конечная концентрация СrО4
2–
Определение степени очистки для модельного раствора с содержанием Сr(VI) 100 мг/л, рН = 2
Ст.оч. = ((100 - 1) / 100) · 100 % = 99 %
Определение степени очистки для модельного раствора с содержанием Сr(VI) 200 мг/л, рН = 2
Ст.оч. = ((200 - 2,55) / 200) · 100 % = 99 %
Определение степени очистки для модельного раствора с содержанием Сr(VI) 300 мг/л, рН = 2
Ст.оч. = ((300 - 3,55) / 300) · 100 % = 99 %
Определение степени очистки для модельного раствора с содержанием Сr(VI) 100 мг/л, рН = 7
Ст.оч. = ((100 - 0,775) / 100) · 100 % = 99 %
Определение степени очистки для модельного раствора с содержанием Сr(VI) 200 мг/л, рН = 7
Ст.оч. = ((200 - 1,675) / 200) · 100 % = 99 %
Определение степени очистки для модельного раствора с содержанием Сr(VI) 300 мг/л, рН = 7
Ст.оч. = ((300 - 9,325) / 300) · 100 % = 99 %
Определение степени очистки для модельного раствора с содержанием Сr(VI) 300 мг/л, рН = 9
Ст.оч. = ((300 - 1,75) / 300) · 100 % = 99 %
Определение степени очистки для модельного раствора с содержанием Сr(VI) 300 мг/л и хлорид ионы
Ст.оч. = ((300 - 3,575) / 300) · 100 % = 99 %
Влияние рН среды на степень очистки
рН среды не влияет на степень очистки. Анионит полностью справился с очисткой при всех значениях рН в изученном интервале (табл. 4, 5, 6)
Промывной раствор 100 мг/л (кислая среда)
С(Сr(VI)) = С · 1000/V
С(Сr(VI)) = 0,03 · 1000/1 мл = 30мг/л
Промывной раствор 200 мг/л (кислая среда)
С(Сr(VI)) = С · 1000/V
С(Сr(VI)) = 0,022 · 1000/1 мл = 22мг/л
Промывной раствор 300 мг/л (кислая среда)
С(Сr(VI)) = С · 1000/V
С(Сr(VI)) = 0,04 · 1000/1 мл = 40мг/л
Промывной раствор 100 мг/л (нейтральная среда )
С(Сr(VI)) = С · 1000/V
С(Сr(VI)) = 0,08 · 1000/1 мл = 80 мг/л
Промывной раствор 200 мг/л (нейтральная среда)
С(Сr(VI)) = С · 1000/V
С(Сr(VI)) = 0,085 · 1000/1 мл = 85 мг/л
Промывной раствор 300 мг/л (нейтральная среда)
С(Сr(VI)) = С · 1000/V
С(Сr(VI)) = 0,02 · 1000/1 мл = 20 мг/л
Промывной раствор 300 мг/л (щелочная среда)
С(Сr(VI)) = С · 1000/V
С(Сr(VI)) = 0,02 · 1000/1 мл = 20 мг/л
Промывной раствор 300 мг/л (хлорид ионы)
С(Сr(VI)) = С · 1000/V
С(Сr(VI)) = 0,035 · 1000/1 мл = 35 мг/л
a = ((C0
-Ck
)/m )·V [ммоль/г]
где: С0
- начальная концентрация СrО4
2–
[моль/л]
СК
- конечная концентрация СrО4
2–
[моль/л]
m - масса сухого анионита [г]
V - объем раствора пропущенного через анионитную колонку [л]
1. Величина адсорбции модельного раствора "Сr(VI) 100 мг/л, рН=2"
а = ((1,92*10-3
- 0,019*10-3
)/10) ·0,3=0,0570 ммоль/г
Величина адсорбции модельного раствора "Сr(VI) 200 мг/л, рН=2"
а = ((3,85*10-3
- 0,049*10-3
)/10) ·0,3=0,114 ммоль/г
Величина адсорбции модельного раствора "Сr(VI) 300 мг/л, рН=2"
а = ((5,77*10-3
- 0,068*10-3
)/10) ·0,3=0,172 ммоль/г
2. Величина адсорбции модельного раствора "Сr(VI) 100 мг/л, рН=7"
а = ((1,92*10-3
- 0,014*10-3
)/10) ·0,3=0,0570 ммоль/г
Величина адсорбции модельного раствора "Сr(VI) 200 мг/л, рН=7"
а = ((3,85*10-3
- 0,032*10-3
)/10) ·0,3=0,114 ммоль/г
Величина адсорбции модельного раствора "Сr(VI) 300 мг/л, рН=7"
а = ((5,77*10-3
- 0,179*10-3
)/10) ·0,3=0,172 ммоль/г
3. Величина адсорбции модельного раствора "Сr(VI) 300 мг/л, рН=9"
а = ((5,77*10-3
- 0,033*10-3
)/10) ·0,3=0,172 ммоль/г
4. Величина адсорбции модельного раствора "Сr(VI) 300 мг/л и хлорид ионы"
а = ((5,77*10-3
- 0,068*10-3
)/10) ·0,3=0,172 ммоль/г
Таблица 4
Величины степеней очистки на анионите при начальной концентрации CrO2-
4
100мг/л
| Начальная концентрация Cr 100 мг/л |
Степень очистки % |
Концентрация после очистки мг/л
С=1,0
С= 0,775
|
Ст.оч=99
Ст.оч=99
|
Таблица 5 Величины степеней очистки на анионите при начальной концентрации СrО2-
4
200 мг/л
| Начальная концентрация Cr 200 мг/л |
Степень очистки % |
Концентрация после очистки мг/л
С=2,55
С=1,675
|
Ст.оч=99
Ст.оч=99
|
Таблица 6
Величины степеней очистки на анионите при начальной концентрации СrО2-
4
300 мг/л
| Начальная концентрация Cr 300 мг/л |
Степень очистки % |
Концентрация после очистки мг/л
С=3,55
С=9,325
С=1,75
С=3,575
|
Ст.оч=99
Ст.оч=99
Ст.оч=99
Ст.оч=99
|
Таблица 7 Величины адсорбции хромат - ионов в зависимости от разности концентрации
| Концентрация доочистки Сr(VI) моль/л (для 100 мг/л) |
Концентрация после очистки СrO2-
4 моль/л |
Величина адсорбции Сr (VI) ммоль/г |
С=1,92*10-3
|
С=0,016*10-3
|
а=0,0570
|
| Концентрация доочистки Сr (VI) моль/л (для 200 мг/л) |
Концентрация после очистки СrО2-
4
моль/л |
Величина адсорбции Сr (VI) _оль/г |
С=3,85*10-3
|
С=0,040*10-3
|
а=0,114
|
| Концентрация доочисткм Сr (VI) моль/л (для 300 мг/л) |
Концентрация после очистки СrО2-
4
моль/л |
Величина адсорбции Сr (VI) ммоль/г |
С=5,77*10-3
|
С=0,348*10-3
|
а=0,172
|
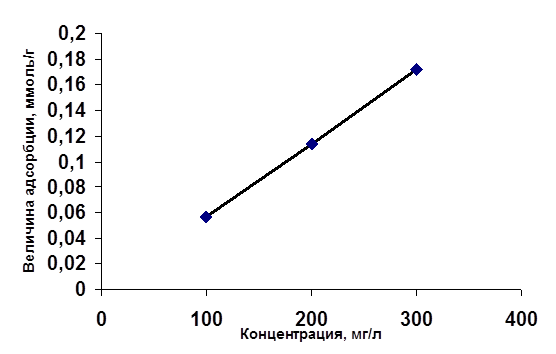
Рис. 2 Зависимость величины адсорбции от концентрации СrО2-
4
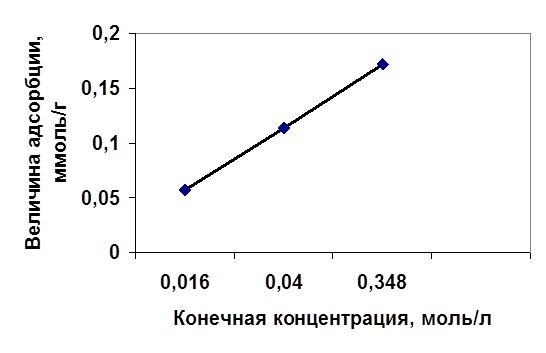
Рис. 3 Зависимость величины адсорбции от конечной
концентрации СrО2-
4
В таблицах 4-6 приведены данные по очистке модельных сточных вод, содержащих хромат - ионы, путем ионообменной сорбции на анионите АВ-17-8. Содержание хрома (VI) после пропускания через анионит при всех изученных начальных концентрациях не превышает ПДК (0,05 мг/л по токсикологическому показателю). Степень очистки во всех случаях составляет 99 %.
На рис. 2 и 3 представлены зависимости величины адсорбции СrО2-
4
на анионите от начальной и равновесной (конечной) концентрации, из которых видно, что величина адсорбции увеличивается с увеличением концентрации в изученном интервале практически линейно.
Проведение, ионного обмена при различных значениях рН (2,7,9) показало независимость степени очистки от кислотности или щелочности среды, хотя не исключено, что в сильно кислой или сильно щелочной среде такое влияние может иметь место.
Введение ионов хлора также не повлияло на степень очистки по хромат - ионам, что можно объяснить разницей в размерах этих ионов, степенях их гидратации или селективностью ионита по отношению к хромат - ионам. Таким образом хлорид - ионы не мешают удалению хромат - ионов из стоков с помощью анионита.
Регенерация анионита 5%-ным раствором гидроксида натрия в течение часа и, соответственно, извлечение хромат - ионов не дала положительных результатов. Степень регенерации оказалась недостаточной. По - видимому, необходимо увеличить концентрацию гидроксида натрия или время регенерации.
Таким образом, можно признать удовлетворительной очистку хром содержащих сточных вод на анионите АВ-17-8, если подобрать подходящие условия регенерации с целью возврата хромат - ионов для повторного использования.
Зависимость концентрации от оптической плотности полученного раствора приведена в табл. 8
Таблица 8 Зависимость концентрации цианид-ионов от оптической плотности раствора
| № |
Содерж. Мкг в 5 см3
р-ра |
D1 |
D2 |
D3 |
D4 |
D5 |
D6 |
D ср. |
| 1 |
0.050 |
0.015 |
0.015 |
0.015 |
0.015 |
0.015 |
0.015 |
0,015 |
| 2 |
0,075 |
0,020 |
0,020 |
0,020 |
0,025 |
0,025 |
0,025 |
0,025 |
| 3 |
0,125 |
0,035 |
0,035 |
0,035 |
0,045 |
0,045 |
0,045 |
0,040 |
| 4 |
0,250 |
0,075 |
0,075 |
0,075 |
0,075 |
0,080 |
0,080 |
0,075 |
| 5 |
0,500 |
0,15 |
0,15 |
0,15 |
0,17 |
0,17 |
0,17 |
0,160 |
| 6 |
1,000 |
0,31 |
0,31 |
0,31 |
0,33 |
0,33 |
0,33 |
0,320 |
| 7 |
1,250 |
0,39 |
0,39 |
0,39 |
0,41 |
0,41 |
0,41 |
0,400 |
| S=3,25 |
S D=1,0355 |
L=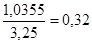 , ,
где L - определение средней оптической плотности.
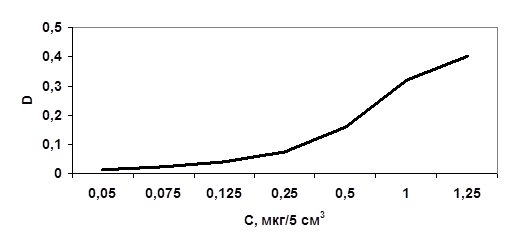
Рис. 4 Калибровочный график
Зависимость концентрации цианид - ионов от оптической плотности раствора При проведении реагентной очистки содержание цианид - ионов уменьшилось с 8,3 до 0,03 мг/л, что ниже ПДК, степень очистки 99,6 % поэтому возможно использовать реагентную очистку в этом случае.
В данной работе проводилась очистка сточной воды машиностроительного предприятия , в процессе которой было использовано оборудование, химическая посуда, химические реактивы. В данной главе просчитаны общие затраты за год на очистку сточных вод адсорбционным методом и реагентным методом.
Материальные затраты
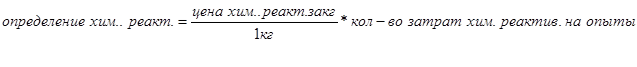
Таблица 9
| Название реактива |
Ед.
Изм.
|
Цена, руб./ кг, руб./ л |
Затраты на хим. показатели |
| Кол-во (мл; шт) |
Сумма затрат за год |
| Анионит АВ-17-8 |
гр |
387,4 |
120 |
46,44 |
| NaOH |
гр |
55,76 |
1200 |
66,96 |
| NaCI |
гр |
79,56 |
1080 |
85,92 |
| К 2
Сr2
О7
(из фиксанала) |
шт |
128,23 |
24 |
3077,52 |
| Н2
SO4
(конц.) |
мл |
32,13 |
720 |
23,04 |
| Н2
SO4
(из фиксанала) |
шт |
70 |
12 |
840 |
| Н3
РО4
|
мл |
112,59 |
360 |
40,56 |
| Дифенилкарбазид |
гр |
11,70 |
60 |
34,56 |
| Спирт этиловый |
мл |
98,20 |
1200 |
117,6 |
| НCI |
мл |
36,60 |
360 |
5,76 |
| Дистиллированная вода |
л |
20 |
240 |
4,8 |
| Итого: |
4338,36 |
Для расчета затрат на химическую посуду сроком использования до 6 месяцев, до 1 года и более:
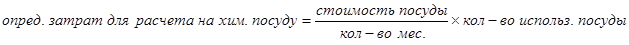
Таблица 10
| Наименование |
Срок использ. м-ев |
Цена материала |
Затраты на хим. посуду за год |
| Кол-во |
сумма |
| Штатив |
60 |
554,28 |
1 |
110,86 |
| Мерная колба на 1 литр |
36 |
120 |
1 |
40,00 |
| Стаканы |
6 |
34,50 |
2 |
69,00 |
| Колбы конические |
12 |
305,76 |
1 |
305,76 |
| Бюретка |
12 |
93,69 |
1 |
93,69 |
| Пипетка |
6 |
83,83 |
4 |
335,32 |
| Цилиндр мерный |
12 |
394,50 |
2 |
789,00 |
| Мерные колбы |
12 |
26,63 |
8 |
213,04 |
| Кюветы с толщиной слоя до 3 см |
12 |
59,16 |
2 |
118,32 |
| Делительные воронки |
6 |
114,66 |
2 |
229,32 |
| Итого затрат на хим. посуду |
2304,31 |
Затраты на оборудование
Опред. затрат на оборуд= Стоимость оборуд * % годов. норм. амортизации
Таблица 11
| Наименование амортиз. имущества |
Сред. срок экспл. лет |
Первоначальн. Стоимость руб. |
Годов. норма амортиз. % |
Кол-во |
Сумма амортиз. в год руб. |
| КФК |
10 |
19090,00 |
10 |
1 |
1909 |
| рН-метр |
5 |
7000 |
20 |
1 |
1400 |
| Весы аналитические |
10 |
10000 |
10 |
1 |
1000 |
| Итого затрат на оборудование |
4309 |
Затраты на з/плату
За месяц лаборант получает 3000 рублей. Имея 8-ми часовой рабочий день и 5-ти дневную рабочую неделю.
З/пл. лаб=З/пл. м*n, где
З/пл. м - заработная плата лаборанта в месяц
N - количество отработанных месяцев
Отраб. 22 дня Оклад 3000 рублей
15% р/к - 3000*15%=450 рублей
Заработная плата лаборанта за месяц
3000+450=3450 рублей
Заработная плата лаборанта за год
3450*12=41400 рублей
ЕСН=41400*26%=10764 рублей
Всего отчислено в фонд 26% на сумму 10764 рублей
Прочие затраты (накладные расходы):
ПР=З/пл. лаб*20%
ПР=41400*20%=8280 рублей
Затраты на электроэнергию за год
Эксплуатация электроприборов при химических опытах использовалась 240 часов в течении всего года, потребление электроэнергии за 240 часов - 120 кВт (стоимость 1кВт - 1руб. 40коп.).
Потребление электроэнергии КФК в час 0,5кВт, использование его 192 часа. Потребление электроэнергии рН - метр в час 0,5 кВт использование его 48 часов. Затраты на электроэнергию = кол-во кВт*цена кВт
Таблица 12
| Наименование |
Время использ. час |
Цена кВ |
Затраты на электроэнергию |
| Количество кВ |
Сумма |
| КФК |
192 |
1,40 |
96 |
134,40 |
| рН-метр |
48 |
1,40 |
24 |
33,60 |
| Итого затрат на электроэнергию за год |
168 |
Затраты за год на исследование очистки сточных вод, состоят из следующих статей затрат:
Материальные затраты - 6647,47 рублей
Затраты на оборудование (амортизация) - 4309 рублей
Затраты на з/плату (за год) - 60444 рублей
Затраты на электроэнергию - 168 рублей
Итого: 71568,47 рублей
Затраты на очистку сточных вод реагентным методом
Материальные затраты
Таблица 13
| Название реактива |
Ед. изм. |
Цена (руб) |
Затраты на хим. показатели |
| Кол-во |
Сумма затрат за год |
| Кислота фосфорная |
кг |
24,80 |
10 |
248 |
| Кислота уксусная |
кг |
57 |
20 |
1140 |
| Кислота серная |
кг |
9,40 |
20 |
188 |
| Гипохлорид кальция |
кг |
10,20 |
3000 |
30600 |
| Железный купорос |
кг |
9,80 |
22000 |
215600 |
| Полиакриламид |
т |
9800 |
8 |
78400 |
| Дифенилкарбазил |
кг |
506 |
0,4 |
202,40 |
| Гидрат окиси кальция |
т |
2796,61 |
20 |
55932,2 |
| Итого: |
382310 |
Затраты на оборудование Опред. затрат на оборуд= стоимость оборудования* %годов. норм. амортиз.
Таблица 14
| Наименование амортизационного имущества |
Первоначальная стоимость руб. |
Годов. норма амортиз. % |
Кол-во |
Сумма амортиз. в год руб. |
| Приемный резервуар |
12325 |
20 |
1 |
2465 |
| Хром-реактор |
9236,90 |
20 |
3 |
1847,38 |
| Емкости |
44124 |
25 |
5 |
11031 |
| Центробежные насосы |
15559,36 |
20 |
20 |
3111,88 |
| Электрические задвижки |
24096 |
12,5 |
3 |
3012 |
| Электрическая задвижка наполнения реакторов |
7749,80 |
12,5 |
3 |
968,72 |
| Реактор с механической мешалкой |
8618,67 |
20 |
2 |
1723,73 |
| Итого затрат на оборудование: |
24159,71 |
Текущие затраты и затраты на капитальный ремонт сооружений и установок для очистки сточных вод и рационального использования водных ресурсов составляют за год 1562,2 тыс. руб.
Затраты на заработную плату
Аппаратчица, которая обслуживает очистные сооружения работает по 4 разряду, тарифная ставка 9 рублей, 4% вредности, 50% премии + 15% районный коэффициент.
Зарплата аппаратчицы за год считается:
9*180ч*1,04(4% вредности)*1,5(50%премии)*1,15*12месяцев=34875,36 рублей.
ЕСН=34875,36*26%=9067,59 рублей
Всего отчислено в фонд 26% на сумму 9067,59 рублей
Прочие затраты (накладные расходы):
Пр=З/пл. *20%
Пр=34875,36*20%=6,975 рублей
Затраты на электроэнергию
Затраты на электроэнергию = кол-во кВ * кВ цена
Таблица 15
| Месяц |
Кол-во кВ (за месяц) |
Цена кВ |
Сумма затрат электроэнергии за год |
| январь |
14976 |
1,26 |
18869,7 |
| февраль |
17320 |
1,27 |
21996,4 |
| март |
15000 |
1,27 |
19050 |
| апрель |
10600 |
1,27 |
13462 |
| май |
17000 |
1,27 |
21590 |
| июнь |
1832 |
1,37 |
2509,84 |
| июль |
1000 |
1,37 |
1370 |
| август |
1508 |
1,39 |
2096,12 |
| сентябрь |
3608 |
1,39 |
5015,12 |
| октябрь |
15080 |
1,39 |
20961,2 |
| ноябрь |
16944 |
1,39 |
23552,16 |
| декабрь |
16600 |
1,39 |
23074 |
| Итого: |
173546,54 |
Затраты за год на очистные сооружения, которые состоят из следующих статей затрат:
- материальные затраты - 382310 руб.;
- затраты на оборудование (амортизация) - 24159,71 руб.;
- затраты на капитальный ремонт сооружений и установок - 1562,2 руб.;
- затраты на заработную плату - 43949,93 руб.;
- затраты на электроэнергию - 625528,38 руб.;
Итого: 625528,38 руб.
Сравнение методов очистки сточных вод
Таблица 16
| Метод очистки сточных вод |
Затраты за год |
| Матери-альные затраты, руб. |
Затраты на оборудова-ние, руб. |
Затраты на заработную плату, руб. |
Затраты на
Электроэ-нергию, руб.
|
Общие затраты, руб. |
| Реагентный метод |
382310 |
25722 |
43949,93 |
173546,54 |
625528,47 |
| Адсорбционный метод |
6647,47 |
4309 |
60444 |
168 |
71568,47 |
Реагентный метод/ адсорбционный метод = 625528,47 / 71568,47 = 8,7 раз.
После проведенного экономического расчета можно сделать вывод, что адсорбционный метод очистки сточных вод, а именно ионообменная адсорбция, в 8,7 раз дешевле реагентного метода.
1. С целью оценки возможности обезвреживания цианид - и хромат - содержащих сточных вод гальванических цехов исследована их реагентная и сорбционная очистка.
2. Установлено, что реагентный метод позволяет достигать ПДК по цианид - ионам, а метод ионообменной сорбции на анионите АВ-17-8 по хромат - ионам.
3. Рассчитаны величины удельной адсорбции хромат - ионов на анионите. Изотермы адсорбции имеют восходящий характер.
4. Обнаружено, что введение ионов хлора в модельный хромат содержащий сток, а также изменение его рН не влияет на степень очистки на анионите.
5. Проведена регенерация хромат - ионов и (анионита), показавшая необходимость увеличения ее продолжительности.
6. Определены затраты на очистку реагентным и ионообменным методом. Показано, что ионообменная сорбция в 8,7 раз дешевле реагентного метода, что дает возможность рекомендовать ионный обмен для очистки от хромат - ионов.
1. Белов С.В., Барбинов Ф.А., Козьяков А.Ф. и др. "Охрана окружающей среды", - М.: Высш. шк., 1991г.-339с (56-70с).
2. Богословская Т.М. "Фотоколориметрия", Методические указания, Омск-1977г-31с (4-5)
3. Виноградова Л.Д., Крюкова Л.Н., "Контроль качества воды". Методические Указания, Омск-1997г-38с (26-28).
4. Громов С.Л. Журнал "Теплоэнергетика" № 11 2006г., раздел: Водоподготовка - Регенерация ионитов.
5. Долгоносов А.М. "Ионный обмен и ионная хроматография" М.: Химия, 1993г.-360с (78-80).
6. Ершов Ю.А., Попков В.А. и др. "Общая химия". "Биофизическая химия". "Химия биогенных элементов". Учеб. Для вузов - 2-е изд., М.: Высш. шк., 2000-560с (264-266).
7. Жуков А.И., Монгайт И.Л., Родзиллер И.Д. "Методы очистки производственных сточных вод", - М.: Химия, 1996-345с (201-210с).
8. Кировская И.А., "Коллоидная химия". Поверхностные явления". Учебное пособие, Омск-1998г-176с (122-124).
9. Крамаренко В.Ф. "Токсикологическая химия", М.: Высш. шк., 1996г-350с (362-364).
10. Методика выполнения измерений массовой концентрации цианидов в природных и сточных водах фотометрическим методом с пиридином и барбитуровой кислотой.
11. Производственная инструкция. Для работников очистных сооружений по обезвреживанию хромсодержащих и кислотно-щелочных сточных вод.
12. Производственная инструкция. Для работников очистных сооружений по приему циансодержащих сточных вод и их обезвреживанию.
13. Проскуряков В.А., Шмидт Л.И., "Очистка сточных вод в химической промышленности" Л.: Химия, 1977-463с (310-312).
14. Скороходова В.А. "Очистка сточных вод" Омск-1982г-360с (194-198).
15. Технологическая инструкция по нейтрализации растворов ванн перед спуском в канализацию.
16. Филов В.А. "Вредные химические вещества". "Неорганические соединения элементов V-VIII групп" - М.: Химия, 1998г-600с (308-311).
17. Чикин Г.А., Мягков О.Н., "Ионообменные методы очистки веществ". Учебное пособие Воронеж: изд-во ВГУ, 1984г-372с (300-312).
|