Федеральное агентство по рыболовству
Федеральное государственное образовательное учреждение высшего профессионального образования
Астраханский Государственный Технический Университет
Кафедра «прикладная биология и микробиология»
Курсовая работа
на тему: «Морфология и метаболизм дрожжей»
Выполнил: ст. гр. ДБМ – 41
Проверил: д.б.н., проф.
Астрахань 2007
Содержание
Введение
Глава 1. Морфология и метаболизм дрожжей
1. Морфология
1.1 Макроморфология
1.2 Микроморфология
1.3 Псевдомицелий
1.4 Диморфизм и плеоморфизм
1.5 Особенности метаболизма
1.5.1 Спиртовое брожение
1.5.2 Дыхание
1.5.3 Вторичные продукты метаболизма
1.6 Источники азота
1.7 Лимитирующие факторы
1.7.1 Температура
1.7.2 Кислотность среды
1.7.3 Ингибиторы роста
1.8 Промышленное использование дрожжей
1.8.1 Традиционные процессы
1.8.2 Дрожжи в современной биотехнологии
Глава 2. Объекты и методы исследований
2.1 Объекты исследований
2.2 Отбор проб
2.3 Приборы для взятия проб
2.4 Методы стерилизации
2.5 Материалы и оборудование
2.6 Методы и способы обработки материала
2.7 Методы приготовления препаратов микроорганизмов
2.8 Выделение чистой культуры и проверка на чистоту
2.9 Получение культуральной жидкости
Глава 3. Экспериментальная часть
Выводы
Список литературы:
Приложение
Среды
Введение
Среди огромного разнообразия микроорганизмов, населяющих различные горизонты почв, обычно присутствуют и дрожжи. В то же время, численность дрожжей в почве невелика. Главным фактором, определяющим развитие дрожжей в почве, является концентрация легкодоступного органического вещества. Во всех типах почв численность дрожжей резко падает с глубиной, и наиболее заселенным является верхний 1-5см слой, непосредственно под подстилкой или слоем растительного опада.
Дрожжи играют большую роль в природных экосистемах. В трофических цепях эти дрожжи выступают как важное звено в питании беспозвоночных. Осуществляют процессы деструкции растительных остатков (Бабьева, Чернов, 2004).
В последние десятилетия разнообразие биотехнологических процессов, в которых используются дрожжи, резко увеличилось. Еще более разнообразны перспективы использования дрожжей: в различных разработках, патентах и т.п. упоминается более 200 видов. Сейчас дрожжи используются для получения различных ферментных препаратов, органических кислот, полисахаридов, многоатомных спиртов, витаминов и витаминных добавок, а также во множестве других мелкомасштабных процессах.
Целью исследовательской работы является выделение чистых культур почвенных дрожжей и создание питательной среды для культивирования базидиальных грибов на основе культуральной жидкости дрожжей.
Для достижения поставленной цели необходимо решить ряд задач:
- выделение чистых культур дрожжей и изучение морфологических и культуральных свойств;
- получение культуральной жидкости различных видов дрожжей и подбор питательной среды для культивирования высших грибов.
Для характеристик дрожжевых грибов обычно используют макро- и микроморфологические признаки, т.к. первые изучают визуально культуральные признаки, а вторые – с помощью микроскопа.
Характеризует рост культуры в жидких или на плотных средах. Эти признаки очень изменчивы и сильно зависят от состава среды и условий культивирования, поэтому они имеют весьма ограниченное значение в систематике дрожжей. Но тем немее, многие виды дрожжей существенно отличаются по характеру роста на скошенном агаре или в виде гигантской колонии, что дает возможность их быстрой предварительной идентификации.
Дрожжевые культуры, растущие на плотных средах, по консистенции бывают чаще всего пастообразными, или стекающими полностью на дно пробирки, слизистыми, вязкими, клейкими, кожистыми или крошащимися. Слизистый рост характерен для многих анаморфных базидиомицетовых дрожжей родов Cryptococcus
,
Rhodotorula
,
Sporobolomyces
,
а также для аскомицетовых почвенных дрожжей рода Lipomyces
. У большинства аскомицетовых дрожжей колонии пастообразные, сухие, культура при росте на скошенном агаре не стекает на дно пробирки. Для дрожжеподобных грибов, образующих как одиночные клетки, так мицелий, характеры колонии с ворсинчатым краем, который хорошо просматривается при просвечивании.
У большинства дрожжей колонии белые, часто приобретающие при старении кремовый или слегка коричневатый оттенок. У некоторых аскоспоровых дрожжей, например, из родов Nadsonia
или Lipomyces
, старые колонии при обильном спорообразовании темнеют и становятся бурыми или шоколадными. Многие дрожжи образуют пигменты, окрашивающие колонии в разные цвета. Наличие каротиноидных пигментов, придающих колониям красную, розовую, оранжевую или желтую окраску, характерно для базидиомицетовых дрожжей родов Rhodotorula
, Sporobolomyces
,
Cystofilobasidium
и др. Так же существуют дрожжи выделяющие в среду красно-вишневый пигмент пульхерримин. «Черные дрожжи» формируют темно бурые или черные колонии за счет накопления меланиноподобных пигментов.
При росте в жидких средах дрожжи вызывают помутнение, образуют осадок, кольцо на стенках пробирки, разного характера пленки. Как правило, рост в виде пленки характеризует способность дрожжей объединяться в мицелиальные структуры или свидетельствует об окислительном типе энергетического метаболизма (Бабьева, Чернов, 2004).
Включает признаки, характеризующие отдельные клетки (форма, размеры), а также способы вегетативного и бесполого размножения и образуемые при этом структуры.
Для большинства аскомицетовых дрожжей характерно многостороннее почкование, почка возникает на любом месте клеточной поверхности последовательно одна за другой, но у некоторых видов может закладываться одновременно несколько почек. В этом случае речь уже идет о множественном почковании. При полярном почковании закладка почек происходит только строго по полюсам клетки и каждая последующая почка возникает на месте предыдущей. При этом шрамы почкования нарастают один на другой и придают клетке характерную форму: грушевидную (у рода Schizoblastosporion) или лимонную, апикулятную (у родов Saccharomycodes, Nadsonia и др.).
1.3 Псевдомицелий
У многих видов дрожжей в определенных условиях роста материнские и дочерние клетки после почкования не разъединяются, а продолжают почковаться. В результате возникают структуры, имитирующие мицелий. Такой мицелий называют ложным, или псевдомицелием. В отличие от истинного(септированного) мицелия, в нитях псевдомицелия между клетками обычно хорошо заметны перетяжки, а апикальные (концевые) клетки всегда короче предшествующих. Псевдомицелий, стоящий только из клеток одного типа, сходных по форме и размерам, называют примитивным (рудиментарным). Сложный псевдомицелий состоит из клеток более чем одного типа, обычно в нем резко различают длинные клетки, составляющие псевдогифы, и расположенные на них одиночные или собранные гроздьями круглые, овальные или клиновидные почки, которые в этом случае называются бластоспорами (рисунок №1). Образование псевдомицелия характерно для многих аскомицетовых дрожжей, например, из родов Candida, Pichia(http://www.ss.msu.ru/soilyeasts/PicsList.htm)
 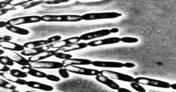
Рисунок 1. Примитивный - состоит из клеток одного типа
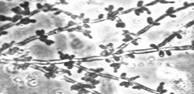 
Сложный - состоит из клеток нескольких типов, обычно из удлиненных стволовых (псевдогифы) и более округлых мелких (бластоспоры).
1.4 Диморфизм и плеоморфизм
Для дрожжей, как и для других грибов, известны явления диморфизма и плеоморфизма. Мицелиально-дрожжевой диморфизм проявляется в том, что один вид может расти в двух формах – одноклеточной и мицелиальной. Это явление известно в микологии и связано с двумя типами роста – сферическим и апикальным. Есть дрожжи, которые образуют только одноклеточные популяции, хотя могут расти в виде конгломератов из отдельных клеток; они могут формировать структуры, внешне имитирующие мицелий. Типичный дрожжевой рост в процессе всего жизненного цикла характерен для многих видов аскоспоровых дрожжей. Другая группа дрожжеподобных грибов имеет либо мицелиальную, либо одноклеточную форму роста в зависимости от стадии жизненного цикла. Например, у базадомицетовых дрожжей обычно гаплоидная фаза одноклеточная, а диплоидная (дикариотическая) – мицелиальная.
Третья группа дрожжей проявляет дрожжевой или мицелиальный рост в зависимости от условий среды. Например, переход от одной клеточной фазе роста может быть связан с условиями аэрации.
О явлении плеоморфизма говорят, когда в жизненном цикле одного вида существуют два или несколько видов бесполого размножения. Плеоморфизм у дрожжеподобных грибов выражается в том, что наряду с основным типом вегетативного размножения почкованием или делением некоторые дрожжи образуют особые бесполые структуры, предназначенные специально для распространения или сохранения вида, например, баллитоспоры, эндоспоры, хламидоспоры.
Баллитоспоры
– это экзогенные споры (конидии), которые формируются на заостренных кончиках особых выростов – стеригм, и при созревании с силой отстреливаются за счет капельно-экскреторного механизма. Способность к образованию баллитоспор, рассеиваемых через воздушную среду, свойственна дрожжам, обитающим на надземных частях растений. Примерами являются дрожжи родов Sporidiobolus, Sporobolomyces, Bullera и др.
Эндоспоры
представляют собой бесполые эндогенные клетки, формирующиеся чаще всего в гифах мицелиальных дрожжей (например, Trichosporon) из участков цитоплазмы, которые отделяются мембраной и затем образую клеточную стенку. Количество эндоспор в одной клетке строго не фиксировано. После разрушения мицелия эндоспоры освобождаются и начинают почковаться. Эндоспоры ни по структуре, ни по устойчивости не отличаются от вегетативных клеток.
Хламидоспоры
– крупные сферические или овальные клетки, которые образуются как из одиночных дрожжевых вегетативных клеток, так и на мицелии: интекалярно, латерально или терминально, по одной или цепочками. Хламидоспоры на мицелии образует, например, Candidaalbicans (рисунок №2). В хламидоспорах значительно снижена метаболическая активность, их клеточные стенки обладают устойчивостью к действию литических факторов. Биологическая функция таких структур заключается в длительном сохранении жизнеспособности в условиях голодания или низкой влажности. (http://www.ss.msu.ru/soilyeasts/PicsList.htm)
 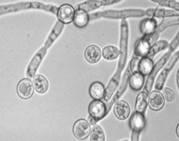
Рисунок 2. Phaffia rhorozyma Candida albicans
Истинный мицелий
дрожжеподобных грибов имеет разное строение в зависимости от таксономического положения.
1.5 Особенности метаболизма
Хотя дрожжи и не так разнообразны по своему метаболизму, как бактерии, различные виды дрожжей могут катаболизировать разные соединения углерода и азота и образовывать разные конечные продукты
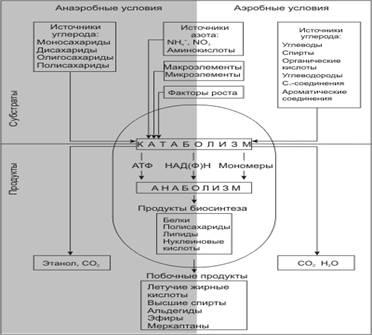
Рисунок 3. (http://www.ss.msu.ru/soilyeasts/PicsList.htm.)
1.5.1 Спиртовое брожение
Наиболее известное свойство многих дрожжей – способность к спиртовому брожению. Многие виды дрожжей могут переключаться с бродильного метаболизма на дыхательный и обратно в зависимости от условий: при наличии кислорода брожение ингибируется и дрожжи начинают дышать, в отсутствии кислорода включается механизм спиртового брожения. Так как кислородное дыхание – энергетически более выгодный процесс, чем брожение, то выход биомассы дрожжей в расчете на единицу используемого субстрата выше при выращивании их в аэробных условиях, чем в анаэробных. Это явление называется эффектом Пастера
.
Спиртовое брожение может идти не только в анаэробных условиях. Если выращивать дрожжи в присутствии кислорода, но при высоком содержании глюкозы в среде, то в этом случае дрожжи также сбраживают глюкозу. Таким образом, глюкоза подавляет процессы анаэробного дыхания. Это явление получило название эффекта Кребтри, или катаболитной репрессии.
Многие дрожжи вообще не способны бродить. По соотношению между этими двумя процессами в метаболизме можно выделить следующие группы дрожжей.
1. Дрожжи, существующие только за счет брожения и не способные расти в аэробных условиях. К ним относятся, например, вид Arxiozymatelluris, обитающие в кишечном тракте грызунов.
2. Активные бродильщики интенсивно сбраживающие различные субстраты, но в анаэробных условиях переключаются на дыхательный обмен. Представители – Saccharomysec cerevisiae, Schizosaccharomyces pombe.
3. Слабые бродильщики в основном существующие за счет аэробного дыхания, но в аэробных условиях могут бродить, однако значительно менее интенсивно, чем виды из предыдущей группы. Это аскомицетовые дрожжи из родов Pichia, Dedaryomycas, а также все способные к брожению базидиомицетовые дрожжи.
4. Дрожжи существующие только а счет дыхания и не способные расти в анаэробных условиях. К этой группе относятся аскомицетовые дрожжи базидиомицетового аффинитета – Cryptococcus, Rhodotorula, Sporobolomyces.
Основными продуктами спиртового брожения являются этанол и углекислота, однако, в микроколичествах образуется также множество побочных соединений.
Субстраты брожения.
Все бродящие дрожжи сбраживают глюкозу и фруктозу, поскольку именно с этих сахаров начинается гликолитическое расщепление. Кроме глюкозы и фруктозы могут сбраживать другие соединения, которые легко превращаются в интермедиаты гликолитического пути. В основном к ним относятся галактоза, из дисахаридов – сахароза, мальтоза, трегалоза. Значительно реже встречаются дрожжи, сбраживающие лактозу и мелибиозу.
Некоторые дрожжи способны сбраживать полисахариды. Например, Sacchoromycopsisfibuliger активно сбраживает крахмал.
Долгое время не были известны дрожжи, способные интенсивно сбраживать пентозы. Такие виды были описаны только к началу 80-х гг. XXв. К ним относятся, например, Pichiastipis (несовершенная стадия – Candidashehatae), Pachysolentannophilus (Бабьева, Чернов, 2004).
При росте в аэробных условиях при низком содержании глюкозы в среде дрожжи получают АТФ за счет процессов дыхания, как это делает большинство аэробных организмов. Полное окисление субстрата до углекислого газа и воды может происходить у дрожжей с помощью трех различных механизмов: в цикле трикарбоновых кислот, в глиоксилатном цикле и в пентозафосфатном цикле.
Спектр углеродных соединений, усваиваемых дрожжами за счет аэробного дыхания, значительно шире, чем в случае брожения.
1.5.3 Вторичные продукты метаболизма
В процессе роста дрожжи на ряду с основными продуктами (этанол, СО2
) образуют множество других метаболитов, которые при катаболизме углеводов, обмене аминокислот и пр. Хотя соединения обычно накапливаются в культуральной среде в очень незначительных количествах и трудно идентифицируются, они могут иметь большое практическое значение, например, для пищевой промышленности, так как от их состава зависит качество пищевого продукта, получаемого с помощью дрожжей. Такие соединения называют органолептическими.
Обязательные побочные продукты метаболизма дрожжей – высшие спирты (сивушные масла). Механизм синтеза высших спиртов связан с образованием алифатических аминокислот.
Чаще всего встречаются спирты: пропиловый, изоамиловый, бутиловый, изобутиловый. Летучие жирные кислоты, такие как уксуная, пропионовая, масляная, изомасляная, изовалериановая – также обычно минорные продукты метаболизма дрожжей. Большое практическое значение имеют выделяемые дрожжами альдегиды и кетоны (ацетоин и диацетил) (Бабьева, Чернов, 2004).
1.6 Источники азота
Универсальным источником азота для дрожжей являются соли аммония.
Многие дрожжи способны усваивать азот в окисленной форме – в виде солей нитратов и нитритов. Дрожжи, использующие нитраты, имеют две ферментные системы: первая восстанавливает нитрат до нитрита, вторая – нитрат до аммония. У некоторых видов присутствует только вторая ферментная система – они способны усваивать нитриты, но не нитраты. Способность к ассимиляции нитратов считается ценным таксономическим признаком, поэтому определение способности к росту на среде с KNO3
в качестве единственного источника азота – рутинный тест при идентификации дрожжей.
Практически все дрожжи используют в качестве источника азота мочевину, расщепляя ее до СО2
и NH3
.
1.7 Лимитирующие факторы
За исключением нескольких исключительно холоднолюбивых видов, среди дрожжей нет ярко выраженных экстремофилов, то есть видов, предпочитающих крайне высокие или низкие значения температуры, рН, осмотического давления, влажности, среды, и т.п. В тоже время существуют дрожжи, которые сильно выделяются среди большинства других видов, которые сильно выделяются среди большинства других видов по своей способности переносить неблагоприятные факторы среды (http://www.ss.msu.ru/soilyeasts/PicsList.htm.).
1.7.1 Температура
У большинства видов дрожжей минимальная температура роста находится в пределах 0-5°С, а максимальная - 30-40°С. Почти все дрожжи могут расти при комнатной температуре 20-25°С. Базидиомицетовые дрожжи в целом характеризуются более низкими максимальными температурами роста, чем аскомицетовые. Однако из этого правила есть ряд исключений.
В целом дрожжи - это довольно холоднолюбивая группа микроорганизмов. Часто это дает возможность создать селективные условия при выделении дрожжей методом посева на твердых питательных средах сильно мешают мицелиальные грибы, присутствующие в изучаемом субстрате. Колонии грибов маскируют более мелкие дрожжевые колонии и затрудняют их изоляцию. Подобрать какую-либо селективную только на одноклеточные грибы питательную среду, то есть ограничить рост мицелиальных грибов химически невозможно: все ингибиторы роста мицелиальных грибов действуют и на дрожжи. Однако при выращивании посевов при низкой (около 5°С) температуре дрожжеподобные колонии в среднем развиваются быстрее. Это дает возможность частично избавиться от колоний мицелиальных грибов.
1.7.2 Кислотность среды
Оптимальные значения рН для роста большинства дрожжеподобных грибов находится в области средней кислотности (рН4-6). Однако отдельные виды способны развиваться в более кислой среде. Например, некоторые штаммы Saccharomycescerevisiae хорошо растут при рН 2,5-3.
Практически все виды дрожжей могут расти в диапазоне рН 4-4,5. В то же время, в такой слабокислой среде не растет большинство банальных бактерий, которые наиболее обычны в самых разных природных местообитаниях. На этом основан простейший метод селективного выделения дрожжей: питательная среда (например, сусло агар) подкисляется НCL или молочной кислотой до рН 4-4,5. В большинстве случаев на такой среде вырастают только дрожжи и быстрорастущие мицелиальные грибы.
1.7.3 Ингибиторы роста
Рост дрожжей подавляется многими антибиотиками актиномицетного и грибного происхождения с разным механизмом действия.
Дрожжи были первыми микроорганизмами, которые человек стал использовать для удовлетворения своих потребностей. Основное свойство дрожжей, которое всегда было привлекательным для человека - это способность к образованию довольно больших количеств спирта из сахара. Первое упоминание о получении спиртных напитков в Египте, так называемой «бузы», представляющей собой разновидность пива, относится к 6000 г. до н. э. Этот напиток получали в результате сбраживания пасты, полученной при раздавливании и растирании проросшего ячменя. Приготовление бузы можно считать рождением современного пивоварения. Из Египта технология пивоварения была завезена в Грецию, а оттуда в Древний Рим. В этих же странах активно развивалось виноделие. Крепкие спиртные напитки, полученные перегонкой бражки, по-видимому, были впервые получены в Китае около 1000 г. до н. э. Сейчас промышленное производство спиртных напитков существует в большинстве стран мира и представляет собой крупную отрасль промышленности.
Другая группа процессов, в которых издавна используются дрожжи, также связана с их способностью к спиртовому брожению: образование углекислого газа под действием дрожжей - важнейший этап в приготовлении хлеба, приводящий к заквашиванию теста. Этот процесс также очень древний. Уже к 1200 г. до н. э. в Египте была хорошо известна разница между хлебом из кислого и пресного теста, а также польза от применения вчерашнего теста для заквашивания свежего.
Виноделие, пивоварение и хлебопечение существуют уже несколько тысячелетий. Естественно, что за это время были отселекционированы сотни видов заквасок, которые используются для приготовления самых различных сортов вина и пива. Однако лишь в начале XIX в. были высказаны предположения, что за спиртовое брожение, вызываемое этими заквасками, ответственны присутствующие в них дрожжи, увиденные впервые в 1680 г. Антони ван Левенгуком. Эти дрожжи были описаны в 1837 г. Мейеном, который дал им название Saccharomyces. К концу ХIХ в. стало известно, что сахаромицеты, выделенные из различных заквасок и различных сортов вина и пива, различаются по физиологическим свойствам, например, по способности к сбраживанию различных сахаров. В дальнейшем на основании таких физиологических различий в роде Saccharomyces было описано несколько десятков видов. Однако в последние годы методами молекулярной и генетической таксономии было показано, что большинство этих «видов» на самом деле представляют собой различные физиологические расы нескольких близких биологических видов, главным образом Saccharomyces cerevisiae. Это такие «виды», как, например, Saccharomyces vini, Saccharomyces ellipsoides, Saccharomyces oviformis, Saccharomyces cheresiensis, Saccharomyces chevalieri и десятки других, которые сейчас переведены в разряд синонимов Saccharomyces cerevisiae. Большинство этих «видов» - это отселекционированные веками расы - такой же продукт человеческой деятельности, как сорта культурных растений. В природе их найти иногда просто невозможно. Однако, недавно Г.И.Наумов обнаружил, что дикие популяции Saccharomyces cerevisiae распространены на Дальнем Востоке в сокотечениях дуба. Он предположил, что Дальний Восток - центр видообразования этих дрожжей.
Кроме вина и пива, ставшими наиболее популярными, в мире производится множество разнообразных традиционных алкогольных напитков: сакэ на Востоке, текила в Южной Америке, помбе в Африке и т.д. Они различаются по типу исходного сырья, способами осахаривания полисахаридов, видами добавок. В некоторых случаях для сбраживания используются виды дрожжей, отличные от Saccharomyces cerevisiae. При производстве рома, например, применяются дрожжи из рода Schizosaccharomyces.
Дрожжи используются также при изготовлении множества других традиционных пищевых продуктов. Например, специальные расы дрожжей входят в состав заквасок, использующихся для приготовления кефира. Дрожжи применяются в сыроварении при получении некоторых сортов сыра. В Восточной Азии широко распространены многочисленные закваски для получения разнообразных традиционных соусов, в состав которых входят специфические виды дрожжей, не встречающиеся в других местообитаниях. В быту большую популярность получил «чайный гриб» - специфическая бактериально-дрожжевая ассоциация, с помощью которой получают легкий, освежающий напиток.
Новый этап в развитии бродильных процессов начался после работ Пастера, Коха и других корифеев микробиологии, которые ввели в практику метод чистых культур. Тем не менее, до конца ХIХ в. дрожжи применялись лишь в виноделии, пивоварении и хлебопечении. Двадцатый век с его безудержным развитием промышленности резко расширил и области применения дрожжей. Они стали выращиваться в больших масштабах в качестве источника белка и витаминов для сельскохозяйственных животных. Дрожжи - основной источник технического этанола. С помощью дрожжей сейчас получают большой спектр соединений, использующихся в разных областях человеческой деятельности. К ним относятся витамины, различные полисахариды, липиды, которые могут служить заменителями растительных масел, разнообразные ферменты, используемые в пищевой промышленности. Развитие генетической инженерии позволило использовать легко культивируемые дрожжи для получения многих полезных веществ животной и растительной природы, например инсулина.
Дрожжи как источник белка
Использование микробной биомассы для обогащения кормов белком и незаменимыми аминокислотами в условиях интенсивного животноводства - одна из важных проблем будущего, так как человечество развивается таким образом, что оно вряд ли сможет обеспечить себя пищей традиционными методами. Выращивание микроорганизмов не зависит от климатических и погодных условий, не требует посевных площадей, поддается автоматизации. Дрожжи - одна из наиболее перспективных групп микроорганизмов для получения белковых кормовых добавок. Содержание белка в клетках некоторых штаммов дрожжей составляет от половины до 2/3 сухой массы, на долю незаменимых аминокислот приходится до 10% (в белках сои, богатых лизином, его содержится не многим более 6%).
Производство этанола
Этанол широко применяется в химической промышленности как исходное соединение для синтеза многих веществ, как растворитель, экстрагент, антифриз и т.п. Вероятно, у этанола большое будущее и как топлива в двигателях внутреннего сгорания: этанол - гораздо более экологически чистое топливо, чем бензин.
В принципе этанол можно получать из любого источника углеводов, которые сбраживаются дрожжами. Разнообразие потенциальных продуцентов тоже велико: более 200 видов дрожжей способны сбраживать глюкозу.
Крупномасштабное получение этанола в качестве топлива осуществляется в основном в Бразилии и других странах Южной Америки. В качестве источника углеводов используется сахарный тростник и маниока, в качестве продуцента этанола - Saccharomyces cerevisiae.
Перспективным сырьем для получения спирта являются отходы целлюлозно-бумажной и деревообрабатывающей промышленности. Однако, гидролизаты древесины содержат большое количество пентоз. До середины 70-х годов XX в. вообще не были известны дрожжи, активно сбраживающие пентозы. Сейчас такие виды найдены: Pachysolen tannophilus и Pichia stipitis (анаморфа - Candida shehatae). Им прочат большое будущее в производстве спирта из гидролизатов древесных отходов, соломы, торфа и т.п.
В небольших масштабах этанол можно получать и из других субстратов, например из молочной сыворотки, используя сбраживающие лактозу дрожжи из рода Kluyveromyces.
Различные продукты, получаемые из дрожжей
В последние десятилетия разнообразие биотехнологических процессов, в которых используются дрожжи, резко увеличилось. Еще более разнообразны перспективы использования дрожжей: в различных разработках, патентах и т.п. упоминается более 200 видов. Сейчас дрожжи используются для получения различных ферментных препаратов, органических кислот, полисахаридов, многоатомных спиртов, витаминов и витаминных добавок, а также во множестве других мелкомасштабных процессах.
Промышленно важные органические кислоты, продуцируемые микроорганизмами, являются либо конечными продуктами (молочная, масляная, пропионовая кислоты у анаэробных бактерий), либо интермедиатами метаболизма. Последние можно получать с помощью дрожжей. В наибольших масштабах производится лимонная кислота, в основном с помощью Aspergillus niger, с использованием в качестве субстрата мелассы. Однако, ее можно получать и с помощью дрожжей на более дешевых субстратах, таких как парафины нефти или этанол. Сейчас разработаны технологии получения и многих других кислот, например, изолимонной из Candida catenulata, фумаровой из Candida hydrocarbofumarica, яблочной из Pichia membranaefaciens и др.
Из дрожжевых полисахаридов наиболее известен пуллулан, который получают из дрожжеподобного гриба Aureobasidium pullulans. Он представляет собой β-глюкан, в котором мальтотриозные остатки соединены между собой β (1→6) гликозидными связями. Пуллулан используется в основном в пищевой промышленности в качестве пленочного покрытия. Возможно получение разнообразных по строению и свойствам полисахаридов и из других видов дрожжей. Особенно много внеклеточных полисахаридов образуют дрожжи Cryptococcus, Rhodotorula, Lipomyces.
Многоатомные спирты (глицерин, ксилит, эритрит, арабит) - широко применяются в химической и пищевой промышленности. Перспективным считается способ получения сахароспиртов, таких как глицерин, эритрит и ксилит, с использованием ксеротолерантных дрожжей рода Zygosaccharomyces. Эти дрожжи способны расти в средах с высоким осмотическим давлением, синтезируя при этом большое количество внутриклеточных полиолов, которые служат осмопротекторами. Другой способ касается получения ксилита - важного полиола для пищевой промышленности. Ксилит накапливается как побочный продукт при сбраживании ксилозы дрожжами Pachysolen tannophilus.
Многие дрожжи служат источниками для получения ферментных препаратов, которые используются в современной пищевой и химической промышленности. Из дрожжевого осадка, образующегося как отход пивоварения, получают фермент β-фруктофуранозидазу (инвертазу), расщепляющий сахарозу на глюкозу и фруктозу. Препараты инвертазы широко применяются в кондитерской промышленности для предотвращения кристаллизации сахарозы, для приготовления инвертных сиропов. С помощью культур Kluyveromyces marxianus получают β-галактозидазу, которая применяется в молочной промышленности. Дрожжи Yarrowia lipolytica используются для получения липолитических ферментов, представляющих большой интерес для многих отраслей хозяйства. Липазы используются в сыроварении, в косметической промышленности, при выделке мехов и кож, в моющих средствах. В последние годы разработано множество способов получения самых различных ферментов из дрожжей: пектиназ из Saccharomycopsis fibuliger, амилаз из Schwanniomyces occidentalis, ксиланаз из Cryptococcus laurentii, гидролаз L-α-амино-ε-капролактама из криптококков, алкогольоксидазы из Pichia burtonii, оксидазы D-аминокислот из Trigonopsis variabilis, фенилаланинаммиаклиазы из Rhodotorula glutinis. Это лишь немногие примеры получения дрожжевых ферментных, спектр которых в последние годы постоянно расширяется.
Применение дрожжей как источников витаминов началось в 1930-е годы. Одним из первых промышленных процессов получения витаминов было выделение эргостерина из Saccharomyces cerevisiae с последующим облучением ультрафиолетом для перевода в витамин D. Затем у дрожжей была открыта способность к сверхсинтезу некоторых витаминов группы В, в частности рибофлавина. Некоторые красные дрожжи используются для получения каротиноидов, в частности β-каротина, служащего предшественником витамина A, астаксантина, используемого в качестве кормовой добавки в рыбоводстве. Кроме производства индивидуальных витаминов уже много лет в мире практикуется получение автолизатов и гидролизатов дрожжей, питьевых дрожжей, которые используются как источник витаминов и как вкусовые добавки.
Глава
2. Объекты и методы исследований
Объектом исследований является почва, отобранная из различных экониш. Проба №1 – почва поля не посевного (Ахтубинский р-он), проба №2 – почва лесная (Ахтубинский р-он), проба №3 – почва садовая (парк АГТУ), проба №4 – почва луговая (луг заливной, Ахтубинский р-он), проба №5 – почва из грибницы шампиньона (Икряненский р-он).
2.2 Отбор проб
Среднюю почвенную пробу получают смешиванием отдельных образцов. Пробы №1, №2, №3, и №4 были отобраны по одном и тому же методу, с площади 100 м2
взяли пробу из трех точек. Верхний слой почвы толщиной 2 см снимается и только после этого отбирается проба почвы. Так проделываем три раза. Проба №5 отбирается из одной точки, из грибницы шампиньона.
2.3 Приборы для взятия проб
Почвенный образец берут буром, лопатой и ножом. В поле перед взятием образца их тщательно очищают, затем обрабатывают спиртом и обжигают. Можно ограничиться очисткой этих предметов, если затем несколько раз воткнуть их в почву изучаемого горизонта. Укладывают образец в заранее приготовленную стеклянную широкогорлую стерильную банку, закрывающуюся корковой пробкой, обернутой стерильной бумагой, либо в стерильные пергаментные пакеты или пакеты из плотной бумаги, взятой двойным слоем. На пакеты, банки наклеивают этикетки с указанием места взятия пробы, горизонта и других сведений.
Почвенные образцы анализируют в первые сутки. При необходимости допускается хранение их в холодном помещении (в холодильнике) в течение двух дней. Для придания среднему образцу большей однородности, соблюдая все условия асептики, тщательно перемешивают почву, вынимают корни растений, различные включения (Теппер, 1994).
2.4 Методы стерилизации
Стерилизация, или обеспложивание (от лат. sterilis – бесплодный), – это полное уничтожение клеток микроорганизмов в питательных средах, посуде и пр.
Известно несколько методов стерилизации. Чаще всего применяют стерилизацию нагреванием.
Фламбирование, или прокаливание
Прокаливать можно непосредственно перед употреблением платиновые петли, иглы, шпатели, мелкие металлические предметы (ножницы, ланцеты, пинцеты), а также стеклянные палочки, предметные, покровные стекла и т. д.
Стерилизация сухим жаром
Ее применяют для обработки посуды и сухих материалов, например крахмала, мела. При этом стерилизуемый объект выдерживают при 170ºС в течение 2 ч (считая с того момента, как установлена необходимая температура) в печи Пастера или в электросушильных шкафах. Поднимать температуру выше 170ºС не рекомендуется: ватные пробки и бумага начинают разрушаться (буреют, становятся ломкими).
Перед стерилизацией стеклянную посуду закрывают ватными пробками и обертывают бумагой. Чашки, пробирки, пипетки, вату, марлю заворачивают в бумагу или помещают в особые футляры и пеналы, в которых стерильная посуда может храниться после стерилизации.
По окончании стерилизации шкаф открывают только после того, как температура снизится до комнатной, иначе стекло может лопнуть.
Стерилизация текучим паром
Текучим паром (100 °С) обрабатывают предметы, портящиеся от сухого жара, и некоторые питательные среды, не выдерживающие более высокой температуры (среды с углеводами, МПЖ, молоко). Проводят стерилизацию в кипятильнике Коха по 30 мин в течение 3 суток ежедневно. Такая стерилизация называется дробной.
Стерилизация насыщенным паром под давлением
Это наиболее быстрый и надежный способ стерилизации, при котором гибнут самые устойчивые споры. С его помощью стерилизуют большинство питательных сред, посуду.
Обработку насыщенным паром проводят в герметически закрывающемся толстостенном котле – автоклаве. На массивной крышке или сбоку котла находятся кран для выхода пара, манометр и предохранительный клапан. Манометр показывает, на сколько давление пара внутри котла выше нормального. Для предотвращения взрыва при превышении предельного давления срабатывает предохранительный клапан, давая выход пару.
Автоклав используют и для дробной стерилизации текучим паром. В этом случае крышку не завинчивают, чтобы обеспечить свободный выход пару (Теппер, 1994).
2.5 Материалы и оборудование
Культуры микроорганизмов, пробирки, колбы, чашки Петри, бактериологические иглы, шпатели, штативы, предметные и покровные стекла, красители, спиртовая горелка.
При любой микробиологической работе: при посевах, при посевах, выделении, пересевах, сохранении чистых культур используются стерильные среды, стерильная посуда, стерильные инструменты, чтобы предотвратить возможность попадания посторонней микрофлоры.
Для стерильной посуды используется стерилизация сухим жаром. Она производится нагреванием в течение 2 часов, при температуре 1700°С (считая с того момента, как температура установилась) в печи Пастера или в электросушильных шкафах (с нагревом до 2000).
Вся посуда перед стерилизацией должна быть вымыта, высушена и завернута в бумагу.
Для заворачивания посуды при стерилизации в автоклаве, используют газетную бумагу (которая не размокает).
Большинство питательных сред стерилизуют насыщенным паром под давлением в автоклавах. Повышение давления в автоклаве повышает температуру пара, образуемого внутри автоклава и следовательно, температуру стерилизации.
Приготовление почвенной суспензии и посев на среды
На стерильную бумагу отвешивают 10 г почвы. Навеску почвы переносят в колбу на 250 мл со 100 мл стерильной водопроводной воды, взбалтывают 10 мин (лучше на механической качалке) и дают отстояться грубым частицам почвы.
Перед приготовлением суспензии для каждого образца готовят 2 стерильные колбы на 250 мл; одна содержит 100 мл стерильной водопроводной воды, другая – пустая. Водой из первой колбы растертую почвенную массу смывают в пустую стерильную колбу. Колбу с полученной суспензией встряхивают 5 мин, оставляют на 30 с и готовят разведения, содержащие разные концентрации почвы. 1 мл суспензии в первой колбе соответствует разведению 10-1
. Последующие разведения (10-2
; 10-3
; 10-4
; 10-5
; 10-6
и т. д.) лучше тоже делать в колбах на 250 мл с 90 мл стерильной водопроводной воды, но мы использовали пробирки со стерильной водой с 9 мл.
Из каждого предыдущего разведения отдельной стерильной пипеткой берут 1 мл суспензии и переносят в следующую пробирку с 9 мл воды. Всякий раз пипетку ополаскивают и отставляют. Последующие пробирки встряхивают по 1 мин.
Из полученных разведений делают посев на плотные среды. Набор сред зависит от задач бактериологического анализа почвы. На плотные питательные среды посев проводят преимущественно поверхностно, но мы использовали преимущественно глубинный посев.
При определении количества бактерий в почве использовались следующие среды: Глюкозо-петонная, Глюкозо-аммонийная, Сабуро, Эшби с сахарозой, и МПА.
Для глубинного посева берут 1 мл почвенной суспензии из разведения на порядок меньшего, чем для поверхностного посева.
Суспензию вносят в стерильную чашку Петри, заливают агаром, расплавленным и охлажденным до 45°С, и смешивают с ним. При глубинном посеве показатели получаются более низкие, чем при поверхностном (Теппер, 1994).
Техника взятия культуры для приготовления препарата
Пробирку с культурой держат в левой руке почти в горизонтальном положении вблизи горелки. Перед взятием культуры правой рукой вынимают ватную пробку из пробирки, зажимая ее между мизинцем и ладонью, а края пробирки обжигают на пламени горелки. Иглу держат в правой руке большим, указательным и средним пальцами. Обожженной в пламени бактериологической иглой из пробирки берут небольшое количество микробной массы.
Если культуру берут из жидкой среды, не следует сильно наклонять пробирку, чтобы не смочить ее края и пробку. Для взятия культуры лучше пользоваться петлей. После взятия культуры края пробирки и пробку обжигают в пламени и закрывают пробирку.
Фиксированные препараты микроорганизмов
Вводные пояснения. В микробиологии часто готовят фиксированные препараты. Их рассматривают под микроскопом в окрашенном виде. Под фиксацией подразумевается такая обработка живого объекта, которая дает возможность быстро прервать течение жизненных процессов в объекте, сохранив его тонкую структуру. В результате фиксации клетки прочно прикрепляются к стеклу и лучше прокрашиваются. Фиксация необходима в случае работы с патогенными микроорганизмами (в целях безопасности).
Приготовление мазка. На чистое обезжиренное предметное стекло наносят каплю водопроводной воды. Для обезжиривания стекол используют смесь этилового спирта и серного эфира в соотношении 1:1. Эти операции проводят вдали от горелок. Прокаленной бактериологической иглой из пробирки с культурой берут небольшое количество микробной массы и вносят в каплю воды. Каплю тщательно размазывают петлей по стеклу на площади около 4 см2
.
В случае, если суспензия густая, ее сначала разводят водой. Для этого прокаленной петлей берут немного суспензии и переносят в каплю воды на другое предметное стекло. Суспензию нормальной густоты размазывают тонким слоем по стеклу, затем мазок сушат на воздухе при комнатной температуре или при слабом нагревании, держа препарат высоко над пламенем горелки. Сильное нагревание препарата при сушке не рекомендуется для избежания коагуляции белков, искажающей структуру и форму клеток. Высушенный препарат фиксируют (Теппер, 1994).
Фиксация мазка.
Ее проводят над пламенем горелки. Для этого препарат три-четыре раза медленно проводят нижней стороной над пламенем горелки.
Окрашивание препарата. При окрашивании мазка препарат помещают на препаратодержатель. На мазок наносят несколько капель красителя. В зависимости от вида красителя и цели исследования продолжительность окрашивания варьирует от 1 до 5 мин, в отдельных случаях занимая до 30 мин и более. По окончании окрашивания препарат промывают водой, фильтровальной бумагой удаляют воду, подсушивают на воздухе и микроскопируют.
Существуют простые и дифференцированные методы окраски.
При простой окраске используют какой-либо один краситель, например метиленовый синий, фуксин, генциан фиолетовый в щелочных или карболовых растворах. При этом прокрашивается вся клетка.
При дифференцированной окраске отдельные структуры клетки окрашиваются разными красителями. Таковы методы окраски по Грамму, окраски спор.
Окрашивание препарата по способу Грама
1. Метил-виолет 30 сек.
2. Краску слить самотеком.
3. Высушить мазок фильтровальной бумагой.
4. Налить на 30сек. раствор люголя.
5. Слить самотеком раствор люголя.
6. Обесцвечивать спиртом 15 сек.
7. Промыть препарат водой.
8. Дополнительная окраска - разведенный фуксин 1 мин.
9. Промыть препарат водой, высушить фильтровальной бумагой, микроскопировать с 90* объективом.
2.8 Выделение чистой культуры и проверка на чистоту
Чистые культуры выделялись на среду Сабуро (см. Приложение №1), т.к. она содержит все необходимые питательные вещества для роста дрожжей.
Полученную культуру проверяем на чистоту методом посевов на селективные плотные питательные среды.
2.9 Получение культуральной жидкости
С помощью шпателя отбиралась биомасса культуры дрожжей, затем ее помещали в жидкую питательную среду (Сабуро). Культура инкубировалась в течение 1 недели в аэробных условиях, в данном случае мы использовали «качалку». После инкубации полученная жидкость центрифугировалась и стерилизовалась при 1 атмосфере.
В полученной культуральной жидкости могут присутствовать различные кислоты (молочная, масляная, пропионовая, яблочная), многоатомные спирты (глицерин, ксилит, эритрит, арабит), некоторые витамины группы В, в частности рибофлавина.
Глава 3. Экспериментальная часть
Выделение почвенных дрожжей производилось чашечным методом, путем высева на различные питательные среды. Рецепт среды см. в приложении.
Проба №1 – почва с полевая (не посевная).
Проба №2 – почва лесная.
Проба №3 – почва садовая (парк АГТУ).
Проба №4 – почва с луговая (заливная).
Проба №5 – почва из грибницы шампиньона.
При исследовании проб выявлена следующая закономерность: В пробах
под номерами 1, 3
и 4
не было обнаружено дрожжей.
Вероятно это можно объяснить тем, что эти почвы бедны легко доступными элементами питания. На этих почвах очень маленькая растительность, а как нам уже известно в основном они попадают в почв с растительным опадом. Почва не является для них истинным местом обитания, а лишь «ловушкой», местом сохранения или постепенного отмирания.
В пробе №2
на среде Сабуро была обнаружена колония дрожжей со следующими культуральными признаками: круглая, слизистая, с валиков по краю, оранжевого цвета, профиль выпуклый, пигмент в агар не выделяет. Микроскопия: крупные, округлые делящиеся клетки, находящиеся в скоплении, одноклеточного мицелия не образуют. С помощью ключа для определения родов дрожжей предполагается, что данная колония относится к роду Schizosaccharomyces.
На глюкозо-пептонной среде этой же пробы была выделена колония другого рода дрожжей. Культуральные признаки: круглая, бархатистая колония, врастающая в агар, зеленовато-голубого цвета с белым кантом. Микроскопия: крупные клетки образуют мицелий, почкующиеся клетки отсутствуют. С помощью ключа для определения родов дрожжей предположительно установлено, что они относится к роду Galactomyces.
Результаты исследований свидетельствуют, что разлагающиеся растительные остатки: опад, лесные подстилки, отмершие части мхов, торф - представляют собой типичные места обитания многих видов дрожжей. Свежий растительный опад, состоящий из листьев растений, сохраняющих анатомическое строение, практически всегда содержит дрожжи в количестве не меньшем, чем на надземных частях растений. В некоторых случаях численность дрожжей в опаде даже выше, чем на живых частях растений. Плотность заселения дрожжами растительного опада в значительной степени определяется количеством дрожжевых клеток изначально присутствовавших на листьях растений (Максимова, Чернов, 2004.)
С повышением степени разложенности растительных остатков средняя численность дрожжей убывает. В образцах нижних слоев лесной подстилки, перегнойных горизонтах почв дрожжи обнаруживаются далеко не всегда, и численность их может снижаться.
Проба №5
Таблица 1.
Характеристика выделенных культур на среде Сабуро
| Культуральные свойства |
Морфологические свойства |
| Персикового цвета, округлая, блестящая не прозрачная, слизистая, гладкая колония, профиль выпуклый, пигмент в агар не выделяет. |
Овальные, круглые иногда удлиненные клетки, почкование многостороннее, формируют примитивный псевдомицелий.
Saccharomyces
|
| Насыщенно розового цвета, округлая, слизистая, гладкая, не прозрачная колония, профиль выпуклый, пигмент в агар не выделяет. |
Округлые клетки, размножающиеся делением, одноклеточные, мицелий не образуют.
Schizosaccharomyces
|
| Светло-оранжевого цвета, округлая, слизистая, не прозрачная, гладкая колония, профиль выпуклый, пигмент в агар не выделяет. |
Клетки круглые, овальные или удлиненные, яйцевидные. Размножение истинным почкование. Формируют истинный септированный мицелий.
Candida
|
При исследовании пробы под №5 было выяснено, что в ней находится максимальное количество дрожжей. Основная масса, которых представлена следующими родами Saccharomyces, Schizosaccharomyces, Candida.
Результат исследований показывает, что надземные части растений почти заселены эпифитными микроорганизмами, среди которых значительную часть составляют дрожжи. Эти дрожжи - не паразиты растений, а симбионты. Единственный источник питания таких дрожжей – прижизненные выделения растений, в состав которых входят глюкоза, фруктоза, сахароза и различные органические кислоты. Известно, что земля грибницы шампиньона имеет слабо-кислую реакцию среды (рН=5.8-6), влажность составляет около 75%. Также грибница богата легко доступными элементами питания (http://www.ss.msu.ru/soilyeasts/PicsList.htm). В ответ дрожжи выделяют различные ростовые вещества, в числе которых витамины, аминокислоты, органические кислоты, ферменты.
Скорость роста маточных культур исследовалась на основе картофельного агара с добавлением культуральных жидкостей из исследуемых образцов:
Образец № 1 – Candida
Образец № 2 – Saccharomysec
Образец № 3 – Galactomyces
Образец № 4 –Saccharomysec
Образец № 5 – Schizosaccharomyces
Интенсивный рост отмечен на среде с добавление культуральной жидкости родов Candida и Saccharomysec (2,4).
Шампиньон 2
Результаты показали, что гриб растет быстрее с культуральной жидкостью дрожжей чем без неё, наибольший показатель роста был установлен с экстрактами образцов № 1,4,5.
Огневка
Результаты показали, что гриб растет быстрее с культуральной жидкостью дрожжей чем без неё, наибольший показатель роста был установлен с экстрактами образцов № 1,2,4.
Вешенка (
Sylvan
)
Результаты показали, что гриб растет быстрее с культуральной жидкостью дрожжей чем без неё, наибольший показатель роста был установлен с экстрактами образцов № 1,4,.
Зонтик
Результаты показали, что гриб растет быстрее с культуральной жидкостью дрожжей чем без неё, наибольший показатель роста был установлен с экстрактами образцов № 2,3,5.
Валуй
Результаты показали, что гриб растет быстрее с культуральной жидкостью дрожжей чем без неё, наибольший показатель роста был установлен с экстрактами образцов № 1,2.
Шампиньон 1
Результаты показали, что гриб растет быстрее с культуральной жидкостью дрожжей чем без неё, наибольший показатель роста был установлен с экстрактами всех образцов.
По данным характеризующих скорость роста исследуемых маточных культур на картофельном агаре с добавлением культуральной жидкости дрожжей установлено, что лучшие показатели скорости роста у шампиньона 2 и шампиньона 1. Мицелий исследуемых культур более плотный, чем на средах без добавления культуральной жидкости дрожжей. Это можно объяснить тем, что культуральная жидкость содержит рибофлавин являющийся как каталализатором для оптимального роста грибов.
Выводы
1. В ходе проведения экспериментальных исследований различных проб почв на наличие почвенных дрожжей установлено, что видовое разнообразие дрожжей в зависимости от различных условий окружающей среды может изменяться.
2. В результате постановки опыта выделены чистые культуры почвенных дрожжей: Schizosaccharomyces, Galactomyces, Candida, Saccharomyces.
3. Интенсивность роста маточных культур базадиальных грибов на картофельной среде с добавлением культуральной жидкости дрожжей располагаются по убыванию:
Candida → Saccharomyces (2) → Saccharomyces (4) → Schizosaccharomyces → Galactomyces.
Список литературы:
1. http://www.ss.msu.ru/soilyeasts/PicsList.htm
2. Бабьева И.П., Чернов И.Ю. Биология дрожжей. – М.: Товарищество научных изданий КМК. 2004г., 221с.
3. Бабьева И.П., Зенова Г.М. Биология почв. - М.: Изд-во МГУ. - 1989 г., 336с.
4. Зенова Г.М., Степанов А. Л., Лихачева А.А., Манучарова Н.А. Практикум по биологии почв.- М: МГУ, 2002. – 120с.
5. Т.Ф. Черняковская, Т.Г. Добровольская и т.д. Микробиология, Экспериментальные статьи, 2004, том 73, №4, с.576-570.
6. Мишустин Е.Н. Микроорганизмы и продуктивность земледелия. – М: Наука, 1972. – 342c.
7. Теппер Е.З. и др. Практикум по микробиологии / Шильникова В. К., Переверзева Г.И. - М.: Агропромиздат., 1994. - 233 с.
8. Бери Д. Биология дрожжей. – М.:Мир.,1985.
9. Кудрявцев В.И. Систематика дрожжей. – М.: изд-во АН СССР., 1954.
Приложение
Среды
Мясопептонный агар (МПА)
К 1 л МПБ добавляют 15–20 г агара. Среду нагревают до растворения агара (температура его плавления – 100°С, затвердевания – 40 °С), устанавливают слабощелочную реакцию среды 20%-ным раствором Nа2
СО3
и через воронку разливают в пробирки (приблизительно по 10 мл агара столбиком для последующего разлива по чашкам Петри и по 5 мл для получения скошенного агара – косяков).
При разливе агара необходимо следить за тем, чтобы края пробирок оставались сухими, иначе пробки прилипнут к стеклу. Пробирки со средой стерилизуют в автоклаве при 120 °С 20 мин.
Глюкозо-пептонная:
| Состав среды |
Количество компонентов, в г |
рН среды |
| Глюкоза |
40 |
4-4,5 |
| Пептон |
10 |
| Агар |
20 |
| Дрожжевой экстракт |
4 |
| Вода |
1000 |
Стерилизовать при 0,5 атмосфере.
Глюкозо-аммонийная:
| Состав среды |
Количество компонентов, в г |
рН среды |
| Глюкоза |
20 |
4-4,5 |
| (NH4
)2
SO4
|
5 |
| KH2
PO4
|
1,95 |
| K2
HPO4
|
0,15 |
| MgSO4
|
0,5 |
| NaCL |
0,1 |
| CaCL2
|
0,1 |
| Агар |
20 |
| Вода |
1000 |
Стерилизовать при 0,5 атмосфере.
Эшби с сахарозой:
| Состав среды |
Количество компонентов, в г |
рН среды |
| Глюкоза |
20 |
4-4,5 |
| K2
HPO4
|
0,2 |
| MgSO4
*7H2
O |
0,2 |
| NaCL |
0,2 |
| K2
SO4
|
0,1 |
| CaCO3
|
5 |
| Вода |
1000 |
Стерилизовать при 0,5 атмосфере.
Сабуро
| Состав среды |
Количество компонентов, в г |
рН среды |
| Глюкоза |
40 |
4-4,5 |
| Пептон |
10 |
| Агар |
18 |
| Вода |
1000 |
Стерилизовать при 0,5 атмосфере
Стерильная вода
Дистиллированную воду разлить по пробиркам по 10 мл. Стерилизовать при 1 атм. 20 мин.
Картофельный агар (г/л):
1.очищенные и измельченные клубни картофеля - 200 г
2.глюкоза-10 г
3.агар-агар -15-20 г (или агароид 35-40г)
4.вода - 1 л
5.пивные дрожжи - 2 г (необязательно)
Для приготовления картофельно-глюкозной среды клубни картофеля, очищенные, обмытые инарезанные ломтиками, отваривают в 1 л воды до готовности (30 мин), отвар фильтруют, объемфильтрата доводят до 1 л. Добавляют глюкозу, агар-агар. Среду нагревают до полного расплавленияагар-агара.
|