Картирование сложно наследуемых признаков человека
Введение
За последние несколько лет генетика человека достигла значительных успехов. Конечно, еще с момента переоткрытия законов Менделя было очевидно, что человек подчиняется тем же законам наследственности, что и другие организмы. Более того, именно анализ наследования семейных заболеваний убедительно свидетельствовал в пользу менделизма. Однако, несмотря на это многообещающее начало, генетика человека намного отстала от частной генетики таких организмов, как дрозофила и кукуруза, по двум главным причинам. Во-первых, люди не лабораторные животные, с которыми можно проводить скрещивания, адекватные целям эксперимента, и, во-вторых, обнаружено лишь небольшое число генетических маркеров, степень гетерозиготности по которым, позволяла рассматривать встречающиеся в естественной популяции браки как информативные для анализа сцепления.
Разработка метода рекомбинантных ДНК явилась импульсом для развития генетики человека. Было высказано предположение, что генетический полиморфизм на уровне последовательностей ДНК, который можно легко наблюдать на примере полиморфизма длины рестрикционных фрагментов, – достаточно частое явление и соответствующие аллельные варианты могут использоваться как генетические маркеры, позволяющие проводить систематическое изучение наследственности человека, включая построение полной картины его генома.
На сегодняшний день известно более 2500 ПДРФ-маркеров. Анализ некоторых из них в родословных с больными выявил ПДРФ-маркеры, проявляющие тесное генетическое сцепление с мышечной дистрофией Дюшенна, болезнью Гентингтона, муковисцидозом 7–10, поликистозом почек у взрослых, ретинобластомой 12, ранней семейной формой болезни Альцгеймера, биполярным аффективным психозом в большой родословной амишей, нейрофиброматозом Реклингаузена, множественной эндокринной неоплазией типа 2А и семейным полипозом. Более того, значительный прогресс в построении генетической карты человека обещает сделать процесс поиска сцеплений более эффективным за счет замены случайного выбора ПДРФ систематическим анализом всех ПДРФ, диспергированных по геному человека.
Достигнутые успехи убеждают нас в том, что для любого заболевания человека может быть найден сцепленный с ним ПДРФ-маркер при условии, что это заболевание:
1) наследуется как простой менделеевский признак – рецессивный или доминантный;
2) возникает вследствие мутации в уникальном генном локусе;
3) достаточно распространено, чтобы можно было собрать необходимое количество семей с несколькими пораженными.
К сожалению, очень многие из интересующих нас наследственных признаков человека обусловлены генетическими причинами, менее подходящими для такого анализа. Затруднения заключаются в следующем:
1) неполная пенетрантность, вследствие которой не все индивиды – носители мутантного генотипа, проявляют фенотип, отличный от нормы;
2) фенокопии, вследствие которых индивиды с нормальным генотипом могут проявить мутантный фенотип по причинам негенетического характера;
3) генетическая гетерогенность, благодаря которой мутации по нескольким различным генетическим локусам могут дать вполне сходную клиническую картину;
4) генные взаимодействия, вследствие которых фенотип является результатом функционирования аллелей нескольких локусов;
5) редкость заболевания, которая может затруднить или сделать невозможным анализ семей с несколькими больными индивидами.
Эти проблемы обычны при анализе таких хорошоизученных объектов, как бактерии, дрожжи, нематоды и плодовые мушки. По-видимому, и человек в этом отношении не является исключением. Чтобы преодолеть указанные трудности, генетики обычно работают с чистыми линиями, несущими мутацию по единичному локусу, культивируя огромное количество особей в контролируемых условиях и проводя целенаправленные скрещивания. В генетике человека приходится, однако, анализировать уже имеющиеся браки.
В этой работе мы даем обзор основных принципов, на основе которых планируется изучение генетического сцепления у человека в случаях, когда возникают указанные осложнения. Акцент будет сделан на практических вопросах отбора семей с целью максимизации вероятности обнаружения сцепления. Мы не будем подробно останавливаться на вычислительных и чисто алгебраических аспектах такого анализа. Необходимо заметить, что оптимальное планирование анализа сцепления существенно зависит от точности модели наследования заболевания, а это не часто бывает известно заранее. Если генетика в действительности очень сложна, анализ сцепления явно будет неуспешным. Поэтому выбор плана зависит в определенной степени от знания возможных осложнений. Заметим, что точное планирование значительно увеличивает мощь анализа сцепления при изучении заболеваний со сложным типом наследования.
1. Основы анализа сцепления
Основы анализа генетического сцепления достаточно полно изложены в работе Отта. Мы лишь суммируем здесь основные понятия анализа правдоподобия.
Предположим, что мы хотим сравнить рабочую гипотезу Н с альтернативной «нулевой» гипотезой Но. Гипотеза Н, к примеру, может утверждать, что локус ПДРФ сцеплен с заболеванием с 10%-ной частотой рекомбинаций, в то же время по гипотезе. Но сцепление может вовсе отрицаться. После сбора семейных данных мы подсчитываем две вероятности: Р – вероятность того, что наблюдаемые данные не противоречат основной гипотезе Н, когда она истинная, и Ро-вероятность того, что те же данные могли иметь место, когда верна гипотеза Но. По отношению Р / Ро можно судить о том, насколько более вероятно появление наблюдаемых данных при условии истинности Н, чем при условии истинности Но – Если это отношение превосходит какой-нибудь достаточно большой порог Т, мы отвергаем Но в пользу гипотезы Н.
По соглашению, в генетике человека предпочитают использовать десятичные логарифмы отношений вероятностей, именуемые лод-баллами. Отношения вероятностей для независимых выборок могут быть объединены путем перемножения, и, таким образом, лод-баллы, полученные по независимым выборкам, могут просто суммироваться.
При планировании анализа возникают два вопроса.
1. Порог: какой должна быть величина порога Т, чтобы снизить до приемлемой величины ошибочно отвергнуть нулевую гипотезу Н0
, в случае, когда она в действительности верна?
2. Необходимая величина выборки: как велика должна быть выборка для того, чтобы можно было с большой достоверностью принять гипотезу Н в случае, когда она действительно верна?
В генетике человека принятая величина порога для единичного наблюдения сцепления соответствует отношению шансов не меньше чем 1000:1 и значению лод-балла 3,0. Этот порог не такой строгий, как может показаться. Два случайным образом выбранных локуса в геноме человека, вероятнее всего, располагаются в разных хромосомах или в разных хромосомных плечах, если речь идет об одной хромосоме. При грубой оценке имеется шансов 50:1 против сцепления. Даже если, согласно наблюдаемым данным, вероятность сцепления в 1000 раз превышает вероятность его отсутствия, тот факт, что в общем случае отсутствие сцепления в 50 раз более правдоподобно, чем его наличие, означает, что лод-балл, равный 3, соответствует истинной величине отношения шансов за сцепление только 20:1. Другими словами, при значении лод-балла, равном 3, в одном из 20 случаев может быть ложный результат. При величине лод-балла, равной 4, результат за наличие сцепления будет фиктивным в одном случае из 200.
Необходимый размер выборки может быть установлен подсчетом ожидаемого вклада каждой семьи в общую сумму лод-баллов. При заданной структуре семьи подсчитывается «ожидаемое значение лод-балла», или ELOD. Необходимо набрать достаточное количество семей, чтобы сумма ожидаемых лод-баллов значительно превысила порог, требуемый для принятия гипотезы о наличии сцепления.
Сила метода правдоподобия – в его гибкости. При наличии генных взаимодействий, к примеру, можно проверить гипотезу, согласно которой для проявления болезни необходимо наличие мутаций одновременно по обоим локусам. В случае же с генетической гетерогенностью можно проверить гипотезу о том, что для проявления заболевания достаточно мутации по любому из двух локусов. В данной ситуации это означает, что в каждой семье будет наблюдаться сцепление только с одним из двух локусов.
2. Карта генетического сцепления генома человека
Генетика человека существенно продвинется вперед с появлением полной карты сцепления. Такая карта будет состоять из маркеров ПДРФ, равномерно разбросанных по всем хромосомам, покрывая в целом около 3300 сантиморганид.
За последние несколько лет в этом направлении был сделан значительный шаг вперед. В конце 1987 г. Донис-Келлер сообщил о построении карты для 403 локусов генома человека, распределенных по всем группам сцепления соответственно числу хромосом. В это же время Уайт распространил буклеты, содержащие 255-локусную карту, с группами сцепления, охватывающими 17 из 23 хромосом. Так как перекрывание между наборами маркеров, изученными в этих двух группах, невелико, возможно построение 600-локусной суммарной карты. Учитывая, что в настоящее время этими и другими группами исследователей картируется множество дополнительных ПДРФ-маркеров, представляется вполне реальным, что вскоре в нашем распоряжении окажется карта для более чем 1000 ПДРФ. Эта карта будет иметь в среднем по одному маркеру на каждые 3 см.
Такая плотная карта ПДРФ-маркеров чрезвычайно удобна для анализа человеческого генома.
1. Все без исключения семьи оказываются полностью информативными для анализа сцепления.Когда в анализе сцепления используются случайные и некартированные ПДРФ-маркеры, мейозы, происходящие у индивидов, гомозиготных по одному из них, не являются информативными для анализа сцепления ПДРФ-маркера с интересующим нас заболеванием. Наличие плотной карты позволяет, однако, выбирать в любом районе несколько близко расположенных ПДРФ таким образом, чтобы все индивиды были заведомо гетерозиготными хотя бы по одному из них. Получение такой информации позволяет осуществить анализ полилокусного сцепления с помощью компьютера.
2. Наследование локуса, ответственного за заболевание, можно проследить более строго, используя фланкирующие маркеры.Бели между маркерами, расположенными по обе стороны от предполагаемого локуса, ответственного за болезнь, рекомбинация не наблюдается, можно быть уверенным, что данный локус, расположенный между ними, наследовался совместно с этими маркерами. В действительности, в генетике давно уже считается, что анализ по таким тройным перекрестам много точнее, чем по двойным. Повышенная точность упрощает процедуру принятия или отклонения гипотезы, и таким образом, уменьшает необходимое для анализа количество семей.
3. Можно одновременно проследить наследование нескольких разных районов генома. Это позволяет установить сцепление в случае генетической гетерогенности заболевания.
Нам представляется, что в будущем анализ сцепления первоначально будет основан на использовании стандартного набора приблизительно 150–200 высокоинформативных ПДРФ-маркеров, распределенных по всему генному, с интервалом около 15–20 см. После того как все изучаемые родословные окажутся генотипировэнными по каждому маркерному локусу, будет проведен компьютерный анализ, тестирующий каждый такой участок на наличие шансов за сцепление. Любой фрагмент, предположительно сцепленный с изучаемым признаком, будет изучен затем более подробно с использованием плотной карты ПДРФ, например с плотностью один маркер на каждые 3 см. Это позволит извлечь всю информацию, заключенную в родословной, и увеличит величину лод-балла. Естественно, при планировании такого анализа вполне уместен вопрос: сколько семей необходимо, чтобы при наличии редкой карты ПДРФ уловить хотя бы намек на сцепление, а для плотной карты ПДРФ иметь возможность доказать с определенностью наличие сцепления?
3. Планирование анализа сцепления для болезней с простым типом наследования
Под простым типом наследования мы понимаем, что болезнь: 1) наследуется как классический менделеевский доминантный или рецессивный признак, проявляющий полную пенетрантность, и 2) вызвана мутациями в одном локусе. Данные точных эпидемиологических исследований заболевания обычно дают основания судить о том, справедливо первое условие или нет. В противоположность этому второе условие обычно следует принимать на веру: не существует такого мощного метода для доказательства того, что мутации по одному локусу являются причиной данного заболевания, и в то же время существует много поводов усомниться в этом. Но к данному вопросу мы вернемся позже, при обсуждении генетической гетерогенности.
Болезнь Гентингтона и муковисцидоз являются яркими примерами признаков с доминантным и рецессивным типом наследования, соответственно. Оказывается, что в обоих случаях болезнь – следствие мутаций единичного локуса.
Для заболевания с простым типом наследования относительно легко построить карту сцепления. Рассчитав сумму ELOD-баллов, можно прямо оценить требуемую величину выборки. На рис. А, Б показано число ядерных семей с двумя или тремя пораженными, которое требуется, чтобы гарантировать 50%-ную вероятность успеха при картировании доминантного или рецессивного признака. Это число является функцией плотности расположения используемых ПДРФ-маркеров. Рисунок демонстрирует количество семей, необходимое 1) в случае, когда несколько маркеров рестрикционного полиморфизма используются по отдельности, и 2) если задействован весь потенциал карты ПДРФ, т.е. используются фланкирующие маркеры. Как следует из рис. 1, необходимое количество семей вполне эффективно при наличии геномной карты ПДРФ, отстоящих друг от друга на расстоянии 20–30 см.
Далее мы рассмотрим признаки с более сложным типом наследования и обсудим проблемы, возникающие при их картировании с помощью анализа сцепления, и пути их преодоления.
4. Осложнения: неполная пенетрантность и ошибки клинической диагностики
Генетический признак, для проявления которого необходимы дополнительные факторы, проявляет неполную пенетрантность. Эти факторы могут включать в себя условия окружающей среды, генетическое предрасположение, а также случайность. Простой пример – ретинобластома, при которой у индивидов, наследующих одну дефектную копию рецессивного онкогена, развивается рак, если вторая копия инактивирована событиями в соматических клетках; это случайное событие встречается достаточно часто, поэтому пенетрантность высока. В семьях с наследственными формами болезни Альцгеймера заболевание может не проявить полную пенетрантность попросту из-за того, что некоторые пораженные погибнут по другим причинам, так и не проявив симптомов. Синдром Вернике – Корсакова вызван, по-видимому, мутацией, приводящей к более слабому по сравнению с нормой присоединению транскетолазой тиаминпирофосфата, однако клинический фенотип проявляется только у больных, предпочитающих диету, обедненную тиамином; таким образом, степень пенетрантности может широко варьировать в зависимости от условий окружающей среды и точности определения фенотипа. Многие заболевания, такие, как наследственные формы маниакально-депрессивного психоза, проявляют неполную пенетрантность по неизвестным причинам.

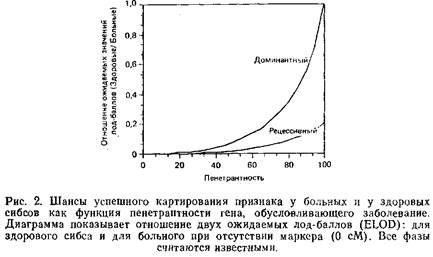
В случае болезни, наследуемой как доминантный признак с полной пенетрантностью, здоровые дети от брака с одним больным родителем так же информативны, как и больные дети: в обоих случаях мы точно знаем, какой аллель локуса, ответственного за заболевание, был унаследован каждым из них. Однако, когда пенетрантность неполная, генотип здорового потомка от больного родителя всегда неоднозначен. Неудивительно, что и анализ наследуемых ими маркеров мало что может дать в этом отношении, поскольку мы не знаем точно, унаследовали они мутантный аллель или нет. Рис. 2 показывает, как быстро уменьшается величина суммарного лод-балла с уменьшением степени пенетрантности.
Проблема неопределенности генотипа здорового индивида возникает и в случае рецессивного признака при полной пенетрантности: существуют три возможных генотипа для группы здоровых сибсов, но только один – для группы больных. Для тесно сцепленного маркера отношение шансов будет 1: в случае здоровых сибсов и 1: в случае больных, что делает вклад в суммарный лод-балл от больных членов в 5 раз меньшим, чем у здоровых. Неполная пенетрантность только усложняет ситуацию.
Оценивая информативность семьи для анализа сцепления, необходимо обратить внимание на количество мейозов, порождающих появление больных индивидов. Сбор данных по здоровым сибсам не приведет к ошибке, но необходимо ясно представлять, что польза от этих данных для идентификации локуса, ответственного за болезнь, относительно невелика, кроме случаев доминантности с полной пенетрантностью.
Следует учесть, что неполная пенетрантность ^заметно осложняет анализ сцепления. Если в проверяемую на сцепление модель не заложена соответствующая степень неполноты пенетрантности, тогда истинное сцепление может быть полностью просмотрено: здоровые индивиды окажутся рекомбинантами. Чтобы исключить сцепление данной болезни с каким-либо районом, необходимо провести специальный анализ, принимая степень пенетрантности очень низкой. Величина суммарного лод-балла при этом будет отражать информацию, полученную от больных индивидов.
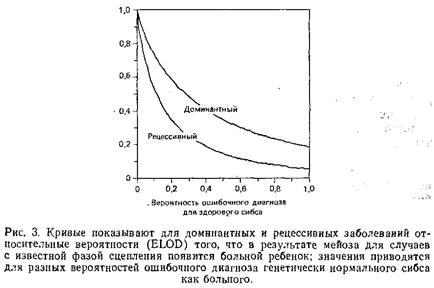
Обратным по отношению к проблеме неполной пенетрантности является вопрос о возможности ошибочной диагностики болезни у здоровых индивидов. В то время как неполная пенетрантность определяет неоднозначность генотипа здорового индивида и тем самым снижает его ценность в анализе сцепления, возможность неправильного диагноза означает, что и генотипы больных индивидов также должны рассматриваться как неоднозначные. Ошибочный диагноз маловероятен для таких явных заболеваний, как муковисцидоз, но представляет серьезную проблему при анализе психических нарушений. В диагностические критерии для этих заболеваний включено огромное количество поведенческих реакций, а наличие других больных в этой семье зачастую рассматривается как подтверждение диагноза. Используя рис. 3, можно оценить влияние данного уровня ошибок диагностики на анализ сцепления. Так как неправильная диагностика может серьезно отразиться на анализе сцепления, лучший выход из положения – приписывать всякому индивиду, диагноз которого сомнителен, «неизвестный фенотип». Только после обнаружения сцепления можно вернуться к таким индивидам и выяснить, унаследовали ли они генотип больного. Только таким путем можно узнать, являются ли неоднозначные симптомы проявлением исследуемого заболевания.
5. Осложнения: генетическая гетерогенность и фенокопии
Самым серьезным препятствием при изучении сцепления является генетическая гетерогенность, связанная с тем фактом, что мутации в разных локусах приводят к одномуфенотипу. Классические примеры генетической гетерогенности для низших организмов – прерывание автономного биохимического пути на любой из его стадий и потеря или нарушение гетеромультимерного белкового комплекса вследствие мутаций в структурном гене любой из его субъединиц. Несложно представить и другие возможные причины гетерогенности. Ими могут быть мутации регуляторных генов или посттрансляционные модификации. Хотя у низших организмов генетическая гетерогенность фенотипов является правилом, это не приводит к серьезным осложнениям, поскольку генетик всегда может поставить комплементационное скрещивание для проверки аллельности мутаций.
Феномен генетической гетерогенности у человека изучен в меньшей степени, однако нет оснований полагать, что в данном случае он более редок. К примеру, выяснилось, что наследственная метгемоглобинемия, которая ранее рассматривалась в клиническом отношении как однородная, может быть вызвана мутациями как альфа-, так и бета-цепей гемоглобина или даже мутациями NADH-дегидрогеназы. Эллиптоцитоз и болезнь Шарко-Мари-Туса оказались гетерогенными, поскольку в обоих случаях тесное сцепление, наблюдаемое в одних больших родословных, полностью отсутствовало в других. Сходная картина обнаружена и при изучении наследования маниакально-депрессивного психоза в большой родословной религиозной общины амишей, в которой было выявлено сцепление этого заболевания с одним из сегментов хромосомы Пр. В других больших родословных подобное сцепление не было обнаружено. По-видимому, пигментная ксеродерма и синдром Луи-Бар генетически гетерогенны, поскольку опыты invitro на клеточных экстрактах выявили соответственно девять и пять групп комплементации. Некоторые браки дают возможность исследовать комплементацию и у человека. Так, семьи, в которых оба родителя страдают альбинизмом, а все их дети – здоровые, демонстрируют генетическую гетерогенность альбинизма, на что ранее указывали фенотипические различия и популяционная генетика. Сходные данные предполагают гетерогенную природу врожденной глухоты.
Гетерогенность – это настоящий кошмар для генетика, поскольку в разных семьях можно найти свидетельства как в пользу сцепления, так и против него. Даже небольшая степень гетерогенности может сказаться на стандартном лод-балле, приводя к отрицательным значениям, даже если маркер тесно сцеплен с одним из локусов, контролирующих признак.
Возможное разрешение затруднений, вызванных гетерогенностью, состоит в следующем.
1. Дифференциация клинических форм заболевания. Наилучший способ преодолеть генетическую гетерогенность – это выявить клинический признак, по которому различные генетические формы четко отличаются: исследование одного гетерогенного нарушения сводится тогда к изучению двух или более гомогенных нарушений. Так, к примеру, клинические фенотипы были использованы для выявления двух форм нейрофиброматоза, которые по данным недавних исследований картируются в различных локусах.
К сожалению, пока нет единого правила, позволяющего безошибочно дифференцировать различные формы генетического заболевания. Клиническая картина заболевания может значительно варьировать вследствие как минимум трех причин:
а) единичная мутация в единственном локусе может экспрессироваться различным образом под влиянием несцепленного генетического локуса, выполняющего роль модификатора окружающей среды или в силу простой случайности;
б) различные мутации в одном локусе могут нарушить одну и ту же биохимическую функцию, но по-разному или с разной степенью, как это имеет место в случае мышечной дистрофии Бекера, которая вызвана менее тяжелыми по своему проявлению аллелями гена мышечной дистрофии Дюшенна;
в) заболевание может быть вызвано мутациями в нескольких разных локусах.
Такие явления носят соответственно названия: эффект фона, аллельная гетерогенность, генетическая гетерогенность.
Другими словами, болезнь может быть клинически гетерогенна, даже если она не является гетерогенной генетически, обратное утверждение тоже верно. Для того чтобы рассматривать клинические различия как полезный генетический инструмент, необходимо показать сначала, что все члены данной семьи попадают в один фенотипический подкласс. К примеру, естественным кандидатом для анализа на дифференциацию генетической картины психического нарушения был бы признак восприимчивости к определенному лекарству. К сожалению, лишь немногие исследователи изучали склонность больных индивидов из одной семьи сходным образом реагировать на лекарства.
Дифференциация фенотипов – ключевой момент в медицинской генетике. Однако следует также полагаться на интуицию, ведь нельзя с уверенностью утверждать, что картина заболевания полностью ясна.
2. Изучение отдельной большой родословной. Другой подход, позволяющий избежать осложнений, вызванных генетической гетерогенностью, – это работа с отдельной родословной, достаточно большой для проведения анализа сцепления. К примеру, Гузелла проанализировал одну обширную родословную из Венесуэлы, в которой сегрегировала хорея Гентингтона. Хотя дальнейшие исследования сцепления показали, что люди, страдающие этой болезнью, составляют генетически гомогенную группу, этот факт все же нельзя было заранее предсказать. При исследовании большой родословной в религиозной общине амишей Эгланд продемонстрировал расщепление по наследуемой форме I маниакально-депрессивного психоза. Кроме того, обнаружено сцепление с ПДРФ-маркером на хромосоме Пр. Анализ нескольких других больших родословных не выявил сцепления с этим районом и доказал таким образом наличие гетерогенности.
В подходе, использующем большие родословные, существуют некоторые недостатки:
а) для большинства доминантных и почти для всех рецессивных заболеваний просто невозможно найти достаточно большой родословной;
б) попытка «расширить» родословную путем выявления как можно большего количества больных может на самом деле привнести гетерогенность в случаях широко распространенных мультификаториальных заболеваний, таких, как маниакально-депрессивный психоз, ишемическая болезнь сердца и др. При сборке таких родословных из большой смешанной популяции, каковой является население США, возникает вероятность того, что в разных частях одной и той же родословной будут сегрегировать аллели или локусы, ответственные за разные заболевания. С позиций анализа сцепления такая внутрисемейная гетерогенность еще хуже, чем гетерогенность межсемейная;
в) даже если подход, основанный на анализе больших родословных, увенчается успехом, сделанный вывод нельзя переносить на общую популяцию.
Чтобы выяснить, имеют ли полученные данные общее значение, необходимы дальнейшие интенсивные исследования на многих других семьях. Действительно, сцепление между маниакально-депрессивным психозом и маркерами на хромосоме lip, выявленное в большой родословной амишей, надо доказать на примере других родословных. Предположительно это может быть очень редкая форма МДП. Несмотря на эти ограничения, подход с использованием больших родословных может быть достаточно полезным, особенно для относительно редких заболеваний.
3. Изучение отдельного географического района. Аналогичный подход, позволяющий избежать эффекта генетической гетерогенности, заключается в проведении исследований в изолированной общине. Заболевания, которые в смешанной популяции, такой, как США, являются гетерогенными, в изолированной группе скорее всего будут обусловлены уникальной мутацией.
4. Симультанный скрининг генома с использованием малых семей. Доступность полной карты сцепления ПДРФ человеческого генома делает возможным выявить сцепление, даже если в изучаемой популяции сегрегирует более чем один локус. Этот недавно разработанный метод, известный как симультанный скрининг, подводит к естественному обобщению стандартного метода картирования сцепления.
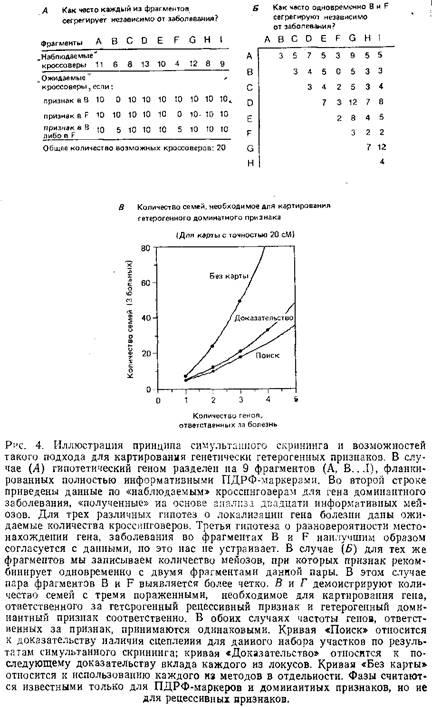
После приготовления препаратов ДНК отобранных семей проводится анализ ПДРФ-маркеров, охватывающих весь геном. Если для всех семей один и тот же фрагмент генома окажется тесно сцепленным с исследуемым заболеванием, картирование на этом будет закончено. Если сцепление не будет обнаружено ни с одним из фрагментов генома, следует проверять все пары фрагментов с целью найти такую их пару А и В, для которой в каждой семье наблюдается тесное сцепление признака либо с фрагментом А, либо с фрагментом В. Если болезнь связана с мутациями в одном из двух локусов, то правильным образом выбранная пара будет обладать указанным свойством.
Для вычисления лод-баллов по любой из пар фрагментов А и В необходимо подсчитать: 1) вероятность появления заболевания для случая, когда оно обусловлено мутациями как по локусу из фрагмента А, так и по локусу из фрагмента В и 2) вероятность появления заболевания в случае, когда оба фрагмента А и В не сцеплены с заболеванием. Смысл состоит в том, что легче выявить пару участков, по которым идет расщепление во всех семьях, чем выделить единичный участок, объясняющий сегрегацию только в половине семей.
Важная проблема – это выбор удовлетворительного порога для принятия наличия сцепления. Так как рассматривается много различных гипотез, вероятность того, что apriori каждая данная гипотеза верна, уменьшается, поэтому обычный порог 3,0 должен быть увеличен в случаях, когда анализируют одновременно два интервала. Ландер и Ботштейн рассмотрели этот математический вопрос и подсчитали количество семей, необходимое для выявления сцепления с доминантным или рецессивным гетерогенным признаком для семей, различных по величине. Основная идея сделанного ими вывода: необходимо отбирать семьи с количеством больных в одном поколении не меньше трех, а в случае с доминантным признаком также и с одним больным родителем.
Метод симультанного скрининга может быть использован не только для поиска локусов, как в приведенном выше примере, но и для проверки ранее установленных другими методами локусов-кандидатов, с той лишь разницей, что для группы порог требуется меньший, чем для начального выявления единичного локуса. Для некоторых гетерогенных заболеваний сцепление с различными локусэми может быть первоначально установлено традиционным анализом на сцепление, проводимым в больших родословных. Чтобы решить вопрос о достаточности только этих локусов для объяснения ситуации с данным заболеванием, необходимо, используя метод симультанного скрининга, исследовать малые семьи для достижения суммарного лод-балла, равного 3,0.
Заметим, что, хотя генетическая гетерогенность может свести на нет усилия традиционного анализа сцепления, она не выявляется даже сегрегационным анализом: сколько бы разных локусов ни участвовало в проявлении рецессивного признака, в каждой семье ожидаемое менделевское расщепление равно 3:1.
С проблемой гетерогенности тесно связано явление фенокопий. О фенокопии говорят, когда негенетическая причина сказывается на проявлении фенотипа, характерного для наследственного заболевания. К примеру, гомозиготность по мутантному аллелю гена i-антитрипсина часто вызывает легочную эмфизему, но более частой причиной такого фенотипа в общей популяции является курение.
Фенокопии сказываются на анализе сцепления таким же образом, как и гетерогенность: наряду с семьями, в которых выявляется сцепление с маркером, обнаруживаются семьи, в которых расщепление затрагивает разные локусы. В случае независимости возникновения фенокопии в общей популяции можно повысить генетическую информативность семей, введя требование о большем количестве содержащихся в них больных индивидов. Так, генетическая этиология более вероятна для семьи, где пять близких родственников болеют раком молочной железы, нежели для семьи, где больных всего двое. Однако этот аргумент теряет значение, если фенокопии появляются в семейных кластерах, к примеру, вследствие сходных условий проживания. В этом случае необходимо попытаться собрать однородную выборку семей, в которых сегрегирует генетическая ферма этого заболевания, и анализировать ее на основе стратегии, описанной выше для генетической гетерогенности. Если предполагаются и генетическая гетерогенность, и фенокопии, симультанный скрининг может быть модифицирован с учетом коррекции на долю «несцепленных» семей.
В любом случае слишком большая доля фенокопии в выборке значительно затруднит всякую попытку найти сцепление.
6.
Осложнения: генетические взаимодействия
Некоторые признаки являются результатом генетического взаимодействия аллелей более чем одного локуса. Среди низших организмов это подтверждается множеством фактов, чего не скажешь о человеке. К примеру, известно, что проявление талассемии частично подавляется наличием fi-формы. Предполагается также, что по крайней мере некоторые из заболеваний, демонстрирующие частичную ассоциацию с генотипом HLA, могут быть обусловлены также и другими локусами.
Результатом генетического взаимодействия является и так называемый синтетический признак. Такой признак обусловлен несколькими «взаимодействующими» локусами, т.е. проявляется только при наличии соответствующих аллелей по всем вовлеченным локусам, в противном случае развивается абсолютно нормальный фенотип. По некоторым локусам мутантные аллели могут доминировать, по другим – быть рецессивными. Часть аллелей может встречаться редко, в то время как другие обнаруживаются в популяции с высокой частотой. Распространенность такого признака будет отражать произведение частот мутаций по всем локусам, участвующим в его детерминации.
Одна из возможных проблем при картировании локусов, вовлеченных во взаимодействие, заключается в том, что некоторые родители могут быть гомозиготными па одному из компонентных локусов, хотя и не будут проявлять интересующий признак из-за отсутствия нужного генотипа по другим локусам. Так как больной ребенок мог унаследовать любую из хромосом такого родителя, то для данной семьи не удастся установить сцепление с определенным локусом. Анализ такого заболевания позволяет утверждать, что картина похожа на случай, когда в выборке имеется большая доля семей с негенетической природой заболевания.
Однако проблема гомозиготности родителей становится значительной только при достаточно высокой частоте соответствующего аллеля по данному локусу. По существу, успешно могут быть картированы только те компонентные локусы, в которых аллели, обусловливающие заболевание, встречаются с низкой частотой.
Иногда следует учитывать параметры, минимизирующие эффект гомозиготности родителей. К примеру, изучение семей с очень большой долей пораженных сибсов может быть нежелательным: в такой семье более вероятно, что один или оба родителя гомозиготны по одному или более компонентным локусам.
Кроме проблемы гомозиготности родителей существует еще одно осложнение при картировании генетического взаимодействия: здоровые дети значительно затрудняют любую попытку картировать отдельный компонентный локус. Если ребенок и наследует по какому-то локусу аллель, ответственный за заболевание, он может не унаследовать саму болезнь, если не унаследует всех необходимых для данного заболевания аллелей по другим локусам. Таким образом, как было отмечено выше, генотипы здоровых детей не могут рассматриваться как свидетельство против сцепления с возможным локусом; полагаться стоит только на генотипы больных детей.
Если предположить, что больные дети являются следствием исключительно генетических причин и что частота аллелей невелика, то анализ сцепления становится относительно простым.
1. Для рецессивного компонентного локуса картирование происходит как и в моногенном случае: признак будет сегрегировать совместно с каждым из рецессивных компонентных локусов; требуется такое же количество семей с заданным числом больных индивидов.
2. Для доминантного компонентного локуса единственное отличие от моногенного случая заключается в том, что нельзя сказать, какой из двух родителей привносит аллель, ответственный за болезнь. Вследствие этого необходимо количество семей большее, чем для случая простого моногенного наследования.
7. Полигенное наследование
Известно, что наследование некоторых признаков характеризуется такими генетическими феноменами, как гетерогенность, неполная пенетрантность или интегрирующее взаимодействие. Наиболее сложное наследование – полигенное, при котором аллели нескольких разных локусов взаимодействуют друг с другом по принципу аддитивности, обусловливая таким образом риск проявления признака или заболевания. Каждый добавочный «плохой» аллель увеличивает предрасположенность индивида, но ни один из локусов не является существенным для этиологии данного заболевания. Поэтому в данном случае невозможно по фенотипу определить генотип. Расчеты показывают, что картирование полигенных заболеваний в общей популяции людей бесперспективно. Тем не менее, для поиска полигенных факторов при скрещивании линий животных, отличающихся по физиологическим признакам, были разработаны методы, использующие весь потенциал полной карты ПДРФ-маркеров. Подобные исследования могут выявить специфические локусы, которые в дальнейшем следует изучать более прямыми методами у человека.
8. Картирование редких рецессивных признаков
В случае многих заболеваний трудно подобрать достаточное количество семей с несколькими больными индивидами для проведения традиционного анализа сцепления. Многие рецессивные нарушения, имеющие медицинскую или биологическую значимость, очень редки и возникают случайно у отдельных индивидов или в малых группах. Даже для распространенных заболеваний подбор семей с несколькими больными может быть сложной задачей, если болезнь приводит к гибели в раннем возрасте.
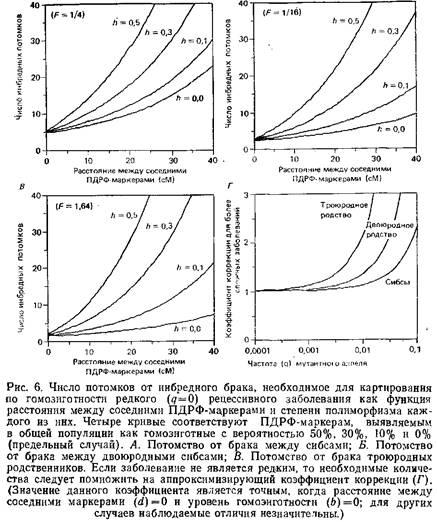
Недавно для картирования редких рецессивных заболеваний был описан эффективный подход, названный картированием по гомозиготности. При этом используется ДНК больных детей от близкородственных браков. В 1902 году Гэррод заметил, что значительную часть его больных алкаптонурией составляли дети от браков между родственниками. Почти сразу же Бэтсон предложил объяснение, основанное на законах Менделя и состоявшее в том, что близкородственные браки предоставляют наилучшую возможность для рецессивного аллеля перейти в гомозиготное состояние. Действительно, чем реже болезнь, тем большей будет доля инбредных браков среди родителей больных детей: если частота аллеля, ответственного за данное заболевание в данной популяции, есть q, то вероятность его гомозиготности в целой популяции пропорциональна q2
, но пропорциональна qв инбредной популяции. Значительная область хромосомы, фланкирующая предполагаемый локус заболевания, также переходит в гомозиготное состояние «по происхождению». Для ребенка от брака двоюродных родственников среднестатистический размер этой области гомозиготности «по происхождению» достигает приблизительно 28 см. Отсюда следует стратегия поиска локуса, ответственного за болезнь: необходимо найти область, неизменно гомозиготную «по происхождению», у больных детей от близкородственного брака.
Если бы существовала возможность достоверного выявления гомозиготности «по происхождению», можно было бы установить сцепление с тем или иным заболеванием на основе данных всего лишь по трем больным потомкам от брака двоюродных сибсов. Это возможно, поскольку вероятность того, что искомый участок будет гомозиготным «по происхождению» у данного ребенка, равна 1, а вероятность того, что случайный участок будет гомозиготен «по происхождению», равна 1/16 – коэффициенту инбридинга при браке двоюродных родственников. Поэтому отношение шансов за правильность выбора фрагмента составит 16:1. Если установлено, что искомый участок гомозиготен «по происхождению» у трех независимых детей от данного инбредного брака, отношение вероятностей составит 163
, или 4096:1, что превышает общепринятый порог правдоподобия 1000:1.
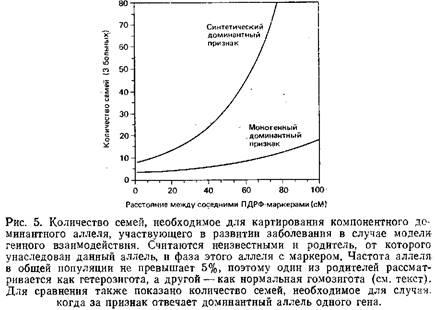
Конечно, невозможно с высокой точностью распознавать гомозиготность «по происхождению». Однако можно использовать плотную карту сцепления на основе ПДРФ для поиска района, в котором многие прилегающие ПДРФ-маркеры становятся гомозиготными. Эффективность этого метода будет зависеть от плотности используемых маркеров рестрикции и уровня их полиморфизма. Рис. 6 показывает количество потомков от брака двоюродных и троюродных сибсов, необходимое для картирования гомогенного рецессивного заболевания. Если использовать карту ПДРФ с полиморфными локусами на каждые 5 см, для обнаружения сцепления понадобится менее 20 инбредных детей в таких браках. Для относительно редких рецессивных заболеваний метод гомозиготного картирования может оказаться лучшим.
Хотя такая точная карта сцепления на основе ПДРФ-маркеров пока недоступна, при существующих темпах прогресса ее удастся получить в ближайшие несколько лет. Поэтому сбор образцов ДНК больных детей от браков двоюродных и троюродных родственников представляется уже целесообразным. Генетики, интересующиеся картированием сцепления, должны проявить особый интерес к тем странам, где близкородственные браки все еще распространены. В качестве примера: одна треть всех браков в индийском штате Андра-Прадеш заключается между дядей и племянницей.
Заключение
Использование ПДРФ-маркеров в генетике человека революционизировало эту отрасль знаний. Стало возможным картировать и в конечном счете клонировать гены, ответственные за признаки и болезни человека, почти таким же способом, как это делается для экспериментальных животных. Единственное остающееся ограничение заключается в том, что такие признаки требуют особого внимания, так как нет возможности применять к ним традиционные экспериментальные подходы.
Используя весь потенциал полной карты сцепления ПДРФ-маркеров человеческого генома, можно разработать альтернативные подходы, позволяющие преодолеть эти генетические затруднения. При настоящих темпах картирования ПДРФ надежда получить такую карту в ближайшие два года кажется оправданной. В будущем при планировании анализа сцеплений исследователи, рассматривая возможные пути преодоления генетических сложностей, могут рассчитывать на доступность карты ПДРФ-маркеров. Некоторые из таких подходов были описаны выше.
Как, должно быть, уже заметил читатель, «оптимальный» подход к изучению сцепления зависит в некоторой степени от точного знания природы генетических трудностей, которые предстоит преодолеть. Однако не часто такие подробности можно с точностью заранее определить. Следует начинать изучение сцепления с выявления на основе имеющихся данных спектра возможных осложнений. Далее следует определить доступный популяционный материал и арсенал медицинских методов, который можно использовать для упрощения задачи. Затем, основываясь на допущениях, принятых для различных типов наследования, следует вычислить количество различных семей, необходимое для картирования признака. В конечном счете проводится подбор семей, готовятся препараты ДНК. которые анализируют по большому количеству ПДРФ. Если предположения о генетической этиологии заболевания верны, то вероятность обнаружения сцепления велика. Если же признак в действительности более сложен, чем это предполагалось, сцепление не будет обнаружено. Отрицательный ответ при поиске по всему геному докажет по крайней мере, что заболевание более сложно, чем исходно предполагалось.
Таким образом, используя весь потенциал карты сцепления человеческого генома, построенной на основе ПДРФ, можно расширить область изучения наследственности человека, выйдя за рамки набора признаков, наследуемых исключительно по законам Менделя. В ходе подобных исследований может быть разрешен широкий круг медицинских вопросов, а также достигнут общий прогресс в исследованиях в области биологии млекопитающих.
|