БИОТЕХНОЛОГИЯ
МАСС-СПЕКТРОМЕТРИЧЕСКАЯ ОЦЕНКА УРОВНЯ ВКЛЮЧЕНИЯ ДЕЙТЕРИЯ И УГЛЕРОДА-13 В МОЛЕКУЛЫ АМИНОКИСЛОТ БАКТЕРИАЛЬНЫХ ОБЪЕКТОВ
@ О. В. МОСИН
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571, г. Москва, просп. Вернадского, д.86
Методом высокочувствительной масс-спектрометрии электронного удара исследованы уровни включения стабильных изотопов дейтерия 2
H и углерода-13 13
С в молекулы секретируемых аминокислот L
-фенилаланинпродуцирующего штамма Brevibacterium methylicum
и L
-лейцинпродуцирующего штамма Methylobacillus flagellatum
и аминокислотные остатки суммарных белков биомассы при выращивании бактерий на средах, содержащих в качестве источников стабильных изотопов (2
Н)метанол, (13
С)метанол и 2
Н2
О. Также осуществлено включение L
-[2,3,4,5,6-2
Н]фенилаланина, L
-[3,5-2
Н]тирозина и L
-[2,4,5,6,7-2
Н]триптофана в бактериородопсин, синтезируемый Halobacterium halobium ЕТ 1001.
Для масс-спектрометрического анализа мультикомпонентные смеси аминокислот в составе культуральных жидкостей и белковых гидролизатов (гидролиз в 6 М 2
НСl (3% фенол) и 2 М Ва(ОН)2
), превращали в N-бензилоксикарбонил-производные аминокислот и метиловые эфиры N-диметиламинонафталин-5-сульфонил-производных аминокислот, которые препаративно разделеляли методом обращенно-фазовой высокоэффективной жидкостной хроматографии. Полученные [2
H]- и [13
C]аминокислоты представляли собой смеси, различающиеся количеством включённых в молекулу изотопов. Уровни включения 2
Н и 13
С в молекулы секретируемых аминокислот и аминокислотные остатки суммарных белков биомассы меняются в зависимости от содержания меченых субстратов в ростовых средах и различаются для разных аминокислот (до 10% для L
-лейцина/изолейцина и до 97.5% для L
-аланина).
Ключевые слова: стабильные изотопы; метилотрофные бактерии; галофильные бактерии; выращивание на 2
Н2
О; изотопномеченые аминокислоты, бактериородопсин
ВВЕДЕНИЕ
Обогащение молекул стабильными изотопами (2
Н, 13
С, 15
N и другие) в настоящее время является важным методом в разнопрофильных биохимических и метаболических исследованиях с использованием аминокислот и других биологически активных соединений (БАС) [1-3]. Тенденции к предпочтительному применению стабильных изотопов по сравнению с их радиоактивными аналогами обусловлены отсутствием радиационной опасности и возможностью определения локализации метки в молекуле методами высокого разрешения, включая ЯМР [4], ИК- [5] и лазерную спектроскопию [6] и масс-спектрометрию [7]. Развитие этих методов детекции стабильных изотопов за последние годы позволило повысить эффективность биологических исследований, а также изучать структуру и механизм действия клеточных БАС на молекулярном уровне [8, 9]. В частности, аминокислоты, меченные 2
Н, 13
С, 15
N с различными уровнями изотопного включения, применяются для изучения пространственной структуры и конформационных изменений белков [10], взаимодействия белковых молекул [11], а также в химических синтезах широкого круга изотопномеченых соединений на их основе. Например, меченый L
-фенилаланин использован в синтезах пептидных гормонов и нейротрансмиттеров [12].
Важным моментом в исследованиях с применением меченых аминокислот, является их доступность. Изотопномеченые аминокислоты могут быть получены с использованием химических, ферментативных и биосинтетических методов. Однако химические синтезы часто многостадийны, требуют больших расходов ценных реагентов и меченых субстратов и приводят в результате к продукту, представляющему собой рацемическую смесь D
- и L
- форм, для разделения которых требуются специальные методы [13]. Более тонкие синтезы меченых аминокислот связаны с использованием комбинации химических и ферментативных подходов [14-16].
Для многих целей и прежде всего для структурных исследований белков биотехнология предлагает альтернативный химическому синтезу путь получения аминокислот, меченных стабильными изотопами, который приводит к высоким выходам синтезируемых продуктов, к эффективному включению изотопов в молекулы, и, самое главное, к сохранению природной конфигурации синтезируемых соединений. При биосинтетическом получении меченых аминокислот используют несколько подходов, один из которых заключается в равномерном обогащении синтезируемых соединений по всему углеродному скелету молекулы за счёт выращивания штаммов продуцентов на средах, содержащих в качестве источников стабильных изотопов следующие субстраты: 15
NН4
Сl [17], (13
С)метанол, (2
Н)метанол [18], и 2
Н2
О [19]. Этот подход включает в себя также комплексное использование химических компонентов биомассы, выращенной в присутствии стабильных изотопов, для выделения и фракционирования нужных изотопномеченых соединений. Другой подход заключается в сайт-специфическом обогащении аминокислот по определённым положениям молекул за счёт ассимиляции клеткой меченых предшественников, например, [1,4- 13
С]сукцината, [1, 2- 13
С]ацетата, [1- 13
С]лактата и др. [20, 21]. Методы получения изотопномеченых аминокислот в аспекте их использования для ЯМР-исследований белков более подробно изложены в работах ЛеМастера [22].
Настоящая работа является продолжением исследований [23-25], направленных на биосинтетическое получение [2
Н]- и [13
С]аминокислот за счёт утилизации низкомолекулярных меченых субстратов - (2
Н)метанола, (13
С)метанола и 2
Н2
О в клетках микроорганизмов и реализацию возможности определения стабильных изотопов методом масс-спектрометрии электронного удара. Чувствительность масс-спектрометрии составляет 10-9
-10-11
нмоль, что существенно выше, чем при использовании ИК- и ЯМР-спектроскопии. Данный метод в сочетании с обращённо-фазовой ВЭЖХ хорошо зарекомендовал себя для исследования уровня изотопного обогащения молекул аминокислот в составе их мультикомпонентных смесей, каковыми являются препараты культуральных жидкостей штаммов-продуцентов аминокислот и гидролизаты белков, полученные со сред, содержащих стабильные изотопы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Объектами исследования служили полученные в результате мутагенеза L
-фенилаланинпродуцирующий штамм факультативных метилотрофных бактерий Brevibacterium methylicum
, ассимилирующий метанол по рибулозо-5-монофосфатному пути фиксации углерода, и L
-лейцинпродуцирующий штамм облигатных метилотрофных бактерий Methylobacillus flagellatum
, реализующий 2-кето-3-дезоксиглюконатальдолазный вариант рибулозо-5-монофосфатного пути фиксации углерода. Для компенсации ауксотрофности по L
-лейцину и L
-изолейцину эти аминокислоты добавляли в ростовые среды в протонированном виде. При этом уровни накопления L
-фенилаланина и L
-лейцина в культуральных жидкостях штаммов-продуцентов достигали величины 0.8 и 1.0 г/л соответственно [23]. Включение дейтерия в молекулы секретируемых аминокислот и суммарных белков биомассы осуществляли за счёт выращивания штамма B. methylicum
на средах с 2
Н2
О и обычным метанолом, так как уровень включения 2
Н в молекулы аминокислоты за счёт ассимиляции (2
Н)метанола незначителен [25].
Поскольку в клетке происходит ассимиляция водорода (дейтерия) из Н2
О (2
Н2
O)среды, мы подбирали условия включения дейтерия в молекулы аминокислот и белков при ступенчатом возрастании концентрации 2
Н2
O в ростовых средах, как показано в табл. 1. Рост бактерий на 2
H2
O-cодержащих средах характеризуется увеличением продолжительности лаг-фазы, времени клеточной генерации и снижением выходов микробной биомассы (табл. 1), поэтому было необходимо проводить адаптацию бактерий к 2
Н2
О. Метод адаптации штамма B. methylicum
к росту на 2
Н2
О при сохранении способности к биосинтезу L
-фенилаланина описан в работе [23]. В данной работе были исследованы образцы культуральной жидкости B. methylicum
и гидролизаты биомассы, полученные в ходе многоступенчатой адаптации бактерий к тяжёлой воде на средах с различным содержанием 2
Н2
О (от 24.5 до 98% 2
Н2
О*). Поскольку данный штамм метилотрофных бактерий удалось адаптировать к росту на 2
Н2
О, исследование уровней включения дейтерия в молекулы аминокислот представлялось наиболее интересным.
В отличие от культивирования на 2
Н2
О-среде, где необходимо проводить клеточную адаптацию к дейтерию, при получении [13
С]аминокислот за счет утилизации 13
СН3
ОН данный этап не является обязательным, поскольку этот изотопный субстрат не оказывает негативного биостатического эффекта на ростовые характеристики метилотрофов (см. табл. 1). Поэтому в случае M.
flagellatum
включение 13
С в молекулы аминокислот осуществляли в одну стадию при выращивании бактерий на водных средах, содержащих 1% (13
C)метанол.
Таблица 1
Влияние изотопного состава среды на рост штаммов B. methylicum
и M. flagellatum
| Номер опыта |
Среда выращивания |
Величина лаг-фазы, ч |
Выход биомассы, % от контроля |
Время генерации, ч |
| 1 |
0 |
24.0 |
100 |
2.2 |
| 2 |
24.5 |
32.1 |
90.6 |
2.4 |
| 3 |
49.0 |
40.5 |
70.1 |
3.0 |
| 4 |
73.5 |
45.8 |
56.4 |
3.5 |
| 5 |
98.0 |
60.5 |
32.9 |
4.4 |
| 6 |
CН3
ОН |
0 |
100 |
1.1 |
| 7 |
13
СН3
ОН |
0.1 |
72.0 |
1.0 |
В качестве другой модельной системы для включения изотопной метки в молекулы белков, использовали бактериородопсин [26], синтезируемый в мембране Halobacterium halobium ЕТ 1001
. Выбор для этих целей бактериородопсина, функционирующего как АТP-зависимая транслоказа в клетках галофильных бактерий, был продиктован возможностью исследования с его помощью процессов функционирования мембранных белков in vivo
в условиях изотопного обогащения среды дейтерием. Для включения дейтериевой метки в молекулу бактериородопсина использовали метод сайт-специфического обогащения белка за счёт выращивания H. halobium ЕТ 1001
на синтетической среде с дейтерийсодержащими аналогами ароматических аминокислот - L
-[2,3,4,5,6-2
Н]фенилаланином, L
-[3,5-2
Н]тирозином и L
-[2,4,5,6,7-2
Н]триптофаном.
Основные этапы при выделении [2
H]-и [13
C]-аминокислот заключались в выращивании штаммов-продуцентов на средах с мечеными субстратами - (2
Н)метанолом, (13
С)метанолом и 2
Н2
О или L
-[2,3,4,5,6-2
Н]фенилаланином, L
-[3,5-2
Н]тирозином и L
-[2,4,5,6,7-2
Н]триптофаном (бактериородопсин), отделении культуральных жидкостей, содержащих секретируемые аминокислоты, от микробной биомассы, разрушении клеток, выделении фракции суммарных белков биомассы и бактериородопсина с последующим их гидролизом, дериватизации смесей аминокислот дансилхлоридом, бензилоксикарбонилхлоридом и диазометаном, разделении метиловых эфиров N-Dns-производных аминокислот и N-Cbz-производных аминокислот методом обращённо-фазовой ВЭЖХ, масс-спектрометрии электронного удара полученных производных аминокислот.
2
Н- и 13
C-Содержащие аминокислоты выделяли из лиофилизованных культуральных жидкостей штаммов-продуцентов аминокислот B. methylicum
и M. flagellatum
, а также в составе гидролизатов суммарных белков биомассы. При выделении фракции суммарных белков необходимо учитывать наличие в них углеводов, липидов и пигментов. В работе использовали богатые по белку штаммы бактерий со сравнительно небольшим содержанием углеводов в них. Гидролизу в качестве фракции суммарных белков подвергали остаток после исчерпывающего отделения липидов и пигментов экстракцией органическими растворителями (метанол-хлороформ-ацетон). В редких случаях для полного отделения от сопутствующих компонентов прибегали к солюбилизации белков в SDS или высаливании их сульфатом аммония.
Выделение и очистку индивидуальных белков с целью дальнейшего изучения их пространственной структуры целесообразно осуществлять методом солюбилизации с использованием подходящих детергентов (см. [27]) что особенно важно для бактериородопсина, являющегося высокоспиральным белком. Поэтому при выделении бактериородопсина из пурпурных мембран галофильной бактерии H. halobium
ЕТ 1001
мы солюбилизовали его в 0.5% растворе SDS с сохранением a-спиральной конфигурации белка [28], а далее осаждали его метанолом. Гомогенность очищенного бактериородопсина была подтверждена электрофорезом в 12.5% ПААГ в присутствии 0.1% SDS.
Гидролиз дейтериймеченых белков проводили в условиях предотвращения реакций изотопного обмена водорода на дейтерий в ходе гидролиза и сохранения остатков ароматических аминокислот в белке. Были рассмотрены два альтернативных варианта проведения гидролиза - кислотный и щелочной. Кислотный гидролиз белка в стандартных условиях (6 М HCl, 24 ч, 1100
С), как известно, приводит к полному разрушению триптофана и частичному разрушению серина, треонина и некоторых других аминокислот [29]. Другим значительным недостатком при проведении гидролиза в HCl является изотопный (1
Н-2
Н)-обмен ароматических протонов (дейтеронов) в молекулах триптофана, тирозина и гистидина, а также протонов (дейтеронов) при атоме С3 аспарагиновой и С4 глутаминовой кислот [30]. Поэтому, чтобы получить реальные данные о биосинтетическом включении дейтерия в молекулы аминокислот необходимо проводить гидролиз белка с использованием дейтерированных реагентов (6 М 2
НCl с 3% фенолом (в 2
Н2
O)). Другой вариант гидролиза белка заключался в использовании 2 М Ba(OH)2
(1100
C, 24 ч). В этих условиях гидролиза белка реакций изотопного обмена водорода на дейтерий в ароматических аминокислотах - тирозине и триптофане не происходит, а триптофан не разрушается. Оба метода гидролиза показали хорошие результаты по сохранению ароматических аминокислот в гидролизатах белка и содержанию дейтерия в молекулах аминокислот. Необходимо подчеркнуть, однако, что для препаративного получения дейтерированных аминокислот из белка микроорганизмов целесообразнее использовать гидролиз в 2
НСl в 2
Н2
О (в присутствии добавки фенола для сохранения ароматических аминокислот), позволяющего избежать рацемизации. Для изучения же уровня включения стабильных изотопов в остатки ароматических кислот бактериородопсина и в аналитических целях лучше применять гидролиз белка в растворе Ва(ОН)2
, при котором отсутствует (1
Н-2
Н)-обмен в аминокислотах и сохраняются остатки фенилаланина, тирозина и триптофана. При щелочном гидролизе возможная рацемизация аминокислот не влияет на результат последующего масс-спектрометрического определения уровней включения дейтерия в аминокислоты.
Для получения летучих производных аминокислоты переводили в метиловые эфиры N-Dns-аминокислот или N-Cbz-аминокислоты, которые затем разделяли методами обращенно-фазовой ВЭЖХ. Условия N-дериватизации аминокислот отрабатывали таким образом, чтобы получить в масс-спектрах как можно более интенсивные пики их молекулярных ионов М+.
на уровне фона метаболитов среды. Для этого проводили прямую дериватизацию аминокислот в составе лиофилизованных культуральных жидкостей и гидролизатов суммарных белков биомассы пятикратным избытком дансилхлорида или бензилоксикарбонилхлорида.
В этих условиях для лизина, гистидина, тирозина, серина, треонина и цистеина наряду с монопроизводными образовывались ди-Dns и ди-Cbz-производные. Кроме этого, из аргинина синтезировался N-три-Dns-(Cbz)-аргинин. Поэтому в масс-спектрометрических исследованиях молекулярные ионы М+.
этих соединений соответствовали ди- или три- производным.
Эффективность использования N-Cbz-производных аминокислот в обращённо-фазовой ВЭЖХ и в масс-спектрометрических исследованиях была показана ранее [31, 32]. Летучесть N-производных аминокислот при масс-спектрометрическом анализе может быть повышена за счет дополнительной дериватизации по карбоксильной группе, поэтому N-Dns-аминокислоты были переведены в их метиловые эфиры. Для предотвращения обратного изотопного обмена ароматических протонов (дейтеронов) при этерификации дейтериймеченых аминокислот, в данной работе отдали предпочтение использованию диазометана для этих целей [33]. Свежеприготовленным раствором диазометана в диэтиловом эфире обрабатывали сухие остатки смесей аминокислот. При дериватизации аминокислот диазометаном происходило дополнительное N-метилирование по a-NH-(Dns)-группе аминокислот, что приводило к появлению в масс-спектрах метиловых эфиров N-Dns-аминокислот дополнительных пиков, соответствующих соединениям с молекулярной массой на 14 массовых единиц больше исходных.
В данной работе включение изотопов 2
Н и 13
С в молекулы аминокислот мультикомпонентных смесей в составе культуральных жидкостей и белковых гидролизатов определяли методом масс-спектрометрии электронного удара. Метиловые эфиры N-Dns-производных аминокислот или N-Cbz-производные аминокислот препаративного разделяли методом обращённо-фазовой ВЭЖХ. Степени хроматографической чистоты 2
Н- и 13
С-содержащих аминокислот, выделенных из культуральных жидкостей B. methylicum и M. flagellatum
и гидролизатов белков в виде их N-Cbz-производных аминокислот составили 96-98%, при выходах - 67-89%. Для отдельных аминокислот оказалось более удобным разделение в виде метиловых эфиров N-Dns-производных аминокислот. При этом степень хроматографической чистоты полученных из гидролизатов бактериородопсина метиловых эфиров N-Dns-фенилаланина, N-Dns-тирозина и N-Dns-триптофана составили 96, 97 и 98% соответственно. Данный результат важен потому, что именно метиловые эфиры N-Dns-аминокислот вследствие своей химической стабильности, наличия высокоинтенсивных молекулярных ионов М+.
при высоких молекулярных массах оказались весьма удобными для масс-спектрометрических исследований и позволяют идентифицировать аминокислоты в присутствии низкомолекулярных метаболитов среды и других продуктов дериватизации. Последний факт очень важен для изучения состава пула аминокислот, секретируемых в культуральные жидкости штаммов-продуцентов.
Пути фрагментации метиловых эфиров N-Dns-фенилаланина и N-Dns-лейцина при масс-спектрометрии электронного удара приводят к формированию пиков их молекулярных ионов при m/z 412 и m/z 378 и к образованию дансильных фрагментов и продуктов их дальнейшего распада до N-диметиламинонафталина, а также к получению аминных А+
и аминоацильных фрагментов В+
(рис. 1). Показанная на рис. 1 фрагментация метиловых эфиров N-Dns-фенилаланина и N-Dns-лейцина характерна для этих производных всех других аминокислот, что позволяет проводить масс-спектрометрический мониторинг изотопномеченых аминокислот в составе интактных культуральных жидкостей штаммов-продуцентов, содержащих сумму аминокислот и других метаболитов среды, до стадии их хроматографического разделения, а также исследовать включение стабильных изотопов в аминокислоты белковых гидролизатов.
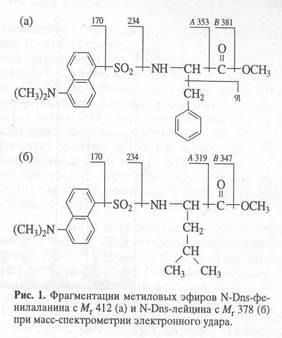
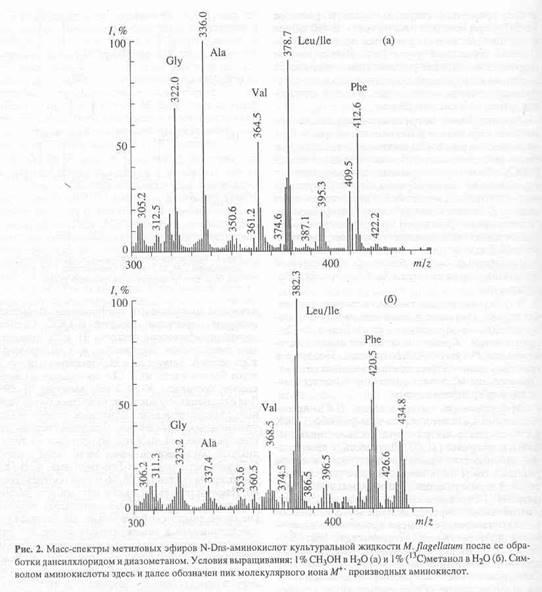
При использовании в качестве источников стабильных изотопов (13
С)метанола и 2
Н2
О, в клетке синтезируются изотопнозамещённые аминокислоты, различающиеся количеством атомов, замещённых на 13
С и 2
Н. При этом, чем выше молекулярная масса аминокислот, тем возможен больший набор ионов, соответствующих изотопнозамещённым формам. Пики при m/z 323.2; 337.4; 368.5; 382.3; 420.5 в масс-спектре [13
С]аминокислот дериватизованной культуральной жидкости M. flagellatum
, полученной с водной среды, содержащей 1% (13
С)метанол (рис. 2 б
), соответствуют по массе метиловым эфирам N-Dns-глицина, N-Dns-аланина, N-Dns-валина, N-Dns-лейцина/изолейцина и N-Dns-фенилаланина. Следует подчеркнуть, что величина m/z для молекулярного иона метиловых эфиров N-Dns-лейцина и изолейцина в масс-спектрах электронного удара одинакова, поэтому данным методом нельзя точно идентифицировать эти аминокислоты. Максимальные уровни включения 13
С в молекулы аминокислот, измеренные по увеличению усреднённого значения m/z для молекулярного иона изотопномеченого образца в сравнении с молекулярной массой природной аминокислоты варьируют от 35% для [13
C]аланина до 95% для [13
С]фенилаланина (табл. 2). Учитывая ауксотрофность штамма по L
-изолейцину, разброс значений может быть объяснён вкладом экзогенного L
-изолейцина в уровень изотопного включения лейцина, а также других метаболически связанных с ним аминокислот (см. текст ниже).
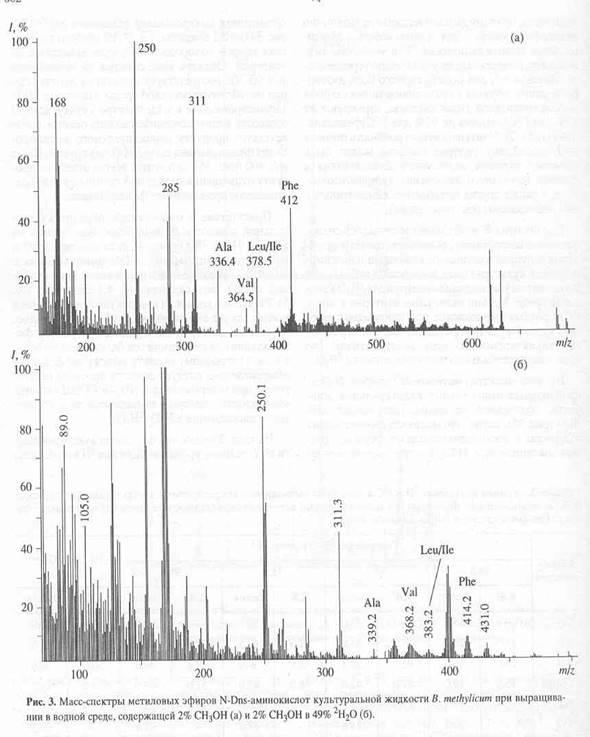
Для штамма B. methylicum
наблюдалось специфическое возрастание уровней изотопного включения дейтерия в молекулы индивидуальных аминокислот культуральных жидкостей (табл. 2) при ступенчатом увеличении концентраций 2
Н2
O в ростовой среде. Уровни включения дейтерия в молекулы разных аминокислот при одинаковых условиях культивирования различаются. Такой результат зафиксирован во всех экспериментах, где источником стабильных изотопов служила 2
Н2
О.
Из масс-спектра метиловых эфиров N-Dns-производных аминокислот культуральной жидкости, полученной со среды, содержащей 49% 2
Н2
О (рис. 3 б
) видно, что молекула фенилаланина содержала 6 изотопнозамещённых форм со средним значением m/z 414.2, которое возрастает по сравнению с контрольными условиями (m/z 412.0, рис. 3 а
) на 2.2 единицы, т. е. 27.5% от общего количества атомов водорода в молекуле замещены на дейтерий. Область масс-спектра со значениями m/z 90-300 соответствует продуктам дериватизации метаболитов ростовой среды. Пик с m/z 431.0, зафиксированный в масс-спектре культуральной жидкости и проявляющийся во всех опытах, соответствует продукту дополнительного метилирования фенилаланина по a-NH-(Dns)- группе. Пик с m/z 400 (рис. 3 б
) вероятнее всего отвечает продукту отщепления метильной группы от дейтерированного производного фенилаланина.
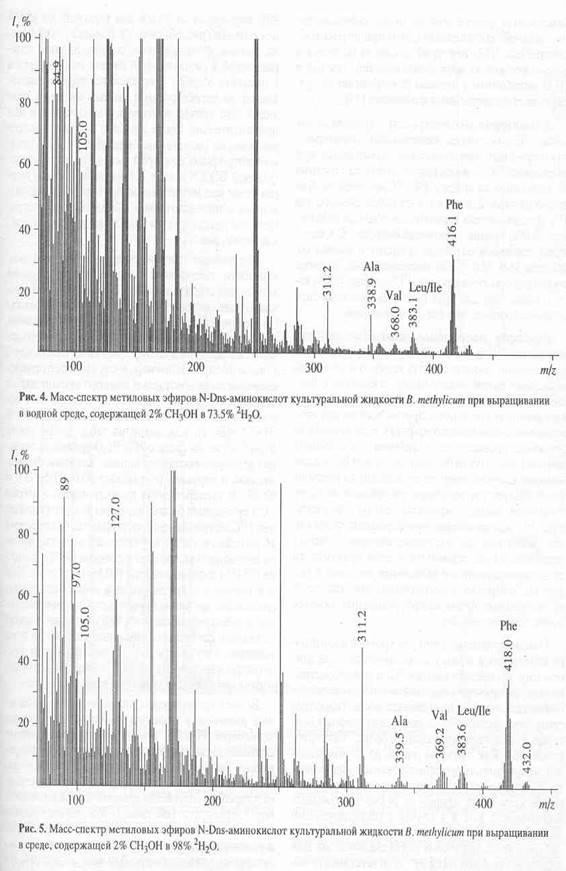
Присутствие в масс-спектре образца культуральной жидкости B. methylicum
, полученной на среде с 73.5% 2
Н2
О (рис. 4) пика молекулярного иона метилового эфира N-Dns-фенилаланина с m/z 416.1 указывает на увеличение молекулярной массы фенилаланина на 4.1 единицу, т. е., 51.2% атомов водорода в молекуле фенилаланина в этом случае замещены на дейтерий. Очевидно, что вышеобозначенные атомы дейтерия включились в молекулу фенилаланина за счет процесса биосинтеза de novo
, т. е. по углеродному скелету молекулы. К легко обмениваемым следует отнести протоны (дейтероны) при гетероатомах в NH2
-и СООН- группах аминокислот, которые замещаются за счёт лёгкости диссоциации в Н2
О (2
Н2
О).
Таблица 2
Уровни включения 2
Н и 13
С в молекулы аминокислот, секретируемых в культуральную жидкость (КЖ) B. methylicum
и M. flagellatum,
и в аминокислотные остатки белков (данные получены для метиловых эфиров N-Dns-аминокислот и N-Cbz-аминокислот)
Из табл. 2 видно, что условиях ауксотрофности по L
-лейцину уровни включения 2
Н в молекулы лейцина/изолейцина ниже, чем для фенилаланина. Отмеченная особенность отчётливее всего проявляется на среде с максимальной концентрацией 2
Н2
О. Ещё раз этот результат подтвердили рис. 5, где показан масс-спектр [2
Н]аминокислот культуральной жидкости в виде метиловых эфиров N-Dns-производных аминокислот после выращивания бактерий B. methylicum
в указанных условиях. Видно, что величина m/z 418.0 пика молекулярного иона метилового эфира N-Dns-фенилаланиа увеличивается по сравнению с контрольными условиями на 6 единиц, что соответствует замещению 75% от общего количества атомов водорода в молекуле. В отличие от фенилаланина уровень включения дейтерия в лейцин/изолейцин составил 51.0%, а в валин - 58.8%. Примечательно, что в масс-спектре этого образца фиксируется пик обогащённого дейтерием бензильного фрагмента при m/z 97.0 (вместо m/z при 91.0 в контроле), что указывает на частичную локализацию атомов дейтерия в молекуле фенилаланина в положениях С2-С6 ароматического кольца и сопредельном с ними положении при углеродном атоме b. Несмотря на то, что в остальных опытах пики бензильных фрагментов не были зафиксированы, логично предположить, что при других концентрациях 2
Н2
О дейтерий также включается в ароматическое кольцо фенилаланина, так как в 2
Н2
О метаболизм у штамма B. methylicum
не претерпевает существенных изменений [25].
Аналогичная закономерность в уровнях включения 13
С в молекулы аминокислот, связанных с ауксотрофным метаболизмом, проявляется при выращивании L
-изолейцинзависимого штамма M. flagellatum
на среде с 1% (13
С)метанолом. Как видно из табл. 2, в отличие от наблюдаемого для [13
С]фенилаланина (уровень изотопного включения - 95.0%), уровни включения изотопа 13
С в молекулы лейцина/изолейцина, аланина и валина составили 38.0; 35.0; 50.0% соответственно. Уровень изотопного включения для [13
C]глицина (60%) хотя и выше, чем для трёх последних аминокислот, но намного ниже, чем для фенилаланина.
Суммируя полученные данные по уровням включения 2
Н-и 13
С в молекулы секретируемых аминокислот, можно сделать вывод о сохранении минорных путей метаболизма, связанных с биосинтезом лейцина и метаболически родственных с ним аминокислот de novo
. Другим логическим объяснением наблюдаемого эффекта, если принять во внимание происхождение лейцина и изолейцина по различным путям биосинтеза, может быть ассимиляция клеткой немеченого лейцина из среды на фоне биосинтеза меченого изолейцина de novo
. Учитывая данные эффекты следует подчеркнуть, что использование ауксотрофных форм микроорганизмов для получения изотопномеченых аминокислот не оправдывает себя практически из-за множественного включения изотопов в молекулы. Напротив, использование для этих целей прототрофных форм микроорганизмов кажется более перспективным.
Общие принципы изучения уровней изотопного включения в молекулы аминокислот при данном способе введения метки были продемонстрированы на примере анализа сложных мультикомпонентных смесей, полученных после гидролиза суммарных белков биомассы метилотрофных бактерий, а также индивидуального белка – бактериородопсина, выполняющего роль АТФ-зависимой транслоказы в клетках галофильной бактерии Halobacteriumhalobium. Как видно из рис. 6, до десяти аминокислот могут быть идентифицированы в гидролизате белка B. methylicum
по пикам молекулярных ионов метиловых эфиров их N-Dns-производных аминокислот.
Как и в случае с секретируемыми аминокислотами, пики М+.
соответствовали смесям изотопнозамещённых форм аминокислот. Для лизина и тирозина пики М+.
соответствовали метиловым эфирам ди-производных аминокислот - a, e-ди-Dns-лизину (с М+.
при m/z 631.0) и О, N-ди-Dns-тирозину (с М+.
при m/z 663.9). Уровни изотопного включения дейтерия в молекулы аминокислот при содержании 2
Н2
O в ростовой среде 49% варьируют от 25.6% для тирозина до 45.0% для аланина (рис. 6 б
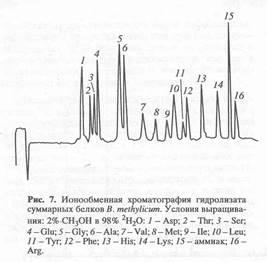
и табл. 2). В молекулах глицина, валина, фенилаланина, серина, лизина, аспарагиновой и глутаминовой кислот они находятся в пределах 35 - 40%. Что касается других аминокислот, не детектируемых данным методом, очевидно, что уровни изотопного включения в них приблизительно такие же. Это подтверждается данными по разделению белковых гидролизатов метилотрофных бактерий методами обращённо-фазовой ВЭЖХ в виде N-Cbz-производных аминокислот или метиловых эфиров их N-Dns-производных аминокислот и ионнообменной хроматографии, где детектируется уже 15 аминокислот (см., например, рис. 7).
Полученные данные свидетельствуют о возможности достижения максимальных уровней включения стабильных изотопов 2
Н и 13
С в аминокислотные остатки суммарных белков биомассы (за исключением лейцина/изолейцина и валина, сниженные уровни включения для которых объясняются эффектом ауксотрофности по L
-лейцину и по L
-изолейцину). Например, в случае с дейтерированными аминокислотами полного замещения на стабильные изотопы удалось достичь за счет использования в качестве источника дейтерия 98% 2
Н2
О (табл. 2). Как видно из табл. 2, при росте B.
methylicum
на среде с 98% 2
Н2
О, уровни включения дейтерия в остатки глицина, аланина, фенилаланина и тирозина составляют 90.0; 97.5; 95.0 и 92.8%. В экспериментах по включению изотопа 13
С в суммарные белки биомассы за счёт утилизации (13
С)метанола метилотрофными бактериями M. flagellatum
также наблюдались высокие уровни изотопного включения в глицине (90%), аланине (95.0%) и фенилаланине (80.5%) (табл. 2). Как и в случае с секретируемыми аминокислотами, сниженные уровни включения стабильных изотопов в лейцине/изолейцине (49%), а также в метаболически связанных с ним аминокислотах в этих условиях могут быть объяснены эффектом ауксотрофности штамма по L
-изолейцину, который добавляли в ростовую среду в немеченом виде.
Во всех экспериментах по включению стабильных изотопов в молекулы аминокислот уровни включения 2
Н и 13
С в метаболически связанные аминокислоты обнаружили определённую коррелляцию. Так, уровни изотопного включения для валина и лейцина (семейство пирувата), фенилаланина и тирозина (семейство ароматических аминокислот) коррелируют (см. табл. 2). Уровни изотопного включения для глицина и серина (семейство серина), аспарагиновой кислоты и в лизина (семейство аспарагина) также имеют близкие величины. Из данных табл. 2 видно, что уровни изотопного включения секретируемых аминокислот и соответствующих аминокислотных остатков суммарного белка при выращивании бактерий на средах с одинаковым изотопным насыщением, в целом, также коррелируют. Причина некоторых наблюдаемых расхождений в уровнях включения изотопов в молекулы аминокислот до конца не изучена.
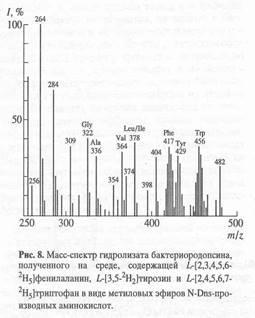
Данный биосинтетический подход показал хорошие результаты по изучению введения дейтериевой метки в молекулу бактериородопсина, выращенного на среде, содержащей L
-[2,3,4,5,6-2
Н]фенилаланин, L
-[3,5-2
Н]тирозин и L
-[2,4,5,6,7-2
Н]триптофан (рис. 8). Как видно из рис. 8, в масс-спектре дериватизованного гидролизата бактериородопсина детектируются пики, соответствующие молекулярным ионам обогащённых дейтерием метиловых эфиров N-Dns-фенилаланина с молекулярным ионом при m/z 417 (ср. m/z 412 для немеченого производного фенилаланина), N-Dns-тирозина с М+.
при m/z 429 (ср. m/z 428 для производного тирозина) и N-Dns-триптофана с М+.
при m/z 456 (ср. m/z 451 для производного триптофана). Все они отвечают смеси изотнопозамещённых форм аминокислот, различающихся количеством атомов водорода, замещённых на дейтерий. Множественный характер включения дейтерия свидетельствует о возможном вкладе биосинтеза de novo
в уровни дейтерированности ароматических аминокислот, но также не исключено, что он определяется самим способом получения изотопномеченых молекул. Кроме вышеобозначенных аминокислот в масс-спектре фиксируются пики молекулярных ионов метиловых эфиров -N-Dns-глицина (m/z 322), N-Dns-аланина (m/z 336), N-Dns-валина (m/z 364) и N-Dns-лейцина/изолейцина (m/z 378). Как и следовало ожидать, эти аминокислотные остатки в бактериородопсине не содержат дейтерия.
Таким образом, проведённые исследования продемонстрировали эффективность масс-спектрометрии электронного удара N-Cbz-производных аминокислот и метиловых эфиров N-Dns-производных аминокислот для исследования уровней изотопного обогащения молекул аминокислот в составе их мультикомпонентных смесей, полученных биосинтетически с использованием микроорганизмов. Метод незаменим для изучения состава пула аминокислот, секретируемых в культуральные жидкости штаммов-продуцентов, выращенных на средах со стабильными изотопами.
Экспериментальная часть
В работе использовали D
, L
-аминокислоты (Reanal, Венгрия), аденозин- и уридин-5-монофосфаты (Sigma, США), панкреотическую телячью дезоксирибонуклеазу I (Fluka Chemie AG, Швейцария), додецилсульфат натрия (Chemapol, Чехо-Словакия). L
-[2,3,4,5,6-2
Н5
]фенилаланин (90 ат.% 2
Н), L
-[3,5-2
Н2
]тирозин (96 ат.% 2
Н) и L
-[2,4,5,6,7-2
Н5
]триптофан (98 ат.% 2
Н) (способы получения указаны в работах [34, 35]), были предоставлены А. Б. Пшеничниковой (МИТХТ им. М. В. Ломоносова). Для синтеза производных аминокислот использовали N-диметиламинонафталин-5-сульфохлорид (дансилхлорид) (Sigma, США), бензилоксикарбонилхлорид (Войковский химзавод, РФ) и диазометан, получаемый из N-нитрозометилмочевины (Merck, Германия).
Исследования проводили с генетически маркированными штаммами бактерий, полученными из коллекции культур Всероссийской коллекции промышленных микроорганизмов (ВКПМ) Государственного научно-исследовательского института генетики и селекции промышленных микроорганизмов:
Brevibacterium methylicum ВКПМ В 5652
, L
-лейцинзависимый штамм факультативных метилотрофных бактерий, продуцент L
-фенилаланина;
Methylobacillus flagellatum KT
, L
-изолейцинзависимый штамм облигатных метилотрофных бактерий, продуцент L
-лейцина;
Halobacterium halobium ЕТ 1001
, пигментсодержащий штамм галофильных бактерий, способный синтезировать бактериородопсин;
Выращивание метилотрофных бактерий
B. methylicum
и
M. flagellatum
осуществляли на минеральной среде М9 [36] в колбах Эрленмейера объёмом 250 мл с наполнением средой 50 мл по методике [23], используя в качестве источников стабильных изотопов (2
H)метанол, (13
С)метанол и 2
Н2
O в присутствии L
-лейцина для B. methylicum
и L
-изолейцина для M. flagellatum
в концентрациях 10 мг/л. Клетки отделяли центрифугированием (10000 g, 20 мин). В культуральной жидкости анализировали секретируемые аминокислоты.
Для выделения фракции суммарных белков биомассы
клетки дважды промывали дистиллированной водой с последующим центрифугированием (10000 g, 20 мин), экспонировали ультразвуком при 40 кГц (3 x 15 мин) и центрифугировали. Полученный осадок (10 мг) после отделения липидов и пигментов смесью органических растворителей хлороформ-метанол-ацетон (2:1:1) использовали в качестве фракции суммарных белков биомассы.
Для получения дейтериймеченого бактериородопсина
использовали синтетическую среду, содержащую 18 аминокислот, в которой немеченые L
-аминокислоты фенилаланин, тирозин и триптофан были заменены их дейтерированными аналогами - [2,3,4,5,6-2
Н]фенилаланином, [3,5-2
Н]тирозином, и [2,4,5,6,7-2
Н]триптофаном (количества компонентов приведены в г/л): (D
, L
-аланин 0.43, L
-аргинин 0.4, D
, L
-аспарагиновая кислота 0.45; L
-цистеин 0.05; L
-глутаминовая кислота 1.3; L
-глицин 0.06; D
, L
-гистидин 0.3; D
, L
-изолейцин 0.44; L
-лейцин 0.8; L
-лизин 0.85; D
, L
-метионин 0.37; D
, L
-фенилаланин 0.26; L
-пролин 0.05; D
, L
-серин 0.61; D
, L
-треонин 0.5; L
-тирозин 0.2; D
, L
-триптофан 0.5, D
; L
-валин 1.0); нуклеотиды (аденозин-5-монофосфат 0.1; уридин-5 монофосфат 0.1); соли (NaCl 250; MgSO4
x 7H2
O 20; KСl 2; NH4
Cl 0.5; KNO3
0.1; KH2
PO4
0.05; K2
HPO4
0.05; цитрат натрия 0.5; MnSO4
x H2
O 3 x 10-4
; CaCl2
x 6H2
O 0.065; ZnSO4
x 7H2
O 4 x10-5
; FeSO4
x 7H2
O 5 x 10-4
; CuSO4
x 5H2
O 5 x 10-5
); глицерин 1.0; ростовые факторы (биотин 0.1 x 10-3
; фолиевая кислота 10 x10-3
; витамин В12
0.02 x 10-3
).
Для выделения фракции пурпурных мембран
клетки, полученные после отделения культуральной жидкости и двухкратной промывки дистиллированной водой (100-150 мг), суспендировали в 100 мл 0.1 М буфера трис-HCl (рН 7.6), добавляли 1 мг дезоксирибонуклеазы I и инкубировали в течении 5-6 ч при 37 0
С, затем разбавляли дистиллированной водой до 200 мл и инкубировали 15 ч при 4 0
С. Осадок промывали дистиллированной водой с последующим отделением водной фракции до получения бесцветных промывных вод. Чистоту полученной суспензии пурпурных мембран (в Н2
О) контролировали на спектрофотометре Beckman DU-6 (США) по соотношению полос поглощения 280/568 нм (e280
1.1 x 105
М-1
см-1
[37] и e568
6.3 x 104
М-1
см-1
[38]).
Бактериородопсин
выделяли по методу [39], солюбилизируя препараты пурпурных мембран (50 мг) в 2 мл 0.5% раствора SDS в Н2
О и осаждая продукт 5-кратным избытком метанола на холоду (00
С). Выход бактериородопсина составил 17-20 мг.
Электрофорез
препаратов бактериородопсина проводили в 12.5% ПААГ с 0.1 % SDS. Образцы для электрофореза готовили стандартным способом (протокол фирмы LKB, Швеция). Для количественного определения содержания синтезированного в клетке белка проводили сканирование прокрашенного в растворе Кумасси-голубой R-250 электрофоретического геля на лазерном денситометре CDS-200 (Beckman, США).
Липиды и пигменты
экстрагировали смесью хлороформ-метанол-ацетон (2:1:1) по методу Блайя и Дайера [40].
Гидролиз белка
проводили 6 М 2
НСl (3% фенола в 2
Н2
О) или 2 М Ва(ОН)2
(1100
С, 24 ч) [41].
N-Dns-аминокислоты
.
К 4-5 мг лиофилизованных препаратов культуральной жидкости и белковых гидролизатов в 1 мл 2 М NaHCO3
рН 9-10 порциями при перемешивании добавляли 25.6 мг дансилхлорида в 2 мл ацетона. Реакционную смесь выдерживали 1 ч при перемешивании при 400
С, затем подкисляли 2 М HСl до рН 3.0 и экстрагировали этилацетатом (3 x 5 мл). Объединенный экстракт промывали водой до значения рН 7.0, сушили безводным сульфатом натрия, растворитель удаляли при 10 мм. рт. ст.
Метиловые эфиры N-Dns-аминокислот
. Для получения диазометана к 20 мл 40% КОН в 40 мл диэтилового эфира добавляли 3 г влажной нитрозометилмочевины и перемешивали на водяной бане со льдом в течении 15-20 мин. После окончания интенсивного газовыделения эфирный слой отделяли, промывали ледяной водой до рН 7.0, сушили безводным сульфатом натрия и использовали для обработки препаратов N-дансиламинокислот в составе культуральной жидкости или гидролизатов суммарных белков биомассы.
N
-Cbz-аминокислоты.
К 1.5 мл охлажденного до 00
С раствора культуральной жидкости (50 мг) или белковых гидролизатов (4-5 мг) в 4 М NaOH добавляли порциями при перемешивании 2 мл 4 М NaOH и 28.5 мг бензилоксикарбонилхлорида. Реакционную смесь выдерживали при 00
С, перемешивали 3 ч, подкисляли 2 М HCl до рН 3 и продукты экстрагировали этилацетатом (3 x 5 мл). Объединенный экстракт промывали водой до рН 7.0, сушили безводным сульфатом натрия, растворитель удаляли при 10 мм. рт. ст.
ТСХ производных аминокислот
осуществляли на пластинках Silufol UV-254 (Чехо-Словакия) в системах растворителей: хлороформ-метанол-уксусная кислота, 10:1:0,3 (А) для N-Cbz-аминокислот и хлороформ-метанол-ацетон, 7:1:1 (Б) для метиловых эфиров N-Dns-аминокислот.
N-Cbz-аминокислоты детектировали по поглощению при 254 нм. Метиловые эфиры N-Dns-аминокислот детектировали по флуоресценции в УФ-свете.
Аналитическое и препаративное разделение
смеси N-Cbz-аминокислот культуральной жидкости и белковых гидролизатов осуществляли методом обращённо-фазовой ВЭЖХ [31].
Метиловые эфиры N-Dns-аминокислот
разделяли методом обращённо-фазовой ВЭЖХ на жидкостном хроматографе Knauer (ФРГ), снабженным насосомKnauer, УФ-детектором 2563 и интегратором С-R 3A (Shimadzu, Япония). Использовали неподвижную фазу: Separon SGX C18
; 18.7 мкм; 150 x 3.3 мм (Kova, Чехо-Словакия); система растворителей: (А) - ацетонитрил-трифторуксусная кислота, (20:80 об/об) и (В) - ацетонитрил. Использовали градиентное элюирование: от 0 до 20% В 5 мин, 20 до 100% В 30 мин, 100% В 5 мин, от 100 до 0% В 2 мин, 0% В 10 мин.
Ионнообменную хроматографию
белковых гидролизатов осуществляли на приборе Biotronic LC 5001 (ФРГ); 230x 3,2 мм; рабочее давление 50-60 атм; скорость подачи натрий-цитратного буфера 18,5; нингидрина - 9,25 мл/ч; детекция при 570 и 440 нм (для пролина).
Секретируемый L-фенилаланин и L-лейцин определяли
на приборе Beckman DU- 6 (США) при 540 нм, в образцах культуральной жидкости, объёмом 10 мкл после её обработки нингидрином.
Масс-спектры электронного удара
производных аминокислот снимали на приборе MB-80 A (Hitachi, Япония) при ионизирующем напряжении 70 эВ.
СПИСОК
ЛИТЕРАТУРЫ
.
1. Beaufrere B., Fournier V., Salle B., Putet G.
// American Journal of Physiology. 1992. V. 263. ¹. 1. P. 214-220.
2. McIntosh L. P., Dahlquist F. W.
// Quarterly Reviews of Biophysics. 1990. V. 23. P. 1-38.
3. Young V. R., Tu Y. M., Krempf M.
//New techniques in nutritional research/ Ed. Whitehead R. G. New York. Academic Press. 1990. V. 9. P. 17-72.
4. Fesic S. W. & Zuiderweg E. R.
// Quarterly Reviews of Biophysics. 1990. V. 23. ¹ 2. P. 97-131.
5. Haris P. I., Robillard G. T., Vandijk A. A., Chapman D.
// Biochemistry. 1992. V. 31. ¹ 27. P. 6279-6284.
6. Rothschild K. J., Braiman M. S., Yi-Wu He., Marti T. and Khorana H. G.
// J. of Biological Chemistry. 1990. V. 121. P.16985-16990.
7. Raap J., Winkel C., de Wit A. H. M., van Houten A. H. H., Hoff A. J., Lugtenburg J.
// Anal. Biochem. 1990. V. 191. P. 9-18.
8. Stockman B. J., Reily M. D., Westler W. M., Ulrich E. L., Markley J. L.
// Biochemistry. 1989. V. 28. P.230-236.
9. Ellman J. A., Volkman B. F., Mendel D.
// J. Am. Chem. Soc. 1992. V. 114. P. 7959-7961.
10. Redfield C. , Dobson C. M.
// Biochemistry. 1988. V. 27. P. 122-136.
11. Zuiderweg E. R. P., McIntosh L. P., Dahlquist F. W., Fesik S. W.
// J. Magn. Reson. 1986. V. 2. P. 210-216.
12. Hruby V. J.
// J. Synth. and Appl. Isot. Labelled Compounds. 1985. V. 4. P. 287-292.
13. Berger A., Smolarsky M., Kurn N., Bosshard H. R.
// J. Org Chem. 1973. V. 38. P. 457-460.
14. Raap J., Wolthuis W. N. E., Hehenkamp J. J. J., Lugtenburg J.
// Amino Acids. 1995. V. 8. P. 171-186.
15. Lugwig S. N., Unkefer C. J.
// J. Labelled Compd. Radiopharm. 1992. V. 31. P. 95-102.
16. van der Berg E. M. M., van Liemt J. H., Willem B. S.
// Recl. Trav. Chim. Pays-Bas. 1989. V. 108. ¹ 9. P. 304-313.
17. McIntosh L. P., Griffey R. H., Muchmore D. C., Nielson C. P., Redfield A. G., Dahlquist F. W.
// Proc. Natn. Acad. Sci. USA. 1987. V. 84. P. 1244-1248.
18. Karnaukhova E. N., Reshetova O. S., Semenov S. Y.,
Skladnev D. A., Tsygankov D. Y.
// Amino Acids. 1994. V. 6. ¹ 2. P. 165-176.
19. Katz J. J., Crespi H. L.
// Pure Appl. Chem. 1972. V. 32. P. 221-250.
20. Patel G. B., Sprott G. D., Ekiel I.
// Applied and Environmental Microbiology. 1993. P. 1099-1103.
21. LeMaster D. M., Cronan J. E.
// Journal of Biological Chemistry. 1982. V. 257. ¹ 3. P. 1224-1230.
22. LeMaster D. M.
// Quarterly Reviews of Biophysics. 1990. V. 23. P. 133-174.
23. Мосин О. В., Карнаухова Е. Н., Пшеничникова А. Б., Складнев Д. А., Акимова О. Л.
// Биотехнология. 1993. N. 9. С. 16-20.
24. Егорова Т. А., Мосин О. В., Ерёмин С. В., Карнаухова Е. Н., Звонкова Е. Н., Швец В. И.
// Биотехнология. 1993. N. 8. С. 45-50.
25. Мосин О. В., Складнев Д. А., Егорова Т. А., Юркевич А. М., Швец В. И.
// Биотехнология. 1996. ¹ 3. С. 3-12.
26. Stoeckenius W., Bogomolni R. A.
// Annu. Rev. Biochem. 1982. V. 51. P. 587-616.
27. Первушин К. В., Арсеньев А. С.
// Биоорганическая химия. 1995. Т. 21. ¹ 2. С. 83-111.
28. Steel J. C. H., Reynolds J. A.
// J. Biol. Chem. 1979. V. 254. P. 1633-1638
29. Звонкова Е. Н., Зотчик Н. В., Филлипович Е. И., Митрофанова Т. К., Мягкова Г. И., Серебренникова Г. А.
// Химия биологически активных природных соединений. М.: Химия, 1970. С.65-68.
30. Cohen J. S., Putter I.
// Biochim. Biophys. Acta. 1970. V. 222. P. 515-520.
31. Egorova T. A., Eremin S. V., Mitsner B. I., Zvonkova E. N., Shvets V. I.
// Journal of Chromatography B. 1995. V. 665. P. 53-62.
32. Daniely B.
// J. Org. mass spectrometry. 1989. V. 24. P. 225-229.
33. Физер Л. Ф., Физер М.
// Реагенты для органического синтеза. М.: Мир, 1971. Т. 2. С. 92.
34. Griffiths D. V., Feeney J., Roberts G. C., Burgen A. S.
// Biochim. et Biophys. Acta. 1976. V. 446. P. 479-585.
35. Matthews H. R., Kathleen S., Matthews K. and Stanley J.
// Biochim. et Biophys. Acta. 1977. V. 497. P. 1-13.
36. Miller J. H.
// Experiments in molecular genetics. Cold Spring Harbor Laboratory. Cold Spring Harbor. New York. 1976. P. 393.
37. Oesterhelt D., Hess B.
// Eur. J. Biochem. 1973. V.37. ¹.1. P. 316-326.
38. Tokunada F., Ebrey T.
// Biochemistry. 1978. V.17. ¹.10. P. 1915-1922..
39. Oesterhelt D., Stoeckenius W.
// Methods Enzymol. 1974. V. 31. P. 660-668.
40. Bligh E. G., Dyer W. J.
// Can. J. Biochem. Physiol. 1959. V. 37. ¹. 8. P. 911-918.
41. Мосин О. В., Егорова Т. А., Чеботаев Д. В., Складнев Д. А., Юркевич А. М., Швец В. И.
// Биотехнология. 1996. ¹ 4. С. 27-32.
MASS-SPECTROMETRY EVALUATION OF 2
H AND 13
C ENRICHMENT LEVELS OF AMINO ACIDS, OBTAINED FROM BACTERIAL OBJECTS
O.V.MOSIN
M. V. Lomonosov State Academy of Fine Chemical Technology, Moscow, 117571
The high-sensitive method of electron impact mass-spectroscopy was employed for evaluation of 2
H and 13
C enrichment levels of secreted amino acids of methylotrophic bacteria Brevibacterium methylicum and Methylobacillus flagellatum, and amino acid resigues of total protein obtained from media contaning as a sourse of stable isotopes (2
H)methanol, (13
C)methanol and 2
H2
O. The incorporation of L-[2,3,4,5,6-2
Н
]phenylalanine, L-[3,5-2
Н
]tyrosine and L-[2,4,5,6,7-2
Н
]tryptopan in bacteriorhodopsin synthesised in membrane of halophilic bacterium Halobacterium halobium ET 1001 was also made. For mass-spectrometric analysis the multicomponential mixures of amino acids, derived from cultural media and protein hydrolysates after hydrolysis in 6 M 2
H
С
l (3% phenol) and 2 M
Ва
(OH)2
were modified to N-benzyloxycarbonyl-derivatives of amino acids as well in methyl esters of N-dansyl-derivatives of amino acids which were preparative separated using a method of reverse-phase high column liquid chromatography (HCLP). [2
H]- and [13
C]amino acids obtained represented the mixures differing in quantities of isotopes incorporated into molecule. The levels of 2
H and 13
С
enrichment of secreted amino acids and amino acid resigues of protein were found to vary from 10% to L-leucine/isoleucine up to 97.5% for L-alanine depending on concentration of labelled substrates.
|