Содержание
Введение
Олово
Состав и свойства некоторых сплавов олова
Список литературы
Важнейшим этапом развития стало использование железа и его сплавов. В середине XIX века осваивается конвертерный метод производства стали, а к концу века - мартеновский.
Сплавы на основе железа и в настоящее время являются основным конструкционным материалом.
Бурный рост промышленности требует появления материалов с самыми различными свойствами.
Середина XX века ознаменована появлением полимеров - новых материал лов, свойства которых резко отличаются от свойств металлов.
Полимеры широко применяют также в различных областях техники: машиностроении, химической и пищевой промышленности и ряде других областей.
Развитие техники требует материалов с новыми уникальными свойствами. Для атомной энергетики и космической техники необходимы материалы, которые могут работать при весьма высоких температурах.
Компьютерные технологии стали возможными только при использовании материалов с особыми электрическими свойствами.
Таким образом, материаловедение - одна из важнейших, приоритетных наук, определяющих технический прогресс.
Олово - один из немногих металлов, известных человеку еще с доисторических времен. Олово и медь были открыты раньше железа, а сплав их, бронза, - это, по-видимому, самый первый "искусственный" материал, первый материал, приготовленный человеком.
Результаты археологических раскопок позволяют считать, что еще за пять тысячелетий до нашей эры люди умели выплавлять и само олово. Известно, что древние египтяне олово для производства бронзы возили из Персии.
Под названием "трапу" этот металл описан в древнеиндийской литературе. Латинское название олова stannum происходит от санскритского "ста", что означает "твердый".
Свойства олова:
Атомный номер ё50
Атомная масса 118,710
Изотопы
Стабильные 112, 114-120, 122, 124
Нестабильные 108-111, 113, 121, 123, 125-127
Температура плавления, ° С 231,9
Температура кипения, ° С 262,5
Плотность, г/см3 7,29
Твердость (по Бринеллю) 3,9
Содержание в земной коре, % (масс) 0,0004
Производство олова из руд и россыпей всегда начинается с обогащения. Методы обогащения оловянных руд довольно разнообразны. Применяют, в частности, гравитационный метод, основанный на различии плотности основного и сопутствующих минералов. При этом нельзя забывать, что сопутствующие далеко не всегда бывают пустой породой. Часто они содержат ценные металлы, например вольфрам, титан, лантаноиды. В таких случаях из оловянной руды пытаются извлечь все ценные компоненты.
Состав полученного оловянного концентрата зависит от сырья, и еще от того, каким способом этот концентрат получали. Содержание олова в нем колеблется от 40 до 70%. Концентрат направляют в печи для обжига (при 600...700°C), где из него удаляются относительно летучие примеси мышьяка и серы. А большую часть железа, сурьмы, висмута и некоторых других металлов уже после обжига выщелачивают соляной кислотой. После того как это сделано, остается отделить олово от кислорода и кремния. Поэтому последняя стадия производства чернового олова - плавка с углем и флюсами в отражательных или электрических печах. С физико-химической точки зрения этот процесс аналогичен доменному: углерод "отнимает" у олова кислород, а флюсы превращают двуокись кремния в легкий по сравнению с металлом шлак.
В черновом олове примесей еще довольно много: 5...8%. Чтобы получить металл сортовых марок (96,5...99,9% Sn), используют огневое или реже электролитическое рафинирование. А нужное полупроводниковой промышленности олово чистотой почти шесть девяток - 99,99985% Sn - получают преимущественно методом зонной плавки.
Олово получают также регенерацией отходов белой жести. Для того чтобы получить килограмм олова, не обязательно перерабатывать центнер руды, можно поступить иначе: "ободрать" 2000 старых консервных банок.
Всего лишь полграмма олова приходится на каждую банку. Но помноженные на масштабы производства эти полуграммы превращаются в десятки тонн... Доля "вторичного" олова в промышленности капиталистических стран составляет примерно треть общего производства. В нашей стране работают около ста промышленных установок по регенерации олова.
Снять олово с белой жести механическими способами почти невозможно, поэтому используют различие в химических свойствах железа и олова. Чаще всего жесть обрабатывают газообразным хлором. Железо в отсутствие влаги с ним не реагирует. Олово же соединяется с хлором очень легко. Образуется дымящаяся жидкость - хлорное олово SnCl4, которое применяют в химической и текстильной промышленности или отправляют в электролизер, чтобы получить там из него металлическое олово. И опять начнется "круговерть": этим оловом покроют стальные листы, получат белую жесть. Из нее сделают банки, банки заполнят едой и запечатают. Потом их вскроют, консервы съедят, банки выбросят. А потом они (не все, к сожалению) вновь попадут на заводы "вторичного" олова.
Другие элементы совершают круговорот в природе с участием растений, микроорганизмов и т.д. Круговорот олова - дело рук человеческих.
Сплавы. Одна треть олова идет на изготовление припоев. Припои - это сплавы олова в основном со свинцом в разных пропорциях в зависимости от назначения. Сплав, содержащий 62% Sn и 38% Pb, называется эвтектическим и имеет самую низкую температуру плавления среди сплавов системы Sn - Pb. Он входит в составы, используемые в электронике и электротехнике. Другие свинцово-оловянные сплавы, например 30% Sn + 70% Pb, имеющие широкую область затвердевания, используются для пайки трубопроводов и как присадочный материал. Применяются и оловянные припои без свинца. Сплавы олова с сурьмой и медью используются как антифрикционные сплавы (баббиты, бронзы) в технологии подшипников для различных механизмов.
| Область использования |
Состав сплавов, % по массе
|
Мех. св-ва |
| Sn |
Sb |
Сu |
Рb |
Предел прочности, МПа |
Относит. удлинение,% |
Твердость по Бринеллю, МПа |
Антифрикц.
сплавы
Припои*
|
88,7-90,2 |
7.3-7,8 |
2,5-3,5 |
80,0 |
18,5 |
240.0 |
| 81-84 |
10-12 |
5,5-6,5 |
90,0 |
6.0 |
300,0 |
| 89-90 |
Не более 0,05 |
- |
До 100 |
43,0 |
25 |
130 |
| 59-61 |
Не более: 0,05 |
- |
То же |
50,0 |
34 |
126 |
| 49-51 |
0,05-0,5 |
- |
-"- |
40,0 |
54 |
149 |
* Припои, содержащие менее 50% Sn, относятся к сплавам свинца
Многие сплавы олова - истинные химические соединения элемента №50 с другими металлами. Сплавляясь, олово взаимодействует с кальцием, магнием, цирконием, титаном, многими редкоземельными элементами. Образующиеся при этом соединения отличаются довольно большой тугоплавкостью. Так, станнид циркония Zr3Sn2 плавится лишь при 1985°C. И "виновата" здесь не только тугоплавкость циркония, но и характер сплава, химическая связь между образующими его веществами. Или другой пример. Магний к числу тугоплавких металлов не отнесешь, 651°C - далеко не рекордная температура плавления. Олово плавится при еще более низкой температуре - 232°C. А их сплав - соединение Mg2Sn - имеет температуру плавления 778°C. Современные оловянно-свинцовые сплавы содержат 90-97% Sn и небольшие добавки меди и сурьмы для увеличения твердости и прочности.
Соединения. Олово образует различные химические соединения, многие из которых находят важное промышленное применение. Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические. Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида - вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др. Другие оловоорганические соединения используются как сельскохозяйственные химикаты, для изготовления красок и консервации древесины.
Важнейшие соединения:
Диоксид олова SnO2
не растворим в воде. В природе - минерал касситерит (оловянный камень). Получают окислением олова кислородом. Применение: для получения олова, белый пигмент для эмалей, стекол, глазурей.
Оксид олова SnO, черные кристаллы. На воздухе выше 400°С окисляется, не растворим в воде. Применение: черный пигмент в производстве рубинового стекла, для получения солей олова.
Гидрид олова SnH2
получается в незначительных количествах как примесь к водороду при разложении кислотами сплавов олова с магнием (т.е. при действии водорода в момент выделения). При хранении постепенно разлагается на свободное олово и водород.
Тетрахлорид олова SnCl4
дымящая на воздухе жидкость, растворимо в воде. Применение: протрава при крашении тканей, катализатор полимеризации.
Дихлорид олова SnCl2
растворим в воде. Образует дигидрат. Применение: восстановитель в органическом синтезе, протрава при крашении тканей, для обесцвечивания нефтяных масел.
Дисульфид олова SnS2
, золотисто-желтые кристаллы, нерастворим. "Сусальное золото" - для отделки под золото дерева, гипса.
Сульфид олова SnS взаимодействует с концентрированными кислотами, не растворяется в воде. Применение: для повышения антифрикционных свойств подшипникового материала, катализатор полимеризации, для получения диоксида олова.
Олово в сплавах. На консервные банки идет примерно половина мирового производства олова. Другая половина - в металлургию, для получения различных сплавов. Самый известный сплав из олова - бронза (существуют также безоловянные бронзы: алюминиевые бронзы, кремнистые и бериллиевые). Одна из главных причин создания безоловянных бронз - дефицитность олова. Тем не менее бронза, содержащая олово, по-прежнему остается важным материалом и для машиностроения, и для искусства. Однофазные и двухфазные бронзы превосходят латуни в прочности и сопротивлении коррозии (особенно в морской воде).
Однофазные оловянные бронзы в катаном состоянии, особенно после значительной холодной пластической деформации, имеют повышенные прочностные и упругие свойства (> 40 кгс/мм2
).
Для двухфазной бронзы характерна более высокая износостойкость.
Важное преимущество двухфазных оловянистых бронз - высокие литейные свойства. Бронзы получают при литье наиболее низкий коэффициент усадки по сравнению с другими металлами, в том числе чугунами. Оловянные бронзы применяют для литых деталей сложной формы. Однако для арматуры котлов и подобных деталей они используются лишь в случае небольших давлений пара. Недостаток отливок из оловянных бронз - их значительная микропористость. Поэтому для работы при повышенных давлениях пара они все больше заменяются алюминиевыми бронзами.
Из-за высокой стоимости олова чаще используют бронзы, в которых часть олова заменена цинком (или свинцом).
Бронзы отличаются невысокой жидкотекучестью из-за большого интервала кристаллизации. По этой же причине в бронзе не образуется концентрированная усадочная раковина, а возникает рассеянная мелкая пористость. Линейная усадка у оловянных бронз очень невелика и составляет 0,8% при литье в песчаную форму и 1,4% при литье в кокиль. Указанные свойства облегчают получение отливок, от которых не требуется высокой герметичности.
В оловянные бронзы часто вводят фосфор. Фосфор, во-первых, раскисляет медь и уменьшает содержание водорода в расплаве; во-вторых, повышает прочностные свойства; в-третьих, улучшает жидкотекучесть и позволяет получать отливки сложной формы с тонкими стенками, в частности, качественное художественное литье.
Фосфор в бронзах с небольшим количеством олова повышает сопротивление износу из-за появления в структуре твердых частичек фосфида меди.
Однако фосфор ухудшает технологическую пластичность, поэтому в деформируемые сплавы вводят не более 0,5% фосфора.
Оловянные бронзы легируют цинком в больших количествах, но в пределах растворимости. При таких содержаниях цинк благоприятно влияет на свойства оловянных бронз:
снижает склонность к ликвации и повышает жидкотекучесть, поскольку он уменьшает температурный интервал кристаллизации сплавов;
способствует получению более плотного литья;
раскисляет расплав и уменьшает содержание в нем водорода;
улучшает прочностные свойства.
Из всех антифрикционных сплавов наилучшими свойствами обладают оловянные баббиты, в составе которых до 90% олова.
Мягкие и легкоплавкие свинцово-оловянные припои хорошо смачивают поверхность большинства металлов, обладают высокой пластичностью и сопротивлением усталости.
Однако область их применения ограничивается из-за недостаточной механической прочности самих припоев.
Составы оловянно-свинцовых припоев. Свойства оловянно-свинцовых припоев.
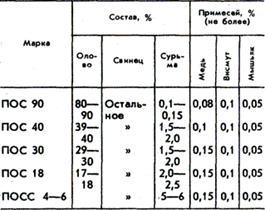 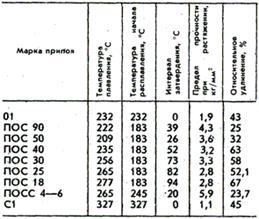
Припои имеют различное назначение, например: ПОС 90 - для паяния внутренних швов пищевой посуды (электрочайники, кастрюли и т.п.); ПОС 40 - паяние латуни, железа и медных проводов; ПОС 30 - паяние латуни, меди, железа цинковых и оцинкованных листов, белой жести, приборов, радиоаппаратуры, гибких шлангов и бандажной проволоки электромоторов.
Олово входит также в состав типографского сплава гарта, из-за чего гарт имеет низкую температуру плавления (240-350 °С) и хорошие литейные свойства.
Наконец, сплавы на основе олова очень нужны электротехнике. Важнейший материал для электроконденсаторов - станиоль; это почти чистое олово, превращенное в тонкие листы (доля других металлов в станиоле не превышает 5%).
Тот факт, что олово образует довольно многочисленные сплавы такого рода, заставляет критически отнестись к утверждению, что лишь 7% производимого в мире олова расходуется в виде химических соединений ("Краткая химическая энциклопедия", т.3, с.739). Видимо, речь здесь идет только о соединениях с неметаллами.
Соединения с неметаллами. Из этих веществ наибольшее значение имеют хлориды. В тетрахлориде олова SnCl4 растворяются иод, фосфор, сера, многие органические вещества. Поэтому и используют его главным образом как весьма специфический растворитель. Дихлорид олова SnCl2 применяют как протраву при крашении и как восстановитель при синтезе органических красителей. Те же функции в текстильном производстве еще у одного соединения элемента №50 - станната натрия Na2SnO3. Кроме того, с его помощью утяжеляют шелк.
Промышленность ограниченно использует и окислы олова. SnO применяют для получения рубинового стекла, a SnO2 - белой глазури. Золотисто-желтые кристаллы дисульфида олова SnS2 нередко называют сусальным золотом, которым "золотят" дерево, гипс. Это, если можно так выразиться, самое "антисовременное" применение соединений олова. А самое современное?
Если иметь в виду только соединения олова, то это применение станната бария BaSnO3 в радиотехнике в качестве превосходного диэлектрика. А один из изотопов олова, 119Sn, сыграл заметную роль при изучении эффекта Мессбауэра - явления, благодаря которому был создан новый метод исследования - гамма-резонансная спектроскопия. И это не единственный случай, когда древний металл сослужил службу современной науке.
На примере серого олова - одной из модификаций элемента №50 - была выявлена связь между свойствами и химической природой полупроводникового материала. И это, видимо, единственное, за что серое олово можно помянуть добрым словом: вреда оно принесло больше, тем пользы. Мы еще вернемся к этой разновидности элемента №50 после рассказа о еще одной большой и важной группе соединений олова.
Оловоорганика. Элементоорганических соединений, в состав которых входит олово, известно великое множество. Первое из них получено еще в 1852 г.
Сначала вещества этого класса получали лишь одним способом - в обменной реакции между неорганическими соединениями олова и реактивами Гриньяра. Вот пример такой реакции:
SnCl4 + 4RMgX SnR4 + 4MgXCl
(R здесь - углеводородный радикал, X - галоген).
Соединения состава SnR4 широкого практического применения не нашли.
Впервые интерес к оловоорганике возник в годы первой мировой войны. Почти все органические соединения олова, полученные к тому времени, были токсичны. В качестве отравляющих веществ эти соединения не были использованы, их токсичностью для насекомых, плесневых грибков, вредных микробов воспользовались позже. На основе ацетата трифенилолова (C6H5) 3SnOOCCH3 был создан эффективный препарат для борьбы с грибковыми заболеваниями картофеля и сахарной свеклы. У этого препарата оказалось еще одно полезное свойство: он стимулировал рост и развитие растений.
Для борьбы с грибками, развивающимися в аппаратах целлюлозно-бумажной промышленности, применяют другое вещество - гидроокись трибутилолова (С4Н9) 3SnOH. Это намного повышает производительность аппаратуры.
Много "профессий" у дилаурината дибутилолова (C4H9) 2Sn (OCOC11H23) 2. Его используют в ветеринарной практике как средство против гельминтов (глистов). Это же вещество широко применяют в химической промышленности как стабилизатор поливинилхлорида и других полимерных материалов и как катализатор. Скорость реакции образования уретанов (мономеры полиуретановых каучуков) в присутствии такого катализатора возрастает в 37 тыс. раз.
На основе оловоорганических соединений созданы эффективные инсектициды; оловоорганические стекла надежно защищают от рентгеновского облучения, полимерными свинец - и оловоорганическими красками покрывают подводные части кораблей, чтобы на них не нарастали моллюски.
Все это соединения четырехвалентного олова. Органические соединения двухвалентного олова, напротив, немногочисленны и практического применения пока почти не находят.
Серое олово. Как и многие другие элементы, олово имеет несколько аллотропических модификаций, несколько состояний. (Слово "аллотропия" переводится с греческого как "другое свойство", "другой поворот") При нормальной плюсовой температуре олово выглядит так, что никто не может усомниться в принадлежности его к классу металлов.
Белый металл, пластичный, ковкий. Кристаллы белого олова (его называют еще бета-оловом) тетрагональные. Длина ребер элементарной кристаллической решетки - 5,82 и 3,18. Но при температуре ниже 13,2°C "нормальное" состояние олова иное. Едва достигнут этот температурный порог, в кристаллической структуре оловянного слитка начинается перестройка. Белое олово превращается в порошкообразное серое, или альфа-олово, и чем ниже температура, тем больше скорость этого превращения. Максимума она достигает при минус 39°C.
Кристаллы серого олова кубической конфигурации; размеры их элементарных ячеек больше - длина ребра 6,49. Поэтому плотность серого олова заметно меньше, чем белого: 5,76 и 7,3 г/см3 соответственно.
Результат превращения белого олова в серое иногда называют "оловянной чумой". Пятна и наросты на армейских чайниках, вагоны с оловянной пылью, швы, ставшие проницаемыми для жидкости, - следствия этой "болезни".
Почему сейчас не случаются подобные истории? Только по одной причине: оловянную чуму научились "лечить". Выяснена ее физико-химическая природа, установлено, как влияют на восприимчивость металла к "чуме" те или иные добавки. Оказалось, что алюминий и цинк способствуют этому процессу, а висмут, свинец и сурьма, напротив, противодействуют ему.
Кроме белого и серого олова, обнаружена еще одна аллотропическая модификация олова - гамма-олово, устойчивое при температуре выше 161°C. Отличительная черта такого олова - хрупкость. Как и все металлы, с ростом температуры олово становится пластичнее, но только при температуре ниже 161°C. Затем оно полностью утрачивает пластичность, превращаясь в гамма-олово, и становится настолько хрупким, что его можно истолочь в порошок.
Изотопы. Олово - один из самых "многоизотопных" элементов: природное олово состоит из десяти изотопов с массовыми числами 112, 114...120, 122 и 124. Самый распространенный из них 120
Sn на его долю приходится около 33% всего земного олова. Почти в 100 раз меньше олова-115 - самого редкого изотопа элемента №50. Еще 15 изотопов олова с массовыми числами 108...111, 113, 121, 123, 125...132 получены искусственно. Время жизни этих изотопов далеко не одинаково. Так, олово-123 имеет период полураспада 136 дней, а олово-132 всего 2,2 минуты.
Изотопы олова 117
Sn и 119
Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Дефицит олова. Несколько лет назад американское Горное бюро опубликовало расчеты, из которых следовало, что разведанных запасов олова хватит миру самое большее на 35 лет. Правда, уже после этого было найдено несколько новых месторождений, в том числе крупнейшее в Европе, расположенное на территории Польши. И тем не менее дефицит олова продолжает тревожить специалистов.
1. Беленький М.А., Иванов А.Ф. Электроосаждение металлических покрытий. Справ. изд. М.: "Металлургия", 1985.
2. Вячеславов П.М. Электролитическое осаждение сплавов. Л.: "Машиностроение", 1986
3. Томашов Н.Д., Чернова Г.П. Коррозия и коррозионностойкие сплавы. М.: "Металлиргия", 1973.
4. Россошинский А.А., Лапшов Ю.К., Яценко Б.П., Олово в процессах пайки, К., 1985;
5. Часть стати Н.В. Одноралова "СЕКРЕТЫ МАСТЕРА" в ж. "СДЕЛАЙ САМ" №2, 1991 стр.61-68
|