ЗМІСТ
Вступ
Розділ 1 Загальна характеристика хімічної промисловості
Розділ 2 Технологія азотної кислоти
2.1 Фізико-хімічні основи процесу
2.2 Технологічна схема виробництва азотної кислоти
Розділ 3 Практична частина
3.1 Розрахунок матеріального балансу
3.2 Теплові розрахунки хімічного реактора
Розділ 4 Оцінка екологічності виробництва
Висновок
Список літератури
Хімічний комплекс охоплює галузі промисловості, що виробляють сировину й конструкційні матеріали. Найважливішою галуззю в цьому комплексі є виробництво з
неорганічних та органічних речовин різних хімічних сполук для інших промисловостей. Сировинна бази хімічної промисловості диференціюється залежно від природних та економічним особливостей окремих країн та регіонів. В одних районах – це вугілля, коксовий газ, в інших - нафта, сумішні нафтові гази, солі, сірчаний колчедан, газові відходи чорної та кольорової металургії, у третіх - кухонна сіль тощо. Сировинний фактор впливає на спеціалізацію окремих територіальних поєднань хімічних виробництв. Хімічне виробництво в міру вдосконалення технологічних методів може, в свою чергу, впливати на сировинну базу.
Розвиток хімічної промисловості потребує все більшого акцентування уваги на розробці та впровадженні високоефективних енерго- та ресурсозберігаючих, а також екологічно чистих технологій.
Мета роботи – охарактеризувати основні технологічні процеси виробництва азотної кислоти та наслідки для навколишнього середовища.
Основні завдання роботи:
1) Дати загальну характеристику хімічної промисловості;
2) Провести аналіз фізико-хімічних основ виробництва азотної кислоти;
3) Провести розрахунок матеріального балансу процесів.
Хімічна промисловість пов'язана з багатьма галузями. Вона комбінується з нафтопереробною, коксуванням вугілля, чорною та кольоровою металургією, лісовою промисловістю. Завдяки складній системі зв'язків утворюються такі або інші поєднання виробництв, зяких формуються міжгалузеві комплекси. До таких комплексів належить і хіміко-лісовий. В одних випадках роль хімічної промисловості у цих комплексах провідна, в інших вона не має формуючого значення, лише доповнюючи усталену систему зв'язків. Проте загалом хімічну промисловість слід розглядати як головну галузь, що визначає склад і напрям розвитку комплексу. Здебільшого лісова промисловість розглядається у цьому комплексі як постачальник деревини для хімічної промисловості. Хімічна промисловість має дуже складну галузеву структуру, що охоплює близько 200 взаємопов'язаних виробництв з великою номенклатурою продукції. Ці виробництва об'єднані у три великі групи: неорганічна або основна хімія, хімія органічного синтезу та гірничо-хімічна промисловість.
Неорганічна хімія переважно виробляє напівфабрикати, що використовуються в інших галузях промисловості. Виняток становлять мінеральні добрива, які виробляє певна галузь.
До органічної хімії відносяться виробництва вуглеводної сировини, органічних напівфабрикатів, синтетичних матеріалів. Основною сировиною для хімії органічного синтезу є вуглеводні нафти, природний та попутний газ. Використовуються також вуглеводні сполуки, що одержуються з вугілля.
Гірничо-хімічна промисловість утворює сировинну базу передусім для неорганічної хімії.
Розглянемо деякі хімічні галузі окремих країн світу. Хімічна промисловість розташована передусім у розвинутих країнах. Лише у США виробляється понад чверть, а в шістьох найрозвинутіших країнах - понад 3/4 хімічної продукції світу.
Закономірність розвитку хімічної промисловості у США пояснюється наявністю на їх території чималої кількості практично усіх видів хімічної сировини: нафти, газу, солей, фосфоритів тощо. Інші розвинуті країни значно залежать від імпорту хімічної сировини.
Розвинені країни мають потужну багатогалузеву хімічну промисловість. Навпаки, у невеликих країнах розвинута переважно одна галузь. Наприклад, у Швейцарії - фармацевтична, у Нідерландах - гумовотехнічна промисловість.
Основна хімія як галузь обіймає кислотну, содову промисловість та виробництво мінеральних добрив. Родовища природної сірки розташовані переважно в США, Канаді, Мексиці, Італії, і пластмасові вироби), Запоріжжі (кремній-органічні сполуки, синтетичні смоли), Дніпродзержинську (полівініл, полістирол), а також Калуші, Одесі, Києві, Фастові, що виробляють хімічну продукцію і стали центрами переробки синтетичних смол на пластмасові, плівкові та інші вироби.
Промисловість хімічних волокон. Найбільші підприємства розміщені у Чернігові, Києві (Дарницький шовковий комбінат), Черкасах.
Виробництво розведеної азотної кислоти з аміаку складається з наступних стадій:
1) контактне окисення аміаку до оксиду азоту (ІІ):
4NH3
+ 5О2
→ 4NO + 6Н2
О, ∆Н = - 907 кДж (а)
2) окислення NОдо NO2
:
2NO+O2
↔2NO2
, ∆Н = -112кДж(б)
3) абсорбція діоксиду азоту водой з утворенням розбавленої азотной кислоти:
3NO2
+ H2
O ↔ 2HNO3
+ NO, ∆Н = — 136 кДж(в)
Оксидазоту, щовиділяєтьсяприцьому, (ІІ) окислюєтьсядодіоксидуізновуабсорбується.
Контактне окислення аміаку.
При окисленні аміаку крім основної реакції (а) можуть протікати й інші процеси:
4NH3
+ 4О2
→ 2N2
O + 6Н2
О ∆Н = -1105 кДж (г)
4NH3
+ 3О2
→ 2N2
+ 6Н2
О, ∆Н = -1270 кДж (д)
4NH3
+ 6NO → 5N2
+ 6H2
O, ∆Н = -1810 кДж(е)
які приводять до непродуктивної витрати аміаку.
Рівновага реакцій окислювання аміаку (а), (г), (д) в умовах виробництва повністю зміщена вправо. Обчислені для реакцій (а) і (д) константи рівноваги при 750 °С мають значно малі значення:
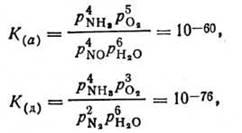
Отже, перетворення аміаку в кінцеві продукти при 750 °С може досягати майже 100%. Загальна швидкість процесу визначається співвідношенням швидкостей реакцій (а) - (е). Під час відсутності каталізатора найбільш швидкої є реакція окислювання до елементного азоту. Природно, що в азотнокислотному виробництві процес окислення проводять на каталізаторах, які мають властивість вибіркової дії, тобто на таких каталізаторах, які різко прискорюють реакцію одержання NO в порівнянні з іншими реакціями окислювання аміаку.
В азотнокислотній промисловості в основному застосовують платинові каталізатори. Процес окислювання аміаку на платиновому каталізаторі відноситься до числа найбільш швидких каталітичних реакцій, відомих у даний час. У виробничих умовах практично повне окислювання аміаку досягається за (1-2) 10-4 с.
Швидкість каталітичного окислювання аміаку.
Швидкість процесу окислювання залежить від технологічного режиму процесу і конструкції контактного апарату. На високоактивних платиноїдних каталізаторах процес протікає в дифузійній області. На менш активних (оксидних) каталізаторах при знижених температурах окислювання аміаку визначається швидкістю каталітичних актів, тобто протікає в кінетичній області.
Підвищення температури сприяє збільшенню не тільки швидкості хімічної реакції, але і коефіцієнта дифузії аміаку в суміші. Тому підвищення температури - ефективний засіб збільшення швидкості процесу окислювання, що протікає як у кінетичної, так і в дифузійній області. Однак підвищення температури каталізу вище ~850°С знижує вихід NO і підвищує вихід елементного азоту (мал. 1) за рахунок реакції (д), а також термічної дисоціації NH3
і інших шкідливих побічних реакцій. На платиновому каталізаторі підтримують температуру від 800°С при атмосферному тиску і до 900 °С при підвищеному тиску, при якому час контакту сильно зменшуються і побічні реакції практично не встигають протікати. На низькоактивних неплатинових оксидних каталізаторах час зіткнення необхідно збільшувати в десятки разів у порівнянні з платиновим. Оптимальна температура знижується до 700-750 °С.
Підвищення тиску прискорює процес окислювання NН3
, тому що збільшуються концентрації реагуючих компонентів у реакційному обсязі, зменшується обсяг газової суміші.
Однак при підвищеному тиску істотно зростає віднесення дрібних часточок платини з газами, що здорожує товарну кислоту, оскільки платина має високу вартість, а процес уловлювання мікроскопічних часточок платини з нітрозних газів після контактного апарата досить складний і не забезпечує повного усунення втрат платини. При підвищенні тиску необхідно збільшувати товщину стінок апаратури, у результаті чого зростає її вартість. Тому застосовують надлишковий тиск 0,2-1 МПа.

Рис. 1. За
лежні
сть ст
у
пен
я
перетворення
ам
і
ак
у
від
температур
и
(τ= =
const
, катал
і
затор
Pt
—
Pd
—
Rh
)
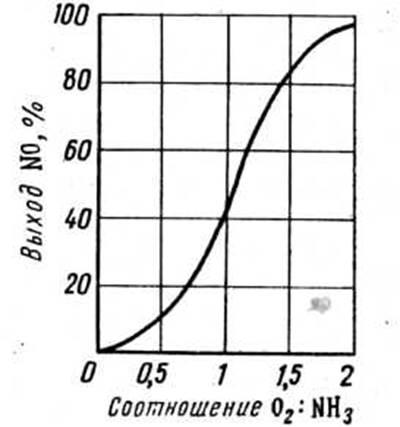
Рис. 2. Залежність виходу оксиду азоту від відношення концентрацій кисню й аміаку
Склад газової суміші впливає на температурний режим і загальну швидкість процесу, особливо якщо лімітує не дифузія, а хімічна реакція між NH3
і О2
. По рівнянню реакції (а) на 1 моль NH3
витрачається 1,25 моль О2
, однак при такому співвідношенні компонентів вихід оксиду азоту (ІІ) не перевищує 65%, тобто дуже малий (мал. 2). Для збільшення ступеня окислювання аміаку на практиці застосовують співвідношення O2
:NH3
=1,8-2,0, що відповідає вмісту аміаку в аміачно-повітряній суміші 9,5-10,5 (об. частки в %). Варто враховувати, що при звичайній температурі суміш аміаку з повітрям вибухонебезпечна в інтервалі 16-27% NH3
. При підвищенні температури межавибуховості розширюються.
Промислові каталізатори процесу окислювання аміаку.
Ці каталізатори являють собою сплав платини з 4% Pd і 3% Rh. Платинові каталізатори виготовляють у вигляді сіток з тонкого дроту діаметром 0,06-0,09 мм, що мають 1024 отвору в 1 см2
. Сітки ці для створення визначеного часу контактування скріплюються у вигляді пакета, встановленого в контактному апараті.
На 1 м2
активній поверхні контактної сітки під атмосферним тиском можна окислити до 600 кг, а при тиску 0,8 МПа - до 3000 кг аміаку на добу. Однак при роботі під тиском 0,8 МПа і вище платиновий каталізатор руйнується швидше.
Руйнуванню каталізатора сприяють і багато контактних отрут (сполуки сірки, фосфін і ін.), які крім отруєння каталізатора знижують його механічну міцність. Домішки (пил, іржа, мастило і т.п. ), що утримуються в газі, також знижують активність і міцність каталізатора. Для відновлення активності каталізатора його промивають розведеним розчином соляної кислоти. Усе це приводить до того, що в процесі окислювання аміаку каталізатор стає пухким і дрібними частками його несуться з потоком газу. Якщо під атмосферним тиском віднесення платини на 1 т азотної кислоти складає 0,04-0,06 г, то при підвищеному він досягає вже 0,15-0,20. Частина Pt уловлюється і регенерується, але і при цьому витрати платини складають значну частину собівартості азотної кислоти.
З метою економії платини застосовують двухстадійне контактування, при якому аміак частково окисляється на платиноїдних сітках, а потім доокислюється в шарі неплатинового зернистого каталізатора. Як неплатинові каталізатори застосовують різні композиції оксидів або солей, у тому числі оксиди заліза або хрому, солі кобальту.
Питома продуктивність платинового каталізатора висока завдяки високій швидкості реакції окислювання. Якщо швидкість усього процесу окислювання визначається швидкістю дифузії аміаку в газі, то інтенсивність роботи каталізатора 1 [кмоль/(м2
*с*Па)] буде характеризуватися рівнянням
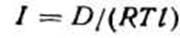
де D - коефіцієнт дифузії аміаку в повітрі; R - молярна газова стала; Т - абсолютна температура; l - середня довжина дифузійного шляху молекули аміаку.
Активність каталізаторів може сильно знижуватися внаслідок отруєння деякими домішками, що маються в газовій суміші, або ж у результаті дії механічних суспензій. До найбільш сильних контактних отрут процесу окислювання аміаку належать сполуки сірки і фосфору.
У промисловості застосовується кілька типів контактних апаратів для окислення аміаку. Однак усі вони мають приблизно однаковий принцип дії.
При підвищеному тиску встановлюють до 18 сіток. При двухстадійному контактуванні (мал. 3) число платиноїдних сіток може бути знижене до 1-3 (при підвищеному тиску).
Окислення оксиду азоту (ІІ) до діоксиду. Нітрозні гази, одержані при окисленні аміаку, містять NО і інші оксиди азоту, кисень, азот і пари води. Для одержання азотної кислоти оксид азоту (ІІ) необхідно окислити до діоксиду.
Процес окислення NО киснем повітря описують наступним сумарним (балансовим) рівнянням:
2NO+O2 ↔ 2NO2, ∆Н=-112кдж(ж)
Відповідно до принципу Ле Шателье рівновага цього процесу зміщується вправо при підвищенні тиску і зниженнітемператури. Практично утворення діоксиду азоту починається при температурі нижче 700°С, а при температурі нижче 100°С рівновага майже цілком зміщена вправо.
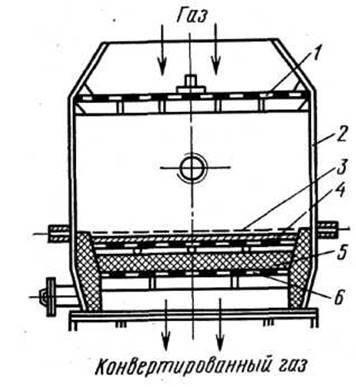
Рис. 3. Контактний апарат
1 - розподільні ґрати; 2 - корпус апарата; 3 - платиноїдна сітка; 4 - шар неплатинового каталізатора; 5 - насадка; 6-опорні ґрати
Константа швидкості процесу збільшується зі зниженням температури, що іноді розглядають як порушення закону Арреніуса. У дійсності це явище можна пояснити тим, що процес по формулі (ж) протікає в дві стадій. Спочатку відбувається швидка оборотна екзотермічна реакція димеризації оксиду азоту
2NO ↔N2
O2
(з)
а потім окислення димера по екзотермічній практично необоротній (при t<100°С) реакції
N2
O2
+ О2
↔ 2NO2
(і)
При підвищенні температури рівновага реакції (з) зміщується вліво, концентрація димера N2
O2
сильно знижується. Відповідно знижується і швидкість реакції (і)
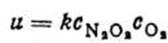
У результаті зменшується і загальна швидкість процесу. Тому для збільшення швидкості перетворення NO у NO2
реакційну суміш енергійно охолоджують. Підвищення тиску сприяє зміщенню рівноваги по реакції (з) в бік димера і збільшенню швидкості реакції (і). Підвищується і ступінь абсорбції діоксиду азоту. Тому в останні роки у виробництві азотної кислоти перейшли від установок під атмосферним тиском до підвищеного тиску до 1 МПа.
При окислюванні оксиду азоту може протікати реакція асоціації NO2
з утворенням димера:
2NO2
↔Ν2
О4
∆Н = -57 кДж
Швидкість цієї реакції дуже велика, а рівновага з підвищенням тиску і зменшенням температури зміщується в праву сторону.
Таким чином, у нітрозних газах, що надходять на абсорбцію, містяться NO2
, N2
O4
, O2
, N2
O, NO, N2
O2
, N2
, пари води та ін.
Абсорбція діоксиду азоту і його димера протікає за схемами
2 NO2
+ Н2
О ↔ HNO3
+ HNO2
, ∆Н = - 116 кДж
N2
О2
+ Н2
О ↔ HNO3
+ HNO2
, ∆Н = - 59 кДж
Одержана при цьому азотиста кислота нестійка і розкладається:
3HNO2
↔HNO3
+ 2NO + Н2
О, ∆Н = 76 кДж
Тому сумарно взаємодію NO2
з водою можна представити рівнянням реакції
3NO2
+Н2
О→ 2HNO3
+ NO, ∆H = - 136 кДж
Поглинання діоксиду азоту водою - типовий хемосорбциійний процес у системі газ - рідина.
У виробництві необхідно одержувати кислоту як можна вищої концентрації. При цьому збільшується пружність оксидів азоту над розчином кислоти, що знижує рушійну силу процесу і, отже, загальну швидкість процесу. Для зміщення рівноваги убік утворення HNO3
необхідно знижувати температуру, а також підвищувати тиск. При абсорбції оксидів азоту використовують принцип протипотоку, тобто більш концентрований газ кантактує з концентрованою кислотою, а наприкінці абсорбції залишки NO2
поглинаються найбільш слабкою кислотою.
Внаслідок екзотермічності процесу абсорбції температура вихідної продукційної кислоти звичайно складає не менш 50 °С, тому в установках, що працюють під атмосферним тиском, виходить кислота, що містить лише 50% HNO3
. В установках, що працюють під тиском 0,6-0,8 МПа, можна одержати 58-60%-ну кислоту. Піднімаючи тиск до 5 МПа, в установках прямого синтезу HNO3
з оксидів азоту і кисню одержують кислоту концентрацією 98% HNO3
.
Для одержання розведеної азотної кислоти з аміаку в промисловості донедавна використовували три системи: 1) під атмосферним тиском; 2) під підвищеним тиском і 3) комбіновані, у яких окислення аміаку відбувається під атмосферним тиском, а окислення оксиду азоту й абсорбція NO2
водою - під підвищеним тиском.
Незважаючи на менші витрати платини, системи виробництва кислоти під атмосферним тиском у даний час не застосовуються через низьку продуктивність, громіздкості апаратури і відповідно значні капіталовкладення, істотні втрати аміаку і необхідність застосування дорогого і не надто ефективного лужного очищення газів, які виділяються з оксидів азоту. Сучасні установки, що працюють під підвищеним тиском (від 0,2 до 1 МПа), і комбіновані розроблені за принципом енерготехнологічних систем, у яких енергія газів (пов'язана з їх високою температурою і тиском) і теплота реакції окислення аміаку використовуються для стиску повітря і нітрозних газів, а також одержання технологічної пари. Цими ж схемами передбачено більш повне використання низкопотенційної теплоти.
Принципова технологічна схема одержання розведеної азотної кислоти під підвищеним тиском наведена на мал. 4.
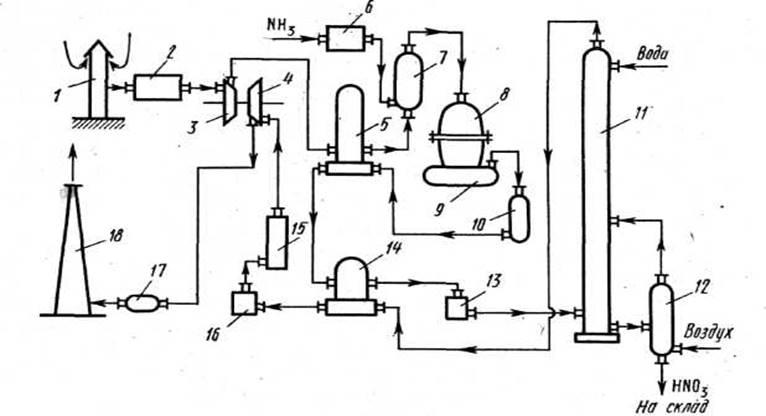
Рис. 4. Принципова технологічна схема одержання розведеної азотної кислоти під підвищеним тиском (0,73 М
П
а)
1 - повітрозабірна труба; 2 - повітроочисник; 3 - газовий компресор; 4 - газова турбіна; 5 - повітропідігрівач; 6 - випарник аміаку; 7 - змішувач з фільтром; 8 - контактний апарат; 9, 17-казан-утилізатор; 10- окислювач з фільтром; 11 - абсорбційна колона; 12 - обдувна колона; 13 - холодильник-конденсатор; 14 - підігрівач хвостових газів; 15 - реактор каталітичного очищення; 16 - камера згоряння; 18 - вихлопна труба
Атмосферне повітря після відповідного очищення надходить у компресор 3, який приводиться в рух газовою турбіною 4. У компресорі повітря стискається до тиску 0,73 МПа, нагріваючись при цьому до 135°С, і надходить далі в підігрівач повітря 5, де його температура підвищується до 250 °С за рахунок теплоти нітрозних газів, яківиходять з окислювача 10. У змішувачі 7 повітря змішується з газоподібним аміаком, яке надходить сюди з випарника аміаку 6. Аміачно-повітряна суміш, що утворилася, далі надходить у контактний апарат 8, де при температурі близько 900 С на Pt-Rh-Pd-каталізаторі відбувається окислення аміаку. Нітрозні гази, що містять 9,0- 9,5% NO, надходять у казан-утилізатор 9, у якому відбувається охолодження до необхідної температури й утворення пари. Далі гази надходять в окислювач 10, у якому окислюються до діоксиду азоту. Охолоджені в підігрівачі повітря 5, підігрівачі хвостових газів 13 і холодильнику-конденсаторі 12 до температури близько 45 °С нітрозні гази надходять в абсорбційну колону 11, зрошувану протипотоковим струменем води. Оскільки абсорбція NO2
водою екзотермічна, абсорбційні тарілки мають змієвидні холодильники, у яких циркулює охолодна вода (на схемі не показано). Отримана азотна кислота надходить в обдувну колону 12, де за допомогою гарячого повітря з готової азотної кислоти відбувається обдувка розчинених у ній нітрозних газів, що подаються в абсорбційну колону. Хвостові гази, пройшовши систему каталітичного очищення від оксидів азоту відновленням їх аміаком до елементного азоту, викидаються в атмосферу.
В установках такого типу ступінь перетворення аміаку в азотну кислоту досягає 98-99%, а концентрація кислоти - 60-62%. Однак при окисленні аміаку під тиском збільшуються витрати платинового каталізатора. Тому застосовують системи, у яких окислення аміаку проводять при більш низькому тиску (~0,4 МПа), ніж окислення оксиду азоту (до 1,2 МПа).
Сучасні азотнокислі ХТС характеризуються високою потужністю окремої технологічної нитки, що складає 380-400 тис. т/рік. Зазначені системи дозволяють одержати лише розведену азотну кислоту. Для виробництва вибухових речовин, деяких пластичних мас, барвників потрібна концентрована кислота (98%). Азотну кислоту такої концентрації можна одержати або концентруванням розведеної азотної кислоти або прямим синтезом.
Відгоном води з розведеної азотної кислоти можна одержати лише 68%-ний розчин, оскільки саме така концентрація відповідає азеотропній суміші HNO3
—Н2
О. Тому концентрування проводять із застосуванням водовіднімаючих засобів, таких, наприклад, як 92-94%-на H2
SO4
. Концентрована сірчана кислота, яка утворює при цьому гідрати, кипить при більш високій температурі, ніж 100%-на HNO3
. У якості водозабираючого засобу може використовуватися також нітрат магнію.
В даний час значне застосування знаходить прямий синтез концентрованої азотної кислоти, що протікає за рівнянням реакції
2N2
O4
(р) + 2Н2
О (р) + О2
(г) ↔ 4HNO3
(р), ∆Н = - 59,5 кДж
Поглинання димера діоксиду здійснюється розведеною азотною кислотою, що містить близько 45% води. Ця операція здійснюється в автоклаві при 90 °С і 5 МПа. В автоклаві виходить так званий нітроолеум HNO3
* nNO2
, що містить до 25% NO2
. Після обдувки диоксиду азоту і виходить 97-98%-на азотна кислота.
Матеріальний баланс хіміко-технологічного процесу — це математичне вираження закону збереження маси речовини, відповідно до якого маса всіх видів сировини і матеріалів, що надходять на переробку (прихід), дорівнює масі отриманих продуктів і витрат при перебігу хімічних реакцій.
Метою матеріального балансу є визначення витратних коефіцієнтів усіх вихідних реагентів за заданою продуктивністю цільового продукту, а також обчислення складу вихідної суміші і продуктів реакції.
Основою для матеріальних розрахунків будь-якою хіміко-технологічного процесу є рівняння всіх хімічних реакцій (основної та побічних), які перебігають у цьому процесі.
Стадія конверсії аміаку у виробництві азотної кислоти
Для реакції:
4NH3
+ 5О2
= 4NO + 6H2
O: ∆Н = 946*103
кДж /кмоль
скласти матеріальний баланс на 40 тонн оксиду (ІІ) азоту за годину.
Вихідні дані для розрахунку: ступінь досягнення рівноваги - 1, тиск - 0,73 МПа, температура газу на виході з реактора, К: Т = 1123 + 2N; вихідні концентрації [молярна частка, %] аміаку - 9 + 0,IN, кисню - 17 + 0,1 N решта – азот.
Розрахувати і критично оцінити початкову температуру газової суміші, якщо процес відбувається адіабатично. Обґрунтувати конструкцію реактора і розрахувати масу каталізатора, якщо його інтенсивність (І)дорівнює 3,84 тони NH3
на добу.
Для реакції:
4NH3
+ 5О2
= 4NO + 6H2
O:
для заданої кількості 40000 (кг) цільового продукту практичний витратний коефіцієнт (кг) за компонентом А становить
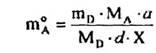
де МА
, МD
- молярні маси компонентів А і D, г/моль; X- ступінь перетворення за компонентом А (взятим за умови нестачі щодо компонента В); об'єм компонента А (м3
) при цьому становить

де рА
- густина компонента А, кг/м .
Вихідні маси т° і об'єм V° вcix компонентів реакції дорівнюють.
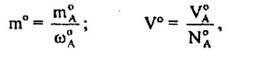
де ωА
0
, NА
0
- масова і об'ємна частки реагенту А у вихідній суміші відповідно.
Вихідна маса і об'єм реагенту В (аналогічно Dі Е) дорівнюють:

Маса і об'єм продукту D, що утворився у ході реакції, становлять:
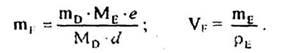
І нарешті, кількості А, В, D, Е після перебігу реакції дорівнюють:
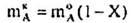

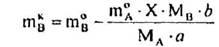
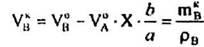

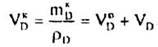
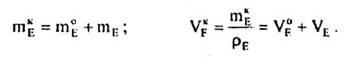
Враховуючи вихідні концентрації [молярна частка, %]
аміаку - 9 + 0,1*40 = 13%
кисню - 7 + 0,1 40 = 11%
азоту – 66 %.
Молярні маси компонентів реакції становлять
М (NH3
) = 17 г/моль,
М (О2
) = 32 г/моль,
М (NO) = 30 г/моль,
М (Н2
О) = 18 г/моль.
Р (NH3
) = 17 / 22,4 = 0,76;
Р (О2
) = 32 / 22,4 = 1,42;
Р (NO) = 30 / 22,4 = 1,34,
P (Н2
О) = 18 /22,4 = 0,8.
Тоді V (NH3
) = 40000 / 1,34 = 29850,7 м3
,
m0
NH
3
= 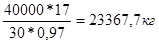
V0
(NH3
) = 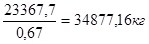
V0
= 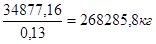
V0
O2
= 268285.8 * 0.21 = 56340 м3
m0
O2
= 56340 * 1,42 = 80002,8 кг
V0
NO
= 268285.8 * 0.66 = 177068.6 м3
m0
NO
= 177068.6 * 1,34 = 237271.9 кг
Результати розрахунків заносимо до таблиці до статті „Прихід”. Після закінчення реакції у суміші залишається:
mNO
= 23367,7 (1 - 0,9) = 2336,77 кг;
VN
О
= 268285.8 * (1 – 0.9) = 26828.58 м3
Матеріальний баланс перетворення аміаку в оксид азоту (ІІ)
| Компонент |
Прихід |
Витрати |
| кг |
% мас. |
м3
|
% об. |
кг |
% мас. |
м3
|
% об. |
| Аміак (NH3
) |
23367,7 |
6,85 |
34877,16 |
13 |
2336,77 |
0,68 |
26828,58 |
64.31 |
| Кисень (O2
) |
80002,8 |
45,48 |
56340 |
21 |
12703.8 |
32,67 |
8531,64 |
20.44 |
| Оксид азоту (ІІ) NO |
237271,9 |
47,67 |
17706.86 |
66 |
23727.19 |
61,2 |
6366,9 |
15.25 |
| Разом |
340642,4 |
100 |
268285,7 |
100 |
38767,78 |
100 |
41727,12 |
100 |
mO
2
= 80002,8 - 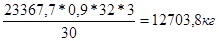
VO2
= 56340 – 17706.86 * 0.9 * 3 = 8531.64 м3
mx
NO = 237271,9 + 40000 = 277271.9 кг
VNO
= 8531,64 / 1,34 = 6366,9 м3
Стадія окиснення оксиду азоту(П) до оксиду азоту(ІV) у виробництві азотної кислоти
Для реакції: 2NO+ О2
↔ 2ΝО2
; ∆Н =-112 * 105
кДж/моль
скласти матеріальний баланс на N тонн оксиду азоту(ІV) за годину.
Ступінь досягнення рівноваги становить 0,97; початкова концентрація [молярна частка, %]: NO- 9 + 0,l*N; O2
- 17 + 0,1*N; решта - азот, температура газу на виході з реактора (К): Т = 380 + N.
Розрахувати і критично оцінити початкову температуру газової суміші, якщо процес відбувається адіабатично. Обґрунтувати конструкцію реактора і розрахувати його об'єм, якщо його інтенсивність дорівнює 1000 м3
/(м3
год).
Враховуючи вихідні концентрації [молярна частка, %]
аміаку - 9 + 0,1*40 = 13%
кисню - 17 + 0,1 *40 = 21%
азот – 56 %
Молярні маси компонентів реакції становлять
М (NO) = 30 г/моль,
М (О2
) = 32 г/моль,
М (NО2
) = 46 г/моль.
Р (NO) = 30 / 22,4 = 1,34,
Р (О2
) = 32 / 22,4 = 1,42;
P (NО2
) = 46 /22,4 = 2.05.
Тоді V (NO) = 40000 / 1,34 = 29850,7 м3
,
m0
NO
= 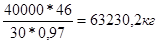
V0
(NO) = 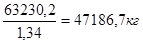
V0
= 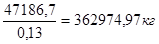
V0
O
2
= 362974.97 * 0.21 = 76224.7 м3
m0
O2
=76224.7 * 1,42 = 108239.1 кг
V0
NO
2
= 362974.97 * 0.56 = 203265,98 м3
m0
NO
2
= 203265,98 * 2.05 = 416695,25кг
Результати розрахунків заносимо до таблиці до статті „Прихід”. Після закінчення реакції у суміші залишається:
mNO
= 63230.2 * (1 - 0,97) = 1896,9 кг;
VN
О
= 47186.7 * (1 – 0.97) = 1415,6 м3
mO
2
= 108239,1 - 
VO2
= 76224,7 – 23956,348 * 0.97 = 52987,04м3
mx
NO2
= 416695,25 + 40000 = 456695,25 кг
VN
О2
= 456695,25 / 2,05 = 222778,0 м3
Матеріальний баланс перетворення оксиду азоту (ІІ) в оксид азоту (ІV)
| Компо-нент |
Прихід |
Витрати |
| кг |
% мас. |
м3
|
% об. |
кг |
% мас. |
м3
|
% об. |
| Оксид азоту (ІІ) |
63230,2 |
10,0 |
29850,7 |
9,65 |
6323,02 |
1,15 |
4718,67 |
1,68 |
| Кисень (O2
) |
108239.1 |
17,23 |
76224.7 |
24,64 |
12703.8 |
2,3 |
52987,04 |
18,89 |
| Оксид азоту (ІV) NO2
|
456695,25 |
72,7 |
203265,98 |
65,7 |
531105,1 |
96,54 |
222778,0 |
79,43 |
| Разом |
628164,55 |
100 |
309341,38 |
100 |
550131,92 |
100 |
280483,71 |
100 |
За рівнянням проводимо розрахунок ентропії та енергії Гіббса даного процесу.
4NH3
+ 5О2
= 4NO + 6H2
O: ∆Н = -946*103
Дж /кмоль
∆S = 4 ∆SNO
+ 6 ∆SН2О
– (4∆SΝН3
+ 5∆SО2
)
∆S = 4 * 210,6 + 6 * 188,7 – (4 * 192,0 + 5*205,0) = 181,6 Дж/моль*К
∆G = 4 ∆ GNO
+ 6 ∆ G Н2О
– (4∆ G ΝН3
+ 5∆ G О2
)
∆G = 4 *86,6 + 6 * (-228,6) – (4* (-16,7) +5* 0) = -958,4 кДж/моль
Визначимо початкову температуру даного процесу
Т = 
Початкова температура становить 68,28 К
Проведемо розрахунок маси каталізатора необхідного для одержання 400 т оксиду азоту на першій стадії добування азотної кислоти.
Визначимо інтенсивність роботи каталізатора за 1 годину.
3,84 т / 24 = 0,16 т
Маса каталізатора становитиме: 0,16 * 400 = 64 т
Розрахунок
За рівнянням проводимо розрахунок ентропії та енергії Гіббса даного процесу.
2NO+ О2
↔ 2ΝО2
; ∆Н =-112 * 103
кДж/моль
∆S = 2*∆SNO
2
– (2*∆SΝО
+ ∆SО2
)
∆S = 2 * 240,2 – (2 * 210,6 + 205,0) = -145,8 Дж/моль*К
∆G = 2 ∆ GNO
2
– (2∆ G ΝО
+ ∆ G О2
)
∆G = 2 *51,5 – (2* 86,6 + 0) = -70,8 кДж/моль
Визначимо початкову температуру даного процесу
Т = 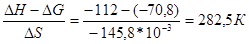
Початкова температура становить 282,5 К
Проведемо розрахунок об`єму каталізатора необхідного для одержання 400 т оксиду азоту (ІV) на другій стадії добування азотної кислоти.
Всі відомі технологічні процеси хімічного виробництва супроводжуються утворенням великої кількості відходів у вигляді шкідливих газів та пилу, шлаків, шламів, стічних вод, що містять різні хімічні компоненти, які забруднюють атмосферу, воду та поверхню землі.
Виробництво азотної кислоти спричиняє значні забруднення кислотоутворюючими оксидами - азоту, сірки, а також вуглекислого газу, аміаком. Їх надходження в повітря помітно змінило склад сучасної атмосфери порівняно з доіндустріальним періодом [8].
В повітрі міститься значна кількість, концентрація значно перевищує ГДК в кілька разів. Однією з особливостей атмосфери є її здатність до самоочищення. Самоочищення атмосферного повітря відбувається внаслідок сухого та мокрого випадання домішок, абсорбції їх земною поверхнею, поглинання рослинами, переробки бактеріями, мікроорганізмами та іншими шляхами. Садіння дерев та кущів сприяє очищенню повітря від пилу, оксидів вуглецю, діоксидів сірки та інших речовин. Найкращі поглинальні властивості стосовно діоксиду сірки має тополя, липа, ясен. Одне доросле дерево липи може акумулювати протягом доби десятки кілограмів діоксиду сірки, перетворюючи його в нешкідливу речовину. Велика роль в очищенні атмосферного повітря належить ґрунтовим бактеріям та мікроорганізмам. При температурі 15-35 °С мікроорганізми переробляють на 1 м2
до 81 т на добу оксидів та діоксидів вуглецю. Однак можливості природи щодо самоочищення мають обмеження, що слід враховувати при розробці нормативів ГДВ.
Після очищення газові викиди містять гранично допустиму концентрацію шкідливих речовин ГДК (NH3
) = 20 мг/м3
, ГДК (NO2
) = 5 мг/м3
.
Сучасні вимоги до якості та ступеня очищення викидів досить високі. Для їх дотримання необхідно використовувати технологічні процеси та обладнання, які знижують або повністю виключають викид шкідливих речовин в атмосферу, а також забезпечують нейтралізацію утворених шкідливих речовин; експлуатувати виробниче та енергетичне обладнання, котре виділяє мінімальну кількість шкідливих речовин; закрити невеликі котельні та підключити споживачів до ТЕЦ; застосовувати антитоксичні присадки, перевести теплоенергетичні установки з твердого палива на газ.
Способи очищення викидів в атмосферу від шкідливих речовин можна об'єднати в такі групи:
— очищення викидів від пилу та аерозолів шкідливих речовин;
— очищення викидів від газоподібних шкідливих речовин;
— зниження забруднення атмосфери вихлопними газами від двигунів внутрішнього згоряння транспортних засобів та стаціонарних установок;
— зниження забруднення атмосфери при транспортуванні, навантаженні і вивантаженні сипких вантажів.
Для очищення викидів від шкідливих речовин використовуються механічні, фізичні, хімічні, фізико-хімічні та комбіновані методи.
Методи очищення викидів від газоподібних речовин за характером фізико-хімічних процесів з очищуваними середовищами поділяються таким чином:
— промивання викидів розчинниками, що не сполучаються із забруднювачами (метод абсорбції);
— промивання викидів розчинами, що вступають в хімічне з'єднання з забруднювачами (метод хемосорбції);
— поглинання газоподібних забруднювачів твердими активними речовинами (метод адсорбції);
— поглинання та використання каталізаторів;
— термічна обробка викидів;
— осаджування в електричних та магнітних полях;
— виморожування.
Організаційні заходи зводяться до попередження скидання стічних вод у водойми без їх очищення. Технічні заходи передбачають очищення стічних вод різними методами, повторне використання стічних вод для технічних потреб та поливу, створення обортних та замкнених систем водокористування, вдосконалення технологічних процесів на підприємствах у напрямку зменшення надходження забруднень у стоки, перехід на безвідходні технології, змешення забруднення територій нафтопродуктами, котрі зі зливовими стоками можуть потрапляти до водойм [11].
Очищення стічних вод на підприємствах може здійснюватися за однією з таких схем:
— очищення стічних вод на заводських очисних спорудах;
— очищення стічних вод після їхнього забруднення на заводських, а потім на міських очисних спорудах з подальшим спуском у водойми;
— безперервне очищення промислових вод та розчинів на локальних очисних спорудах протягом певного часу, після чого вони передаються на регенерацію, після регенерації повертаються в оборот та лише після з'ясування неможливості регенерації усереднюються і передаються на заводські очисні споруди та утилізуються. Способи очищення забруднених промислових вод можна об'єднати в такі групи: механічні, фізичні, фізико-механічні, хімічні, фізико-хімічні, біологічні, комплексні (рис. 6).

Основні способи очистки води
Механічні способи очищення застосовуються для очищення стоків від твердих та масляних забруднень. Механічне очищення здійснюється одним з таких методів:
- подрібнення великих за розміром забруднень у менші за допомогою механічних пристроїв;
- відстоювання забруднень зі стоків за допомогою нафтовловлювачів, пісковловлювачів та інших відстійників;
— розділення води та забруднювачів за допомогою центрифуг та гідроциклонів;
— усереднення стоків чистою водою з метою зниження концентрації шкідливих речовин та домішок до рівня, при котрому стоки можна скидати у водойми або в каналізацію;
— вилучення механічних домішок за допомогою елеваторів, решіток, скребків та інших пристроїв;
— фільтрування стоків через сітки, сита, спеціальні фільтри, а найчастіше — шляхом пропускання їх через пісок;
— освітлення води шляхом пропускання її через пісок або спеціальні пристрої, наповнені композиціями або мінералами, здатними поглинати завислі частки.
Вибір схеми очищення води від завислих часток та нафтопродуктів залежить від виду та кількості забруднень, необхідного ступеня очищення.
Фізико-механічні способи очищення стоків та води базуються на флотації, мембранних методах очищення, азотропній відгонці [11].
Флотація — процес молекулярного прилипання частинок забруднень до поверхні розподілу двох фаз (вода — повітря, вода — тверда речовина). Процес очищення СПАР, нафтопродуктів, волокнистих матеріалів флотацією полягає в утворенні системи "частинки забруднень - бульбашки повітря", що спливає на поверхню та утилізується. За принципом дії флотаційні установки класифікуються таким чином:
— флотація з механічним диспергуванням повітря;
— флотація з подачею повітря через пористі матеріали;
— електрофлотація;
— біологічна флотація.
Чиста азотна кислота HNO3 при нормальній температурі - безбарвна рідина, що замерзає при - 4 0
С, що кипить при 86°С. Максимальну температуру кипіння 121,9°С має розчин, що містить 68,4% HNO3
, що представляє собою азеотропну суміш. Азотна кислота дуже сильний окислювач. Багато органічних речовин (у тому числі тваринні і рослинні тканини) при дії азотної кислоти руйнуються, а деякі здатні воспламеняться. Особливо сильна як окислювач розведена HNO3
. Концентрована ж кислота пасивує такі метали, як залізо, на цьому і засноване використання стали як конструкційного матеріалу у виробництві азотної кислоти.
Вітчизняна промисловість випускає азотну кислоту двох видів: розведену зі змістом 50-60% HNO3
і концентровану, утримуючу 96-98% HNO3
. Розведена кислота використовується в основному для виробництва азотовмісних мінеральних добрив. Міцна азотна кислота споживається для виробництва вибухових речовин, барвників, пластичних мас, нітролаків, кіноплівки й інших найважливіших продуктів. Азотну кислоту виробляють з аміаку.
В даній роботі розглянуто технологію виробництва азотної кислоти з аміаку.
В роботі наводиться аналіз основних екологічних наслідків від роботи хімічної промисловості, а також пропонуються заходи щодо зниження хімічного навантаження на довкілля.
1) Алпатьев А.М. Развитие, преобразование и охрана природной среды. — Л., 1983. — 240 с.
2) Антропогенные проблеми экологии / А.И.Коблева. - Днепропетровск: Проминь, 1997. - 144 с.
3) Атлас природных условии и природных ресурсов Украинской ССР. — М., 1978. — 174 с.
4) Бакинский Г.А. Социоэкология. — К., 1991. — 154 с.
5) Борнацкий И.И. Теория металлургических процессов. - К.: Техника, 1978. - 430 с.
6) Брылов С.А., Штродка К., Грабчак Л.Г. и др. Охрана окружающей среды. — М.: Высш. шк., 1986. — 272 с.
7) Будыко М.И. Эволюция биосферы. — Л., 1984. — 488 с.
8) Владимиров А,М., Ляхин Ю.И., Матвеев Л.Т. и др. Охрана окружающей среды.— Л.: Гидрометеоиздат, 1991.— 423 с.
9) Воронов А. Г. Биогеография с основами экологии. — М., 1987. — 206 с.
10) Воскобейников В.Г., Кудрин В.А., Якушев В.А. Общая металлургия. - М.: Металлургия, 1979. - 488 с.
11) Григорьев А. А. Экологические уроки прошлого и современности. — Л., 1991. — 249 с.
12) Злобін Ю.А., Кочубей Н.В. Загальна екологія: Навч. посібник. – Суми: ВТД “Університетська книга”, 2003. – 416 с.
13) Клименко Л.П. Техноекологія. – Одеса – Сімферополь, 2000. – 542 с.
14) Коммонер Б. Замыкающийся круг. — Л., 1974. — 134 с.
15) Куценко А.М., Писаренко В.Н. Охрана окружающей среды в сельском хозяйстве. — К., 1991. — 200 с.
16) Лаптев А. А., Приемов С. И., Родичкин И. Д. и др. Охрана и оптимизация окружающей среды. — К., 1990. — 254 с.
17) Мухленов И.М., Табоцева В.Д., Горштейн А.Е. Основы химических технологий. - М.: Просвещение, 1964. - 632 с.
18) Назарук М. М., Сенчина Б. В. Практикум із основ екології та соціології. Навчальний посібник. — Львів, 1999. — 116 с.
19) Новиков Ю.В. Природа и человек. — М., 1991. — 222 с.
20) Основы химической технологии. / Под ред. И.П.Мухленова. – М.: Высш школа, 1991. – 463 с.
21) Охрана и оптимизация окружающей среды. / Под ред. А.А.Лаптева. – К.: Лыбидь, 1990. – 256 с.
22) Примак А.В. Экологическая ситуация на Украине и ее мониторинг: анализ и перспективы. — К., 1990. — 44 с.
23) Сытник К.М., Брайон А.В., Гордецкий А.В. Биосфера, экология, охрана природы. — К. Высш. шк., 1987. — 523 с.
24) Теоретические и методические исследования /Под ред. А. М. Маринича, М. М. Паламарчука. — К., 1990. — 200 с.
25) Экология города: Учебник./ Под ред. Ф.В.Стольберга. – К.: Либра, 2000. – 464 с.
26) Юдасин Л.С. Энергетика: проблемы и надежды. — М., 1990. — 205 с.
|