Реферат на тему:
«Первый закон термодинамики»
«Первый закон термодинамики, как и закон сохранения энергии в механике, часто дает возможность исследовать тепловые процессы в макроскопических системах даже в тех случаях, когда нам не известны детали микроскопической картины изучаемых явлений.
Первый закон универсален, он применим ко всем без исключения тепловым процессам в любых системах. Как и всякий закон сохранения, он не дает детальной информации о ходе процесса, но позволяет составить уравнение баланса, если заранее известно, какие энергетические превращения происходят в рассматриваемой системе.
Сделаем несколько замечаний о смысле входящих в уравнение первого закона величин. Количество переданной теплоты было определенно как мера изменения внутренней энергии системы при теплопередаче. Но не всегда подведение к системе теплоты приводит к изменению ее внутренней энергии. Например, при изотермическом расширении идеального газа подведение теплоты не сопровождается увеличением внутренней энергии газа. Внутренняя энергия идеального газа зависит только от температуры и при изотермическом процессе не меняется, но газ совершает работу, и величина этой работы равна подводимому к системе количеству теплоты.
Совершение внешними силами механической работы над системой также может не сопровождаться изменением ее внутренней энергии. Если сжимать идеальный газ, принимая меры к тому, чтобы его температура при этом не увеличивалась, то внутренняя энергия газа останется без изменения, а окружающим телам перейдет некоторое количество теплоты, равное совершенной над газом при его сжатии работе»[1]
.
«Применение первого закона термодинамики к процессам в одноатомных идеальных газах
1.
Изотермический процесс (Т = const):
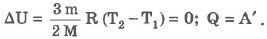
При изотермическом процессе обмен энергией между идеальным газом и окружающими телами происходит и в форме теплопередачи, и в форме работы. Все подведенное к идеальному газу тепло затрачивается на совершение работы.
Если газ получает теплоту (Q > 0), то он совершает положительную работу (А` > 0), если газ отдает теплоту (Q < 0), то А` < 0. Работа внешних сил над газом в этом случае положительная (А > 0).
2.
Изобарический процесс (р = const):
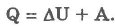
При изобарическом процессе обмен энергией между идеальным газом и окружающими телами происходит в форме работы и теплопередачи. Сообщенная идеальному газу теплота затрачивается и на изменение внутренней энергии, и на совершение газом работы:
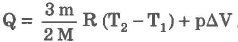
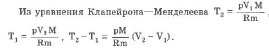

3.
Изохорический процесс:
При изохорическом процессе обмен между идеальным газом и окружающими телами происходит только в форме теплопередачи. Вся подведенная к идеальному газу теплота затрачивается на изменение его внутренней энергии:
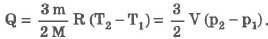
4.
Адиабатический процесс (Q = 0):
Адиабатический процесс - процесс, при котором физическая система не получает теплоты извне и не отдает ее. Этот процесс протекает без теплообмена с окружающими телами.
При адиабатическом процессе:

При адиабатическом процессе обмен энергией между идеальным газом и окружающими телами происходит только в форме работы. Работа при адиабатическом процессе совершается за счет изменения внутренней энергии газа.
Если А` > 0 (газ расширяется), то дельта U < 0 - температура газа понижается. Если же А` < 0 (газ сжимается), то дельта U > О - температура повышается»[2]
.
«Змеевик как тепловая машина. Посмотрим как происходит протекание газа через змеевик. Если в змеевике газ охлаждается, т.е. отдает теплоту (Q<0), то совершаемая работа над газом положительна – внешние силы «проталкивают» газ через змеевик. Если теплота подводится к газу (Q>0), то наш змеевик подобен тепловой машине – газ сам совершает работу над внешними телами. Этот результат не зависит от того, какова величина давления газа на выходе и на входе. Единственное условие при этом – давление на входе должно быть больше давления на выходе, иначе газ просто потечет в обратную сторону.
Попробуем при помощи компрессора прокачивать через змеевик газ в вакуум. Для того чтобы процесс можно было считать стационарным, сечение выходного отверстия нужно сделать много меньше сечения входного. Змеевик теплоизолируем от окружающей среды.
Совершаемая компрессором над газом работа положительна и равна полной совершаемой над газом работе, ибо, выходя за вакуум, газ работы не совершает. Так как нет обмена теплотой, налицо противоречие с утверждением о том, что при адиабатическом протекании работа равна нулю.
Это противоречие возникло потому, что при прокаичвании газа в вакуум происходят и такие энергетические превращения, которые были совершенно несущественны. Действительно, первый закон термодинамики использовался в виде Q + A = U, где U – внутренняя энергия газа. Поэтому при использовании такой формулировки первого закона термодинамики заранее молчаливо предполагается, что в рассматриваемых процессах не происходит изменения механической энергии системы, т.е. не меняется потенциальная энергия газа как целого во внешнем поле, не меняется и кинетическая энергия движения газа как целого, не возникает в газе никаких макроскопических потоков. Теперь уже становится ясно, что при прокачивании газа в вакуум возникает макроскопический направленный поток, кинетическую энергию которого необходимо учитывать. Работа компрессора в этом случае как раз и определяет кинетическую энергию этого потока.
Если вход и выход змеевика расположены на разной высоте, то в уравнении закона сохранения энергии необходимо учитывать и изменение потенциальной энергии газа в поле тяжести, подобно тому как это делалось в гидродинамике при выводе уравнения Бернулли»[3]
.
Список использованной литературы:
1) Бутиков Е.И., Кондратьев А.С., Уздин В.М. Физика. Строение и свойства вещества. М. – С.-П., ФИЗМАТЛИТ.
2) Учебник «Физика-10» В.А.Касьянов , М., Дрофа, 2003.
3) http://www.fizika.asvu.ru/page.php?id=34 - Первый закон термодинамики - закон сохранения энергии для систем, в которых существенную роль играют тепловые процессы
Реферат
по дисциплине Концепции современного естествознания
на тему:
«Первое начало термодинамики».
«Термодинамика – это раздел физики, изучающий общие закономерности обмена тепловой энергии между системами, системой и внешней средой и производства работы за счет этой энергии».[4]
«Законы термодинамики описывают тепловые свойства тел, число молекул в которых огромно. Такие тела называются макросистемами. Газ в баллоне, вода в стакане, песчинка, камень, стальной стержень и т.п. – все это примеры макросистем. Тепловые свойства макросистем определяются термодинамическими параметрами (параметрами состояния): температурой, давлением и удельным объемом (объемом единицы массы)».[5]
«Изучая механику, мы говорили о двух формах энергии: кинетической и потенциальной. При переходе к изучению состояния газов было введено понятие температуры, как меры энергии хаотического движения молекул. Энергию хаотического движения молекул мы называли внутренней энергией газа. При изучении термодинамики для достижения максимальной наглядности пользуются модельными представлениями. Самая общая термодинамическая модель включает в себя: внешние источники тепловой энергии, рабочее тело и внешний приемник тепловой энергии, в который можно отводить энергию, накопленную в рабочем теле».[6]
«Всякая термодинамическая система в любом состоянии обладает внутренней энергией – энергией теплового (поступательного, вращательного и колебательного) движения молекул и потенциальной энергией их взаимодействия. Возможны два способа изменения внутренней энергии термодинамической системы при ее взаимодействии с внешними телами: совершение работы и теплообмен.
Известно, что в процессе превращения энергии действует закон сохранения механической энергии. Поскольку тепловое движение тоже механическое (только не направленное, а хаотическое), то при всех превращениях должен выполняться закон сохранения энергии не только внешних, но и внутренних движений. Данное утверждение составляет основу первого начала термодинамики».[7]
«Первый закон термодинамики можно сформулировать так: количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
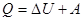 ».[8] ».[8]
«Первое начало термодинамики является частным случаем закона сохранения энергии. В каком бы виде ни подводилась энергия к системе, всегда эта энергия расходуется на два процесса: 1) на повышение внутренней энергии системы; 2) на совершение системной работы».[9]
«Из первого начала термодинамики следует важный вывод: невозможен вечный двигатель, который совершал бы работу «из ничего» без внешнего источника энергии. При наличии внешнего источника часть энергии неизбежно переходит в энергию теплового хаотического движения молекул, что и является причиной невозможности полного превращения энергии внешнего источника в полезную работу».[10]
«При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу.
Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами:
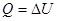
При изотермическом процессе постоянна температура, поэтому внутренняя энергия не изменяется.
При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
Q = A.
При изотермическом расширении газа, находящегося в цилиндре под поршнем, молекулы газа, сталкиваясь с поршнем, уменьшает свою скорость и соответственно среднюю энергию, поэтому для поддержания постоянной температуры газа к нему подводится дополнительное количество теплоты.
При изотермическом сжатии газа (А<0) для сохранения постоянной температуры от газа отводится определенное количество теплоты (Q<0).
При изобарном расширении газа подведенное к нему количество теплоты расходуется на увеличении его внутренней энергии (U>0) и на совершение работы газом (А>0):
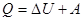 ».[11] ».[11]
Список использованной литературы:
1) Грибов Л.А., Прокофьева Н.И. Основы физики. М.: Гардарика, 1998
2) Карпенков С.Х. Концепции современного естествознания. М.: Академический проект, 2003
3) Касьянов В.А. Физика. М.: Дрофа, 2003
Электролиты. Причины диссоциации
«Одной из характерных особенностей водных растворов солей, кислот и оснований является их электролитическая проводимость. В то же время дистиллированная вода очень плохо проводит электрический ток, а сухие кристаллические соли или щелочи вообще не обладают этой способностью.
Изучая свойства растворов солей, кислот и оснований, С. Аррениус пришел к заключению, что под действием молекул воды вещества в растворе подвергаются ионизации.
Вещества, водные растворы которых обладают электрической проводимостью, называют электролитами.
К электролитам относятся соединения, молекулы которых характеризуются полярной или ионной связью.
Вещества, водные растворы которых не проводят электрический ток, называют неэлектролитами.
Процесс распада электролита на ионы в водном растворе называют электролитической диссоциацией.
Механизм электролитической диссоциации позднее получил объяснение в связи с разработкой теории химической связи и химического равновесия. Распад электролита на ионы в растворе происходит в результате сложного физико-химического взаимодействия молекул с полярными молекулами воды. Если поместить кристаллы хлорида натрия в воду, то полярные молекулы воды принимают упорядоченное направленное положение по отношению к ионам в кристаллической решетке соли. Под влиянием этого взаимодействия и теплового движения молекул воды хлорид натрия распадается на ионы:
NaClNa+
+ Cl-
В данном случае происходит взаимодействие молекул воды с ионами в кристаллической решетке соли, в результате чего гидратированные ионы переходят в раствор (Рис.1).
О том, насколько велика роль растворителя для процесса диссоциации, можно судить по поведению хлороводорода в воде и, например, в бензоле.
Раствор HCl в бензоле электрической проводимостью не обладает, следовательно, в данном растворе отсутствуют ионы, т.е. не происходит диссоциации. Водный же раствор хлороводорода содержит ионы Н+
и Сl-
, хотя газообразный HCl представляет собой молекулу с полярной ковалентной связью.
При воздействии диполей воды полярная связь в HCl еще больше поляризуется и в конце концов происходит ионизация молекулы HCl:
HClН+
+ Сl-
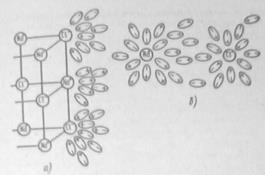
Рис.1. Распад кристаллов хлорида натрия на отдельные ионы под влиянием диполей воды:
а – открытых отдельных ионов; б – гидратированные ионы натрия и хлора в растворе
Далее ион водорода Н+
присоединяется к атому кислорода в молекуле Н2
О по донорно-акцепторному механизму. Пару электронов для образования связи поставляет атом кислорода. Следовательно, суммарно диссоциацию HCl можно изобразить уравнением:
HCl + Н2
О Н3
О+
+ Сl-
Образующийся ион Н3
О+
называется гидроксонием»[12]
.
«Стрелки показывают, что процесс идет в двух направлениях: наряду с диссоциацией молекулы на два иона идет обратный процесс рекомбинации (воссоединения) ионов в нейтральную молекулу.
Положительные ионы, движущиеся к катоду, называются катионами, отрицательные – анионами, т.е движущиеся к аноду.
Заметим, что если молекулы растворенного вещества не диссоциируют на ионы, то раствор не является проводником. Примером могут служить водные растворы сахара и глицерина, которые являются хорошими изоляторами»[13]
.
Степень диссоциации. Факторы, влияющие на степень диссоциации
«Поведение водных растворов электролитов в химических реакциях во многом зависит от того, насколько полно они распадаются на ионы. Для количественной оценки диссоциации важное значение имеют параметры, как степень и константа диссоциации.
Степень диссоциации а – это отношение числа молекул, распавшихся на ионы, к исходному числу молекул растворенного вещества:

Степень диссоциации иногда выражаю в процентах:
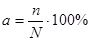
Степень диссоциации электролитов зависит от концентрации растворов: с понижением концентрации уменьшается взаимодействие ионов в растворе, которое приводит к образованию молекул, поэтому степень диссоциации возрастает. По степени диссоциации электролиты принято делить на сильные, слабые и средние. Сильные электролиты имеют а > 30%; слабые – а < 3%; средние - а в пределах от 3 до 30%.
К сильным электролитам в водных растворах относятся почти все соли, большинство неорганических кислот (HNO3
, HCl, H2
SO4
, HClO4
и др.), а также гидроксиды щелочных и щелочноземельных металлов. Средними электролитами являются H2
SO3
, H3
PO4
и др. такие соединения, как H2
S, Cu(OH)2
и др. являются слабыми электролитами.
Деление электролитов на слабые, средние и сильные носит условный характер, так как степень диссоциации зависит от природы электролита и растворителя, от концентрации и температуры раствора. Водные растворы различных солей, кислот и оснований одной и той же концентрации в разной степени диссоциируют на ионы. На степень диссоциации существенно влияет присутствие одноименных ионов в растворе. Так, если в растворе имеется CuCl2
, то равновесие системы
CuCl2
 Cu2+
+ 2Cl- Cu2+
+ 2Cl-
Можно сдвинуть влево путем увеличения концентрации ионов Cu2+
илиCl-
. Это достигается добавлением к раствору электролита, содержащего один из этих ионов»[14]
.
«Процессом, противоположным электролитической диссоциации является молизация – воссоединение ионов противоположных знаков в нейтральные молекулы. Если между процессами диссоциации и молизации существует динамическое, подвижное состояние, то а находится из уравнения:
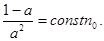
При 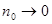 имеем имеем 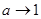 , т.е. в слабых растворах почти все молекулы диссоциированы. С ростом концентрации раствора а убывает. В сильных концентрированных растворах , т.е. в слабых растворах почти все молекулы диссоциированы. С ростом концентрации раствора а убывает. В сильных концентрированных растворах
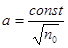 »[15]
. »[15]
.
Необычные электролиты
Встречаются весьма и необычные электролиты. Например, электролитом является стекло, представляющее собой сильно переохлажденную жидкость, обладающую громадной вязкостью. При нагревании стекло размягчается и его вязкость сильно уменьшается. Присутствующие в стекле ионы натрия Na+
приобретают заметную подвижность, и становится возможным прохождение электрического тока, хотя при обычных температурах стекло является хорошим изолятором.
Наглядной демонстрацией этого может служить опыт, схема которого показана на рис.2.

Рис.2.
Демонстрация электропроводности стекла при нагревании
Стеклянная палочка АВ включена в осветительную сеть через реостат R. Пока палочка холодная, ток в цепи ничтожный из-за высокого сопротивления стекла. Если палочку нагреть газовой горелкой до температуры 300-400 0
С, то ее сопротивление упадет до нескольких десятков омов и нить лампочки Л раскалится. Теперь можно закоротить лампочку ключом К. При этом сопротивление цепи уменьшится, и сила тока возрастет. В таких условиях палочка будет эффективно нагреваться электрическим током и раскаляться до яркого свечения, даже если убрать горелку[16]
.
[1]
См.: бутиков Е.И., Кондратьев А.С., Уздин В.М. Физика. Строение и свойства вещества. М. – С.-П., ФИЗМАТЛИТ. – Стр. 141.
[2]
См.: Учебник «Физика-10» В.А.Касьянов , М., Дрофа, 2003. – Стр. 248.
[3]
См.: http://www.fizika.asvu.ru/page.php?id=34 - Первый закон термодинамики - закон сохранения энергии для систем, в которых существенную роль играют тепловые процессы
[4]
Грибов Л.А., Прокофьева Н.И. Основы физики. М.: Гардарика, 1998, с.219
[5]
Карпенков С.Х. Концепции современного естествознания. М.: Академический проект, 2003, с.158
[6]
Грибов Л.А., Прокофьева Н.И. Основы физики. М.: Гардарика, 1998, с.219
[7]
Карпенков С.Х. Концепции современного естествознания. М.: Академический проект, 2003,с. 161.
[8]
Касьянов В.А. Физика. М.: Дрофа, 2003, с. 269.
[9]
Грибов Л.А., Прокофьева Н.И. Основы физики. М.: Гардарика, 1998, с. 220.
[10]
Карпенков С.Х. Концепции современного естествознания. М.: Академический проект, 2003,с. 161.
[11]
Касьянов В.А. Физика. М.: Дрофа, 2003, с.269,270,271.
[12]
См.: Э.Т. Оганесян. Руководство по химии поступающим в вузы. М., «Высшая школа», 1991. – Стр. 116-117.
[13]
См.: Б.М. Яворский, А.А. Пинский. Основы физики. Том 1. Механика. Молекулярная физика. Электродинамика. М., «Наука». – Стр.454.
[14]
См.: Э.Т. Оганесян. Руководство по химии поступающим в вузы. М., «Высшая школа», 1991. – Стр. 119
[15]
См.: Б.М. Яворский. А.А. Детлаф. Справочник по физике. М., «Наука», 1996. – Стр. 226.
[16]
См.: Е.И.Бутиков, А.С. Кондратьев, В.М,Уздин. Физика. Строение и свойства вещества. М.-С.-П., «Физматлит», 2000. – Стр. 267.
|