Элементы кинетической теории газов и вероятностные модели
Содержание
1.Идеальный газ
2. Вероятностные характеристики идеального газа
3. Давление газа на стенки и уравнение состояния идеального газа
4. Теплообмен и температура
5. Плотность равновесного распределения молекул в потенциальном силовом поле
6. Плотность распределения по скоростям. Распределение Максвелла
1.
Идеальный газ
Назовём простейшей термодинамической системой цилиндрический сосуд, заполненный идеальным газом, вида

Стенки сосуда непроницаемы для газа. Объём может меняться, поскольку стенка, которую в дальнейшем мы будем называть поршнем, может перемещаться вдоль оси цилиндра, совмещённой с осью х. Сосуд расположен так, что его объём V = Sx, x>0, где х – расстояние между дном сосуда и поршнем, S-площадь поршня.
Внешность сосуда будем называть термостатом. Термостат взаимодействует с термодинамической системой двумя способами:
1) посредством теплообмена через стенки сосуда и
2) механически, посредством изменения объёма при перемещении поршня.
Именно поэтому система и называется термодинамической.
Физическая среда  под названием "идеальный газ" с точки зрения молекулярной теории представляет собой совокупность упругих шариков-молекул, движущихся подобно биллиардным шарам внутри сосуда, сталкиваясь между собой и со стенками сосуда. Между этими столкновениями молекулы движутся равномерно и прямолинейно, т.е. на них не действуют в это время никакие силы. под названием "идеальный газ" с точки зрения молекулярной теории представляет собой совокупность упругих шариков-молекул, движущихся подобно биллиардным шарам внутри сосуда, сталкиваясь между собой и со стенками сосуда. Между этими столкновениями молекулы движутся равномерно и прямолинейно, т.е. на них не действуют в это время никакие силы.
При комнатной температуре и нормальном атмосферном давлении объём, в среднем приходящийся на одну молекулу газа, приблизительно в 103
раз больше объёма самой молекулы, и если газ с помощью сжатия и охлаждения сжижить, то его объём уменьшится приблизительно в тысячу раз.
Что касается массы такого шарика-молекулы, то её легко получить по формуле  , ,
где m — масса граммолекулы газа, а  — число Авогадро, равное числу молекул, содержащихся в одной граммолекуле. Например, для гелия m»4г., и — число Авогадро, равное числу молекул, содержащихся в одной граммолекуле. Например, для гелия m»4г., и 
Задача. Вычислить отношение величины перепада значений потенциальной энергии молекулы на разности высот в 1м в поле силы тяжести на поверхности Земли к величине кинетической энергии молекулы, движущейся со скоростью 500 м/сек.
Замечание. Как будет видно из дальнейшего, приблизительно таковы значения скорости теплового движения молекул кислорода и азота в составе воздуха при нормальной (комнатной) температуре.
Представление о молекулах как упругих шариках — ни что иное, как совокупность следующих свойств:
1) они заметно воздействуют друг на друга лишь когда сближаются на расстояние между центрами масс порядка диаметра молекулы-шарика;
2) при таком взаимодействии (соударении) сохраняются полная кинетическая энергия и количество движения пары.
Заметим в заключение описания свойств идеального газа, что реальный газ близок к идеальному по своим свойствам в случае одноатомных газов, таких, как гелий или аргон. Случай газов с многоатомными молекулами (H2
,N2
,O2
,CO2
,CH4
) более сложен для изучения, и наши рассмотрения мы начнём с идеального газа.
Важнейшим свойством идеального газа является то, что полная энергия его молекул в слабых внешних полях практически совпадает с их кинетической энергией. А полная энергия такого газа в простейшей термодинамической системе равна сумме кинетических энергий составляющих его молекул, которые следует рассматривать как материальные точки.
Предполагается, что простейшая термодинамическая система (далее ПТДС), изолированная от термостата (поршень неподвижен, теплообмен отсутствует, силовые поля отсутствуют) через короткий промежуток времени достигает состояния термодинамического равновесия:
1) плотность газа постоянна во всех точках, т.е. — число молекул в области G, где — число молекул в области G, где  — объём области G, n — число молекул в единичном объёме не зависит от выбора G; — объём области G, n — число молекул в единичном объёме не зависит от выбора G;
2) существует такая функция  , что доля молекул в ПТДС, скорость которых , что доля молекул в ПТДС, скорость которых  для произвольной области для произвольной области  даётся интегралом даётся интегралом  . В частности, если N — полное число молекул в ПТДС, то . В частности, если N — полное число молекул в ПТДС, то  — общее число молекул, вектор скорости которых принадлежит — общее число молекул, вектор скорости которых принадлежит  . .
Если диаметр области  мал, то приближённо мал, то приближённо  — количество молекул, скорость которых лежит в малой окрестности — количество молекул, скорость которых лежит в малой окрестности  точки точки  , даётся формулой , даётся формулой
 . .
С вероятностной точки зрения скорость молекулы идеального газа можно рассматривать как случайную величину, спектр значений которой совпадает с  , а плотность распределения равна , а плотность распределения равна  . .
Символически это записывается так:
 , ,
и читается так: вероятность того, что случайный вектор  принадлежит области принадлежит области  из из  , равна интегралу по , равна интегралу по  от — плотности распределения случайного вектора от — плотности распределения случайного вектора  . .
Понимать это утверждение следует так. Пусть наблюдатель произвёл n статических испытаний, т.е. n раз замерил скорость отдельной молекулы (первой попавшейся) из числа тех, что заполняют наш цилиндр. И пусть — число тех молекул, скорость которых попала в — число тех молекул, скорость которых попала в  . Тогда . Тогда  . (Сравнить с бросанием монеты !). Плотность распределения . (Сравнить с бросанием монеты !). Плотность распределения  — функция трёх переменных, компонент вектора — функция трёх переменных, компонент вектора , где , где  – орты координатных осей декартовой системы координат. – орты координатных осей декартовой системы координат.
Наряду со случайным вектором  введём в рассмотрение скалярную случайную величину, равную проекции вектора скорости на некоторую прямую введём в рассмотрение скалярную случайную величину, равную проекции вектора скорости на некоторую прямую  , и её плотность распределения , и её плотность распределения  . Естественно предположить, что вид функции . Естественно предположить, что вид функции  не зависит от направления прямой, задаваемого ортом не зависит от направления прямой, задаваемого ортом  . Это означает, в частности, что компоненты вектора . Это означает, в частности, что компоненты вектора  (проекции на орты (проекции на орты  ) – случайные величины ) – случайные величины  имеют одну и ту же плотность распределения имеют одну и ту же плотность распределения  . .
Между  и и  существует связь: существует связь:
 , поскольку , поскольку

для произвольного интервала  на координатной оси на координатной оси  . .
Действительно, стоящий слева интеграл равен доле молекул ПТДС, первая компонента скорости которых принадлежит интервалу  , а , а  и и  могут принимать любые значения. Ведь условие могут принимать любые значения. Ведь условие  не накладывает на них никаких ограничений. Именно поэтому справедливо равенство (**), а вместе с ним и (*). не накладывает на них никаких ограничений. Именно поэтому справедливо равенство (**), а вместе с ним и (*).
Итак,  – доля молекул, первая компонента которых принадлежит окрестности – доля молекул, первая компонента которых принадлежит окрестности  значения значения  первой компоненты скорости первой компоненты скорости  . Тогда . Тогда  – доля молекул, у которых дополнительно известно, что вторая компонента скорости – доля молекул, у которых дополнительно известно, что вторая компонента скорости  принадлежит окрестности принадлежит окрестности  точки точки  на второй координатной оси (при том, что первая …). на второй координатной оси (при том, что первая …).
Аналогичным образом  есть доля молекул, вектор скорости которых принадлежит прямоугольному параллелепипеду с рёбрами есть доля молекул, вектор скорости которых принадлежит прямоугольному параллелепипеду с рёбрами  вокруг точки вокруг точки  . Но тот же смысл имеет и выражение . Но тот же смысл имеет и выражение  , откуда мы получаем соотношение , откуда мы получаем соотношение
 . .
На языке теории вероятностей такое равенство означает независимость случайных величин, представляющих собой компоненты вектора скорости молекулы идеального газа в декартовой системе координат в условиях термодинамического равновесия. Метод получения этого равенства не представляет собой доказательства, а лишь объясняет мотивы, по которым оно принимается нами за постулат.
Ясно, что по своему смыслу функции  и и  удовлетворяют условиям: удовлетворяют условиям:
1)  , ,
2)  , ,
3) 
и, аналогично (как следствие),
1)  , ,
2)  . .
Упражнение. Показать, что  зависит только от зависит только от  или, что всё равно, от или, что всё равно, от  . .
Далее будет найдено явное выражение для функций  и и  . .
При упругом соударении молекулы с поршнем происходят следующие события:
1) первая компонента вектора  , которая до столкновения была положительной, сохраняя свою абсолютную величину, меняет знак на противоположный, т.е. вектор , которая до столкновения была положительной, сохраняя свою абсолютную величину, меняет знак на противоположный, т.е. вектор  после соударения превращается в вектор после соударения превращается в вектор 
2) для неподвижной стенки закон сохранения импульса , ,  даёт равенство даёт равенство , где , где  – сила, действующая на поршень со стороны молекулы в процессе соударения, – сила, действующая на поршень со стороны молекулы в процессе соударения,  – импульс, который приобрела стенка в процессе соударения. – импульс, который приобрела стенка в процессе соударения.
Поскольку соударение длится очень недолго, единственная (первая) компонента вектора  имеет график вида имеет график вида
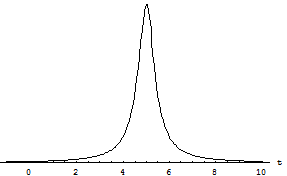
За малый промежуток времени  происходит огромное количество таких соударений, и на поршень, таким образом, будет со стороны газа действовать сила со средним по времени значением происходит огромное количество таких соударений, и на поршень, таким образом, будет со стороны газа действовать сила со средним по времени значением , ,
где индексом  занумерованы силы, отвечающие индивидуальным соударениям, происшедшим за промежуток времени занумерованы силы, отвечающие индивидуальным соударениям, происшедшим за промежуток времени  . .
Все молекулы, первая компонента скорости которых  , находящиеся внутри объёма , находящиеся внутри объёма  за время за время  успеют долететь до поршня и передать ему импульс, равный успеют долететь до поршня и передать ему импульс, равный  . То же самое можно (с малой погрешностью) сказать и о молекулах, скорость которых принадлежит окрестности . То же самое можно (с малой погрешностью) сказать и о молекулах, скорость которых принадлежит окрестности  точки точки  . .
Общее число таких молекул рано, очевидно, выражению
 , ,
переданный ими поршню импульс равен
 , ,
а суммарный импульс, переданный поршню за время  с произвольным с произвольным  , оказывается равным по величине , оказывается равным по величине

 , ,
где  – полная кинетическая (а другой никакой нет) энергия идеального одноатомного газа, заполняющего наш сосуд. Но – полная кинетическая (а другой никакой нет) энергия идеального одноатомного газа, заполняющего наш сосуд. Но
 , ,
и, в силу (1.3),  . Если в этом равенстве обозначить . Если в этом равенстве обозначить  , то мы получим состояния ПТДС для случая одноатомного газа вида , то мы получим состояния ПТДС для случая одноатомного газа вида
 , ,
где  – давление газа, – давление газа,  – объём, заполненный газом, а – объём, заполненный газом, а  – его полная внутренняя энергия. – его полная внутренняя энергия.
Из равенства (2.3) видно, что под полной внутренней энергией ПТДС  понимается выражение понимается выражение

В теории вероятностей выражение  называется математическим ожиданием функции от случайной величины называется математическим ожиданием функции от случайной величины   , равной в нашем случае , равной в нашем случае . .
В общем случае
 . .
Упражнение. Воспользовавшись физической интерпретацией плотности распределения по скоростям  для идеального газа, описанной ранее, показать, что для идеального газа, описанной ранее, показать, что  в (4.3) равно сумме кинетических энергий отдельных молекул, из которых состоит газ, заполняющий ПТДС. в (4.3) равно сумме кинетических энергий отдельных молекул, из которых состоит газ, заполняющий ПТДС.
Из (4.3) видно, что
 , ,
т.е. математическое ожидание для кинетической энергии молекулы в одноатомном идеальной газе равно среднему значению его полной энергии, приходящейся на одну молекулу.
Уже повседневный опыт свидетельствует: при тепловом контакте двух тел то из них, которое на ощупь воспринимается как более горячее, становится холоднее, а более холодное, наоборот, нагревается. При длительном контакте и без теплообмена с термостатом температура обоих тел уравнивается.
Здесь термин "температура" означает пока не более, чем то, что оба тела на ощупь кажутся одинаково тёплыми.
Рассмотрим явление теплового контакта с точки зрения молекулярной теории.
Итак, пусть две ПТДС отделены друг от друга теплопроводящей стенкой и теплоизолированы от термостата. На уровне молекул взаимодействие осуществляется через соударения, причём молекулы стенки выступают в роли "посредников". И если в газе молекулы между соударениями движутся по инерции, свободно, то в твёрдой стенке связаны с соседними силами межмолекулярного взаимодействия. Однако эти силы много меньше тех сил, которые возникают в момент контакта между молекулой газа и молекулой стенки или двумя молекулами стенки, когда они сталкиваются на большой скорости.
Центральное взаимодействие двух молекул-шариков проще всего описать с помощью потенциальной энергии  , где x и y – радиусы векторы центров молекул. Сила, действующая со стороны молекулы в точке y на молекулу в точке x определяется по формуле , где x и y – радиусы векторы центров молекул. Сила, действующая со стороны молекулы в точке y на молекулу в точке x определяется по формуле
 , ,
а функция  имеет график вида имеет график вида
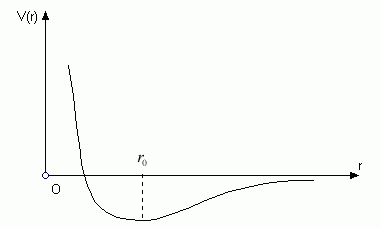
Соседние молекулы в стенке (твёрдой) сосуда находятся на расстояниях, близких к  , совершая колебательные движения вокруг своих положений равновесия. Но как только они достаточно сблизятся, между такими столкнувшимися молекулами возникает сильное отталкивание, так как множитель , совершая колебательные движения вокруг своих положений равновесия. Но как только они достаточно сблизятся, между такими столкнувшимися молекулами возникает сильное отталкивание, так как множитель  резко возрастает при уменьшении резко возрастает при уменьшении  . Большая сила действует лишь краткое мгновение, словом, всё происходит как при соударении бильярдных шаров, соединённых упругими связями типа пружинок в трёхмерную "сеть", составляющую материал стенки. . Большая сила действует лишь краткое мгновение, словом, всё происходит как при соударении бильярдных шаров, соединённых упругими связями типа пружинок в трёхмерную "сеть", составляющую материал стенки.
Всё сказанное выше поясняет, почему можно считать законы соударения для таких молекул такими же, как для идеального газа.
Будем считать, как и ранее, скорости сталкивающихся молекул  и и  случайными величинами. Если они принадлежат к одному из двух сортов, их массы m1
и m2
могут быть различными. случайными величинами. Если они принадлежат к одному из двух сортов, их массы m1
и m2
могут быть различными.
Введём две новые случайные скорости:
 и и  . .
 . .
Вычислим математическое ожидание или среднее значений от обеих частей этого равенства. Как легко видеть, в системе центра масс картина столкновений в целом выглядит так, что вектор относительной скорости  , так же как и вектора , так же как и вектора  в отдельности, распределён по всем направлениям равномерно. Поэтому для любого фиксированного значения в отдельности, распределён по всем направлениям равномерно. Поэтому для любого фиксированного значения  случайная величина случайная величина , будучи нечётной по , будучи нечётной по  , в среднем равна нулю. То же самое можно сказать и о среднем значении , в среднем равна нулю. То же самое можно сказать и о среднем значении  . .
Отсюда немедленно следует, что установление термодинамического равновесия в такой двойной системе ПТДС означает уравнивание средних значений кинетической энергии молекул идеальных газов, заполняющих каждую из частей нашей сдвоенной системы. И, таким образом, выравнивание температур при тепловом контакте двух ПТДС означает выравнивание средних значений кинетической энергии составляющих их идеальных газов. Температура и средняя энергия оказывается пропорциональными друг другу. Точнее, под температурой следует понимать характеристику или функцию состояния термодинамической системы, пропорциональную средней энергии молекул газа-наполнителя.
Исторически понятие температуры и способы её измерения возникли много раньше, чем Максвелл, Больцман и др. создали кинетическую теорию газов и статическую физику как раздел теоретической физики.
В частности, Гей-Люссак опытным путём показал, что для большинства газов, в том числе и многоатомных, при условии, что расстояния между молекулами в среднем много больше их диаметра, справедливо соотношение
 , ,
где  – абсолютная температура, связанная с температурой по Цельсию – абсолютная температура, связанная с температурой по Цельсию  соотношением соотношением

Универсальная газовая постоянная  , ,
 – масса газа в граммах, – масса газа в граммах,  – масса граммолекулы газа, так что отношение – масса граммолекулы газа, так что отношение  равно числу молей газа, заполняющего ПТДС. равно числу молей газа, заполняющего ПТДС.
Отношение  в (4.1) можно, очевидно, заменить отношением в (4.1) можно, очевидно, заменить отношением  , где , где  – число молекул газа в нашей ПТДС, а – число молекул газа в нашей ПТДС, а  – число Авогадро. Уравнение (4.1) можно переписать теперь в таком виде – число Авогадро. Уравнение (4.1) можно переписать теперь в таком виде
 , ,
где  – универсальная постоянная Больцмана. – универсальная постоянная Больцмана.
Если сравнить равенство (4.2) с уравнением состояния для одноатомных газов, полученным исходя из молекулярной теории и вероятностных соображений в третьем разделе, то первое, что следует отметить. это его более общий характер. Оно остаётся неизменным, если газ-наполнитель представляет собой смесь газов, необязательно одноатомных (как, например, воздух). Во-вторых, T – величина измеряемая, в отличие от полной энергии U. Да и коэффициент перед U, полученный в предположении об одноатомности газа-наполнителя, в случае многоатомных газов найти гораздо труднее.
Если сравнить (3.3) и (4.2) в случае, когда  , то в случае одноатомного газа получается равенство , то в случае одноатомного газа получается равенство

Упражнение. Вычислить  для гелия для гелия  и аргона и аргона  при при  . .
До сих пор мы считали, что на молекулы не действуют никакие другие силы кроме тех, которые возникают в момент соударения молекул.
Предположим теперь, что ПТДС помещена в потенциальное силовое поле, т.е. на молекулу в точке х действует сила . Например, в поле силы тяжести Земли на каждую материальную точку массы m действует сила . Например, в поле силы тяжести Земли на каждую материальную точку массы m действует сила
 , ,
если ось  декартовой системы координат направить вверх перпендикулярно поверхности Земли. декартовой системы координат направить вверх перпендикулярно поверхности Земли.
Если взять газ, заполняющий некоторый объём Д внутри термостата, то со стороны газа, находящегося вне Д, на выделенный объём будет действовать сила давления , где , где – вектор внешней нормали к поверхности – вектор внешней нормали к поверхности  Д в окрестности х. Равнодействующая этих сил будет равна Д в окрестности х. Равнодействующая этих сил будет равна

Со стороны поля сил на газ, заполняющий Д, будет действовать сила, равная
 , ,
где n(x) – число молекул в единице объёма в точке х. Но
 
В условиях равновесия силы, даваемое выражениями (5.1) и (5.2), равны по величине и противоположны по знаку, т.е.
 . .
Поскольку это равенство верно для любого Д, то из него вытекает, что
(5.3)  . .
Найдём теперь связь между P(x) и плотностью частиц n(x) в точке х. Если взять шар  радиуса радиуса  с центром в точке х, то при малых с центром в точке х, то при малых  уравнение состояния для газа в этом объёме будет иметь вид уравнение состояния для газа в этом объёме будет иметь вид

или . .
Подставляя найденное P(x) в (5.3), получим уравнение
 . .
Беря интеграл от обеих частей по кривой, соединяющей х с точкой  , в которой мы полагаем , в которой мы полагаем  , получим , получим
 , ,
т.е.  . .
В частности, для газа (воздуха) в поле силы тяжести Земли в условиях равновесия (равновесная атмосфера) получаем формулу Больцмана
 . .
Обозначим через  проекцию скорости молекулы газа массы m, находящегося в равновесии в поле силы тяжести Земли при температуре T. Тогда в единичном объёме на высоте h будет находиться проекцию скорости молекулы газа массы m, находящегося в равновесии в поле силы тяжести Земли при температуре T. Тогда в единичном объёме на высоте h будет находиться  молекул, вертикальная составляющая скорости которых молекул, вертикальная составляющая скорости которых  в окрестности точки v. Двигаясь вверх, эти молекулы заполнят единичный объём на высоте в окрестности точки v. Двигаясь вверх, эти молекулы заполнят единичный объём на высоте  , имея скорость , имея скорость  (вертикальную составляющую), где (вертикальную составляющую), где  находится из соотношения: находится из соотношения:
 . .
Отбрасывая бесконечномалые второго порядка, получаем
 . .
Но, как уже было сказано выше,
 , ,
или  , ,
т.е.  . .
Но  и и  , ,
т.е. . .
Итак, 
Упражнение. Найти  из условия из условия  . .
|