МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕТСТВО ПО ОБРАЗОВАНИЮ
Реферат
Железо в почвах
Методы определения железа
Выполнила:
Проверила:
Содержание
Введение
Глава 1. Железо в почвах
Глава 2. Методы определения железа в почвах
2.1 Атомно-абсорбционный метод
2.2 Комплексонометрическое определение железа в почвах
2.2.1 Методика комплексонометрического определения валового содержания железа в почвах
2.3 Фотометрические методы определения железа
2.3.1 Методика определения общего содержания железа сульфосалицинатным методом
2.4 Методика определения подвижных форм железа с помощью роданида аммония
Список литературы
Введение
Железо — элемент, абсолютно необходимый для жизни растений, без железа не образуется хлорофилла. В почвах железо встречается в составе минералов группы ферросиликатов, в виде гидроокислов, окислов, простых солей, а также ферро- и ферриорганических комплексных солей.
В результате выветривания минералов, содержащих железо, освобождается гидроокись железа — малоподвижное соединение, выпадающее в виде аморфного геля Fe2
O3
*nH2
O и, переходящее при кристаллизации в гетит Fe2
O3
*Н2
O и гидрогетит Fe2
O3
*ЗН2
O. [1]
Только в сильнокислой среде (рН<3) подвижность гидроокиси железа увеличивается и в почвенном растворе появляются ионы железа (Fe3+
). В восстановительных условиях окисное железо переходит в закисное с образованием растворимых соединений FeCO3
, Fe(HCO3
)2
, FeSO4
, доступных растениям. Повышенная растворимость соединений железа угнетает растения. На почвах нейтральных и щелочных с ярко выраженными окислительными условиями растения могут испытывать недостаток железа, что внешне проявляется как хлороз.
Гидроокись железа, так же как и гидроокись алюминия, может образовывать с органическими кислотами подвижные формы комплексных соединений, способных перемещаться по профилю почвы.
Глава 1. Железо в почвах
Среднее содержание железа в почвах составляет 3,8%. В составе почв в зависимости от кислотно-основных и окислительно-восстановительных условий железо может присутствовать в степени окисления +3 и +2. Принципиально возможно определение количества Fe(III) и количества Fe(II) в почвах, но, как правило, при проведении валового анализа определяют общее содержание железа в почвах. А.А. Роде (1971) считал существенным недостатком исследований элементного состава почв отсутствие сведений о содержании Fe(III) и Fe(II) в почвах. Введение в практику валового анализа почв определения Fe(II) позволило бы выявить и количественно оценить особенности гидроморфного почвообразования.[3]
Этот элемент присутствует в почве в составе как первичных, так и вторичных минералов, являясь компонентом магнетика, гематита, титаномагнетита, глауконита, роговых обманок, пироксенов, биотитов, хлоритов, глинистых минералов, минералов группы оксида железа. Много в почвах содержится и аморфных соединений железа, особенно разнообразных гидроксилов (гетит, гидрогетит и др.). Общее содержание в почве Fe2
O3
колеблется в очень широких пределах (в %): от 0,5 – 1,0 в кварцево-песчаных почвах и 3 – 5 в почвах на лессах, до 8 – 10 в почвах на элювии плотных ферромагнезиальных пород и до 20 – 50 в ферраллитных почвах и латеритах тропиков. В почвах также часто наблюдаются железистые конкреции и прослои.[2]
Согласно С. В. Зонну, соединения железа в почвах представлены следующими формами, соотношение которых показано в таблице 1: 1)силикатное железо, входящее в состав кристаллических решеток: а) первичных минералов; б) вторичных (глинистых) минералов; 2) несиликатное (свободное) железо: а) окристаллизованное (слабо или сильно) оксидов и гидроксидов; б) аморфных соединений (железистых и гумус-железистых); в) подвижных соединений (обменных и водно-растворимых).
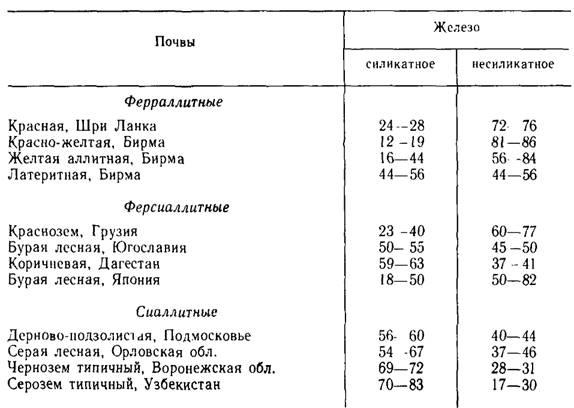
Таблица 1. Соотношение групп соединений железа в различных почвах, % от валового
Глава 2. Методы определения железа в почвах
2.1 Атомно-абсорбционный метод
Для количественного определения общего содержания железа в растворах, полученных при разложении почв, могут быть использованы разнообразные методы. Широко применяют атомно-абсорбционную спектроскопию, фотометрические методы и комплексонометрическое титрование.
Атомно-абсорбционный метод используют для определения валового содержания железа и оценки содержания отдельных групп его соединений в почвах. Железо атомно-абсорбционным методом может быть определено непосредственно в пламени воздух—ацетилен и воздух—пропан—бутан, если его концентрация близка или выше 1 мг/л. Растворы с более низкой концентрацией железа рекомендуется анализировать после концентрирования или непламенным вариантом атомно-абсорбционного метода с использованием графитовой кюветы.
Определение валового содержания железа проводят пламенным вариантом метода. При этом, как правило, приходится в десятки раз разбавлять растворы, полученные при разложении почвы. Атомно-абсорбционным методом железо обычно определяют при длине волны 248,3 нм.
2.2 Комплексонометрическое определение железа в почвах
Определение общего содержания железа в почвах комплексонометрическим методом проводят титруя ионы трехвалентного железа. Комплексонат трехвалентного железа более устойчив, чем железа двухвалентного. Поэтому перед титрованием Fe(II) окисляют азотной кислотой при нагревании.
В связи с тем что Fe(III) легко гидролизуется, его комплексонометрическое титрование можно проводить лишь в сильно-кислой среде. Трехвалентное железо может быть оттитровано даже при рН 1, константа устойчивости комплексоната трехвалентного железа в этом случае равна 107'1
(1gКэфф
уст
= 25,1 — 18,0). При титровании в сильнокислой среде устраняется мешающее влияние многих сопутствующих элементов, которые в этих условиях либо вовсе не образуют комплексонатов (Ва, Mg, Ca), либо комплексонаты образуются, но они малоустойчивы (Си и др.). Относительно устойчивые комплексонаты в сильно кислой среде образуют Bi3+
, V3+
, но их содержание в почвах невелико и влиянием этих элементов на результаты определения железа в почвах пренебрегают. Титан при высоких содержаниях в почвах может влиять на результаты определения валового содержания железа.[3]
В связи с тем что железо медленно реагирует с комплексном III, титруют подогретые растворы. В качестве индикатора используют сульфосалициловую кислоту. Интервал рН, в котором развивается красно-фиолетовая окраска сульфосалицилатного комплекса железа, не велик. Поэтому нужно очень строго соблюдать предписанные методикой условия проведения анализа. В противном случае окрашенное соединение может не образоваться. Часто раствор не приобретает красно-фиолетовой окраски в связи с тем, что имеет более кислую, чем необходимо, реакцию. В этом случае в анализируемую систему нужно добавить раствор аммиака, а не сульфосалициловой кислоты.
В конечной точке титрования сульфосалицилат железа разрушается вследствие образования более устойчивого комплексоната железа и лиловая окраска исчезает, переходя в лимонно- желтую, обусловленную комплексонатом железа. Как уже отмечалось, молярный коэффициент поглощения сульфосалицилата железа невелик, поэтому переход окраски при комплексонометрическом титровании железа нерезкий.
2.2.1 Методика комплексонометрического определения валового содержания железа в почвах
Прежде чем проводить анализ на конических колбах вместимостью 250 мл, делают отметку на уровне, соответствующем объему 50 мл. В колбу помещают 25 мл фильтрата, полученного после отделения кремниевой кислоты, добавляют 5—7 капель концентрированной HN03
и нагревают до кипения окисляя Fe(II).
Затем в колбу добавляют 10—15 капель 25%-ного раствора аммиака, помещают кусочек индикаторной бумаги конго-рот и добавляют по каплям сначала 25%-ный раствор аммиака, а затем 10%-ный до перехода синей окраски индикаторной бумаги в бурую. Если при этом выпадет осадок, его растворяют несколькими каплями 1 н. НСl. В колбу приливают 5 мл 1 н. НСl, и объем жидкости дистиллированной водой доводят до отметки, соответствующей 50 мл. Содержимое колбы нагревают до 50-60°, добавляют 1-3 капли 10%-ного раствора сульфосалициловой кислоты и титруют 0,01 М раствором комплексона III до перехода лиловой окраски сульфосалицилата железа в бледно-желтую комплексоната железа. Скорость реакции невелика, поэтому последние порции титранта добавляют медленно
Реагенты:
1. 0,01 Мраствор комплексона III. См. раздел 5.6.2.1.
2. 25%-ный раствор аммиака.
3. 1 н. раствор НС1. 8,2 мл конц. НС1 разбавляют водой до 1 л.
4. 10%-ный раствор сульфосалициловой кислоты.
2.3 Фотометрические методы определения железа
В связи с тем что и Fe2+
и Fe3+
обладают хромофорными свойствами (электронная конфигурация атома железа — 1s2
2s2
2р6
3s2
Зр6
3d6
4s2
), для фотометрического определения железа используют различные типы химических реакций, которые приводят к образованию окрашенных соединений.
Для определения общего содержания железа в почвах разработаны фотометрические методы, основанные на образовании окрашенных соединений как двух-, так и трехвалентного железа. В России наиболее широко используют фотометрический сульфосалицилатный метод определения Fe(III).
Сульфосалициловая кислота в зависимости от рН раствора образует с Fe(III) три различно окрашенных комплекса. При рН 2-3 образуется красно-фиолетовый комплекс [FeSsal]+, при рН 4-8 коричневато-оранжевый комплекс [Fe(Ssal)2
]-
и при рН 8—10 в аммиачном растворе образуется устойчивый желтый комплекс [Fe(Ssal)3
]3-
.
Красно-фиолетовый комплекс, образующийся в кислой среде, может быть использован для селективного определения Fe(III) в присутствии Fe(II); вариант метода малочувствительный, молярный коэффициент поглощения при длине волны 490 нм равен 2,6-103. Этот комплекс используют при комплексонометрическом определении железа в почвах, предварительно переведя Fe(II) в Fe(III).
Для фотометрического определения валового содержания железа в почвах используют комплекс желтого цвета, устойчивый в щелочной среде. Этот вариант метода позволяет определить общее содержание железа в почвах, так как в условиях эксперимента Fe(II) легко окисляется до Fe(III). Максимум светопоглощения находится в области длин волн 420-430 нм, молярный коэффициент поглощения равен 5,8-103. Кривые светопоглощения сульфосалицилатных комплексов железа приведены на рис. 1.
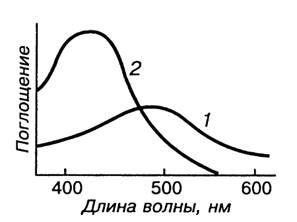
Рисунок 1. Кривые свстопоглощения сульфосалицилатных комплексов железа при рН 2 (1) и рН 9 (2) молярный коэффициент поглощения
Сульфосалициловая кислота образует устойчивые комплексные соединения со многими металлами. При проведении анализа добавляют избыток реагента, чтобы предотвратить осаждение алюминия, магния, кальция при подщелачивании раствора. Комплексы этих элементов с сульфосалициловой кислотой бесцветны. Окрашенные комплексы сульфосалициловая кислота образует с металлами, обладающими хромофорными свойствами.[3]
Для предотвращения выпадения в осадок гидроксида Mn(IV) при подщелачивании в раствор предварительно добавляют гидроксиламин.
Валовое содержание железа может быть определено по окрашенному комплексу двухвалентного железа с бртофенантролином (Methodsofsoilanalysis, 1982). В этом случае железо восстанавливают гидроксиламином до двухвалентного состояния. Затем в раствор добавляют ортофенантролин, с которым Fe(II) образует устойчивый, имеющий красноватую окраску, комплекс — Fe(C12
H10
N2
)2+
3
. Эта цветная реакция специфична для Fe2+. Присутствующие в почвах химические элементы, как правило, не влияют на результаты анализа.
Ортофенантролин может быть использован для раздельного определения Fe(II) и Fe(III). В этом случае анализируют две аликвоты исследуемого раствора. В одной из них определяют суммарное содержание Fe(II) и Fe(III) после предварительного восстановления трехвалентного железа, в другой — Fe(II). Определение Fe(II) рекомендуется проводить в темноте или при слабом красном свете, чтобы предотвратить фоторедукцию комплекса Fe(III) с ортофенантролином.
Окрашенный комплекс Fe(II) с ортофенантролином образуется сразу после добавления реагента и устойчив в течение нескольких суток. Окраска развивается в интервале значений рН от 2 до 9. Однако при проведении анализа почв оптическую плотность измеряют при рН 3—5, так как при высоком содержании кальция и фосфора в условиях меньшей кислотности может произойти образование труднорастворимого фосфата кальция.
2.3.1 Методика определения общего содержания железа сульфосалицинатным методом
В мерную колбу вместимостью 100 мл помещают 10-25 мл фильтрата, полученного после отделения кремниевой кислоты. В колбу добавляют 0,5 г гидроксиламина, приливают 5—10 мл 25%-ного раствора сульфосалициловой кислоты. Раствор в колбе перемешивают и приливают аммиак до появления слабого запаха. Раствор снова перемешивают и добавляют еще 2 мл аммиака. Объем жидкости в колбе доводят водой до метки, раствор тщательно перемешивают и через 10 мин измеряют оптическую плотность.
Для построения калибровочного графика в мерные колбы вместимостью 100 мл помещают 1, 2, 4, 5, 7 мл стандартного раствора с содержанием Fe 0,1 мг/мл. В колбы приливают 25 мл воды и проводят анализ, как указано выше, для испытуемых растворов.
Строят график зависимости оптической плотности от концентрации Fe2
O3
и находят содержание железа в почве.
Реагенты:
1. 25%-ный раствор сульфосалициловой кислоты. Навеску сульфосалициловой кислоты массой 25 г растворяют в 100 мл дистиллированной воды. Раствор хранят в темной склянке с притертой пробкой.
2. 25%-ный раствор аммиака, не содержащий С02.
3. Гидроксиламин солянокислый NH2
OH HCl.
4. Стандартный раствор железа. Навеску [(NH4
)2
SO4
Fe2
(SO4
)3
*24 Н2
O] массой 0,8637 г растворяют в 1 л 5%-ного раствора H2S04 и тщательно перемешивают. Полученный раствор должен содержать в 1 мл 0,1 мг железа. Концентрацию железа в растворе проверяют гравиметрическим методом.
Стандартный раствор железа может быть получен растворением 0,1000 г металлического железа в 5%-ном растворе серной кислоты. Если для полного растворения железа необходимо, раствор подогревают.
2.4 Методика определения подвижных форм железа с помощью роданида аммония
Навеску воздушно-сухой почвы 5 г, просеянной через сито с отверстиями 1 мм, помещают в колбу и приливают 250 мл 0,2 Н раствора HCL, перемешивают и настаивают в течение суток.
Суспензии фильтруют, пипеткой отбирают 5 мл фильтрата в колбу на 100 мл и приливают 5 мл HNO3
, затем перемешивают и по каплям добавляют раствор KMnO4
с м.д. 0,3% до образования неисчезающей слабо-розовой окраски от одной капли, затем добавляют 80-90 мл дистиллированной воды и 5 мл аммония роданистого. Доводят водой до метки и колориметруют.
Из рабочего раствора соли Мора готовят эталонные растворы. Для этого в колбы на 100 мл наливают количество раствора по таблице 2, доливают дистиллированной воды около 80 мл, приливают 5 мл аммония роданистого, доводят водой до метки, перемешивают колориметрируют сразу в течение 15 – 30 мин.
| № колбы |
Объем раствора соли
Мора, мл
|
Масса Fe в 100 мл
эталонного раствора, мг
|
| 1 |
1 |
0,1 |
| 2 |
2 |
0,2 |
| 3 |
4 |
0,4 |
| 4 |
8 |
0,8 |
| 5 |
16 |
0,16 |
| 6 |
24 |
0,24 |
| 7 |
32 |
0,32 |
Таблица 2. Таблица эталонных растворов для проведения анализа
По результатам фотометрирования эталонных растворов строят градуировачный график. По оси абсцисс откладывают массу железа в миллиграммах, соответствующую объему соли Мора в эталонных растворах, а по оси ординат – соответствующие им показания прибора. Пользуюсь градуировачным графиком, по результатам анализа определяют массу железа в анализируемых пробах.
Для вычисления массы подвижных форм железа при натуральной влаге используют следующие уравнение:
Fe % = m*250*100/V*m1
где m – масса Fe по градуировачному графику; 250 – объем HCL, приливаемый к навеске; V – объем вытяжки, взятый на определение, в мл; m1
– масса навески, в г.
Для вычисления массы подвижных форм железа в пересчете на оксид железа при натуральной влаге используют следующие уравнение:
Fe % = m*250*1,43*100/V*m1
где 1,43 – коэффициент пересчета на оксид железа.
Список литературы
1. Почвоведение: учебник для сельскохозяйственных вузов: допущено Главным управлением высшего и среднего сельскохозяйственного образования Минестерства сельского хозяйства СССР/ Кауричева И. С., Гречина И. П. – Москва: «Колос», 1969. – 542 с.
2. Почвоведение: учебник для университетов. В 2 ч./ Под ред. В. А. Ковды, Б. Г. Розанова. Ч. 1. Почва и почвообразование / Богатырев Л. Г., Васильевская В. Д., Владыченский А. С. и др. – Москва: Издательство Высшая школа, 1988. – 368 с.
3. Химический анализ почв: учебник для студентов высших учебных заведений, обучающихся по направлению и специальности «Почвоведение»:рекомендовано Министерством общего и профессионального образования Российской Федерации/Воробьева Людмила Андреевна. – Москва: Издательство Московского университета, 1998. – 271 с.
4. Материалы сайта http://www.pochva.com/
|