Министерство образования и науки РФ
ГОУ ВПО «КЕМЕРОВСКИЙ ГОСУДАРСТВННЫЙ УНИВЕРСИТЕТ»
Химический факультет
Кафедра органической химии
Магнийорганические соедиения
(курсовая работа)
Выполнил:
студентка группы Х-051
Тарасова К. В.
Проверил:
к.х.н., доцент
Лузгарев С. В.
Кемерово 2008
Содержание
Введение
История открытия
Строение
Получение
Реакции
Применение
Заключение
Список литературы
Введение
Магнийорганические соединения относятся к числу одних из самых известных металлоорганических соединений. Они широко применяются в органическом синтезе, хотя в последнее время их потеснили литийорганические соединения, которые в ряде случаев оказываются более удобными. Использование магнийорганических соединений позволило получить органические производные многих элементов и привело к развитию целого направления - химии элементоорганических соединений, успешно развиваемое в нашей стране школой академика А.Н. Несмеянова. С их помощью можно получать соединения различных классов: спирты, альдегиды, кетоны, эфиры, органические кислоты и т. д. Место, занимаемое магнийорганическими соединениями среди всех металлоорганических соединений, уникально. Причина заключается в том, что магнийорганические соединения легко доступны и обладают высокой реакционной способностью, однако не столь чувствительны к кислороду и влаге как литийорганические соединения. Они взаимодействуют со многими органическими соединениями достаточно селективно (также в отличие от литийорганических соединений, которые часто реагируют неселективно и проявляют свойства восстановителей) и поэтому находят широкое применение в органическом и металлоорганическом синтезе. Реакции, в которые вступают реактивы Гриньяра, чрезвычайно разнообразны. К ним относятся переметаллирование с получением самых различных металлоорганических соединений, алкилирование и каталитическое арилирование, приводящие к образованию новых связей углерод-углерод. Важнейшей группой реакций Mg-органических соединений являются реакции присоединения по кратным связям С=О, С=NR, C≡N, приводящие к получению спиртов, кетонов, кислот, аминов.
История открытия
К магнийорганическим относят химические соединения, в которых атом углерода непосредственно связан с атомом магния. Они представляют отдельный очень важный класс соединений магния. С их помощью химики синтезировали огромное количество органических соединений: лекарственных препаратов, витаминов, душистых веществ и т.д. История металлоорганических соединений началась в 1849г, когда молодой английский химик Франкланд получил вещество, в котором атом углерода был непосредственно связан с цинком. Своей способностью вступать во все возможные реакции они сразу же привлекли внимание химиков. Однако их чрезвычайная активность, например, они мгновенно самовоспламенялись на воздухе, сильно затрудняла работу с этими веществами. В 1899г французский ученый Ф. Барбье предложил заменить цинк на магний, обнаружив, что в присутствии диэтилового, "серного" эфира магний легко вступает в те же реакции, что и цинк. Магнийорганические соединения оказались значительно эффективнее цинкорганических, менее опасными в обращении и получили широкое распространение. Особая заслуга в их исследовании и внедрении в лабораторную практику принадлежит выдающемуся французскому химику В. Гриньяру. В 1900 г. он усовершенствовал метод синтеза, предложив разделить реакцию на две стадии: 1 - образование смешанного магнийорганического соединения в эфирной среде:
RX + Mg → RMgX,
где R - углеводородный радикал, а Х - галоген; 2 - взаимодействие RMgX с соединением, содержащим карбонильную группу, приводит к образованию новой углерод - углеродной связи. Реакции такого типа получили название по имени автора открытия - "реакции Гриньяра", подробно рассмотренные ниже.
За эти работы В. Гриньяр был удостоен в 1912 г. Нобелевской премии. Магнийорганические галогениды нашли широкое применение в органическом синтезе. С их помощью можно получать соединения различных классов спирты, альдегиды, кетоны, эфиры, органические кислоты и т.д. Сам В. Гриньяр писал 1926г так: "Подобно хорошо настроенной скрипке, магнийорганические соединения под опытными пальцами могут дать звучание все новым неожиданным и более гармоничным аккордам".
Строение
Включение атома непереходного металла в органическую молекулу с образованием s-связи С-Мет придает молекуле высокую реакционную способность в качестве нуклеофила или, как говорят, скрытого карбаниона, поскольку в большинстве таких молекул связь М-С сильно поляризована и атом углерода несет частичный отрицательный заряд. Эта специфика металлоорганических соединений главных групп сделала их мощным орудием металлоорганического и органического синтеза.
Магнийорганические соединения содержат связь Mg–C. Основные типы магнийорганических соединений – R2
Mg и RMgX, где Х = Hal, OR, SR, NRR'. Наиболее важны RMgHal (Hal = Cl, Br, I), называемые реактивами Гриньяра – бесцветные кристаллы или вязкие жидкости состава Mg:R:Hal = 1:1:1; устойчивы до 100-150°С.
В растворе RMgHal существует равновесие Шленка, смещенное влево:
2RMgHal → MgHal2
+ R2
Mg
Стехиометрическая смесь MgHal2
и R2
Mg в эфире дает продукт, полностью идентичный RMgHal. Полагают, что в равновесии Шленка участвуют сольватирированные комплексы, например:
R2
Mg·2ТГФ + MgHal2
·4ТГФ ↔ 2(RMgHal·nТГФ) + mТГФ
(n = 2,3; m = 0-2)
В гексаметаполе (L) главная форма – RMgHal·2L с частично ионной связью Mg–С. В углеводородах RMgHal образуют структуры с мостиковыми атомами галогена, RMgF в эфире и ТГФ – димер с мостиковыми атомами F.
Соединения R2
Mg – бесцветные твердые вещества, обычно разлагающиеся при нагревании без плавления, для некоторых R2
Mg известны температуры плавления. Плохо растворимы в насыщенных углеводородах, лучше – в бензоле. Обычно кристаллизуются из полярных сред в виде комплексов с растворителем составов 1:1 или 1:2, однако в отличие от RMgHal растворитель может быть легко удален в вакууме. В кристаллическом состоянии R2
Mg (R = СН3
, С2
Н5
) имеют структуру линейных полимеров с мостиковыми алкильными группами. В среде углеводородов R2
Mg представляют собой димеры или тримеры в эфире или ТГФ – сольватированные мономеры, однако при высоких концентрациях R2
Mg возможна их ассоциация. Связь Mg–С в растворенных R2
Mg обычно ковалентная однако в гексаметаполе она существенно ионизирована. Фактически комплексно связанный эфир входит в состав магнийорганического соединения. Кроме того, по эбуллиоскопическим определениям А. П. Терентьева гриньяров реактив имеет удвоенный молекулярный вес. При электролизе его эфирного раствора на катоде отлагается магний. Всё это дало основание Тереньтеву предложить для реактива Гриньяра такую структуру (контактная ионная пара):
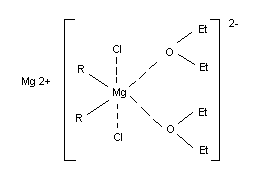
Эшби и Уокер (1967 г.) привели доводы в пользу того, что ассоциация гриньяровского реактива осуществляется галоидными мостами:
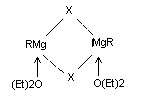
Однако такая структура не объясняет факта электропроводности и электролиза эфирных растворов гриньяровских реактивов с переносом Mg2+
на катод. Несмотря на сложную структуру реактивов Гриньяра, для описания всех их реакций вполне удовлетворяет формула RMgHal, которую обычно и применяют.
Получение
Получение RMgHal
: главным образом в эфирном растворе из магниевых стружек и органического галогенида:
R-Hal + Mg → R-Mg-Hal
При этом раствор органического галогенида в диэтиловом эфире медленно, при перемешивании, прибавляют к суспензии Mg этом же растворителе. Во многих случаях (особенно при работе с АrНаl) магний активируют, для чего в реакционную смесь добавляют I2
, ВrСН2
СН2
Вr или C2
H5
Br. Для синтеза RMgНа1 из СН2
=СННаl и АrСl вместо диэтилового эфира применяют ТГФ или другие циклические эфиры, а также эфиры ди- и триэтиленгликоля. Эфир полностью обычно не удаляется, и RMgHal, доведенные до постоянного веса в вакууме при 100° С, представляют собой смесь MgHal2
и [R2
Mg]n
; в твердом виде выделяются как комплексы с растворителем состава 1:1 или 1:2. RMgHal, полученные в углеводородах, дают осадок MgHal2
и растворимое металлоорганическое вещество, которое в твердом виде отвечает составу R3
Mg2
Hal.
Активность RНаl уменьшается в ряду: R-I > R-Вr > R-Сl.
При получении реактива Гриньяра на практике применяют RВr, т.к. RСl мало реакционноспособен, а реакции с RI сопровождаются побочными процессами в большей степени, чем с бромидами. В случае вторичных и особенно третичных RI наблюдается отщепление НI с образованием олефина. Другая побочная реакция, которая часто сопровождает синтез алкилмагнийгалогенидов – образование углеводородов (реакция Вюрца - Гриньяра):
R'Наl + RМgНаl–> R–R' + МgHal2
В присутствии каталитических количеств солей переходных металлов (например, Со(II), Ni(II), Cu(II) и др.) образуется обычно R–R (реакция Хараша). Реакция из гетеролитической становится гомолитической из-за первоначального образования RCoHal, гомолизующегося на радикал и радиколообразный галогенид переходного металла:
RCoHal → R∙ + ∙CoCl
Получение R2
Mg
: осаждением диоксаном из эфирного раствора RMgHal; реакцией с ртутьорганическими соединениями:
R2
Hg + Mg –> R2
Mg + Hg.
Реакции
Магнийорганические галогениды чрезвычайно реакционноспособны. Наиболее широко их применяют в реакциях с соединениями, содержащими поляризованную кратную связь (например, С=О, С≡N, С=S).
1.
Соединения RMgHal разлагаются выше 100°С по типу -элимиминирования, например:
2RCH2
CH2
MgHal –> 2RСН=СН2
+ MgH2
+ MgHal2
.
2.
Окисление RMgHal первоначально приводит к ROOMgHal, затем образуются ROMgHal.
RMgHal + O2
→ ROOMgHal → ROMgHal
3.
При действии органические соединения с активным атомом водорода RMgHal дают RH. Эту реакцию (при R = СН3
) используют для определения активного Н в органических соединениях (метод Церевитинова). Измеряя объём метана, выделившегося при взаимодействии определённого количества соединения с подвижным водородом, можно вычислить число молей активного водорода в образце. Если известна молекулярная масса, то можно определить число активных водородов в молекуле.
RMgHal + C2
H5
O∙∙∙H → CH4
+ C2
H5
OMgHal
4.
Магнийорганические соединения RMgHal разлагаются под действием воды и кислот, восстанавливаются водородом при нагревании до RH, MgH2
и MgHal2
.
RMgHal + H2
O → RH + Mg(OH)Hal
RMgHal + H2
→ RH + MgH2
+ MgHal2
5.
С галогенами образуют RHal и MgHal2
, с S (и последующим гидролизом) – RSH, с SO2
– RSO2
MgHal, с СО2
– соли карбоновых кислот.
RMgHal + Hal2
→ RHal + MgHal2
RMgHal + S(гидролиз) → RSH
RMgHal + SО2
→ RSO2
MgHal
RMgHal + СО2
→ RCOOMgHal
6.
С солями других металлов реагируют с образованием продуктов замещения. Это основной метод синтеза металлоорганических соединений переходных и непереходных металлов со -связью металл-элемент. Реакции способствуют более полярные растворители. Эта реакция нашла широкое применение в синтезе элементоорганических соединений.
RMgBr + HgBr2
→ RHgBr + MgBr2
7.
В обычных условиях RMgHal не присоединяются к несопряженным алкенам и алкинам. При высоких температуре и давлении RMgHal присоединяются к терминальным алкенам, сопряженным алкенам и алкинам, что используют как стадию в органическом синтезе. Присоединение возможно и в тех случаях, когда двойная связь активирована соседней электроноакцепторной группой.
8.
При взаимодействии RMgНаl с формальдегидом, оксидом этилена или этиленхлоргидрином образуются первичные спирты, из других альдегидов и формиатов (эфиров) – вторичные, из кетонов, ангидридов, хлорангидридов и сложных эфиров – третичные.
Реакцию RMgНаl с ангидридами и хлорангидридами в специальных условиях используют для синтеза кетонов (проведение синтеза при низких температурах позволяет уменьшить скорость побочной реакции образования третичного спирта до такой степени, что кетоны могут быть выделены). Наиболее широко для синтеза кетонов применяют амиды кислот и нитрилы.
CH3
COCl + RMgHal → CH3
(COMgHal)ClR → CH3
COR
R*
-C≡N + R∙∙∙MgHal → R*
(R)C=N-MgHal
R*
(R)C=N-MgHal + H+
+ H2
O → R*
(R)C=O + NH3
Кетоны образуются также в реакции Гриньяра с применением ортоугольных эфиров.
Удобный метод синтеза альдегидов – реакции с использованием ортомуравьиного эфира (Чичибабин), ацеталь далее легко гидролизуется в альдегид; вместо него применяют также формиаты (эфиры и соли) и формамиды (обычно N-метилформанилид).
RMgHal + HC(OR*
)3
→ R-CH(OR*
)2
+ R*
OMgHal
9.
Взаимодействием RMgX с СО2
синтезируют карбоновые кислоты, с диалкилкарбонатами и ортоугольным эфиром – эфиры и ортоэфиры карбоновых кислот.
RMgHal + (R*
O)4
C → RC(OR*
)3
+ R*
OMgHal
RMgHal + СО2
→ RCOOMgHal
RCOOMgHal + HHal → RCOOH + MgHal2
10.
Во многих случаях реакции Гриньяра с карбонильными соединениями протекают с количественным выходом.
RMgHal + CH2
=O → RCH2
OMgHal
RCH2
OMgHal + H2
O → RCH2
OH + Mg(OH)Hal
Затруднения возникают при синтезе веществ с разветвленными радикалами. Наиболее распространенные побочные реакции – енолизация и восстановление, например:

Первая реакция может происходить, если в карбонильном соединении имеется хотя бы один -атом Н, вторая – когда в реактиве Гриньяра имеется атом Н в -положении. Образующийся алкоголят, подобно алкоголятам Аl, может реагировать как восстановитель, например:
RRCH(OMgX) + R'CHO → R2
CO + R'CH2
OH
Следствием енолизации может быть конденсация, подобно альдольно-кротоновой или Кляйзена.
Реакции с ароматическими кетонами часто сопровождаются образованием пинаконов. В реакциях с -непредельными карбонильными соединениями возможно как 1,2-, так и 1,4-присоединение, а с ароматическими производными – и 1,6-присоединение.
RCH=CH-C(R*
)=O + R**
MgHal → R(R**
)CH-CH=C(R*
)OMgHal
R(R**
)CH-CH=C(R*
)OMgHal + H2
O → R(R**
)CH-CH2
-C(R*
)=O
Обычно эта реакция идёт наряду с 1,2-присоединением, дающим третичный спирт:
RCH=CH-C(R*
)=O + R**
MgHal → RCH=CH-C(R**
)(R*
)OMgHal
RCH=CH-C(R**
)(R*
)OMgHal + H2
O → RCH=CH-C(R**
)(R*
)OH
Чем более объёмист R**,
тем более он склонен к 1,4-присоединению. Наиболее способен к нормальному 1,2-присоединению CH3
MgHal. Объёмистость радикала R действует в обратном направлении. То есть альдегиды (R*
= Н) в большей степени, чем кетоны, способны к реакциям 1,2-присоединения.
Гриньяровские реактивы присоединяются к ароматическим кетонам в положения 1,4. В случае настолько пространственно загромождённых ароматических кетонов, что орто-положение бензольного ядра недоступно, радикал реактива Гриньяра вступает в пара-положение, т. е. 1,6-присоединение.
Наиболее вероятный механизм реакции с карбонильными соединениями – гетеролитический. Предполагается, что переходное состояние представляет собой квазишестичленный цикл (1,4-присоединение):

11.
Ацетиленилмагнийгалогениды могут быть получены взаимодействием алкилмагнийгалогенидов с производными ацетилена (Ж. И. Иоцич)
R-C≡CH +RMgHal → R-C≡C-MgHal +RH
12.
Важны магнийорганические производные пиррола, индола и других пятичленных гетероциклов, имеющие связь N-MgHal.
C4
H4
NH + RMgHal → C4
H4
N-MgHal + RH
13.
С окисью азота гриньяровы реактивы реагируют по схеме:
RMgHal + 2NO → R-N(NO)OMgHal
R-N(NO)OMgHal + H2
O → R-N(NO)OH
После гидролиза образуется алкил- или арилнитрозогидроксиламин.
14.
Хлористый нитрозил даёт с реактивом Гриньяра нитрозосоединения:
RMgCl + ClNO → R-NO + MgCl2
15.
С хлорамином (Колеман) образуются первичные амины:
RMgCl + ClNH2
→ RNH2
+ MgCl2
16.
Из оснований Шиффа и реактива Гриньяра получают вторичные амины (Буш):
ArN=CHAr*
+ RMgHal + H2
O → ArNH-CH(R) Ar*
17.
Алкил- или арилазиды с реактивом Гриньяра образуют триазены (диазоаминосоединения):
R-N=N=N + R*
MgHal + H2
O → R-N=N-NH- R*
18.
Нитрозосоединения превращаются в N-диалкил (диарил-) гидроксиламины:
R-N=O + R*
MgHal + H2
O → R(R*
)N-OH
19.
По химическим свойствам R2
Mg в целом аналогичны RMgHal, однако часто химические реакции R2
Mg протекают с большими скоростями. Таковы, например, реакции с О2
, СО2
, Н2
, реакции с органическими соединениями. Однако наблюдаются и некоторые различия. Например, 1,2-присоединения R2
Mg к -ненасыщенным кетонам, тогда как для RMgHal характерно 1,4-присоединение.
Применение
Магнийорганические соединения в основном используют в органическом синтезе и для получения металлоорганических соединений. В промышленности их в смеси с другими металлоорганическими соединениями применяют как катализаторы полимеризации.
Для аналитической химии магния большое значение имеют окрашенные соединения его с органическими реагентами, используемые в качестве комплексонометрических индикаторов, для фотометрического определения и для обнаружения магния. Ион магния не обладает хромофорным действием, поэтому цветные реакции дают только соединения его с окрашенными органическими реагентами. Из них наиболее важны азосоединения, меньшее значение имеют соединения магния с азокрасителями.
При взаимодействии магния с некоторыми азокрасителями образуются интенсивно окрашенные внутрикомплексные соединения. Саввин и Петрова изучили цветные реакции магния с азосоединениями на основе хромотропной кислоты. Некоторые из них с магнием дают интенсивно окрашенные комплексы, пригодные для фотометрического определения магния. Диль и Эллингбоэ изучили образование магнием окрашенных соединений с 26 моноазосоединениями с целью использования их в качестве индикаторов для комплексонометрического определения магния.
Заключение
Как мы видим, магнийорганические соединения – это обширный класс веществ, используемый в основном как реагент для получения разнообразных химических соединений: спиртов, альдегидов, кетонов, эфиров, органических кислот, аминов и др.
К сожалению, создание крупномасштабного производства на основе магнийорганических соединений встречает значительные трудности из-за исключительной пожароопасности эфира. В настоящее время разрабатываются методики применения магнийорганических соединений с использованием не столь горючих растворителей. Вероятно, недалеко то время, когда магнийорганические соединения будут широко применяться в химической технологии при получении соединений других классов.
Список литературы
1. Агрономов А.Е. Избранные главы органической химии. М.: Химия, 1990.
2. Бартон Д., Оллис У.Д. - Общая органическая химия (том 7). Металлоорганические соединения. 1984.
3. А.С.Днепровский, Т.И. Темникова. Теоретические основы органической химии. Химия, 1979.
4. Иоффе Ф.Т., Несмеянов А.Н., Магний, берилий, кальций, стронций, барий, в сборнике: Методы элементоорганической химии, под редакцией А.Н. Несмеянова, К.А. Кочешкова, [ч. 1], М., 1963.
5. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. Книга 2. Издание второе. М., 1978.
6. Реутов О.А., Белецкая И.П., Соколов В.И. Механизмы реакций металлоорганических соединений. М.: Химия, 1972
7. Робертс Дж., Касерио М. Основы органической химии. Том 1. М.: «Мир», 1978.
8. Д.Ж. Харвуд. Промышленное применение металлоорганических соединений. Химия, 1970.
9. А.Е.Чичибабин. Основные начала органической химии. Том.1 Госхимиздат, 1953.
|