Контрольная работа
по химии
вариант № 10
2009
Содержание
Парные потенциалы взаимодействия между двумя молекулами в вакууме
Разделение межмолекулярных взаимодействий по типам
Электростатические взаимодействия
Индукционные взаимодействия
Дисперсионные взаимодействия
Zbond - энергия связи
Обменное взаимодействие
Водородная связь
Теоретические модели и параметры
Вода как диэлектрик
Гидрофобные взаимодействия
Теория Дебая-Хюккеля
Межмолекулярные взаимодействия имеют фундаментальное значение для понимания того, как атомы и молекулы организованы в жидкостях и твердых телах. В качестве примера рассмотрим образование мицелл заряженными молекулами ПАВ. Почему образуются мицеллы и какие силы действуют между молекулами поверхностно-активного вещества? Поскольку мицеллы не образуются в газовой фазе, очевидно, что недостаточно рассматривать взаимодействия только между молекулами ПАВ. Растворитель играет определяющую роль в процессе мицеллярного агрегирования, а вода в этом отношении вообще уникальна. На рис. показано, что мицеллы не могут возникать в растворителе с низкой диэлектрической проницаемостью вследствие очень слабого экранирования полярных групп молекул ПАВ и, следовательно, сильного электростатического отталкивания между ними. Можно ли разобраться в механизме мицеллообразования, основываясь на знании взаимодействий между молекулами ПАВ, противоионами и молекулами воды? На качественном уровне, безусловно, да, однако при этом количественно описать систему невозможно. Последующие разделы посвящены подробному рассмотрению типов межмолекулярных взаимодействий, существующих между указанными частицами.
При изучении атомных и молекулярных сил взаимодействия можно не учитывать некоторые силы, действие которых не соответствует размерам молекул; например, для данного случая исчезающе малы гравитационные силы. Для анализа рассматриваемой системы важны только электростатические силы, возникающие при взаимодействии между электронами и протонами различных молекул. Здесь уместно напомнить размеры небольших молекул и величину энергии водородной связи, например, в водном растворе. Грубая оценка размера молекулы воды может быть получена из ее плотности. Оценочное значение диаметра молекулы воды составляет 3 А. Основной вклад в межмолекулярные взаимодействия молекул воды дают диполь-дипольные взаимодействия. Используя известное значение дипольного момента воды, равное 1.85 Д, и принимая усредненное расстояние между молекулами воды равным 3 А, найдем, что типичная энергия взаимодействия составляет 10-20 кДж/моль. Такой расчет, безусловно, является грубым приближением. Но, как станет понятно далее, он приводит к значению, совпадающему по порядку величины с реальной энергией взаимодействия. Этот пример приведен специально, чтобы показать, насколько полезно проводить приближенные оценки при обсуждении межмолекулярных взаимодействий. Следующий расчет, немного более строгий, показывает, как усложненные квантово-механические расчеты помогают разобраться в межмолекулярных взаимодействиях.
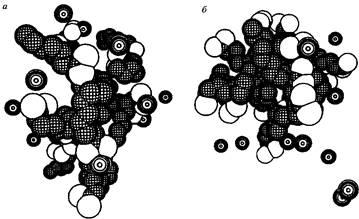
Мицеллярные структуры октаноата натрия в двух растворителях с различными диэлектрическими проницаемостями Sr
: Sr
= 20 и Sr
= 80. Мицеллы не могут образовываться в растворе с низкой диэлектрической проницаемостью из-за сильного электростатического отталкивания полярных групп молекул ПАВ
Допустим, что два атома находятся на бесконечном расстоянии друг от друга. Суммарная энергия взаимодействия состоит из индивидуальных вкладов, т.е. энергий изолированных атомов 1 и 2. При приведении в контакт атомы будут взаимодействовать друг с другом, и суммарная энергия взаимодействия выражается уравнением
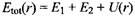
где U - межмолекулярный потенциал. По определению, он равен работе, которую необходимо совершить для переноса атомов из бесконечного удаления на расстояние г друг от друга:
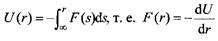
где F - сила, действующая между двумя атомами. Так как сила является отрицательной производной потенциальной энергии, можно заключить, что сила отталкивания не обязательно определяется энергией отталкивания.
Рассмотрим атом, состоящий из тяжелого, положительно заряженного ядра, окруженного быстрыми электронами, способными мгновенно реагировать на изменения в положении ядра. Согласно приближению Борна-Оппенгеймера, потенциальная энергия зависит только от относительного расположения ядер. В таком приближении можно численно решить уравнение Шрёдингера. На практике этот подход можно применять только к молекулам, содержащим не более 1000 электронов. Для изучения взаимодействий более крупных молекул можно попытаться разделить суммарную энергию на серию наиболее важных вкладов и исследовать каждый вклад отдельно, надеясь на то, что проигрыш в строгости теории компенсируется более глубоким пониманием физической природы молекулярных сил.
Напоминаем, что наше обсуждение изначально ограничено взаимодействием между парами атомов или молекул в вакууме. В таком случае это действительно парные взаимодействия, не зависящие от растворителя и температуры. Далее рассмотрим взаимодействие между двумя молекулами в некоторой среде, например взаимодействие двух ионов в воде. В этом случае взаимодействие зависит от диэлектрической проницаемости растворителя, поэтому взаимодействие становится температурно-зависимым. Такой тип взаимодействий обозначим как эффективный парный потенциал. Химики часто пользуются эффективными потенциалами; например, гидрофобные взаимодействия или экранированные кулоновские взаимодействия описываются такими потенциалами.
Взаимодействие на близких расстояниях называется обменным взаимодействиям Uqxc
. Энергия обменного взаимодействия рассчитывается на основе квантовой механики, исходя из принципа Паули. Другие силы межмолекулярного взаимодействия можно рассматривать в рамках классической электростатики. Суммарную энергию взаимодействия можно представить следующим выражением:
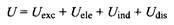
где Ue
\Q
- энергия непосредственно электростатического взаимодействия, aUm
d и CZdis
- энергии индукционного и дисперсионного взаимодействий соответственно.
В качестве примера на рис. показана энергия взаимодействия между двумя молекулами воды, рассчитанная квантовомеханическим способом.
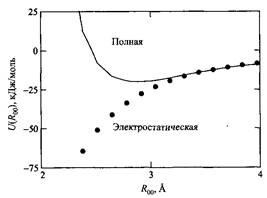
Энергия взаимодействия между двумя молекулами воды, рассчитанная неэмпирическим квантовомеханическим методом. Сплошная линия - полная энергия взаимодействия U. Точками показан вклад электростатической составляющей Lr
e
Ie
.
Такое распределение энергии на несколько вкладов не является единственно возможным. Оно предполагает, что взаимодействующие частицы сохраняют индивидуальность и все присущие им свойства.
Но это условие не всегда выполняется: любая химическая реакция с образованием новых ковалентных связей служит типичным примером непригодности такого подхода.
Рассмотрим, например, образование воды из О2 и Н2. Ни один из реагентов, вступающих в реакцию, не имеет дипольного момента, в то время как продукт реакции обладает очень большим дипольным моментом.
Разделение и классификация вкладов различных взаимодействий является в некотором смысле персональным выбором. Водородную связь и комплексы с переносом заряда не имеет смысла рассматривать как отдельные виды взаимодействий. Водородную связь можно описать с помощью электростатического вклада UQ
\Q
, а перенос заряда в основном представляет собой индукционное взаимодействие, включенное в Сind
. Безусловно, указанные четыре типа взаимодействий не независимы, но для большинства систем члены, характеризующие их взаимосвязь, малы и ими можно пренебречь.
Распределять суммарную энергию взаимодействия на отдельные вклады можно и для внутримолекулярных взаимодействий в больших молекулах, таких как белки или полимеры. В этом случае атомы или группы атомов, разделенные друг от друга более чем тремя или четырьмя связями, рассматривают как принадлежащие разным молекулам. Обычно из-за неявности данного приближения выделяют вклады связей, валентных углов и диэдральных углов. Некоторые виды внутримолекулярных движений относятся к почти классическим, например вращение вокруг связи, в то время как быстрые колебания связи являются строго квантовомеханическими. Эти силы невозможно точно описать. Учитывая задачи данного изложения, можно ограничиться оценочными классическими приближениями.
Для двух произвольно выбранных распределений заряда и и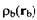 энергия кулоновского взаимодействия описывается уравнением энергия кулоновского взаимодействия описывается уравнением
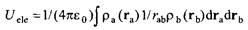
Для двух точечных зарядов выражение приводится к виду

Обычно распределение заряда представляют мультипольным рядом, что позволяет рассматривать отдельно ион-ионные, ион-дипольные, диполь-дипольные и т.д. взаимодействия.
Молекулы, не обладающие сферической симметрией, характеризуются постоянными электрическими моментами.
Момент нулевого порядка - это полный заряд Qy
а момент первого порядка - дипольный момент, являющийся векторной величиной:

Моменты более высоких порядков являются тензорными величинами. Электрические моменты различных молекул взаимодействуют между собой, не нарушая распределения зарядов.
Дипольные моменты молекул различаются очень сильно: дипольный момент м полярных молекул Н2
О равен 1.85 Д; молекул Н
33
- 1.47 Д, в то же время дипольные моменты молекул насыщенных углеводородов очень малы и проявляются только для определенных конформаций. Значения дипольных моментов некоторых небольших молекул приведены в табл.
Рассмотрим снова взаимодействие между двумя молекулами воды. В данном случае достаточно учитывать только электростатические взаимодействия в форме диполь-дипольного потенциала:
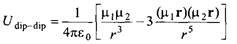
который для коллинеарного параллельного расположения диполей описывается выражением
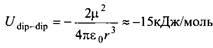
где м = 1.85 Д и 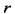 = 3 А. Для сравнения напомним, что квантово-механический расчет энергии взаимодействия для димера молекул воды дает величину около - 25 кДж/моль. = 3 А. Для сравнения напомним, что квантово-механический расчет энергии взаимодействия для димера молекул воды дает величину около - 25 кДж/моль.
Постоянные дипольные моменты небольших молекул
| Молекула |
Дипольный момент |
Молекула |
Дипольный момент |
| H2
O |
1.85 |
Гексанол |
1.7 |
| NH3
|
1.47 |
C6
H5
OH |
1.5 |
| СО |
0.11 |
HCONH2
|
3.7 |
| CO2
|
О |
CH3
COCH3
|
2.9 |
| СНзОН |
1.7 |
С2
ЩО |
1.9 |
| CH3
CH2
OH |
1.7 |
C6
H5
NO2
|
4.2 |
Между двумя молекулами воды преобладает притяжение за счет диполь-ди-польного взаимодействия, в то время как в димерах диоксида углерода или бензола электростатическое взаимодействие обусловлено квадруполь-квадрупольным вкладом. Для нейтральных молекул характерны дипольные взаимодействия, которые дают наиболее значимый вклад в энергию взаимодействия. Важно отметить, что взаимодействия разных моментов характеризуются разными зависимостями от расстояния. Например, ион-ионное взаимодействие обратно пропорционально расстоянию между ионами, диполь-дипольное взаимодействие пропорционально r-3
, причем дополнительно оно обнаруживает сильную ориентационную зависимость. Квадруполь-квадрупольное взаимодействие спадает пропорционально r
-5
, что объясняет малый вклад таких взаимодействий при ненулевом дипольном моменте. Позже мы увидим, что расстояние, на котором проявляется взаимодействие, сильно влияет на макроскопические характеристики.
Отдельно от электростатических сил в рамках классических представлений можно рассматривать явление индукции. В случае точечного диполя и нейтральной молекулы, не обладающей постоянным электрическим моментом, электрическое поле Eext
диполя индуцирует небольшое перераспределение заряда в форме противоположно направленного дипольного момента:
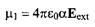
Энергия индуцированного диполя задается взаимодействием индуцированного дипольного момента с приложенным полем за вычетом энергии, необходимой для создания диполя в поле. В индукционном взаимодействии участвует много тел, т.е. индуцированный дипольный момент зависит от всех постоянных, а также от всех индуцированных дипольных моментов.
Рассмотрим две молекулы с постоянными дипольными моментами и поляризуемостями. Электрическое поле от молекулы 1, влияющее на молекулу 2, приблизительно равно  , а соответствующий индуцированный диполь молекулы 2 равен , а соответствующий индуцированный диполь молекулы 2 равен
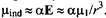
Взаимодействие постоянного дипольного момента молекулы 1 с наведенным диполем молекулы 2 описывается соотношением:
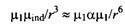
Если сравнить уравнение с уравнением, описывающим взаимодействие постоянных диполей, получим
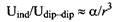
Поскольку поляризуемость имеет порядок молекулярного размера, можно заключить, что энергия индукционного взаимодействия может быть по величине одного порядка с C/dip - dip на расстояниях, сравнимых с молекулярным размером, тогда как постоянные дипольные моменты доминируют на больших расстояниях.
Типичные значения поляризуемостей приведены в табл. Бензол, имеющий систему делокализованных р-связей, обладает очень высокой поляризуемостью. Очевидно, что чем больше молекула, тем больше наведенные дипольные моменты, которые она может приобрести под влиянием небольших полярных молекул, например молекул воды. Дипольный момент молекулы в растворе не является строго определенной величиной. Если сделать приблизительную оценку для молекулы воды в водном растворе, то обнаружится, что дипольный момент увеличивается от 1.85 Д в газовой фазе до ~2.3 Д в растворе. Такое увеличение "эффективного" или полного дипольного момента оказывает огромное влияние на свойства жидкой воды. Приближенная оценка показывает, что индукционные взаимодействия в жидкой воде увеличивают температуру кипения на 100°!
Поляризуемость некоторых небольших молекул:
| H2
O |
1.5 |
Не |
0.20 |
| CO2
|
2.9 |
Ar |
1.63 |
| со |
2.0 |
Xe |
4.0 |
| Глицин |
5.9 |
H2
|
0.81 |
| C6
H6
|
10.6 |
Cl2
|
4.6 |
| C2
H4
|
4.3 |
Дисперсионные силы имеют квантово-механическую природу, но их можно интерпретировать с помощью более простых концепций. Электроны в молекуле движутся быстрее ядер, и электрическое поле изменяется под влиянием окружающих молекул. Однако флуктуации электронной плотности молекулы происходят независимо от окружения; другими словами, флуктуации существуют также и в вакууме. Вследствие этого появляются мгновенные диполи, которые, в свою очередь, генерируют электрическое поле. В случае двух атомов аргона эти два поля взаимодействуют аналогично индукционным взаимодействиям, приводя к притяжению. Движение электронов становится согласованным, что является источником дисперсионной энергии. Дисперсионные взаимодействия присутствуют всегда; например, они ответственны за притяжение между атомами благородных газов. Величина дисперсионного взаимодействия между двумя молекулами приблизительно пропорциональна произведению их поляризуемостей.
Как и в случае индукционных взаимодействий, для дисперсионных взаимодействий можно ввести члены более высокого порядка. Однако основной вклад дает член, пропорциональный Ilr6
. Зависимость Xlr6
выполняется на промежуточных расстояниях, при больших расстояниях необходимо учитывать тот факт, что электроны не могут мгновенно отвечать на изменения поля, что приводит к эффекту запаздывания. Запаздывание изменяет зависимость первого члена дисперсионной энергии от расстояния на ~ Xlr1
.
Роль дальнодействующих взаимодействий CTe
Iej
CTind и CZdis
зависит от природы изучаемой системы. Дисперсионные взаимодействия доминируют между атомами благородных газов.
Это же справедливо для димеров СО, где дипольный момент мономера оказывается близок к нулю. Для полярных молекул электростатическое взаимодействие сильнее, нежели индукционное, как это видно из табл. для воды и аммиака. Кроме того, для аммиака характерны дисперсионные взаимодействия, которые являются главным источником энергии притяжения в димере. Вклады притяжения в энергию димера при условии компенсации энергий притяжения и отталкивания:
| Система |
CZe
ie
|
CZind |
CZdis |
CZbond |
| Ar |
О |
0 |
-1.2 |
- |
| Xe |
о |
0 |
-1.9 |
- |
| СО |
"0 |
"0 |
-1.4 |
343 |
| HCl |
-0.2 |
-0.07 |
-1.8 |
431 |
| NH3
|
-6.3 |
-0.9 |
-13.0 |
389 |
| H2
O |
-16.0 |
-0.9 |
-5.3 |
464 |
Zbond
- энергия связи
Дисперсионные взаимодействия всегда создают притяжение между двумя неполярными молекулами углеводородов, а также между молекулами воды и углеводорода. Поверхностное натяжение на границе вода-воздух равно примерно 70 мН/м, в то время как на границе вода-углеводород межфазное натяжение ниже почти в два раза. Причина этого различия - дисперсионные взаимодействия. Различие в свойствах катионных и анионных ПАВ также часто объясняют разницей в индукционных и дисперсионных силах взаимодействия. Катионное ПАВ с сильно поляризующимся противоионом будет отличаться по свойствам от ПАВ с противоинами ОН" или СГ. Например, KKM хлорида додецилтриметиламмония равна 20.3 мМ. Значение KKM понижается до 15.6 мМ, если роль противоиона будет выполнять бромид-ион. Для анионных ПАВ с небольшими противоионами значительных изменений в величинах KKM не обнаружено.
Сближение двух электронных облаков и их перекрывание должно рассматриваться на основе принципа Паули, который запрещает нахождение на одной орбитали более двух электронов. Для размещения дополнительных электронов должны быть использованы более высокие по энергии орбитали, что вызывает отталкивание. Силы отталкивания можно использовать, чтобы задать "размер" молекул. Параметр исключенного объема в уравнении Вандер-Ваальса является мерой такого размера; например, молекулярные радиусы ССЦ, бензола и этанола равны соответственно 2.4,2.3 и 1.9 А. Когда говорят о "молекулярном размере" или строят объемные модели молекул, то по сути описывают обменные взаимодействия. Выбор расстояния в 3 А между двумя диполями молекул воды в предыдущем примере при оценке энергии димера воды был также обусловлен обменным взаимодействием.
Характеристики межмолекулярных взаимодействий приведены в табл.
Водородная связь не является особым типом взаимодействия, и ее природу можно понять с учетом сил, рассмотренных выше. Специфическим для водородных связей является то, что основной вклад, определяющий притяжение при их образовании, дают электростатические взаимодействия. Атом водорода присоединяется к высокоэлектроотрицательному атому, например атому кислорода.
В результате электрон, принадлежащий атому водорода, смещается в сторону электроотрицательного атома. Поскольку атом водорода теряет электрон, его радиус отталкивания мал, и возникает сильное электростатическое притяжение между ним и другими электроотрицательными атомами или молекулами. Так, при образовании димера молекул воды электростатическое взаимодействие намного превышает вклады дисперсионного и индукционного взаимодействий. В минимуме потенциальной энергии димера воды с расстоянием между атомами кислорода T00
~ 2.9 А вклад электростатической энергии UQ
\e
составляет - 31 кДж/моль, вклад индукционной энергии равен - 4 кДж/моль, вклад дисперсионного взаимодействия С/dis составляет - 6 кДж/моль, а вклад энергии обменного взаимодействия Uqxc
+20 кДж/моль. В жидкой воде при комнатной температуре усредненную внутреннюю энергию молекулы воды можно разделить на те же вклады: <Uq\q
> = - 53 кДж/моль, <C/ind> = - 18 кДж/моль, <t/diS
>==
-17 кДж/моль и <
С4хс>
=
+47 кДж/моль.
Характеристика межмолекулярных взаимодействий:
| Тип взаимодействия |
Диапазон действия |
Знак |
| Электростатическое |
Дальнодействующие |
Притяжение/Отталкивание |
| Индукционное |
Среднедействующие |
Притяжение |
| Дисперсионное |
Среднедействующие |
Притяжение |
| Обменное отталкивание |
Короткодействующие |
Отталкивание |
При решении конкретных задач необходимо определить силы либо прямыми измерениями, либо с помощью квантово-механических расчетов. Путем численного моделирования эксперимента также можно оценить параметры взаимодействия. Вывод точных аналитических выражений для потенциальных функций непрост. Для больших молекул невозможно ни измерить, ни рассчитать силы. Вместо этого можно использовать параметры, определенные для малых молекул, и относить их к более крупным сегментам; например, принимать, что распределение заряда в амидной связи в полипептиде одинаково по всей длине полипептидной цепи, независимо от природы боковой группы.
Потенциальная поверхность, которая точно отвечает всем экспериментальным данным, известна только для небольших димеров благородных газов. Потенциальная поверхность димера аргон-аргон полностью описывается обменными и дисперсионными взаимодействиями. Точный вид этого парного потенциала чрезвычайно громоздок, но для качественного описания вполне достаточно простого потенциала Леннард-Джонса:
Физический смысл е и у можно понять из рисунка.
Для более крупных частиц, например для молекул аминокислот, обычно пользуются функцией, описывающей взаимодействие центров атомов с учетом потенциала Леннард-Джонса и кулоновского взаимодействия:
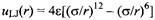
где / и/ - центры различных молекул. Полное взаимодействие суммируется по всем /-ым иу'-ым центрам.
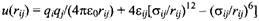
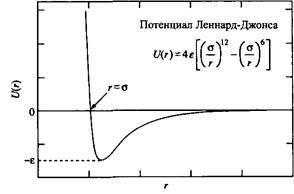
Схематическое представление потенциала Леннард-Джонса, где е - глубина минимума энергии притяжения, у - расстояние действия сил отталкивания
Эффективные парные потенциалы взаимодействия между двумя молекулами в среде.
Из сказанного выше очевидно, что мицеллообразование ионных ПАВ главным образом происходит за счет электростатических взаимодействий. Вклад электростатических сил в суммарное межмолекулярное взаимодействие наиболее значим; кроме того, электростатические силы - это силы дальнодействующие. Достаточно сильное взаимодействие двух ионов в воде нарушается молекулами воды, так что эффективное взаимодействие ослабевает. Это явление обычно называют диэлектрическим экранированием. Диэлектрическая проницаемость воды очень велика, что сильно влияет на взаимодействие пары ионов в водной среде:

При анализе ионных взаимодействий с хорошим приближением можно рассматривать воду как диэлектрическую среду. Такой подход - это всего лишь примитивная модель, но он оказался краеугольным камнем в теории электролитов и в теории двойного электрического слоя. Одним из проявлений дальнодействия ионных взаимодействий является относительно низкая чувствительность KKM ионных ПАВ к типу противоиона. Например, замена иона натрия в качестве противоиона на ион тетраэтиламмония приводит к незначительному изменению KKM.
Значения KKM для додецилсульфатов с различными противоионами. Причина небольших изменений значений KKM - дальнодействие кулоновских взаимодействий
| ПАВ |
ККМ, мМ |
| Ci2
SO4
" Na+
Ci2
SO4
" Li+
Ci2
SO4
-K+
Ci2
SO4
-N; C12
SO4
-N; |
8 9 8 6 5 |
Если обратиться к структуре мицелл, то очевидно, что электростатические взаимодействия препятствуют мицеллообразованию. Проявляется сильное отталкивание между отрицательно заряженными карбоксилатными группами на поверхности мицеллы. Тогда возникает вопрос: какие силы способствуют образованию мицелл? Конечно, определенную роль могут играть дисперсионные или индукционные взаимодействия, но они обычно невелики и по величине приблизительно одинаковы для взаимодействий молекул воды, молекул воды и ПАВ и ПАВ-ПАВ. Таким образом, эти силы не могут вызывать образование агрегатов молекул ПАВ.
Итак, нужно найти силы, ответственные за мицеллообразование. Как уже отмечалось, взаимодействие меду молекулами воды довольно сильное вследствие образования водородных связей. Введение неполярных молекул в воду оказывает сильное воздействие на сетку водородных связей, что приводит к уменьшению энергии взаимодействия. Энергетический проигрыш может быть минимизирован, если молекулы воды каким-то образом организуются вокруг молекулы растворенного вещества. Ценою этому будет проигрыш в энтропии. И свободная энергия переноса неполярной молекулы в воду при комнатной температуре будет определяться большим вкладом энтропии. При растворении неполярных молекул они будут стремиться минимизировать воздействие на сетку водородных связей за счет самоагрегирования. Рис. иллюстрирует силы притяжения между двумя атомами неона в воде. Притяжение возникает как результат эффектов сольватации. Сближение атомов неона вызывается растворителем. Притяжение между двумя атомами неона в газовой фазе характеризуется намного менее глубоким минимумом. На рис. показано, что замена одного из атомов неона на бесконечную гидрофобную стенку, как и следовало ожидать, приводит к еще большему притяжению в воде. Таким образом, можно сделать вывод о том, что гидрофобные взаимодействия обусловливают мицеллообразование.
Из табл. видно, что чем длиннее углеводородная часть молекул ПАВ, тем легче они агрегируют, о чем свидетельствуют более низкие значения ККМ. Гидрофобные взаимодействия могут быть достаточно сильными и являются результатом тонкого баланса энергетического и энтропийного вкладов. В настоящее время принято также считать, что гидрофобные взаимодействия являются главной движущей силой фолдинга молекул белков. Можно привести разные аргументы в пользу того или другого объяснения гидрофобных взаимодействий. Один из способов - допустить сильное когезионное взаимодействие между молекулами воды. Более того, эти взаимодействия чувствительны к ориентации, и любая попытка разрушить структуру приводит к изменению свободной энергии. В каком виде проявляется этот фактор - в энтропийной форме или энергетическом вкладе - это уже вторично. В случае неполярных молекул, например углеводородов, проигрыш в свободной энергии не может быть восполнен взаимодействием с молекулами растворенного вещества.
Простой способ оценки энергии переноса молекулы углеводорода из неполярного окружения в воду задается уравнением
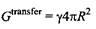
где R - радиус молекулы растворенного вещества. Подобное выражение можно использовать для оценки гидрофобного взаимодействия между двумя контактирующими молекулами неполярных растворенных веществ:
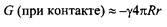
где r - радиус молекулы воды.
Критическая концентрация мицеллообразования алкилсульфатов с различной длиной алкильной цепи.
Снижение KKM происходит вследствие гидрофобных взаимодействий между алкильными цепями
| ПАВ |
ККМ, мМ |
| C8
SO4
" |
160 |
| CioSO4
|
40 |
| Ci2
SO4
" |
10 |
| Ci4
SO4
|
2.5 |
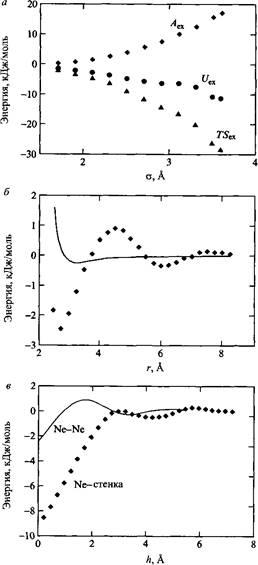
Моделирование гидрофобного эффекта методом Монте-Карло: а - свободная энергия гидратации для леннард-джонсовской частицы в воде. Параметр е принят постоянным и равным 0.62 кДж/моль; параметр у - варьируемая величина. Энтропийный и энергетический вклады показаны отдельно. б - Свободная энергия взаимодействия между двумя атомами неона в воде. Сплошная линия - то же для взаимодействия двух атомов неона в газовой фазе, в - Свободная энергия взаимодействия атома неона с гидрофобной стенкой в воде. Сплошная линия - взаимодействие двух атомов неона в воде. С разрешения AmericanInstituteofPhysics
Полуколичественной мерой способности растворителя растворять неполярные соединения является так называемый параметр Гордона, равный 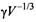 , где г - поверхностное натяжение растворителя, V - его молярный объем. У воды параметр Гордона очень высокий, а у гексана - очень низкий. , где г - поверхностное натяжение растворителя, V - его молярный объем. У воды параметр Гордона очень высокий, а у гексана - очень низкий.
Эти данные подтверждают, что природа гидрофобных взаимодействий заключается в высокой плотности энергии когезии воды. Следует также отметить, что вода - более хороший растворитель, чем предсказывает параметр Гордона. Это означает, что вода до некоторой степени способна компенсировать проигрыш когезионной энергии при растворении неполярного вещества. Кроме того, гидрофобные взаимодействия можно качественно объяснить на основе теории регулярных растворов.
Таким образом, качественно роль гидрофобных взаимодействий при ассоциации поверхностно-активных веществ ясна, но описать эти взаимодействия количественно пока не представляется возможным. В отличие от гидрофобных взаимодействий эффективный потенциал взаимодействия между двумя ионами в растворе точно описывается уравнением.
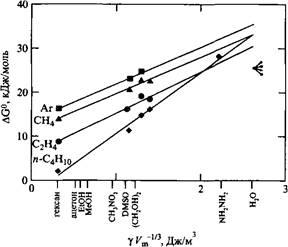
Зависимость свободной энергии переноса неполярного газа в растворители различной природы от параметра Гордона растворителя. Для большинства жидкостей энергия возрастает приблизительно линейно с увеличением параметра Гордона. В то же время для воды обнаружено значительное отклонение от такой зависимости. С разрешения JohnWiley & Sons, Inc.
Растворы, содержащие заряженные частицы обладают особыми физико-химическими свойствами, что обусловлено дальнодействующим электростатическим потенциалом, спадающим с расстоянием г по закону г ~1
. Уже при небольших концентрациях электролита отчетливо проявляется неидеальность раствора. Добавки индифферентной соли сильно влияют на стабильность дисперсных систем, а также на скорости реакций и на кривые титрования. Различные электролиты существенно влияют на состояние ПАВ и полимеров в растворах. Например, введение индифферентного электролита в растворы ионных ПАВ заметно понижает величину KKM.
Таким образом, электростатические эффекты разнообразны и характерны для растворов. К счастью, качественно, а иногда и количественно в них можно разобраться на основе простой теории Дебая-Хюккеля.
Электростатический потенциал связан с распределением заряда уравнением Пуассона-Больцмана:
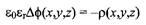
где Д - оператор Лапласа:
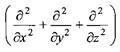
Задача сильно упрощается для сферически симметричных систем, поскольку в этом случае оператор Лапласа выражается соотношением
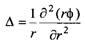
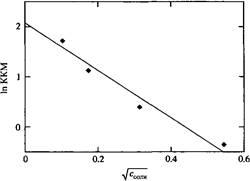
Влияние концентрации соли на ККМ. Прямая линия проведена с максимальным приближением к экспериментальным данным. Теория Дебая-Хюккеля предсказывает линейность между KKM и Соли.
Теперь нужно найти выражение для распределения заряда, отражающее "самораспределение" ионов под действием электростатического потенциала.
Принимая, что распределение ионов вокруг центрального иона, расположенного в начале координат, подчиняется распределению Больцмана:
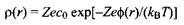
приходим к уравнению Пуассона-Больцмана:
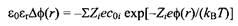
где Z - зарядовое число иона, кв - константа Больцмана, T - температура и coi - концентрации ионов на бесконечном удалении. Это нелинейное уравнение, и его решение обычно сопряжено с большими трудностями. Если для преобразования уравнения воспользоваться разложением экспоненты в ряд, получим более простое уравнение
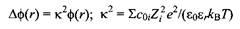
в котором вводится новый параметр - дебаевский радиус экранирования к-1
. Конечное выражение для электростатического потенциала имеет вид:
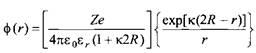
где R - радиус иона. Уравнение имеет уже достаточно простой вид и является очень важным. Из него вытекает, что потенциал вокруг иона в растворе соли не спадает с расстоянием по закону г _1
, а уменьшается как ехр /г. Это означает, что электростатическое взаимодействие имеет гораздо более короткий радиус действия, зависящий от к-1
. В свою очередь параметр к-1
зависит от концентрации соли и от зарядов ионов.
Физический смысл этого вывода заключается в том, что центральный ион притягивает противоположно заряженные ионы и отталкивает ионы одного с ним заряда, создавая таким образом экранирование. Другое важное и тоже простое уравнение получено для избыточного химического потенциала, который, согласно теории Дебая-Хюккеля, имеет следующий вид:

Дебаевский радиус экранирования - очень важная величина, использующаяся для качественных и количественных оценок. Из уравнения следует, что вклад электростатических взаимодействий снижается на расстояниях 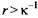 Для водного 1 M раствора 1: 1-валентной соли при комнатной температуре толщина ионной атмосферы равна 3.0 А. Так как к-1
обратно пропорциональна Для водного 1 M раствора 1: 1-валентной соли при комнатной температуре толщина ионной атмосферы равна 3.0 А. Так как к-1
обратно пропорциональна то при концентрации соли 10 мМ к-1
увеличивается до 30 А. Заряд иона также имеет значение. Многозарядные ионы очень эффективно экранируют электростатические взаимодействия. Теория Дебая-Хюккеля прекрасно выполняется для водных растворов 1: 1-валентных солей, но приводит к заниженным оценкам экранирования заряженных агрегатов в присутствии многозарядных противоионов. то при концентрации соли 10 мМ к-1
увеличивается до 30 А. Заряд иона также имеет значение. Многозарядные ионы очень эффективно экранируют электростатические взаимодействия. Теория Дебая-Хюккеля прекрасно выполняется для водных растворов 1: 1-валентных солей, но приводит к заниженным оценкам экранирования заряженных агрегатов в присутствии многозарядных противоионов.
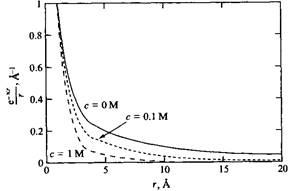
Изменение электростатического потенциала с расстоянием при трех различных концентрациях соли
Дебаевский радиус экранирования для некоторых простых солей в водных растворах при комнатной температуре:
| Электролит |
к"1
, А |
| 1 M NaCl |
3 |
| IOmM NaCl |
30 |
| 100 мкМ NaCl |
300 |
| 1 мМ NaCl |
95 |
| 1 мМ CaCl2
|
55 |
| 1 мМ AlCl3
|
39 |
|