|
Система "человек - окружающая среда" находится в состоянии динамического равновесия, при котором поддерживается экологически сбалансированное состояние природной среды, при котором живые организмы, в том числе человек, взаимодействуют друг с другом и окружающей их абиотической (неживой) средой без нарушения этого равновесия.
В эпоху научно-технической революции возрастающая ролью науки в жизни общества нередко приводит к всевозможным негативным последствиям использования научных достижений в военном деле (химическое оружие, атомное оружие), промышленности (некоторые конструкции атомных реакторов), энергетике (равнинные ГЭС), сельском хозяйстве (засоление почвы, отравление речных стоков), здравоохранении (выпуск лекарств непроверенного действия) и других областях народного хозяйства. Нарушение равновесного состояния между человеком и окружающей его средой может иметь уже в настоящее время глобальные последствия в виде ухудшения среды обитания, разрушения природных экологических систем, изменения генофонда населения. По данным ВОЗ 20-40% здоровья людей зависят от состояния среды, 20-50% - от образа жизни, 15-20% - от генетических факторов.
По глубине реакции окружающей среды различают:
Возмущение, временное и обратимое изменение среды.
Загрязнение, накопление поступающих извне или генерируемых самой средой в результате антропогенного воздействия примесей техногенного характера (веществ, энергии, явлений).
Аномалии, устойчивые, но локальные количественные отклонения среды от состояния равновесия. При длительном антропогенном воздействии могут наступить:
Кризис среды, состояние, при котором параметры ее приближаются к допустимым пределам отклонений.
Разрушение среды, состояние, при котором она становится непригодной для обитания человека или использования в качестве источника природных ресурсов.
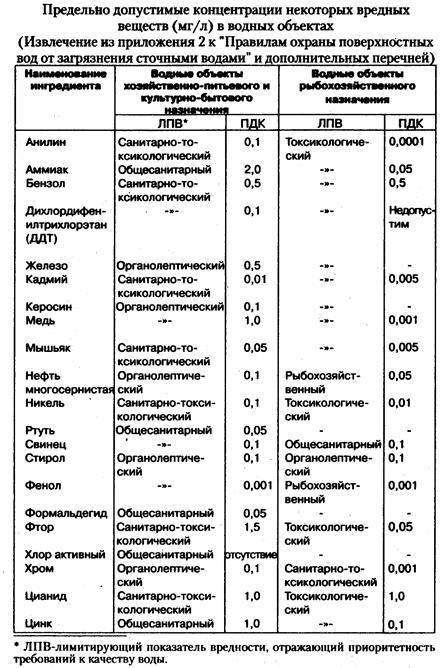
Чтобы предотвратить настолько пагубное действие антропогенного фактора, было введено понятие ПДК (предельно допустимые концентрации веществ) - концентрация веществ, которая не оказывает на человека прямого или косвенного влияния, не снижает работоспособности, не сказывается на здоровье и настроении.
ПДК некоторых загрязняющих веществ в воздухе рабочей зоны



Для оценки токсичности определяют свойства вещества (растворимость в воде, летучесть, рН, температурные и другие константы) и свойства среды, куда оно попало (климатические характеристики, свойства водоема и почвы).
Мониторинг - наблюдение (слежение) за состоянием среды с целью обнаружения изменения этого состояния, их динамики, быстроты и направления. Получаемые в результате длительных наблюдений и многочисленных анализов сводные данные позволяют прогнозировать экологическую обстановку на ряд лет вперед и принимать меры для устранения неблагоприятных воздействий и явлений. Этой работой профессионально занимаются специальные организации - биосферные заповедники, санэпидемстанции, экологические стационары и др.
Отбор пробы воздуха.
Биопроба воздуха может быть относительно небольшой;
В лабораторных условиях биопробу из воздуха формируют в жидком состоянии;
Биопробу отбирают, используя улавливающее устройство: аспиратор для отбора проб, поглотительный прибор Рыхтера с поглотительным раствором. Срок хранения отбираемых проб не более 2 суток;
В замкнутом пространстве пробу воздуха забирают в центре комнаты, на высоте 0,75 и 1,5 м. от пола
Отбор пробы воды.
Пробы отбирают при помощи пипеток, бюреток, мерных колб (демонстрация учащимся).
Отбор пробы жидкости из замкнутого объема проводят после ее тщательного перемешивания.
Отбор биопробы гомогенной жидкости из потока производят через определенные интервалы времени и в разных местах.
Биопробы природной воды для получения достоверных результатов необходимо анализировать в течение 1-2 ч после отбора.
Для отбора биопроб на разной глубине используют специальные пробоотборные устройства - батометры, основной частью которых является цилиндрический сосуд вместимостью 1-3 л, снабженный сверху и снизу крышками. После погружения в жидкость на заданную глубину крышки цилиндра закрывают, и сосуд с пробой поднимают на поверхность.
Отбор пробы твердого вещества.
Биопроба твердых веществ должна быть представительной по отношению к исследуемому материалу (содержать максимально возможное разнообразие в составе исследуемого материала‚ например‚ для контроля качества таблеток целесообразно анализировать не отдельную таблетку‚ а смешивать определенное их количество и отбирать из этой смеси пробу‚ соответствующую средней массе одной таблетки).
При отборе пробы стремятся к возможно большей гомогенизации материала‚ достигаемой механическим способом (растирание‚ размельчение).
Биопробы из твердых биосубстратов преобразуют в жидкофазную биопробу.
Для этого используют специальные технологические приемы: подготовка растворов, взвесей, коллоидов, паст и других жидкообразных сред.
Приготовление водной почвенной вытяжки.
Ход работы: пробу почвы тщательно растереть в ступке. Взять 25 г почвы, перенести в колбу на 200 мл и прилить 50 мл дистиллированной воды. Содержимое колбы тщательно взболтать и дать отстоятся в течение 5-10 мин, а затем после кратковременного взбалтывания отфильтровать в колбу на 100 мл через плотный фильтр. Если фильтрат получился мутный, повторить фильтрование через этот же фильтр до получения прозрачного фильтрата.
Определение показателей‚ характеризующих органолептические свойства воды.
Органолептические свойства нормируются по интенсивности их восприятия человеком. Это запах, привкус, цветность, прозрачность, мутность, температура, примеси (пленка, водные организмы).
Опыт № 1. Определение прозрачности воды.
Реактивы: 3 пробы воды (из разных районов г. Пензы).
Оборудование: 3 мерных цилиндра, пластинка из пластмассы, маркер.
Ход работы. В мерный цилиндр налить разные пробы воды. На дно каждого цилиндра поместить пластинку из белой пластмассы с нанесенными на нее черным несмывающимся крестом. Перед замером воду взболтать. Прозрачность, зависящая от количества взвешенных частиц определяется высотой столба воды в цилиндре (в см), сквозь, который просматривается контур креста.
Определение запаха воды.
Естественные запахи воды связаны с жизнедеятельностью растений и животных или гниением их остатков‚ искусственные запахи с попаданием производственных или сточных вод.
Различают ароматический, болотный, гнилостный, древесный, землистый, плесневелый, рыбный, сероводородный, травянистый и неопределенный запахи.
Силу запаха определяют по 5-бальной системе:
балл - запаха нет или очень слабый (обычно не замечается).
балла - слабый (обнаруживается, если на него обратить внимание).
балла - заметный (легко замечается и может вызвать неодобрительные отзывы о воде).
балла - отчетливый (способный вызвать воздержание от питья).
баллов - очень сильный (настолько сильный, что вода совершенно непригодна для питья).
Определение цветности воды.
Цветность - это природное свойство воды‚ обусловленное наличием гуминовых веществ‚ которые придают ей окраску от желтоватого до коричневого цвета. Гуминовые вещества образуются при разрушении органических соединений в почве‚ вымываются из неё и поступают в открытые водоёмы. Поэтому цветность свойственна воде открытых водоёмов и резко увеличивается в паводковый период.
Реактивы: пробы воды, дистиллированная вода.
Оборудование: 4 химических стакана, лист белой бумаги.
Ход работы: Определение проводится путем сравнения ее с дистиллированной водой. Для этого берут 4 одинаковых химических стакана, заполняют их водой - один дистиллированной, другие - исследуемой. На фоне листа белой бумаги сравнить наблюдаемый цвет: бесцветная, светло-бурая, желтоватая.
Определение показателей‚ характеризующих химический состав и свойства воды.
Такие показатели, как сухой остаток‚ общая жесткость‚ рН‚ щелочность‚ содержание катионов и анионов: Ca2+
, Na+
, HCO3
-
, Cl-
, Mg2+
характеризуют природный состав воды.
Определение плотности воды.
Определение рН (водородного показателя).
На величину рН влияет содержание карбонатов, гидроокисей, солей, подверженных гидролизу, гуминовых веществ и т.п. Данный показатель является индикатором загрязнения открытых водоемов при выпуске в них кислых или щелочных сточных вод. В результате происходящих в воде химических и биологических процессов и потерь углекислоты рН воды может быстро изменяться, и этот показатель следует определять сразу же после отбора пробы, желательно на месте отбора.
Обнаружение органических веществ.
Ход работы: Возьмите 2 пробирки, в одну из них налейте 5 мл дистиллированной воды‚ в другую - исследуемую. В каждую пробирку прибавьте по капле 5% -ного раствора перманганата калия.
Опыт № 7. Обнаружение хлорид-ионов.
Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах. В проточных водоемах содержание хлоридов обычно невелико (20-30 мг/л). Незагрязненные грунтовые воды в местах с несолончаковой почвой обычно содержат до 30-50 мг/л хлориона. В водах, фильтрующихся через солончаковую почву, в 1 л могут содержаться сотни и даже тысячи миллиграммов хлоридов. Вода, содержащая хлориды в концентрации более 350 мг/л, имеет солоноватый привкус, а при концентрации хлоридов 500-1000 мг/л неблагоприятно влияет на желудочную секрецию. Содержание хлоридов является показателем загрязнения подземных и поверхностных водоисточников и сточных вод.
Таблица 2. Определение концентрации хлорид-ионов
| Внешний вид раствора
|
Концентрация ионов Сl -
‚ мг/л
|
| Опалесценция, слабая муть
Сильная муть
Хлопья осаждаются не сразу
Белый объемистый осадок
|
1-10
10-50
50-100
более 100
|
Концентрацию ионов SО2-
4
можно определить, сравнивая полученный результат с данными, содержащимися в таблице 3:
Опыт № 9. Определение ионов железа (II) и железа (III).
Высокое содержание железа ухудшает органолептические свойства воды, делает воду непригодной в масло-сыродельном и текстильном производстве, усиливает размножение железоусваивающих микроорганизмов в водопроводных трубах, что ведет к зарастанию труб. В водопроводной воде содержание железа не должно превышать 0,3 мг/л. В некоторых сточных водах железо встречается в больших количествах, например, в стоках травильных цехов, в сточных водах от крашения тканей и др.
Общая жесткость (Нобщ
) -
это природное свойство воды, обусловленное наличием в ней двухвалентных катионов (главным образом кальция и магния).
Различают общую, карбонатную, постоянную и устранимую жесткость.
Устранимая‚ или временная‚ (Нвр
) и карбонатная (Нк
)
жесткости обусловлены наличием бикарбонатов (и карбонатов) кальция и магния.
Вода с жесткостью свыше 10 мг-экв/л часто имеет неприятный вкус. Резкий переход при пользовании от мягкой к жесткой воде (а иногда и наоборот) может вызвать у людей диспепсические явления.
Течение почечно-каменной болезни ухудшается при использование очень жесткой воды. Жесткие воды способствуют появлению дерматитов. При повышенном поступлении в организм кальция с питьевой водой на фоне йодной недостаточности чаще возникает зобная болезнь.
При кипячении бикарбонаты переходят в малорастворимые карбонаты и выпадают в осадок, что приводит к образованию накипи, а жесткость воды уменьшается. Но кипячение полностью не разрушает бикарбонаты, и часть их остается в растворе. Устранимая (временная) жесткость определяется экспериментально и показывает, насколько уменьшилась жесткость воды за 1 час кипячения. Устранимая жесткость всегда меньше карбонатной. Неустранимая, постоянная (НПОСТ
) и некарбонатная жесткость (ННк
)
обусловлены хлористыми, сернокислыми и другими некарбонатными солями кальция и магния. Эти виды жесткости вычисляют по разности:
Нпост
.
=
Нобщ -
Нвр
; Ннк
= Н
об.
- Нк
Мягкая вода - общая жесткость < 3,5 мг-экв/л.
Вода средней жесткости - общая жесткость от 3,5 до 7 мг-экв/л.
Жесткая вода - общая жесткость от 7 до 10 мг-экв/л.
Очень жесткая вода - общая жесткость > 10 мг-экв/л.
Для питьевых целей предпочитают воду средней жесткости, для хозяйственных и промышленных целей - мягкую воду.
Исходя из этого общая жесткость для воды, не подвергающейся специальной обработке, установлена на уровне 7 мг-экв/л.
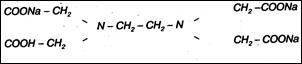
Для определения общей жесткости пользуются трилонометрическим методом. Основным рабочим раствором является трилон Б - двунатриевая соль этилендиаминтетрауксусной кислоты:
Определение суммарного содержания ионов кальция и магния основано на способности трилона Б образовывать с этими ионами прочные комплексные соединения в щелочной среде, замещая свободные ионы водорода на катионы Са2+
и М
g2+
:
Са2+
+
Na2
H2
R →
Na2
CaR + 2Н+,
где R - радикал этилендиаминтетрауксускной кислоты.
В качестве индикатора используется хромоген черный, дающий с Mg2+
соединение винно-красного цвета, при исчезновении М
g2+
он приобретает голубую окраску. Реакция идет при рН-10, что достигается добавлением в пробу аммиачного буферного раствора (NH4
OH+
NH4
CI).
В первую очередь связываются ионы кальция, а затем магния.
Определению мешают ионы меди (>0,002 мг/л), марганца (>0,05 мг/л), железа (>1,0 мг/л), алюминия (>2,0 мг/л).
Вычисление общей жесткости в мг-экв/л производят по формуле:
Нобщ. мг/экв
= n∙ N ∙ 1000/V‚
где:
n - количество трилона Б, израсходованное на титрование, в мл;
V
- объем пробы, в мл;
N
- нормальность трилона Б.
Определение сухого остатка
Сухой остаток - это количество растворенных солей в миллиграммах, содержащееся в 1 л воды.Т. к. масса органических веществ в сухом остатке не превышает 10-15%, сухой остаток дает представление о степени минерализации воды.
Минеральный состав воды на 85% и более обусловлен катионами Са2+
М
g2+
,
Na+
и анионами НСО3
-
,
CI-
,
SO4
2-
Остальная часть минерального состава представлена макроэлементами Na+
,
K+
, РО4
3 -
и др. и микроэлементами Fe2+
, Fe3+
, I - ,
Си2+
,
Mo
и др.
Воду с сухим остатком до 1000 мг/л называют пресной, свыше 1000 мг/л - минерализованной. Вода, содержащая избыточное количество минеральных солей, непригодна для питья, т.к имеет соленый или горько-соленый вкус, а ее употребление (в зависимости от состава солей) приводит к различным неблагополучным физиологическим отклонениям в организме. С другой стороны, слабоминерализованная вода с сухим остатком ниже 50-100 мг/л неприятна на вкус, длительное ее употребление также может привести к некоторым неблагоприятным физиологическим сдвигам в организме (уменьшение содержания хлоридов в тканях и др.). Такая вода, как правило, содержит мало фтора и других микроэлементов.
Слабо минерализованная вода - содержит < 20-100 мг/л солей.
Удовлетворительно минерализованная вода - 100-300 мг/л солей.
Повышенно минерализованная вода - содержит 300-500 мг/л солей.
Определение структуры почвы.
Под структурой почвы понимают способность её распадаться на отдельные частицы, которые называются структурными отдельностями. Они могут иметь различную форму: комки, призмы, пластинки и др.
Неправильное и избыточное внесение минеральных удобрений, способы их хранения являются причиной загрязнения почв и сельхозпродукции. Водорастворимые формы азотных удобрений стекают в пруды, реки, ручьи, достигают грунтовых вод, вызывая повышенное содержание в них нитратов, что неблагоприятно сказывается на здоровье человека.
Очень часто удобрения вносят в почву неочищенными, что является причиной загрязнения почв радиоактивными (например, изотопами калия при использовании калийных удобрений), а также токсическими веществами. Различные формы суперфосфатов, обладая кислой реакцией, способствуют подкислению почвы, что нежелательно для районов, где рН почвы понижена. Избыточное количество фосфорных удобрений, стекая в стоячие и медленно текущие воды, вызывает развитие большого количества водорослей и другой растительности, что ухудшает кислородный режим водоемов и способствует их зарастанию.
Нитраты - неотъемлемая часть всех наземных и водных экосистем, поскольку процесс нитрификации, ведущий к образованию окисленных неорганических соединений азота, носит глобальный характер. В то же время в связи с применением в больших масштабах азотных удобрений поступление неорганических соединений азота в растения возрастает. Избыточное потребление азота удобрений не только ведет к аккумуляции нитратов в растениях, но и способствует загрязнению водоемов и грунтовых вод остатками удобрений, в результате чего территория загрязнения сельхозпродукции нитратами расширяется. Однако накопление нитратов в растениях может происходить не только от переизбытка азотных удобрений, но и при недостатке других их видов (фосфорных, калийных и др.) путем частичной замены недостающих ионов нитрат-ионами при минеральном питании, а также при снижении у ряда растений активности фермента нитратредуктазы, превращающего нитраты в белки.
Ввиду этого наблюдается четкое различие видов и сортов растений по накоплению и содержанию нитратов. Так, накопителями нитратов являются семейства тыквенных, капустных, сельдерейных. Наибольшее их количество содержится в листовых овощах: петрушке, укропе, сельдерее (Приложение 3), наименьшее - в томатах, баклажанах, чесноке, зеленом горошке, винограде, яблоках и др. И между отдельными сортами существуют в этом отношении сильные различия. Так, сорта моркови "Шантэне", "Пионер" отличаются низким содержанием нитратов, а "Нантская", "Лосиноостровская" - высоким. Зимние сорта капусты мало накапливают нитратов по сравнению с летними.
Наибольшее количество нитратов содержится в сосущих и проводящих органах растений - корнях, стеблях, черешках и жилках листьев. У кабачков, огурцов и т.п. плодов нитраты убывают от плодоножки к верхушке (Приложение 4).
В результате употребления продуктов, содержащих повышенное количество нитратов, человек может заболеть метгемоглобинией. При этом заболевании ион NO3
-
взаимодействует с гемоглобином крови, окисляя железо, входящее в гемоглобин, до трехвалентного, а образовавшийся в результате этого метгемоглобин не способен переносить кислород‚ и человек испытывает кислородную недостаточность‚ задыхается при физических нагрузках. В желудочно-кишечном тракте избыточное количество нитратов под действием микрофлоры кишечника превращается в токсичные нитриты, а далее возможно превращение их в нитрозоамины - сильные канцерогенные яды, вызывающие опухоли. В связи с этим при употреблении в пищу растений-накопителей нитратов важно нитраты разбавлять и употреблять в малых дозах. Содержание нитратов можно уменьшить вымачиванием, кипячением продуктов (если отвар не используется), удалением тех частей, которые содержат большое количество нитратов.
Допустимые нормы нитратов (по данным ВОЗ) составляют 5 мг (по нитрат-иону) в сутки на 1 кг массы взрослого человека, т.е. при массе 50-60 кг - это 220-300 мг, а при 60-70 кг - 300-350 мг.
Может также наблюдаться эффект синергизма (усиление) и антагонизма, так как заводы загрязняют биосферу комплексно.
Решение экологических проблем:
1. Изменить технологическую схему производства (прекращение или снижение образования отходов, максимальное выделение промежуточных продуктов и использование их в циклических процессах).
2. Выделить максимальное количество элементов из отходов для других производств.
3. Обезвреживание производственных выбросов.
Методы решения экологических проблем:
Газообразные отходы (гомогенные: оксиды серы и азота, органические вещества в виде газов - и гетерогенные: туман, пыль, аэрозоли).
Источники загрязнения атмосферы.
Атмосфера делится на тропосферу (7-8 км от поверхности земли). Выше - стратосфера - от 8-17 до 50-55 км. Температура воздуха здесь повыше, что связано с наличием здесь озона.
В тропосфере существуют разные формы жизни. Поэтому именно тропосферу относят к биосфере. Загрязнения, попадая в тропосферу, переходят в более высокие слои очень медленно. Основными антропогенными источниками загрязнений являются:
тепловые электростанции, работающие на каменном угле и выбрасывающие в атмосферу сажу, золу и диоксид серы;
металлургические заводы, выбросы которых содержат сажу, пыль, оксид железа, диоксид серы, фториды;
цементные заводы, выделяющие огромное количество пыли;
крупные предприятия по производству продуктов неорганической химии - диоксид серы, фтороводород, оксиды азота, хлор, озон;
заводы по производству целлюлозы, очистке нефти - газообразные отходы (одоранты);
предприятия нефтехимии - служат источником поступления углеводородов и органических соединений других классов, таких, как амины, меркаптаны, сульфиды, альдегиды, кетоны, спирты, кислоты и др.
отработанные газы автомобилей, а также процессы испарения ч
топлива - оксид углерода, газообразные углеводороды и не изменившиеся составные части топлива, высококипящие полициклические ароматические углеводороды и сажа, продукты неполного окисления топлива (например, альдегиды), галогеноуглеводороды, тяжелые металлы и оксиды азота, образованию которых способствуют процессы, происходящие при сгорании топлива;
лесные пожары, в результате которых в воздух выделяется значительное количество углеводородов и оксидов углерода.
В зависимости от источника и механизма образования различают первичные и вторичные загрязнители воздуха.
Первичные загрязнители представляют собой вещества, попадающие в воздух непосредственно из стационарных или подвижных источников,
в то время как вторичные загрязнители образуются в результате взаимодействий в атмосфере первичных загрязнителей между собой
и с присутствующими в воздухе веществами (кислород, озон, аммиак, вода) под действием ультрафиолетового излучения.
Большая часть присутствующих в воздухе твердых частиц и аэрозолей являются вторичными загрязнителями, которые часто оказываются гораздо токсичнее первичных. Выхлопные газы состоят из различных веществ и могут под действием солнечной радиации вступать в атмосфере в фотохимические реакции, приводящие к образованию токсичного смога.
Критериальные загрязнители
(для которых вводятся специальные критерии ПДК) - оксид углерода, диоксид серы, оксиды азота, углеводороды, твердые частицы и фотохимические оксиданты
Один из самых вредных среди загрязнителей воздуха - диоксид серы‚ участвующий в образовании фотохимического смога.
Хотя его концентрация в среднем в воздухе больших городов не столь велика по сравнению с другими компонентами, этот оксид считается наиболее опасным для здоровья горожан, вызывая заболевания органов дыхания, общее ослабление организма. В сочетании с другими загрязнителями ведет к сокращению средней продолжительности жизни.
Но вред, приносимый диоксидом серы, нельзя приписывать непосредственно этому соединению. Главный виновник - триоксид серы SO3
, который образуется в результате реакции: 2SO2
+ O2
= SO3
Действие SO2
сильнее проявляется в темноте, чем на свету. Как вы думаете, с чем это связано?
Всем вам известен оксид СО. Человек, вдыхающий несколько часов воздух с содержанием СО всего в 0,1%, поглощает его столько, что большая часть гемоглобина (60%) связывается с НbСО. Этот процесс сопровождается головной болью и снижением умственной деятельности. При отравлении СО применяются смесь СО2
и О2
(объемная доля первого 3 - 5%), называемую карбогеном. Повышенные концентрации этих газов в смеси позволяют вытеснить угарный газ из тканей в крови.
Высокие локальные концентрации СО, даже кратковременные, вызванные в больших городах главным образом работой автомобильного транспорта, представляют собой так называемые экологические ловушки. Монооксид углерода - бесцветный не имеющий запаха газ, поэтому его трудно обнаружить нашими органами чувств. Однако первые симптомы отравления им (появление головной боли) возникают у человека, находящегося в среде с концентрацией СО 200 - 220 мг/м3
, всего лишь за 2 часа.
Таким образом, человек может оказаться жертвой экологической ловушки. Аналогичному воздействию СО подвергаются курильщики.
Следовые количества химических элементов представлены в атмосфере такими высокотоксичными загрязнителями, как мышьяк, бериллий, кадмий, свинец, магний и хром (обычно присутствуют в воздухе в виде неорганических солей, адсорбированных на твердых частицах). Около 60 металлов присутствуют в продуктах сгорания угля и дымовых газах ТЭС. Ежегодно в воздушный бассейн попадает огромное количество свинца. Очень токсичны металлическая ртуть и свинец, а также их металлоорганические соединения.
Скапливаясь в атмосфере, загрязнители взаимодействуют друг с другом, гидролизуются и окисляются под действием влаги и кислорода, а также изменяют свой состав под воздействием радиации Большую опасность представляют также смеси различных загрязнителей, концентрация отдельных компонентов в которых ниже ПДК. Вместе такие смеси могут представлять значительную угрозу всему живому вследствие кумулятивного эффекта. Велика продолжительность пребывания в воздухе малоактивных соединений - постоянных газов (фреоны и диоксид углерода). Из пестицидов, которые распыляют с самолетов, особенно токсичны фосфорорганические пестициды, при фотолизе которых в атмосфере образуются продукты еще более токсичные, чем исходные соединения.
Так называемые абразивные частицы, к которым относятся диоксид кремния и асбесты, при респираторном проникновении в организм вызывают серьезные заболевания.
Экологический смог - комплексное загрязнение атмосферы, обусловленное застаиванием масс воздуха в крупных городах с развитой промышленностью и большим количеством транспорта. Происхождение этого английского слова ясно из следующей схемы: SMОКЕ+FOG=дым туман.
SMOG.
Смог лондонского типа - сочетание газообразных загрязнителей (в основном сернистого газа), пылевых частиц и тумана. Особенно характерен для загрязненной атмосферы над Лондоном, причем главным источником загрязнения воздуха служат продукты сжигания угля и мазута. В декабре 1952 года в Лондоне во время смога, продолжавшегося около двух недель, погибло свыше 4000 человек. Аналогичные последствия смога отмечались в Лондоне в 1873, 1882, 1891, 1948 годах. Такого типа смог наблюдается лишь в осеннее - зимнее время (с октября по февраль), Ю когда резко ухудшалось самочувствие людей, возрастало число простудных заболеваний и пр.
Смог фотохимический (Лос-Анджелеского типа) - возникает в результате фотохимических реакций при наличии в атмосфере высокой концентрации оксидов азота, углеводородов, озона, интенсивной солнечной радиации и безветрия или очень слабого обмена воздушных масс в приземном слое. В отличие от смога лондонского типа, именно в солнечную погоду при значительных концентрациях выхлопных газов автомобилей в атмосфере обнаружен в 30 - х годах 20 - го века в Лос-Анджелесе, а теперь это нередкое явление в крупных городах мира.
Автомобильные двигатели внутреннего сгорания - главный источник этого комплексного загрязнения. В России автотранспорт ежедневно выбрасывает в атмосферу 16,6 млн. тонн загрязняющих веществ. Особенно тяжелая экологическая ситуация сложилась в Москве, Санкт - Петербурге, Томске, Краснодаре.30% заболеваний горожан непосредственно связаны с загрязненностью воздуха выхлопными газами. Автомобильными двигателями выделяются в воздух городов более 95% оксида углерода, около 65% углеводородов и 30% оксидов азота. Характер выделяемых вредных примесей зависит от типа двигателей, которые подразделяются на бензиновые и дизельные. Основными вредными примесями, содержащимися в выхлопных газах, являются: оксиды азота, оксиды углерода, различные углеводороды, включая и канцерогенный бензпирен, альдегиды, оксиды серы. Бензиновые двигатели, кроме того, выделяют продукты, содержащие свинец, хлор, а дизельные - значительные количества сажи и частичек копоти.
1. Метод рассеивания через трубу.
2. Фильтры.
3. Каталитическая очистка газов:
S-> S02
- > S03 -
>H2
SO 4
NO->N2
СО - > СH4
4. Химические методы очистки:
а) абсорбционные - поглощение газов жидкости при пониженной температуре и повышенном давлении (вода, органические абсорбенты, перманганат калия, раствор поташа, меркаптоэтанол); Ь) адсорбция (активированный уголь, силикогель, циалиты).
Очистка сточных вод химических предприятий.
Гидросфера служит естественным аккумулятором большинства загрязняющих веществ, поступающих в атмосферу или литосферу. Это связано с большой растворяющей способностью воды, с круговоротом воды в природе, а также с тем, что водоемы являются конечным пунктом на пути движения различных сточных вод.
В результате сброса неочищенных сточных вод предприятиями, коммунальными и сельскохозяйственными объектами происходит изменение естественных свойств воды за счет увеличения вредных примесей неорганической и органической природы. К неорганическим примесям
относят тяжелые металлы, кислоты, щелочи, минеральные соли и удобрения с биогенными элементами (азот, фосфор, углерод, кремний). Среди органических примесей
выделяют легко окисляемые (органические вещества сточных вод пищевых предприятий и другие биологически мягкие вещества) и трудноокисляемые и поэтому трудно выводимые из воды (нефть и продукты ее переработки, органические остатки, БАВ, пестициды и др.).
Изменение физических параметров воды возможно в результате попадания в нее примесей трех типов: механических (
твердые нерастворимые частицы: песок, глина, шлак, рудные включения); тепловых (
сброс подогретых вод ТЭС, АЭС и промышленных предприятий); радиоактивных (
продукция предприятий по добыче радиоактивного сырья, обогатительные фабрики, АЭС и т.д.) - Влияние механических и радиоактивных примесей на качество воды понятно, а тепловые примеси могут привести к экзотермическим химическим реакциям компонентов, растворенных или взвешенных в воде, и синтезу еще более опасных веществ.
Изменение свойств воды происходит в результате увеличения количества микроорганизмов, растений и животных из внешних источников: бактерий, водорослей, грибов, червей и др. (сброс бытовых сточных вод и отходов некоторых предприятий). Их жизнедеятельность могут сильно активизировать физические загрязнения (особенно тепловые).
Тепловое загрязнение вызывает интенсификацию процессов жизнедеятельности водных организмов, что нарушает равновесие экосистемы.
Минеральные соли опасны для одноклеточных организмов, обменивающихся с внешней средой осмотически.
Взвешенные частицы уменьшают прозрачность воды, снижают фотосинтез водных растений и аэрацию водной среды, способствуют заилению дна в зонах с малой скоростью течения, оказывают неблагоприятное воздействие на жизнедеятельность водных организмов-фильтраторов. На взвешенных частицах могут сорбироваться различные загрязняющие вещества; оседая на дно, они могут стать источником вторичного загрязнения воды.
Загрязнение вод тяжелыми металлами не только оказывает экологический вред, но и наносит значительный экономический ущерб. Источниками загрязнения воды тяжелыми металлами служат гальванические цехи, предприятия горнодобывающей промышленности, черной и цветной металлургии.
При загрязнении воды нефтепродуктами на поверхности образуется пленка, препятствующая газообмену воды с атмосферой. В ней, а также в эмульсии тяжелых фракций накапливаются другие загрязнители, кроме того сами нефтепродукты аккумулируются в водных организмах. Основными источниками загрязнения вод нефтепродуктами является водный транспорт и поверхностный сток с городских территорий. Загрязнение водной среды биогенными элементами ведет к эвтрофированию водоемов.
Органические вещества-красители, фенолы, ПАВ, диоксины, пестициды и др. создают опасность возникновения токсикологической ситуации в водоеме. Особенно токсичными и устойчивыми в окружающей среде являются диоксины. Это две группы хлорсодержащих органических соединений относящихся к дибензодиоксинам и дибензофуранам. Один из них - 2, 3, 7, 8-тетрахлордибензодиоксин (2, 3, 7, 8 - ТХДД) является самым токсичным соединением, известным науке. Токсическое действие различных диоксинов проявляется одинаково, но отличается по интенсивности. Диоксины накапливаются в окружающей среде и концентрация их растет.
Если условно рассечь водную массу вертикальной плоскостью, можно выделить места различной реакционной способности: поверхностную пленку, основную водную массу и донный осадок.
Донный осадок и поверхностная пленка являются зонами концентрирования загрязняющих веществ. На дно оседают нерастворимые в воде соединения, а осадок является хорошим сорбентом для многих веществ.
В воду могут попадать неразлагаемые загрязняющие вещества. Но они способны реагировать с другими химическими соединениями, образуя устойчивые конечные продукты, которые накапливаются в биологических объектах (планктоне, рыбах и т.д.) и через пищевую цепь попадают в организм человека.
При выборе места отбора пробы воды учитываются все обстоятельства, которые могут оказать влияние на состав взятой пробы.
Различают две основные пробы: разовую и среднюю. Разовую пробу получают путем отбора требуемого объема воды за один раз. Средняя проба получается смешением равных объемов проб, отобранных через равные промежутки времени. Средняя проба тем точнее, чем меньше интервалы между отдельно взятыми составляющими ее пробами.
Воду на анализ отбирают в чистую посуду, предварительно 2-3 раза сполоснув ее исследуемой водой. С открытых водоемов пробы отбирают в фарватере реки с глубины 50 см. Бутыль с грузом опускают на глубину, после чего пробку открывают с помощью прикрепленного к ней держателя. Лучше для этой цели использовать специальные приборы - батометры, которые позволяют применять посуду разной формы и емкости. Батометр состоит из зажима, плотно обхватывающего посуду, и приспособления для открывания пробки на нужной глубине.
При длительном стоянии пробы могут произойти существенные изменения в составе воды, поэтому, если нельзя начать анализ воды сразу после отбора или через 12 часов после отбора, ее консервируют для стабилизации химического состава. Универсального консервирующего средства не существует.
Выделяют 3 группы показателей, определяющих качество воды (подробно и экспериментально разберем на практикуме):
А - показатели, характеризующие органолептические свойства;
Б - показатели, характеризующие химический состав воды;
В - показатели, характеризующие эпидемическую безопасность воды.
Для того, чтобы человек мог использовать воду для питья, её сначала очищают.
Стадии очистки воды:
Отстаивание
Фильтрование
Обеззараживание
Для обеззараживания применяют газы - хлор и озон.
Используют и химико-биологическую очистку воды. Отстойники заселяют хлореллой. Это одноклеточное растение, быстро размножаясь, поглощает из воды СО2
и некоторые вредные вещества. В результате вода очищается, а хлореллу используют в качестве корма для скота.
Подготовка питьевой воды.
Река, озеро или резервуар - отделение крупных примесей - предварительное хлорирование - выпадение хлопьев - осаждение примесей отстаиванием - фильтрование через песок - хлорирование - дополнительная обработка - в городскую систему водоснабжения.
Чтобы выжить, человеку требуется около 1,5 л воды в сутки. Но каждый гражданин ежегодно расходует на бытовые нужды до 600 л воды. Много воды потребляет промышленность.
Например, для выпуска 1 кг бумаги требуется 20 000 л пресной воды. Основной загрязнитель воды - сельское хозяйство. Для повышения урожайности на поле вносят различные удобрения. Это может привести к повышению концентрации различных соединений в продуктах питания и питьевой воде, а это опасно для здоровья. Среди других загрязняющих веществ наиболее заметны нефть и нефтепродукты, попадающие в природные воды при эксплуатации нефтяных танкеров.
По данным ВОЗ 80% от всех инфекционных болезней в мире связано неудовлетворительным качеством питьевой воды и нарушениями санитарно - гигиенических норм водоснабжения. В мире 2 млрд. человек имеют хронические заболевания в связи с использованием загрязненной воды (Приложение 2, таблица 1).
По оценке экспертов ООН, до 80% химических соединений рано или поздно попадают в водоисточники. Ежегодно в мире сбрасывается более 420 км3
сточных вод, которые делают непригодными около 7 тыс. км3
воды. Серьезную опасность для здоровья населения представляет химический состав воды. В природе она никогда не встречается в виде химически чистого соединения. Она постоянно несет в себе большое количество различных элементов и соединений, соотношение которых определяется условиями формирования воды, составом водородных пород.
Методы очистки воды в быту.
Самый простой и доступный для всех метод - отстаивание
водопроводной воды. При этом улетучивается остаточный свободный хлор. Под действием гравитационных сил происходит осаждение относительно крупных суспензионных и коллоидных частиц, находящихся во взвешенном состоянии. Осадок может пожелтеть Как вы думаете, о чем это будет свидетельствовать? (выпадение осадка Fe (OH) 3
).
Кипячение.
Основное предназначение этого метода - обеззараживание воды. В результате термического воздействия гибнут вирусы и бактерии. Кроме того происходит дегазация воды - удаление всех растворенных в ней газов, в том числе и полезных. Каких? (О2
, СО2
). Эти газы улучшают органолептические свойства воды.
Объясните, почему кипяченая вода безвкусна и малополезна для кишечной флоры?
Метод вымораживание
воды.
Используется гораздо реже. Основан на разности температур замерзания чистой воды и рассолов (раствор минеральных солей). Сначала замерзает чистая вода, а в оставшемся объеме концентрируются соли. Существует мнение, что такая вода обладает целебными свойствами за счет особой структуры водных кластеров - групп взаимно ориентированных молекул воды.
Очистка сточных вод
Технология очистки включает несколько этапов.
Таблица 2. Обезвреживание сточных вод.
| Обезвреживаемый продукт
|
ПДК (мг/л)
|
Способ очистки
|
Степень очистки,%
|
| Ароматические органические соединения
|
- -------
|
Адсорбция на угольных фильтрах
|
|
| Ацетон
|
0,1
|
Биохимическое окисление
|
|
| Грубодисперсные примеси
|
10-15
|
Отстаивание
|
70
|
| Железа (III) гидроксид
|
10
|
Фильтрование через слой вспомогательных материалов
|
99
|
| Железа (II) соли
|
0,5
|
Хлорирование
|
99
|
| Нефть
|
0,1
|
Фильтрование через песок. Улавливание в нефтеловушках. Биохимическое окисление.
|
99,9
|
| Сероводород
|
--------
|
Отдувка воздухом из воды
|
80
|
| Фенол
|
0,001
|
Экстракция.
Озонирование.
Биохимическое окисление.
|
|
Сначала сточные воды очищают от нерастворимых примесей. Крупные предметы удаляют фильтрованием (вспомните, что такое фильтрование) воды через решетки и сетки.
Затем вода идет в отстойник, где постепенно оседают мелкие частицы.
Для удаления растворенных органических веществ (NH3
и катионов аммония) их окисляют с помощью бактерий. Процесс протекает более интенсивно в условиях аэрации. Что такое аэробные условия? Аэрация? (насыщение воды кислородом воздуха)
Нитраты превращаются в газообразный азот с использованием особых микроорганизмов. Соединения фосфора осаждают в виде малорастворимого ортофосфата кальция.
Затем проводят:
повторное отстаивание;
поглощение оставшихся примесей активированным углем;
дезинфекция.
Только после этого воду можно возвращать в природные водоемы.
Сброс сточных вод в окружающую среду не прекращается. Почти 1/3 попадает в природные водоемы без какой-либо очистки. Это не только опасно для жизни организмов, но и приводит к ухудшению качества питьевой воды. Предотвращение загрязнения воды остается одной из самых важных задач охраны окружающей среды и сохранение здоровья людей.
1. Фильтрование.
2. Отстаивание и фильтрование.
3. Флотация.
4. Дистилляция.
5. Ионный обмен.
6. Биохимические (для нефти).
7. Микроорганизмы для вод с повышенным содержанием азота, фосфора и ПАВ.
8. Создание водооборотных циклов.
Заболевания, возникающие при токсическом воздействии химических элементов и субстанций находящихся в питьевой воде
Таблица 1.
| Болезнь
|
Возбуждающий фактор
|
| Анемия
|
Мышьяк, бор, фтор, медь, цианиды, трихлорэтен.
|
| Заболевания пищеварительного тракта
а) повреждения
б) боли в желудке
в) функциональные расстройства
|
Мышьяк, бериллий, бор, хлороформ, динитрофенолы.
Ртуть, пестициды
Цинк
|
| Болезни сердца:
а) повреждение сердечной мышцы
б) нарушение функционирования сердца
в) сердечно - сосудистые изменения
г) трахикардия
д) тахикордия
|
Бор, цинк, фтор, медь, свинец, ртуть
Бензол, хлороформ, цианиды
Трихлорэтилен
Галоформы, трипалометаны, альдрин (инсектицид) и его производные
Динитрофенолы
|
| Облысение
|
Бор, ртуть
|
| Цирроз печени
|
Хлор, магний, бензол, хлороформ, тяжелые металлы.
|
| Злокачественные опухоли почек
|
Мышьяк, галоформы
|
| Злокачественные опухоли легких
|
Мышьяк, бензопирен
|
| Злокачественные опухоли кожи
|
Мышьяк, бензопирен, продукты дистилляции нефти (масла)
|
| Уремия
|
Мышьяк, свинец, ртуть
|
| Бронхиальная астма
|
Фтор
|
| Лейкемия
|
Хлорированные фенолы, бензол.
|
Твердые отходы (непрореагировавшее сырье, фильтры и катализаторы).
1. Извлечение полезных компонентов путем экстракции (благородные металлы из отработанных катализаторов).
2. Термические методы.
3. Санитарные засыпки.
4. Закапывание в океане.
В XIX и XX столетиях взаимодействие человека с окружающей средой или антропогенная деятельность реализуется в форме крупномасштабного материального производства.
|