1. Характеристика курсу
Дистанційний курс “Термодинаміка та теплотехніка ”
Загальна кількість кредитів: національних 2
ECTS 3,5
Лекційне навантаження 32 год.
Лабораторне навантаження 16 год
Практичне навантаження (кількість годин навчального навантаження необхідно узгоджувати з інструктором курсу)
Автор та інструктори курсу – Стадник Ігор Ярославович, кандидат технічних наук, доцент, доцент кафедри обладнання харчових технологій.
Курс дистанційного навчання призначений для студентів напрямів
6.0925 "Автоматизація та комюторно-інтегрована техніка",
Стислий зміст дистанційного курсу
Мета дисципліни - Ціллю вивчення дисципліни являється одержання знань і вмінь, необхідних для розуміння і розрахунків теплових процесів, аналіз основних термодинамічних процесів,вивчення загальних закономірностей теплообміну і шляхів інтенсифікації, вивчення методів оцінки енерготехнолопчних система різних галузях промисловості
Основні задачі дисципліни стосовно освіти бакалавра можна сформулювати таким чином:
Одержати навики в експериментальному рішенні практичних задач по розповсюдженню при зварюванні плавленням теплоти, що виділяється при утворенні зварного з'єднання, проведенні вимірювань та користування сучасним математичним апаратом.
Дисципліна Термодинаміка і теплові процеси при зварюванні" являється базовою в підготовці інженерів-механіків по спеціальності "Технологія та устаткування зварювання, прилягає до курсу "Теорія зварювальних процесів'' і являється його складовою частиною.
2. Структура дистанційного курсу
- характеристика курсу
- методичні рекомендації щодо роботи з курсом
- робоча навчальна програма з потижневим плануванням
- навчальні модулі курсу
Mодуль 1. Характеристичні функції та диференційні рівняння термодинаміки
Тема 1.1. Основи технічної термодинаміки. Значення теплоенергетики в народному господарстві Мета і завдання курсу Основні визначення технічної термодинаміки Робоче тіло і параметри стану.
Тема 1.2 Основні закони ідеальних газіві газових сумішей. Рівняння стану ідеального газу Газові суміші Способи задання складу газових сумішей Парціальний тиск і об'єм Закон Дальтона Теплоємність газів і газових сумішей Фізична суть теплоємності, масова, об'ємна і мольна теплоємності Ізохорна і ізобарна теплоємності Залежність теплоємності від температури
Тема 1.3 Реальні гази Властивості водяної пари. Рівняння стану реального газу Ван-дер-Ваальса, рівняння Вукаловичаї Новикова Властивості і характеристики водяної пари, р-t діаграма Зображення процесу пароутворення в р-v, Т - s , h-s діаграмах
Тема 1.4 Термодинамічні властивості вологого повітря. Абсолютна і відносна вологість Вологовміст повітря Співвідношення між основними характеристиками р-s діаграма водяної пари у вологому повітрі h-d діаграма вологого повітря Термодинамічні процеси у вологому повітрі Визначення параметрів вологого повітря Визначення параметрів вологого повітря по Н-d діаграмі
Тема 1.5 Перший закон термодинаміки, процеси в ідеальному газі. Внутрішня енергія газу як функція стану Термодинамічна робота стиснення і розширення Роботазмінитиску Зміна внутрішньої енергії Формулювання і математичний зміст першого закону термодинаміки, його фізична суть Дослідження термодинамічних процесів на основі першого закону термодинаміки Зображення процесів_р-v, Т - s, і h-s координатах
Тема 1.6 Другий закон термодинаміки. Умови перетворення теплоти в роботу Фізична суть П-го закону термодинаміки Формулювання основних принципів побудови теплового двигуна Цикл Карно в р-v, Т - s координатах Термічний ккд циклу Теорема Карно Математичний зміст II-го закону термодинаміки Принцип зростання ентропії в необоротних процесах Закон Гюі-Стодоли
Тема 1.7 Витікання газів і водяної пари. Перший закон термодинаміки для потоку газу, або пари Зміна кінетичної енергії пари при витіканні Швидкість газу навиході із сопла, витрата газу через сопло Критична швидкість витікання і масовий розхід Витікання через сопла
Тема 1.8. Дроселювання газів і водяної пари. Характеристика процесу дроселювання Дроселювання реальних газів Диференціальний і інтегральний дросель ефект Температура і точка інверсії Практичне використання процесів дроселювання Розрахунок процесів дроселювання водяної пари з використанням Н-s діаграми
Лабораторне заняття №1. Ознайомлення з лабораторією, розприділення лабораторних робіт по підгрупах, проведення інструктажу з техніки безпеки.
Лабораторне заняття №2. Дослідження процесів вологого повітря Лабораторне заняття №3. Дослідження процессу адіабатного витікання газу (повітря) через сопло
Mодуль 2 Термодинаміка та теплопередача.
Тема 2.1. Теорія теплообміну . Теплопровідність Закон Фур'є Коефіцієнт теплопровідності Диференційне рівняння теплопровідності, умови однозначності Теплопровідність плоскої і циліндричної стінок Теплопровідність тіл із внутрішнім джерелом те плоти Нестаціонарна тепло провідність
Тема 2.2 Теплопередача. Рівняння теплопередачі Визначення коефіцієнта теплопередачі для плоскої і циліндричної стінки Критичний діаметр теплопередачі Шляхи інтенсифікації теплопередачі Типи теплообмінників Основи розрахунку теплообмінників
Тема 2.3. Конвективний теплообмін. Закон Ньютона-Ріхмана, коефіцієнт тепловіддачі Теорія подібності явищ Теореми подібності Критерії подібності Критеріальні рівняння вільної і вимушеної конвекції. Променистийтеплооомін. Закони променистого теплообміну тіл Теплообмін між тілами розділеними прозорим середовищем Теплообмін випромінюванням прн наявності екрану
Лабораторне заняття №4. Дослідження теплообмінного апарату
Лабораторне заняття №5 Тепловіддача горизонтальної труби при вільному русі повітря
Mодуль 3 Інженерне забезпечення підприємства.
Тема 3.1. Парові котли і котельні агрегати, його схеми і елементи.
Тема 3.2.Паливо і процеси горіння палива .Характеристика палива, способи надання робочого складу палива Основні положення теорії горіння палива Особливості горіння палива різних видів Витрати повітря на процес горіння Загальна кількість продуктів згорання Визначення ентальпії продуктів згорання і температури горіння
Тема 3.3. Цикли двигунів внутрішнього згорання.
Тема 3.4.Термодинамічні цикли паросилових установок. Цикл Ренкіна для ПСУ Схема циклу Ренкінаї зображення и в р-v і Т—s координатах Визначення основних процесів циклу Ренкіна Термічний ккд циклу Методи підвищення термічного ккд циклу Цикл з вторинним перегрівом пари, регенераційний, теплофікаційний цикли ПСУ
Тема 3.5. Ідеальні циклитеплових машин. Схема ГТУ і зображення циклу ГТУ в_р-уі Т—s координатах Основні процеси циклу ГТУ «відкритого» типу Термічнийккд циклу ГГУ Переваги і недоліки ГТУ «відкритого» типу, и практичне використання Схема поршневого одноступеневого компресора Зображення процесів стиснення в р-v і Т—s координатах Визначення роботи стиснення в різних процесах
Лабораторне заняття №6. Вимірювання температур термопарами.
Лабораторне заняття №7 Визначення коефіцієнта теплопровідності твердих тіл
Лабораторне заняття №8 Захист лабораторних робіт
- КОМПЮ’ТЕРНЕ ТЕСТУВАННЯ (включає модульні та підсумковий тест)
- ВИМОГИ ТА МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО АТЕСТАЦІЇ
- ГЛОСАРІЙ (термінологічний словник)
- СПИСОК ЛІТЕРАТУРИ
М.Михеев, И.Михеева. Краткий курс теплопередач и, 1961.
А. Баскаров й др. Общая теплотехника, 1963.
Н.Кираковский, М.Недужий. Лабораторний практикум по курсу общей теплотехники, 1966.
Є.Міговк та В.Єресько, Лабораторні роботи з загальної теплотехніки, 1960.
Конспект лекцій
Методичні вказівки до лабораторних робіт
3. Методичні вказівки для роботи з курсом
Інструктор вітає Вас нас сторінці курсу дистанційного навчання „Термодинаміка та теплотехніка”.
Контакта інформація інструктора:
кафедра ОХ( корпус 2, ауд. 30). Робочий телефон – 25-17-89.
e-mail [email protected]
Вивчення дисципліни допоможе знаходити оптимальні технологічні, інженерні, проектно-конструкторські рішення, виходячи з енерго- та ресурсозбереження, прогнозувати і оцінювати можливі негативні наслідки діючих виробничих підприємств і тих що проектуються, вчасно виявляти і коректувати недосконалі технологічні процеси, які завдають збитків навколишньому середовищу і загрожують здоров‘ю населення.
Коротка інструкція щодо роботи із курсом
Матеріал курсу розбито на окремі модулі в межах однієї загальної теми.
Для успішної роботи із курсом дистанційного навчання студент повинен якісно опрацювати в межах кожного із змістовних модулів лекційний матеріал, виконати завдання, запропоновані у лабораторних роботах, підготувати реферати на семінари та здати тестування після кожного із модулів, наведених у робочій програмі. Виконані лабораторні роботи студент надсилає інструктору через електронну пошту. Так само студента буде повідомлено про результати. Лабораторні роботи потрібно виконувати від першої до останньої (згідно матеріалу відповідних лекцій та методичних вказівок), в порядку їх представлення в структурі курсу. Необхідні дані для виконання робіт береться додатково і інструктора, тобто параметри, основні складові для розв’язання поставленої мети. Після здачі матеріалу першого модуля студент допускається до опрацювання наступного.
Остаточне вивчення курсу закінчується здачею завершального тесту, за результатами якого студент має можливість отримати залікову оцінку.
Вся необхідна інформація щодо роботи зібрана у відповідних розділах дистанційного курсу:
–робоча програма з потижневим плануванням,
–лекційний матеріал,
–лабораторні роботи,
–список необхідної літератури,
–термінологічний словник.
Для кращого засвоєння матеріалу курсу рекомендується використовувати інформацію з мережі Internet.
Порядок та графік консультацій
Консультації за окремими розділами курсу проводяться згідно встановленого графіка. Студент має можливість змінити час консультації, попередньо узгодивши це з інструктором через електронну пошту.
Після успішного завершення навчання за матеріалами курсу, студент повинен знати:
основні величини, які характеризують термодинамічний стан системи, їх фізичну суть, співвідношення між ними,
закони термодинаміки,
властивості ідеальних газів і газових сумішей,
основні термодинамічні процеси ідеальних газів,
властивості реальних газів,
особливості термодинамічних процесів для реальних газів,
принцип побудови діаграм для водяної пари і вологого повітря,
-закономірності витікання і дроселювання газів і пари,
теоретичні цикли паросилових установок, двигунів внутрішнього згорання,
- види теплообміну втехнолопчних системах, закони теплообміну, шляхи інтенсифікації теплообміну,
методи оцінки еф ективності енерготехнолопчних систем
Мета самостійної роботи – навчити студентів самостійно працювати з літературою, технічною інформацією, вміти виконувати розрахунки стосовно термодинамічних процесів, у стислій формі(реферат) викласти ті чи інші положення удосконалення механізму управління тепловими процесами, виходячи із змісту теми.
Інструкцію „Як готуватися до екзамену”
Підготовка до екзамену включає поглиблене вивчення тем змістовних модулів, виконання самостійних завдань в процесі підготовки до лабораторних робіт, а також опрацювання тестових завдань при захисті робіт та здачі модульного контролю.
4. Робоча навчальна програма з потижневим плануванням
НАВЧАЛЬНІ МОДУЛІ КУРСУ
Титульний лист
Розподіл навчального часу та зміст модулів дисципліни (1,2,3)
Потижневий розклад дистанційного курсу
Вимоги до атестації
5. Потижневий розклад дистанційного курсу навчання
| Тиждень/Дата |
Діяльність студента |
| Завдання на 1 тиждень |
Тема 1.1. Основи технічної термодинаміки. Значення теплоенергетики в народному господарстві Мета і завдання курсу Основні визначення технічної термодинаміки Робоче тіло і параметри стану.
Тема 1.2 Основні закони ідеальних газіві газових сумішей. Рівняння стану ідеального газу Газові суміші Способи задання складу газових сумішей Парціальний тиск і об'єм Закон Дальтона Теплоємність газів і газових сумішей Фізична суть теплоємності, масова, об'ємна і мольна теплоємності Ізохорна і ізобарна теплоємності Залежність теплоємності від температури
Тема 1.3 Реальні гази Властивості водяної пари. Рівняння стану реального газу Ван-дер-Ваальса, рівняння Вукаловичаї Новикова Властивості і характеристики водяної пари, р-t діаграма Зображення процесу пароутворення в р-v, Т - s , h-s діаграмах
Тема 1.4 Термодинамічні властивості вологого повітря. Абсолютна і відносна вологість Вологовміст повітря Співвідношення між основними характеристиками р-s діаграма водяної пари у вологому повітрі h-d діаграма вологого повітря Термодинамічні процеси у вологому повітрі Визначення параметрів вологого повітря Визначення параметрів вологого повітря по Н-d діаграмі
|
| Понеділок |
1. Отримання доступу до навчальних матеріалів
2.Ознайомлення зі структурою курсу та методикою роботи з ним.
3. Підбір навчальної літератури
|
| Вівторок |
Тема 1.1. Основи технічної термодинаміки. Значення теплоенергетики в народному господарстві Мета і завдання курсу Основні визначення технічної термодинаміки Робоче тіло і параметри стану. |
| Середа |
Тема 1.2 Основні закони ідеальних газіві газових сумішей. Рівняння стану ідеального газу Газові суміші Способи задання складу газових сумішей Парціальний тиск і об'єм Закон Дальтона Теплоємність газів і газових сумішей Фізична суть теплоємності, масова, об'ємна і мольна теплоємності Ізохорна і ізобарна теплоємності Залежність теплоємності від температури. |
| Четвер |
Тема 1.3 Реальні гази Властивості водяної пари. Рівняння стану реального газу Ван-дер-Ваальса, рівняння Вукаловичаї Новикова Властивості і характеристики водяної пари, р-t діаграма Зображення процесу пароутворення в р-v, Т - s , h-s діаграмах |
| П’ятниця |
Тема 1.4 Термодинамічні властивості вологого повітря. Абсолютна і відносна вологість Вологовміст повітря Співвідношення між основними характеристиками р-s діаграма водяної пари у вологому повітрі h-d діаграма вологого повітря Термодинамічні процеси у вологому повітрі Визначення параметрів вологого повітря Визначення параметрів вологого повітря по Н-d діаграмі |
| Завдання на 2 тиждень |
Тема 1.5 Перший закон термодинаміки, процеси в ідеальному газі. Внутрішня енергія газу як функція стану Термодинамічна робота стиснення і розширення Роботазмінитиску Зміна внутрішньої енергії Формулювання і математичний зміст першого закону термодинаміки, його фізична суть Дослідження термодинамічних процесів на основі першого закону термодинаміки Зображення процесів_р-v, Т - s, і h-s координатах
Тема 1.6 Другий закон термодинаміки. Умови перетворення теплоти в роботу Фізична суть П-го закону термодинаміки Формулювання основних принципів побудови теплового двигуна Цикл Карно в р-v, Т - s координатах Термічний ккд циклу Теорема Карно Математичний зміст II-го закону термодинаміки Принцип зростання ентропії в необоротних процесах Закон Гюі-Стодоли
Тема 1.7 Витікання газів і водяної пари. Перший закон термодинаміки для потоку газу, або пари Зміна кінетичної енергії пари при витіканні Швидкість газу навиході із сопла, витрата газу через сопло Критична швидкість витікання і масовий розхід Витікання через сопла
Тема 1.8. Дроселювання газів і водяної пари. Характеристика процесу дроселювання Дроселювання реальних газів Диференціальний і інтегральний дросель ефект Температура і точка інверсії Практичне використання процесів дроселювання Розрахунок процесів дроселювання водяної пари з використанням Н-s діаграми
Лабораторне заняття №1. Ознайомлення з лабораторією, розприділення лабораторних робіт по підгрупах, проведення інструктажу з техніки безпеки.
Лабораторне заняття №2. Дослідження процесів вологого повітря
|
| Понеділок |
Тема 1.5 Перший закон термодинаміки, процеси в ідеальному газі. Внутрішня енергія газу як функція стану Термодинамічна робота стиснення і розширення Роботазмінитиску Зміна внутрішньої енергії Формулювання і математичний зміст першого закону термодинаміки, його фізична суть Дослідження термодинамічних процесів на основі першого закону термодинаміки Зображення процесів_р-v, Т - s, і h-s координатах |
| Вівторок |
Тема 1.6 Другий закон термодинаміки. Умови перетворення теплоти в роботу Фізична суть П-го закону термодинаміки Формулювання основних принципів побудови теплового двигуна Цикл Карно в р-v, Т - s координатах Термічний ккд циклу Теорема Карно Математичний зміст II-го закону термодинаміки Принцип зростання ентропії в необоротних процесах Закон Гюі-Стодоли |
| Середа |
Лабораторне заняття №1. Ознайомлення з лабораторією, розприділення лабораторних робіт по підгрупах, проведення інструктажу з техніки безпеки.
Лабораторне заняття №2. Дослідження процесів вологого повітря.
|
| Четвер |
Тема 1.7 Витікання газів і водяної пари. Перший закон термодинаміки для потоку газу, або пари Зміна кінетичної енергії пари при витіканні Швидкість газу навиході із сопла, витрата газу через сопло Критична швидкість витікання і масовий розхід Витікання через сопла. |
| П’ятниця |
Тема 1.8. Дроселювання газів і водяної пари. Характеристика процесу дроселювання Дроселювання реальних газів Диференціальний і інтегральний дросель ефект Температура і точка інверсії Практичне використання процесів дроселювання Розрахунок процесів дроселювання водяної пари з використанням Н-s діаграми. |
| Завдання на 3 тиждень |
Тема 2.1. Теорія теплообміну . Теплопровідність Закон Фур'є Коефіцієнт теплопровідності Диференційне рівняння теплопровідності, умови однозначності Теплопровідність плоскої і циліндричної стінок Теплопровідність тіл із внутрішнім джерелом те плоти Нестаціонарна тепло провідність
Тема 2.2 Теплопередача. Рівняння теплопередачі Визначення коефіцієнта теплопередачі для плоскої і циліндричної стінки Критичний діаметр теплопередачі Шляхи інтенсифікації теплопередачі Типи теплообмінників Основи розрахунку теплообмінників
Тема 2.3. Конвективний теплообмін. Закон Ньютона-Ріхмана, коефіцієнт тепловіддачі Теорія подібності явищ Теореми подібності Критерії подібності Критеріальні рівняння вільної і вимушеної конвекції. Променистийтеплооомін. Закони променистого теплообміну тіл Теплообмін між тілами розділеними прозорим середовищем Теплообмін випромінюванням прн наявності екрану
Лабораторне заняття №3. Дослідження процессу адіабатного витікання газу (повітря) через сопло
Лабораторне заняття №4. Дослідження теплообмінного апарату
Лабораторне заняття №5 Тепловіддача горизонтальної труби при вільному русі повітря Повторення матеріалу. Захист лабораторних робіт по контрольних запитаннях. Здача модуля №1 по тестах
|
| Понеділок |
Лабораторне заняття №3. Дослідження процессу адіабатного витікання газу (повітря) через сопло Повторення матеріалу. Захист лабораторних робіт по контрольних запитаннях. Здача модуля №1 по тестах |
| Вівторок |
Тема 2.1. Теорія теплообміну . Теплопровідність Закон Фур'є Коефіцієнт теплопровідності Диференційне рівняння теплопровідності, умови однозначності Теплопровідність плоскої і циліндричної стінок Теплопровідність тіл із внутрішнім джерелом те плоти Нестаціонарна тепло провідність |
| Середа |
Тема 2.2 Теплопередача. Рівняння теплопередачі Визначення коефіцієнта теплопередачі для плоскої і циліндричної стінки Критичний діаметр теплопередачі Шляхи інтенсифікації теплопередачі Типи теплообмінників Основи розрахунку теплообмінників. |
| Четвер |
Тема 2.3. Конвективний теплообмін. Закон Ньютона-Ріхмана, коефіцієнт тепловіддачі Теорія подібності явищ Теореми подібності Критерії подібності Критеріальні рівняння вільної і вимушеної конвекції. Променистийтеплооомін. Закони променистого теплообміну тіл Теплообмін між тілами розділеними прозорим середовищем Теплообмін випромінюванням прн наявності екрану. |
| П’ятниця |
Лабораторне заняття №4. Дослідження теплообмінного апарату
Лабораторне заняття №5 Тепловіддача горизонтальної труби при вільному русі повітря.
|
| Завдання на 4 тиждень |
Тема 3.1. Парові котли і котельні агрегати, його схеми і елементи.
Тема 3.2.Паливо і процеси горіння палива .Характеристика палива, способи надання робочого складу палива Основні положення теорії горіння палива Особливості горіння палива різних видів Витрати повітря на процес горіння Загальна кількість продуктів згорання Визначення ентальпії продуктів згорання і температури горіння
Тема 3.3. Цикли двигунів внутрішнього згорання.
Лабораторне заняття №6. Вимірювання температур термопарами.
Повторення матеріалу. Захист лабораторних робіт по контрольних запитаннях. Здача модуля №2 по тестах
|
| Понеділок |
Повторення матеріалу. Захист лабораторних робіт по контрольних запитаннях. Здача модуля №2 по тестах |
| Вівторок |
Тема 3.1. Парові котли і котельні агрегати, його схеми і елементи. . |
| Середа |
Тема 3.2.Паливо і процеси горіння палива .Характеристика палива, способи надання робочого складу палива Основні положення теорії горіння палива Особливості горіння палива різних видів Витрати повітря на процес горіння Загальна кількість продуктів згорання Визначення ентальпії продуктів згорання і температури горіння |
| Четвер |
Тема 3.3. Цикли двигунів внутрішнього згорання.. |
| П’ятниця |
Лабораторне заняття №6. Вимірювання температур термопарами |
| Завдання на 5 тиждень |
Тема 3.4.Термодинамічні цикли паросилових установок. Цикл Ренкіна для ПСУ Схема циклу Ренкінаї зображення и в р-v і Т—s координатах Визначення основних процесів циклу Ренкіна Термічний ккд циклу Методи підвищення термічного ккд циклу Цикл з вторинним перегрівом пари, регенераційний, теплофікаційний цикли ПСУ
Тема 3.5. Ідеальні циклитеплових машин. Схема ГТУ і зображення циклу ГТУ в_р-уі Т—s координатах Основні процеси циклу ГТУ «відкритого» типу Термічнийккд циклу ГГУ Переваги і недоліки ГТУ «відкритого» типу, и практичне використання Схема поршневого одноступеневого компресора Зображення процесів стиснення в р-v і Т—s координатах Визначення роботи стиснення в різних процесах
Лабораторне заняття №7 Визначення коефіцієнта теплопровідності твердих тіл
Лабораторне заняття №8 Захист лабораторних робіт
Повторення матеріалу. Захист лабораторних робіт по контрольних запитаннях. Здача модуля №3 по тестах
|
| Понеділок |
Тема 3.5. Ідеальні циклитеплових машин. Схема ГТУ і зображення циклу ГТУ в_р-уі Т—s координатах Основні процеси циклу ГТУ «відкритого» типу Термічнийккд циклу ГГУ Переваги і недоліки ГТУ «відкритого» типу, и практичне використання Схема поршневого одноступеневого компресора Зображення процесів стиснення в р-v і Т—s координатах Визначення роботи стиснення в різних процесах |
| Вівторок |
Тема 3.4. Підготовка води для живлення котлів. Термохімічне водопом’якшення. Міри боротьби з утворенням накипів в котельнях низького тиску. |
| Середа |
Лабораторне заняття №7 Визначення коефіцієнта теплопровідності твердих тіл
Лабораторне заняття №8 Захист лабораторних робіт
|
| Четвер |
Повторення матеріалу. Захист лабораторних робіт по контрольних запитаннях. Здача модуля №3 по тестах. |
| Складання підсумкового залікового тесту з курсу (під час залікової сесії з _____ до ______) |
Оцінювання. При вивченні курсу «Термодинаміка та теплотехніка» використовується 100-бальна шкала; методи оцінювання: поточне опитування (з допомогою on-line чату чи off-line форуму); тестування за матеріалами кожного модуля; оцінювання виконання індивідуальних завдань та лабораторних робіт; після вивчення всього курсу – підсумкове залікове тестування.
6. Рейтингова система оцінювання навчальних досягнень студента
Модуль 1 ( 25 балів)
Лабораторні заняття ( по 5 балів=10)
Модульний тестовий контроль №1 ( 15 балів)
Модуль 2 ( 25 балів)
Лабораторні заняття ( по 5 балів=10)
Модульний тестовий контроль №2 ( 15 балів)
Модуль 3 ( 25 балів)
Лабораторні заняття ( по 5 балів=10)
Модульний тестовий контроль №3 (15 балів)
Підсумковий тестовий контроль ( 25 балів)
7. Вимоги та методичні рекомендації щодо атестації студентів
Для успішного засвоєння матеріалу курсу і, як наслідок, здачі екзамену у вигляді завершального тестування студент повинен дати мінімум 2/3 правильних відповідей на тести, які бдуть проводитися після опрацювання матеріалу кожного змістовного модуля.
Оцінювання. При вивченні курсу «Термодинаміка та теплотехніка» використовується 100-бальна шкала; методи оцінювання: поточне опитування (з допомогою on-line чату чи off-line форуму); тестування за матеріалами кожного модуля; оцінювання виконання індивідуальних завдань та лабораторних робіт; після вивчення всього курсу – підсумкове залікове тестування.
| Оцінка за шкалою ВНЗ |
Оцінка за національною шкалою |
Оцінка за шкалою ECTS |
| 90-100 |
Відмінно |
А |
| 82-89 |
Добре |
В |
| 75-81 |
Добре |
С |
| 67-74 |
Задовільно |
D |
| 60-66 |
Задовільно |
Е |
| 35-59 |
Незадовільно |
FX |
| 1-34 |
Незадовільно |
F |
8. Перелік рекомендованої літератури
1. М.Михеев, И.Михеева. Краткий курс теплопередачи, 1961.
2. Баскаров й др. Общая теплотехника, 1963.
3. Н.Кираковский, М.Недужий. Лабораторний практикум по курсу общей теплотехники, 1966.
4. Є.Міговк та В.Єресько, Лабораторні роботи з загальної теплотехніки, 1960.
5. Конспект лекцій
6. Методичні вказівки до лабораторних робіт
Передмова
Посібник “Теоретичні основи теплотехніки” складений в об'ємі лекційного курсу (36 годин) по однойменній дисципліні для студентів напрямку "Інженерна механіка". Посібник складений у відповідності анотації до навчалшої програми.
В посібнику висвітлені основні питання технічної термодинаміки і теорії теплообміну, які забезпечують подальше засвоєння спеціальних дисциплін, враховуючи низку спеціальностей за напрямком “інженерна механіка” а також загальнотехнічну підготовку спеціалістів.
1. Основні положення термодинаміки
1.1 Загальні поняття
Теплотехніка, як наука вивчає методи використання хімічної енергії палива, закони перетворення цієї енергії в теплову, речовини, які приймають участь в цих перетвореннях, а також принципи роботи і конструкції машин і апаратів, які служать для перетворення хімічної енергії в теплову і механічну.
Курс 'Теоретичні основи теплотехніки'' складається із двох розділів: технічна термодинаміка і теорія теплообміну.
Технічна термодинаміка є феноменологічною теорією макроскопічних процесів, які супроводжуються перетворенням енергії.
Першою роботою, яка положила початок розвитку термодинаміки була робота С.Карно. "Роздуми про рушійну силу вогню і про машини, які можуть розвивати цю силу".
Карно поставив питання: "чи обмежена рухома сила теплоти чи вона не має границь; чи має межу можливе удосконалення машини, межу, яку неможливо перейти по самій природі речей ніяким чином, або ж навпаки ці покращення можуть бути безмежно продовженими."
Термодинаміка вивчає властивості тіл не опираючись на будь-які представлення про їх структуру. Вона не розглядає механізм явищ, не цікавиться внутрішньою будовою тіл. Вона досліджує явища які безпосередньо спостерігаються на практиці і проходять з тілами, масштаби яких звичні для людини. Вона оперує тільки з такими величинами, які можуть бути безпосередньо виміряні, або вивчені за допомогою інших залежностей.
Термодинамічною системою називається сукупність матеріальних тіл, які є об'єктом вивчення і знаходяться у взаємодії з навколишнім середовищем
Під рівновагою системи розуміють такий стан, при якому у всіх точках об'єму тиск, температура, питомий об'єм та всі інші властивості одинакові.
За участю окремих тіл, які входять в термодинамічну систему, їх поділяють на робочі тіла (РТ), джерела теплоти (ДТ) і об'єкти роботи (ОР).
Врівноваженим термодинамічним станом називається стан робочого тіла, який не змінюється в часі без зовнішньої енергетичної дії.
Якщо термодинамічна система не взаємодіє з навколишнім середовищем, то її називають ізольованою або замкнутою.
Стан робочого тіла можна охарактеризувати параметрами стану. Повністю стан тіла може бути охарактеризований трьома параметрами стану:
ν -питомий об'єм. М3/кг;
Т- абсолютна температура, К;
р -тиск. Па.
Питомий об'єм -це величина обернена до густини тіла.
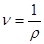 (1.1) (1.1)
Тиск з точки зору молекулярно-кінтичної теорії є середнім результатом ударів молекугт газу,які перебуваютьв неперервному хаотичному русі:
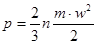 (1.2) (1.2)
де п - число молекул в одиниці об'єму;
т -маса молекул,кг;
w- швидкість руку, м/с;
Дня вимірювання тиску використовують наступні одиниці вимірювання:
Паскаль (Па), Н/м ; фізична атмосфера (ф.атм); бар; технічна атмосфера (ат); міліметри ртутного стовпчика (мм.рт.ст.), міліметри водного стовпчика (мм.вод.ст).
При переводі в кг/см2 показів ртутних барометрів потрібно враховувати те, що з підвищенням температури повітря, ртуть розширюється. Тому необхідно робити приведення показів барометра до 00 С
В0 = В(1 -0,000172t),
Де В-висота стовпа ртуті при t 0С.
Співвідношення між величинами для вимірювання тиску наступні:
1ат = 1 кГ/см2;
1 ф.ат. = 1,033 кГ/см2 - середній атмосферний тиск на рівні моря при t°=0°;
1 ат.= 735,6 мм.рт.ст. = 10 м.вод.ст.;
1 ф.ат.=1,013 бар
1бар = 10 Н/м =150ми.рт.ст. =10200 мм.вод.ст.
1.2 Температура
Температура -характеризує степінь нагрітості тіл і є мірою середньої кінетичної енергії руху молекул.
Параметром стану єабсолютна температура.
 , (1.3) , (1.3)
Де к- постійна Больцмана к= 1,3 8∙10-23 Дж.
Дня вимірювання температури використовуються дві термодинамічні шкали: термодинамічна шкала, основана на другому законі термодинаміки і міжнародна практична шкала, яка одержана за допомогою реперних (опорних) точок. За 0°С прийнято температуру танення льоду, за 100 °С-температуру кипіння в оди.
Крім стоградусної шкали в США користуються шкалою Ф аренгейта °F Температура танення льоду відповідає 320F,а кипінняводи-212 0F.
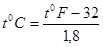 (1.4) (1.4)
Основні термодинамічні параметри стану р, ν, Т взаємозв'язані F(р,ν,Т) = 0.
Якщо зовнішні умови, в яких знаходиться термодинамічна система змінюється,то буде змінюватисяі стан системи.
Послідовність змін стану системи складає термодинамічиий процес. Всякий процес зміни стану системи представляє собою відхилення від стану рівноваги.
Порушення рівнов аги спричиняє виникнення в середині с истеми процесів, які протидіють відхиленню від стану рівновага.
Процес, який протікає настільки повільно, що в системі в кожен момент часу встигає встановитись практично врівноважений стан, представляє собою кв азі статичний процес. Якщо в процесі виконання роботи система послідовно проходить через врівноважені стани, то такий гроцес називається врівноважені м
Якщо нескінченно мале розширення системи проходить в зовнішньому середовищі, яке знаходить ся під одним і тимже тиском р, то збльшення об'єму системи супроводжується виконанням роботи
Оборотним називається процес, який може проходитияк в прямому такі в зворотному напрямі так, що при зворотному напрямі система проходить всі ті ж врівноважені стани, що і при прямому. Вході прямого і зворотного процесу як в навколишній системі так і в самому тіш не виникає ніяких залишкових змін. Процеси, які не задовільняють цій умові називають необоротними.
Оборотний процес, зокрема, характеризується тим, що виконаної в ході цього процесу роботи достатньо для того, щоб повернути систему при тих же самих зовнішніх умовах в попередній стан. Мірою необоротності процесу може послужити величина додаткової зовнішньої дії, яка необхідна для того, щоб повернути робочетіло в попередній стан.
Оборотним процесом може бути тільки процес врівноважений.
Теплота і робота представляють дві форми передачі енергії від одного тіла або системи до іншого.
Перетворення теплоти в роботу здійснюється за допомогою робочого тіла.
2. Ідеальні гази. Основне рівняння кінетичної теорії газів
Ідеальними називаються гази, в яких сили міжмолекулярної взаємодії малі і їх можна грирівняги до нуля, об'єм, який займає молекула малий, порівняно з міжмолекулярним пр оміжком.
2.1 Вивід основного рівняння кінематичної теорії газів
Розглянемо кубик із довжиною сторони l В кубику рухається N молекул, які створюють тиск р на грані. Маса газу рівна т
Оскільки тиск на стінки посудини є результатом ударів молекул, то при виведенні рівняння зробимотакі припущення:
швидкість руху всіх молекул однакова і дорівнює їх середній швидкості ш;
тиск молекул здійснюється паралельно до ребер кубика в трьох взаємноперпендикулярних напрямках.
Кожна молекулаггои ударі об стінку змінює свійнапрям на протилежний -ш і виникає зміна імпульсу сини:
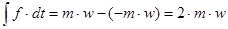
Кожна молекула, якщо вона рукається з швидкістю w, за одиницю часу здійснить  ходів. При кількості молекул N/3 сума імпульсів буде ходів. При кількості молекул N/3 сума імпульсів буде
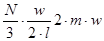
і буде рівна загальному тиску на грань:
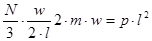
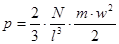
де
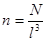 - число молекул в одиниці об'єму. - число молекул в одиниці об'єму.
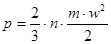 , (2.1) , (2.1)
Як уже відомо, кінетична енергія пропорційна абсолютній температурі газу:
 , (2.1а) , (2.1а)
а - коефіцієнт пропорційності.
Якщо помножити ліву і праву частини рівняння (2.1) на повний об'єм газу V і підставити замість 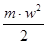 його значенняз (2.1а), то одержима його значенняз (2.1а), то одержима
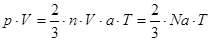 , ,
де
nV=N,
 ; ;
р∙V=m∙R∙T , (2.2)
де R -питома газова стала.
Рівняння одержало назву - рівняння стану ідеального газу, або рівняння Клапейрона. Із рівняння (22) можна одержати відомі закони для ідеальних газів:
при Т= const - закон Бойля-Маріотта; р = const - закон Гей-Люсака;
V=cons t- закон Шарля.
2.2 Газова стала та її фізична суть
Якщо уявити собі, що газ вагою 1 кг при тиску р вміщений в об'єм абсолютно довільної форми, то при нагріванні з об'єму ν1 перевде в об'єм ν2. При цьому виконається робота рівна сині на шлях (рис 2.1):
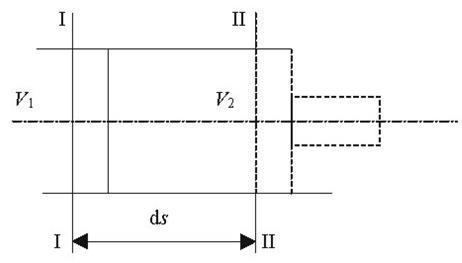
Рис2.1. До вияснення фізичного змісту газової сталої.
dL=dF∙p∙dS
де dF∙p - сила,
dF -площа,
dS – шлях
Але dF∙dS=dv, тоді
 (2.3) (2.3)
До початку розширення характеристичне рівняння матиме такий вигляд:
p∙v1=R∙T1 (2.4)
в кінці:
p∙v2=R∙T2 (2.5)
Із рівняння (2 3), (2.4) і (2.5):
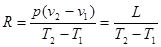
Газова стала являє собою роботу розпилення, яку виконує 1кг газу при нагріванні на 10 С при р=const.
Італійський вчений Авогадро довів, що при однакових температурах і тисках в рівних об'ємах ідеальних газів міститься однакова кількість молекул, абої моль газу при нормальних умовах займає однаковий об'єм.
Для одного моля газу:
p∙Vm=μ∙R∙T
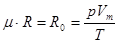
де Vт - об'єм однієї молекули;
м - молекупярна маса.
мR=R0 -універсальна газова стала. При нормальних умовах
(Р= 101325 Па, Т=273,15 К, Vm = 22,4∙10-3 м3/моль
R0=8314 Дж/моль∙К)
Знаючи універсальну газову сталу можна визначити питому:
R = 8314/μ.
3. Суміші ідеальних газів
Під газовою сумішшю розуміють суміш окремих газів, які не вступають з собою в хімічні реакції.
Кожній із газів, які входять в суміш можна розглядати як ідеальний газ і саму суміш можна розглядати як ідеальний газ. Англійський фізик Дапьтон сформулював в 1809 році наступний закон для суміші ідеальних газів: кожний із компонентів газової суміші поширений в цілому об'ємі простору, займаючи весь простір, при те маературі суміші.
Із вищесказаного можна зробити наступні висновки:
кожний газ, якш входить в суміш, має таку жтемпературуякі вся суміш;
кожний з газів займає об'єм, який займає суміш;
кожний з газів підпорядковується своєму характеристичному рівнянню, а суміш - своєму характеристичному рівнянню стану;
загальній тиск суміші газів рівний суміші парціальних тисків окремих газів, які складають суміш.
Р=Р1+Р2+...+Рп
де р1,р2,рз, ...рп -парціальний тиск окремих компонентів газу.
Парціальний тиск -це тиск, який ои мав кожний газ, що входить в суміш, коли б цей газ знаходився один в тій же кількості і займав той же об'ємі при тій же температурі, що і суміш.
Склад газової суміші визначають ваговими, об'ємними або мольними частками.
Масовою або ваговою часткою називається відношення маси окремого компоненту газу до маси всієї суміші.

де m1, m2…mn -маса окремого компоненту. т - мас а суміші.
g1+g2 +…+gn=1
Об'ємною часткою називається відношення парціального об'єму окремого компонента газу до загального об'єму суміші газів.
Парціальним об'ємом газу називається об'єм, який займав би цей газ, якщо б він знаходився при температурі і тиску суміші.
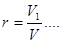
де V1, V2…Vn - парцальнийоб'єм окремого компоненту,
V - об'єм суміші.
r1+r2 +…+rn=1
Мольною часткою називається відношення кількості молей окремого компоненту газу до кількості молей всієї суміші.
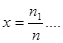
де n1, n2…nn -кількість молей окремого компоненту,
n-кількістьмолей суміші.
Задання суміші мольними частками рівносильнезаданнюїї об'ємними. Молекулярна маса суміші:
μсум=r1μ1+r2 μ2+…+rnμп, (3.1)
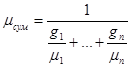 (3.2) (3.2)
Газова постійна суміші:
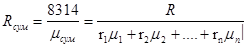
Допустимо, що ми маємо суміш газів mсум
Складові частини лзі, т1, т2 .
P1∙Vсум=m1∙R1∙Tсум
P2∙Vсум=m2∙R2∙Tсум
Pn∙Vсум=mn∙Rn∙Tсум
(P1+P2 +…+Pn) Vсум = (m1∙R1+…+ mn∙Rn) Tсум
Pсум ∙Vсум=(m1∙R1+…+ mn∙Rn) Tсум
З іншої сторони:
Pсум ∙Vсум= mсум∙Rсум Tсум
Оскільки ліві частини рівнянь рівні, топовий бути рівні і праві:
mсум∙Rсум Tсум=(m1∙R1+…+ mn∙Rn) Tсум

Rсум=g1R1+...+gnRn (3.3)
Зв'язок між масовими та об'ємними частками можна встановити наступним чином:
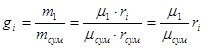
або:
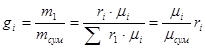 (3.4) (3.4)
Для перерахунку масових часток в об'ємі використовують наступні співвідношення:

але:
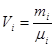
тоді:

розділивши чисельник і зна менннк на mсум, одержимо
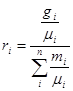 (3.5) (3.5)
4. Перший закон термодинаміки
Перший закон термодинаміки представляє собою частковий вигадок загального закону збереженняі перетворення енергії стосовно теплових явищ. Закон збереження і перетворення енергії є фундаментальним законом природи, який одержанийна основі узагальнення значної кількості експериментальних даних і застосовується до всіх явищ природи.
Він стверджу є, що енергія не виникає і не зникає вона лише переходить із однієї форми в іншу.
Якщо деякому робочому тілу з об'ємом V масою М, яке має температуру Т і тиск Р надати зовні нескінченно малу кількість теплоти δQ то в результаті підведення теплотитіло нагріється на dT збільшиться в об'єм на dV
Підвищення температури пов'язане зі зміною внутрішньої енергії U тіла, азмна об'єму із виконанням роботи dL. Тобто можна записаги:
δQ = dU+dL (4.1)
Внутрішня енергія в кожчому із станв має повністю визначене значення і є функцією стану.
Кількість теплоти і робота є функціями процесу. Теплота і робота, будучи еквівалентні одна одній як способи передачі енергії, не є рівноцінними. Ця нерівноцінність полягаєвтому, що робота, в оточуючих нас умовах, може бути перетворена в тепло повні стю, а тепло може бути перетворене в роботу тільки частково.
Внутрішня енергія системи включає в себе:
кінетичну енергію поступального, обертового і коливального руху частин;
потенціальну енергію взаємодії частин;
енергію електронних оболонок атомів;
внутрішню ядерну енергію.
В більшості термодинамічних процесів дві останні залишаються незмінними. Тому будемо під внутрішньою енергією розуміти енергію хаотичного руку молекул і ато мів, включаючи енергію постугального,
Обертового і коливального руху, а також енергію сил міжмолекулярної взаємодії. Для того, щоб одержати абсолютну величину внутрішньої енергії необхідно про інтегрувати перший закон термодинаміки.
U=∫(dQ-dL)+U0
де U0 - постійна інтефування.
Оскільки в термодинаміці нас цікавить головним чиномне абсолютне значення внутрішньої енергії, а їїзміна, товеличина константи інтегрування U0 є несуттєвою.
Внутрішня енергія як функця стану має наступні властивості:
Внутрішня енергія системи є однозначною функцією стану системи.
При довільно нескінченно малійзміні стану системи зміна внутрішньої енергії системи dU= dQ-dL. Диференціалі dU повним диференціалом.
Внутрішня енергія системи є аддитиеною величинсю.
Внутрішня енергія визначаєтьсяв термодинаміці з точністю до деякого постійного доданку U0
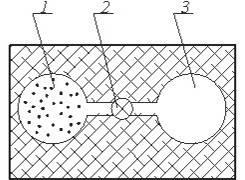
Рис. 4.1. Схема досліду: 1 -посудина з газом; 2 - адіабітна гкрегородка;3 -посудина без газу
Залежність внутрішньої енергії від температури може бути в становлена із дослідів по адіабатному розширенню газу в пустоту. Вперш є такий дослід був проведений Гей-Люсаком, а потім Джоулем
Нехай в одній половині теплоізольованої посудини із жорсткими стінками знаходиться деяка кількість досліджуваного газу (рис 4.1). Друга половина посудини відділена від першої адіабатною перегородкою і не містить газу.
Якщо відкрити перегородку, то газ буде перетікати із першої половини посудини в другу.
В процесі розширення газу із-за жорстко сгі стінок посудини об'ємне змінюєтьсяі тому ніякої роботи розширення негроходить, тобто l1-2 = 0, із другої стерши із-за адіабатного прсцесу Q1-2 = 0 і тому ні основі рівняння першого закону термодинаміки U1=U2 тобто внутрішня енергія газу не міняється. Прн цьому покази термометрів, які вимірюють температуру, залишаться без змін.
Звідси можна зробити висновок, що внутрішня енергія газу незалежить ні від об 'єму ні від тиску, а є однозначн ою функцією температури.
Тому внутрішня енергія є однозначна функція стану тіла, тобто любих двох незалежних параметрів, які визначають цей стан.
U=φ(p,V) U=φ2(p,T) U=φ3(T,V) (4.2)
Зміна внутрішньої енергії ∆U в термодинамічному гроцесі не залежить від характеру процесу, а визначається тільки початковим і кінцевим станом тіла.

Математично це значить, що нескінченно мала зміна внутрішньої енергії dU є повний диференціал U

Початком відліку внутрішньої енергії ідеальних газів прийнято рахувати t=00C.
Робота розширення. Робота в термодинаміці так же як і в механіці визнач ається добутком сили, яка діє на тіло, на шлях.
Робочими тілами в термодинаміці виступають гази.
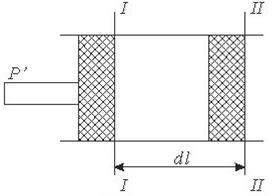
Рис. 42. До визначення роботи в термодинамічному процесі.
Нехай поршень площею^ який з находиться в ціліндрі пермістигься із положенняі-іна від дальні і займе положення П-ІІ. Робота, яку при цьому виконав поршень буде становити:
δl=p∙Sdl=pdV
Робота, яку виконує система при кінцевій зміні об'єму від V1 до V2 рівна:

Робота залежить від шляху, ію якому система із стану І переходить в стан II тобто є функцією процесу, а не стану.
При розширенні робота позначається знаком "плюс", при стисканні -знаком '"мінус". Робота системи віднесена до 1 кг маси робочого тіла називається питомою роботою. В диференціальній формі перший закон термодинаміки буде мати вигляд:
δq=du+pdv (4.3)
Крім роботи розширення використовується ще таке поняття як робота зміни тиску lр:
δ lр= pdv 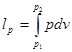 (4.4) (4.4)
Це робота, яку необхідно виконати, щоб помістити тіло в середовище з даним тиском.
Якщо до правої частини рівняння (4.3) додати і відняти величину vdр одержима
δq=du+pdv+ vdр - vdр,
або
δq=du+d(pv)- vdр=d(u+pv)-vdp,
δq=dh-vdp.
Величина
h= и + рv
є функцією стану системи і чисельно рівна всій енергії, зв'язаній зданим рівноважним станом тіла -кінетичній і потенціальній і одержала назву ентальпія.
Ентальпія має наступні властивості:
ентальпія єпараметром стану системи;
при любій нескінченно малій зміні стану системи з міна ентальпії рівна:
dh =δq+vdp.
Диференціал dh є повним диференціалом. Ентальпія тіла є аддитивною величиною, тобто ентальпія складної системи рівна сумі ентальпій її частин:
H=∑Hi
Ентальпія тіла визначається в термодинаміці з точністю до деякого постійного доданку. В термодинаміці цю постійну величину вибирають довільним способом. Так, наприклад, вважають, що ентальпія ідеального газу при t=0 рівна нулю. Ентальпія води, яка знаходиться в потрійній точці рівна нулю
З врахуванням такого поняття як ентальпія перший з акон термодинаміки можна записати такожу вигляді:
δq=dh-vdp. (4.5)
5. Теплоємність
Під питомою теплоємністю або просто теплоємністю розуміють кількість теплоти, яку можна надати (або відняти) одиниці речовини (1 кг,1 м3 , 1 кмоль), щоб змінити його температуру на 10 С.
Тепломісткість тіла, яка відповідає безконечно малій зміні температури, називається істинною теплоємністю:

Теплоємність тіла, яка відповідає зміні температури на кінцеву величину називається середньою теплоємністю.
 .(5.2) .(5.2)
Якщо теппоємшсть відноситься до 1 кг газу, таку теплоємність прийнято називати мас овою теплоємністю і позначати буквою с.
Тегпоємність 1 м3 при нормальних умовах називають об 'ємною теплоємністю, позначаєтьсясґ, Дж/м3К.
Тегпоємність 1 кмоля тіла називається мольною теплоємністю мс,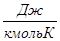
Із цих визначень витікає настугний зв'язок:
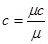 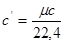
Оскільки теплота залежить від процесу, то теплоємність є функція процесу.
Тегпоємність в ізохорному процесі позначають з індексом v, в ізобарному з індексом p.
Наприклад:
мсv - мольна середня теплоємність при постійному об'ємі, ізобарна та ізохорна теплоємність зв'язані між собою рівнянням Майєра.
cр=сv+R (5.4)
Відношення теплоємностей позначається буквою к і називається показником адіабати.
 (5.5) (5.5)
Для одноатомних газів к=1,67, двоатомних -к=1,4, трьохатомних -к=1,29.
Для визначення теплоємності газової суміші необхідно зніти склад газовоїсумішіі теплоємності компонентів.
Очевидно, що для збільшення температури газової суміші на 1° необхідно збільшити на 1° температуру кожного газу суміші.
На нагрів кожного газу в суміші необхідна кількість тепла рівна ciMi
де сі, -теплоємність і-го елементу;
Мі, - маса і-го елементу.
Тоді
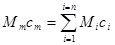 (5.6) (5.6)
де Мт - маса суміші;
ст -теплоємність суміші.
Після ділення лівої і правої частини на Мт одержимо:
 (5.7) (5.7)
Якщо склад суміші заданий об'ємними долями, то об'ємну теплоємність суміші можнавизначитиза формулою:
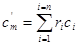 (5.8) (5.8)
де с, -об'ємна теплоємність к-го газу, який входить в суміш. Мольна теплоємність суміші:
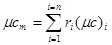 (5.9) (5.9)
6. Ентропія
Якщо в рівнянні першого закону термодинаміки (1.17) ліву і праву частину поділити на Т, одержимо:
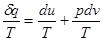
Як буде показано далі, для ідеального газу du=cvdT рівняння стану ідеального газу можна представити, як рівняння стану ідеального газу можна представити, як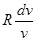 . .
Тоді
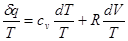
Вираз 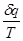 при врівноваженому стані є повний диференціал деякої функії при врівноваженому стані є повний диференціал деякої функії
стану, яка називається ентрогіоо, для одного кілограму газу позначається через s і вимірюється в Дж/(кг∙К).
 (6.1) (6.1)
Подібно любій іипій функції стану ентропія може бути представлена в вигляді функції любих двох параметрів стану:
s=ƒ(p,v) s=ƒ(p,T) s=ƒ(T,v)
Значення ентр олії для з ад аного ста ну визначаєть ся інтегру ванням рівняння

де s0 -константаінтегрування.
При температурах, близьких до абсолютного нуля, всі відомі речовини знаходягьсяв конденсованому стані.
В Нернст (1906р) експериментально встановив, а МПланк (1912р) повністю сформулював наступний принцип: при температурі, яка прямує до абсолютного нуля, ентропія речовини, яка знаходиться в конденсованому стані з впорядкованою кристалічною структурою прямує до нуля. s0 = 0 при Т = 0 К.
Цей закон називається третім законом термодинаміки або тепловою теоремою Нернста.
7. Ексергія
Для оцінки ефективності термодинамічних машин необхідно знати, яку максимальну роботу можна одержати. Очевидно, що максимальна кількість роботи буде одержана при оборотному переході робочого тіла із початкового стану р1,Т1 в кінцевий стан ро,То, який знаходиться в рівновазі з навколишнім середовищем.
Тика максимальна робота одержала назву- ексергія.
Ексергія речовини є максимальна робота, яку може виконати робоче тіло в оборотному процесі з навколишнім середовищем в якості джерела дармової теплоти, якщо в кінці ц»ого процесу всі враховані в ньому види матерії переходять в стан термодинамічної рівноваги зі всіма компонентами
навколишнього середовища.
Види ексергії. Ексергія ділиться на два основних види: ексергія видів енергії, яка не характеризується ентропією, дггя якої вона рівна самій енергії е=Е (механічна, електрична та інш.) і ексергія ввдів енергії, які характеризуються ентропією (внутрішня енергія, енергія випромінювання, термомеханічна, нульова).
Ексергія останніх ввдів енергії поділяється на ексергію речовини в замкнутому об'ємі, ексергію потоку речовинні ексергію потоку енергії Ексергія речовини в замкнутому об'ємі еv розглядається в закритих системах. Визначимо максимальну роботу, яку може здійснити речовина з початковими параметрами Р, v Т, u, h, s прн оборотному переході в рівновагу з навколишнім середовищем, яке має параметри Р0, v0 Т0, u0, h0, s0 Дня того, щоб речовина прийшла в рівновагу з навколишнім середовищем, необхідно змінити її внтршню енергію за рахунок підведення (або відведення) донеї теплоти або за рахунок виконаннянею роботи
В оборотному процесі підведення теплоти до речовини проходить прн постійній температурі, рівній температурі навколишнього середовища. Тоді ексергія речовини в замкнутому об'ємі dev ,буде рівна роботі dl зменшеній на роботу, яку необхідно затратити на подолання тиску навколишнього сер ед овищ а podv,
dev =δl- podv = δq-du- podv,
або після інтегрування
еv=c-s)-(U0U)- p0(v0-v)=(u0-u)- v-s)+p0(v0-v)
Рівняння можна записати так
еv=u- T0s+ p0v+e0 (7.1)
де
ео=u+T0s0-p0v0=сопst,
і відповідно, є параметром стану речовини і середовища - ексергатичною функцією.
Дня визначення термомеханічної ексергії потоку речовини необхідно знайти максимальну роботу його гри оборотному переході від даного стану, який характеризуєтьсяпараметрамир, p, v Т, u, h, s до врівноваженого стану, тобто з парам етра p0, v0 Т0, u0, h0, s0
Ця робота буде рівна роботі рv мінус робота p0v затрачена на подолання тиску середовища,
рv- p0v= v(p-p0)
Відповідно, ексергія потоку речовини
е= еv+ v(p-p0)
Підставляючив рівняння значення еv, одержимо
e=(u+pv)- T0s-v+T0s0+ p0v
e=h- T0s+ ео (7.3)
де ео= u0+ T0s0- p0v0. (7.4)
Нульова ексергія е0 зв'язана із встановленням рівності хімічних потенціалів між відповідними компонентами речовини і гввколишнього середовища і вимірюється кількістю роботи, яка може бути одержана в оборотному процесі встановлення рівноваги компонентів речовини із відповідними компонентами навколишнього середовища.
Ексергія теплового опотоку q розраховується за рівнянням
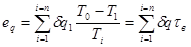 (7.5) (7.5)
де tві=1 -(То/Т)- називається ексергетичною температурною функцією.Зокрема при Т=іdет іτв=1 формула (7 5) буде мати вигляд.
Функція τв має універсальне значення вона придатна для оцінки максимальної роботоздатності в кругових і розімкнутих термодинамічних процесах.
Зміна ексергії потоку робочого тіла в ізобарному процесі рівна ексергії еq зв'язаногоз цим процесом теплового потоку.
Ексергія випромінювання eе визначається максимапьнолю роботою, яка може бути виконана в оборотному процесі приведення цього випромінювання в стан рівноваги з навколишнім середовищем
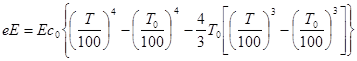
де Е - степінь чорнотиповерхн;
С0 - коефіцієнт випромінювання абсолютно чорного тіла.
8. Аналв основних термодинамічних процесів ідеального газу
Задачею аналізу будь-якого термодинамічного гроцесу є встановлення закономірностей зміни параметрів стану робочого тіла та виявлення особливості перетворення енергії.
З цією метою проводяться наступні операції:
виводиться рівнянняпроцесув р-v-координатах;
встановлюється залежність міжзмінюваннми параметрами в процесі;
визначається зміна внутрішньої енергії ∆u;
визначаєтьсятермодннамічна робота газу l;
визначаєтьсязовнішнятеплота q,необхідна дляздійсненняпроцесу.
Одночасно знаходиться зміна ентальпії ∆h та ентропії ∆s між початковим та кінцевим станами процесу. Отримані таким чином дані дозволяють розглянути особливості перетворення енергії в процесі та скласти схему енергобалансу.
З багатоманітності можливих процесів для аналізу вибираються спочатку простіші, чи так звані основні процеси: при постійному об'ємі (ізохорний), при постійному тиску (ізобарний), при постійній температурі (ізотермічний), а такожпроцес беззовнішньоготеплообміну (адіабатний).
Перш ніж приступити до аналізу основних термодинамічних процесів, слід звернути звагу на те, що внутрішня енергія та ентальпія є функціями стану та їх зміна не залежить від характеру процесу. Тому можна отримати розрахункові вирази для обчислення їх зміни, які будуть справедливі для будь -яких процесів з ідеальним газом.
Враховуючи, що в ізохорному процесі dv = 0, pdv= 0, вираз першого закону термодинаміки (4.3) для ізохорного пр оцесу прийме вигляд
qv=∆u
Одначе кількість теплоти можна виразититакожчерезтеплоємність
qv=cvm(t2-t1) (8.1)
Отже,
∆u=cvm(t2-t1) (8.2)
або
du=cvdt (8.3)
З виразу першого закону термодинаміки для ізобарного процесу (4.5) випливає, що
dqp=dh (8.4)
або
qp=h2-h1 (8.5)
Одначе
qp= cpm(t2-t1) (8.6)
Тоді
∆h= cpm(t2-t1) (8.7)
Або
dh=cpdt (8.8)
Таким чином, вирази (8.2) та (8.7) придатні для обчислення зміни внутрішньої енергії та штальпії в будь-якому процесі ідеального газу.
Можна також отримати загальні вирази для обчислення зміни ентропії в процесах змі ни стану ідеальних газів.
Враховуючи, що

підставимо значення dq з (4.3) та (4.5), отримаємо:

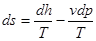
Замінившив цих виразах du з (8.3) та dh з (8.8) та враховуючи, що
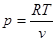 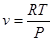
Отримаємо:
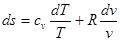 (8.9) (8.9)
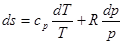 (8.10) (8.10)
Інтегруючи ці диференціалші рівняння, отримаємо :
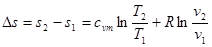 (8.11) (8.11)
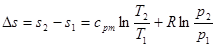 (8.12) (8.12)
8.1 Ізохорний процес(v =const)
В р - v -координатах графік процесу являє собою пряму лінію
Рис. 8.1.1. Зоораженняізохорногопроцесу
В РV і ТS-координатах. паралельну осі р (рнс.8.1.1 а), причому процес може протікати з підвищенням (процес 1-2) тапониженнямтиску (процес 1-2').
Виписавши для крайніх точок 1 та 2 рівняння стану та поділивши їх почленно, отримаємо залежність між параметрами газу в ізохорному процесі:
p1v=RT1 p2v=RT2
або
 (8.13) (8.13)
В ізохорному процесі dv=0 і робота не виконується (lv=0). Томувся теплота витрачається тільки на зміну внутрішньої енергії:
qv=∆u=cvm(t2-t1)
Зміна ентальпії може бути знайдена із загального виразу для всіх процесів (8.7).
Вираз для зміни ентропії в ізохорному процесі можна отримати із загального співвідношення (8.11), прийнявши v1=v2
 (8.14) (8.14)
чи з врахуванням (8.12)
 (8.15) (8.15)
Із (8.14) випливає, що між ентропією та температурою існує логарифмічна залежність . На Т- s - діаграмі ця залежність зображується кривою 1-2 ( рис. 8.1.1,6).
8.2 Ізобарний процес (р=сопst)
В р-v -координатах процес позначається прямою 1-2 ( рис. 8.2.1, а). Записавши рівняння стану для двох точок процесу.
pv1=RT1 pv2=RT2
та розділивши почленно друге на перше, отримаємо залежність між параметрами.
 (8.16) (8.16)
Зміна внутрішньої енергії визначається за загальним виразом (8.1). Робота процесу, віднесена до 1 кг газу:
 (8.17) (8.17)
Так як для ідеального газу
pv2=RT2 pv1=RT1
то
lp=R(T2-T1) (8.18)
Кількістьтегтотнв ізобащомупроцесі може бути обчислена за(8.5)
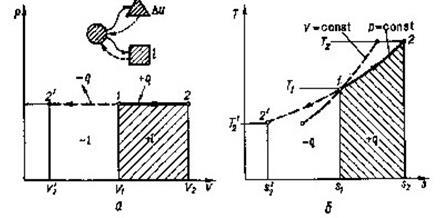
Рис 8.2.1. Зображення ізобарного процесу в РV і ТS-діаграмах.
qp=∆h=(h2-h1) (8.19)
тобто кількість теплоти в ізобарному процесі рівна зміні ентальпії.
Однач є, згідно (8.6):
qp=cpm(t2-t1)
тобто
∆h=cpm(t2-t1) (8.20)
А оскільки ентальпія є параметром стану, то в любому термодинамічному процесі ∆h можна визначитиза формулою (8.20).
Зміну ентропії в ізобарному процесі можна визначити із загального виразу (8.12),прийнявши р1 = р2,
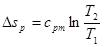 (8.21) (8.21)
чи, враховуючи (8.16):
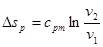 (8.22) (8.22)
Отже, в Т-s -координатах ізобара - логарифмічна крива (рис.8.2.1, б. пунктиром нанесена ізохора). Оскільки ср >сv, то з порівняння (8.14) та (82.1)
видно, що ізобара розташована більш полого, ніжізохора.
8.3 Ізотермічний проце с (Т = сопst)
Рівняння процесу отримаємо із рівняння стану рv = RT
рv = сопst (8.23)
В р-v - координатах ізотерма зобразиться рівнобокою гіперболою (рис. 8.3.1,а). Зв'язок мі ж параметрами встановлюється з рівняння процесу(8.23).
p1v1= p2v2 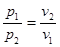
Зміна внутрішньої енергії та ентальпії для ідеального газу в ізотермічному процесі рівна нулю (du = 0 та dh = 0)9 оскільки dТ = 0. Отже, вся підведена в процесі теплота витрачається тільки на роботу. Робота в процесі визначається за (4.4) шляхом заміни
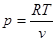
з рівняння стану.
Рис 8.3.1. Зображення ізотермічного процесу в РV і ТS-діаграмах
Після інтегрування
dlT=pdv
одержимо:
 (8.23) (8.23)
Теплота, необхідна для здійснення процесу, згідно (4 3)
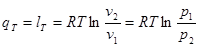 (8.24) (8.24)
чи на основі (6.1)
δq=Tds
qT=T(s2-s1) (8.25)
Вираз для зміни ентропії в ізотермічно му процесі може бути отриманий із (8.24) та (825)
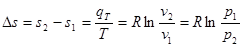 (8.26) (8.26)
Графік ізотермічного процесу в Т-s-координатах приведений на рис. 8.3.1,6.
8.4 Адіабатний процес
Адіабатним називається такий процес, при якому робоче тіло не обмінюється теплотою з навколишнім середовищем (q = 0; dq = 0).
Рівняння адіабатного процесу в р-v- координатах може бути отримано, якщо використовувати вирази першого закону термодинаміки (4.3) і (4.5) та врахувати особливості ідеального газу:
dU=cvdT dh=cpdT
Тоді:
dq=cvdT+pdv=0 або cvdT=-pdv
dq=cpdT+vdp=0 або cpdT=vdp
Звідки
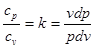
або

Проінтегрувавши останній вираз, отримаємо рівняння процесу k∙lnv+lnp=0:
рvk =сопst,(8.27)
де к - показник адіабати.
В р-v- координатах адіабата зображується нерівнобокою гіперболою (рис.8.4.1,а ), що проходить трохи крутіше ізотерми. Зв'язок між параметрами р і v виходить з рівняння процесу (8.27):
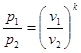 (8.28) (8.28)
Для двох точок процесу напишемо рівняння стану:
p1v1=RT1 p2v2 =RT2
звідки
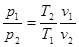 (8.29) (8.29)
Підставивши відношення тисків з (8.28), отримаємо залежність між Т і v
 (8.30) (8.30)
Розв'язавши спільно рівняння (8.30) і (8.29) отримаємозапежність між р і Т
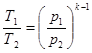 (8.31) (8.31)
Зміна внутрішньої енергії визначається за загальним виразом (8.2); формула для роботи в процесі може бути отримана з (43):
δlq=-du або lq=-(u2-u1) (8.32)
тобто в адіабатному процесі робота здійснюється за рахунок зміни внутрішньої енергії.
З врахуванням (8.2) вираз (8.32) прийме вигляд
lq=-cvm(T2-T1)= cvm(T1-T2) (8.33)
чи з врахуванням (5.4) і

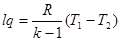 (8.34) (8.34)
За мінивши з рівнянь стану Т1 і Т2 отримаємо
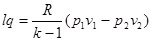 (8.35) (8.35)
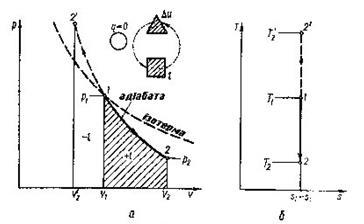
Рис. 8.4.1. Зображення адіабатного гроцесу в РV і ТS-координатах.
Перетворимо рівняння (8.34)з врахуванням (8.31)
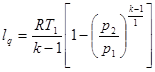 (8.36) (8.36)
Зміна ентаттьпії в адіабатному процесі підраховується по (8.7). Зміна ентропії рівна нулю, такяк за визначенням процесу q = 0 і
ds=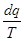 = 0. = 0.
Відповідно, s = сопst. Тому адіабатний процес називають ізоентропійним процесом.
В Т-s-координатах адіабата зображується вертикальною прямою (рис.8.4.1,б).
8.5 Політропнийі процесс
Любий самовільний процес зміни стану робочого тіла, що проходить при постійнійтеплоємності, називається політропним.
Рівняння політропното процесу може бути одержано з рівняння першого закону термодинаміки для ідеального газу:
dq=cvdT+pdv
dq=cрdT-vdp
Кількість підведоіої теплоти для політропного процесу
dq=cпdT (8.37)
де сп- теплоємністьполітропногопроцесу. Тоді рівняння першого закону термодинаміки для політропного процесу:
cпdT=cvdT+pdv
cпdT=cрdT-vdp
або
(cп-cv)dT=pdv
(cп-cp)dT=-vdp
Розділивши другерівняння на перше, одержимо:
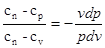
Позначимо величину 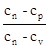 - постійну для даного процесу, через n - постійну для даного процесу, через n
Тобто 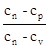 = п. (8.38) = п. (8.38)
Одержима
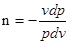 (8.39) (8.39)
а після розділ ення змінних:
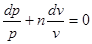
інтегрування отримаємо рівняння політропного процесу
Величина п, залежна від теплоємності процесу сп, називається показником політропи. Будучи постійним для конкретного процесу, показник політропи визначає його характер.
Політропний процес є узагальнюючим; розглянуті вище процеси є його частковими випадками.
Дійсно, зрівняння рvп = сопst при різних пмаємо:
n=0 рv0=p= сопst- ізобаричний процес;
n = ±∞ v=сопst - ізохоричний процес;
n=1 рv=сопst -ізотермічний процес;
n=k рvk=сопst - адіабатичний процес.
Зв'язок між параметрами р,v,Т і вирази для роботи в політропному
процесі аналогічні таким же в адіабатному процесі, так як рівняння попітропного процесу співпадає по формі з рівнянням адіабатного гроцесу, в якому показник к за мінений показником п :
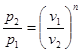 ; ; 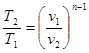 ; ; 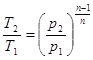 (8.40) (8.40)
Це ж відноситься і до виразів для визначення роботи в політропному процесі:
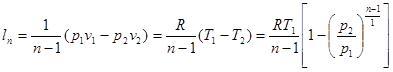
Зміна внутрішньої енергії в політропному процесі визначається по загальному виразу для ідеальних газів (8.2). Кількість тепла в процесі може бути обчислена на підставі математичного виразу першого закону термодинаміки (43)
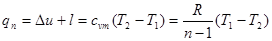 (8.41) (8.41)
або,виходячи зуявленняпро теплоємність в процесі
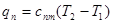 (8.42) (8.42)
Вираз для теплоємності в політропному процесі отримаємо з (8.38)
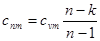 (8.43) (8.43)
Показник політропн п може бути обчислений, якщо відомі р і v в двох точках процесу. Тоді з рівняння (8.40) одержуємо:
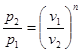
або
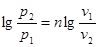
Звідки
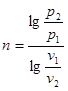 (8.44) (8.44)
Зміну ентропії в політропному процесі може бути знайдено на основі (5.9) і (8.42):
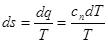 (8.45) (8.45)
Інтегруючи цей вир аз отримаємо
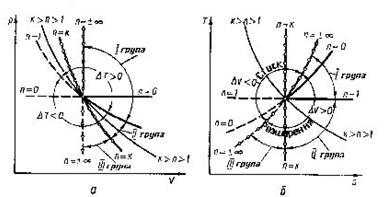
Рис 8.5.1 Зображення процесів в РV і TS координатах.
Щоб прослідкувати за розміщенням політропних процесів прн різних значеннях п в р-v і Т - s-координатах, на діаграми наносять криві окремих процесів, за якими можна визначити відносне розміщення політроп при різннх п а також знайти знак для q і ∆и в цих процесах (рис 8.5.1). Наприклад, графік паштропного процесу з показником попітрспн к>п>1 проходить між n=1 і п = к, причому при розширенні в цьому процесі теплота підводить ся (так як Д? >0), температура і внутрішня енергія зменшуються.
Характерно, що всі політропні процеси розширення (∆s>0) можна розбити натри типові групи, кожна з яких має спільну схему енергобалансу. В кожній групі процесів особливості перетворення енергії являються загальними, але кількісний розподіл трьох складових балансу енергії змінюється. В табл. 1.1 приведені особливості трьох груп політропних процесів розширення (∆и>0 ). Аналогічно можна розбити на три групи всі політропні процеси стиску (∆и <0).
Таблиця 8.5.1. Групи політропних процесів.
| Група |
Межа зміни показника політропи |
∆и |
q |
Теплоємність в процесі |
Схема енергобалансу |
| 1 |
1>n>-∞ |
∆и >0 |
q>0 |
Сn>0 |
1 |
| 2 |
к>п> 1 |
∆и <0 |
q>0 |
Сn <0 |
2 |
| 3 |
+∞>n>к |
∆и <0 |
q<0 |
Сn >0 |
3 |
Обмін енергією в термодинамічному процесі.

9. Реальні гази
Реальні гази відрізняються від ідеальних тим, що молекули щх газів мають кінцеві власні об'єми і зв'язані між собою силами взаємодії, які мають електромагнітну і квантову природу. Рівняння стану РV= RТ для реальних газів не виконується
 . .
де С - коефіцєнт стисливості - виражає відхилення властивостей реального газу від властивостей ідеального газу.
Суттєвою відмінністю реального газу від ідеального є також те, що реальний газ в залежності від зовнішніх умов може знаходитися в газоподібному, рідкому і твердому агрегатному стані.
Згідно правила фаз Гіббса, число інтенсивних параметрів стану N (тиск, температура, концентрація), які можуть незалежно змінюватись без зміни фаз, складає
N=m-r+2
де т -число компонентів,
r - число фаз.
Тому для чистої речовини (т = 1) в однофазному стан (r= 1) може незалежно мінятися два параметри (тиск і температура), в двофазному (r = 2) - один параметр, в трифазному (r = 3) N = 0, тобто три фази можуть знаходитись в рівновазі тільки при визначенійтемпературі і тиску (потрійна точка води).
Ван-Дер-Ваальс ввів дві поправки, які враховують відхилення реального газу від ідеального.
Перша поправка - враховує об'єм, який займають молекули.
З рівняння Кл апейрона одержуємо
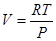
При зростанні .Рдонескінченності, впадає до нуля. Для реального газу найменший об'єм рівний об'єму молекул vмол плюс об'єм проміжку між молекулами vгаз
b - найменша величина, до якої можна стиснути газ
b= vмол+ vгаз
Тоді вільний об'єм буде рівний
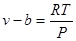
При Р →∞, v→b або v-b = 0.
Оскільки тиск ідеального газу за рівнянням Клапейрона визначається як
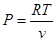
а для реального,
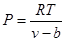
то при однаковій температурі тиск в реальних газах буде більший.
Друга поправка враховуєвплив сил взаємодії між молекулами.
В реальному газі син а ударів об стінку посудини буде менша в результаті того, що всі молекули гритягуються спідніми Поправка ∆Р пропорційна як числу молекул притягуючих, так і тих, що притягуються, тобто пропорційна квадрату густини газу, або обернено пропорційна квадрату його питомого об'єму.
∆p=aρ2=a/v2
де а -коефіцієнт пропорційності, який не залежить від параметрів стану. Враховуючи другу поправку, одержимо
P=RT/(v-b)- ∆p (9.1)
або
(p+ a/v2)(v-b)=RT
- рівняння Ван- Дер-Ваальса.
Вираз a/v2 називають внутрішнім тиском. Для води при t = 295°К
(20 °С) a/v2→1080МПа.
Рівняння можна використовувати длядвофазних станів. .Якщо розкрити дужки і розміститипо степенях v, одержимо:
pv3-(bp+RT)v2+av-ab (9.2)
Можливі випадки:
а)всі трикорені різні ідійсні;
б)всі три корені дійсні і рівні між собою;
в)один корінь дійсний і дв а уявні.
.Якщо в рv - діаграмі побудувати ізотерми, які відповідають рівнянню
Ван-Дер-Ваальса, то вони будуть мати внгляд показаний на рис. 9.1:

Рис. 9.1 Ізотерми, побудовані зарівняннямВан-дер-Ваапьса.
Рівняння Ван-Дер-Ваапьса при великих гу:тннах газу дає значні похибки в зв'язку з тим, що гши його виеедеіні не враховується силова асоціація і дисоціація молекул.
Молекули утворюють комплекси із двох - трьох молекул і така частинка ведесебеяк окремий газ, а реальний газ-як суміш газів, які склад аються із одиночних, подвійних і трійних комплексів. Це дозволяє врахувати рівняїня, запропоноване Вукалович ем і Новиковим.
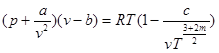
де с і m -визначаються дослідним шляхом
Розвиток кінетичної теорії газів дозволив встановити точне рівняння стану реальних газівв такомувигляді:
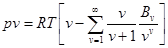
де В, v - варіальні кофіцієнти, які виражаються через потенціальну енергію взаємодії і температуру Т. v = 2, 3, 4 - порядковий номер варіапьного кофіцієнгу. Рівняння для зручності спрощують.
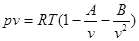
Де А і В -стільки функціями температури.
Суттєвою відмінністю реального газу від ідеального є те, що реальний газ може переходити із одного агрегатного стану в інший.
Криві фазових переходів в РІ координатах мають вигляд пжазаний на рис.9.2:

Рис. 9.2 Р t - діаграма води
Якщо стискати газ при постійній температурі t<tкр то при деякому тиску точка ) починається зрідження газу. При подальшому стисканні газ перетворюється в рідину. Процес конденсації проходить при постійному тиску. При подальшому стисненні тиск в рідині різко росте. Таке явице спостерігається і дгтяіншнхізотермпри t<tкр.
Для зображення процесів в реальних газах використовують рv, Тs
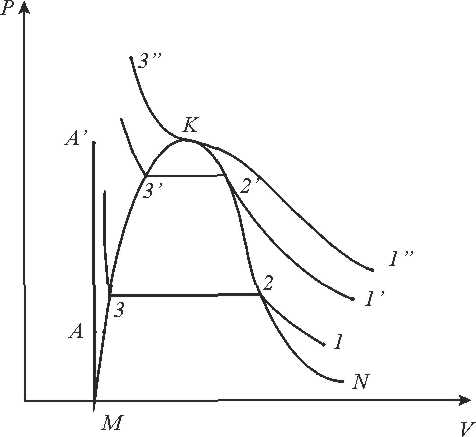
Рис. 9.3 рv - діаграма.
З'єднуючи точки горизонтальних кривих, одержимо лінії, які сходяться в точці К.
Лівіше лінії МК існує тільки рідка фаза, правіше лінії КN - тільки газ. Між пограничними кривими знаходиться область двофазного стану рідина -газ. Важливе значення в термодинаміці має існування критичної точки і критичних параметрів, які визначаються експериментально.
Можна отримати єдине рівняння стану в вигляді універсальної функції від безрозмірних параметрів
 ; ; 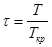 ; ; 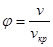
Які називаютьсяпрнведеним тиском, температурою і об'ємом.
Тоді рівняння Ван-Дер-Ваальса має вигляд

Стани речовин, коли вони мають одинакові приведені пара метри, називаються відповідними станами.
Речовини, які знаходяться в відповідних станах, називаються термодинамі чно подібними.
9.1 Властивості і процеси водяної пари
Найбльш широке викорнстанняв техніці знайшла водяна пара.
Процес переходу рідини в пару починається тоді, коли температура рідини досягне температури кипіння.
Насиченою парою називають пару, яка знаходиться в динамічній рівновазі із своєю рідиною. Насичена пара буває суха і волога.
Суха насичена гвра - це пара, яка не має рідини і має температуру кипіння tk при даному тиску. Двофазна система, яка складається із сухої насиченої парні рідини, називається вологою насиченою парою.
Відношення маси сухої пари тсп до маси вологої пари щ, mвn=тсп+тр називається стелінню сухості вологої пари.
Якщо д о сухої насиченої пари підводити теплоту, то її температура оуде збільшуватись Пара, температура якої при даному тиску більша від темпер атури кипіння (насичення), називається перегрітою парою.
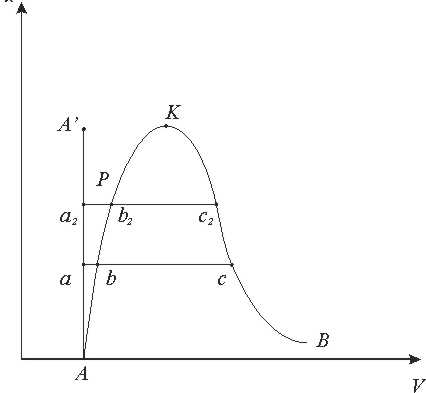
Рис. 9.1.1 рv –діаграма водяної пари.
Процес пароутворення.(рис 9.1.1)
Лінія АА0 - відповідає стану холодної рідини при різних тисках, яса має температуру 0°С. За початок відліку внутрішньої енергії u ентальпії h, ентропії s для в оди прийнято вважати трйнуточку води.
Стан киплячої абонасиченої рідини відповідає лінії АК.
Параметри киплячої рідини позначають буквами зі штрихами (vr, иr, hr, sr,і т.д). Параметри сухої насиченої пари позначаються буквами з двома штрихами (vrr, иrr, hrr, srr,і т.д.). Параметри вологої насиченої пари позначаються буквами з індексом х (vx, иx, hx sx i тд.). Кількість теплоти, яка необхідна для нагріву рідини до кипіння становить:
qр=hr=ср tk.
Зміна внутрішньої енергії при підігріві води:
∆uав=h-pk(vk-v0)
Зміна єнтротїе процесі а-b
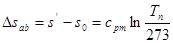
де tn Тn -температуранасичення
Процес пароутворення проходить при постійному тиску і постійній температурі, тобто є одночасно ізобарним і ізотермним
Лінія ВК - називається верхньою пограничною кривою. На лінії ВК х = 1, тобто сука насичена пара.
Кількість теплоти, яка витрачається на пароутворення в процесі b - с, називається теплотою пароутворення r.
r=hS-hr=Tn(sS-sr)
Подібний вигляд має Т - s діаграма водяної пари. Процес підігріву води до температури кипіння майже співпадає з лінією АК. Процес кигіння проходить при постійній температурі (лінія b - с). При подальшому підведенні теплоти температура зростає. Із діаграми (рис .9.1.2) видно, що гри підвищенні температури або тискутеплота пароутворення зменшується
Стан насиченої пари може бути визначеним, якщо крім тиску рн і температури tn буде відомий склад суміші киплячої води і сухої пари, яка характеризується степенню сухості х.
Питомий об'єм вологої пари можна визначити за формулою:
vx=xvS+(1-x)vr.
Дня звичайних умов vr<<vS тому другимдоданком можна знехтувати
Тоді
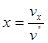
тобто любаточка ділить відрізок між b і с на частини, пропорційні степені сухості і степені вологості.
Очевидно, що енталшія і ентропія вологої пари може бути підрахована так
hx=hr+rx
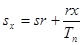
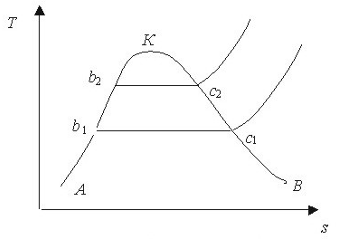
Рис. 9.1.2 Т s -діаграма водяної парн
Процес перегріву парн характеризується підвищеннями температури (t > tn ) при постійному тиску з а рахунок додаткового підведення теплоти.
Стан перегрітої гари визначається не одним, а двома незалежними параметрами - тиск омі температурою.
Кількість теплоти, яка необхідна для перегріву 1 кг сухої насиченої пари до необхідної температури при постійному тиску, називається теплотою перегріву qпер:
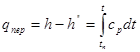
Або
q=h-hS=cpm(t-tn)
де Срт - середня теплоємність перефітої пари в інтервалі температур від tn до t. Зміна внутрішньої енергії парн буде рівна:
Зміна ентропії в процесі перегріву:

h -s діаграма водяної пари.
Дія практичних розрахунків процесів водяної пари широке застосування одержала h-s діаграма, в якій ентальпія і ентропія вимірюється лінйними відрізками.
На h –s діаграмі нанесені лінії:
- постійного вологовмісту x=const
постійної температури t=const
постійного тиску p=const
- постійного питомого об'єму v=const.
Координатну сітку діаграми утворюють лінії h=const s=const. В області вологої насиченоїпари ізотерми та ізобари співпадають
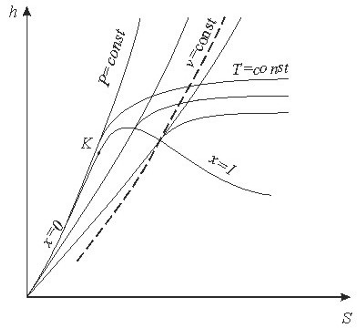
Рис 9.1.3 h s-діаграма водяної пари
9.2 Термодинамічний процес и у водяній парі
При розгляді різних процесів зміни стануводяної гари можуть зустрітися три випадки:
процес проходить повні стю в області насичення;
процесгроходить повні стю в області перегріву;
процес проходить частково в області насичення і частково в області перегріву.
Розрахунок процесів зміни стану водяної пари, тобто визначення всіх параметрів стану на початку і в кінці процесу, визначення кількості теплоти, роботи і зміни внутрішньої енергії можна визначити аналітично і графічно.
В розрахунках в основному використовується графічний метод, який полягає в знаходженні по hs-діаграмі числових значень пари в початковому і кінцевому станах. Нарис. 9.1.4. Показані термодинамічні процеси в Рv Ts, hs -координатах.
Параметри пари в початковому і кінцевому станах всіх процесів визначаютьпо розміщенні точок 1 i 2.

Рис. 9.1.4 Термоднівлічні процеси у водяній парі: а -ізохорнийпроцес;б -ізобарнийпроцес; в -ізотермічний процес;г - адіабатний процес.
Внутрішню енергію можна визначити за формулою u = h2-рv.
Необхідно відмітити, що перший закон термодинаміки виконується завжди.
Так для ізохорного процесу робота переміщення рівна нулю lv=0, а кількістьпідведеноїтеплотид q=Дu.
В ізобарному процесі qp=h2-h1, а робота розширення 1Р = р(v2-v1).
В ізотермічному процесі водяної пари. Kількість підведеної теплоти можна визначити із рівняння q=T(S2-S1), а робота lт=qт-Дu.
В адіабатичному процесі робота розширення пари чисельно рівна зміні внутрішньої енергії l=u1-u2=- Дu.
10. Вологе повітря
10.1 Параметри вологого повітря
В атмосферному повітрі завжди є певна кількість вологи у вигляді водяної пари. Суміш сухого повітря з водяною парою називається вологим повітрям.
Водяна парау вологому повітрі може бути в насиченому або перегрітому стані. Суміш сухого повітря і насиченої водяної пари називають насиченим вологим повітрям Суміш сухого повітря і перегрітої водяної пари називають ненасиченим вологим повітрям.
Температура, до якої необхідно охолодити ненасичене вологе повітря, щоб перегріта пара стала насиченою, називається температурою точки роси. При подальшому охолодженні вологого повітря (нижче температури точки роси) відбуваєтьсяковденсаціяводяної пари.
В атмосферному повітрі, як правило, пара знаходиться під невеликим парціальним тиском і в перегрітому стані. Тому вологе повітря можна розглядати як суміш ідеальних газів, за винятком того, що при певних умовах буде проходити конденсація водяної пари. Згідно закону Дальтона, тиск вологого повітря, рівний барометричному Рбар, являє собою суму парціальних тисків сухого повітря Рпов і водяної гари Рп , тобто:
Р= Рпов+ Рп
Стан перегріт ої пари в суміші характеризується на Р-v діаграмі точкою A (рис.10.1.1).
Якщо прн незмінній температурі t=сопst збільшувати кількість водяної пари, то її парціальний тиск буде збільшуватись до величини тиску насичення Рк (процес АВ) і пара стане сухою насиченою парою, а відповідно повітря насиченим волоіим повітрям Процесподальшого збільшення кількості водяної пари при t=сопst (процес В-Е) буде супроводжуватись частковою конденсацією, а кількість водяної пари в вологому повітрі буце запишатись незмінною
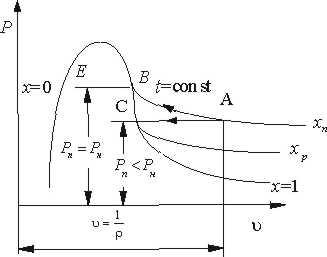
Рис. 10.1.1. .Р v - діаграма водяної пари в повітрі.
Таким чином, точка В відповідає максимально можливій кількості водяної пари у вологому повітрі при даній температурі, що є границею насичення
Процес насичення може проходити і при незмінній кількості водяної пари, якщо охолоджувати вологе повітря при постійному парціальному тиску водяної пари Рп (процес АС). В точці С пара стає шсиченою і при подальшому незначному зниженню температури створюється туман (випадання роси).
Дня характеристики пароповітряної суміші необхідно знатнії склад. Про склад вологого повітря судять по його вологості і вологовмісгу. Розрізняють абсолютну і відносну вологість.
Абсолютною вологістю повітря називається кількість водяної пари, яка знаходиться в 1м3 вологого повітря, тобто:
 (10.2) (10.2)
Оскільки об'єм вологого повітря vвп рівний об'єму пари vп то абсолютні вологість повітря рівна густині водяної пари ρn яка знаходиться у вологому пoвітрі.
Відношення абсолютної вологості ρn до максимально можливої абсолютної вологості ртaх приданому тиску і температурі повітря називається відносною вологістю.
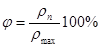 (10.3) (10.3)
Значення ф можуть змінюватися в межах від  = 0 (суке повітря) до = 0 (суке повітря) до  =100% (вологе насичене повітря). =100% (вологе насичене повітря).
Враховуючи, що пара, яка знаходиться в повітрі, розглядається як ідеальний газ, відношення густин по ізотермі АВ можна замінити відношенням тисків
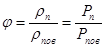 (10.4) (10.4)
Парціальний тиск в стані насичення Рn визначають із таблиць насиченої пари за температурою рівній температурі насиченого повітря tп =tn.пов. Парціальний тиск Рп знах одять т акож із таблиць за температурою точки роси.
Оскільки в процесах, які проходять з вологим повітрям (підігрів, охолодження), кількість сухого повітря тс.пов не змінюється, то слід всі питомі величини відносити до 1 кг сухого повітря. Маса водяної пари в 1 кг сухого повітря називається вологовмістом.
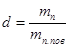 (10.5) (10.5)
При прийнятому допущенні про ідеальність водяної пари і повітря можна записати:
Pnvn=mnRnTnPповvпов=mповRповTпов
Вважаючи,що vп=vпов; Тп=Tпов, одержимо:
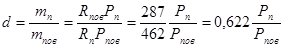 , ,
Врахуючи, що барометричний тиск
Р= Рпов+ Рп і Рп= Рпов (10.6) Рпов (10.6)
Гостину вологого повітря ρв.пов можна визначити як суму густини пари ρп . і густини сухого повітря ρпов. приїх парціальних тисках. Очевидно,що

Ентальпію вологого повітря відносять до 1 кг сухого повітря або до (1+d) кг вологого повітряі визначають як суму ентальпій 1 кг сухого повітря і d кг водяної пари, тобто
H=hпов+hnd=cp.повt+hnd (10.9)
Дня температур і тисків, які застосовуються в сушильній техніці, приблизно можнавважати cp.пов=1,0кДж/(кг К) ), а для водяної пари
hn=(r+ cp.mt)=(2500+1,9)tk Дж/кг
Тоді:
H=t+(2500+1,9t)dk Дж/кг.сух.пов (10.10)
10.2 Температура мокрого термометра
Коли температура води не рівна температурі повітря, в залежності від вологовмісту повітря, можна спостерігати випаровування води з її поверхні, або конденсацію водяної тири з повітряна поверхню води.
Біля поверхні води повітря завжди насичене, тому його вологовміст визначається парціальним тиском насиченої водяної пари, взятої при температурі води.
При різниці температур між повітрям і водою (tпов >tводи)виникає тепловий потік від повітря до води, температура останньої підвищується, що приводить до збільшення вологовмісту шару повітря, яке прилягає до поверхні води, за рахунок випаровування вологи. Одночасно збільшіться різниця вологовмісту між шаром гювітря, яке грилягає до поверхні води і основною масою повітря, яке знаходиться на деякій віддалі від води, що приводить до збільшення інтенсивності випаровування.
Коли тепгтота, яку одержує вода від повітря, стане рівною теплоті, яка витрачається на випаровування, підвищення температури води не відбувається. Таку незмінну температуру води називають температурою мокрого термометра.
10.3. Н-d діаграма вологого повітря
Визначення параметрів і дослідження процесів вологого повітря значно спрощується і стає нагляд ним, якщо використати h-d діаграму волого повітря, запропоновану в 1918 р. професором Л.К. Рамзіннм. На цій діаграмі (рис.10.3.1) по осі ординат відкладають значення ентальпії вологого повітря h кДж/кг сухого повітря, а по осі абсцис - вологовміст d г/кг сух.пов.
На діаграмі вісь абсцис направлена під кутом 135 до осі ординат. Тому лінія h = соnst нахилена під кутом 45 до горизонту. Для скорочення розмірів діаграми значення d з осі абсцис зносять на горизонтальну умовну вісь 0-0.
На діаграму наносять сітку ізотерм Ці ізотерми являють собою прямі з невеликим нахилом вверх. На кожній з них знаходять точки з однаковими значеннями  , а з'єднавши їх, одержують сітку кривих , а з'єднавши їх, одержують сітку кривих  = соnst. Крива = соnst. Крива  = 100% зображає стан вологого насиченого повітря і є граничною кривою. Ця крива розподіляє область ненасиченого вологого повітря (зверху) і область туману (знизу), в якій волога частково знаходиться в крапельному стані. Ліня = 100% зображає стан вологого насиченого повітря і є граничною кривою. Ця крива розподіляє область ненасиченого вологого повітря (зверху) і область туману (знизу), в якій волога частково знаходиться в крапельному стані. Ліня  = соnst. піднімається до ізотерми 99,4 ° С (температура насичення р = 745 мм.рт.ст.), після того майже вертикально піднімається вверх, так як при t >tm величина ф залежить тільки від d. = соnst. піднімається до ізотерми 99,4 ° С (температура насичення р = 745 мм.рт.ст.), після того майже вертикально піднімається вверх, так як при t >tm величина ф залежить тільки від d.
На діаграмі (рис. 10.3) нанесені також лінії (показані пунктирами) постійної температури мокрого термометра, яка відіювідає температурі води, якщо її поверхня оодуваєіься потоком ненасиченого вологого повітря Якщо поверхня води обдувається потоком насиченого повітря ( = 100%) то температура води буде співпадати з температурою повітря. Тому на h-d діаграмі ізотерми вологого повітря (сухого термометра) і мокрого термометра, які відповідають одному і тому ж значенню температур, перетинаються на лінії = 100%) то температура води буде співпадати з температурою повітря. Тому на h-d діаграмі ізотерми вологого повітря (сухого термометра) і мокрого термометра, які відповідають одному і тому ж значенню температур, перетинаються на лінії  = 100%. = 100%.
В нижній частині діаграми побудована по рівнянню (10.7) ліня парці ального тиску Рп = ƒ(d).
Стан вологого повітря на Н - d діаграмі (точка А) можна виїначиги за будь-якими двома параметрами ( і t або Рп і t після цього можна визначати h i d. Дія визначення температури точки роси із відповідної точки гроводягь вертикаль (d=соnst) до перетину з і t або Рп і t після цього можна визначати h i d. Дія визначення температури точки роси із відповідної точки гроводягь вертикаль (d=соnst) до перетину з  = 100% Ізотерма, що проходить через цю точку, буде відповідати температурі точки роси tp . = 100% Ізотерма, що проходить через цю точку, буде відповідати температурі точки роси tp .
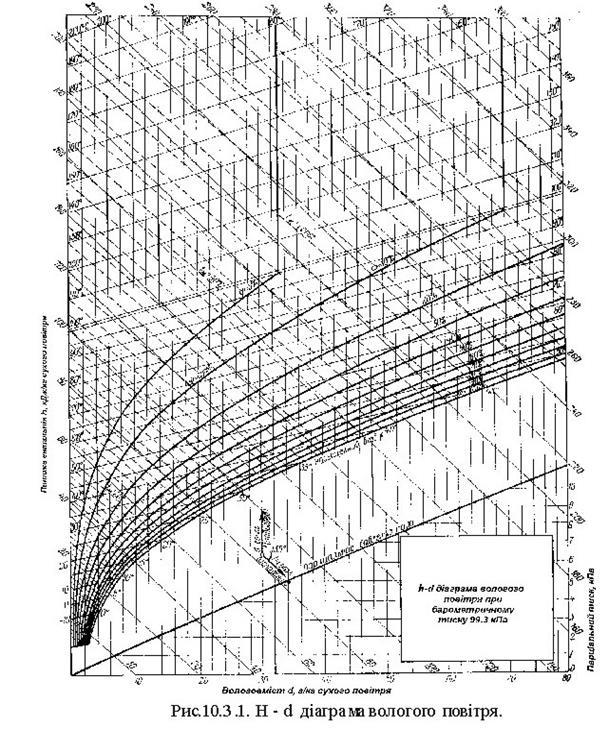
На h - d діаграмі показані основні процеси вологого повітря. Так, враховуючи, що в процесі підігріву вологого повітря (нагриклад, в калорифері
сушильної установки) кількість водяної пари не змінюється, процес підігріву буде зображатись вертикальною прямою d=соnst (А - В). При цьому температура повітря збільшується від tА до tВ а відносна вологість зменшується від  Aдо Aдо  B. Різниця ординат hB-hА дає витрати тепла на підігрів (1+d) кг вологого повітря. Теоретичний процес зволоження повітря в сушильній камері проходить по кривій h=соnst, так як частина ентальпії, затраченої на випаровування вологи, повертається в вигляді ентальпії водяної пари. На h - d діаграмі цей процес зображається відрізком ВД. Різницяй dA-dB визнач ає кількість вологи, випар еної 1 кг сухого повітря. B. Різниця ординат hB-hА дає витрати тепла на підігрів (1+d) кг вологого повітря. Теоретичний процес зволоження повітря в сушильній камері проходить по кривій h=соnst, так як частина ентальпії, затраченої на випаровування вологи, повертається в вигляді ентальпії водяної пари. На h - d діаграмі цей процес зображається відрізком ВД. Різницяй dA-dB визнач ає кількість вологи, випар еної 1 кг сухого повітря.
10.4 Визначення вологості повітря з температурою мокрого і сухого термометрів
Прилад для вимірювання відносної вологості повітря називається психрометром. Психрометр складається із двох однакових термометрів. Один з них сухий термометр, а другий термометр обгорнутий мокрою стрічкою
Мокрий термометр показує нижчу температуру, ніж сухий термометр. На h - d - діаграмі на перетині температур сухого tс і мокрого tm термометрів одержимо точку 1, по якій можна визначити відносну вологість  і вологовміст d. Відносну вологість можна визначити якщо використовувати психрометричні таблиці. і вологовміст d. Відносну вологість можна визначити якщо використовувати психрометричні таблиці.
11. Перший закон термодинаміки для потоку (відкритої термодинамічної системи)
Під відкритими розуміють термодинамічні системи, які крім обміну теплотою і роботою з навколишнім середовищем допускають ще й обмін масою.
Будемо розглядати лише одномірні стаціонарні потоки, в яких параметри залежать тільки від однієї координати, яка співпадає з вектором швидкості і не залежить від часу.
Умова нерозривності потоку полягає в однаковості масової витрати ш робоч ого тіла в будь - якому січенні
 (11.1) (11.1)
де F-площа поперечного січення, м ;
с - швидкість, м/с;
v -питомий об'єм, м /с.
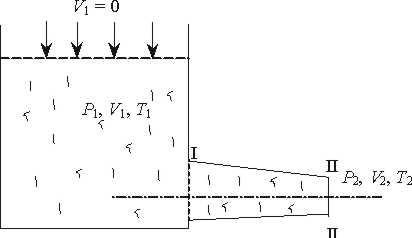
Рис 11.1. Схема процесу витікання із посудини необмеженої ємності.
По трубопроводу робоче тіло з параметрами Т1,р1,v1 поступає в тепломеханічний агрегат. Тут кожний кілограм робочого тіла одержує від зовнішнього джерела теплоту q і здійснює технічну роботу lтех , наприклад, приводячив рух ротор турбіни, а потім виходить із швидкістю с2, маючи параметри Т2,р2,v2. Оскільки перший закон термодинаміки виконується завжди, то можна записати:
q=∆u+l.(11.2)
При русі тіла по каналу може змінитись внутрішня енергія u2-u1 тіло виконує роботу на витіснення об'єму газу р1v1-р2v2 (рис.11.1). Якщо змінюється швидкість тіла, то частина енергії витрачається на зміну швидкості
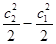
В процесі проходження по каналу робоче тіло виконує роботу lтех а такожвиконаєроботу на подолання сил тертя lтp .
Теплота, яка надається тілу в процесі його проходження по каналу, складається з зовнішньої теплоти і теплоти тертя. Тйким чином можна записати:
 (11.3) (11.3)
Враховуючи, що u+ рv = h , qтp =lтр ,запишемо:
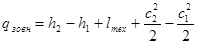 (11.4) (11.4)
Перший закон термодинаміки для потоку можна сформулювати так теплота, підведена до робочого тіла ззовні, витрачається на збільшення ентальпії робочого тіла, виконання технічної роботи і збільшення кінетичної енергіїпотоку.
В диференціальній формі рівняннязагишетьсятак:
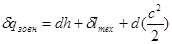
Використаємо перший закон термодинаміки до різних типів теплотехнічного обладнання.
Теплообмінний апарат
Для нього lтех=0 , а  тому тому
 =h2-h1 =h2-h1
Для теппообмінника, встановленого в потоці цей вираз справедливий не тільки в ізобарному процесі, але й в процесі з тертям, коли тиск середовица зменшуєтьсячерез опір.
2 Тепловий двигун
Як правило 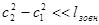 , ,  =0 тому робоче тіло виконує технічну роботу за рахунок зменшення ентальпії. =0 тому робоче тіло виконує технічну роботу за рахунок зменшення ентальпії.
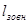 =h2-h1 =h2-h1 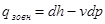
(перший закон термодинаміки),
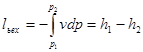
3. Компресор .
Якщо процес стиснення газу в компресорі проходить без теплообміну з навколишнім середовищем (qреn = 0) і с1 = с2, то 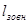 =h2-h1 де h2<h1. =h2-h1 де h2<h1.
11.1 Витікання
Канали, в яких проходить збільшення швидкості газу, називаються соплами.
Канали, в яких проходить зменшення швидкості - дифузорами. Процес витікання проходить без теплообміну з зовнішнім середовищем і його можна вважати адіабатним Згідно першого закону (11.4) термодинаміки для відкритих систем при  =0 і =0 і 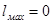
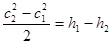
Швидкість с2 в адіабатному процесі можнавизначитиза формулою:
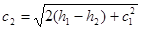
Приймаємо с1 = 0, оскільки с1<<с2 тоді
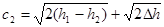
адіабатному процесі:
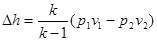 (11.7) (11.7)
Тоді
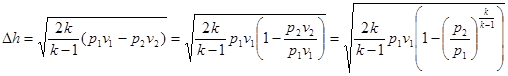 (11.8) (11.8)
Масові витрати газу шчерез сопла
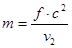
деƒ-площапоперечногоперерізу сопла, м3 ;
v. -питомий об'єм газу на виході із сопла
Для адіабатного процессу
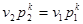 ; ;

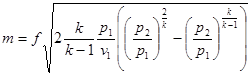 (11.9) (11.9)
Із виразу (11.9) можна зробити висновок, що масова секундна витрата ідеального газу при витіканні з великого резервуару залежить від площі вихідного січення сопла, властивостей і початкових параметрів газу, а також від кінцевого тиску р2
Якщо побудувати графік залежності
згідно (11.9), то одержимо
При р2=р1  =1, m=0; =1, m=0;
При р2=0  =0, m=0 =0, m=0
Якщо порівняти теоретично одержану криву (рис. 11.1) з експериментальною кривою залежності
 , ,
то від 1 до точки К криві співпадають. Від точки К дійсні масові витрати залишаються постійними.
Для того, щоб пояснити це розходження Сен-Венан в 1839 році висунув гіпотезу, що в соплі неможливо одержати тиск газу, нижчий ркр який відповідає максимальній витраті пари через сопло.

Рис. 11.1 Графік зміни 
Дня визначення максимуму функції

візьмемо першу похідну від виразу в квадр атних дужках рівняння (11 9).
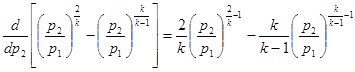 =0 (11.10) =0 (11.10)
Розділимо ліву і праву частиш рівняння (11.10) на
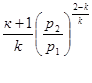
Одержима
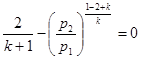
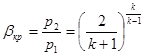
Звідси можна зробити висновок, що величина βкр є постійною величиною і залежить від величини показнік а аді абати.
Для одноатомного газу к = 1,66 і βкр =0,49.
Для двохатомногогазу к = 1,4 і βкр = 0,5 28. Для трьохатомного газу к = 1,3 і βкр =0,546.
11.2 Критична швидкість витікання
В рівняння для визначення швидкості
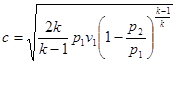
підставимо значення для βкр
 (11.12) (11.12)
Величина критичної швидкості визначається фізичннми властивостями і початковими параметрами газу.
Із рівняння адіабати випливає, що
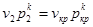
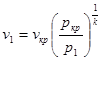
Замінюючи значення 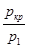 одфжимо: одфжимо:
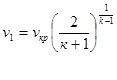
Врахуємо також, що
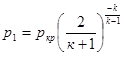
Підставляючи в формулу, одержимо:

 =а =а
- швидкість поширення звуку в середовищі. Таким чином критична швидкість газу при витіканні рівна місцевій швидкості звуку у вихідному січенні сопла.
Як відомо із фізики, імпульс тиску поширюється в стисливому середовищі із швидкістю звуку, тому, коли швидкість витікання менша, чим швидкість звуку, зменшення тиску за соплом передається потоком газу всередину каналу з відносною швидкістю с<а і приводить до перерозприділення тиску. В результаті у вихідному січенні сота встановлюється тиск, рівний тиску середовища.
11.3 Сопло Лаваля
Поставлена задача: побудувати такий профіль сопла, який би забезпечив повне перетворення потенціальної енергії потоку, яка відповідає перепаду тнскувід р1 до р2.
Проведемо аналіз рівняння суцільності потоку
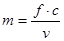 тv=fc . (11.13) тv=fc . (11.13)
Якщо продиференціювати рівняння тV=fc ,одержимо :
mdv=cdf+fdc (11.14)
Поділимо рівняння (11.14) на рівняння (11.13), одержимо:
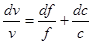
Для адіабатного витікання
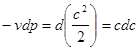 . .
Розділивши це рівняння на с2,одержимо:

Продиференціюємо рівняння адіабати рvk =const, одержима
kpvk-1dv+vkdp=0
Поділимо рівнянняна рVкk, одержимо:
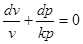 ; ;
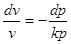
Підставимов рівняння (11.15) одержані значення, будемо мати:
 (11.15) (11.15)
де
a2=kpv
Проаналізуємо рівняння.
Оскількн kрс2>0, а dp <0, то в цілому діапазоні зміни швидкості витікання від 0 до с <а , <0, тобто профіль сопла повинен звужуватись. <0, тобто профіль сопла повинен звужуватись.
При с=0  =0 і f=fmin . =0 і f=fmin .
Із рівняння також можна зробити висновок, що при всіх швидкостях с>а,  >0 і профіль сопла повиненрозширюватись. >0 і профіль сопла повиненрозширюватись.
11.4 Максимальні масові витрати
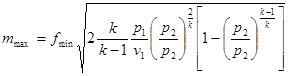
Якщо підставити
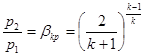
одеожимо:
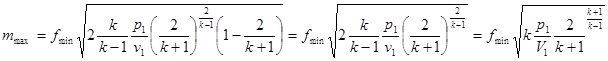
Якщо позначити
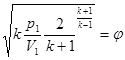 , ,
то одержимо
 (11.18) (11.18)
Мінімальне січення сопла :
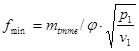
Площувихідногосічення fвих можнавичислити, якщоприйнятидоуваш, що в довжині каналу масові витрати залишаються постійними.
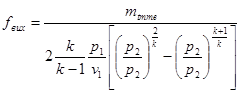
де р2 - тиск на виході рівний тиску навколишнього середовища кут а= 10-12°.

11.5 Розрахунок пронесу єипікшіняш допомогою h -s-діаграми
Розрахунок процесу витікання за допомогою h -s -діаграми проводять для водяної пари, оскільки вош не є ідеальним газом.
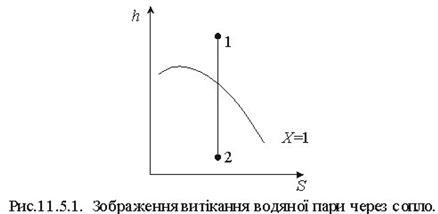
Процес витікання протікає при постійній ентропії і на h -s діаграмі позначається вертикальною прямою (рнс.11.5.1).
Швидкість витікання розраховують за формулою :

Якщо підставити h в кДж/кг, то с=44,7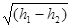 м/с. м/с.
Дня визначення критичної швидкості по h -s -діаграмі використовують метод послідовних наближень.
В першому наближенні задаються значенням k=1,3 і із співвідношення
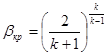
знаходим Ркр. Потім по значеннях ркр і sкр=s1 визначають питомий об'ємо vкр по h-s- діаграмі.
Із співвідношення для адіабатного процесу, маємо:
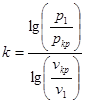
таким чином знаходять нове значення k. Розрахунки закінчують, коли значення k співпаде з прийнятим значенням.
11.6 Дійсний процес витікання
В реальних умовах процес витікання є необоротній, ентрогія в процесі зростає.

При цьому ж перепаді тисків різниця ентальпій менша, в результаті чого буде і менша швидкість витікання.
Відношення втрат в соплі до наявного теплоперепаду називається коефіцієнт втрати енергії в соплі ζ0
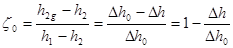
Якщо визначити ∆h=∆h0(1-ζ0) і підставимо його в формулу,одержимо:
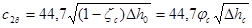
Відношення втрат в соплі до наявного теплоперепаду називається коефіцієнтом втрат енергіївсоті
Якщо визначити АН =А/їо(і-^)іпідставигийогов формупу, одержимо:
Коефіцієнт uс називається швидкісним коефіцієнтом сопла. Він представляє собою відношення дійсної швидкості ωд дотеоретишої.
φ=0,96-0,98 -для добре оброблених каналів.
Відношенні дійсної кінетичної енергії робочого тіла - до теоретичної називається коефщієнтом корисної дії канаяу.
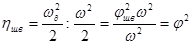
ККД рівний квадрату коефіцієнта швидкості газу.
Теплота тертя без врахування початкової швидкості визначається так
qTp=φ(h1-h2)
h1-h2-енгальпія робочого тіпана початку і в кінці оборотного гроцесу.
11.7 Дроселювання газу і пари
Дроселюванням називається необоротній процес, в якому тиск при проходження газу через вузький отвір зменшується без здійснення зовнішньої роботи
При проходженні газу через вузький отвір кінетична енергія газу і його швидкість в вузькому січенні збільшується, що приводить до падіння температури і тиску. За отвором, коли газ тече по повному січенні, швидкість знов знижується, а тиск підвищується, але до початкового тиску не доходить Деяка зміна швидкості про йде в зв'язку ззошьшеннямпитомого об'єму газу від зменш ення т ис ку.
Рівняння дроселювання. Нехай на початку трубопроводу є вуїький отвір (рис. 11.6.1.).
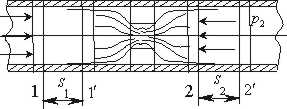
Рис 11.7.1. Схемапроцесудроселювання.
Січення 1-1і 2-2 в трубопроводі закриті невагомими поршнями, які можуть рухатись без тертя. На поршеньї площею Д діє тиск р1 а на поршень 2 площею А1 тиск Р2. Причому р1 >р2.
При русі газу поршень 1 перемістився в положення 1ґ, а 2 в 2ґі відповіднопройдугьшлях s1 і s2.
Для руху газу необхідно затратити роботу p1s1A1 або р1v1. Частина цієї роботи p2s2A2 або р2v2, буде витрачена на подолання сили р2, а різниця визве зміну енергії робочого тіла. →p1v1-p2v2
Якщо початкова швидкість газу ω1 і внутрішня енергія U1 кінцева швидкість ω2 і внутрішня енергія U2 то
p1v1-p2v2= U1- U2=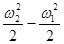
При умові, що швидкість ω1, і ω2 мало відрізняється одна від одної, їх зміною можна знехтувати
Тоді:
(U1+ p1v1)-( U2+ p2v2)=0 h1-h2= 0, h1= h2
Але оскільки ентальпія є однозначною функцєю температури то значення Т1 = Т2.
В результаті процесу дроселювання реального газу ентальпія для початкових і кінцевих значень залишається однаковою, ентропія і об'єм збільшуються тиск падає, а температура може збільшуватись, зменшуватись або залишатись так ою ж.
11.8 Ефект Джоуля -Тамсона
В кожному реальному газі є сили гритягання між молекуламн і якщо газ розширяється, то на збільшення віддані між частинками або на зміну їх внутрішньої потенціальної енергії тіла завжди затрачується робота, що зв'язано із зміною температури.
Відношення зміни температури реального газу при дроселюванні до зміни тиску в цьому процесі називається ефектом Джоуля-Томсона.
Дня ідеального газу ефект Джоуля-Томсона рівний нулю. Відповідно зміна температури реального газу при дроселюванні визначається відхиленням властивостей реального газу від ідеального, що обумовлено дією міжмолекулярних сил.
Процес дроселювання робочого тіла супроводжується затратою або здійсненням зовнішньої роботи р2v2 – р1v1 Так як при дроселюванні р2<р1 а і v2>v1, то різниця р2v2 – р1v1 до, може бути більша від нуля менша нуля і рівна нулю
Оскільки для адіабатного процессу
h1= h2 і u1+p1v1=u2+p2v2
або
u1-и2 = р2v2–р1v1 -рм,
то витікає, що зовнішня робота проштовхування здійснюється за рахунок зміни внутрішньої енергії. Внутрішня енергія складається з кінетичної і потенцальної. Потенціальна енергія завжди збільшується врезультаті збільшення об'єму.
Якщо р2v2–р1v1=0 , то потенціальна енергія збільшується і процес повинен супроводжуватись охолодженням газу.
При р2v2>р1v1 і и2 <u1 ще більше охолодження реального газу.
В деяких випадках р2v2–р1v1 може бути рівним зміні внутрішньої енергії і при цьому кінетична енергія залишається без змінні відповідно Т1= Т2. Такий випадок називається інверсією газу, а температура, при якій це проходить -температурою інверсії.
Розрізняють ефекти дроселювання: диференціальний температурний, при якому тиск і температура міняються на безкінечно малу величину і інтегральний температурний, коли тиск і температура міняються на кінцеву величину. Якщо тиск міняється на безконечно малу величину dр , то проходить безконечно мала зміна температури dТ1 =α1dр1 або
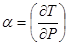
a1-називають дифферащальним температурним ефектом Джоуля -Томсона.

Стан реального газу при адіабатному дроселюванні, в якому диференційний ефект Джоуля-Томеона рівний нулю називається точкою інверсії.

Якщо початкова температура реального газу перед дроселюванням менша температури інверсії, то газ при дроселюванні охолоджується, якщо бльша, то газ нагрівається
Дослідження процесу дроселювання Ван- Дер-Ваальсового газу, а також дослідні дані з реальними газами показують, що реальний газ має безконечно велике число точок інверсії, які утворюють на р - T діаграмі інверсійну криву. Рівняння інверсійної кривої, якщо відомо рівняння стану реального газу , може бути отримано в явній формі із співвідношення
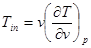 ; ; 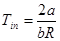
де а та b -постійні з рівняння (9.1).
При любому значенні тиску речовина має дві точки інверсії: одна знаходиться в області рідини, а друга в області перегрітої пари.
Температуру інверсії можна визначитичерез критичну температуру.
Ti=6,757Tkp,
Всі процеси дроселювання всередині кривої супроводжуються охолодженням речовини, а ззовні нагріванням.
12. Другий закон термодинаміки
12.1 Основні положення другого закону термодинаміки
Мжперетворенням теплоти в роботу і навпаки існує велика різниця: вся робота може бути перетворена в теплоту і навпаки, вся теплота не може бути перетворена вроботу.
Другий закон термодинамікидозволяє вказати напрям теплов ого потоку і встановлює максимально можливу границюперетвореннятеплотив роботу.
Суть другого закону термодинаміки вперше виклав Сади Карно. Він писав: "Всюди, де є різниця температур проходить виникнення рушійної сили. Рушійна сила тепла не залежить від агентів для її розвитку: її кількість виключно визначається температурою тіл, між якими в кінцевому рахунку проходить перенос теплоти Температура газу спочатку повинна бути як можливо вищою, щоб одержати значний розвиток рухомої сиди По тій же причин охолодження повинно бути як можливо нижчим Неможливо надіятись коли-небудь практично використовувати всю рухому силу."
В 50-х роках Клауіисом бугто дано формулювання другого закону термодинаміки у вигляді наступного постулату: 'Теплота, не може переходити від холодного тіла до більш нагрітого сама собою даровим процесом."
Одночасно з Клаузисом в 1851 р. Томсоном бугто сказано інше формулювання, наслідок якого такий: не вся теплота одержана від теплов іддатчнка можеперейтив роботу, алиш деяка її частина.
Значить, для одержання роботи необхідно мати джерело теплоти з високою температурою, або тепп овід датчик і джерело теплоти з низькою темпер атурою, або теплоприймач.
Робота в термодинамічних процесах можлива або в результаті підведення теплоти, або зміни внутрішньої енергії. При одноразовому циклі можна одержатиякусь визначену кількість теплоти. Для одержання заданої кількості теплоти цикл необхідно повторити. Отже для повторного одержання роботи необхідно в процесі стиску повернути робоче тіло в іючатковий стан (рисі 2.1). Якщо робоче тіл о розширюється по лінії 1,3,2, то робота рівна 1-3-2-4-5.

Повернення тіла в початковий стан може проходити по трьох кривих 2-3-1; 2-6-1; 2-7-1.
Цикл, в результаті якого одержується позитивна робота називається прямим циклом
Цикл, в результаті якого затрачується робота називається зворотним Цикл, який складається з врівноважених оборотних процесів називається оборотним В оборотному циклі робоче тіло повертається в точку 1 по лінії 2-3-1.
Дослідження любого оборотного циклу показує, що для його здійснення необхідно в кожній точці прямого процесу підводити тептоту від тепловіддатчиків до робочого тіла при безкінечно малій різниці температур і відводити теплоту такожпри безкінечно малій різниці температур.
В прямому термодинамічному циклі на шляху 1-3-2 тіло здійснює роботу L1 за рахунок гідведення тепгтоти і зміни внутрішньої енергії. На шляху 2-6-1 затрачуєтьсяпитома робота стиску L2 чисельно рівна пп. 426154, частина якої у вигляді питомої кількості теплоти q2 відводиться в теплоприймач, а друга витрачається на зміну внутрішньої енергії тіла.
Співвідношення між питомими кількостями теплоти і питомоюроботою визнач аєтьсяпершимзаконом термодинаміки
q1-q2=u2-u1+L
и2-u1=0 - оскільки початковий і кінцевий стан тіла співпадає.
Відношення питомої кількості теплоти, гкретвореної в позитивну роботу, до всієї кількості теплоти, підведеної до робочого тіла, називається термічним коефіцієнтом корисної дії прямого циклу
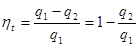 (12.1) (12.1)
Зворотний цикл проходить в напрям проти годинникової стрілки. Робота розширення менша роботи стиснення. Такий цикл може проходити тільки при затраті роботи ззовні.
В зворотному циклі від теплоприймача відводиться питома кількість теплоти q2 і затрачаться питома робота L , яка переходить в рівну питому кількість теплоти, які разомпередаютьсятепловіддатчику-
q1= q2+L. (12.2)
Степінь досконалості зворотного циклу визначається холодильним коефіцієнтом.
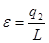 (12.3) (12.3)
Холодильний коефіцієнт показує, яка кількість теплоти віднімається від теплоприймачапризатраті одиниці роботи. Величина є може бути більшою 1.
12.2 Прямий оборотній цикл Карно
Кількість джерел теплоти може бути зменшена якщо на окремих у частках циклу теплота буде відводитись і підводитись при постійній температурі.
Здійснити оборотний цикл можна наступним чином: тепло підводиться до робочого тіла від тепловіддатчика при постійній температурі, і робоче тіло адіабатно розширюється до температури теплоприймача. Дальше в ізотермічному процесі проходить відвід теплоти від робочого тіла до нього. Замикаючим цикл п овинен бути процес адіабатного стиснення
За весь цикл Карно (рис. 12.3.1) до робочого тіла від тегшовіддатчика була підведена кількість теплоти q1 і відведена в теплоприймач питома кількість теплоти q2 .
Термічний ККД циклу
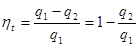
Підведена кількість тегшотипоізотермі 1-2 визначається так:
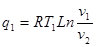
Абсолютне значення відведеної питомої кількості теплоти по ізотермі 3-4 буде становити:
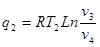 . .
Підставляємо знайдені значення в рівняння для термодинамічного ККД.
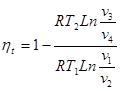 (12.4) (12.4)
Для адіабатного процесу розшир енняі стиснення відповідн о маємо:
 і і 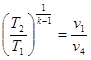
Звідси

або
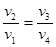
Відповідно формула для визгачення термодинамічного ККД циклу Карно після скорочення приймає вигляд
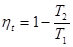 (12.5) (12.5)
Аналізуючи рівняння (12_5) можна зробити на ступні висновки:
термодинамічний коефіцієнт циклу Карно залежить тільки від абсолютних температур тепловіддатчика і теплоприймача;
термодинамічний ККД буде тим більшим, чим вища температура теплоприймача і нижча температура тептовіддавача.
12.3 Зворотний оборотний цикл Карно
В зворотному процесі (рис. 12.3.2) робоче тіло відводить тепло від джерела теплоти з нижчою температурою і віддає джерелу теплоти з вищою температурою. Для виконання та кого процесу необхідно затратити роботу L.
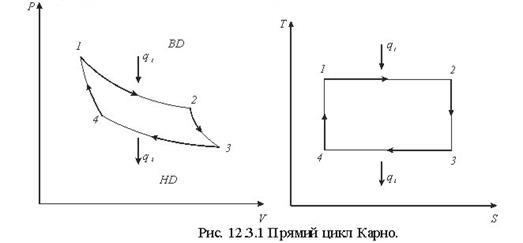
В зворотному процесі робоче тіло від т.1 розширюється до т.4 по адіабаті 1-4 без теплообміну з зовнішнім середовищем.
Температура Т1 зменшується доТ2
Потім розширення проходить по ізотермі 4-3 з підводом теплоти q2 , яка віднімається від джерела з низькою температурою Т2. 3-2 лінія адіабатного стиснення 2-1 - ізотермічний стиск з відводом теплоти до джерела з вищою температурою.
Робота стиснення більша роботи розширення на величину пл.14321 всередині замкнутої лінії циклу.
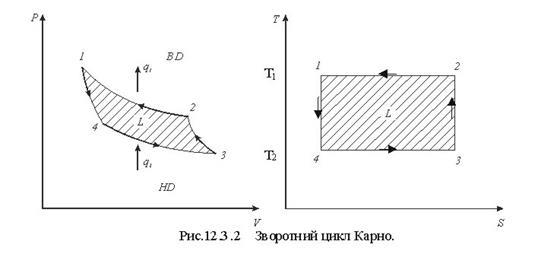
Теплота, яку одержує теплоприймач:
q1= q2+L
Характеристикою ефективності холодильних машин є холодигтьний коефіцієнт.
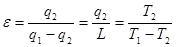
12.4 Властивості оборотних і необоротних циклів, математичний вираз другого закону термодинаміки
Розглян емо оборотний цикл
Із визначення термічногоККД слідує, що

а для оборотного циклу
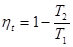
Якщо прирівняти ці два вирази, то
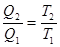
або

Якщо рахувати підведену роботу позитивною, а відведену негативною, то
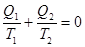
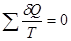 (12.6) (12.6)
Відношення підведеної або відведеної теплоти до відповідної температури називається привединою теплотою Можна сформулювати так: алгебраїчна сума приведеної теплоти для оборотного циклу Карно дорівнює нулю
Це може бути використано і для любого оборотного циклу. Люоий довільний процес 1-2-3-4-1 може бути розглянутий як сума елементарних циклів Карно (рис 12.4.1), якщо цей цикл розбитий відповідними адіабатами.
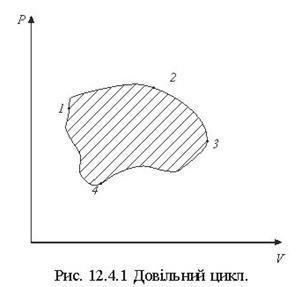
Дня кожного елементарного цикла Карно 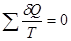 і для всього цикла. і для всього цикла.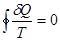 Таким чином, Таким чином, 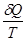 - є повний диференціал дня деякої функції, яка залежить від даного стану тіла. Такою функцією, єентропія. Отже: - є повний диференціал дня деякої функції, яка залежить від даного стану тіла. Такою функцією, єентропія. Отже:
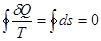
Рівняння представляє собою математичний вираз другого закону термодинаміки для довільного оборотного циклу і називається першим інтегралом Клаузиса. Для необоротних процесів ηtнеобор <ηtобор
або
 ; ;  ; ; 
Поскількн  є величина від'ємна, то дпянеоборотнихпроцесів є величина від'ємна, то дпянеоборотнихпроцесів
  (12.7) (12.7)
Для робочого тіла, яке здійснює замкнений цикл ds = 0. Отже,
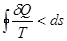
Нерівність представляє собою математичнийвираз другогозакону термодинаміки для довільного необоротного циклу і назива ється другим інтегралом Кпаузіса. .Якщо оо^єднати дві формули то одержимо:

12.5 Змінна ентропії є оборотних і необоротних процесах. Закон Гюі-Сподоли
Розглянемо ізольовану термодинамічну систему яка складається із джфела теплоти з температурою Т1 холодильника з температурою Т2 <Т1 і робочого тіла, яке здійснює оборотний цикл Карно між джерелом теплоти і холодильник ом
Робота, яку виконує система
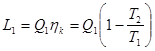
Встановимо між джерелом теплоти Т1 і робочим тілом джерело теплоти Т1’ (рис.12_5.1). Ця ж сама кількість теплоти спочатку в необоротному процесі від джерела з температурою Т1 передається джерелу з температурою Т1’, а дані в оборотному процесі робочому тілу.
Тоді робота, яку вік онає система:

Зменшення роботи із-за необоротності процесу передачі теплоти від джерела з температурою Т1 до джерела з температурою Т1’
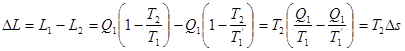 (12.8) (12.8)

Рівняння (12.8) називається рівнянням Гюі-Сто доли.
Таким чином зменшення роботоздатності ізольованої термодинамічної системи (в результаті протікання в ній необоротних процесів пропорційно збільшенню в ній ентропії). Іншими словами ентропія є мірою деградації енергіїв ізольованій термодинамічній системі.
Енергія системи, залишаючись незмінною кількісно (Q1 =const), погіршується якісно, переходячи в тепл оту низькотемпературного потенціалу.
Другий закон термодинаміки по суті є статистичним законом, який характеризує необоротність процесів, яа протікають в кінцевих ізольованих системах.
13. Термодинамічні основи компресора
Компресором називається машина, яка служить для стиснення газу і пари і транспортування його до споживача.
По принципу стиснення робочого тіла в компресорі ці машини класифікуються на дві основні групи: перша -поршневі, гвинтові і ротаційні, друга -лопатеві.
В першій групі машин стиснення робочого тіла здійснюється шляхом зменшення його об'єму, в другому - шляхом руху потоку по канапах змінного січення
Задачею термодинамічного аналізу компресора є визначення роботи, яка витрачається на стискання робочого тіла при заданих початкових і кінцевих параметрах.
На рис.13.1. показана принципова схема одноступеневого компресора і теоретична індикаторна діаграма , яка показує залежні сть тиску робочого тіла в циліндрі від ходу поршня на протязі одного оберту поршневого вала, або від змінного обєму робочого тіла в циліндрі. При русі поршня від крайнього лівого положення в праве, в циліндрі машини через всмоктуючий клапан δ поступає газ, який при наступно му русі сграва наліво (при закритих клапанах а і b ) стискається від тиску р1 до р2. При досягненні газом тиску р2 відкривається випускний клапан b і тоді при подальшому русі поршня справа наліво буде проходити процес виштовхування газу із щліндра компресора в нагнітальний трубопровід. Коли поршень прийде в крайнє ліве положення, відкривається впускний клапан і процес починається знову.
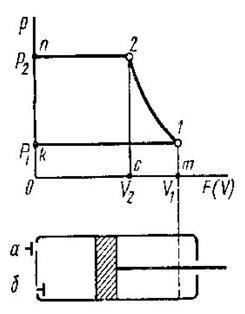
Рис.13.1. Принципова схема одноступеневого поршневого компресора і теоретична індикаторна діаграма.
Робота Lk, яка витрачається в компресорі за один оберт вала рівна сумі робіт всмоктування газу в циліндр L0,1 стиснення його в циліндрі L1,2 і виштовхування газу з циліндра L2n тобто
Lk= L0,1+ L1,2+ L2n=-Lтех
де Lтех-технічна робота компресора.
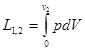 о о
оскільки V1>V2 на індикаторній діафамі робота L1,2 позначається площею під кривою процесуі-2;

Оскільки в процесі всмоктування тиск постійний; на індикаторній діаграмі робота L0,1 позначається площею під прямою к-1
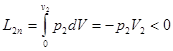
Робота L2n означ аєть ся площею підпрямою 2-п.
На індикаторній діаграмі технічна робота компресора позначається площею
Якщо стискається ідеальний газ, то робота стиснення газу впопітропному процесі

а відповідно технічна робота компресора
В рv- діаграмі робота може бути представлена площею, обмеженою кривою процесу стискання 1-2, початковою і кінцевою абсцисами і віссю ординат (рис 13.2). Процес стискання газу в циліндрі компресора проходить настільки швидко, що теплообмін його через стінку малий і процес мсснта рахувати адіабатним (п = к). Якщо компресор має теплову сорочку, яка забезпечує ізотермічне стиснення газу в циліндрі п = 1, то мінімальна технічна робота буде при ізотермічному стиснені.
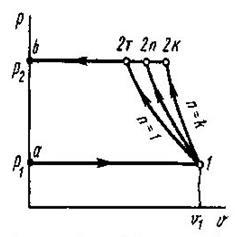
Рис 13 2 Порівняння роботи адіабатного, політропного і ізотермічного стискання в компресорі
Реальний процес стиснення газу гредставляє собою політропу, яка знаходиться міжадіабатоюі ізотермою

Кількі сть теплоти, яка відводиться від 1 кг ідеального газу в процесі його стисненняв циліндрі компресора

Дійсна індикаторна діаграма стиснення газу в щліндрі представлена на рис. 13.3
Продуктивність реального компресора за один оберт валу в результаті наявності шкідливого простору буде рівна Vд =V1-V4-дійсному об'єму газу, який поступає в циліндр. Відношення шкідливого об'єму газу Vо до корисного об'єму цигтіндра Vкор називають коефіцієнтом шкідливого простору і позначають Ео. Ця величина залежить від конструкції поршневого компресора і коливаєтьсявмежах 0,05...0,1.
Відношення дійсного об'єму газу Vд, який засмоктується в цилівдр до корисного об'єму циліндра Vпов називається коефіцієнтом об'ємного наповнення циліндра і позначається X
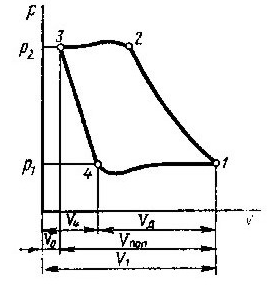
Рис 13 З Дійсна індикаторна діаграма стиснення газу в компресорі
14. Котельна установка
Пристрої, які служать для одержання пари або гарячої води гідвищено го тиску за рахунок теплоти, яка виділяється при спалюванні палива, або теплоти, яка підводиться від постійних джерел теплоти, щзиваєть ся котельним агрегатом. Вониподіляютьсяна парові і водонагрівні котли. Котельні агрегати, які використовують теплоту газів,що відводяться із печей, або інших гродуктів різних технологічних гроцесів,називаютьсякотлами-утилізаторами.
Котельні агрегати оснащують додатковим обладнанням, яке служить дгтя підготовки і подачі палива, подачі повітря, очистки і подачі води, Еідведення продуктів згорання палива і їх очистки від попелу і токсичних домішок, відведенняпотелошлакових залишків палива.
Комплекс пристроїв, які вкалючають в себе котельний агрегат і допоміжне обладнання назива ється котельною установкою.
Джерелом теплоти длякотельнихустановок є природне і штучне паливо.
Технологічна схема котельної установки показана нарис. 14.1.
Паливо з вугільного складу після подрібнення подається конвейєром в бункер сирого вугілля 1, з якого подається в систему пиле приготування, яка має вуглеподрібнювальний млин 2. Пилеподібне паливо за допомогою спеціального вентилятора 3 транспортується по трубах в повітряному потоці допальників 4 пі чкикотла 5, який знаходиться в котельній 14. До пальників підводиться такожвторннне повітря дуттєвим вентилятором 13 через повітрепідігрівач котла 10. Вода для живлення котла подається в його барабан 7 живильним насосом 12 з баку живильної води 11, який має деаераційний пристій Перед подачею води в барабан вона підігрівається в водяному економайзері 9 котла. Випаровування води проходить в трубній системі 6. Суха насичена пара із барабану поступає в пароперенагрівач 8 потім направляється до споживача

Рис 14 1 Технологічна скема котельної установки: а-водяний тракт, б-перегріта пара, в-паливний тракт, г-шлях руку повтря, д-тракт продуктів згорання, е-шляк попелу і шлаку, 1-бункер топ лив а, 2-вуглерознольний млин, 3-нлинний вентилятор, 4 -пальник, 5-контур шчки і газ ох одів котельного агрегата, 6-екрани пічки, 7-ЄараЄан, 8-пароперегрівач, 9-водяний економайзер, 10-повітр є підігрів ач, 11-бак запасу води з деаераційнин пристроєм, 12-живильний насос, 13-вентилятор, 14-контур будівлі котельної (приміщення котельного відділення), 15-попеловлювлюючий пристрій, 16-димоедсмоктувач, 17-димова труба, 18-насоснадля вдкачкипопелошлакової пульпи
Паливно-повітряна суміш, яка подається пальниками в гічкову камеру паровогокотла згорає, утворюючи вис окот емпературний (1500°С) факел, який випромінює тепло на труби 6, розміщені на внутрішній поверхні стін пічки. Це - випаровувальні поверхні нагріву, які називаються екранами. Віддавши частину теплоти екранам, пічкові гази з температурою біля 1000°С переходять через верхню частину заднього екрану, труби якого тут розташовані з великими проміжками (ця частина труб називається фестонними) і омивають пароперегрівач.
Поті м продукти згора ння рухают ься ч ерез в одяний економайз ер, повід трелі ді грів ач і покидають котел з температурою, яка перевищує 100°С Відведені гази очищаються від попелу в попелоуловлювачі 15 і димососом 16 викидаються в аг мо сферу через димову трубу 17.
14.1 Паровий котел і його основ ні елементи
Найпростішим паровим котлом є простий паровий котел, виконаний в ввді горизонтального б ара ба ну з пічкою під ним (рис. 14.1.1). Стінки барабану були одночасно і поверхнею нагріву. В подальшому для збільшення поверхні нагріву йшли по двох парямках. В одному випадку безпосередньо в водяному просторі барабану розміщались великі і мані труби, при цьому великі були одночасної пічкою (котли з жаровими трубами). В другому випадку до барабану приєднувались додаткові зовнішні тр^би -кип'ятильні пучки, заповнені водою (водотрубні котли). В котлах цього типу рух середовища через пучок кип'ятильних тр^б забезпечувався підйомом легкої пароводяної суміші, яка витісняється поступаючою з барабану більш холодною водою, яка не має бульбашок пари.
Сучасний паровий барабанний котел складається із пічкової камери і газоходів, барабану, поверхонь нагріву, повітрегідігрівача, які знаходяться гід тиском , з'єднувальних паропров одів і трубопроводів. Опускні труои більшого діаметру з'єднують барабан з колекторами , з яких вода поступає в екрані труои (розміщені в пічці). Барабан, опускні труби, колектор, екрані труои утворюють циркуляцйний контур. В барабані проходить розділення пари і води.
Походу димових газів може бути розміщений конвективний пучок труб, водяний економайзер (для підігріву води) і повітрепіді грівач. Ці поверхні нагріву називаються хвостовими. Температура димових газів після пароперегрівачазннжуєтьсявід500-700°С до 100-120 °С.
Вся трубна система і барабан котла підтримуються каркасом, який який складається із колон і поперечних балок. Пічка і газоходи захищені від зовнішніх тепловтрат обмурівкою - шаром вогнетривких і ізоляційних матеріалів.
15. Паливо. Процеси горіння
15.1 Основні характеристики
Паливом, називаються речовини, які використовуються для одержання значної кількості теплоти.
Волога 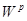 ділиться на два види: повітряну ділиться на два види: повітряну 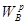 , яку відводять при кімнатній температурі і гігроскопічну , яку відводять при кімнатній температурі і гігроскопічну 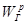 яка відводиться в сушильній шафі при температурі 102-105 °С Відповідно яка відводиться в сушильній шафі при температурі 102-105 °С Відповідно
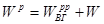
Паливо, з якого відведена волога, називається абсолютно сухим, або аналітичною пробою. Так як робоче паливо відрізняється від аналітичної проби вмістом  то то
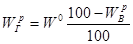
Склад аналітичної маси палива
С0+ Н0 + О0 + N0 + Sn0+Аа +W0=100%
Найбльш важливою і стабільною є горюча маса. .Якщо відомо склад горючої маси зольність 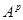 вологість вологість 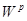 , то можна знайти елементарний склад робочого палива , то можна знайти елементарний склад робочого палива
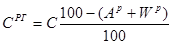
Важливою характеристикою палива є теплота згоряння. Теплота згорання - це кількість теплоти, яка виділяється при повному згорянні одного кілограма твердого палива і при охолодженні продуктів горіння до початкової температури процесу.
В паливі є три горючих компоненти - С, Н,S.
Розрізняють вищу 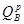 і нищу і нищу  теплоту згоряння палива. Різниця між ними полягає в тому, що в вищу теплоту згорання палива входить кількість теплоти, яка може бути виділена прнконденсаціїводяноїпарн, яка знаходиться в гродукгахзгоранняпалива. Тобто теплоту згоряння палива. Різниця між ними полягає в тому, що в вищу теплоту згорання палива входить кількість теплоти, яка може бути виділена прнконденсаціїводяноїпарн, яка знаходиться в гродукгахзгоранняпалива. Тобто
 ; ; 
Де r-питома теплота пароутворення;
Gn - маса пари, кг.
В відповідності із реакцією горіння
2Н2 + О2 =2Н2О.
При згоранні 1кг водню утворюється 9 кг водяної гащ плюс кількість вологи яка міститься в паливі. кг водяної гащ плюс кількість вологи яка міститься в паливі.
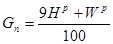
Питома теплота пароутворення r = 2500кДж/кг. Відповідно:
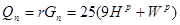
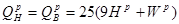
Теплота згоряння палива залежить від температури, при якій проходить процес спалювання, але як правило подають дані при температурі 20°С.
Експериментально теплоту згорання визначають шляхом спалювання в калориметрах.
Для порівняння енергетичної вартості різних видів палива вводять поняття умовного палива, теплот а згорання як ото прийнята рівною
Qуіл = 29,33Дж/кг .
Баластом робочого палива є сірка,попіл і волога.
Сірка хоча й горить входить в склад баласту оскільки утворює шкідливі речовини.
Склад сірки в торфі, дровах, малоефірнистій нафті - 0,3-0,4%, антрациті, кам'яному і бурому вугіллі 2-6%.
Погіл, який утворюється після горіння має вигляд сипучої маси або сплавлених кужів -шлаку. При температурах горіння попіл розм'якшується, а поті м плавиться.
Плавкість попелу х аракгеризуєть ся тема ературами початку
Деформації t1,розм'якшення t2, рідкого стану t3.
В залежності від температури рідкого стану попелу розрізняють
Легкоплавкий - tз <1200°С
Середньоплавкий- tз <1200ч 14000С 14000С
Тугоплавкий – t3 >1400°С.
Вихід ляетких речовин. При нагріві палива без доступу повітря проходить термічний розклад палива з виділенням летких речовин і твердого нелеткого залишку.
В складлеткихречовинвходять гази: СО2,СО,СтНт, Н2S.
В склад нелеткого залишку входять вуглець С (кокс) і попіл А
Вихід летких речовин коливається від 4% для антрациту, до 85% для нафти.
Процес сухої перегонки при t = 1050-1100°С називається коксуванням.
Характеристики окремих видів палива. Торф - найбільш молоде паливо. Вихід летких речовин 70%, вологість 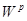 = 40...50%, нижча теплота згорання = 40...50%, нижча теплота згорання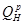 =8,37...10,47 МДж/кг =8,37...10,47 МДж/кг
Буре вугілля використовується як енергетичне паливо місцевого значення. Середній склад: С°-68%; Н° -5,5%; О0 - 25,0%; N0 -1,0%
Нижча теплот а згорання 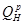 = 27200 kДж/кг = 27200 kДж/кг
Характеризується високою сірчистістю, 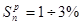 попільністю АР = 10 попільністю АР = 10 25 % і вологістю Wр=30%. 25 % і вологістю Wр=30%.
Кам'яне еугтля - об'єд ну є багато видів палива. Д0 числа загальних ознак, які відрізняють кам'яне вугілля від бурого і торфу відносяться: відсутність видимих неозброєним оком слідів рослинних залишків, мала гігроскопічність W0 <10%, загальна лужна реакція продуктів сухої перегонки, висока теплота згоряння.
В основу класифікації покладений вихід летких речовин VГі характеристика нелеткого залишку. Марки палива:
Д-довгополум'яний, Г- газовий, ГЖ— газовий жирний,Ж-жирний, КЖ-коксовий жирний, К— коксовий, ОС-отощений сгікниц СС- слабосгікний, Т— тощий, ПА-напівантрацит, А-антрацит.
Кам'яне еугтпя класифікується також по розміру кусків, мм.
К- крупне (50 -100), О- оріх (25- 50),М- мілке (13-25), С- сім'я (6-13), Ш— штиб (< 6), Р— рядовий (не обмежений).
Горючі спанщ представляють собою суміш сапропелітових (нафтоподіоних) продуктів, утворених в результаті розкладу багатих жирами водних мікроорганізмів, які закінчили свою життєдіяльність з мінеральними речовинами, які попалив сапропелітові накопичення в результаті обвалів.
Характеризуються високим виходом летких речовин (до 85%), високим вмістом водню (цо 10%) і високою попільністю (до 10%). Нижча теплота згорання 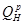 =5,87 =5,87 10 МДж/кг . 10 МДж/кг .
Нафта - складна система вуглеводів різного складу. Розрізняють 6 її типів. Основні із них - метанова і нафтонова.
Нафту класифікують по вмісту сірки (малосірчиста 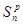 <0,5%, висок о сірчиста <0,5%, висок о сірчиста 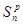 <3,5%)9 смолистих речовин і по температурі застигання масляної фракції (малопарафіниста tзаат <-16°С, парафіниста tзаат <3,5%)9 смолистих речовин і по температурі застигання масляної фракції (малопарафіниста tзаат <-16°С, парафіниста tзаат  -15 до + 20°С, високопарафіниста tзаат >20°С). -15 до + 20°С, високопарафіниста tзаат >20°С).
Для енергетики використовують тільки відходи нафтопереробної промисловості - мазути.
Теплота згоряння мазуту 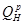 =39200КДж/кг. Важливою характеристикою мазутів є їх відносна в'язкість, виражена в градусах Енглера. В залежності від цього мазути позначаються марками 40,100,200. =39200КДж/кг. Важливою характеристикою мазутів є їх відносна в'язкість, виражена в градусах Енглера. В залежності від цього мазути позначаються марками 40,100,200.
Газоподібне паливо. В котельних установках використовується природній і доменннйгаз.
Склад газоподібного палива представляють в об'ємних відсотках горючих інегорючих газів.
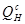 = 128СО2 +107H2 + 355СН4+628CmHn = 128СО2 +107H2 + 355СН4+628CmHn
Природні гази поділяються надві групи: сухі гази чисто газовихродовищ і попутні "жирні гази", які супутні нафтодобуванню. Теплота згорання сухого природного 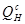 =35,52 =35,52 35,61 МДж/кг 35,61 МДж/кг
15.2 Горіння палива
Горінням, називають процес швидкого окислення горючого у висок отемпературн їй зоні.
Температура запалювання - це температура, до якої необхідно нагріти паливо і необхідне для його горіння повітря, щоб почалось інтенсивне з'єднання елементів палива з киснем повітря.
Температура запалювання становить для кам'яного вугілля 300- 350 С, метану 650-7500С дров225-280°С, антрациту 650-700°С.
Дня газоподібних палив існує межа, за границями якої горіння палива неможливе.
Основним джерело м теплоти для підігріву горючої суміші до температури запалювання є теплота продуктів згоряння
При спалюванні твердого палива велике значення має час згорання, який впливає на розміри пічкової камери
τг=τд+ τк
де τд - час дифузійних проц есів;
τк час на кінетичні процеси виконання хімічних реакцій.
Швидкість протікання хімічних реакцій пропорційна концентраціям реагуючих речовин і визначається за формулою:
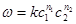
Де с1 і с2-концентрації реагуючих речовин;
к -постійна реакції.
Постійна реакції, яка залежить від природи реагуючих речовин оцінюється формуггою Арреніуса:

де Е- енергія активації, кДж/кмоль ;
R-універсальна газова стала;
к0 - визначається експериментально.
Енергія активації необхідна для послаблення і руйнування зв'язків.
Для газових сумішей Е = 85 -170 кДж/кмоль.
15.3 В шпроти повітря для горіння палива
Мінімальна кількість повітря необхідна для повного згоряння палива називається теоретичною кількістю повітря. її можна визначити використовуючи реакції горіння:
С + О2=СО2S+О2=8О2
2С+О2=2СО 2Н2 + О2 = 2Н2О
СО + О2 = 2СО2 СН4 + 2О2 = СО2 + 2Н2О
Наприклад, ізреакцїповногозгорання вуглецю ввдно, що для повного згорання вуглецю масою 2кг необхідно 32кг кисню і в результаті цього утвориться 44кг СО2.
Тобто для згорання 1кг С необхідно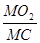 кг О2. При кількості вуглецю Сp кг О2. При кількості вуглецю Сp
в 1кг палива потрібно  кг О2= кг О2=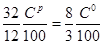
Загальна кількість кисню визначається за формулою:
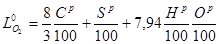
Враховуючи, що кисню в повітрі 0,231%, а також питому вагу сухого повітря 1,293кг/м3, одержима ,
V0=0,0889(Cp+0,375Sp)+0,265Hp-0,0333Op ,м3/кг
Відношення дійсної кількості повітря до теоретично необхідної, назвається коефіцієнтом надтіищ повітря:

Цей коефіцієнт залежить від виду спалюваного палива, конструкції пічки і способу перемішування палива зповітрям
16. Аналіз циклів теплових двигунів. Двигуни внутрішнього згорання
Теплові установки поділяють на теплові двигунн, в яких здійснюється прямнй цикл з віддачею роботи зовнішньому споживачу і на холодильні установки, які працюють по зворотньому циклу проти годинникової стрілки з затратою роботи, яка підводиться ззовні.
В свою чергу теплові двигуни можна розділити на три основні групи: двигуни внутрішнього згорання, в яких процес підводу теплоти і перетворення її в роботу проходить в середині циггіндра двигуна; газотурошні установки і реактивні двигуни, в яких процес горіння палива є ча ситною робочого процесу, паросилові установки, де теплота надається робочому тілу в окремому агрегаті - паровому котлі, а перетворення теплоти в роботу - впаровійтурбіні.
Огільним дггя циклів теплових двигунів перших двох груп є використання в якості робочого тіла газоподібних продуктів горіння, які на протязі щклу знаходяться в одному і тому ж стані і при відносно високих температурах їх можна вважати ідеальним газом Характерною рисою теплових двигунів третьої груги є використання таких робочих тіл, які в циклі мають фазові зміни і гідчиняються законам реальних газів.
Аналіз циклів теплових двигунів гроводягь в два етапи:
Спочатку аналізують теоретичний (оборотний), а потім реальний (необоротний).
Степінь досконалості теоретичних циклів повністю характеризується величиною термічногоККД
ηt=lo/qi=(q1-q2)/q1=1-q2/q1 (16.1)
де q1-кількість гідведеноїтеплоти;
q2 -кількість відведеної теппоти.
Ефективність реального необоротного циклу оцінюється внутрішнім ккд.
ηi=li/q1 (16.2)
де lі, -дійсна робота в необоротному циклі.
Для встановлення степеня необоротності циклу використовують поняття відносного внутрішнього ККД, який представляє собою відношення дійсної роботи li до теоретичної lо:
η0i=li/l0 (16.3)
Коефіцієнт показу наскільки реальний цикл менш досконалий, ніж теоретичний.
ηi=ηt∙η01
Крім необоротних втрат, які враховує внутрішній ККД, в теплосиловій установці є ряд інших втрат (втрати теплоти в навколишнє середовище, на тертяв підшипниках).
Відношення дійсної корисної роботи lB відданої споживачу до кількості затраченої теплоти q1 називається ефективним ККД:
ηB=lB/q1 (16.4)
В реальних необоротних процесах (циклах) теплових двигунів спостерігається необоротність двох видів: викликана наявністю тертя і завихрення в потоці робочого тіла і обумовлена наявністю кінцевої різниці темпер атур.
Оцнка ефективності циклів теплових двигунів методом ККД враховує втрати, викликані внутрішньою необоротністю, але не враховує втрат, викликаних кінцевою різницею температур в процесі підводу і відводу теплоти. Зовнішня необоротність приводить до втрати роботоздатності теплоти, тобто,
до невикористання її температурного рівня
В теплових установках найбільша зовнішня необоротність має місце в процесах підводу т еплоти від верхнього джерела до робочого тіла, температура якого значно менша температури джерела теплоти 3 термодинамічної точки зору необхідно завжди прагнути підвищигитермічнийККД.
16.1 Цикли двигунів внутрішнього згорання
В двигунах внутрішнього згорання (д.вз.) в результаті згорання палива в циліндрі зростає тиск продуктів згорання, який передається на поршень, поступальний рух якого за допомогою кривошипно-шатунного механізму, перетворюється в обертовий рух колінчатого валу. Характер дійсних процесів в цих двигунах відбиває індикатор на діаграма.
В циклі зпідведенням теплоти поізохорі (карбюраторному двигуні) при рул поршня від верхньої мертвої точки (ВМТ) до нижньої мертвої точки (НМГ) за рахунок створення розрідження і при відкритому всмоктуючому клапані в циттіндр із змішувача (карбюратора) гюстугвє горюча суміш, яка складається із парів бензину і повітря. Цей процес всмоктування називається першимтактом роботи дв.з- тактомвсмоктування(оа) (рис 16.1.1).
При зворотному русі поршня від НМТ до ВМТ всмоктуючий клапан закритий і горюча суміш разом з газами, які залишитись в цигтіндрі від попереднього циклу, піддається стисненню (ас). Цей процес утворює другий такт роботи двигуна - такт стиснення. Процес стиснення проходить по політропі, середній гюказник якої n1 =1,25 -1,35.
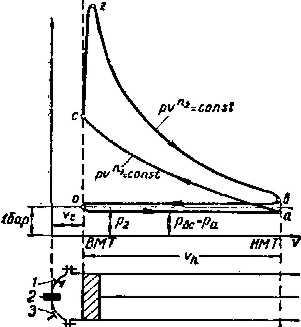
Рис 16.1.1 Індикаторна діаграма карбюраторного д.в.з. 1- всмоктуючий клапан; 2-свіча; 3-випускний клапан.
В кінці такту стиснення за допомогою свічки запалювання в циліндр подається електрична іскра, від якої загоряється стиснута робоча суміш. В першу чергу загоряються гари робочої суміші, які знаходяться ошя електродів свічки. Фронт полум'я зі швидкістю 40-50 м/с поширюється по напрямі до днища поршня Не дивлячись на таку високу швидкість згорання, поршень встигаєвсе ж відійти по напрямі до НМТ, в результаті чого процес згорання в рv - координатах (се) буде позначатися не вертикальною прямою, а похилою,близькою доізохори.
В точці г закінчується процес види мого згорання, на протязі якого встигає згоріти приблизно 80-85% всього палива, яке знаходиться в робочій суміші, і тому в цій точці буде максимальний тиск. Страва точки z (8-12% по куті обертання колінчатого валу) знаходиться і максимальне значення температури при згоранні. Робоча суміш догоряє на початку процесу розширення, починаючи від точки z і продовжується до моменту, поки не почне відкриватися випус кний клапан.
Закінчується процес розширення в точці b (НМТ). Сукупність процесів сг і zb - третій такт роботи двнгуна, який носить назву робочого ходу. При русі поршнявідНМТ до ВМТ через відкритий випускний клапан продукти згорання
виштовхуються із циліндр а. Четвертий такт роботи двигуна називається тактом випуску.
Індикаторна діаграма двигуна, в якому згорання палива проходить при постійному тиску (дизелі) показана на рис. 16.1.2
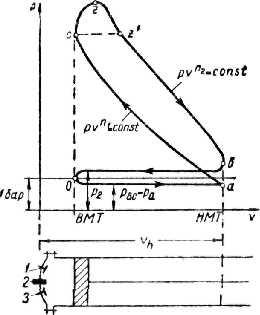
Рнс. 16.1.2 Індикаторна діаграма дизеля. 1 -всмоктуючий клапан; 2 -форсунка; 3- випускний клапан.
Принципова відмінність дизеля від карбюраторного двигуна полягає в тому, що на першому такті в циліндр поступає повітря. На другому такті повітря стискається і коли поршень підходить до ВМГ (за 25-15° по кугу обертання) то через форсунку, розміщену в головці цилівдра, вприскується розпилене рідке паливо під тиском приблизно 200-300 бар. Прн дуже короткому часі, який відводиться на процес вприскування, перемішування і згорання процес протікає з деяким підвищенням тиску.
Для термодинамічного аналізу процесу дійсні процеси заміняють оборотними термодинамічними процесами, атакожвважають, що в циліндрі на протязі всього циклу кількість і склад робочого тіла (газу) незмінні.
Теплоємність робочо го тіла приймається незалелмою від температури, а самеробоче тіло розглядається як ідеальний газ.
З термодинамічної точки зору ідеальний двигун внутрішнього згорання, якілюоийіншнй двигун, повинен би працювати за циклом Карно. Але двигун, в якому підведення і відведення теплоти проходить по ізотермі створити не вдалось. Практично найбільш зручним виявилось підводити теплоту по ізохорі або ізобарі або змішаним способом - ізохорі і ізобарі. Відведення теплоти завжци проходить по ізохорі.
В відповідності з цим розроблено три теоретичних цикли:
з підведенням теплоти при v=const
з підведенням теплоти при р = const;
зі змішаним підведенням теплоти.
Цикл з підведенням теплоти при постійному об'ємі (v=const) є прототипом робочого процесу в двигунах з постороннім запаленням (карбюраторні двигуни)рис 16.1.3.
Особливістю такихдвигунів є стиснення горючої суміші.
Цикл складається із двох адіабат і двох ізохор
Рис 16.1.3 Цикпз підведенням теплоти поізохорі в РV i TS-діаграмах Адіабата 1-2 відпжідає стисненню горючої суміші, 2-3 - ізохора згорання, 3-4 - процес адіабатного розширення. В ізохорному процесі 4-1 від газу відводиться теплота q2.
Цикл з ізобарним підведенням теплоти (р=const) складається із двох адіабат, ізобарні ізохори (дизельні двигуни) (рис.16.1.4).
В цих двигунах спочатку стискається по адіабаті 1-2 чисте повітря, в результаті чого його температура підвищується до потрібної температури самозагорянняпалива. Потім в ізобарному процесі 2-3 проходить вприскування і горіння палива (підведення теплоти q). Дальше проходить адіабатне розширення 3-4 і по тім ізохорний випуск 4-2.
Цикли із змішаним підведенням теплоти характерний для безкомпресорних двигунів важкого палива з внутрішнім суміш еутворенням.
Спалювання палива в таких двигунах спочатку проходить по лінії v=const ( зпідвиїценнямтиску, а потім при постійному тиску (рис 16.1.5).
Дня характеристики циклів двигунів внутрішнього згорання в нкорн ст овують ся п о няття:
v 1/v2=ε - степінь стиснення;
р3/p2=λ - стегінь підвищення піску;
v4/v3=ρ -степінь попереднього розширення.
Температуру газу в вузлових точках циклу можна визначити через почапсову температуру, якщо прийняти робоче тіло за ідеальний газ. Дня адіабатного процесу 1-2:
T2=T1εk-1
Для із охорного проц есу 2-3:

T3=λT2=T1εk-1λ
Для ізобарного процесу 3-4
T4=ρT3=T1εk-1λρ
Для адіабатного процесу розширення4-5:
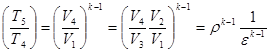
Звідси
T5=T4ρk-1/ εk-1= T1λρк
Кількість підведеної і відведеної теплотн в циклі зі змішаним підведенням відповідно складе:
q1=q1+q2=cvm(T3-T2)+cpm(T4-T3)=cvm T1εk-1:[(λ-1)+kλ(ρ-1)]
q2=cvm(T5-T1)=cvmT1(λρк-1)
Тоді термодинамічний ККД циклу зі змішаним підведенням теплоти
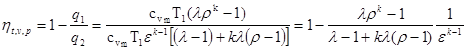 (16.5) (16.5)
З цього виразу можна зробити висновок, щотермічнийККД збільшіться іззбльшенням степені стискування ε і залежить від λ і ρ.
При ρ=1 цикл із змішаним підведенням теплоти перетворюється в цикл із ізохорним підведенням. Термічний коефіцієнт буде рівний
 (16.6) (16.6)
а при λ=1 в цикл з ізобарним підведенням теплоти. Дня цього циклу одержима
 (16.7) (16.7)
16.2 Порівняння циклів
Із порівняння (16.7) і (16.6) ввдно, що при однакових степенях стиску цикл з ізохорним підведенням теплоти має більший ККД чим цикл з ізобарннм підведенням. Але практично двигуни з ізобарннм підведенням теплоти мають більш високий ККД, чим цикл з ізохорним підведенням. Двигуни з ізобарним підведенням теплоти мають більш високу степінь стиснення, тому вони більш економічні, чим двигуниз ізохорним підведенням
Тому доцілшо порівнювати ці цикли при однакових кінцевих тисках і температурах, тобто, в умовах однакових допустимих термічних і механічних напруг (рис. 16.2.1).
На рисунку показані цикли з ізобарним і ізохорним підведенням теплоти в одному і тому ж інтервалі температури
Рис. 16.2.1 Порівнянняцнклівз підведенням теплоти по ізохоріі ізобарі в ТS -діаграмі: а- при однакові й степені стиснення; б -при однаковій максимальній температурі циклу.
Як видно з графіку середня температура підводу теплоти Т1ср в циклі з p=const більша, чим в циклі з v=const тому ККД циклу при p=const вищий, чим ККД циклу при v=const.
З цього порівняння виходить, що для кращого використання теплоти q1, доцільно частину її q1’ надати при v=const до моменту одержання в двигуні допустимих максимальних тисків, а другу частину q1’’ надати при p=const (. Тобто д.в.3. працює по щклу зі з мішаним підведенням теплоти.
17. ГАЗОТУРБІННІ УСТАНОВКИ (ГТУ)
Можливість отримання значної потужності в одному агрегаті (до 100 тис. кВт і вище) внаслідок відсутності інерційних зусиль від мас, що рухаються зворотньо-поступально, і більш повного розширення продуктів згорання (до тиску зовнішнього повітря), атакожмалі габарити і низький розхід мастила та охолоджуючої рідини зумовиш розвиток газотурбінних установок в різних галрях народного господарства і особливо в авіації в зв'язку з створенням реактивних двигунів. Останнє вдалося здійснити завдяки використанню сугасних досягнень аеродинаміки і металургії, бо практична реалізація цгкла газотурбінної установки стає економічно вигідною лише при високих температурах робочого тіла (700-900°С).
Газотурбінні установки можуть працювати по їдклам зі згоранням при постійному об'ємі і при по стінному тиску. Практикою газотурбобудування було доведено, що найкращі перспективи розвитку мають газотурбінні установки, що працюють по циклу зі згоранням при p=const.
Рис 17.1 .Принцистова схема найпростішої газотурбінної установки 1 - газова турбіна; 2 - повітряний компресор; 3 - регенератор; 4 -камери згорання; 5 -паливний нас ос; 6 - піковий двигун.
Принципова схема найпростішої газотурбінної установки зі згоранням при p=const показана на рис. 17.1. Робота установки протікає наступним чином: пусковий двигун (найчастіше поршневий д в.з. або електродвигун) через з'єднувальну муфту розкручує вал турбіни і барабан осьового компресора. Комстресор починає засмоктувати повітря з атмосфери, стискає його і направляє в регенератор (повітрепідігрвач). В регенераторі повітря нагрівається за рахунок тепла відпрацьованих газів, що виходять з турбіни. Підігріте повітря по трубопроводу поступає в камеру зговання. Сюди ж паливний насос через форсунки подає рідке паливо. Паливо згорає неперервно при p=const
Продукти згорання направляються по трубогроводу до сопел газової турбіни, звідки виходять звеликою швидкістю (до 1000м/сек) і попадають на лопатки робочого колеса, віддаючи їм більшу частину своєї кінетичної енергії, за рахунок якої і отримується механічна енергія обертання вала турбіни. Частина цієї енергії витрачається на гривід компресора і паливного насоса (пусковий двигун вимикається) а решта знімається з валу у вигляді ефективної потужності М9 що служить для приводу машини-зас обу.
Відпрасовані гази по виході з лопатевих каналів робочих коліс турбіни направляються в регенератор, де віддають частину свого тепла на підігрів повітря, що проходить з компресора в камери згорання. Камера згорання неперервно з'єднується з повітряним і гвливним трубопроводами і трубопроводом, що служить для відводу продуктів згорання. Цим самим забезпечується неперервний процес горіння палива припостійному тиску.
Відомо, що для термодинамічного дослідження циклу такого газотурбінного агрегата потрібно ідеалізувати процеси, що протікають в ньому, рахуючиїхзворотніми. Дляцього дійснийпроцесроботизаміняють замкнутим і припускають, що в ньому приймає участь незмінна кількість робочого тіла. Розглянемо спочатку такий ідеальний цикл без регенератора, зобразивши його в рv і ТS -діаграмах (рис 172). В цьому циклі робоче тіло піддається стиску по адіабаті 1-2, потімвід безкінечного ряду зовнішніх джерел проводиться тепло по ізобарі 2-3; в подальшому відбувається розширення по адіабаті 3-4 і,
нарешті охолодження робочого тіла q2 протікає поізобарі 4-1.
Термічний КК.Д цикпа газотурбінної установки з згоранням при p=const може бутивизначенийзвідношеннят
 . .
Графічно корисна робота А0 вимірюється площею 12341, рівною різниці між площами 45634 і 15621. Перша з них (площа 45634) вимірює роботу т^роши Ат, а друга (площа 15621) вимірює роботу Аок, затрачену на стиск 1кг повітря від р1 до р2, тобто корисна робота газотурбінної установка дорівнює різниці повної роботи газової турбіни і теоретичної роботи компресора:
А0= Ат - Аок
Звідси
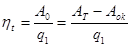
Оскільки температура відпрацьованих газів Т4 вище, ніж температура повітря на виході з компресора Т2, то частина тепла, що віддається при охолодженні газів в процесі 1-4 може бути передана в регенератор дгтя нагрівання повітря, що поступає в камеру згорання В Тs -діаграмі (див. рис. 17.2) нарів повітря в регенераторі відображається гроцесом 2-2', і тоді кількість тепла, що отримує робоче тіло від гарячого джерела, буде вимірюватися площею 2'3572', котра менша від площі 62356, що визначає q1 без регенератора, а це, природно, буд є збільшувати ККД циклу, дійсно:
без регенератора
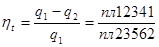
з регенератором
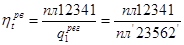
але так як площа 2'3572'<площі23562,то 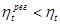 , ,
Очевидно, що теоретично максимальна температура підігріву повідря в регенераторі Т2 = Т4 в цьому випадку степінь регенерації σ=1. Степенем регенерації називається відношення кількості тепла, отриманого повітрям при проходженні через регенератор до максимально можливої кількості тепла, яке могло би отримати повітря в регенераторі, жон воно нагрівалось до температури відпрацьованих газів Т4. В діючих установках степінь регенерації о складає зазвичайО.6-0,75.
Дійсний цикл газотурбінної установки відрізняється від теоретичного наявністю втрат на тертя і вихороутворення в турбіні і компресорі (цикл 12а34а1 в Тs - діаграмі на рис 17.2) ці втрати уточнюються відносним внутрішнім ККД турбіни ηОіТ адіабатнім ККД компресора – ηАД і тоді внутрішній ККД такого дійсного цикла складає

Найбільш ефективними методами підвищення економічності газотурбінних установок являється застосування регенерації таїла, ступінчатий процес згорання,перехід назамкнутийі напівзамкнутийциклроботиі інші.
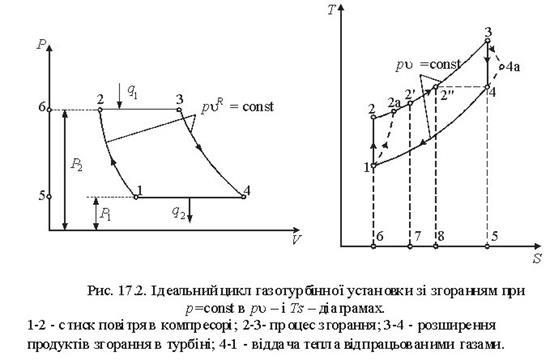
18. Цикли паросилових установок (псу)
Теплові паросилові установки дають біля 80% енергії, яка виробляється в країні. Принципова схема паросилової установки показана на рисі 8.1.
В паросилових установках продукти згорання палива безпосередньо не приймають участь в робочому циклі, вони є тільки джерелом теплоти, а робочим тілом служить пара, найчастіше це водяна пара. Волога насичена пара із котла 1 поступає в пароперегрів ач 2. де за рахунок теплоти димових газів нагрівається до стану перегрітої пари. Далі пара поступає в парову турбіну З, де теплова енергія пари перетворюється в кінетичну енергію. В конденсаторі 5 проходить повна конденсація водяної пари і вода насосом 6 подається назад в котел.
Цикл Карно, який є найефективнішим для водяної пари можливий тоді, коли ізотерми співпадають з ізобарами, тобто повинен проходити в області вологої насиченої пари. Технічно здійснити такий цикл важко через громіздкість насосної установки для стиснення вологої насиченої пари (рис.18.1.1).

Робота, яку необхідно виконати відповідає площі аdпт. Тому в паросилових установках за циклом Карно зберігається лиш загальне термодинамічне значення як циклу, який має в заданому інтервалі температури найбільше значення термічного к.к.д.
18.1 Цикл Ренкіна паросилової установки
Основним циклом паросилової установки є цикл Ренкіна. Принципова схема циклу показана на рис.18.1.2. Графічне зображення циклу показано на проходить при постійному тиску. В турбіні (процес 1-2) проходить адіабатне розширення пари до станув ологої насиченої пари. Конденсація пари і відведення теплоти проходить при постійному тиску і об'ємі. Процес 2-3 є одночасно ізобарнимі ізотермічним.
Оскільки вода практично нестислива, то в процес подачі води 3-4 є ізохорним, в TS - координатах точка 3 і 4 співпадають Робота, яка витрачається на стиснення в 34 8 7 є значно меншою чим в циклі Карно.
Термічний ККД циклу Ренкіна може бути визначений з загального виразу:
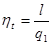
де l -робота в циклі;
q1 - кількість підведеної теплоти.
Теплота надається робочому тілу на ділянках 4-5-6-1 при постійному тиску. її можна визначити як
q1=h1-h2’,
де h1- ентальпія пари на вході в турбіну;
h2’- ентальпія живильної води.
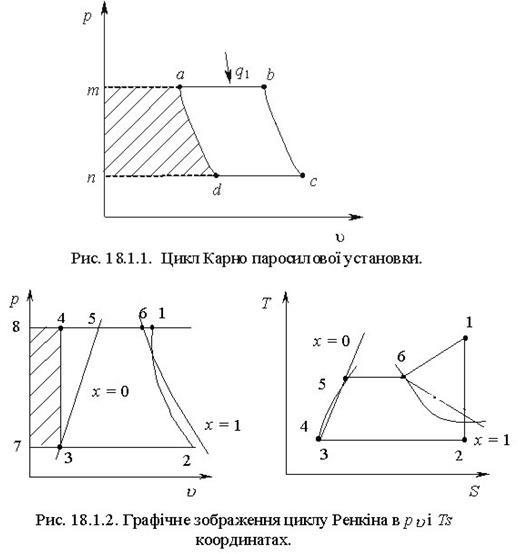
Теплота, віддана парою в конденсаторі при постійному тиску на ділягках 2-3 буде рівна q2=h2 -h2’, де h2 - ентальпія пари, яка виходить із турбіни.

Зручно визначити ККД циклу паросилової установки за допомогою h і-s -діаграми, де h1 і h2 визначаються за відомими початковими і кінцевими параметрами адіабатного процесу розширення парив турбіні. h2’- визначається за таблицями насиченої пари для тиску p2
Важливою розрахунковою характеристикою циклу є питомий розхід пари d0 який представляє собою відношення часового розходу пари Dо в ідеальному двигуні довиробпеної елекгроенергіїіУ.
Із теплового балансу ідеального двигуна Dо ( h1- h2)=3600N
 (18.2) (18.2)
Із рівняння (18.1) неможливо вияснити характер впливу параметрів стану водяної пари на величину η циклу Ренкіна.
Для цього використаємо поняття еквівалентного циклу Карно, який проходить в межах середніх температур підведення і відведення тепла.
Із рівняння ηt=1-Т2ср/Т1cр випливає, що із збільшенням інтервалу середніх температур циклу (Т2ср і Т1ср) термічний ККД любого циклу збільшується. Збільшення середньої температури Т1ср в процесі підведення теплоти в циклі Ренкіна можна здійснити двома способами.
Перший - збльшення початкового тиску під ведення теплоти від 2,0 до 10,0 МПа при одній і тій же температурі перегрітої гари Т1=500°С і одним і тим же тиском в конденсаторі р2 = 0,004 МПа підвищує ККД циклу Ренкіна від 0,368 до 0,426 тобто на 16,2 %.
Необхідно відмітити, щовласне підвищення тиску ніякої переваги не дає і якщо б підвищення ηt; можна було б досягнути іншим шляхом то йому необхідно було б надати перевагу. Негативним наслідком підвищення початкового тиску є збльшення степені вологості гари в гроцесі розширення.
Другий - підвищення температури перегрітої гари Т’1>Т1 що також приводить до збільшення середньої температури підведення теплоти в процесі (рисі 8.1.4). В зв'язку з цим найбільш сприятливі результати одержані при використанні високих початкових параметрів пари. Мінімальна температура Т2 визначається температурою навколишнього середовища 20-30°С , що відповідає тиску р=0,0024-0,0043Мпа
Навідміну від теоретичного циклу в дійснік циклах процеси протікають необоротно. Робота тертя пари в турбіні перетворюється в теплоту, підвищує ентальпію пари в кінцевому стані від h2 до h2Д. Тому дійсний процес адіабатного розширення пари в турбін, протікає необоротно зі збільшенням ентропії, умовно позначиться не прямою 1-2, а кривою 1-2д (рис. 18.1.5)
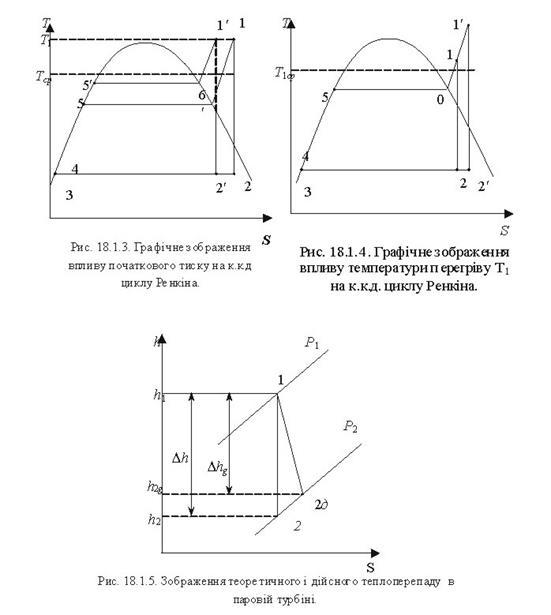
Тоді відноснийвнутрішнійККД турбіни
 (18.3) (18.3)
η01 для сучасних машин складає 0,8-0,9. Абсолютний внутршній ККД для циклу Ренкіна:
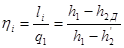 (18.4) (18.4)
ηі- сучасних паросилових установок η становить 0,35.
Дня підвищення ККД паросилової установки використовують попередній підігрів живильної води за рахунок відпрацьованої пари (регенеративний цикл), вторинний перегрів пари (цикл з вторинним перегрівом), комбіноване використання тепла (теплофікаційний цикл).
Особливістю регенеративного циклу (рис. 18.1.6) є те, що конденсат після конденсатора попередньо підігрівається в спеціальних теплообмінниках парою, яку відбирають із проміжних ступенів турбіни. Практично доцільне використання 6-8 степеней.
При відборі пари на підігрів конденсату з однієї сторони зменшується розхід теплоти q1 на одержання пари, але з іншої зменшується робота lо в турбіні. Не дивлячись на протилежний характер цих процесів відбір пари завжди підвищує ηt. Це пояснюється тим, що при підігріві живильної води за рахунок теплоти конденсації відпрасованої пари виключається підвід теплоти від зовнішнього джерела на ділянці 4-5' - (рис.18.1 6) і таким чином середня температура підводу теплоти від зовнішнього джерела в регенеративному циклі збільшується (підведення зовнішньої теплоти здійснюється тільки на ділянц 5 -6-1).
Задачі зручно вирішувати по h-s діаграмі. Розглянемо схему і регенеративний цикл з однимвід бором (рис.18.1.6).
Із одного кілограма пари, яка поступає в турбіну, акг пари розширяються тільки до тиску від бору р20 виконуючи корисну роботу і, l1= а(h1-h2),а 1-a кг розширюються в турбіні до кінцевого тиску р2, виконуючи корисну роботу
l2 = (1-а) (h1-h2)
Загальна робота 1 кг пари в регенеративному циклі:
l0 = l1 + l2 = а(h1-h20)+ (1-а) (h1-h2) або l0 = h1-h2- а (h20 -h2)
Кількість теплоти, затраченої на нагрів 1 кг пари, q1= h1-h20
Tермічний ККД регенеративного циклу:
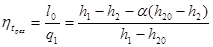
Кількість відібраної парн визначається із балансового рівня теплоти нагрівана:
(1-а)(h'20- h'2)=а(h20- h'2), (18 6)
звідки:
 (18.7) (18.7)
де h20- ентальпіяшрипритиску відбору;
h'20- ентальпія парн при тиску виходу парн із турбіни;
h'2- ентальпія парн при тиску в конденсаторі.
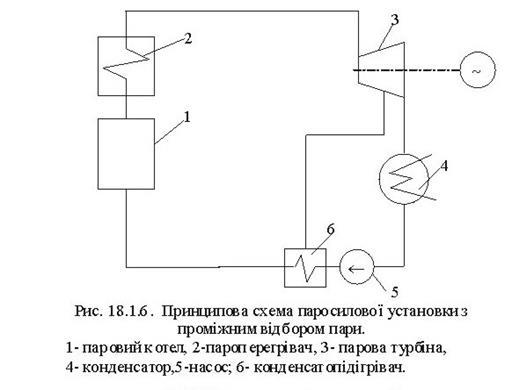
18.2 Цикл з вторинним перегрівом пари
Як було встановлено негативним наслідком підвищення початкового тискуєзошьшення степені вологості гвривкінці розішрення.
Щоб уткнути підвищення вологості в кінці адіабатного розширення за допустиму межу, використовують підвищення початкової температури перегрітої пари, а також вторинний або проміжний перегрів (рисі 8.2.1 та 182.2). Суть проміжного перегріву полягає в тому, що пару після розширення 1-2 в першій ступені турбіни І при постійному тиску рпр вторинно перегрівають в другому перегрівачу ПП2 до температури Т’1.
Потім пар а поступає в наступну ступень турбіни, депроходить розширення 1’-2 до тиску в конденсаторі. В результаті вторинного Перегріву степінь сухості пари збільшується з x1; до х2 відповідно точки 20 i 2.
Одночасно може підвищуватись і термічний коефіцієнт циклу.

Рис 18.2.1. Принципова схема паросилової установки з вторинним перегрівом пари.
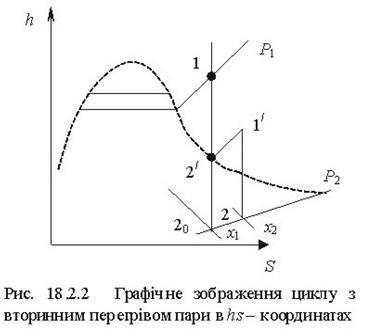
18.3 Теплофікаційний цикл
В описаних цикл ах значна частина теплоти (більше 50%), що надається парі в паровому котлі, відводиться в конденсаторі. Вода, яка має температуру 25-30°С не може бути використана в огвлювапьних системах або для технологічних нужд.
Щоб в подальшому використовувати теплоту необхідно підвищити її температуру, для цього необхідно підвищити тиск парц яка виходить із турбіни. Такі установки працюють з погіршеним вакуумом або з протитиском. Поряд з виробництвом електроенергії вони відпускають теплоту в вигляді пари або гарячої води і називаються теплофікаційннмн(ТЕЦ). Схема і цикл показані на рисунку 18.3.1 та 18 3.2.
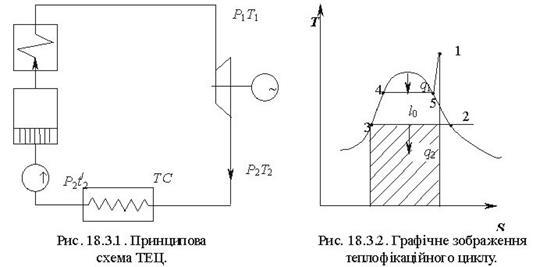
В цій установці відсутній конденсатор і пар а після турбіни з підвищеним тиском і температурою Тп направляється до споживача теплоти ТС, віддаючи теплоту споживачу, пара конд енсуєть ся і насосом направляється в котел.
Підвищення протитиску приводить до зменшення електричної енергії і термічного ККД, але загальне використання теплоти qвих при цьому значно підвищується.
qвих=l0 + q2 (13 8)
Комбінований спосіб виробництвом електроенергії і теплової енергії є одним з головних методів підвищення економічності теплових ел ектростанцій і служить основою тепгтофікації.
Характеристикою комбінованого процесу буде служити відношення використаної енергії іо l0 + q2 до підведеної теплоти в процесі q1
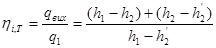 (18.9) (18.9)
В ідеальних випадках, коли вся теплота q2 використовується  = 100%. В дійсності = 100%. В дійсності  досягає 60-80%. досягає 60-80%.
Щоб в великому діагвзоні міняти теплове і електричне навантаження на більшості ТЕЦ використовують конденсаційні турбіни з проміжним відбором пащ, при тиску, необхідному для споживачів теплоти
18.4 Парогазовий цикл
Значне підвищення ефективності ПСУ можна досягнути шляхом комбінування газотурбінної установки з паросиловою (рнс.18.4.1, 18.4.2).
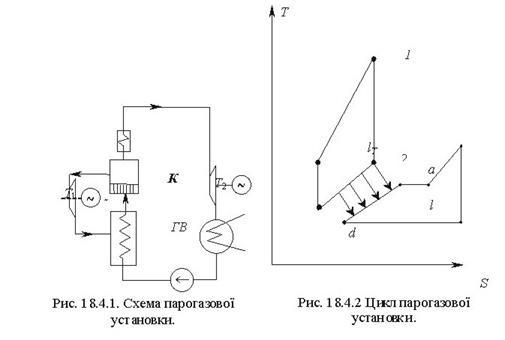
Продукти згорання після парового котла з температурою біля 700°С поступають в газову турбіну Т1. Попередній нагрів конденсату, який поступає в котел, проводиться випускними газами газової турбіни (процес d-а) в газоводяному підігрівану ГВ. Пара з котла поступає в парову турбіну Т2.
Відповідно в таких умовах ефективно використовується гази, що виходять із котла, а також покращується використання газів, які залишають газову турбіну. Переваги газотурбінного циклу - використання більш високої темстератури робочого тіла. В газових турбінах до 700°С, в паросилових установках - 500-550 ЯС. Перевага перед газовими є те, що в паровому котлі використовується більш низька температура холодного джерела. В газотурбінному температура на виході складає 150°С, а в паросиловому 25-30°С. Комбінована установка дає економію палива на 15% в порівнянні з паротурбінною.
19. Цикли холодильних установок
Холодильні установки використовують в харчовій промисловості і побуті, при заморожуванні ґрунту в будівництві тунелів і каналів, в хімічній і газовій промисловості приспалюванні газу, кондиціюванні повітря
Холодильні установки працюють по поротних циклах.
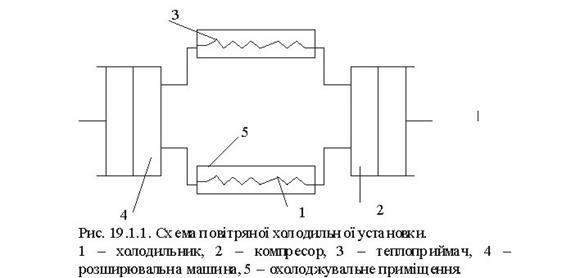
19.1 Цикл повітряної холодильної установки
Повітря з холодильника 1 (рис. 19.1.1), яке охолоджує приміщення 5 всмоктується в циліндр компресора 2 (процес й-1), де стискується (процес 1-2) (рис 19.1.2). При стискуванні температура повітря підвищується від Т1, до Т2 (процесі -2). Стиснуте повітря виштовхується з циліндра компресора (процес 2-b) в теплоприймач 3, де ізобарно охолоджується до температури Т3, віддаючи теплоту охолоджуючій воді q=Cрm1(Т2- Т3)
Охолоджене повітря прн тиску Р3 поступає в щліндр розширювальної машннн 4 (процес в-3). Тут проходить процес його адіабатнчного розширення від Р3 до Р4 = Р1 з виконанням роботи.
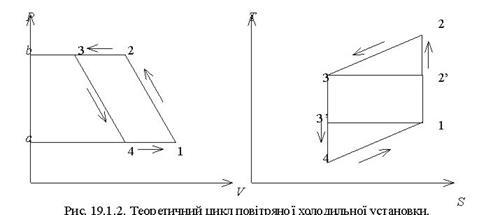
При адіабатичному розширенні повітря температура його знижується до 203...21K.
Охолоджене повітря з цнлівдра розширювальної машннн виштовхується в холодильник 1 (процес 4-1), де ізобарно нагрівається (4-1), забираючи від середовища приміщення кількість теплоти з, q1= Cрm2 (Т1- Т4). Площа а12bа показує роботу компресора lk площа b34аb - роботу розширювальної машннн lр, а площа 12341 рівна різниці площ - роботу, яка витрачається в установці, тобто роботу циклу lk = lk - lр.
З іншої сторони, робота циклу lk=q1-q2- Холодильний коефіцієнт установки визначаємо наступним чином:
 (19.1) (19.1)
Приймаємо Cрm1= Cрm2 і поділимо чисельник і знаменник дробу на (Т1- Т4).. Одержимо:
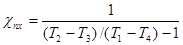 (19.2) (19.2)
З адіабат 1-2 і 3-4 слідує,що
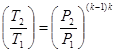
а
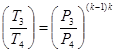
Оскільки
р2 =р3 і р4=р1,
то
Т2/Т1 = Т3/Т4 ; Т4/Т1= Т3/Т2
Тоді:
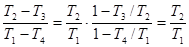
Підставляємо в рівняння (19.2). Одержима
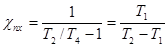 (19.3) (19.3)
Порівняємо між собою холодильні коефіцієнти циклу повітряної установки і зворотного циклу Карно, взятих в одному і тому ж інтервалі граничних температур холодильника і теплоприймача
При ізотермічних процесах підводу і віддачі теплоти в зворотному щклі Карно гранична температура холодильника повинна бути рівна Т1, анагрівача -Т3. Тоді холодильнийкоефіцієнгзворотногоциклу Карно:
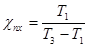 Т3< Т2 то чпл<чк Т3< Т2 то чпл<чк
Холодильний коефіцієнт називають також питомою холодопродуктивністю qо, яка показує кількість відібраної від холодильного джерела теплоти на одиницю затраченої роботи.
Цикл повітряної холодильної установки малоефективний. Крім того повітря має малу теплоємність, в результаті чого потрібний його великий об'єм.
19.2. Цикл парової холодильної установки
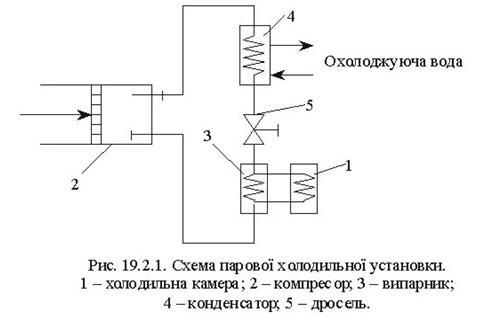
Відношення маси аміаку до маси розчинника називається масовим відношенням аміаку.
Коли t  -34 обидва компоненти знаходяться в рідкому стані. Якщо розчин підігрівати, аміак випарується і в кінці масове відношення рівне 0. Пара буде чистий аміак, а рідина - вода. охолоджуюча -34 обидва компоненти знаходяться в рідкому стані. Якщо розчин підігрівати, аміак випарується і в кінці масове відношення рівне 0. Пара буде чистий аміак, а рідина - вода. охолоджуюча

Рис. 19.4.1. Схема абсорбційної холодильної установки.
На рнс.19.4.1. показана схема найбільш простої абсорбційної установки. В кип’ятильнику 1, який містить водно-аміачний розчин при тиску рк і міцності ζк, проходить випарювання з розчину аміаку за рахунок теплоти, яка поступає з гарячим теплоносієм. На випарювання витрача ється теплота в кількості q1,.
Одержані таким чином пари аміаку направляються в конденсатор 2, де, віддаючи теплоту охолоджуючій воді (навколишньому середовищу), конденсується при рк = const. В результуючому вентилі 3 тиск рідкого аміаку знижується до тиску в абсорбері 6 ра< рк, в якому міцність розчину підтримується ζк > ζa. При такому тиску аміак поступає у випарник 4 і перетворюється в пару за рахунок теплоти q2, яка відводиться від охолоджуючих тіл в холодильній камері 5. Потімпаранаправляєгьсяв паровий простір абсорбера 6, в якому знаходиться випарений із розчину аміак, що має в зв'язку з цим Яльш високу температуру, ніж пара, яка поступила із випарювача. Ця хол одна парапоглннається розчином. Виділена при поглинанні теплота виводиться із абсорбера охолоджуючою водою.
Для того, щоб масове відношення розчинів в котлі і абсорбері запишалось весь час постійним, проводять перекачування насосом 7 розчину з більшим масовим відношенням з абсорбера в котел, а розчин з меншим масовим відношенням поступає з котла в абсорбер. В результаті того, що тиск в котлі вищий, чим в абсорбері, розчин по шляху в абсорбер проходить через дросельний клапан 8.
20. Тепловий насос
Тепловий насос - це машина призначена для поглинання теплоти з навколишнього середовища і передачі її об'єкту з ошьш високою темпер атурою.
На рис. 20.1. показана схема теплового насосу. Основними елементами є: компресор 1, конденсатор 2, регулюючий вентиль 3 і випарник 4, які складають звичайну компресійну холодильну установку. Вигарювання холодильного агенту в випарнику проходить за рахунок холодної води з жого-небудь водоймища. Подача водив випарник проходить за допомогою насосу 5. Охолоджена в випарнику вода скидається далі в водоймище. Конденсація виштовхнутого із компресора агента здійснюється в конденсаторі водою із зворотньої лінії системи опалення Підігріта в конденсаторі вода направляється в прилади опалювання 9, розміщені в опалюваному приміщенні 7. Циркуляція водив системі огвленняздійснюєтьсянасосом 6.
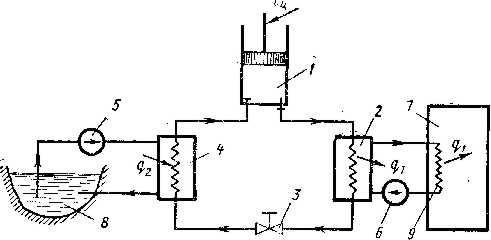
Рис 20 1 Тепловий насос
Ефективність теплового насосу оцінюється опалювальним коефіцієнтом
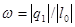
де q1 - питома теплота, яка виділяється при конденсації холодильного агенту в конденсаторі;
l0 - питома робота, яка затрачається на привід компресора.
ОСНОВИ ТЕПЛООБМІНУ
Основні види теплообміну.
Теорія теплообміну вивчає закони поширення і передачі теплоти між тілами
Розрізняють три види тепло обміну: теплопровідність, конвекція і променистий тепп ообмін.
21. Теплопровідність
Якщо у твердому тіш, нерухомій рідині або газі температура в різних точках не однакова, то теплота буде переходити від ділянки тіла з більшою
температурою до ділянки тіла з меншою температурою. Такий процес передачі теплоти називається теплопровідністю. Теплота при цьому передається за рахунок руху і взаємодії ел ементарних частинок - електронів.
Необхідною умовою процесу теплопровідності є різниця температури в різних точках тіла. В загальному випадку температура є функціао координат і часу:
t=f(x,y,z,τ) (21.1)
Сукупність значень температури для всіх точок простору в даний момент часу називається температурним полем.
Якщо температура тіла не змінюєтьсяв часі, то таке температурне поле називається стаїі онарннм, якщо змінюється - не стаціонарним.
Температура може бути функцією однієї, двох або трьох координат. Відповідно цьому температурне поле може бути одновимірним, двовимірним і тривимірним.
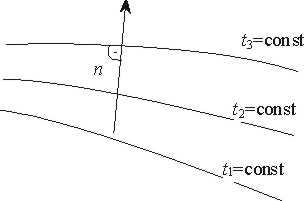
Рис. 21.1. До визначення температурного градієнту і теплового потоку.
При довільному температурному полі в тілі можна знайти точки з однаковою температурою. Геометричне місце таких точок утворює ізотермічну поверхню (рис. 21.1). Очевидно, що передача теплоти може відбуватися тільки від поверхні з більшою температурою до іншої з меншою температурою. Кількість переданої теплоти буде залежати від різниці температур між цими ізотермічнимиповерхнямиі від віддалі міжними.
Границя відношення зміни температур ∆t між двома ізотермічними поверхнями до віддані між ними ∆n взятій по нормалі називається темпер атурним градієнтом.
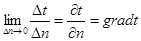 (21.2) (21.2)
Температурний градієнт є вектором, направленим по нормані до ізотермічної поверхні в сторону збільшеннятемператури.
Теплота поширюється в сторону гротиггежну градієнту температури, тобто в сторону меншої температури. Кількість теплоти, яка ператосить ся через будь-яку ізотермічну поверхню за одиницю часу називається тепловим потоком Q[Вт]
Тепловий потік віднесений до одиниці площі називається густиною теплового потоку 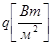 . Густина теплового потоку величина векторна і направлена в сторону поширення тепла. . Густина теплового потоку величина векторна і направлена в сторону поширення тепла.
21.1 Закон Фур’є
Фур'є експериментатгьно встановив, що кількість переданої теплоти пропорційна падінню температури, часу і площ січення, перпендикулярно направленого напряму поширення теплоти,
Q=λFτgrad t (21.3)
Для густити теплового потоку закон Фур'є буде мати вигляд:
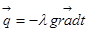 (21.4) (21.4)
Де n-називається коефіцієнтом теплопровідності  ,. ,.
Знак "-" показує, що напрям поширення теплового потоку і напрям градієнту температури- протилежні.
Коефіцієнт теплопровідності є фізичною властивістю речовини і характеризує її здатність проводити тепло:
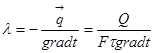
Значення коефіцієнта теплопровідності представляє собою кількість теплоти, яка проходить через одиницю площі ізотермічної поверхи за одиницю часу при температурному градієнті рівному одиниці.
Дтярізних матеріалів коефіцієнт теплопровідності різний і в загалшому випадку залежить від структури, густини, температури, вологості і тиску. В зв'язку з тим, що в процесах теплообміну температура тіла змиюється і неоднакова в різних частинах тіла, тов першу чергу необхіднознатн залежність коефіцієнту теплопровідності від температури. Для металів ця залежність майже лінійна
 (21.6) (21.6)
n0- коефіцієнт теплопровідності прн температурі t0
b-постійна, жавизначаєтьсядослідним шляхом.
Коефіцієнт теплопровідності газів лежить в межах 0,005-0,5 Вт/мК З підвищенням температури коефіцієнттеплопровідності росте.
Коефіцієнт теплопровідності крагшевих рідин лежить в межах 0,08-0,7Вт/мК. З гідвищенням температури зменшується, за виключенням води і гліцерину.
Коефіцієнт теплогровідності металів лежить в межах 20 -400 Вт/мК. Найбльш тепгтопровідним металом є срібло (n=410) потім чиста мідь (n=395), золото (n=300), алюміній (n=210). -400 Вт/мК. Найбльш тепгтопровідним металом є срібло (n=410) потім чиста мідь (n=395), золото (n=300), алюміній (n=210).
Дня більшості металів при збільшані температури коефіцієнт теплопровідності падає. Коефіцієнт тепгтопровідності падає при наявності в металі різних домішок. Так коефіцєнт теплопровідності дгтя чистої міді n = 395Вт/м К а для міді зі слідами миш 'яку n=1425т/м К
21.2 Диференціальне рівняння теплопровідності
Розглянемо передачу теплоти за рахунок теплогровідності через елементарний кубик з гранями dх, dу, dz приймаючи, що коефіцієнт теплопровідності n, питома теплопровідність Ср і густина с постійні (рис 21.2)
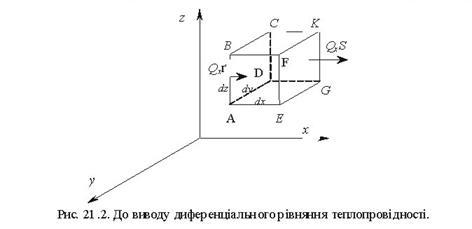
Визначимо потік теплотичерез грані елемента в результаті теплопровідності. З гідно закону Фур'є кількість теплоти, яка проходить через грань АВСДВ направленні осі Х рівна
 (21.7) (21.7)
а через грань ЕFGК, яка має температуру
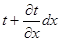
за цей же час
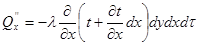 (21.8) (21.8)
Віднімаючивід рівняння(21.7) рівняння(21.8) одержима
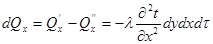 (21.9) (21.9)
Аналогічнов напрямі осей У i Z
 (21.10) (21.10)
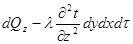 (21.11) (21.11)
Кількість теплоти, яка залишилася в цьому об'ємі:
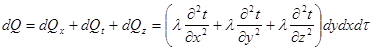 (21.12) (21.12)
В зультаті цього температура тіла зміниться
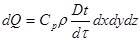 (21.13) (21.13)
а значить
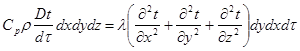
Після скорочення одержима
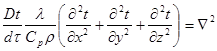
де
а=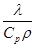
коефіцієнт температуропровідності.
 - операторЛапласа. - операторЛапласа.
Одержане рівняння називається диференційним рівнянням теплопровідності Фур'є-Kірхгофа.
Дня того, щоб розв'язати рівняння теплопровідності в кожному конкретному випадку необхідно поставити умови однозначності. Умови однозначності включають:
геометричні умови, які характеризують розміри і положення системи;
фізичні умови, які визначають теплофізичні параметри тіла (коефіцієнт теплопровідності, густин а, теплоємність);
початкові умови, які описують розпрнділення температури в тілі в
початковий момент часу;
граничні умови, які описують стан тіл а на гр аничних поверхнях.
Граничні умови бувають трьох родів.
Граничні умови першого роду задають температуру на граничних поверхнях: t=f(x,y,z)
Граничні умови другого роду задають тепловий потік на граничних поверхнях: q=f(x,y,z)
Граничні умовитретього роду задають коефіцієнт тепловіддачі а і температуру навколишнього середовища tn
21.3 Тетопровідність плоскої стінки
Розглянемо одношарову необмежену плоску стінку, товщиною Б , з коефіцієнтом теплопровідності А. (рис. 21.3.1).

Визначимо постійні інтегрування, використовуючи граничні умови (21.15).
х=0х = 6
c2=t1t2=c1δ+t1 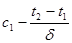
Отже розподілення температури в стінці
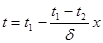
буде мати лінійний характер.
Визначити тепловий потік через плоску одношарову стінку можна, використовуючи закон Фур'є (21.4).
Проінтегрувавширівняння від t1 до t2, одержимо:
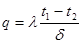
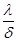 - називають теплопровідністю плоскої стінки. - називають теплопровідністю плоскої стінки.
 - термічний опіртеплопровідносп одношарової стіки. - термічний опіртеплопровідносп одношарової стіки.
21.4 Теплопровідність багатошарової стінки
Розшянемо теплопровідність багатошарової плоскої стінки з товщиною шарів δ1, δ2, δ3 і коефіцієнтами теплопровідності λ1, λ2, λ3, (рис 21.4.1).
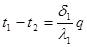
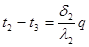

Після додавання лівих і правих частн рівнянь, одержима
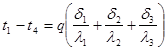 (21.17) (21.17)
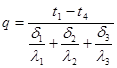
для п шарів
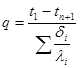 (21.18) (21.18)
21.5 Теплопровідність через циліндричну стінку
Розглянемо стаціонарний процес теплопровідності (рнс 21.5.1).
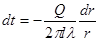
Проінтегру єм о рівняння:
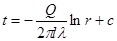 (21.21) (21.21)

Підставимо граничні умови (21.20) в рівняння (21.21).
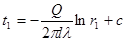 (21.22) (21.22)
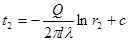 (21.23) (21.23)
віднімемо від (21.22) рівняння (21.23):
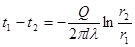 (21.24) (21.24)
Теплопровідність через цилівдрнчну стінку
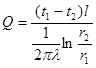 (21.25) (21.25)

- термічний опір теплопровідності через циліндричну стінку.
Дня багатошарової циліндричної стінки тепловий потік рівний :
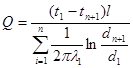 (21.26) (21.26)
21.6 Теплопровідність тіл з внутрішнім джерелом теплоти
Розглянемо стінку товщиною - 2δі коефіцієнтом теплопровідності – λ (рис 21.6.1). В стінці діє внутрішнє джерело з об'ємною густиною теплового qv

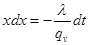 (21.27) (21.27)
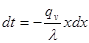
Інтегруємо рівняння (21.27):

Підставимо граничні умови: х = 0 , t0 = С.
Одержимо:
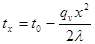
-рівняння зміни температури в плоскій стінці з внутрішнім джерелом теплоти.
22. Конвективний теплообмін
Конвекцією називається процес поширення теплоти за допомогою руху макроч астин ок рі ди нн.
В інженерній практиці найчастіше розглядають теплообмін між рухомою рідиною і твердою поверхнею, який називається конвективнич теплообміном, або тепловідд ачею
Згідно закону Ньютона-Ріхмана тепловий потік Q від рідини до стінки пропорційний площі поверхні теплообміну і різниці температур між твердою етикою tc і рідиною tp.
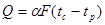 (22.1) (22.1)
Де а-коефіцієнттепловіддачі Вт/м2К
Фізичний зміст коефіцієнта тепловіддачі можна визначити як кількість теплоти, яка проходить через одиницю площі ізотермічної поверхні за одиницю часу при різниці температур між стінкою і поверхнею рівною 1 С.
Процес конвективного теплообміну нерозривно зв'язаний з руком рідини Розрізняють два видируху-вимушений і вільний.
Вільний рух рідини виникає в результаті дії масових сил; вимушенім -
при дії стороннх збудників (насоси, вентилятори). На процес конвективного теплообміну впливає і режим руху - ламінарний чи турбулентний При ламінарному русі течія має спокійний характер, при турбулентному -утворюються завихрення Але при люб ому режимі руху рідини в тонкому шарі біля поверхні стінки рух рідини в результаті дії сил тертя сповільнюється і швидкість падає до нуля. Тонкий шар рідини біля поверхні тіла, в якому відбувається зміна швидкості рідини від значення швидкості не збудженого потоку подалі від стінки до нуля безпосередньо на стінці називається динамічнимпограничним шаром.
Тонкий шар рідини, безпосередньо біля стінки, рух в якому має ламінарний характер,називають в'язкимпідшаром .Якщо температури стінкиі рідини неодинакові, то біля стінки утворюється тепловий пограничний шар, в якому відбувається вся зміна температури рідини. За пограничним шаром температура рідини постійна і рівна й. В загальному випадку товщини теплового і динамічного шару можуть не співпадати. Співвідношення товщини динамічного і теплового пограничних шарів визначається безрозмірним числом Прандля:
 (22.2) (22.2)
Де v-кінематичнав'язкість рідини;
а-коефіцієнт температуропровідності.
Безпосередньо біля стінки в ламінарному підшарі перенесення теплоти до стіїки здійснюється теплопровід ні стю і може бутивиражене законом Фур'є:
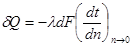
Де п – нормаль до поверхні тіла
Цю ж кількість теплоти можна визначити законом Ньютона-Ріхмана
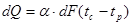
Прирівнюючи ці рівняння одержимо:
 ; ; 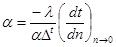 (22.3) (22.3)
Диференціальне рівняння, що описуєумови теплообміну на поверхні каналу (п = 0) називається рівнянням тепгтопер едачі.
По своїй фізичній суті конвективний теплообмін є дуже складним процесом і залежить від великого числа факторів, які визначають процес тепловіддачі. В загальному випадку коефіцієнт тепловіддачі є функцією фізичних параметрів рідини, характеру руху, форми і розмірів тіла.
Звідси коефіцієнт тепловіддачі:
а =f(λ,l,ρ,v,υ,β,Ф,a). (22.4)
Рівняння (22.4) (показує, що коефіцієнт тепловіддачі -складна величина і для її визнач еннянеможливодатизагальну формулу. Як правило для визначення а необхідно використовувати експериментальні дослідження.
22.1 Основні поняття теорії подібності
При вивченні різних фізичних явищ використовують два методи досліджень, які дозволяють одержати кількісні закономірності. В першому методі використовується експериментальне дослідження конкретних властивостей одиничного явищ а, в друго му - виходять з теоретичного дослідження даної проблеми. Перевагою експериментального методу дослідження є достовірність одержаних результатів. Але результати даного експерименту не можуть бути використані стосовно другого явица, яке в деталях відрі зняєть ся від вивчено го.
Другий метод досліджень для знаходження кількісних характеристик використовує найбільш загальні закони природи, які в свою чергу є результатом надзвичайно широкого уза гальнення дослідних даних.
Будь-яке диференціальне рівняння є математичною моделлю цілого класу явищ.
Таким чином, гід класом розуміють таку сукупність явищ, які характеризуються основним механізмом процесіє і однаковою фізичною природою
Явища, які входять в клас, підпорядковуються однаковим рівнянням як по формі, так і по фізичному змісту величин, які в нього входять Наприклад, диференціальне рівняння теплопровідності.
До кожного диференціального рівняння необхідно поставити умови однозначності.
В багатьох випадках знайти рішення диференціального рівняння, яке б відповідало конкретним умовам однозначності неможливо.
Об'єднання двох методівздійснюється теорією подібності.
Крім класу явищ і одиничного явища теорія подібності вводить поняття групи явищ
Групою явищ називають сукупність фізичних процесів, які описуються однаковими по формі і змісту диференціальними рівняннями і однаковими по формі і змісту розмірними умовами однозначності.
Поняття про подібні сть явищ зустрічається ще в шкільному курсі, коли ми говоримо про подібність трикутників. В даному випадку мова йде про геометричну подібність. Можна також говорити про подібні сть картини руху двох потоків рідини - кінематичну подібність, подібність поля розподілу сил -динамічну подібні сть, подібність розподілу температур-теплову подібність.
В загальному вигляді поняття подібності явищ зводиться до наступних положень:
Понягтяпро подібність у відношенні до фізичних явищ можна тільки застосовувати до явищ фізично однорідних, які описуються однаковими по формі і по змісту аналітичними рівняїнями.
Обов'язковою умовою подібності явищ є геометрична подібність.
При аналізі подібних явищ сггівставляги між собою можна тільки однорідні величини у відповідних точках простору і у відповідний момент часу.
Однорідними називаються величини, які мають однаковий фізичний зміст і однакову розмірність.
Відповідними точками геометрично подібних систем називаються такі точки, координати яких задовольняють умові:
 ; ;  ; ; 
Два проміжки часу називають ся відповідними, якщо вони мають спільний моментвідгтіку і зв'язані між собою співвідношенням:
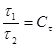
- Подібність двох фізичних явищ означає подібність всіх величин, які
характеризують дане явище.
Це означає, що у відповідних точках простору і у відповідний момент часу для любих однорідних фізичних величин справедлива рівність: Х1 = СХ2.
Коефіцієнт пропорційності С називається константою подібності, або постійною подібності.
Постійні подібності не можна встановлювати або вибирати випадкова Між ними існує зв'язок, який виводиться із математичного опису процесу. Сгівв ід ношення між постійними подібності встановлює існування особливих величин, які називаються числами подібності.
Числа подібності встановлюються з розв'язку диференціаттьних рівнянь або шляхом узагальнення експериментальних даних. Наприклад, розглянемо рівняннятеплопередачі (22.3):
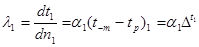 (22.5) (22.5)
 (22.6) (22.6)
Позначимоконстантиподібності:
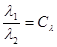 ; ;  ; ;  ; ; 
Звідси:
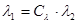 ; ; 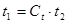
і.т.д., підставляючи ці співвідношення в рівняння (22.6) і скоротивши на С, одержимо:
 (22.7) (22.7)
Рівняння (22.5) і (22.7) тотожні, оскільки виражають зв'язок між параметрами процесу, обумовленим диференціальні мрівнчнням тепловіддачі:
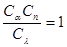 ; ; 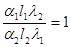
де 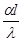 - число Нуссельта - характеризує теплообмін в пограничному шарі. - число Нуссельта - характеризує теплообмін в пограничному шарі.
Безрозмірні числа подібності представляють собою нові змінні. Кількісний зв'язок між числами подібності визначається дослідним шляхом Вказівку на те, в якому напрямку вести експеримент дає теорія подібності.
В основу теорії подібності покладені три теореми
Перша теорема: Подібні між собою явища мають одинакові критерії подіон ості.
Теорема вказує на те, що при виконанні дослідів необхідно і достатньо вимірювати лише ті величини, які входять в числа подібності явища, яке ми вивчаємо.
Друга теорема подібності: Залежність між змінними величинами, які характеризують процес, може бути подана у вигляді залежності між числами подіон ості.
З другої теореми подібності випливає, що результати любого експерименту можна описати у вигляді критеріїв подібності і залежність між нимиподати увигляці рівнянь подібності.
Третя теорема подібності вказує необхідні умови для того, щоб явища виявилися подібними один одному.
Третя теорема може бути сформульована наступним чином - подібні ті процеси, умови однозначності яких подіоні, і числа подібності, складені зумов однозначності, чисельно одинакові.
Тобто вшначальнезначення мають числа подібності складені з величин, які входять в умови однозначності. Такі числа подібності називаються критеріямиподібності.
Таким чином, теорія подібності дозволяє не інтегруючи диференціальне рівняння одержати з них числа подібно сті і встановити рівняння подібності, які справедливі для всіх подібних процесів.
Конвективний теплообмін характеризується такими числами подібності:
числоПрандгля

характеризує теплофізичніпараметрнречовини
число Грасгофа

де β -коефіцієнт об'ємного розширення; g-прискорення вільного падіння;
l - характерний лінійний р оз мір;
v-кінематична в'язкість;
∆t -різниця температур між стінкою і рухомим середовищем.
Число Грасгофа характеризує кінематичну подібність явищ при вільній конвекції
Число Реинольдса:
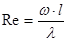 , ,
де ω-швидкість руху.
Число Реинольдса характеризує гідродинамічну подібність явищ.
В теорії теплообміну часто використовують також числа подібності:
число Фур'є
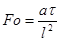
де τ- час процесу,характеризує нестаціонарні явища теплопровідносп;
число Біо
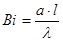
де λ -коефіцієнт теплопровідності твердого тіла.
Число Біо характеризує поширення теплоти в тілі при нестаціонарній теплопровідності;
число Пекле

характеризує співвідношення між швидкістю руху
джерела теплоти і швидкістю поширення теплоти
Залежність між критеріями подібності представляється у вигляді критеріальних рівнянь.
Загальний вигляд критеріального рівняння вимушеної конвекції можна записати так:
Nu=f(Re,Pr)
Визначальним є критерій Рейнольдса. По його величині можна вибирати показник степеня і коефіцієнгив рівнянні.
Длявільної конвекції критеріальне рівняння має вигляд:
Nu=f(Gr,Pr)
Де визначальним є критерій Грасгофа.
Для вільно-вимушеної конвекції:
Nu=f(Re,Gr,Pr)
Для вибору теплофізичним параметрів при розрахунку критеріїв подібності при вільній конвекції визначальною є середня температура між стінкою і рухомим середовищем, при вимушеній- середня температура рідини.
23. Променистий (радіаційний) теплообмін
Променистий теплообмін - це процес поширення теплоти за допомогою електро матнітнж хвиль.
Випромінювання характеризується довжиною хвилі X і частотою V. Теплове випромінювання має однакову природу з іншими видами випромінювання і відповідає діапазону довжин хвиль від 0,8-10-6 <λ<0,8-10-3 м. Роль теплового випромінювання особливо велика в процесах з високою температурою. Мж процесами теплопровідності, конвекції і променистим теплообміном існує суттєва різниця В процесах променистого теплообміну суцльність середовища необов'язкова. За рахунок променистого теплообміну тепло поширюється і в вакуумі.
Величина теплового випромінювання, яка відповідає дуже вузькому
інтервалу зміни довжини хвилі від λ до λ + dλ, який можна характеризувати даним значенням довжини хвилі λ, називається потоком монохроматичного випромінювання Qλ.
Потік випромінювання, який відповідає всьому спектру в межах від нуля до ∞, називається інтегральним або повним променистим потоком Q.
Потік, який випромінюється з одиниці поверхні по всіх напрямках наггівсф еричн ого простору називається густиною теплового потоку.
Випромінювання, яке визначається гриродою даного тіла називається власним. Енергія електромагнітних хвиль (Епад) які попадають на навколишні тіла, частково поглинаються ними (Епог). При і*ому частина енергії випромінювання переходигьу внутрішню енергію поглинального тіла, частина відбивається (Евід) і частина проходить крізь нього (Епр).
Згідно закону збереження енергії:
Епад= Епог+ Евід+ Епр (23.1)
Позначимо Епог/ Епад=А; Евід/ Епад=R; Епр/ Епад=Д
де А - коефіцієнт іюглннання;
R - коеф іцієнт відбивання;
Д - коефіцієнт пропускання
А+R+Д=1
Якщо тіло поглинає всі падаючі на нього промені. тобто.А=1. Д=0. R=0. то воно називається абсолютно чорним. Коли вся падаюча енергія відбивається. R=1, .A=0. Д=0. то тіло називається дзеркальним. .Якщо Д=1, .A=0. R=0, то таке тіло називається прозорим. Тіло, яке приймає участь в теплообміні крім власного випромінювання буде відбивати падаючу на нього енергію:
Евід= RЕпад (23.2)
Сума енергії власного і відбитого випромінювання становить ефективне випромінювання
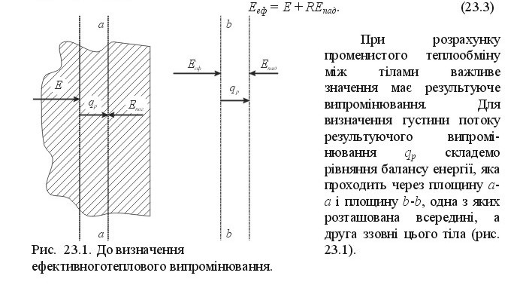
Для площини а-а
qp=E-Eпог=Е-АЕпад (23.4)
Для площини b-b
qp=Eеф-Епад (23.5)
Із рівняння (23.4)
Eеф= qp +Епад (23.6)
В свою чергу (23.4)
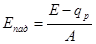
Підставляючи вираз для Епад в рівняння (23.6) одержимо:
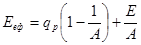 (23.7) (23.7)
23.1 Закони променистого теплообміну
Залежність мі ж спектральною інтенсивністю випромінювання абсолютно чорного тіла і довжиною хвилі встановиюсзакон Планка:

де с1=3,74∙10-16Вт∙м2
с2=1,44∙10-2м/град

При декому значенні λm залежність має максимум. Для всіх довжин хвиль інтенсивність випромінювання тим вища, чим вища температура. Максимум кривих з підвищенням температури зміщується в сторону більш коротких довжин хвиль.
Згідно закону зміщення Віна:
λmaxT=2,898∙10-3 мК (23.9)
Якщо проінтегрувати залежність (23.8) по всьому інтервалі хвиль одержимо закон Стефана-Больцмана. Гостина інтегрального випромінювання для абсолютно чорного тіла пропорцйна температурі в четвертій степені:
Е=σ0∙Т4, (23.10)
де σ0= 5,6710-3 Вт/мК- постійна Стефана-Больцмана.
Для сірих тіл:
Е=εσТ4 (23.11)
де ε - ступінь чорноти - відношення випромінювальної здатності сірого тіла до випромінювальної здатності абсолютно чорного тіла при цій же темпер атурі.
Згідно закону Кірхгофа відношення густини потоку випромінювання сірого тіла до його поглинальної властивості не залежить від природи тіла і рівне густині потоку випромінювання абсолютно чорного тіла при цій же темпер атурі.
Розглянемо систему двох тіл, які мають необмежені плоскі поверхні, повернуті одна до іншої (рис. 23.1.2). Поверхня 1 належить сірому тілу, а поверхня 2 - абсолютно чорному.

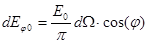
Де Eφ0 - густина потоку випромінювання, яка відповідає куту φ
dΩ - елементарний тілесннйкуг.
23.2 Теплообмін між дбома тілами
Як правило, тілов процесі променистого теплообміну взаємодіє з іншими тілами Розглянемо процес теплообміну між двома плоско паралельними поверхнями, (рис 232.1). Дія кожної повфхні задані постійні в часі температури Т1 і Т2 (Т1>Т2), поглинальні властивості тіл А1 і А2.
Падаючий на пластину променистий потік рівний ефекгивн ому випромінюванню першої пластини і навпаки.
Тоді результуючий тепловий потік:
Q1-2=Eеф1- Eеф2 (23.14)
В свою чергу за формулою (23.7):
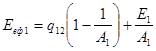

Враховуючи що Q12=-Q21 і підставляючи в значення q12 одержим:
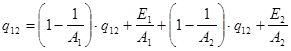

Звідси:
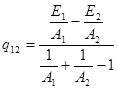
Згідно закону Кірхгофаі Стефана-Больцмана:

звідси
 (23.15) (23.15)
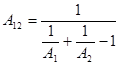 (23.16) (23.16)
Розглянемо променистий теплообмін між двома тілами, одне з яких знаходиться є порожнині іншого (рис 23.2.2). Поверхня внутрішнього тіла F1 випукла, зовнішнього F2 - ввігнута - відповідне значення температур поверхонь Т1 і Т2 (Т1>Т2) пошинальні властивості тіл А1 і А2. Резупьтуючий тепловий потік, який передається від першого тіла до другого, визначається рівнянням:
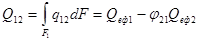 (23.17) (23.17)
де φ21- середній кутовий коефіцієнт випромінювання, який характеризує частину випромінювання зовнішньої поверхні, яка по падає на внутрішню.
Частина енергії, яка залишилася, проходить повз внутрішнє тіло і знову попадає на зовнішню поверхню.

Рис 23.2.2. Схема променистого теплообміну між тілами в замкнутому просторі
Повні потоки ефективного випромінювання визначається співвідношенням:
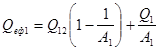 (23.18) (23.18)
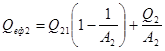
Враховуючи, що Q12 = -Q21 також співвідношення (23.17) і (23.18) одержима
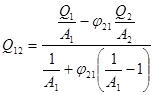
Замінити співвідношення 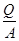 виразом виразом
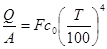
одержимо:
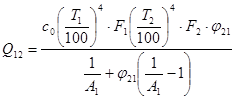
Дня визначення величини φ21 приймаємо Т1= Т2 і отже Q12 = 0.
В цьому випадку F1- φ21F2=0 , звідси
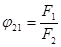
Кінцевий вираз для результуючого потоку:
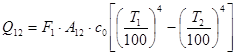 (23.19) (23.19)
де:

приведена поглинальна здатність системи
При випромінюванні тіла в необмежений простір з температурою Т2 приймемо F1<<F2. Тоді:
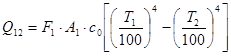 (23.20) (23.20)
При наявності екранів поглинапьна здатність:
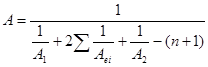
Де А1, А2 -тюглинапьна здатність тіл;
Аеі – поглинальна здатність і-го екрану;
п-кількість екранів.
24. Теплопередача
Теплопередачу можна розглядати як теплопровідність при граничних умовах треть ого роду. Теплопередача включає в себе: тепловіддачу від більш гарячої рідини до стінки, теплоповідність в стінці, тепловіддачу від стінки до більш холодного середовища.
Теплопередача - це передача тепла від одного рухомого середовища до іншого через розділюючу стінку до іншого.
24.1 Тепюпередача через плоску спинку
При стаціонарному тепловому режимі тепловий потік через стінк
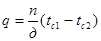 (24.2) (24.2)

Той же тепловий потік передається від стінки до холодного середовища
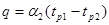
Рівняння можна зали сатиувнгляді:
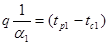
 (24.3) (24.3)
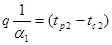
Якщо просумувати всі рівняння отримаємо:
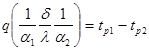
Тепловий потік становить:
 (24.4) (24.4)
Величину

називають коефіцєнтом теплопередачі,
Рівняння можна загасати у вигляді:
q=k(tp1-tp2),  (24.5) (24.5)
Величина, обернена до коефіцієнта теплопередачі, називається повним термчнимопоромтеплопередачі:

Оскільки загальний термічний опір складається з часткових термічних опорів, то у випадку багатошарової стінки необхідно враховувати опір всіх складових:
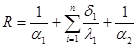 (24.6) (24.6)
Густина теплового потоку через багатош рову стінку:
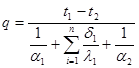 (24.7) (24.7)
Температури поверхонь:
 ; ; 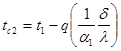
На межі двох шарів температуру можна визначити за формулою:
 (24.8) (24.8)
24.2 Теплопередта через циліндричну стішу
Розглянемо однорідну циліндричну стінку довжиною l зі сталим коефіцієнтом теплопровідності λ (рис. 24.2.1). Температури рухомих середовищ відповідно tр1 і tр2 постійні коефіцієнти тепло віддачі на внутрішній і зовнішній поверхнях труби а1, і а2.
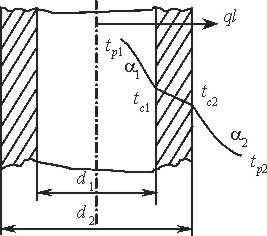
Рис. 24.2.1. До визначення теплового потоку через циліндричну стінку.
Допустимо, що довжина труби велика порівняно з товщиною стінки. То му в трата ми з тор ця тру ои можна знехтувати.
Кількість тепла, яке поступає від рухомого середовища до стінки і від стінки до другого середовища буде одна і таж
Від середовищадостінки:
q1=a1πd1(tр1- tc2)
Тепловийпотік через стінку:

Від стінки до другого серед овища:
q2=a2πd2(tр1- tc2)
Запишемо рівняння наступним чином:
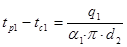
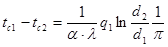
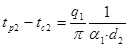
Просумуємо рівняння і одержимо:

Звідси:
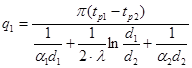
Позначимо:
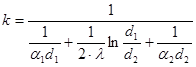 (24.9) (24.9)
Рівняння запишеться:
q1=k1pπ(t1-t2), Вт/мК
Значення k1 чисельно рівне кількості теплоти, яка проходить через стінку довжиною 1м за одиницю часу від одного середовища до іншого при різниці температур між ними в один градус.
Величина
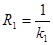
обернена до лінійного коефіцієнта теплопередачі називається лінійним термічним опором теплопередачі.
Окремі доданки повного термічного опору представляють собою:
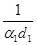 , , 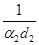 - термічні опори тепловіддачі на відповідних поверхнях; - термічні опори тепловіддачі на відповідних поверхнях;
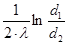 - термічний опір теплопровідності стінки. - термічний опір теплопровідності стінки.
Якщо тепловий потік через циліндричну стінку віднести до внутрішньої або зовнішньої гюверхні стінки, то отримаємо густину теплового потоку Вт/м , віднесену до одиниці відповідної поверхні труби:
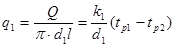
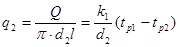
Тобто:
kl=d1.k1= d2.k2
Формули для k1і k2 мають вигляд:
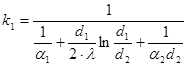
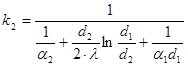
У випадку теплопередачі через багатошарову стінку система рівнянь (24.9) повинна бути замінена системою, яса враховує опір теплопровідності всіх шарів:
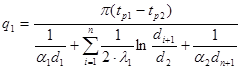 (24.10) (24.10)
З рівняння отримаємо, що:
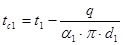
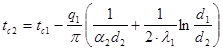

Критичиеий діаметр теплопередачі через циліндричну стінку. Розглянемо вплив зміни зовнішнього діаметра на термічний опір однорідної циліндричної стінки:
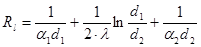
При постійних значеннях а, d, λ та a2 - повний термічний опір циліндричної стінки буде залежати від зовнішнього діаметра.
При збільшенні d2 вираз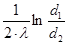 - буде зростати, а - буде зростати, а  - зменшуватись. - зменшуватись.
Дослідимо Rl як функцію d2 на екстремум:

При 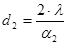 - термічний опір теплопередачі буде мінімальним. - термічний опір теплопередачі буде мінімальним.
Значення зовнішнього діаметра труби, яке відповідає мінімальному критичному опорові теплопередачі називається критичним діаметром і позначається dкр:
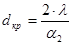 (24.11) (24.11)
Якщо труба має ізоляцію зовнішнім діаметром й-^ то термічний опір для такої труби буде:

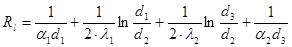
24.3 Шляхи інтенсифікації теплопередачі
Розшянемо шляхи інтенсифікації теплопередачі:
а) інтенсифікація теплопередачі шляхом збільшення коефіцієнтів тепловіддачі.
З рівняння теплопередачі Q=kF∆t слідує, що при заданих розмірах стінки і температурах рідини величиною, яка визначає тепловий потік, є коефіцієнт теплопередачі k. Але оскільки при теплопередачі k є характеристикою складною,тонеобхіднопроаналізувативсіскладові:

При  =0 (длятонких стінок): =0 (длятонких стінок):
Із рівнянь видно, що коефіцієнт теплопередачі не може бути більшим найменшого а.
При а2 →∞, k→ а1
При а1→∞, k→ а2
Якщо збільшення більшого з коефіцієнтів теплопередачі (а2) практично не дає збльшення k Збільшення меншого з коефіцієнтів а1, в 2-5 разів дає збільшення k в 2,5 разів.
б) інтенсифікаціятеплопередачі зарахунокоребрення стінок.
При передачі теплоти через циліндричну стінку термічний опір  і і
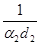 визначається не лише коефіцєнтом тепловіддачі, але і розмірами самих поверхонь. Таким чином, якщо а мале, то термічний опір можна збільшити шляхом збільшення відповідної поверхні. визначається не лише коефіцєнтом тепловіддачі, але і розмірами самих поверхонь. Таким чином, якщо а мале, то термічний опір можна збільшити шляхом збільшення відповідної поверхні.
Збільшити поверхню плоскої стінки, можна шляхом оребрення. При використанні методу оребрення необхідно керуватися наступним:
якщо а1<<а2, то ореорення поверхні доцільно проводити зі сторони а1 до тих пір, поки а1,F1, не досягне значення а2,F2, Подальше збільшення поверхні F1 мало ефективне.

Теплопередача через ребристу стінку.
в) інтенсифікація теплопередачі можлива за рахунок збільшення &.І. Це можна досягнути змінюючи температуру теплоносія, або схему руху.
24.4 Принцип розрахунку теплообмінних апаратів
По принципу дії всі теплообмінники можуть бути розділені на три групи: рекуперативні,регенеративні і змішувальні.
В рекуперативних теплообмінниках теплообмін здійснюється через розділ яючи п ер егор одку.
В регенеративних теплообмінниках передача теплоти здійснюєть ся почерговим омиванням поверхні гарячимі холодним тепло носієм.
В теплообмінниках змопування теплообмін здійснюється безпосереднім змішуванням гарячого і холодного теплоносія.
Зупинимося на розрахунку рекуперативних теплообмінників, які найчастіше зустрічаються в техніц. При розрахунку теплообмінників можуть зустрітися наступні задачі:
-визначення поверхні нагріву F, яка забезпечує передачу заданої кількості теплоти;
-визначення кількості теплоти Q яке може бути передане при відомій
поверхні F
- визначення кінцевих температур теплоносіїв при відомих значеннях F і Q
Основними розрахунковими рівняннями для рішення поставлеіих задач є
рівняння теплопередачі:
Q=k∙F∙Дtсер (24.12)
і рівнданя теплового балансу:
Q=G1c1(t’1-t’’1)= G2c2(t’2-t’’2)
Де G1 і G1 -витати гарячогоі холодного теплоносіїв;
c1 і с2 -відповідно теплоємності теплоносіїв;
tr1, і ts1, а також tr2, і ts2- початкова і кінцева температура гарячого і холоди ого теплоносіїв.
Оскільки температури гарячого і холодного теплоносіїв змінюється, то відповідно змінюється різниця температур. Тому в формулі (24.12) використовують ∆Дсер- середню різницю температур. Середня різниця температур залежить від схеми руху теплоносіїв.
.Якщо робочі середовища рухаються вздовж поверхні нагріву в одному напрямі такий потік руху рідин називається прямотечійним, зустрічний паралельний рух рідин називається протигоком. Якщо в різних поверхнях нагріву є обидва вигадки руху, такий рух називається змішаним і якщо обидва теплоносії рухаються в взаємно перпендикулярних площинах, такий рух називається перехресним
Рис. 24.4.1. Схема руху рідин в теплообмінниках. а) прямотечійний; б) протитечійнщ в) змішаний; г,д) перехресний: 1 - гарячий теплоносій; 2 -холодний теплоносій.
Середній температурний напір. Розглянемо теплообмінний апарат, який працює за схемою прямотоку.
Нехай в довільному перерізі температури теплоносіїв tr, і ts Температурний напір:
t’-t’=τ (24.13)

δQ=m1cp1∙dt’= m2cp2∙dt’
або
 ; ; 
Продиференціюємо рівняння (24.13), підставивши в нього значення dtr I dts
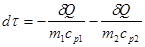
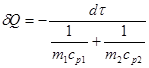
Позначимо:

Тоді:
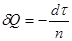
Підставивши значення δQ із (24.15) в рівняння (24.14), одержимо:
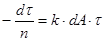 або або 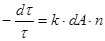
Інтегруємо рівняння в межах від t’1- t’2 =τ1 до t’’1- t’’2 =τ2 і від 0 до А знаходимо:
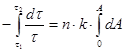 ; ; 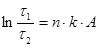
Звідки:
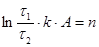 (24.16) (24.16)
Проінтегруємо рівняння (24.15):
Q=( τ1-τ2)n
і підставимо в нього значенняп з рівняння (24.16):
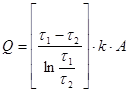
де τ1=t’1- t’2 =Дmax - максимальний перепад температур для даного теплообмінника.
τ2 =t’’1- t’’2 =Дmin - мінімальний перепад температур.
Середній температурний напір можна записати та
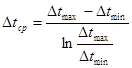 (24.17) (24.17)
Аналогічну формулу можна одержати якщо розглядати протитечійну схему руху.
При 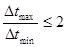 Дtcp можна визначити за формулою: Дtcp можна визначити за формулою:
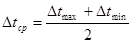 (24.18) (24.18)
25. Методи термодинамічного аналізу енерго-технологічних систем (ЕТС)
Енергетичний метод. Найпростішим методом термодинамічного аналізу ЕТС є енергетичний метод, оснований на першому законі термодинаміки. Цей метод дозволяє оцінити втрати енергії в технологічній системі і її окремих елементах, а також виявити участки, де втрати теплоти максимальні.
Суттєвим недоліком енергетичного методі є те, що він не враховує цінність різного виду енергії, її придатність. Тому більш широке поширення отримали ентропійнийі ексергетичний методи аналізу.
Ектроггійний метод термодинамічного аналізу оснований на першому і другому законі термодинаміки.
Дня термодинамічної оцінки ефективності системи (установки) необхідно відповісти на чотири запитання:
який ККД оборотного циклу, від яких факторів він залежить і що необхідно дляйого збільшення;
як розприділяються втрати по окремих елементах установки.
на удосконалення якої частини установки необхідно звернути увагу з метою зменшення ступ єн я необоротності.
У відповідності з щми задачами термодинамічний аналіз установки проводиться в два етапи: спочатку аналізується оборотний цикл, а потім необоротний.
ККД оборотного циклу:
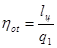
Для того, щоб оцінити, наскільки даний дійсний (необоротний) цикл менш досконалій, чим теоретичний, вводять поняття відносного внутрішнього ККД циклу як відношення:
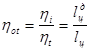
Ефективність реальної установки в цілому характеризується ефективним ККД ηв який представляє собою відношення кількості енергії (в формі теплоти або роботи), відданої зовнішньому споживачу до кількості енергії (в формі теплоти абороботи), підведеної доустановки.
В термодинамічній системі, яка складається з багатьох елементів необхідно враховувати ККД кожного елементу ηв,j
Перемноживши між собою всі ефективні ККД елементів системи на абсолютній внутрішній ККД циклу, одержимо ефективний абсолютний ККД для всієї системи.

де 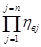 - добуток величин ефективних ККД які характеризують необоротні втрати в всіхп елементах системи. - добуток величин ефективних ККД які характеризують необоротні втрати в всіхп елементах системи.
ККД показує, яка доля виділеної в системі теплоти перетворюється в корисну роботу, віддану зовнішньому споживачу.
lпов=ηвq1
Очевидно, що втрати теплоти ∆q = (1-ηс) q1 представляють собою долю теплоти q1, яка не перетворилася в роботу і включає теплоту q2 передану холодному джерелу і втрати теплоти ∆qвт , обумовлені необоротністю процесів в окремих елементах установки в результаті тертя і кінцевої різниці температур, втратами в навколишнє середовище.
Очевидно:
∆qвт=lц-lпов
де lц - робота, яка виконується в оборотньому циклі.

Рис 25.2 Діаграма Грасмана- Шагурта компресійної теплонасосної установки.
В відкритих системах ексергія речовини рівна нулю, в закритих системах, коли відсутній обмінречовиничерез межі системи, рівні нулю ексергії потоку речовини і нульова ексергія.
В хімічних реакторах періодичної дії нугтьова ексергія при хімічних перетвореннях є основною.
Ексергетичний коефіцієнт корисної дії для малих машині апаратів:
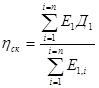
Діаграма Грассмана - Шаргута. Для аналізу термодинамічних циклів, роботи машин і апаратів використовується діаграма Гзассмана-Шаргута.
Націй діаграмі кожний потік ексергії позичається полосою, ширина якої пропорційна значенню ексергії.
На рис 25.1 і 25.2 представлена схема і відповідно діаграма Цїассмана-Шаргута компресорної теппонасосної установки
В компресорі П проходить стиснення парів низькокиплячого теплоносія, телячого він поступає в конденсаторІІІ. Тут пари теплоносія охолоджуються і конденсуються при високому тиску, при цьому виділяється кількість теплоти Q", яка далі використовується для нагріву. Із апарату Ш конденсат поступає в дросель IV, де в результаті дроселювання його температурапоннжується Ддлі охолоджений конденсат поступає в випарник V, де з а рахунок теплоти Q’< Q" яка підводиться з навколишнього середовища він повністю випарюється Утворєні в випарнику пари теплоносія поступають в компресор II
На діаграмі величина втрати ексергії в кожному елементі установки відповідає зменшенню полоси ексергії і умовно позначається заштрихованим трикутником. На вході ексергія рівна ексергії електродвигуна. В елементі І проходять втрати ексергії, пов'язані з втратами в приводі. Дані по ходу відмічені втрати ексергії в окремих елементах. Втрати ексергії мають різну природу і можуть бути пов"язані із кінцевою різницею температур, із теплообміном з навколишнім середовищем, теплопровідністю, тертям в деталях і вузлах машин і тд. Діаграма дозволяє встановити де спостерігаються максимальні втрати ексергії і розробити заходило їх зниженню.
26. Шляхи економії енергоресурiв
26.1 Вторинні енергоресурси і відновлювальні джерела теплоти
Одним із важливих шляхів економії енергоресурсів є використання вторинних енергоресурсів (ВЕР) і в т.ч. і відновлювальних джерел теплоти (ВД).
Під ВЕР розуміють хімічно зв'язану теплоту, фізичну теплоту і потенціальну енергію надлишкового тиску продукції, відходів, побічних і проміжних продуктів, які утворюються в технологічних агрегатах (установках, процесах), не використовуються в самому агрегаті, але можуть бути частково або повністю використані для енергопостачання інших агрегатів. ВЕР можуть використовуватись безпосередньо без зміни ввду енергоносія або зі змною енергоносія шляхом одержання теплоти, енергії, холоду абот ехнічної роботи в утилізаційній установці.
В залежності від виду і параметрів робочих тіл відрізняють чотири основних напрямки використання ВЕР:
- паливне - безпосереднє використ ання горючих компонентів в якості палива;
- теплове-використання теплоти, яку одержуємо зарахунокВЕР;
- ситове ( використання механічної та електричної енергії, яка виробляється за рахунок ВЕР;
- комбіноване;
Найбльші джерела ВЕР мають підприємства чорної і кольорової металургії, хімічної і нафтопереробної промисловості.
В даний час тегпота високого потенціалу в загальній витраті корисної енергії складає 26% Із загальної виграти теплоти високого потенціалу 33% йде на плавку, 40% на нагрів і 20% на випалювання руд.
Приблизно 52% всієї корисної енергії в народному господарстві витрачається в виді теплоти середнього (373-623 К) потенціалу і на її одержання витрачається 38% всіх паливно-енергетичних ресурсів. Ця теплота використовується для задоволення технологічних потреб. Основними енергоносіями,які забезпечують середнії низькотемпературні процеси є пара і гаряча вода.
Для утилізації ВЕР найбільш поширеними в різних галузях народного господарства установками є котли-угилізатори, які використовують високо потенціальні димові гази промислових печей і технологічні гази хімічного виробництва, а такожводяні економайзери для нагріву живильної води котлів і повітрепідігрівачів для нагріву дуттєвого повітря.
Котли-утилізатори забезпечують велику економію палива шляхом генерування енергетичної і технологічної пари, а також нагріву води.
Можлива виробітка тегпоти в виді пари або гарячої води в утилізаційній установці за рахунок теплових ВЕР в загальному вигляді визначається за формулою
QT=(h1G1- h2G2)β(1-ζ)
а можлива виробітка холоду
Qx= QTε
де G1 і G2 -кількість енергоносія на вході і на виході.
h1, h2- ентальпія
β - враховує невідповідність годин роботи і режиму утипізаційної установки і джерела ВЕР.
ζ - коефіцієнт, який враховує втрати;
ε - холодильний коефіцієнт.
Можлива виробітка електроенергії в утипізаційній турбіні за рахунок ВЕР.
W=mВЕР∙τ∙l∙ηoi∙ηM∙ηI∙
де mВЕР∙-часова кількість енергоносія,яка має надлишковий тиск.
τ -число годинроботн;
l -робота ізоентропного розширення;
ηoi∙ - внутрішній відносний ККД турбіни;
ηM - механічний ККД;
ηI∙ -ККД генератора.
26.2 Відновлювані джерела теплоти
Відновлювальними джерелами теппоти є енергія сонця, енергія вітру, припливів і відпливів і т.д.
Таблиця 26.1. Природні ресурси енергії і їх величина.
| Назва |
Величина (кВт∙г) |
| Невідновлювальні джерела теплоти |
| Термоядерна енергія |
100000000∙1012 |
| Ядерна енергія ділення |
547000 012 |
| Хі мічна енергія корисних копалин органічного походження |
55000 1012 |
| Внутрішнє тепло земні |
134 1012 |
| Щорічно поповнювальні ресурси |
| Еіергія морських приплив в |
70000 1012 |
| Енергія падаючого на землю сонячного проміння |
58000∙1012 |
| Енергія сонячного проміння, яке акумулюється в верхніх шарах атмосфери (150-200 км) в вигляді атмосферних кисню і азоту. |
0,012∙1012 |
| Енергія вітру |
1700∙1012 |
| Енергія рік |
18∙1012 |
Всі види енергії, які виробляються на землі складають 5% від поступаючої на землю сонячної радіації. Температура в центрі сонця досягає 10 °С. Температура на поверхні сонця 5500°С.
Сонячна енергія є виключно чистим джерелом енергії. її використ ання не зв'язано з забрудненням навколишнього середовища. Трудність її використання пов'язана із технічними проблемами її перетворення Сонячна радіація дуже розсіяна і має малу густину.
Одним із напрямків використання сонячної енергії є її перетворення в теплову.
Сонячні печі мають параболічний рефлектор. При діаметрі зеркала 1,5 м в тропічних умовах потужність, яку получають в фокусі такого пристрою складає 0,5 -1 кВт. Температура встановлюється на протязі години.
Дня одерлання дуже високих температур використовують декілька параболічних дзеркал (рис 22.2.1), таким чином, що вони мають спільний фокус. В системах, які складаються з декількох дзеркал додатково встановлюється плоске діеркало — геліостат, за допомогою якого слідкують з а сонцем і направляють проміннянанерухомідзеркала.
Рис. 22.2.1. Пристрій дляперетворення сонячної енергії в т еппову. 1 -рефлектор.
В лабораторії сонячної енергії Французького національного науково-дослідного центру, розміщеній в західних Піренеях за допомогою сонячної печі з дзеркалом діаметром біля 10 метрів, булипроведені роботи по очистці особливо тугоплавких металів.
Тепер встановлено параболічне діеркало діаметром 50 м. Воно виготовлене із 8000 невеликих дзеркал В фокусі одержують зображення сонця в виді кругу діаметром 50см. Таке дзеркало може забезпечити потужність 1200 кВт. Матеріал в центрі розппавляється і температура досягає 3000°С. За рахунок того,що тіглі обертаються, матеріал не виливається Тйким чином розплавляються оксиди кремнію і цирконію.
Використовують сонячну енергію для опалення, арячого водопостачання, нагріву води в басейнах. Складовою частиною є пластина-поглинач. Вода, чи повітря яке знаходиться в контакті з пластиною-поглиначем нагріваються.
Одним із шляхів використання сонячної енергії є акумулюання з можливістю забезпечення його рівномірного споживання.
Для акумулювання тепла необхідно забезпечити рівномірний нагрів. Використовують басейн з водою, парафін, камінь, шоуберову сіль Nа2SО410Н2O, яка плавиться при температурі 32°С, при цьому затрачується на руйнування кристалічної решітки 67 Вт∙г/кг.
26.3 Розробка раціональної схеми підприємства
Основним напрямком про розробці раціональної теплової схеми підприємства харчової промисловості є:
Вибір технологічного режиму з можливою низькою температурою процесів нагрівання.
Розвиток енерготехнологічного комбінування з метою найбільш повного використання генерованих енергоносіїв в виробничому процесі.
Основними напрямками енерготехнологічного комбінування є наступні: Комбінуванняпаровогокотлаі сушарки з метою використання димових газів для сушки продуктів, які використовуються в якості фуражу (сушка жому).
Комбінування парового котла із абсорбційною холодильною машиною з метою використання димових газів в якості теплоносія (птвоварені заводи).
Комбінування газотурбінної установки і сушки. Його метою є використання теплової енергії від палива і використання димових газів для скіпки.
Комбінування вистарної установки і скіпки. Для нагріву вологого гювітря в калорифері сушарки в якості енергоносія може бути використана пара або конденсат від випарної установки або те і інше одночасн о.
Комбінування випарної установки і ректифікаційної установки без посер едньо зв'язаних на лінії роз чину.
Комбінування випарної і абсорбційної холодильної машини. Ця комбінація може бути використана на цукрових заводах для зберігання буряку.
Комбінування випарної установки і вакуум кристалізаторів.
Міністерство освіти і науки України
Тернопільський державний технічний університет імені Івана Пулюя
Кафедра обладнання харчових технологій
МЕТОДИЧНІ ВКАЗІВКИ
до лабораторної роботи № 1
«Дослідження процессу адіабатного витікання газу (повітря) через сопло».
Тернопіль 2003
Дослідження процесу адіабатного витікання газу (повітря) через сопло
Мета роботи: поглибити знання в питаннях витікання газу (повітря), експериментальне визначити розхід і швидкість витікання повітря через сопло при різних тисках перед ним.
Теоретичні основи витікання
Витікання - це процес прискореного руху і азу в коротких каналах змінного перерізу.
Канал, в якому збільшується швидкість струмини І падає тиск робочого тіла, називають соплом, В соплах потенціальна енергія газу перетворюється в кінетичну енергію потоку, їх використовують в парових і газових турбінах, реактивних двигунах, турбо- і пароструменевих компресорах.
Канап, в якому сповільнюється рух робочого тіла і збільшується його тиск, називають дифузором. В дифузорах кінетична енергія потоку газу перетворюється в його потенціальну енергію, їх використовують в турбо- і пароструменевих компресорах, а також в вентиляторах.
Рухаючись в горизонтальному каналі, газ виконує роботу подоланая зовнішнього тиску о\ру) і зміни кінетичної енергії потоку:
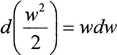
В цьому випадку рівняння пертого закону термодинаміки мас вигляд (для газового потоку):
dg=dU+d(pv)+wdw=di+wdw (1.1)
де: g - питома теплота, то сприймається газом, Вт/м2;
U - внутрішня енерпя газу, Дж/кг;
р - тиск газу. Па;
v - питомий об'єм газу, м3/кг;
w - швидкість потоку, м/с;
і - ентальпія газу, Дж/кг. Рівняння першого закону термодинаміки мас вигляд:
dg-di-vdp (1.2)
Прирівнюючи формули (1,1) і (1,2) одержуємо:
wdw=-vdp (1,3)
Це значить, шо приріст кінетичної енергії визначається роботою зміни тиску vdp; при збільшенні швидкості потоку (dw>0) тиск газу (dр<0) зменшується, і навпаки.
При русі газу в каналі кінцевої довжини (рис. 1.1, а) його параметри змінюються від v1, р1, Т1, до vу, ру, Ту (рис. 1.1, б). Робота зміни тиску - 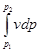 в рv - координатах зображується площею М1УКМ (рис 1.1, в). в рv - координатах зображується площею М1УКМ (рис 1.1, в).
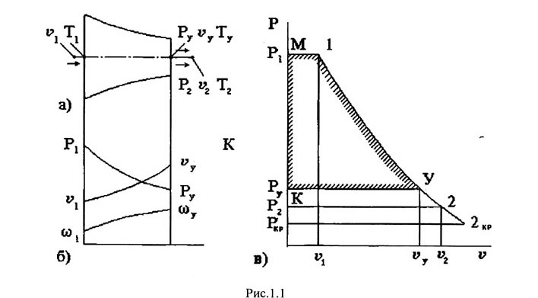
В соплах і дифузорах контакт газу з каналом короткочасний, тому обміном з навколишнім середовищем нехтують. Це дозволяг розглядати витікання як адіабатний процес (dg=0). В цьому випадку рівняння (1.1) приймає вигляд wdw=-dі, а для каналу кінцевої довжини (сопла) після інтегрування:
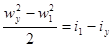 (1.4) (1.4)
це: w1,wy - швидкість газу відповідно на вході і в гирлі каналу, м/с;
і1, іу - ентальпія відповідно на вході і в усті каналу, Дж/кг, Для сопел wу >>w1, тому величиною w1 частіше всього нехтують. В цьому випадку
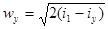 або або 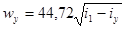 (1.5) (1.5)
якщо ентальпія виражена в кілоджоулях на кілограм (кДж/кг).
Для газів що повністю або приблизно підпорядковуються рівнянню рv=RТ і справедливі умови і=СрТ, Сp=RК/(К-1), рівняння (1.5) приймає вигляд:

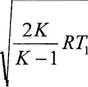
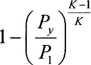 (1.6) (1.6)
де: К - показник адіабати, К=Сp/Сv;
R - питома газова стала, Дж/кг К,
Якшо відома площа перерізу в усті сопла f, то із умови нерозривності потоку масовий розхід газу:
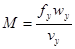 (1.7) (1.7)
з врахуванням (1.7):
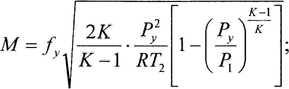 (1.8) (1.8)
Із (1.7) і (1.8) слідує, шо для даного газу (k-соnst) з початковими параметрами р1, і V1, швидкість його потоку і розхід визначається тільки відношенням тисків Рv/Р1=β. Так швидкість і розхід зростають при збільшенні Р1. Це досягається збільшенням абсолютного тиску Р, середовища, з якого витікає газ (див. рис. 1.1 а). При цьому тиск в усті сопла Ру рівний тиску за соплом P2: до тих пір, поки швидкість потоку не досягне швидкості поширення звуку а в даному середовищі. З цією швидкістю поширюються пружні хвилі тиску (розрідження). Тиск Р2, при якому (wv досягає швидкості звуку, називають критичним і позначають Ркр а відношення цього тиску до тиску Р1- критичним відношенням Ркр / Р1= β кр
Хвиля зменшення тиску в усті сопла, яке виникає при Р2 < Ркр (β < β кр) не може поширюватись в соплі назустріч течії, так як а=w, як наслідок для всіх значень Р2 < Ркр (β < β кр) В усті сопла тиск Р2 =Ркр,. Тому, якщо витікання газу докритнчне (β < β кр), в рівняннях (1.6) і (1.8) замість відношеннч Рv / Р1 використовують величину Р2 / Р1= β,, а якщо витікання критичне і зверхкритичне (β < β кр) величину β кр=β кр /Р1. Залежність wv =f(β) i M =f1(β) зображені на рис. 1,2.
Рис 1.2
В рівняннях (1.6) і (1.8) для двоатомних газів К=1,4 і β кр =0,528, для багатоатомних газів К =1,3, а β кр =0,546.
Витікання газу супроводжується помітними втратами кінетичної енергії потоку на тертя між шарами газу і газу зі стійками каналу.
Із-за вказаних втрат кінетичної енергії дійсна швидкість витікання w w д, менша теоретичної w. Величину
φ= wд/ w
називають швидкісним коефіцієнтом сопла, а відношення дійсного масового розходу газу Мд до теоретичного М - коефіцієнтом розходу μ
μ = Мд / М (1.10)
Дійсний масовий розхід за 1 с. визначають, використовуючи швидкість витікання і питомий об’єм vд газу в усті сопла:
Мд=fy
або безпосереднім вимірюванням.
Лабораторна установка
Схема лабораторної установки показана на рис. 1.3.
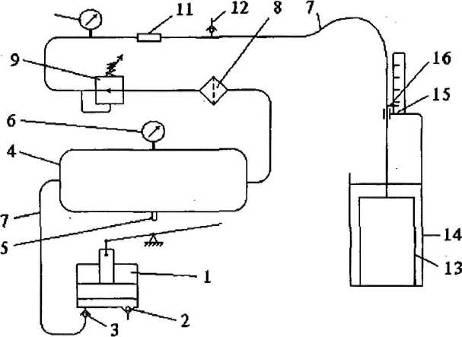
Рис.1.3 1- пневм о циліндр; 2- впускний клапан; 3-випускний клапан; 4 -балон; 5 - запобіжний клапан 6-10- манометри; 7 - трубопроводи; 8 - фільтр; 9-редуктор тиску; 11 - сопло; 12 - стравлюючий клапан; 13 - ковпак; 14 -посудина; 15 – шкала 16 - вказівник.
Повітря Із пневмоциліндра 1 поступає в балон 4, з якого через фільтр 8, редуктор тиску 9 і сопло 11 поступає по трубопроводу 7 в ковпак ІЗ, який знаходиться в посудині 14, заповненій водою. Повітря, яке поступає в ковпак ІЗ, витісняючи з нього воду, піднімає його вверх. Висоту підйому ковпака 13, визначаємо по шкалі 15 за допомогою вказівника 16. Випуск повітря із ковпака 13 проводиться за допомогою стравлюючого клапана 12.
Діаметр ковпака дорівнює 150 мм.
Постановка дослідів
1.Одержати завдання на досліди на шість-вісіи значень Р ,
2.Розрахувати абсолютний тиск (Рабс< Па) для всіх значень β. Тиск в ковпаку 13 (Р2 Па) прийняти рівним атмосферному.
По тиску Р1абс визначити тиск Р1м для манометра 10 для всіх значень р,
З допомогою п не вм о циліндра і заповнити балон 4 стиснутим повітрям до тиску 2-3 атмосфери по манометру 6.
Редуктором тиску 9 відрегулювати тиск повітря Р1м по манометру 10 (при відкритому стравлюючому клапані 12).
По шкалі 13 відмітити положення показника 16
Закрнти стравлюючий клапан 12, одночасно включивши секундомір і визначити положення показника 16 по шкалі 15 при підйомі ковпака 13 на
Відкрити стравлюючий клапан 12 і відрегулювати редуктором тиску 9 по манометру 10 тиск Р1м (для другого значення 0) і продовжити досліди,
Результати дослідів занести а таблицю.
Обробка дослідних даних
1.По рівняннях (1,6) і (1.8) визначити теоретичну швидкість витікання повітря і теоретичний масовий розхід повітря.
2,По рівняннях (1.9) і (1,10) підрахувати швидкісний коефіцієнт сопла φ і коефіцієнту розходу μ.
3.Побудувати графік залежності Mд =f(β) і визначити дійсний максимальний розхід повітря Mд =f(β)
4,Побудувати графік залежності wд =f(β)
Контрольні питання
Пояснити роботу установки по її схемі.
Пояснити черговість включення установки.
Як перевести установку в слідуючий режим роботи,
4.Записати і пояснити рівняння першого закону термодинаміки для потоку.
Пояснити характер зміни розходу повітря із зміною величини β,
Що називають критичним розходом і швидкістю витікання
7.Що називають коефіцієнтом розходу/г і швидкісним коефіцієнтом розходу φ
8.Який канал називають соплом, а який дифузором?
9.Чому при Р1 > Ркр збільшення тиску перед соплом не збільшує розхід повітря?
10.Коли наступає критичний режим витікання ічим він хара ктеризусться
11.Як визначити розрахункове і дійсне максимально можливе значення р для витікання повітря через сопло лабораторної установки
12.Яку швидкість має повітря при витіканні із сопла
Список літератури
1. Недужий НА.. Алабовский А.Н. Техническая термодинамика й теплопередача, К.: Вища школа, 1981, - 248 с.
2. Чечеткин А,В., Занемонец Н,А. Тєплотехника, М.: Вьісшая школа, 1986. - 344 с.
3. Міністерство освіти України
4. Тернопільський Державний Технічний університет імені Івана Пулюя
Кафедра обладнання харчових технологій
Методичні вказівки
до лабораторної роботи № 2
«Дослідження теплообмінного апарату».
Тернопіль 2003
Дослідження теплообмінного апарату
Мета роботи; Вивчити процес теплообміну в теплообмінних апаратах, ознайомитись з методикою і'х випробування, одержати навики в проведенні експериментів, їх призначення, вплив різних факторів на інтенсивність теплообміну.
Загальні відомості
А Типи теплообмінних апаратів
Теплообмінниками називаються такі апарати, в яких в Збувається передача тепла від одного теплоносія до іншого (процес нагрівання або охолодження).
В теплосилових установках до теплообмінних апаратів належать; паровий котел, пароперегрівач, водяний економайзер, підігрівач повітря, конденсатор, деаератор та ін.
По принципу дії теплообмінні апарати розділяються на рекуперативні, регенеративні, змішувальні із внутрішнім тепловиділенням.
В рекуперативних теплообмінниках тепло від одного теплоносія до другого передасться через стінку (поверхню теплообміну є котлах, пароперегрівачах та ін.)
В регенеративних теплообмінниках тепло передається поперемінним омиванням гарячим і холодним тілом спеціальних металічних плит (насадів -акумуляторів тепла), що мас місце в доменному виробництві.
В теплообмінниках змішуючого типу (контактних) тепло передається безпосередньо змішуванням обох тіл. Вони найпростішої конструкції, в них повніше використовується тепло, але мають обмежену область використання.
Такі теплообмінники - градірні - мають місце на теплові»: електростанціях, в розімкну тих системах охолодження двигунів внутрішнього згоряння, компресорних станцій та ін.
4.Теплообмінники з внутрішнім тепловиділенням мають місце в ядерній енергетиці.
Б. Схеми теплообмінних апаратів
Рекуперативні теплообмінники виготовляються трубчатими або пластинчастими. В свого чергу трубчасті теплообмінники бувають одно-, дво- і багатоходові.
Зміна температури обох теплоносіїв вздовж поверхні нагріву залежить ВІД схеми їх руху.
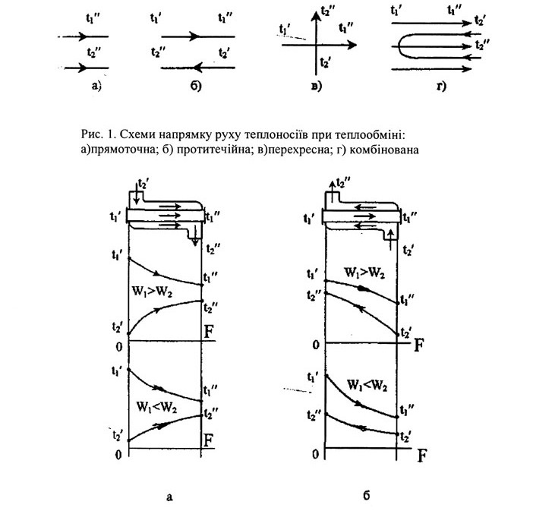
Рис, 2, Графіки зміни температури вздовж теплообмінника а)при прямоточній схемі б)при протитечійній схемі
Схеми руху теплоносіїв показані на рис. 1.
Прямоточна.
Протитечійна.
Перехресна.
Комбінована.
В усіх теплообмінниках температура більш нагрітого теплоносія, що вілдас тепло зменшується від t’1 до t’’1 ( а температура менш нагрітого збільшується віл t’2 до t’’2; . Одночасно різниця температур (температурний напір) між теплоносіями вздовж поверхні нагрівання також буде змінюватись від ∆tmax до ∆tmin
Характер зміни температур для прямоточної і протитечійної схем руху теплоносіїв показано на рис, 2.
В розглянутих схемах руху теплоносіїв також будуть мати місце рівні термічні опори тепловіддачі для кожного теплоносія і термічні опори тепловіддачі взагалі.
Звідси видно, шо буде різна і інтенсивність теплопередачі в теплообмінниках.
Інтенсивність передачі тепла від одного до другого характеризується коефіцієнтом теплопередачі К. Розглянемо схему передачі тепла через елемент стінки (рис.3).
Кількість переданого тепла (потужність теплового потоку) визначається формулою теплопередачі:
Q=kF∆tсер (1)
Де Q - потужність потоку тепла, Вт;
Р - поверхня теплообміну, м2;
k - коефіцієнт теплопередачі, Вт/м2К
tсер - середній температурний напір - середиьологарифмічна різниця між температурами теплоносіїв, град, С.
Коефіцієнт теплопередачі визначається формулою:
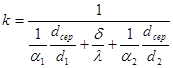  (2) (2)
для циліндричних сттнок.
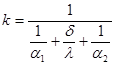  (3) (3)
для плоских та тонких циліндричних стінок.
де α1- коефіцієнт віддачі тепла від гарячого середовища до стінки. Вт/м" К;
δ- товщина стінки, м;
λ. - коефіцієнт теплопровідності стінки,:
а2- коефіцієнт віддачі тепла від стінки до холодного серелонища, Вт/м2 К;
dсер - середній діаметр, м.
Середній температурний напір залежить від схеми руху теплоносіїв в теплообміннику і їх фізичних властивостей (рис, 1 та рис. 2):

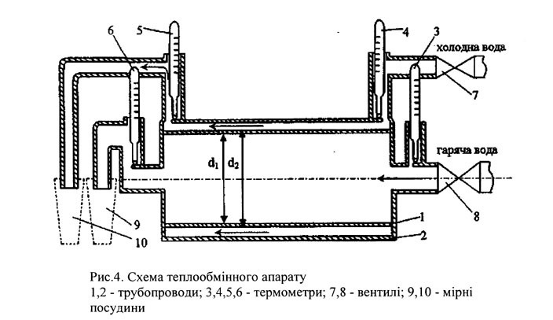
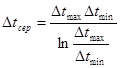 (3) (3)
Де ∆tmax-максимальна різниця між температурами теплоносіїв в °С;
∆tmin- мінімальна різниця між температурами теплоносіїв в °С;
∆tmax=t’1- t’2
для прямотоку
∆tmax=t’’1- t’’2
Якщо зміна температур теплоносіїв невелика, то можна використати середньоарифметичний напір, тобто при
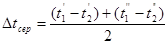 (3a) (3a)
Потужність теплового потоку Q, відданого гарячим і одержаного холодним носісм (нехтуючи втратами б навколишнє середовище), визначаємо з рівняння теплового балансу
Q=G1cp1(t’1- t’2)= G2cp2(t’’1- t’’2) (4)
де G1і G2 - масові витрати гарячого і холодного теплоносія, кг/сек;
cp1 і cp2- ізобарна теплоємність гарячого і холодного теплоносія, Дж/кг град.
Добуток 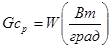 і називається умовним еквівалентом. Тоді рівняння (4) прийме вигляд: і називається умовним еквівалентом. Тоді рівняння (4) прийме вигляд:
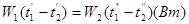 (4а) (4а)
Якщо позначити зміну температури через δt, то одержимо
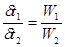 (4б) (4б)
Отже, чим більший еквівалент, тим менше змінюється температура даного теплоносія (мал, 2).
Якщо в теплообміннику тепло передається віл пари, що конденсується, то рівняння теплового балансу прийме вигляд:
Q=G2cp2(t’’2- t’2)=Gn(in-in) (Вт) (5)
де: in - ентальпія пари при вході в теплообмінник, Дж/кг;
ik - ентальпія конденсату, Дж/кг.
В. Випробовування теплообмінного апарату
Хід роботи
До проведення досліду необхідно вивчити схему установки.
По трубі 1 (рис. 4) з центральної системи подається гаряча вода. Кількість її протікання регулюється вентилем 8. Витрата гарячої води визначається мірною посудиною 9. Трубу 1 помішено в трубу 2 більшого діаметра, а в кільцевий простір між ними подається холодна вода з системи водопроводу. При передачі тепла температура одного теплоносія зменшується від t’1до t’’1, а другого підвищується від t’2 до t’’2
Розхід холодної води визначаємо мірною посудиною 10. Регулювання проводиться вентилем 7.
Теплообмінник зовні покритий тепловою ізоляцією. Температуру гарячої і холодної воли вимірюємо скляними спиртовими термометрами.
Під час проведення лабораторної роботи спочатку частково відкриваємо вентиль 7, потім вентиль 8 і встановлюємо стабільний тепловий режим, після того робимо вимірювання і записуємо в журнал випробування. Далі змінюємо кількість протікання холодної води, коли режим знову встановлюється повторюємо вимірювання. Вимірюваний проводимо 3-4 рази і визначаємо для кожного режиму середнє значення.
На основі даних досліду визначаємо за формулою (2) коефіцієнт теплопередачі і будуємо графік залежності k=f(v).
ПРОТОКОЛ ВИМІРЮВАННЯ
Показ барометра Во=мм.рт,ст
Температура оточуючого повітря = ос
| № досліду |
№ заміру |
Вода гаряча (гріюче середовище) |
Вода холодна (середовище, що нагрівається) |
| Температури на вході, t,0С |
Температура на виході t,0С |
К-сть води, води, см2 |
Трив, заміру, сек |
Тем-ра при вході t,0С |
Тем-ра на виході t,0С |
К-сгь зібр. води, см2 |
Трив, виміру сек |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| І |
1 2 3 |
| Середнє значення |
| ІІ |
1 2 3 |
| Середнє значення |
| Ш |
1 2 3 |
| Середнє значення |
| Найменування |
Позначення |
Розмірність |
Спосіб одержання величини |
Числові значення |
| 1 |
2 |
3 |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
| Внутрішній діаметр трубопровода |
d1 |
м |
| Зовнішній діаметр трубопровода |
d2 |
м |
| Робоча довжина трубопровода |
L |
м |
| Робоча поверхня теплообмінника |
F |
м2 |
ΠdсерL |
| Середня температура холодної води при вході |
t’2 |
0С |
3 показу термометра |
| Середня температура холодної води на виході |
t’2з |
°С |
3 повазу термометра |
| Середня температура холодної води |
t2сер |
°С |
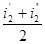 |
| Теплоємність холодної води |
Ср2 |
 |
3 таблиць |
| Густина колодної води |
ρ |
кг/м |
- |
| Кількість зібраної холодної води |
G2 |
кг/сек |
| Середня тем пература гарячої води при вході |
t’2 |
°С |
3 показу термометра |
| Середня температура гарячої води на виході |
t’’2 |
°С |
3 показу термометра |
| Середня температура гарячої води |
t1сер |
°С |
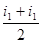 |
| Теплоємність гарячої води |
Ср1 |
 |
| Густина гарячої води |
ρ |
кг/м |
| Кількість зібраної гарячої води |
G1 |
кг/сек |
| Швидкість протікання гарячої води |
V |
м/с |
| Кількість тепла, відданого гарячою водою |
Q |
Дж/сєк |
За формулою (4) |
| Максимальний температурний напір між гарячою і холодною водою |
∆tmax |
°С |
∆tmax=t’1- t’2 |
| Мінімальний температурний напір між гарячою і холодною волою |
∆tmin |
°С |
∆tmax=t’’1- t’’2 |
| Середиьолога- рифмічний температурний напір між гарячої і холодною водою |
∆tсер |
°С |
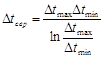 |
| Коефіцієнт теплопередачі |
k |
 |
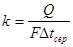 |

Використана література
1. М.Михеев, И.Михеева. Краткий курс теплопередач и, 1961.
2. А. Баскаров й др. Общая теплотехника, 1963.
3. Н.Кираковский, М.Недужий. Лабораторний практикум по курсу общей теплотехники, 1966.
4. Є.Міговк та В.Єресько, Лабораторні роботи з загальної теплотехніки, 1960.
Міністерство освіти України
Тернопільський державний технічний університет імені Івана Пулюя
Кафедра обладнання харчових технологій
Методичні вказівки
до лабораторної роботи № З
«Тепловіддача горизонтальної труби при вільному русі повітря».
Тернопіль 2003
У даних методичних вказівках подані теоретичні основи, опис експернментальної установки і практичні рекомендації лля проведення лабораторної роботи і обробки дослідних даних
Мета роботи - засвоїти знання з теорії" конвсктивнот теплообміну при вільному русі цілини (вільній конвекції), ознайомитись з метопи кою експериментального дослідження середньої характери стики процесу: іасвоіти поняття: чільна конвекція, тепловнР потік, густина теплового потоку, коефіцієнт тепловіддачі, температурний палір, теплофізичні властивості рідин.
Завдання
1. У процесі виконання експерименту визначити середні коефіцієнти тепловіддачі при вільному русі повітря біля горизонтальної трубн в залежності від температурного напору, стінка туби - навколишнє повітря.
2 Розрахував повну похибку експериментального визначення косфіціїнта тепловіддачі в даній лабораторній роботі.
3. Визначити коефіцієнт тепловіддачі за загальним критеріальнич рівнянням для учов експерименту і порівняти одержані значення з дослідними на графіку.
4 На основі виконаної роботи скласти звіт, що містить протокол спостережень, схему експериментальної установки, результати розрахунку з дослідних даних і з критсріальнОї залежності, розрахунок похибки.
До виконання роботи необхіднії приступати після поглибленого ознайомлення з літературою по темі /1-4/
Основні теоретичні відомості.
При розв'язанні техтчннх задач (наприклад, розрахунку теплових втрат трубопроводів, охолодження або нагрівання різних виробі н нрч металообробці, розрахунку тепло- і електрйОналювальних пристроїв тощо) часто епостер і гається теплообмін чіж твердич тілом і рухомою рідиною, який називається конвектнвним теплообміном, тепловіддачею аоо конвекцією
Характерною особливістю процесу є тісний зв'яюк теплообміну з рухом рідин Відрізняють вільний і вимушений рух рідини, а залежно від цього - вільну і вимушену конвекцію.
Вільним називається рух рідини під дією неоднорідного поля масових сил, ітрикладеннх до її частинок Масові сили можуть бути викликані зовнішніми іншими1 гравітаційним, магнітним, електричним. Вільний рух у гравітаційному полі виникає під дією різниці густин в різних точках простору, яка викликана різницею температур твердого тіла і навколишнього середовища Теплообмін, цю виникає при цьочуч називається тепловіддачею при вільній, конаекшї
У випадку нагрітої труби, розміщеної в повітрі, найближчі тари повітря ш.інхом теплопровідності нагріваються При цьому густина іїпго іченшугться і виникає внштовхувальна сила, під дією якої нагріте повітря підпічаггься. а йою місце гаймаг більш холодне. Якую ізометричні розміри, які характсриіуюіь об'см нонігря, достатньо великі, то взаємодія висхідних потоків нагрітого повітря і більш холодного, яке витісняє нагріте, практично відсутня. Іншими словами, розміри простору, які зайчає повітря, не впливають на інтенсивність теплообміну, який у цьому випадку називається вмілою конвекцією. Процес тепловіддачі оиіиюггься коефіцієнтом тепловіддачі. Вт/м2К.
 (1) (1)
де а – коуфіцієнт тепловіддачі: представляє собою кількість теплоти, яку приймає обо віддає одиниця поверхні тіла при температурному напорі 1 К

де Qк – тепловий потік, який передається нагрітим поверхням шляхом конвенції, Вт
F – площа поверхні тіла м2
tc і tр - температура відповідно поверхні стінкн і рідини (в даному випадку навколишнього повітря), 0С
За формулою (1) визначають локальні значення а , якщо необхідно дослідити тепловіддачу в стаціонарних умовах на всій поверхні
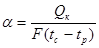 (2) (2)
Важливо зазначити, що коефіцієнт тепловіддачі не являється фізичною характеристикою, тобто, одержавши в ході ексиернченту яке-небудь значення а, не можна стверджувати, що відоме значення кпсфіпігнтії тепловіддачі повітря.
Інтенсивність тепловіддачі при вільному русі у великому об'ємі буде залежати від швидкості руху рідини (остання буж тич більша, чим більший температур ний напір між стінкою і напколмігшім середовищем), фізичних властивостей середовища, форчн і положеній тіла в просторі і ряду інших факторів Залежно відзначення і співвідношення величин, характеру руху рілннн біля стінки буде різним при малому температурному напорі переважає ламінарний режим рух), при великому - турбулентний Відповідно до цього і змінюється тепловіддача
У даній робим необхідно встановити вплив температурного напору на інтенсивність тепловіддачі.
Інструментом для цього може служити теорія подібності, яка дозволяє узагальнити розрізнені експериментальні дані у вигляді крнтерійльннх рівпнпь Для галів і крапельних рідин при Рг > 0,7 узагальнена критеріальна формула для розрахунку теплообміну при вільній конвекції у великому об'ємі мас вигляд
Nu=c(Gr,Pr)n (3)
де Nu - критерій Hуссeльта або критерій тепловіддачі, який характеризує інітенсивність в пограничночу шарі
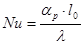 (4) (4)
де l0 - визначальний розмір поверхні (для горизонтальної труби діаметр), м:
λ - коефіцієнт теплопровідності рідини, Вт/ М Кч
Gr - критерій Грaсгофа, або критерій підіймальної сили. який харакгеризує кінематичну подібність явищ при вільному русі рідини.
Критерій Грасгофа визначається за формулою:
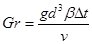 (5) (5)
де g = 9,81 м/с - прискорення вільного падіння;
v - кінематична в'язкість рідини м/с;
β-коефіцыэнт об'ємного розширення рідини, 0С
∆t - різниця температур між стінкою труби і повітрям;
Рг - критерій Прандтля. який характеризує фізичні властивості рідини.
 (6) (6)
де а - коефіцієнт температуропровідності. м2/с.
Для визначення констант с і п при вільній: конвекції біля горизонтальної труби використовується табл. 1
Таблиця 1
| №п/п |
Режими руху |
Сг-Рr |
с |
| 1 |
Плівковий |
<10-5 |
0.4 |
| 2 |
Перехідний |
10-5.. 5 10-5 |
1,18 |
| 3 |
Ламінарний |
5 10-5.. 109 |
0.54 |
| 4 |
Турбулентний |
109.. 1012 |
0.13 |
У залежності (3) в якості визначального розміру для тіл обертання використовується діаметр (l0 = d), а в якості визначальної температури - середня температура пограничного шару
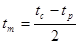 (7) (7)
за якою в довідникових таблицях знаходнгь значення фізичних параметрів середовища; а,v,λ,β
Для повітря коефіцієнт об'ємного розширення знаходять за формулою ідеального газу, 1/К:
 (8) (8)
де: Тm - визначальна температура. К
Тm = tm.+273,15.
Опис експериментальної установки
Експериментальна установки (рис, 1) служить для визначення коефіцієнта тепловіддачі від горизонтальної труби до навколишнього повітря при нагріві поверхні трубн від 30 до 125 0С. Вона повинна бути розміщена в кімнаті з достатньо спйкою температурою навколишнього повітря.
Основний елемент установки - горизонтальна труба, в якості якої використаний трубчаттий електронагрівач (ТЕН), довжиною 995 мм і зовнішнього діаметра D = 14 мм. Теплоізоляцій ТЕНа на торцях забезпечується фарфоровими пробками, за допомогою яких він закріплюється на вертикальних стійках. Електроживлення ТЕНа здійснюється провідинками, розміщених в отворах стійок. Кількість виділеної і розсіяної в навколишній простір теплоти визначається за витратами електроенергію яку спожинає ТЕН Потужність, яку спожива ТЕН, регулюється лабораторним автотрансформатором і вимірюється ваттметром 5Д500Д4 класу 0,5.
Для зменшення променевої складової розсіюваної теплової" потужності поверхня ТЕНа покрита шаром нікелю. в результаті чого середня степінь чорноти по нормалі до поверхні складав не більше 0,015

Рис. 2. Встановлення термопар на поверхні труби.
Температура зовнішньої стінки ТЕНа вимірюється за допомогою шести хромельалючепєвих термопар, розташованих рівномірно по довжині і по кільшо труби (термопари стандартної градуіровки з чутливістю 41 мкВ/К і граничною допустимою похибкою не більше 0,16 мВ за ГОСТ 3044-74)
Термоелектрони діаметром 0,2 мм ізольовакі кремнеземною ниткою. Схема установки термопар на ТЕН показана нарис 2.
Технічні дані установки
Установка забезпечує низначения в ході виконання експерименту в діапазоні температур ∆t= 30...120 0С і повною похибкою не більше 0,6 Вт/м2-К або 7% (достовірна імовірність Р = 0.68) При цьому вмазаному діапазоні ∆t середньоквадратнчне відхилення дослідних даних вкл розрахованих за критеріальними залежностями складає 5-8%.
Значення всіх величин необхідно заміри і н в стаціонарному тепловому режиме Максимальний час виходу установки на стаціонарний режим після включення не більший 75 хв. Час стабілізації теплового режиму працюючої установці після підвищення температури стінки труби не більший 25 хв
Максимально допустима температура поверхні дослідної труби 330 0С(30 Вт навантаження на ТЕН).
Зміна потужності ТЕНа при коливанні напруги в системі не більше 0,2. 0,4 Вт. Максимальна різниця температур між показнчкани термопар по поверхні труби 10.. 15 0С
Максимально допустимий час заміру (індикації) температури в окремій точці труби А565-2С
Променева складова розсіюваної потужності при значенні температури поверхні труби 40.,. 120 "С-нс більше 4%.
Методика досліджень
Після ознайомлення з експериментальною установчою включають тумблер живлення, після чого засвічується сигнальна лампочка і табло цифрової індикани мілівольтметра (див рис П
У процесі виконання лабораторної роботи необхідно одержати значення для 3-4 теплових режимів Тепловий режим задасться електричною потужністю ТЕНа за допомогою ЛАТРа і ватметра.
Навантаження на ТЕН для кожного теплового режиму вибирають довільно в діапазоні 5...25 Вт. Про перебільшення навантаження наТЕНа (більше 30 Вт) сигналізує світлове табло 13.
Всі заміри проводяться при строго встановленому в часі тепловому стані ТЕНа (стаціонарний режим) Тому після надання наступного навантаження на ТЕН необхідно постійно записувати покази термопар Т1...Т6.
Через деякий час теплові трати конвекцією і випромінюванням вш поверхні ТЄЕіа в навколишній простір досягнуть постійних значень Цей стан фіксується а часі за незмінними показами термопар ТІ-Т6 3 участю викладача студент робить висновок про настання стацюнарното теплового режиму Далі проводять три-чотири серії вимірювань електричної навантаження на ТЕН, температуру стінки труби з температурами Т1-Т6 і середньої температури навколишнього середовища
Одержані покази приладів заносять в табл. З, після цьою установку переводять на повий тепловий режим і вимірювання повторюють у відповідності з викладеною методикою.
У процесі виконання лабораторію і роботи необхідно з'ясувати всі складові для розрахунку повної похибки при визначенні дослідного коефіцієнта тепловіддачі
В процесі досліду необхідно уникати різких рухів біля труби.
Обробка результатів експерименту
Тепловий потік, який передається три юігшлі.пою трубою шляхом конвекції становить, Вт
Qk=Q-Qn (9)
де Q-сумарний тепловий потік який передається в зовнішнє середовище шляхом конвенції і випромінювання, визначається за потужністю W нагрівача:
Q=W
Qn - променистий тепловий потік, який передасться трубі шляхом Вт:
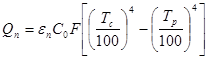 (10) (10)
де С0=5.67 Вт/м2К4 – коефіцієнт випромінювання абсолютно чорного тіла;
εп= ε01,2 – степінь чорноти поверхні із врахуванням напівсферичним випромінюванням;
ε0=0,045 – степінь чорноти по нормалі до поверхні випромінювання (εп=0,054);
F=πdl – площа поверхні труби, м2;
Тс і Тр – абсолютні температури дослідної труби і навколишнього повітря.
Середня температура стінки. 0С (К);
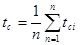
де: tci, - середня температура стінки в одній серії замірів
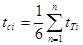 (11) (11)
де tTі- покази термопар Т1-Т6 в одній серії замірів;
п - кількість замірів температур стінки в одному стаціонарному режимі (ножна обмежитися трьома-чотирма замірами).
Аналогічно середня температура навколишнього повітря, 0С.
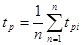
де tp1, - покази термометра
Одержані значення tc і tр заносять, в табл. 2 і далі розраховують значення необхідних величин.
Коефіцієнт тепловіддачі визначають за рівнянням (2). Результати дослідів представляють у вигляді графіка залежності.
α=f(∆t) (12)
яка є строго справедлива лише для даної дослідної труби. Тому необхідно співставити результати дослідів з αр, одержаними з розрахунку за формулою (3).
Розрахунок коефіцієнт тепловіддачі αр проводить для дослідних значень tc, tр, tж.
Постійні с і п вибирають з табл. 1. а необхідні фізичні властивості сухого повітрі (Р=1,01∙105)- із табл.2
| Параметри |
розмірність |
Температура, 0С |
| 0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
| λ∙102 |
Вг/мК |
2,44 |
2,51 |
2,59 |
5,67 |
5,76 |
2,83 |
5,90 |
2,26 |
3,05 |
3,13 |
| v∙106 |
м2/с |
13,28 |
14,16 |
15,06 |
16,00 |
16,96 |
17,95 |
18,97 |
20,02 |
21,09 |
22,10 |
| Рг |
- |
0,707 |
0,705 |
0,703 |
0,701 |
0,698 |
0,696 |
0,696 |
0,694 |
0,692 |
0,690 |
Результати розрахунку представляють у вигляді плавної кривої за формулою (12).
По відповідності експериментальних точок і розрахункової кривої можна судити про надійність одержанії результатів. Для цього розраховують середньоквадратичне відхилення дослідних від а по ар залежності
 ; ; 
де.п0 - кількість дослідів для визначення а,
ар-коефіцієнт тепловіддачі з першого чосліду
Необхідні розрахунки зручно провести за допомогою ЕОМ. На рис.З наведена блок-схема і далі програма розрахунку а, ар γ і γ0 мовою Паскаль ча прикладі використання „ІВМ" сумісних ЕОМ.
При роботі на ЕОМ з іншими термінальними пристроями й іншими алгоритмічними мовами представлена програма майже не змпіняться
Окречі фрагменти розрахунків можна проиоднти на мікрежалькулчюрі.
1- тумблер живлення;
- сигнальна лампа;
- ЛАТР;
- ланцюг електричного реле для світлових табло:
- ваттметр;
- стійка;
- мінівольтметр;
З - спіраль нагрівана;
9 - реле;
10 - ТЕН (термоелектричний нагрівач);
11 - гарячі спаї термопар;
12-13 - світлові табло;
14 - термометр.
Зміст звіту
Мета роботи.
Принципова схемя установки.
Протокол запису показів вимірювань.
Обробка результатів експерименту.
Графіки залежності тепловіддачі від температурного напору.
Порівняння коефіцієнта тепловіддачі а, одержаного у процесі експерименту, з аналогічними, представленими в 1-3.
Розрахунок похибкиа
Контрольні питання,
Дати визначення вільної конвекції,
Назвати основні фактори, що впливають на вільну конвекцію. їх вплив на інтенсивність тепловіддачі,
Назвати основні режими руху рідини при вільній конвекції у великому об'ємі
Охарактеризувати розподілення швидкостей і температур в пограничночу шарі при вільному русі у великому об'ємі.
Які величини погрібно вимірювати при експериментальному визначенні коефіцієнта тепловіддачі.
Назвати методи вимірювання температури і теплових потоків, які використовуються при виконанні експериментальної часі мни даної роботи.
За якої умови можливе вивчений явищ теплообміну при вільній конвекції на моделях без збереження геометричної подібності.
Записати рівняння Нютона-Ріхмана.
Фізичний зміст коефіцієнгу тепловіддачі.
Критерії і критеріальні рівняння вільної і вимушеної конвекції.
Методика експериментального і розрахункового визначення коефіцієнту тепловіддачі.
Основні положення теорії подібності явищ.
Теореми подібності.
Список літератури
1. Исаченко В. П. и др. "Теплопередача. 3-4-е изд, -М.: Энергия, 1975-1933 - 4К8 с
2. КреитФ. Блск У. Основи теплопередач к/ Пер. с англ. -М.: Мир, 1983. - 512 с.
3. НедужниЙ Й. А , Анабопский А. Н Техннческая термодннамнка й теплопередача. Уч. нособиедля ву-іов. - 2-е изд. - К.: Виша школа. 1981. - 248 є.
4. Инженерные методы расчета погрешностей при виполнепии лабораторних работ по курсах “Теплообмен” й “Техннческая термодинамика”. Мстоднчссклс указаний /Сост. В. її. Босий, Г, Н, Васильченко, Р,. Н. Панов. -Киев: КПИ, 1985, - 71 с.
Похибка експериментального визначення коефіцієнта тепловіддачі
Відносна і повна похибка визначення коефіцієнта тепловіддачі.
де  - повна абсолютна похибка визначення коефіцієнта тепловіддачі, яка містить дослідне експериментальну похибку - повна абсолютна похибка визначення коефіцієнта тепловіддачі, яка містить дослідне експериментальну похибку 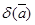 .винадкову .винадкову 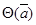 , і похибку відношення , і похибку відношення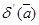
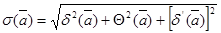
де 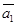 - середнє значення коефщюіта тепловіддачі для першого теплового режиму - середнє значення коефщюіта тепловіддачі для першого теплового режиму
У свою чергу 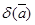 залежить від точності визначений конвективного потоку залежить від точності визначений конвективного потоку  ,температури стінки ,температури стінки  , температури рідинн , температури рідинн 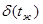 - геометричних розмірів - геометричних розмірів 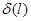 , ,  ,числа π- δ(π) , і поправок ,числа π- δ(π) , і поправок 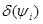 . .
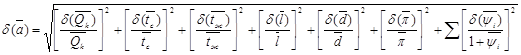
Випадкова похибка
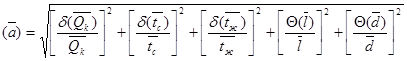
де під знаком радикалу сума квадратів випадкових відніксних похибок вимірювання відповідних величин, кожна з яких вираховується як середньоквадратична похибка вимірювання даної величніш. Кінцева кількість вимірів враховується коефіцієнтом Стьюдента.
Похибка відношення залежить від точки визначення різниці температур і вигляду
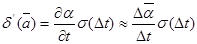
Приклад розрахунку повної похибки для даній лабораторної роботи приведені в метоличних вказівках «Инженерлные методи расчета погрешностей при выполнении лабораторных работ по «Тепломассобмен» и «Техническая термодинамика»
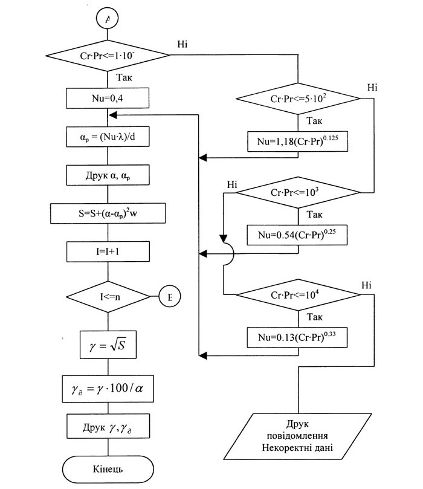
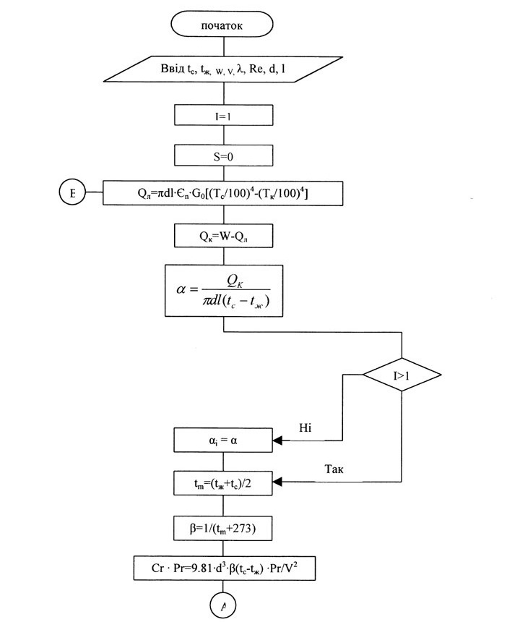
Лабораторна робота №8
Дослідження процесів вологого повітря
Мета роботи: вивчити методику визначення параметрів вологого повітря за допомогою Hd- діаграми; зобразити процеси нагріву, зволоження й охолодження повітря на Hd- діаграмі; вивчити методику розрахунку витрат повітря й теплоти на випаровування 1 кг вологи.
Основні теоретичні відомості
Вологе повітря – це механічна суміш сухого повітря ( µс.п = 29 кг/кмоль, R с.п = 287 Дж/(кг·К)) і водяної пари ( µп = 18 кг/кмоль, Rп = 461,5 Дж/кг ).
У харчовій промисловості вологе повітря широко використовується як сушильний агент при виробництві макарон, сухарів, печива, цукру, кухонної солі, сухофруктів і фруктових порошків, солоду, сухого молока та інших продуктів.
Процеси сушіння, кондиціонування, вентиляції зазвичай проходять при барометричному тиску, який згідно з законом Дальтона дорівнює сумі парціальних тисків сухого повітря й водяної пари: Рδ = Р с.п + Рп .
У більшості випадків барометричний тиск приймають рівним 99,3 кПа. Це відповідає середньорічному тиску для України. Для цього тиску й побудована Hd – діаграма стану вологого повітря. Указаному тиску відповідає температура насичення 99,45 ºС. Якщо температура вологого повітря нижча за 99,45 ºС, то максимальна можлива кількість водяної пари в ньому дорівнює густині сухої насиченої пари при цій температурі.
Повітря, в якому густина пари рівна максимально можливій при даній температурі називається насиченим ρ = ρmax = ρн, повітря в якому ρп < ρн - ненасиченим ( Рп < Рн), а повітря , в якому ρп > ρн - перенасиченим.
При парціальному тиску пари Рп < 10 кПа з похибкою до 0,1%, водяну пару можна вважати ідеальним газом. Знаючи температуру вологого повітря, тиск насиченої пари Рн можна визначити за таблицею теплофізичних властивостей насиченої водяної пари.
Основні параметри вологого повітря
Абсолютна вологість повітря – це маса водяної пари в кілограмах у 1 м3 вологого повітря, тобто густина водяної пари при заданих тиску Рп і температурі повітря t :
ρп = mп / V = Pп / (Rп T). / 2.1 /
де Rп – питома газова стала, Дж/(кг×К);
Т – температура, К.
Відносна вологість повітря – це відношення абсолютної вологості в даному стані до максимально можливої абсолютної вологості насиченого повітря при одинаковій температурі :
φ = 100 ρп / ρн = 100 Рп / Рн . / 2.2 /
Для сухого повітря φ = 0 , а для насиченого φ = 100%.
Вологовміст повітря – це маса водяної пари в грамах, що припадає на 1 кг сухого повітря:
d =103 mп /mс.п = 103 Pп µп / ( Pс.п µс.п) = 622 Pп / ( Pб – Pп ). / 2.3 /
де µп, µс.п – відповідно молекулярна маса сухого повітря і водяної пари.
В процесі нагрівання повітря вологовміст d і парціальний тиск Рп не змінюються, тиск насичення Рн збільшується, відносна вологість φ зменшується й зростає здатність повітря поглинати вологу, яка пропорційна dн - d.
Ентальпія вологого повітря дорівнює сумі ентальпій сухого повітря й водяної пари:
H = hc.п + 0,001d hп = ср.с.п. t + 0,001d ( rо+ ср.п.t) , / 2.4 /
де ср.с.п., ср.п. –середня ізобарна теплоємність відповідно сухого повітря і водяної пари; Ср.с.п. =1,006 кДж/(кг·К), Ср.п. =1,92 кДж/(кг·К); r0 =2500 кДж/кг – питома теплота пароутворення води при температурі 0 ºС;
Ентальпія вологого повітря розраховується на 1 кг сухого повітря , тобто на /1+d/ кг вологого повітря. Тому її позначають не малою, а великою літерою H.
На практиці відносна вологість повітря визначається за допомогою психрометра, який включає два термометри. Кулька одного з них обмотана тканиною, змоченою водою. Перший термометр називається сухим і показує температуру вологого повітря t , другий – мокрим, а температура, яку він показує, називається температурою мокрого термометра tм . Це температура води, яка випаровується з вільної поверхні тканини після досягнення теплової рівноваги між нею і вологим повітрям, тобто коли кількість теплоти, яку одержує вода від повітря, дорівнює кількості теплоти, що йде на випаровування.
У ненасиченому повітрі tм < t , у насиченому, де є рівновага між випаровуванням і конденсацією, tм = t .
Зі зниженням t ( Pп = const) через деякий момент часу ненасичене вологе повітря перетворюється в насичене / Рп = Рн /. Температура , при якій проходить це перетворення, називається температурою точки роси tр. При подальшому охолоджені з вологою повітря почне конденсуватися вода.
Нd- діаграма вологого повітря
Ця діаграма була запропонована проф. Л. К. Рамзіним у 1918 р. Аналогічна діаграма побудована Р. Мольє у 1923 р., в ній замість d використано x = 0,001 d , кг/кг /рис.2.1/. Діаграма побудована для Pп=745 мм рт.ст., але при розрахунках процесу сушіння коливанням барометричного тиску з достатньою в техніці точністю можна знехтувати.
З метою збільшення корисного поля діаграми кут між осями ентальпій і вологовмісту дорівнює 135º. Для компактності нижня частина діаграми відрізана і значення d відкладені на горизонталі /рис.2.1/.
З лівого нижнього кута вгору і вправо йде жмуток кривих φ = const. Нижня крива відповідає насиченому повітрю φ = 100%, верхня φ = 5%. При t >99,45 ºС φ =f(d) і лінії φ = const направлені вертикально вгору, тому що у формулі dн = 622 Рн /(Рб – Рн) знаменник перетворюється на нуль. Для сухого повітря d = 0, для водяної пари d = ∞.
Нижня частина діаграми використовується для визначення парціального тиску пари в повітрі. Значення Рп = f(d), кПа, відкладені внизу на правій ординаті .
Ізотерми вологого повітря /показники сухого термометра/ - суцільні прямі, направлені зліва направо, злегка піднімаючись угору. Ізотерми мокрого термометра починаються на кривій насичення /при φ = 100% tм = t / і у вигляді штрихових прямих направлені справа наліво дещо пологіше, ніж прямі Н = const.
Початковий стан повітря /точка 0 на рис.2.1/ наносять на Нd – діаграму за показами психрометра. За допомогою діаграми / для відомого положення точки / можна знайти значення ще п’яти параметрів вологого повітря. Наприклад, при t =20 ºС і tм = 15 ºС Н = 43 кДж/кг, φ = 60%, tр = 12 ºС , d = 8,5 г/кг, Рп =1,4 кПа.
Вологе повітря / наприклад, у калорифері сушарки / нагрівається при d = const і процес нагріву зображається відрізком вертикальної лінії від початкової точки 0 до перетину ліній з ізотермою, яка відповідає температурі нагрітого повітря t1 /див. рис.2.1/.
Процес охолодження зворотний нагріву і зображається вертикальною лінією, що йде зверху вниз.
В ідеальній сушарці, що працює без втрат теплоти в оточуюче середовище, процес сушіння (випаровування) ішов би при Н = const, тому що теплота сушильного агента, витрачена на випаровування вологи, повертається в повітря разом з парою вологого матеріалу. В реальних умовах із-за втрат теплоти в оточуюче середовище, процес сушіння відбувається із зменшенням ентальпії, ізотерми на Hd – діаграмі йдуть крутіше, ніж за ізоентальпією.
При t < tр починається конденсація водяної пари чи на поверхні тіл з утворенням роси, чи в об’ємі вологого повітря з утворенням туману /при t < 0ºС можуть утворюватися відповідно іній або паморозь /. При цьому осушується вологе повітря. Охолодження повітря продовжується за кривою φ = 100%. Із зниженням температури зменшується значення d і збільшується кількість сконденсованої вологи. Ентальпія перенасиченого повітря / ρп > ρн / зменшується пропорційно кількості сконденсованої пари.
Опис лабораторної установки
Основними елементами установки є калорифер 2 та сушильна камера 4 /рис.2.2/.
Стан вологого повітря у приміщенні визначають за показами сухого t та мокрого tм термометрів психрометра 8. Для визначення барометричного тиску Рб використовують барометр 9. Масову витрату повітря через установку знаходять за допомогою реометра 1, вимірюючи перепад тиску, що виникає на каліброваному звуженні / круглий отвір /, через який тече повітря.
Через реометр повітря надходить у двоходовий калорифер – горизонтальну скляну трубу, поділену навпіл уздовж осі сталевою перегородкою і закриту з обох торців кришками. Потужність електронагрівача / два тени / 3 регулюється автотрансформатором 7 і вимірюється ватметром W. За допомогою такого самого автотрансформатора / на схемі не показаний / зміною напруги, що подається на електродвигун вентилятора 6, установлюють задану масову витрату повітря / її знаходять, використовуючи номограму, за висотою нижньої частини водяного меніска у прямій скляній трубці реометра /.

Рис.2.2 Схема експериментальної установки 1 – реометр, 2 – калорифер, 3 – тени, 4 – сушильна камера, 5 – потенціометр,6 – вентилятор, 7 – автотрансформатор, 8 – психрометр, 9 – барометр.
Сушильна камера 4 циліндричної форми має ванну для води і кільцевими поперечними перегородками розділена на три секції. На перегородках закріплені серветки тканини, нижні краї яких занурені у воду. Повітря, яке тече від секції до секції, змінює напрям і зволожується.
Температури на різних ділянках потоку повітря вимірюється за допомогою хромель-копелевих термопар, що підключені до шестипозиційного потенціометра 5. Термопари t1 та t2 служать для вимірювання температур повітря відповідно на вході та виході із сушильної камери, а суха tз та мокра tм4 термопари – для визначення стану вологого повітря на певній відстані від сушильної камери, тобто після його часткового охолодження.
Порядок виконання роботи
Добавити декілька мілілітрів води у ванночку сушильної камери.
Перевірити наявність води у U- подібному коліні мокрої термопари.
Встановити нуль шкали реометра 1 / по низу водяного меніска у скляній трубці реометра /.
Включити вентилятор, а потім / але не раніше / електричний нагрівач калорифера. За допомогою автотрансформаторів встановити задані викладачем витрату повітря та потужність нагрівача, записати ці дані у табл.2.1.
Змочити тканину мокрого термометра і включити вентилятор психрометра, уважно стежити за зміною tм . Записати мінімальне значення tм / воно спочатку знижується, а після підсихання тканини починає підвищуватися / і відповідну температуру сухого термометра t .
Записати покази барометра.
Включити потенціометр. Включити привід діаграми і виключити його, як тільки підключиться термопара t1 . Коли підвищення температури за калорифером припиниться, тобто коли установка ввійде у стаціонарний режим роботи, можна починати експеримент. Одержані результати записати у табл.2.1.
Таблиця 2.1
| Номер досліду |
Витрата повітря за реометром, л/хв |
Потужність нагрівача, Вт |
Температура вологого повітря, ºС, на термопарах |
Примітка |
| t1 |
t2 |
t3 |
t4 |
1 t =
2 tм =
3 Рбар=
Обробка результатів спостережень
За показами психрометра t і tм знаходимо початкову точку 0. Піднімаємось за вертикаллю до ізотерми t1, яка відповідає температурі повітря за калорифером, і дістаємо точку 1 /рис.2.3/.
Точка 2 повинна лежати на ізотермі t2 і перебуватиме на одній вертикалі з точкою 3, тому що за сушильною камерою вологе повітря лише охолоджується. Точку 3 знаходимо аналогічно точки 0 за показами термопар t3 і tм4 . Піднімаючись від точки 3 за вертикаллю до ізотерми t2 , визначаємо положення точки 2.
З’єднавши точки 2, 3 прямими лініями, дістанемо три процеси, що відбуваються з повітрям в установці: 0-1 – нагрів повітря в калорифері; 1-2 – зволоження його в сушильній камері; 2-3 – охолодження повітря за сушильною камерою (рис.2.3).
Парціальний тиск сухого повітря у вологому повітрі приміщення, Па:
Рс.п = Рб - Рп ,
де Рп – визначаємо за Нd- діаграмою.
Масова витрата сухого повітря через установку, кг/с:
Мс.п = Рс.п V / (Rс.п T0) ,
де V – об’ємна витрата повітря, м3/с; Rс.п – питома газова стала сухого повітря, Дж/(м·К); То – абсолютна температура повітря в приміщенні / точка 0 /, К.
Потужність теплового потоку, який витрачається на нагрів повітря в калорифері, кВт:
Qк = (H1-H0)Mс.п ,
де H1, H0 - ентальпія вологого повітря відповідно після калорифера і перед ним, кДж/кг Мс.п - потужність нагрівача, кВт:
Q = 0,001W .
ККД калорифера, %:
ηк = 100 Qк / Q
Потужність теплового потоку, який втрачається при охолодженні повітря в процесі 2-3, кВт:
Qохол = (Н2-Н3) Мс.п .
Продуктивність сушильної камери за випареною вологою, кг/с:
Мр =0,001(d2-d1) Мс.п .
де d2, d1 – вологовміст повітря після і до сушильної камери.
Витрати на випаровування 1 кг вологи:
сухого повітря, кг:
mс.п = 1000 / (d2-d1);
теплоти в сушильній установці, кДж:
q = 1000 (Н1-Н0) / ( d2-d1).
Ефективність сушильної установки можна оцінити, порівнюючи q з мінімальною витратою теплоти qmin на підігрів висушуваного матеріалу до температури випаровування 1 кг вологи. Для атмосферної конвективної сушки qmin = 2500 кДж/кг. Чим ближче до одиниці значення 2500 / q , тим ефективніше працює установка.
Контрольні запитання
Що являє собою вологе повітря ?
Що називається абсолютною вологістю повітря ?
Що називається відносною вологістю повітря ?
Що називається вологовмістом ?
Що таке ентальпія і як вона визначається для вологого повітря ?
У якому стані може перебувати вологе повітря ?
Як, використовуючи покази психрометра, знайти на Id- діаграмі точку, що характеризує стан вологого повітря ?
Як на Id- діаграмі зображається процес, який відбувається у калорифері?
Як і які параметри можна знайти для заданої на Id- діаграмі точки ?
Пояснити, як визначено стан повітря в характерних точках процесів, що відбуваються в сушильній установці.
Який тепловий режим вважають стаціонарним ?
Будова й призначення елементів лабораторної установки.
Порядок виконання лабораторної роботи.
Як визначається витрата повітря й теплоти на випаровування 1 кг вологи ?
Як визначити теплові втрати калорифера в оточуюче середовище ?
Як визначається витрата сухого повітря через установку ?
З якими процесами вологого повітря ви стикаєтесь у побуті ?
Чому ентальпію вологого повітря, яка має одиницю кДж/кг, позначають H,а не h, що, звичайно, вживається для величин, віднесених до 1 кг ?
Чому у розрахунку сушарок за основну розрахункову одиницю беруть1 кг сухого повітря ?
Список літератури
1. Воронец Д., Козич Д. Влажный воздух: Термодинамические свойства и применение. – М.: Энергоатомиэдат, 1984.
2. Нащокин В.В. Техническая термодинамика и теплопередача. – М.: Высш. шк., 1980. – С.210-217.
3. Теплотехника. / Под ред. А.П. Баскакова. – М.: Энергоатомиэдат, 1982. – С.44-47.
4. Теплотехника./ И. Т. Швец, В. И. Толубинский, Алабовский и др. – К.: Высш. шк., 1976. – С.68-72.
5. Техническая термодинамика /В. А. Кириллин, В. В. Сычев, А. Е. Шейндлин. – М.: Энергоатомиэдат, 1983. – С.371-382.
6. Шинкарик М.М. Теоретичні основи теплотехніки. – Тернопіль, вид. ТДТУ ім. І.Пулюя, 2002. – с. 39-45.
Основні положення термодинаміки
Технічна термодинаміка є феноменологічою теорієюмакроскопічних процесів, які супроводжуються пертворенням:
1. енергії; 2. тепла; 3. тиску; 4. ідеального газу;
2. Першою роботою яка положила початок розвитку термодинаміки була робота:
1. С. Карно; 2. М. Ломоносова; 3. Больцмана; 4. Лаваля;
3. Термодинамічною системою називається сукупність матеріальних тіл, які є об’єктом вивчення і знаходиться з навколишнім:
1. середовищем; 2. тиском; 3. атмосферним тиском; 4. питомим об’ємом;
4. Питомий об’єм – це величина:
1. 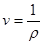 ; 2. ; 2.  ; 3. ; 3. 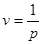 ; 4. ; 4. 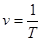 ; ;
5. Питомий об’єм – це об’єм, який займає:
1. 1 кг речовини; 2. 1 кг газу; 3. 1 м3 речовини; 4. 1 м2 речовини;
6. Для вимірювання тиску використовують одиниці виміру:
1. Паскаль(Па),Н/м2; фізична атмосфера(ф.атм.) бар; технічна атмосфера (ат) міліметри ртутного стовпчика, міліметри водяного стовпчика; 2. Паскаль (Па); фізична атмосфера, бар; технічна атмосфера; 3. фізична атмосфера; технічна атмосфера; міліметри ртутного стовпчика, міліметри водяного стовпчика; 4. атмосфера, бар;
7. Температура – характеризує степінь нагрітості тіл і є мірою середньою:
1. кінематична енергія руху молекул; 2. потенціальна енергія руху молекул; 3. енергія руху молекул; 4. внутрішня енергія;
8. Параметром стану є абсолютна температура:
1. 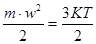 ; 2. ; 2. 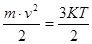 ; 3. ; 3.  4. 4. 
9. Основні термодинамічні параметри стану P, v, T взаємоз’язані:
1. F(P, v, T=0); 2. F(w, p,T)=0; 3. F(P, v, T)≠0; 4. F(v, T)=0
10. Послідовність зміни стану системи складає:
1. термодинамічний процес; 2. тепловий процес; 3. термодинаміка; 4. теплообмінний процес;
11. Оборотним процесом може бути тільки процес:
1. врівноважений; 2. стислий; 3. внутрішній 4. зовнішній;
12. Перетворення теплоти в роботу здійснюється за допомогою:
1. робочого тіла; 2. робочого тиску; 3. робочого об’єму; 4. робочого впливу;
13. Кожна молекула, якщо вона рухається зі швидкість w, за одиницю часу здійснює:
1.  ходів; 2. ходів; 2. 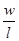 ходів; 3. ходів; 3. 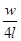 ходів; 4. ходів; 4.  ходів; ходів;
14. Рівняння стану ідеального газу:
1. PV=mRT; 2. pw=mRT; 3. PV=RT; 4. PV=RT
Перший закон термодинаміки
1. Перший закон термодинаміки стверджує, що енергія не виникає і не зникає, вона лише переходить із однієї в іншу.
1. форму; 2. фази; 3. залежності; 4. температури;
2. Яке рівняння вірне?
1. dQ=dU+dL; 2. dQ=dP+dL; 3. dQ=dT+dP; 4. dQ=dT+pdV;
3. Абсолютна величина внутрішньої енергії:
1. v=∫(dQ+dL)+U0; 2. v=∫(dQ+dL)+V; 3. v=∫(dQ+dL); 4. v=∫dp+pdV;
4. Внутрішня енергія системи є однозначною функцією стану:
1. системи; 2. температури; 3. об’єму; 4. тиску;
5. Внутрішня енергія системи є однозначною функцією стану тіла:
1. U=φ(P,V); U= φ2(P,T); U= φ3(V,T); 2. U= φ(P,V); U= φ3(P,T);
3. U= φ(V,T); U= φ(P,T); 4. U= φ(p,V,T);
6. Робота виконана поршнем:
1. dL=Pdv; 2. dL=TdV; 3. dL=VdV; 4. dA=SdV;
7. Перший закон в диференціальній формі:
1. dg=du+pdυ; 2. dg=dT+pdυ; 3. dg=dv+dp; 4. dg=dv+dυ;
8. Величина:
1. h=v+рυ; 2. h=v-рυ; 3. h=dv+g; 4. h=v+pυT;
-є функцією стану системи і чисельно рівна всій енергії
9. Ентальпія є:
1. параметром; 2. тиском; 3. температурою; 4. станом системи;
10. Істинна теплоємність тіла:
1. 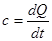 ; 2. ; 2. 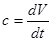 ; 3. ; 3. 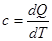 ; 4. ; 4. 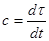
11. Середня теплоємність це:
1.  ; 2. ; 2.  ; 3. ; 3.  ; 4. ; 4. 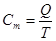 ; ;
12. Показник адіабати це:
1. 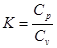 ; 2. ; 2. 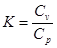 ; 3. ; 3.  ; 4. ; 4. 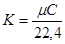
Друний закон термодинаміки
1. Друний закон термодинаміки встановлює максимально можливу границю пертворенн2я:
1. теплоти в роботу; 2. риску в роботу; 3. густини потоку в роботу;
4. теплоти;
2. Робота в термодинамічних процесах можлива в результаті:
1. зміни внутрішньої енергії; 2. зміни тиску; 3. зміни об’єму;
4. зміни середовища;
3. Цикл, в результаті якого одержується позитивна робота, називається:
1. прямим циклом; 2. зворотнім циклом; 3. оборотнім циклом;
4. змішаним циклом;
4. Співвідношення між питомими кількостями теплоти і питомою роботою визначається:
1. першим законом термодинаміки g1-g2=u2-u1+L;
2. другим законом термодинаміки g1-g2=u2-u1+L;
3. термодинамічними законами; 4. станом тіла
5. Термічний коефіцієнт корисної дії:
1.  ; 2. ; 2.  ; ;
3.  ; 4. ; 4. 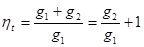 ; ;
6. Степінь досконалості зворотнього циклу визначається холодильним коефіцієнтом:
1. 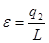 ; 2. ; 2. 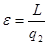 ; 3. ; 3. 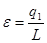 ; 4. ; 4.  ; ;
7. Термічний коефіцієнт циклу Карно:
1. 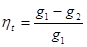 ; 2. ; 2. 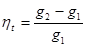 ; 3. ; 3. 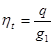 ; 4. ; 4.  ; ;
8. В зворотному процесі робоче тіло від т.1 розширюється до т.4 по адіабаті 1-4 без теплообміну з зовнішнім середовищем:
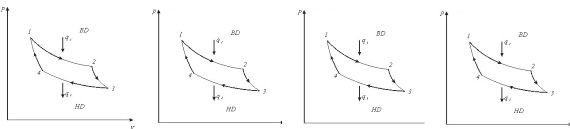
1. по адіабаті 1-4 без теплообміну з зовнішнім середовище
2. по ізохорі 1-4 без теплообміну з зовнішнім середовище
3. по ізотермі 1-4 без теплообміну зовнішнім середовище
4. по ізобарі 1-4 без теплообміну з зовнішнім середовище
9. В зворотному процесі робоче тіло
від т.4-3 підводиться тепло q2 по :
1. ізотермі;
2. ізобар;
3. ізохорі;
4. адіабаті
10. Для адіабатного процесу розшир енняі стиснення відповідн о маємо
1.  ; 2. ; 2.  ; 3. ; 3. 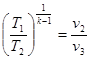 ; 4. ; 4. 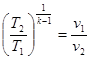
Аналіз основних термодинамічних процесів ідеального газу
1. Вираз першого закону термодинаміки для ізохорного процесу:
1. qυ=∆u; 2. qυ=∆t; 3. qυ=∆Р; 4. qυ=∆Q;
2. Вираз першого закону термодинаміки для ізобарного процесу:
1. dgp=dh; . dgp=dТ; 3. dgp=dV; 4. dgp=∆u;
3. В ізохорному процесі dυ=0 і робота:
1. не виконується lυ=0; 2. виконується lυ≠0; 3. не виконується lυ>0; 4. виконується lυ<0;
4. Теплота в ізохорному процесі тільки на зміну:
1. внутрішньої енергії qυ=∆u= Сυm(t2-t1); 2. внутрішньої енергії qυ=du= Сυm(t2-t1);
3. внутрішньої енергії qυ=∆u= Сυm(t-t); 4. внутрішньої енергії qυ=∆h= Сυm(t2-t1);
5. Рівняння стану двох точок ізобарного процесу:
1. pυ1=RT1; pυ2=RT2; 2. p=RT1, p=RT2;
3. pυ1=RT; pυ2=RT; 4.1 υ=RT1; υ=RT2;
6. Заміна ентальпії в ізобарному процесі визначається:
1. 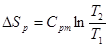 ; 2. ; 2.  3. 3.  4. 4. 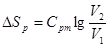 ; ;
7. Кількість теплоти в ізобарному процесі рівна зміні:
1. qp=Cpm(t2-t1)=∆h; 2. qp=∆u; 3. qp=∆h∆T; 4. qp=∆u =Cpn(t2-t1);
8. Теплота необхідна для здійснення ізотермічного прцесу:
1. 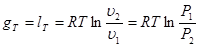 ; 2. ; 2. 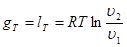 ; ;
3. 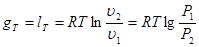 ; 4. ; 4. 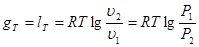 ; ;
9. Зміна ентропії в ізотермічному процесі:
1. 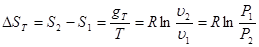 ; 2. ; 2. 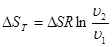 ; ;
3. 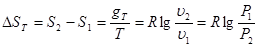 ; 4. ; 4. 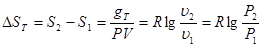
10. Адіабатним називається такий процес, при якому робоче тіло не обмінюється теплотою з:
1. навколишнім середовищем g=0, dg=0; 2. навколишнім тілом;
3. навколишнім тиском; 4. навколишнім об’ємом;
11. Рівняння адіабатного процесу:
1. k∙lnυ+lnp=0; 2. k∙lgυ+lgp=0; 3. k∙lnυ-lnp=0; 4. k∙lgυ-lgp=0;
12. Робота в адіабатному процесі:
1. 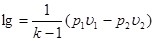 ; 2. ; 2. 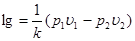 ; ;
3. 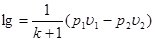 ; 4. ; 4. 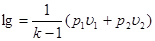 ; ;
13. В TS координатах адіабата зображається:
1. вертикальною прямою; 2. горизонтальною прямою;
3. гіперболою; 4. параболою;
14. В TS координатах ізобара зображається
1. логарифмічною кривою; 2. горизонтальною кривою;
3. вертикальною кривою; 4. похилою;
Перший закон термодинаміки для потоку відкритої термодинамічної системи
1.Умова нерозривності потоку полягає в однаковості масової витрати m робочого тіла в будь-якому січенні:
1) m=F∙c/γ=const; 2) m=F∙l/ν=const; 3) m=F∙c/V=const; 4) m=F∙ ν /c=const.
2.Під відкритими розуміють термодинамічні ситеми, які крім обміну теплотою і роботою з навколишнім середовищем допускають ще й обмін:
1) масою; 2) об’ємом; 3) тиском; 4) швидкість.
3. Теплота ,яка надається тілу в процесі його проходження по каналу,
складається з:
1) зовнішньої теплоти і теплоти тертя; 2) зовнішньої теплоти; 3) теплоти тертя.
4. У теплообмінному апараті для 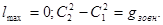 , тому: , тому:
1) 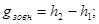 2) 2) 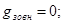 3) 3)  4) 4) 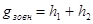 . .
5. У теплового двигуна, як правило 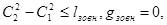 тому тому
1)  2) 2) 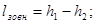 3) 3) 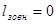 ; 4) ; 4)  . .
6. У компресора процес стиснення газу проходить без теплообміну з навколишнім середовищем. 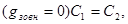 то то
1) 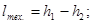 2) 2)  3) 3)  4) 4) 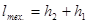 . .
7.Канали в яких проходить збільшення швидкості газу, називаються:
1) соплами; 2) дифузорами; 3) турбінами.
8. масові витрати газу m через сопло:
1) m=f∙С2/V2; 2) m=f∙С2 ; 3) m=f∙С2∙V2; 4) m=f∙V.
9. Критична швидкість, це:
1) 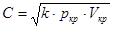 2) 2) 
3)  4) 4) 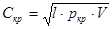 . .
10. Дроселюванням називається необоротний процес, в якому тиск при проходженні газу через вузький отвір:
1) зменшується; 2) збільшується; 3) без змін; 4) без здійснення зовнішньої роботи.
11. Коефіцієнт корисної дії каналу, це відношення дійсної кінетичної енергії робочого тіла 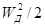 до: до:
1) теоретичної; 2) досліджуваної; 3) експериментальної. 4) витікаючої
12. Швидкість поширення звуку в середовищі, це:
1) 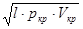 ; 2) ; 2) 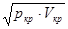 ; 3) ; 3)  ; 4) ; 4) 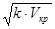 . .
Променистий теплообмін
1.Променистий теплообмін це:
1) процес поширення теплоти за допомогою руху електронів; 2) процес поширення теплоти за допомогою мікрочастинок речовини; 3) процес поширення теплоти за допомогою електромагнітних хвиль; 4) процес поширення теплоти за допомогою руху елементарних астинок.
2.Густиною теплового потоку при променистому теплообміні називається:
1) тепловий потік, який відповідає вузькому інтервалу хвиль від λ до λ+dλ
2) тепловий потік, який відповідає всьому спектру від 0 до ∞;
3) тепловий потік, який випромінюється перпендикулярно до поверхні;
4) тепловий потік, який випромінюється з одиниці поверхні по всіх напрямках напівсферичного простору.
3.Коефіцієнт поглинання, це:
1) відношення пропущеної енергії до відбитої; 2) відношення поглинутої енергії до відбитої; 3) відношення поглинутої поверхні до падаючої;
4.Ефективне випромінювання, це:
1) 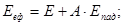 2) 2) 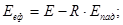 3) 3) 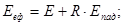 4) 4) 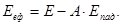
5.Закон Планка для променистого теплообміну має вигляд:
1) 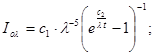 2) 2) 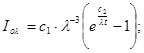
3) 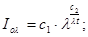 4) 4) 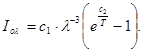
6. Згідно закону Віна, максимальна інтенсивність випромінювання спостерігається при:
1) λmax=0; 2) λmax ∙T = 2,898∙10 -3 м ∙ к; 3) λmax ∙T = 3∙10 8 м ∙ к; 4) λmax= 1,4 м ∙ к.
7.Густина інтегрального випромінювання для абсолютно чорного тіла визначається за формулою:
1) 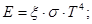 2) 2)  3) 3)  4) 4) 
8.Згідно закону Кіргофа відношення густини потоку випромінювання сірого тіла до його поглинаючої здатності
1) Залежить від природи тіла;
2) не залежить від природи тіла і рівне густині потоку випромінювання абсолютно чорного тіла при тій же температурі;
3) залежить від природи тіла і рівна коефіцієнту поглинання абсолютно чорного тіла;
4) не залежить від природи тіла і рівне коефіцієнту поглинання абсолютно чорного тіла.
9. Приведений коефіцієнт поглинання між двома плоско паралельними тілами рівний:
 1) 1)

2)
 3) 3)
 4) 4)
10. Густину теплового потоку між двома плоско паралельними стінками можна визначити за рівнянням:
1) 2)
Теплопровідність
1.При теплопровідності передача тепла проходить за рахунок:
1) руху мікрочастинок речовини; 2) руху і взаємодії елементарних частинок;
3) електромагнітних хвиль; 4) дотику тіл з різною температурою.
2.В загальному вигляді температура тіла:
1) є функцією координат і часу; 2) є функцією координат;
3) залежить від коефіцієнту теплопровідності; 4) є функцією часу.
3.Ізотермічна поверхня це:
1) поверхня: з різною температурою; 2) поверхня паралельна граничним поверхням тіла;
3) поверхня, всі точки якої мають однакову температуру; 4) поверхня, в якій коефіцієнт теплопровідності має постійне значення.
4.Градієнт температури це:
1) зміна температури протягом певного часу,
2) границя відношення зміни температур між двома ізотермічними поверхнями до віддалі між ними, взятій по нормалі;
3) зміна температури між двома граничними поверхнями тіла;
4) зміна коефіцієнту теплопровідності тіла в різних точках.
5.Густина теплового потоку - це відношення теплового потоку до:
1) одиниці площі; 2) одиниці температури; 3) одиниці часу; 4) одиниці об'єму.
6.Закон Фур'є має вигляд:
1)  2) 2) 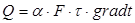 3) 3) 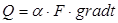 4) 4) 
7. Коефіцієнт теплопровідності залежить від;
1) структури, густини, температури, вологості і тиску; 2) густини, температури, тиску;
3) густини, температури, вологості; 4)структури, температури, вологості і тиску.
8. Диференціальне рівняння теплопровідності:
1) 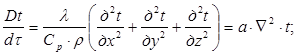 2) 2) 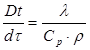
3) 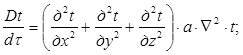 4) 4) 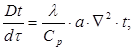
9. Граничні умови бувають:
1) трьох родів; 2) двох родів; 3) чотирьох родів; 4) п´яти родів.
10. Що таке а:
1) коефіцієнт температуропровідності; 2) коефіцієнт теплопровідності;
3) коефіцієнт тепловіддачі; 4)коефіцієнт теплопередачі.
11. Оператор Лапласа це:
1) 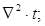 2) 2)  3) 3) 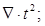 4) 4) 
12. Теплопровідністю плоскої стінки називають:
1) 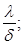 2) 2) 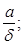 3) 3) 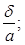 4) 4) 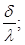
13. Опором теплопровідності одношарової стінки називають:
1)  2) 2) 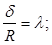 3) 3) 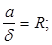 4) 4) 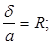
14. Тепловий потік через плоску стінку має вигляд:
1) 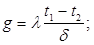 2) 2) 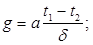 3) 3) 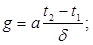 4) 4) 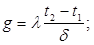
15. Тепловий потік для багатошарової стінки має вигляд:
1)  2) 2) 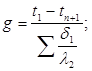 3) 3) 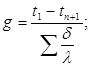 4) 4) 
Конвективний теплообмін
1.Конвекцією називається процес поширення теплоти за допомогою:
1) мікрочастинок речовини; 2) макрочастинок речовини; 3) електромагнітних хвиль; 4) руху електронів.
2.Критерій Прандгля характеризує:
1) теплофізичні характеристики речовини; 2) режим руху речовини; 3) тепловіддачу в пограничному шарі;
4) зміну температури тіла протягом часу.
3.Критерій Прандтля можна визначити за формулою:
  1) 2) 1) 2)

 3) 4) 3) 4)
4.Критерій Рейнольдса характеризує:
1) режим руху речовини; 2) теплообмін в пристінному шарі;
3) нестаціонарні явища теплопровідності; 4) теплообмін при вільній конвекції.
5.Критерій Рейнольдса визначається за рівнянням:
1)  2) 2) 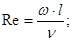
 3) 3)  4) 4)
6.Критерій Грасгофа характеризує:
1) режим руху речовини при вимушеній конвекції; 2) теплообмін в пограничному шарі;
3) кінематичну подібність явищ при вільній конвекції; 4) нестаціонарні процеси теплопровідності;
7.Критерій Грасгофа можна визначити за рівнянням:
 1) 1)  2) 2)

3)  4) 4)
8.Перша теорія подібності формулюється так:
1) подібні між собою фізичні явища мають однакові критерії подібності;
2) подібні між собою фізичні явища мають різні критерії подібності;
3) залежність між фізичними явищами можна представити у вигляді залежності між числами подібності; 4) подібні між собою явища мають рівні між собою фізичні величини.
9.Друга теорія подібності формулюється так:
1) залежність між фізичними величинами можна представити у вигляді залежності між числами подібності, складеними із цих величин;
2) залежність між фізичними величинами необхідно знаходити експериментальним шляхом;
3) залежність між фізичними величинами необхідно встановити шляхом розв'язку диференційних рівнянь;
4) залежність між фізичними величинами можна встановити із умов однозначності диференційних рівнянь.
10.Вкажіть неправильне твердження:
1) обов' язковою умовою подібності явищ є геометрична подібність;
2) подібні явища описуються однаковими по формі і змісту диференційними рівняннями;
3) при аналізі подібних явищ співставляти між собою можна тільки однорідні величини;
4) для подібних явищ всі фізичні величини, взяті в відповідних точках простору і часу, рівні.
11.Критеріальне рівняння вимушеної конвекції має вигляд:
1)  2) 2) 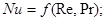 3) 3)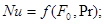 4) 4)
Аналіз циклів теплових двигунів
1. Теплові установки поділяються на – двигуни, в яких здійснюється прямий цикл з віддачею роботи зовнішньому споживачу і на установки, які працюють по зворотньому циклу, з затратою роботи, яка підводиться ззовні:
1. теплові, холодильні; 2. особливі, захолоджувальні; 3. холодильні, особливі; 4. холодильні, теплові;
2. Теплові двигуни можна розділити на:
1. 3 групи; 2. 2 групи; 3. 4 групи; 4. 5 груп;
3. Двигуни внутрішнього згоряння, в яних процес підводу теплоти і перетворення її в роботу проходить в:
1. середині циліндра двигуна; 2. камері згоряння; 3. поршні двигуна; 4. ззовні циліндричного двигуна;
4. Степінь досконалості теоретичних циклів повністю характеризуються величиною термічного ККД, а саме:
1. ηt=l0/gi=1-g2/g1; 2. ηt=l0/gi=1+g2/g1; 3. ηt=l0/gi=1-g1/g2; 4. ηt=l0/gi=1-g1
5. Ефективнысть реального необоротнього циклуоцынюэться внутрышным ККД, а саме:
1. ηt=lі/g1; 2. ηt=l/g; 3. ηt=l1/g1; 4. ηt=lі/g2
6. Ефективним ККД буде відношення:
1. ηе=lе/g1; 2. ηе=lе/g; 3. ηе=l/g; 4. ηе=l0/gi;
7. Процес всмоктування називається:
1. першим тактом роботи д.в.з.; 2. другим тактом роботи д.в.з.; 3. тактом стиснення; 4. згорання газу;
8. Процес стискання проходить по:
1. політропі; 2. ізохорі; 3. ізобарі; 4. адіабаті;
9. Процес згорання в pv – координатах близького до:
1. ізохори; 2. ізобари; 3. ізотерми; 4. політропи;
10. Принципова відповідність дізеля від д.в.з. полягає в тому, що першому такті в циліндр поступає:
1. повітря; 2. паливо; 3. суміш; 4. горіння;
11. Які двигуни більш екологічні?
1. ізобарним підведенням теплоти; 2. ізохорним підведенням теплоти; 3. змішаним підведенням теплоти; 4. ізотермним підведенням теплоти;
Котельні агрегати
1. Котельним агрегатом називається:
1. пристрій, який служить для спалювання палива; 2. пристрій, який служить для спалювання палива і одержання пари або гарячої води підвищеного тиску; 3. пристрій, який служить для одержання пари підвищеного тиску за рахунок високотемпературних газів інших технологічних процесів; 4. немає правильної відповіді;
2. Пароперегрівач котельного агрегату служить для:
1. одержання водяної пари; 2. охолодження димових газів; 3. підігріву живильної води; 4. підвищення енергетичного потенціалу пари за рахунок теплоти димових газів;
3. Економайзер в котельному агрегаті служить від:
1. підігріву живильної води; 2. підігріву повітря; 3. перегріву пари; 4. відведення димових газів;
4. Для захисту обмурівки котла від високої температури використовують:
1. фестоні труби; 2. конвективний пучок труб; 3. екрані труби; 4. колонтери;
5. Температура димових газів на виході із котла становить:
1. 10000С; 2. менше 1000С; 3. 100÷1200С; 4. більше 3000С;
6. Робочим складом палива називається:
1. паливо в такому виді, як воно поступає до споживача; 2. паливо, з якого повністю відведена волога; 3. паливо, яке містить тільки горючі компоненти; 4. паливо, яке не містить органічних домішок;
7. Якщо з органічного палива вилучити неорганічні домішки, то отримаєм:
1. робочий склад палива; 2. абсолютно сухе паливо; 3. горючу масу палива; 4. органічний склад палива;
8. Паливо, з якого повністю видалена волога називається:
1. робочим паливом; 2. сухим паливом; 3. горючим складом палива; 4. органічним паливом;
Паливо. Процеси горіння
1. Паливом називаються речовини, які використовуються для одержання значної кількості:
1. теплоти; 2. тепловіддачі; 3. продукту горіння; 4. теплоносія;
2. Всі види палива по агрегатному стану можуть бути розділенні на:
1. тверді, рідкі, газоподібні; 2. рідкі, газоподібні; 3. рідкі, тверді, аерозольні; 4. тверді, рідкі, аерозольні
3. Основними хімічнимим елементами палива є:
1. 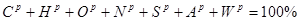 ; 2. ; 2. 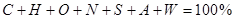 ; 3. ; 3. 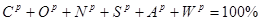 ; ;
4. 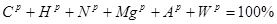 ; ;
4. Абсолютно сухе паливо є:
1.  ; 2. ; 2. 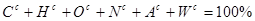 ; 3. ; 3. 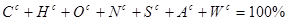 ; 4. ; 4. 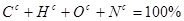 ; ;
5. Органічна маса палива є:
1. 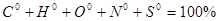 ; 2. ; 2. 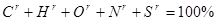 ; 3. ; 3. 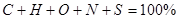 ; 4. ; 4.  ; ;
6. Теплота згорання – це кількість теплоти, яка виділяється при повному згоранні одного кілограма твердого палива і при охододжені продуктів горіння до:
1. початкової температури процесу; 2. температури 800С; 3. кінцевої температури процесу; 4. середньої температури процесу;
7. Реакція горіння є:
1. 2Н2+О2=2Н2О; 2. Н+О2=2Н2О; 3. Н2+О2=2Н2О; 4. Н2+О2=Н2О;
8. Теплота згоряння палива є:
1. 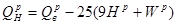 ; 2. ; 2. 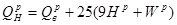 ; 3. ; 3.  ; 4. ; 4. 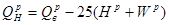 ; ;
9. Умовне паливо, теплота згоряння якого прийнята рівною:
1. 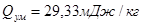 ; 2. ; 2. 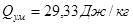 ; 3. ; 3. 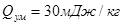 ; 4. ; 4. 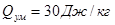 ; ;
10. Температура запалювання – це температура,до якої необхідно нагріти паливо і необхідно для його горіння повітря, щоб почалося інтенсивне з’єднання елементів палива з:
1. кинем повітря; 2. вуглецем; 3. відкритим вогнем; 4. повітрям;
11. швидкість протікання хімічних реакцій це:
1. 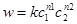 ; 2. ; 2. 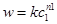 ; 3. ; 3. 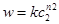 ; 4. ; 4. 
Ідеальний газ
1. Рівняння стану ідеального газу:
1. PV=mRT; 2. PR=mT; 3. Vm=RT; 4. mR=PVT;
2. Температура є функцією:
1. питомої газової сталої; 2. теплоти; 3. внутрішньої енергії; 4. ентальпія;
3. Питома газова стала рівна:
1.  ; 2. ; 2. 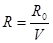 ; 3. ; 3.  ; 4. ; 4.  ; ;
4. Виберіть відповідь, яка не справедлива для газової суміші:
1. кожний газ, який входить в суміш, має туж температуру що і вся суміш; 2. Кожний з газів займає об’єм, який займає суміш; 3. тиск суміші рівний суміші парціальних тисків окремих компонентів; 4. суміш не підпорядковується рівнянню стану ідеального газу.
5. Перший закон термодинаміки:
1. δq=du+pdv; 2. δq=du-pdv; 3. δq=du+vdp; 4. δq=dh+ pdv;
6. Вкажіть не рівні залежності:
1.  ; 2. Cp=Cv+R; 3. ; 2. Cp=Cv+R; 3.   ; 4. ; 4. 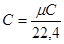 ; ;
7. Вкажіть правельну залежність:
1. 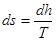 ; 2. ; 2. 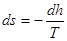 ; 3. ; 3. 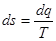 ; 4. ; 4.  ; ;
8. Ентальпія рівна:
1. h=u+pv; 2. h=u-pv; 3. h=u+R; 4. h=q-R;
9. В якому термодинамічному процесіідеального газу кількість теплоти qv=Cvm(t2-t1):
1. ізобарному; 2. ізотермічному; 3. ізохорному; 4. адіабатному;
10. В якому термодинамічному процесі dq=Cpm(t2-t1):
1. ізобарному; 2. ізотермічному; 3. ізохорному; 4. адіабатному;
11. Для якого термодинамічного процесу справедлива формула 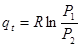 ; ;
1. ізобарному; 2. ізотермічному; 3. ізохорному; 4. адіабатному;
12. Для якого термодинамічного процесу робота lv=0:
1. ізобарному; 2. ізотермічному; 3. ізохорному; 4. адіабатному;
13. Для якого термодинамічного процесу роботу можна обчислити за формулою 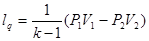
1. ізобарному; 2. ізотермічному; 3. ізохорному; 4. адіабатному;
14. Покази політропи n рівний:
1. n=0; 2. n=1; 3. n=k; 4. -∞<n<∞;
15. Рівнянння політропного процесу має вигляд:
1. PV=const; 2. PVn=const; 3. PVk=const; 4. P=const;
Реальні гази
1. Чи виконується рівняння Менделєєва-Клапейрона для реальних газів:
1. так; 2. Ні; 3. частково в області визначених температур; 4. немає правильної відповіді;
2. Коефіцієнт стислості  характеризує: характеризує:
1. зміну температури при зміні тиску; 2. зміну тиску при нагріву газу; 3. відхилення властивостей реальних газів від властивостей ідеального газу;
3. В рівнянні Ван-дер=Вальсса  поправка b враховується: поправка b враховується:
1. швидкість руху молекул; 2. густину газу; 3. вплив взаємодії між молекулами; 4. об’єм молекул і між молекулярним проміжком;
4. В рівнянні Ван-дер=Вальсса  поправка а враховується: поправка а враховується:
1. швидкість руху молекул; 2. густину газу; 3. вплив взаємодії між молекулами; 4. об’єм молекул і між молекулярним проміжком;
5. Якщо ступінь сухості пари х=1, то пара:
1. суха; 2. волога ненасичена; 3. перегріта; 4. рідина;
6. Трійна точка речовини характеризує:
1. початок кипіння рідини; 2. початок плавлення; 3. стан коли тіло може існувати в рідкому, твердому чи газоподібному стані; 4. завершення кипіння;
7. Насиченою називається пара, яка:
1. має більшу температуру, чим температура кипіння при даному тиску; 2. має меншу температуру чим температуру кипіння при даному тиску; 3. знаходиться в теродинамічній рівновазі з рідиною; 4. немає правильної відповіді;
8. Суха насичена пара це пара, яка має:
1. більшу температуру чим температуру кипіння при даному тиску; 2. немає рідини і температура рівна температурі кипіння при даному тиску; 3. двофазна система, яка складається з пари і рідини; 4. немає правильної відповіді;
9. Вологою насиченою парою називають пару, яка:
1. має більшу температуру, чим температура кипіння при даному тиску; 2. має меншу температуру чим температуру кипіння при даному тиску; 3. складається із пари і рідини, як ізнаходяться в термодинамічній рівновазі при температурі кипіння; 4. пара в якій не має рідини;
10. Стан вологої насиченої водяної пари характеризується на діаграмі лінією: 1.АК; 2. КВ; 3. АА’; 4. АКВ;

11. Стан сухої насиченої водяної пари характеризується на діаграмі лінією:
1. АА’; 2. АК; 3. КВ; 4. АКВ
12. Степінь сухості пари це відношення:
1. маси рідини до маси пари; 2. відношення маси вологої пари до маси сухої пари; 3. відношення маси сухої пари до маси вологої пари; 4. немає правильної відповіді;
13. Кількість теплоти яку необхідно підвести до рідини, щоб нагріти її до температури кипіння:
1. qp=VvtН; 2. qp=VntН; 3. qp=VptН; 4. немає правильної відповіді;
Вологе повітря
1. Вологим повітрям називається:
1. суміш сухого повітря і водяної пари; 2. суміш води і сухого повітря; 3. суміш води і вологого повітря; 4. немає правильної відповіді;
2. Відносною вологістю повітря називається:
1. кількість водяної пари, яка знаходиться на 1 м3; 2. відношення абсолютної вологості ρп до максимально можливої ρmax при даному тиску і температури 3. густина пари в повітрі; 4. кількість водяної пари в одному кілограмі повітря;
3. Маса водяної пари в 1 кг сухого повітря називається:
1. абсолютною вологістю; 2. відносна вологість; 3. вологовмістом; 4. немає правильної відповіді;
4. Вологовмістом вологого повітря називають:
1. маса волого, яка міститься в одному кілограмі вологого повітря; 2. маса волого, яка міститься в одному кілограмі сухого повітря; 3. маса вологи в насичені й водяній парі; 4. правильної відповіді нема;
5. Температура мокрого тармометра співпадає з температурою сухого термометра при:
1. відносній вологості φ=100%; 2. відносній вологості φ<100%; 3. відносній вологості φ=15%; 4. при постійному вологовмісті;
6. Точка роси це:
1. температура до якої необхідно нагріти водяну пару, щоб почався процес кипіння; 2. температура до якої необхідно нагріти водяну пару, щоб почався процес конденсації води; 3. тиск при якому температура кипіння 1000С; 4. тиск при якому лід утворюється при 00С;
7. Кількість теплоти, яку затрачають на нагрів повітря можна визначити за H-d діаграмою як:
1. різницю ентропій в двох точках; 2. різницю ентальпій в двох точках; 3. як зміну температури помножену на теплоємність; 4. не має правельної відповіді.
8. Процес нагріву в калорифері проходить на H-d діаграмі по лінії:
1. φ=const; 2. d=const; 3. t=const; 4. tм=const;
9. Змыну ентропыъ пари в процесі нагріву до температури насичення можна визначити за рівнянням:
1. 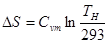 ; 2. ; 2. 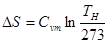 ; 3. ; 3. 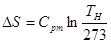 ; 4. ; 4. 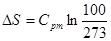 ; ;
10. Кількість теплоти, яка необхідна для переходу речовини з рідкого стану в газоподібний називається:
1. питомою теплоємністю; 2. питомою теплотою пароутворення; 3. питомою газовою сталою; 4. питомою ентальпією;
11. Питому теплоту пароутворення можна визначити за рівнянням:
1. 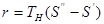 ; 2. ; 2.  ; 3. ; 3. 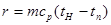 ; 4. ; 4. 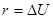 ; ;
12. Питомий об’єм вологої насиченої пари можна визначити за формулою:
1. 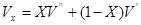 ; 2. ; 2. 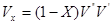 ; 3. ; 3. 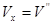 ; 4. ; 4. 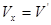 ; ;
Х – степінь сухості; V’ – питомий об’єм води; V’’ – питомий об’єм водяної пари.
13. Виберіть графік, який відповідає ізобарному процесу водяної пари:
14. Виберіть графік, який відповідає ізохорному процесу водяної пари:

15. Виберіть графік, який відповідає ітермічному процесу водяної пари:
|