Зміст
Вступ
1. Фізико-хімічна характеристика процесу
1.1 Існуючі методи одержання вінілацетату, їх стисла характеристика. Вибір методу
1.2 Теоретичні основи вибраного методу отримання вінілацетату
2. Технологічна характеристика процесу
2.1 Основні фізико - хімічні властивості сировини, допоміжних матеріалів, готової продукції
2.2 Опис технологічної схеми
2.3 Відходи виробництва, їх використання
2.4 Новизна в проекті
Література
Вступ
Хімія високомолекулярних сполук за останні роки розвивається винятково швидкими темпами. Величезне число досліджень у цій області привело до нагромадження багатого експериментального матеріалу, на основі якого був зроблений ряд теоретичних узагальнень. Хімія високомолекулярних сполук перетворилася в самостійний великий розділ хімічної науки. Промисловість синтетичних високомолекулярних сполук, що охоплює виробництво пластичних мас, плівок, синтетичного каучуку й синтетичного волокна, що зародилася на початку XX століття, розвивалася в значному відриві від хімічної науки, тому технічні досягнення часто були результатом чисто емпіричних досліджень і випереджали наукове вивчення відповідних процесів. У тридцятих роках відбулися істотні зміни у взаєминах між хімією й технологією синтетичних високополімерів. Промисловість стала виготовляти цілий ряд нових технічних високополімерів, синтез яких почав базуватися на глибокому вивченні реакцій полімеризації й поліконденсації і перетворень у ланцюгах високополімерів. Бурхливий розвиток промисловості пластичних мас, синтетичного каучуку й синтетичного волокна у свою чергу стимулювало подальше розширення об'єму досліджень і поглиблене вивчення складного механізму процесів утворення високополімерів, їхніх властивостей і залежності фізичних показників від структури.
Полімери на основі вінілацетату володіють рядом цінних і специфічних властивостей і, незважаючи на відносно невелику потребу в них у порівнянні із загальною потребою в полімерних матеріалах, відіграють важливу роль у розвитку різних галузей промисловості. Методи їхнього одержання пов'язані з використанням техніки полімеризації в розчинниках, суспензії й емульсії, статистичної й щепленої сополімерізації, численних реакцій полімераналогічних перетворень. Найважливішими особливостями цього класу полімерів є їх універсальні адгезійні та сполучні властивості, висока міцність волокон і плівкових матеріалів, виготовлених з їхнім застосуванням. У цей час важко назвати яку-небудь галузь народного господарства, де б не застосовувалися полімери на основі вінілацетату.
До полівінілацетатних пластиків відносять полівінілацетат і сополімери вінілацетату, які випускають у вигляді гранул, розчинів і дисперсій, полівініловий спирт і полівінілацетати.
Більше 60% колишнього СРСР виробляємого вінілацетату витрачається на виробництво полівінілацетатної дисперсії. Одержаний емульсійною полімеризацією вінілацетат в присутності захисних колоїдів або емульгаторів і окислювально-відновних ініціюючих систем використовується у вигляді 50 % водного продукту такого як клеї, що зв'язуют, плівкоутворювачів. Перевагами полівінілацетатних дисперсій перед іншими клеями є їхня низька вартість, негорючість, нешкідливість, стійкість до старіння, дії жирів, мастил і нафтопродуктів, гарні адгезійні властивості.
Полівінілацетатні дисперсії широко використаються для склеювання паперу, картону, гофрокартону, деревини, пінополістиролу, шкіри, тканин, а також у якості сполук у водоемульсійних фарбах, компоненту композиції для кріплення керамічної плитки і багатьох інших призначень. Недарма полівінілацетатні дисперсії називають «матеріалом тисячі можливостей».
Лакофарбові матеріали на основі дисперсій полівінілацетату є чудовим покриттям для вбираючих прокладок, наприклад штукатурки, бетону, цегли, асбоцементу. Вони швидко висихають і мають здатність «дихати», тобто пропускати вологу з прокладки, при цьому не відбувається ні відлущування покриття, ні утворення в ньому міхурів.
Водоемульсійні полівінілацетатні фарби заміняють мастильні, що дозволяє зменшити використання для технічних цілей харчової сировини. Так, застосування 1 тони полівінілацетатної дисперсії у вигляді фарби дозволяє заощадити 900 кілограмів натуральної оліфи, що виготовляється із соняшникової олії.
Розмаїття областей застосування полівінілацетатної дисперсії зробило необхідним створення різноманітних сортів цього продукту. У цей час промисловими підприємствами випускається 25 марок полівінілацетатних дисперсій, що розрізняються в'язкістю, складом і природою пластифікаторів, розміром часток.
Розроблено спосіб підвищення морозостійкості (до —40° С) дисперсій, пластифіцированого 15% дибутілфталату. Підвищення морозостійкості має істотне значення для транспортування й зберігання дисперсій і фарб на їхній основі в різних кліматичних умовах.
Однак застосування пластифікаторів, здатних згодом випаровуватись з покриттів і мігрувати в субстрати, погіршує споживчі властивості полівінілацетатних дисперсій. Цих недоліків позбавлені дисперсії сополімерів вінілацетату зі складними ефірами ненасичених моно- і дікарбонових кислот, іншими складними вініловими ефірами, етиленом, що є внутрішньо пластифіцированими продуктами. Крім того, дисперсії сополімерів вінілацетату відрізняються від гомополімерної полівінілацетатної дисперсії більш високою адгезією до різних матеріалів, а плівки на їхній основі стійкі до лужного гідролізу.
Особливий інтерес представляють дисперсії сополімерів вінілацетату з етиленом. Не поступаючись за властивостями іншим сополімерним дисперсіям, вони мають ту перевагу, що для їхнього виробництва використовується дешева й легкодоступна сировина - етилен. Ці дисперсії стійкі при низьких температурах, утворюють високоеластичний клейовий шов, здатний міцно зклеювати папір і дерево з полівінілхлоридною плівкою й у майбутньому зможуть майже повністю замінити гомополімерні полівінілацетатні дисперсії.
Сополімери вінілового спирту з етиленом поєднують високу еластичність із водостійкістю, зберігаючи інші властивості полівінілового спирту: газонепроникність, стійкість до дії мастил, жирів, нафтопродуктів, більшості органічних розчинників. Ці сополімери можуть знайти застосування в якості плівкових і конструкційних матеріалів.
Потреба народного господарства в полімерах на основі вінілацетату систематично випереджає ріст обсягу виробництва. Це обумовлено високою економічною ефективністю застосування полівінілацетатних пластиків у різних галузях народного господарства. Для більш повного задоволення потреби в них необхідне створення великих виробництв із великою потужністю технологічних ліній періодичної й безперервної дії й подальше розширення марочних асортиментів. [1]
1. Фізико-хімічна характеристика процесу
1.1 Існуючі методи одержання вінілацетату, їх стисла характеристика. Вибір методу
Рідкофазний процес синтезу вінілацетату
У першому патенті Клат’є опис процесу дається в наступному виді: 250 м безводної оцтової кислоти змішуються з 10 м сірчанокислого закису ртуті. Через суміш при температурі 60—100°С при перемішуванні пропускається ацетилен. Після припинення абсорбції ацетилену реакційна суміш переганяється під вакуумом. При цьому відганяється дуже невелика кількість вінілацетату й у залишку перебуває непрореагована оцтова кислота й етілідендіацетат. Таким чином, у цьому процесі реакція йде головним чином у бік етілідендіацетату. Таким методом можуть бути отримані етіліденові ефіри оцтової, моно-, ді- і тріхлороцтової, пропіонової, молочної, бензойної й іншої кислот.
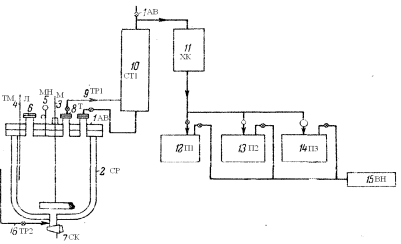
Рисунок 1:1(АВ) – автоклав; 2(СР) – сорочка; 3(М) – мішалка; 4(ТМ) – термометр; 5(МН) – монометр; 6(Л) – лаз; 7(СК) – спускний кран; 8(Т) – труба;9,16(ТР1,2) – трубопровід; 10(СТ1) – стовпчик для фракчіонування; 11(ХК) – холодильник; 12-14(П1-3) – приймач; 15(ВН) – вакуум-насос.
Схема виробництва вінілацетату за рідкофазним процесом із застосуванням підвищеного тиску рисунок 1.
Основним апаратом є автоклав (1) (АВ), футерований склом. Автоклав з термометром (4) (ТМ), манометром (5) (МН), завантажувальним лазом (6) (Л), мішалкою (3) (М),сорочкою для охолодження й обігріву (2) (СР),відвідною трубою (8) (Т), спускним краном (7) (СК) і трубопроводами (9, 16) (ТР 1,2).
В автоклав завантажується 600 частин оцтової кислоти, 30 частин сірчанокислої ртуті і 100 частин сірчанокислого окису заліза. Після завантаження реакційна суміш прохолоджується шляхом додавання в сорочку охолодженого розчину, автоклав продувається азотом і при роботі мішалки нагнітається ацетиленом. Температура підтримується близько 10°С. Протягом 5-6 годин поглинається 142 частин ацетилену, після чого до реакційної суміші додається 50 частин безводного оцетокислого натрію (для нейтралізації сірчаної кислоти), надлишок ацетилену відділяється і суміш піддається діленню у вакуумі за допомогою вакуум-насосу (1) (ВН). Пара проходить через мідний стовпчик для фракціонування (10) (СТ1) в алюмінієвий холодильник (11) (ХК) і конденсуються. У приймачах (12-14) (П1-3) відбираються фракції, що відповідають вінілацетату, оцтовій кислоті й етилідендіацетату. Сірчанокислий натрій і ртутні солі, що залишається в автоклаві віддаляються при промиванні автоклаву, і ртуть піддається регенерації.
У результаті виходить 100 частин вінілацетату, близько 5 частин етилідендіацетату і рекуперується 360 частин оцтової кислоти. Вихід вінілацетату на прореаговану оцтову кислоту становить близько 42 ваг. %.
Основні методи одержання вінілацетату в газовій фазі зводяться до наступного. Синтез вінілацетату здійснюється шляхом проходження суміші ацетилену з парою оцтової кислоти через нагрітий каталізатор. Каталізаторами служать солі цинку й кадмію (оцтові й фосфорнокислі). Як носій каталізатора застосовуються силікагель або активоване вугілля. Температура реакції лежить у межах 210–250°.
Газову суміш рекомендується нагрівати до цієї або трохи вищої температури. Ацетилен застосовується в надлишку проти теоретичного.
Схема одержання вінілацетату рисунок 2.
Ацетилен, що вживався для одержання вінілацетату, промивався спочатку у вежі водою, насиченої хлором, і потім у другій вежі 3%-м розчином їдкого натру.
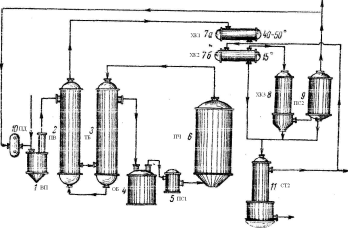
Рисунок 2:
1(ВП) - випарник; 2(ПВ) – підігрівник; 3(ТБ) – теплообмінник; 4(ОБ) – обігрівач; 5,9(ПС1,2) – пастка; 6(ПЧ) – піч; 7а,б,8(ХК1,2,3) – холодильник; 10(ПД) – повітродувка; 11(СТ2) – стовпчик.
Після проходження через карбідні сущії для видалення вологи ацетилен надходив в очисники, завантажена сухою очисною масою, що складається з кізельгуру, просоченого хромовою кислотою, і звідси через повітродувку (10) (ПД) у випарник оцтової кислоти (1) (ВП), у якому підтримувалася температура 120°С. Ацетилен при температурі 90°С, насичений оцтовою кислотою, нагрівався послідовно в підігрівнику (2) (ПВ) до 120—140° С, у теплообмінника (3) (ТБ) до 165—190° і, нарешті, в електричному обігрівачі (4) (ОБ) до 170—220° С. У пастці для купрена (5) (ПС1), завантаженої використаним каталізатором і розташованої перед контактною піччю, газ звільняється від продуктів конденсації ацетилену. Суміш ацетилен-оцтова кислота входила в контактну піч (6) (ПЧ) і проходила через каталізатор, що складається з активованого вугілля з нанесеним на нього ацетатом цинку (20% Zn), що містяться у 785 трубках 3,5 м висоти й діаметром 50 мм. Піч ємністю 5 м3
містить 2100 кг каталізатора. Перетворення оцтової кислоти досягає 30—40%. Охолодження здійснюється ізофороном (з температурою кипіння 213—214°С), що входить у піч при температурі на 4°С нижче температури печі й залишає її при температурі печі. Початкова температура реакції 175°С і кінцева близько 220°С.
Контатна газова суміш проходить з контактної печі (6) (ПЧ) через теплообмінник (3) (ТБ) і підігрівник (2) (ПВ) до першого холодильника (7а) (ХК1), що залишала при температурі 45—50°С, і до другого холодильника (7б) (ХК2), що залишила при температурі 15°С. У наступному холодильнику (8) (ХК3) газ охолоджується до 12°С і реціклює через пастку (9) (ПС2), яка промивається оцтовою кислотою. Конденсат із другого холодильника, з газового холодильника (8) (ХК3) і пастки проходить до верхньої частини стовпчика (11) (СТ2). Ацетальдегід й ацетилен відганяються, і залишок, що складається з 40% вінілацетату, 0,6 % ацетальдегіду й 59,2% оцтової кислоти, переганяється послідовно в трьох колонах Рашига.
Перша дає сирий вінілацетат, що містить ацетальдегід; у другому стовпчику альдегід й інші домішки відокремлюються: у верхній частині третього стовпчика виходить чистий вінілацетат (температура кипіння 71°С при 730 мм). Залишок із третього стовпчика, що складає з оцтової кислоти, вінілацетату й альдегіду, який містить домішки, і другого стовпчика переганяється періодично на двох інших колонах. Для запобігання утворення полімеру під час перегонки додається розчин гідрохінону. За 1 годину на 1 л каталізатора виходить близько 50 м3
вінілацетату. Вихід вінілацетату становив по ацетилену приблизно 92% і по оцтовій кислоті 96-98%.
Парофазний метод синтезу має істотні переваги перед рідкофазним. При парофазному методі застосовуються більш дешеві неотруйні каталізатори, що мають більший термін служби, чим при рідкофазному методі. В самій сутності процесу він є безперервним і допускає легке одержання будь-якого співвідношення компонентів у парогазовій суміші, що дає можливість регулювати процес, створювати практично будь-який надлишок ацетилену й працювати з обраним відсотком конверсії, що визначається як технічними, так і економічними міркуваннями (практично застосовані співвідношення оцтової кислоти й ацетилену лежать у межах від 1:2 до 1:10). Застосування парофазного методу, однак, вимагає використання більше високих температур і здійснення ряду додаткових заходів пожежної й вибухонебезпечності. [1]
1.2 Теоретичні основи вибраного методу отримання вінілацетату
Синтез вінілацетату з ацетилену й оцтової кислоти проводиться в парогазовій фазі по реакції:
С2
Н2
+ СН3
СООН → СН2
=СНОСОСН3
+ Q
через утворення комплексу ацетилену й оцтової кислоти із цинкацетатом, нанесеним на активоване вугілля.
Крім основної реакції протікає ряд побічних, що приводять до утворення ацетальдегіду, кротонового альдегіду, ацетону, етілідендіацетату, бензолу, діоксиду вуглецю й інших домішок.
Зворотний гідроліз вінілацетату з утворенням оцтової кислоти й ацетальдегіду протікає по реакції:
Н2
О + СН2
=СНОСОСН3
→ СН3
СНО + СН3
СООН
Утворення кротонового альдегіду:
СН3
СНО → СН3
СН=СНСНО + Н2
О
Утворення й розкладення етілідендіацетату:
СН3
СООН + СН2
=СНОСОСН3
→ СН3
СН=(ОСОСН3
)2
СН3
СН=(ОСОСН3
)2
→ (СН3
СО)2
О + СН3
СНО
(СН3
СО)2
О → СН3
СОСН3
+ СО 2
(СН3
СО)2
О + Н2
О → 2СН3
СООН
Розкладення оцтової кислоти на ацетон, воду й діоксид вуглецю:
2СН3
СООН → СН3
СОСН3
+ Н2
О + СО 2
Ацетилування ацетальдегіду:
СН3
СООН + СН3
СНО → СН2
=СНОСОСН3
+ Н2
О
Утворення бензолу:
3С2
Н2
→ С6
Н6
Розкладення ацетилену:
3С2
Н2
→ СН4
+ 5С + Н2
+ Q
Утворення на каталізаторі смолоподібних продуктів відбувається за рахунок полімеризації ацетальдегіду і кротонового альдегіду, а також полімерів ацетилену і його гомологів з утворенням купренів.
Купрени (продукт конденсації молекул ацетилену) - жовта аморфна речовина, що не змочується водою й не розчиняється у звичайних розчинниках.
Купренизації ацетилену сприяє присутність міді, а також контакт ацетилену з нагрітими металевими поверхнями.
Вирішальним фактором в утворенні купренів є збільшення часу перебування у парогазовій суміші (ПГС) у зоні контактування.
Протіканню побічних реакцій сприяє підвищена вологість, місцеві перегріви каталізатора при невірному веденні технологічного процесу або пропуски води в теплообмінних апаратах.
Забруднення вінілацетату-сирцю домішками збільшується при недостатній чистоті змішаної оцтової кислоти і піролізного ацетилену. [6]
2. Технологічна характеристика процесу
2.1 Основні фізико - хімічні властивості сировини, допоміжних матеріалів, готової продукції
Вінілацетат - безбарвна, прозора рідина з різким ефірним заходом.
| Молекулярна формула |
СН3СОOСН=СН2 |
| Структурна формула |
| Молекулярна маса |
86 |
| Щільність |
кг/м3
|
934 |
| Температура |
| кипіння |
о
С |
72,7 |
| плавлення |
о
С |
мінус 92,8 |
| Теплота |
| горіння |
кДж/моль |
2065,7 |
| полімеризації |
кДж/моль |
89,3 |
| Розчинність у воді |
% |
2,4 |
Ацетилен при нормальних умовах являє собою безбарвний газ з слабким ефірним заходом, що має наступні фізичні характеристики:
| Молекулярна формула |
С2
Н2
|
| Структурна формула |
| Молекулярна маса |
26 |
| Щільність |
кг/м3
|
1,175 |
| Температура |
| кипіння |
о
С |
мінус 83,8 |
| плавлення |
о
С |
мінус 81 |
| Критична |
| температура |
о
С |
35,6 |
| тиск |
МПа |
6,16 |
| кгс/см2
|
61,6 |
| Теплотворна здатність |
ккал/м3
|
13387 |
| кДж/ м3
|
52200 |
Оцтова кислота - безбарвна рідина з різким заходом оцту, добре розчинна у воді.
| Молекулярна формула |
СН3
СООН |
| Структурна формула |
| Молекулярна маса |
60 |
| Щільність |
кг/м3
|
1049 |
| Температура |
| кипіння |
о
С |
118 |
| плавлення |
о
С |
16,6 |
Вінілацетат-сирець фізико-хімічні властивості визначаються наявністю в ньому не менш 40% вінілацетату й не більше 60% оцтової кислоти.
Ацетальдегід - безбарвна, прозора рідина з різко вираженим заходом прілих яблук. Ацетальдегід необмежено розчинний у воді.
| Молекулярна формула |
СН3—СНО |
| Структурна формула |
| Молекулярна маса |
44 |
| Щільність |
кг/м3
|
783 |
| Температура |
| кипіння |
о
С |
20,8 |
| плавлення |
о
С |
мінус 124 |
Кротоновий альдегід -рідина із сильним і різким заходом.
| Молекулярна формула |
СН3-СН=СН―СНО |
| Структурна формула |
| Молекулярна маса |
70 |
| Щільність |
кг/м3
|
848 |
| Температура |
| кипіння |
о
С |
102,2 |
| плавлення |
о
С |
мінус 69 |
Ацетон - безбарвна, прозора рідина з характерним заходом. Змішується з водою й органічними розчинниками в будь-яких співвідношеннях.
| Молекулярна формула |
СН3
―СО―СН3
|
| Структурна формула |
| Молекулярна маса |
58 |
| Щільність |
кг/м3
|
790 |
| Температура |
| кипіння |
о
С |
56,2 |
| плавлення |
о
С |
мінус 95 |
Карбамід при нормальних умовах
| Молекулярна формула |
Н2
N―CО―NН2
|
| Структурна формула |
| Молекулярна маса |
48 |
Газоподібний азот - інертний газ без кольорів, запаху й смаку.
| Молекулярна формула |
N2
|
| Структурна формула |
| Молекулярна маса |
28 |
| Щільність |
кг/м3
|
1,25 |
| Температура |
| кипіння |
о
С |
мінус 195 |
| плавлення |
о
С |
мінус 210 |
Розсол - водяний розчин хлористого кальцію з добавкою біхромату натрію.
| Щільність |
кг/м3
|
не менш 1240 |
| Температура |
о
С |
від мінус 10 до мінус 18 |
| РН середовища |
від 8 до 10 |
Кубовий залишок випарників.
Фізико-хімічні властивості обумовлені наявністю не менш 40% оцтової кислоти й не більше 60% полівінілацетату, смол неграничних вуглеводнів, гідрохінону, води.
Фракція кротонового альдегіду з 16 тарілки колони (КЛ1).
Фізико-хімічні властивості обумовлені наявністю від 5% до 15% кротонового альдегіду розчиненого в оцтовій кислоті. [6]
2.2 Опис технологічної схеми
Ректифікація вінілацетату-сирцю
Процес ректифікації вінілацетату-сирцю здійснюється на двох агрегатах ректифікації - ректифікаційних колонах КЛ1і КЛ2. Регенерація оцтової кислоти здійснюється випарюванням оцтової кислоти у випарниках.Виділення вінілацетату з ацетальдегідної фракції здійснюється на одній ректифікаційній колоні загальної для двох агрегатів ректифікації.
Вінілацетат-сирець зі стадії синтезу надходить у збірник ЗБ 1. Подих збірника ЗБ1 здійснюється через зворотний холодильник, гідрозатвор.
Затворною рідиною в гідрозатворі служить вінілацетат-сирець, що подається насосами Н1.
Вінілацетат-сирець зі збірника ЗБ1 насосом Н1 через холодильник ХК1 і холодильник-конденсатор ХР1 без зупинок подається як харчування в ректифікаційну колону КЛ1. Колона КЛ1 обігрівається паром, що подається в кип'ятильники КП1 і КП2. У колоні КЛ1 відбувається відгін вінілацетату від висококиплячих компонентів. Температура в кубовій частині колони підтримується в межах 122-130 0
С, тиск не більше 0,06МПа.
Висококиплячі компоненти з куба колони КЛ1 відбираються у випарник.
Парогазова суміш із верхньої частини колони КЛ1 конденсується в дефлегматорі ДФ1 і холодильнику ХК2. Продукти конденсації зливаються у збірник ЗБ2. Гази, що не сконденсувалися, і пари, з холодильника ХК 2 скидаються через гідрозатвор і ОПК на смолоскипову установку цеху ацетилену.
Частина дистиляту зі збірника ЗБ2 подається у верхню частину колони КЛ1 як флегма, інша частина дистиляту подається як харчування на ректифікаційну колону КЛ2 і для готування розчину інгібітору в розчинники. Збірник дистиляту ЗБ2 повідомлений з відстійником Е1, де відбувається розшарування вінілацетату й водного шару. Водний шар періодично скидається в каналізацію промислових брудних стоків.
Для запобігання полімеризації вінілацетату в колоні КЛ1, з розчинників гідрохінону насосом подається інгібітор-розчин гідрохінону.
Для зв'язування кротонового альдегіду й інших неграничних вуглеводнів на 6-у тарілку колони КЛ1, насосом з розчинника карбаміду, подається розчин карбаміду в оцтовій кислоті. Утворені при цьому смолоподібні продукти виводяться з куба колони у випарники. Крім того, фракція кротонового альдегіду відбирається з 16-ої тарілки колони КЛ1 у дренажний приймач і в суміші з кубовим залишком випарників відправляється для спалювання на установку термічного знешкоджування рідких відходів.
Парогазова суміш, що містить пари вінілацетату з домішками ацетальдегіду й ацетону, з верхньої частини колони КЛ2 конденсується в дефлегматорі ДФ2 і холодильнику ХК3.
Продукти конденсації зливаються в збірник ЗБ3. Гази, що не сконденсувалися, і пари (ацетилен з домішками ацетальдегіду, ацетону й вінілацетату) з холодильника ХК3 скидаються через гідрозатвор і ОПК на смолоскипову установку цеху ацетилену.
Частина дистиляту зі збірників дистиляту ЗБ2 насосом подається як флегма у верхню частину колони КЛ2. Інша частина дистиляту колони КЛ2, з метою виходу із системи ректифікації ацетальдегіду й ацетону, зі збірника флегми ЗБ3 відбирається в збірник.
Для запобігання полімеризації вінілацетату в колоні КЛ2 у збірник дистиляту СБ 2 з розчинників гідрохінону насосом подається інгібітор - розчин гідрохінону.
Пари вінілацетату по бічному відбору, що перебуває між 4 - 5 тарілками колони, через регулюючу заслонку надходять на конденсацію в конденсатор КР1 і холодильник ХК4. Вінілацетат-ректифікат, що сконденсувався, через холодильник зливається в збірник ЗБ4, звідки товарний вінілацетат-ректифікат насосом Н2 відкачується в сховища базисного складу або в збірник ЗБ1 на переробку.
Кубова частина колони КЛ2 (вінілацетат з домішками полівінілацетату, оцтової кислоти й води) виводиться в збірник ЗБ4. [6]
2.3 Відходи виробництва, їх використання
Відходи виробництва вінілацетату характеризуються таблицею
| Найменування відходу. Апарат або стадія, де утвориться |
Напрямок використання, метод очищення або знешкодження |
Норми утворення відходів, кг. 2007 р. |
| 1 |
2 |
3 |
| Тверді відходи |
| 1. Мішки паперові з-під гідрохінону |
Відправляється у хімнакопичувачі твердих відходів
с. Фугаровка
|
0,018 |
| 2. Рукави гумовотканинні відпрацьовані |
Відправляється у хімнакопичувач твердих відходів
с. Фугаровка
|
0,023 |
| 3. Полівінілацетат після очищення резервуарів ХГС відділення ректифікації |
Відправляється у хімнакопичувач твердих відходів
с. Фугаровка
|
0,03 |
| Рідкі відходи |
1. Кубовий залишок випарників поз. 403/1-2
Масова частка, %
–оцтової кислоти не менш 40,0;
–полівінілацетата води, смол неграничних вуглеводнів, гідрохінону, етілідендіацетату не більше 60,0
|
Відправляється у цех ацетилену на спалювання |
20,0 |
| 2. Вода при промиванні апаратів у процесі підготовки в ремонт устаткування відділення ректифікації, К. 1200 А |
Відкачується через станцію перекачування № 3 на ФХО |
351 |
| 3. Вода при змиві нульової оцінки етажерки відділення ректифікації, К. 1200 А |
Відкачується через станцію перекачування № 3 на ФХО |
255 |
| 4. Дистилят колони поз. 101 |
На спалювання у цех ацетилену |
19,0 |
| 5. Фракція кетонів колони поз.101 |
На спалювання у цех ацетилену |
0,975 |
| Газоподібні відходи |
1.Викідні гази відділення
ректифікації
|
Направляється на
смолоскипову установку цеху ацетилену
|
69,064 |
2. Викиди через воздушку ємностей поз. 109/1-3, розчинника поз. 111(6/П-7), К.1200 А
Масова концентрація, мг/м3
–оцтової кислоти не більше 10,735
|
Викидаються у атмосферу |
0,019 |
| 3. Неорганізовані викиди: |
3.1 Відділення ректифікації (22Н/П-7)
–вінілацетат
–оцтова кислота
|
Викидаються у атмосферу |
0,258
1,4526
|
4. Димови гази печі спалювання рідких відходів:
–оксид вуглецю
–діоксид азоту
–сірчистий ангідрит
|
Викидаються у атмосферу |
0,00876
0,02183
0,00197
|
2.4 Новизна в проекті
Довідка за результатами впровадження рацпропозиції «Підвищення ефективності роботи колони поз.101 цеху вінілацетату»
Введення в експлуатацію додаткових потужностей виробництва вінілацетату в листопаді 2005р. привів до збільшення кількості побічних продуктів, що утворяться на стадії синтезу, відповідно до росту навантаження на колону ректифікації ацетальдегідної фракції і до зниження ефективності роботи цієї колони.
Середні показники роботи колони поз.101 у період із грудня 2005р. до реконструкції колони відносять:
¾ середня масова концентрація вінілацетату в кетоновій фракції - 25%; середня масова концентрація вінілацетату в дистиляті колони - 5%.
Дистилят колони і кетонова фракція піддавалися термічному знешкодженню на печі.
Після впровадження заходів щодо рацпропозиції «Підвищення ефективності роботи колони цеху вінілацетату» середні показники роботи колони склали:
¾ середня масова концентрація вінілацетату у кетоновій фракції - 1%;
¾ середня масова концентрація вінілацетату у дистиляті колони - 0.1%.
Середньогодинне утворення кетонової фракції і дистилята колони становить 12.25кг/год. і 62кг/год. відповідно.
Безповоротні втрати вінілацетату з кетоновою фракцією й дистилятом колони до її реконструкції відносили:
12.25 * 0.25 + 62 * 0.05 = 6.16кг/год. або
6.16 * 8400 / 1000 = 51.744т/рік.
Безповоротні втрати вінілацетату з кетоновою фракцією і дистилятом колони поз.101 після її реконструкції становлять:
12.25 * 0.01 + 62 * 0.001 = 0.185кг/ч або
0.185 * 8400 / 1000 = 1.554т/рік.
Зменшення втрат вінілацетату після впровадження заходів щодо рацпропозиції склало:
51.744 - 1.554 = 50.19т/рік,
що в грошовому вираженні, при фактичній собівартості вінілацетату в жовтні 2007р. 4555.95грн/т, становить:
50.19 * 4555.95 = 228663грн/рік
Крім того, впровадження заходів щодо рацпропозиції дозволило поліпшити показники якості кетонової фракції з досягненням масової концентрації ацетону від 94 до 97%. З моменту реконструкції колони отримано 33.61т кетоновій фракції, що відповідає показникам якості по ТУУ В 24.1-33270581-016:2007.
Таким чином, при збільшенні кількості тарілок збільшилася продуктивність колони. [6]
Література
1. Ватлаев Ф.П., Вайнштейн В.Б., Лапидус А.С. Бюллетень по обмену опытом в азотной промышленности, ГХИ, 10, 3 2008
2. Федоренко Н.П. Методы и экономика получения винилацетата. Химическая наука и промышленность, в 3 т., т. 1, 1956
3. Гриненко В.С. Получение винилацетата, изд. АН СССР, 1958 с. 106
4. Лебедев Н.Н. Химия и технология органического и нерганического синтеза – М., Химия, 1988 – 592 с.
5. Адельсон С.В., Вишнякова Т.П., Пацикин Я.М. Технология нефтехимического синтеза – М., Химия, 1985 – 608 с.
6. Тимофеев В.С. Принципы технологии основного органического и нефтехимического синтеза – М., Высшая школа, 2003 – 536 с.
|