ВВЕДЕНИЕ
Получение этанола — одно из крупнотоннажных промышленных производств основного (тяжелого) органического синтеза. При его изучении можно проследить основные тенденции технического прогресса в химической промышленности. Большие масштабы производства этанола предъявляют определенные требования к экономике производства, в первую очередь в решении проблемы выбора сырья (в себестоимости химической продукции доля сырья достигает 70 %) и рационального оформления технологического процесса. Кроме того, эти требования направлены на сокращение числа стадий производства; укрупнение единичных Мощностей аппаратов и установок в целом; повышение комплексности использования сырья; создание малоотходных технологических процессов; обеспечение необходимых мер по охране окружающей среды; максимальное внедрение на всех стадиях производства АСУ.
ГЛАВА 1. ПРОИЗВОДСТВО ЭТАНОЛА ФЕРМЕНТАЦИЕЙ БИОМАССЫ
Получение этанола.
Обычно этанол получают отгонкой, и, по всей вероятности, этот способ будет применяться и в ближайшем будущем. Отгонка производится в колоннах путем последовательного отделения этанола от других компонентов жидкой фазы.
Отделение барды. В первой колонне отделяются продукты ферментации (главным образом этанол) и некоторое количество воды от неферменти-рующихся твердых веществ в жидкой фазе (барде). Эта колонна обычно называется «пивным перегонным кубом». Желательно, чтобы на этом этапе из жидкой среды был отогнан весь этанол. В некоторых конструкциях колонн возможно увеличение концентрации этанола в верхнем погоне путем ректификации. Для отделения твердых веществ из жидкой фазы, движущейся вниз, предусмотрена отпарная секция.
Производство безводного этанола. Последовательность перегонки после «пивного перегонного куба» зависит от требований, предъявляемых к этанолу. При производстве пищевого этанола последний должен быть очищен в соответствии с требованиями спецификаций на этанол или продукт, в котором он будет использован. При производстве этанола промышленного назначения необходимо удалить из него все загрязняющие вещества, в том числе сивушные масла, которые являются побочными продуктами ферментации. При получении безводного к очищенному продукту добавляют вещества, разрушающие водно-этанольную азеотропную смесь. Этанол и азотообразующую компоненту отделяют друг от друга в следующей колонне. В стандартных условиях для производства безводного этанола требуется по крайней мере четырехкратная перегонка.
Этанол, предназначенный для использования в качестве топлива, не должен содержать воду [8]. Вместе с тем предполагается, что из такого этанола нет необходимости отделять сивушные масла. Поэтому перегонная система для получения этанола, предназначенного для использования в качестве топлива, включает «пивной перегонный куб» с ректификацией и колонны для азеотропной перегонки и отпарки. Спецификации на готовый продукт. Количество энергии, расходуемой на очистку этанола, определяет числа действующих колонн. В каждой колонне для поддержания заданного равновесия паров и жидкости над тарелками расходуется значительное количество тепловой энергии. Поэтому с энергетической точки зрения важное значение имеет спецификация на готовый продукт. В зависимости от спецификации и гибкости установки для производства более широкого ассортимента продуктов эксплуатационные расходы могут возрасти больше или меньше.
Глава 2. ЭКОЛОГИЧЕСКИЕ И ЭКОНОМИЧЕСКИЕ АСПЕКТЫ ПРОИЗВОДСТВА ЭТАНОЛА
Получение этанола — одно из крупнотоннажных промышленных производств основного (тяжелого) органического синтеза. При его изучении можно проследить основные тенденции технического прогресса в химической промышленности. Большие масштабы производства этанола предъявляют определенные требования к экономике производства, в первую очередь в решении проблемы выбора сырья (в себестоимости химической продукции доля сырья достигает 70 %) и рационального оформления технологического процесса. Кроме того, эти требования направлены на сокращение числа стадий производства; укрупнение единичных Мощностей аппаратов и установок в целом; повышение комплексности использования сырья; создание малоотходных технологических процессов; обеспечение необходимых мер по охране окружающей среды; максимальное внедрение на всех стадиях производства АСУ.
Этанол (метилкарбинол, этиловый, винный спирт) известен человеку с глубокой древности. Первые упоминания о нем относятся к VIII в. В арабских источниках (950 г.) описано получение водного этанола. В 1050—1150 гг. этанол получали ректификацией вина, в котором он образуется при брожении глюкозы, и использовали под названиями «aquaardens» («вода горючая»), «aquavitae («вода жизни»), «spiritusvinb («дух вина»). Последний термин удержался в фармакологии до настоящего времени,
С XIII в. этанол стали применять в медицине под названиями «мать», «государыня», «царица всех, лекарств». К 1440 г. относится исследование состава спирто-водных смесей (водки). С 1600 г. этанол используют в химических опытах для экстракции органических веществ. В книге А. Либавия «Алхимия» (1597) приведен проект химической лаборатории, в которой предусмотрен «винный погреб».
В 1682 г. И. Бехер впервые описал метод получения водного этанола (водки) из картофеля, а в 1748 г. он опубликовал сообщение Шведской академии наук о промышленном способе получения этанола из картофеля. Попытка получить в 1775 г. Т. Бергманом. Впервые безводный этанол получил Т. Е.Ловиц в 1796 г. В 1798 г. А. Арганд описал применение метода ректификации для перегонки этанола. Однако только в 1820 г. для этой цели была сконструирована промышленная ректификационная колонна.
В 1783 г. А. Лавуазье установил элементный состав этанола и попытался объяснить природу спиртового брожения. Окончательно химизм этого процесса был выяснен в XIX в. Исследование Д. И. Менделеевым в 1864 г. систем «этанол — вода» стало основой для разработки им гидратной (химической) теории растворов.
До 1934 г. в стране этанол получали исключительно из пищевого сырья. В 1934 г. было освоено производство этанола гидролизом древесины, а в 1935 г. построен первый гидролизный завод в Ленинграде. С 1930 г. в стране велись работы по получению этанола сернокислотной гидратацией этилене, ив 1936 г, вступил в строй опытный завод в Баку. Поиски технологического решения производства этанола методом прямой f-идратации этилена были прерваны войной. В 1952 г. поэтому методу началось освоение производства этанола в г. Сумгаите, а в период с 1953 по 1958 г. вошли в строй заводы в Саратове, Уфе, Грозном, Самаре.
В результате этих работ к 1960 г. доля синтетического этанола достигла уже 25 % в общем объеме его производства. В 1988 г. на основе этилена было получено 26,5 дал. этанола, что эквивалентно 2,7 млн. тонн картофеля или 0,86 млн. тонн зерна. Однако, несмотря на более низкую себестоимость -синтетического этанола, его доля в общем балансе продукции возрастала медленно. Так, в 1975 г. в СССР пищевой этанол составлял 60,0%, синтетический — 26,7%, гидролизный — 8,3%, в то время как в США уже в 1970 г. производство синтетического этанола достигло 83 %. С 1964 г. в стране было полностью прекращено использование для технических целей этанола, полученного из пищевого сырья, что отвечало решению общей задачи по сокращению доли пищевого сырья в сырьевом балансе химической промышленности.
Разработка промышленных методов производства этанола из этилена и гидролизом древесины позволила в свое время решить в стране важнейшую народнохозяйственную задачу по увеличению производства мономеров для синтетических каучуков (бутадиен-1,3) и переводу производства на дешевое непищевое сырье. В настоящее время перевод производства бутадиена на углеводородное сырье (бутана и бутилен-дивинильная фракция продуктов пиролиза) высвобождает значительное количество синтетического этанола. Его предполагается использовать как сырье для производства кормовых дрожжей — белковых добавок к кормам, по качеству значительно превосходящих кормовой белок из парафина, а само производство не будет столь вредным в экологическом аспекте. В этой связи экономически целесообразна схема производства, основывающаяся на этане природного газа, который у нас в настоящее время не находит должного применения и, как правило, его сжигают. Таким образом, значение технологического процесса получения синтетического этанола не только сохраняется, но и возрастает, так как потребность в этом продукте для указанной цели в 5—10 раз превышает уровень его современного производства.
В связи с этим гидролизные заводы переводят на производство кормовых дрожжей и производство гидролизного этанола прекращается.' Это в свою очередь вызывает необходимость вновь использовать часть мощностей по производству этанола из пищевого сырья для получения спирта высокой чистоты для специальных технических целей.
Этанол образует с водой азеотропную смесь (95,67 % этанола), кипящую при 78,15 °С, поэтому получение безводного (абсолютного) этанола требует специальных методов обезвоживания! Он обладает наркотическим действием (ПДК=1000 мг/м3
).
Этанол относится к числу важнейших продуктов основного органического синтеза. Это сырье для производства ацетальдегида, хлороформа, диэтилового эфира, сложных эфиров органических кислот, пищевой уксусной кислоты, бутадиена, лекарственных препаратов. Его используют в качестве растворителя, антисептика, компонента моторных топлив, применяют в пищевой и парфюмерной промышленности. На основе разбавленных растворов этанола разработано производство кормовых дрожжей методы производства, этанола.
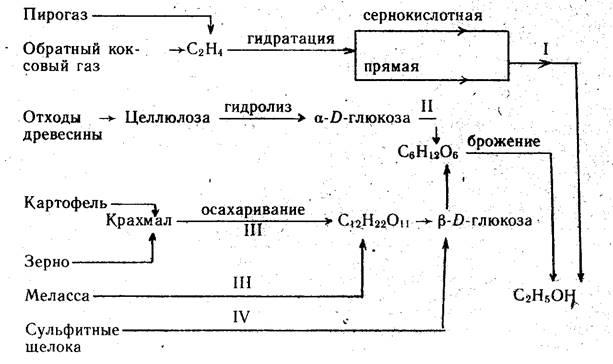
В основу классификации всех существующих промышленных методов производства этанола могут быть положены виды используемого сырья (углеводородные газы, древесина, пищевые продукты, отходы производства) и химизм превращений (гидратация, брожение), лежащих в основе технологических процессов (схема 1).
В соответствии с этой классификацией различают производства синтетического (I), гидролизного (II), ферментативного (пищевого) (III) и сульфитного (IV) этанола.
Выход этанола существенно зависит от вида сырья и составляет (в л на 1 т сырья): для этилена — 740, картофеля -г 93— 117, зерна — 185—361, мелассы — 270—300, древесины — 160—200, сульфитных щелоков — 90—110 (в расчете на 1 т древесины). При использовании в качестве сырья древесины и сульфитных щелоков помимо этанола образуются дрожжи, фурфурол, лигнин и лигниносульфонаты, гипс. Во всех вариантах биохимического метода производства этанола выделяется оксид углерода (IV).
В настоящее время синтетический этанол получают исключительно прямой гидратацией этилена. Метод сернокислотной гидратации сохранил значение только для производства изопропанола и бутанолов вследствие низкой экономичности процесса.
Производство этанола прямой гидратацией этилена
Этилен как сырье в этом методе производства этанола может быть выделен из пирогаза, полученного пиролизом низкооктанового бензина, из газов нефтепереработки или попутного газа, из этиленовой фракции обратного коксового газа (ОКГ),
а также получен пиролизом этана (Схема 2).

Основную массу этилена в настоящее время получают пиролизом нефтяного сырья, преимущественно бензина.
Физико-химические основы прямой гидратации этилена;
Из уравнения реакции следует, что равновесный выход этанола зависит от условий гидратации и растет с понижением температуры, повышением давления и увеличением мольного отношения воды и этилена.
Процесс гидратации катализируется кислыми и нейтральными катализаторами, среди которых наибольшее применение получила фосфорная кислота на носителе в виде кизельгура или силикагеля. В присутствии фосфорной Кислоты происходит электрофилыюе присоединение воды к этилену по схеме:

Катализ осуществляется свободной фосфорной кислотой, которая в жидком состоянии находится на поверхности зерен носителя. Таким образом, активность катализатора зависит от концентрации кислоты. При концентрации кислоты ниже. 83% активность катализатора резко падает. В свою очередь, концентрация кислоты зависит от парциального давления паров воды в системе и температуры. Поэтому, вопреки, требованиям термодинамики данного процесса, его нельзя вести при большом мольном отношении воды (пара) и, этилена, так как это снижает концентрацию кислоты, а следовательно, и активность катализатора. На практике это отношение' поддерживают в пределах (0,6-0,7):1.
Время работы катализатора — около 500 ч, после чего его активность падает, так как часть кислоты уносится током продуктов. Это вызывает необходимость непрерывного добавления фосфорной кислоты в процессе работы установки. При соблюдении этого условия и применении в качестве сырья газа с высоким содержанием этилена интенсивность катализатора составляет 180—200 кг этанола с 1 м3
катализатора в час. В качестве побочных продуктов при гидратации этилена образуются ацетальдегид, диэтиловый эфир и различные олигомеры.
Технологическая схема прямой гидратации этилена. В промышленности процесс гидратации может осуществляться- в двух вариантах: в жидкой и паровой фазах. На практике реализован, преимущественно второй вариант. В этом случае процесс ведут при температуре 290 °С и давлении 8 МПа, что позволяет обеспечить степень конверсии этилена за один проход до 6% при выходе этанола по этилену около 95 %.
Технологический процесс получения этанола прямой гидратацией этилена в паровой фазе строится по циклической схеме. В ней', предусмотрены приготовление, парогазовой смеси (этилен и водяной пар), пополнение потерь катализатора, нейтрализация уносимой с газовым потоком фосфорной кислоты, периодическая отдувка циркуляционного газа для удаления из него примесей и рациональный теплообмен с использованием теплоты реакции гидратации.
Парогазовую смесь готовят совместным нагреванием паров воды и этилена в теплообменниках и трубчатой печи или смешением этилена с перегретым паром высокого давления.
В промышленном масштабе реализованы обе схемы, однако вторая, используемая в нашей' стране, экономически целесообразна при наличии ТЭЦ вблизи производства этанола, В последнее время для приготовления парогазовой смеси вместо пара высокого давления рекомендуют использовать рецикловую воду и паровой конденсат.
На рис. 1 приведена схема гидратации этилена в паровой фазе.
Вводимый этилен сжимают в компрессоре 1до 8 МПа и смешивают с циркуляционным газом. Так как давление циркуляционного газа ниже, чем этилена (объем газа уменьшился за счет образования этанола), его дополнительно сжимают в компрессоре 2. Смесь свежего этилена с циркуляционным, газом подогревают до 300 °С в теплообменнике 3 продуктами реакции и смешивают с перегретым да 450 °С паром при давлении 8 МПа. Парогазовая смесь поступает в гидрататор 4. Гидрататор выполнен в виде реактора идеального вытеснения ~ (РИВ-Н) представляет собой стальной цилиндр диаметром 1,5 м и высотой 10 м; футерованный изнутри медью и наполненный катализатором, насыпанным на перфорированный конус

Рис. 1. Схема гидратации этилена в паровой фазе:
1 — компрессор этилена; 2 — компрессор циркуляционного; 3 — теплообменник; 4—гидрататор; 5—котел-утилизатор
На выходе из гидрататора смесь этанола, водяного пара и непрореагировавшего этилена обрабатывают водным раствором гидроксида натрия для нейтрализации унесенной потоком фосфорной кислоты, охлаждают в теплообменнике 3 и направляют в котел-утилизатор 5, в котором вырабатывается пар низкого давления, поступающий затем в пароперегреватель.
Из котла-утилизатора продукты поступают в сепаратор (газоотделитель) высокого давления 6. Здесь отделяется циркуляционный газ, направляемый в компрессор 2, а спирто-водный конденсат с содержанием этанола до 15 % дросселируют через редукционный вентиль 7 до давления 0,5—0,6 МПа и направляют в сепаратор (сборник) низкого давления 8. В сборнике за счет снижения давления выделяется растворенный в конденсате этилен, который добавляют к циркуляционному газу.
Из сепаратора-сборника 8 спирто-водный конденсат поступает в отпарную ректификационную колонну 9. Здесь за счет нагревания жидкости паром через кипятильник 10 и ректификации смеси происходит отделение паров этанола, загрязненных примесями, от водного раствора фосфата натрия. Из колонны 9 этанол направляют в ректификационную колонну. После ректификации получают очищенный этанол-ректификат, содержащий ацетальдегид (до 2 %) и диэтиловый эфир (не более 1 %).
Последующая очистка синтетического этанола и требования к нему зависят от области использования этанола.Производительность современных установок прямой гидратации этилена достигает 30 тыс. тонн этанола в год.
Производство этанола гидролизом древесины
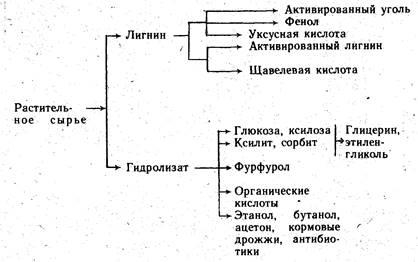
Гидролизное производство. Производство этанола из древесного сырья представляет собой частный случай гидролизного производства, т. е. производства, основанного на химической переработке растительных материалов путем каталитического превращения содержащихся в них полисахаридов в моносахариды. При этом непищевое растительное сырье (отходы древесины, подсолнечная лузга, кукурузные кочерыжки и др.) может быть превращено в пищевые, кормовые и технические продукты. Из образующихся в результате гидролиза этих полисахаридов водных растворов моносахаридов (гидролизатов) кристаллизацией получают пищевую глюкозу и техническую ксилозу; гидрированием — ксилит и сорбит; дегидратацией — фурфурол; окислением — органические кислоты; микробиологической переработкой — этанол, бутанол, ацетон, кормовые дрожжи, антибиотики.
Из лигнина, остающегося после отделения гидролизата, термической обработкой получают активированный уголь, уксусную кислоту и фенол; химической переработкой — активированный лигнин и щавелевую кислоту; прессованием — строительные материалы.
Процесс гидролиза растительных материалов, как пример малоотходного производства, представлен на схеме 3.
В зависимости от природы целевых продуктов гидролизное производство строится по той или иной технологической схеме. При этом, если в качестве сырья используют древесные отходы, то из 1 т абсолютно сухой древесины может быть получено 220 кг кормовых дрожжей, или 35 кг дрожжей и 175 л этанола, или 110 кг дрожжей и 80 кг фурфурола.
Физико-химические основы производства гидролизного этанола. Наиболее распространенное сырье для производства гидролизного этанола — древесина — представляет собой сложную систему, состоящую из целлюлозы, гемицеллюлоз, лигнина, а также небольших количеств смол, эфирных масел, дубильных и красящих веществ. Элементный состав органической части древесины практически постоянен: углерод — 49—51 %, Водород — 6,1—6,9 %, кислород — 43—45 %, азот — 1 %. В то же время содержание целлюлозы, лигнина и гемицеллюлоз зависит от природы древесины. В среднем в сухой древесине хвойных пород, используемой для производства этанола, содержится 52—58 % целлюлозы, 28—29 % лигнина и около 20 % гемицеллюлоз. Гемицеллюлозы — это олигомеры различной степени нолимеризации, состоящие из пентозанов и гексозанов (С6Н1005
)п
. Пентозаны построены из остатков, моносахаридов ксилозы и арабинозы, гексозаны — из остатков моносахаридов маннозы, галактозы, фруктозы и глюкозы.
Гидролиз древесины — каталитический процесс взаимодействия полисахаридов (целлюлозы, пентозанов и гексозанов гемицеллюлоз) с водой. При этом они превращаются в соответствующие моносахариды: ксилозу, a-D-глюкозу и т. д., например:
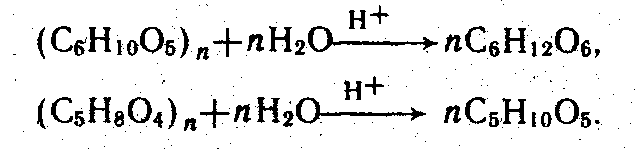
Катализаторы процесса гидролиза —концентрированные и разбавленные кислоты или кислые соли. При этом скорость гидролиза возрастает с увеличением константы диссоциации кислоты, ее концентрации и при повышении температуры гидролизата существенно зависят от природы катализатора. Гидролиз в присутствии разбавленной серной кислоты (0,4—0,7 %-ной) проводят при температуре 120—190 "С и давлении 0,6—1,2 МПа. В результате получают гидролизат, загрязненный фурфуролом, органическими кислотами и другими веществами. Это объясняется тем, что параллельно с гидролизом протекают реакции разложения образовавшихся моносахаридов, скорость которых с повышением температуры также возрастает. Поэтому, несмотря на то что константа скорости реакции гидролиза больше константы скорости реакции разложения, выход гексоз в этом Случае не превышает 70 % от теоретически возможного при степени гидролиза около 90%. Гидролиз в присутствии концентрированных кислот (70— 80 %-ной серной кислоты или 31—41 %-ной соляной кислоты) проводят при температуре не выше 60 "С и атмосферном давлении. Он дает чистый гидролизат с выходом моносахаридов до 95% от теоретически возможного.
Брожение (ферментация) процесс разложения углеводов под воздействием микроорганизмов или выделенных из них ферментов. В производстве этанола используют одну из разновидностей брожения — спиртовое брожение, вызываемое ферментом зимазой, содержащимся в дрожжевых клетках. Из моносахаридов спиртовому брожению подвергаются только гексозы. Процесс спиртового брожения, a-D-глюкозы, составляющей структурную единицу целлюлозы, происходит без доступа кислорода (анаэробное брожение) и включает ряд стадий с участием фосфорорганических соединений. В результате сложных превращений из глюкозы образуется этанол.
Параметры процесса брожения выбирают, исходя из оптимальных условий развития дрожжевых клеток и подавления развития их спутников — кислотообразующих бактерий молочнокислого и уксуснокислого брожения.

Так как оптимальные температуры размножения дрожжевых клеток практически совпадают и равны 35— 50 °С, то подавить развитие бактерий изменением температуры нельзя. Для этого повышают кислотность среды, вводя в гидролизат серную или молочную кислоту. При рН 4,2 дрожжевые клетки интенсивно растут, а бактерии не размножаются. Поэтому на практике процесс брожения проводят при температуре 27 С, атмосферном давлении и в кислой среде (рН= =3,8—4,0).
Технологическая схема производства этанола гидролизом древесины.
Процесс производства этанола складывается из двух последовательных стадий; объединенных в единую технологическую схему: гидролиза древесины и сбраживания образующегося гидролизата. В нашей стране распространен метод гидролиза древесины разбавленной серной кислотой. В качестве сырья используют отходы хвойной древесины с высоким содержанием гексозанов.
Производство этанола по этой схеме представляет собой полунепрерывный перколяциоиный процесс, в основе которого лежит принцип: непрерывной фильтрации раствора кислоты через периодически загружаемое в реактор древесное сырье с непрерывным в течение нескольких часов отбором гидролизата.. При этом раствор кислоты служит одновременно экстрагентом образующихся при гидролизе моносахаридов. Схема производства этанола гидролизом древесины приведена на рис. 2.
Древесное сырье в виде опилок или измельченной щепы загружают в гидролиз-аппарат 1 — цилиндрический стальной сосуд, футерованный внутри кислотоупорным материалом. После загрузки сырья в аппарат через специальное оросительное устройство подают нагретый до 1$0—190 °С раствор серной кислоты концентрацией около 0,5 %. Воду для получения раствора кислоты подогревают в подогревателе 2. В гидролиз-аппарат вводят также пар и создают давление 1,0—1,2 МПа. Через фильтрующее устройство, расположенное в нижней части гидролиз-аппарата и выполненное в виде перфорированных медных трубок, из аппарата непрерывно отводят гидролизат и направляют его в испаритель 4. Вследствие снижения давления гидролизат вскипает и пары, содержащие фурфурол (tKHn
= 161,7 °С при атмосферном давлении), поступают в конденсатор 5. Цикл непрерывной работы гидролиз-аппарата от загрузки до выгрузки составляет несколько часов, затем оставшийся в нем лигнин передавливают после открытия заслонки в сборник после этого в аппарат загружают новую порцию древесного сырья.
После отделения фурфурола гидролизат из испарителя поступает в нейтрализатор 6, куда подают раствор гидроксида кальция, а оттуда —
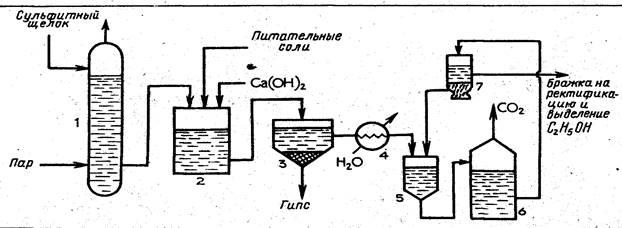
Сульфитный щелок подают в колонну /, где из него паром выдувают примеси. Очищенный щелок поступает в нейтрализатор 2, куда подают раствор гидроксида кальция и вводят питательные соли. Из нейтрализатора щелок после охлаждения до 30 °С в холодильнике 4 направляют сначала на первую ступень брожения в дрожжанку 5, а затем на вторую ступень брожения в бродильный чан 6 и в. сепаратор 7. В сепараторе дрожжи отделяются от образовавшейся бражки, и их возвращают в дрожжанку. После сепаратора бражку, содержащую 1,0— 1,2 % спирта, направляют на концентрирование и выделение этанола аналогично тому, как это происходит в производстве гидролизного этанола (см. рис. 2).
Переработкой сульфитных щелоков можно получить (в расчете на 1 т воздушно-сухой древесины) 90—110 л этанола, 40—50 кг белковых дрожжей, 600—700 кг сухих лигносульфонатов.
Комплексная переработка сульфитных щелоков имеет и большое значение в экологическом плане. Существующие промышленные способы производства целлюлозы не обеспечивают полной утилизации и переработки его отходов — варочных сульфитных щелоков и отдувочных газов. Вследствие этого целлюлозно-бумажная промышленность в настоящее время — одна из основных источников загрязнения водоемов сточными водами.
этанол урок одноатомный спирт
Глава 3. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «СПИРТЫ»
Система уроков по теме: "Предельные одноатомные спирты"
Пояснительная записка.
Все классы органических соединений преподаю блоками. Блок состоит из трех частей:
1. урок-лекция,
2. тренировочные домашние упражнения,
3. урок-коррекция.
Урок-лекция (объяснение нового материала).
Цели:
- ввести понятие предельных одноатомных спиртов, свойств;
- развитие интереса, умения выделять главное, научить сравнивать и анализировать.
1. Определение.
Органические соединения, которые состоят из предельного углеводородного радикала и содержат одну функциональную гидроксильную группу (-ОН), называются насыщенными одноатомными спиртами.
Общая формула Сn
Н2n+1
ОН ( где n 1) или R – ОН 1) или R – ОН
2. Гомологический ряд и номенклатура
СН3
ОН – метиловый спирт (метанол),
СН3
СН2
ОН – этиловый спирт (этанол)….
- СН2 -
гомологическая разница
Пример: 3-метилгексанол – 1
2. Изомерия положения функциональной группы (-ОН)
Пример: бутанол-1 -> бутанол-2
3. Изомерия между классами (предельные одноатомные спирты изомерны простым эфирам)
4. Физические свойства
1) Спирты от С1 до С11 – жидкости, от С12 до С - твердые.
2) Легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют.
3) Низшие спирты (до пропилового) смешиваются с водой в любых отношениях. Высшие спирты практически нерастворимы в воде.
Межмолекулярная водородная связь возможна между отдельными молекулами спирта и между молекулами спирта и воды. Это влияет на физические свойства спиртов: повышает температуру кипения, снижает летучесть, способствует хорошей растворимости в воде, не позволяет перегонкой получить 100% спирт из его водного раствора.
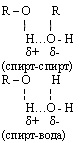
5. Химические свойства (с примерами):
1) горение,
2) взаимодействие с активными металлами;
3) взаимодействие с органическими кислотами, с неорганическими кислотами;
4) с галогеноводородами;
5) окисление
- первичный спирт -> альдегид,
- вторичный спирт -> кетон,
- третичный спирт: тяжело окисляется с разрывом С-С связи;
6) дегидратация:
- внутримолекулярная,
- межмолекулярная с образованием простых эфиров;
7) дегидратация и дегидрирование (реакция Лебедева).
6. Получение одноатомных спиртов (с примерами).
В промышленности:
1) получение СН3
ОН
- из синтез-газа
- во время сухой перегонки древесины (древесный спирт),
2) гидратация алкенов,
3) брожение сахаристых веществ.
В лаборатории:
1) из алканов через галогенопроизводные,
2) восстановление альдегидов.
Физиологическое действие спиртов на организм негативно.
СН3
ОН – сильный яд! В малых количествах вызывает слепоту, в больших – приводит к смерти.
С2
Н5
ОН – наркотик. Под влиянием этанола у человека ослабляется внимание, затормаживается реакция, нарушается корреляция движений. При продолжительном употреблении вызывает глубокие нарушения нервной системы, заболевания сердечно-сосудистой системы, пищеварительного тракта, наступает тяжелая болезнь – алкоголизм.
7. Применение спиртов.
1) Метанол:
- в промышленном органическом синтезе (производство формальдегида),
- как растворитель,
- как добавка к бензину.
2) Этанол:
- производство уксусной кислоты,
- как растворитель,
- в парфюмерии,
- в медицине,
- как топливо,
- в пищевой промышленности.
8. Связь между ациклическими углеводородами и спиртами (показать на примерах).
Домашнее задание: пар. 17 (учебник О.С. Габриелян), тренировочные упражнения.
Приложение 1. Закрепление (если позволяет время)
1. Назвать по международной номенклатуре (2-4 примера).
2. Написать структурные формулы изомерных спиртов С4
Н9
ОН и назвать их.
Приложение 2. Тренировочные домашние упражнения.
Тема: “Одноатомные спирты”.
Сложность 1
(оценка “удовлетворительно”).
1. Написать структурные формулы следующих соединений: 2-метилпентанол-1; 2,3-диметилбутанол-2; 2-метилпентен-1-ол-3.
2. Назвать вещество и написать два его гомолога и два изомера
1. Какой объем водорода выделится при взаимодействии 19,5 г калия с этанолом.
Сложность 2
(оценка “хорошо”).
1. Чем объясняется изомерия спиртов? Пояснить это на примере спирта, в молекуле которого четыре атома углерода. Назвать каждый изомер.
2. Написать реакции получения метанола.
3. Осуществить превращения:
Этан -> бромэтан-> этен-> этанол-> метилэтиловый эфир. Где происходит дегиратация?
4. При сжигании 4,8 г органического вещества образовалось 3,36 л оксида углерода (IV) и 5,4 г воды. Плотность паров этого вещества по метану 2. Определить формулу вещества.
Сложность 3
(оценка “отлично”).
1. Чем отличаются первичные, вторичные и третичные спирты? (Привести примеры каждого и назвать их)
2. Предложить схему получения из пропана пропанол-1.
3. Осуществить превращения (предложить две цепочки).
4. При межмолекулярной дегидратации 100г одноатомного предельного спирта неизвестного строения выделилось 21,09 г воды и выход продукта реакции составил 75% от теоретического. Определить строение спирта.
Урок-коррекция.
1 этап.
10-15 минут. Учащиеся задают вопросы по тренировочным упражнениям.
2 этап.
20-30 минут. Самостоятельная работа. Работа разноуровневая. Учащиеся выбирают любой вариант.
Самостоятельная работа
(тема: “Одноатомные спирты”).
Оценка “удовлетворительно”
| Вариант 1 |
Вариант 2 |
1. Какие вещества называют спиртами? (привести примеры).
2. Какие спирты образуются в результате гидратации следующих веществ: этена, бутена-2.
3. Осуществить превращения:
1)С2
Н 5
ОН->С2
Н 4
->С2
Н 5
Cl->С2
Н5
ОН
2)ацетилен- >А-> этанол
4. При взаимодействии 12,8 г спирта с натрием образовалось 4,48 л водорода. Какой это спирт?
|
1. Написать общую формулу спиртов. Что такое функциональная группа?
2. Написать уравнение гидролиза водным раствором щелочи следующих соединений: хлорэтана, 2-хлорбутана.
3. Осуществить превращения:
1)СН 4
-> С2
Н 2
-> С2
Н 4
-> С2
Н 5
ОН
2)этанол -> А-> этан
4. При дегидратации 12 г спирта образовался алкен и 3,6 г воды. Какой это спирт?
|
Оценка “хорошо”
| Вариант 3 |
Вариант 4 |
1. Объяснить образование водородных связей между молекулами спирта и влияние на физические свойства.
2. Как получить спирты из алкенов (привести два примера).
3. Осуществить превращение: оксид углерода (IV) – метанол – хлорметан – этан – углекислый газ.
4. Найти молекулярную массу вещества А: пропанол-1 – А - пропанол-2
5. 0,5 моль метанола нагрели с KBr и H2
SO4
и получили 38 г бромметана. Найти выход бромметана
|
1. Как доказать, что спирты отравляюще и пагубно действуют на организм человека.
2. Дописать уравнения и назвать вещества.
1. СН 3
– CHCl - СН 2
- СН 3
+ КОН(водн)
2. СН 3
– CHCl - СН 2
- СН 3
+ КОН(спирт)
1. Осуществить превращения: метан – этан – этен – этанол – углекислый газ
2. Определить молекулярную массу вещества А: этанол – А – 1,2-дихлорэтан.
3. Какая масса этилата натрия получится при взаимодействии этанола массой 11,5 г с натрием массой 9,2 г?
|
Оценка “отлично”
| Вариант 5 |
Вариант 6 |
1. Почему температура кипения спиртов намного выше, чем соответствующих углеводородов?
2.
Сколько изомерных бутиловых спиртов может образоваться из изомерных алкенов С4
Н 8
при их гидратации?
3. Написать уравнения реакций, в результате которых можно получить из метана бутадиен-1,3.
4. Метанол массой 2,04 кг получили взаимодействием оксида углерода (11) объемом 2 м3 с водородом объемом 5 м3 (ну). Найти выход продукта реакции.
5. Определить массу пропанола-2, взятого для реакции, если во время дегидратации пропанола-2 получили пропен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2%.
|
1. Почему нельзя физическими методами получить 100%-ный этанол из его водного раствора?
2.
Сколько изомерных третичных спиртов имеют состав .С6
Н13
ОН? Написать формулы и назвать .
3. Написать уравнения реакций, в результате которых можно получить из метана диэтиловый эфир.
4. Какую массу бутадиена-1,3 можно получить из спирта объемом 230 л и плотностью 0,8 кг/л, если массовая доля этанола в спирте 95%? Выход продукта реакции составляет 60%.
5. Вычислить массу добытого продукта, если выход на обеих стадиях синтеза составляет по 60%, если известно, что из пропанола-2 массой 24 г добыт 2-бромпропан, из которого синтезировали 2,3-диметилбутан.
|
Химические свойства спиртов
Одноатомные спирты не обладают ни щелочными, ни кислотными свойствами. Водные растворы спиртов на индикаторы не действуют.
Рассмотрим химические свойства спиртов на примере этанола. В молекуле этилового спирта СН3
–СН2
–ОН имеется четыре типа химических связей, различающихся полярностью: 1) Н–О;
2) С–О; 3) С–Н; 4) С–С. В результате химических превращений разрываются наиболее полярные связи Н–О, С–О и С–Н. Неполярная связь С–С в реакциях спиртов не разрывается.
1. Разрыв связи Н–О в реакции с натрием:
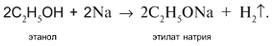
2. Одновременный разрыв связей Н–О и С–Н, находящихся при спиртовом атоме углерода, под действием окислителя (CuO) с отщеплением молекулы Н2
О и образованием альдегида (СН3
СНО):
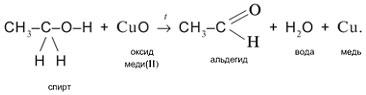
2. Разрыв связи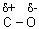 под действием нуклеофильных реагентов (ионов В–
или молекул с неравномерным распределением заряда в молекуле под действием нуклеофильных реагентов (ионов В–
или молекул с неравномерным распределением заряда в молекуле  ) в кислой среде. ) в кислой среде.
3. а) Действие кислот НСl или НВr с образованием галогеналканов:

б) Действие кислородсодержащих кислот – неорганических и органических – с образованием сложных эфиров (подробнее см. урок 29):


Модель нуклеофильного и электрофильного процессов
4. Внутримолекулярное отщепление Н и ОН от соседних атомов С в присутствии концентрированной серной кислоты при нагревании с образованием алкена:

5. Межмолекулярное отщепление Н и ОН от двух разных молекул спирта при умеренном нагревании в присутствии дегидратирующих агентов. Продукт реакции – простой эфир:

6. Спирты горят на воздухе с расщеплением всех связей и образованием углекислого газа и воды:
С2
Н5
ОН + 3О2
 2СО2
+ 3Н2
О. 2СО2
+ 3Н2
О.
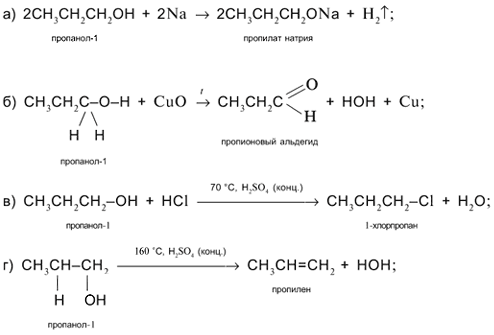
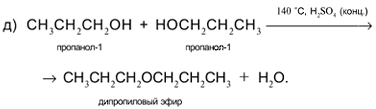
Задача. Составьте уравнения реакций пропанола-1 СН3
СН2
СН2
ОН со следующими реагентами: а) Na; б) CuO; в) HCl в присутствии H2
SO4
(конц.) при нагревании; г) H2
SO4
(конц.) при 160 °С (продукт – алкен); д) H2
SO4
(конц.) при 140 °С (продукт – простой эфир).
Решение
1. Составьте уравнения реакций пропанола-2 СН3
СН(ОН)СН3
со следующими реагентами:
а) Na; б) CuO; в) HCl в присутствии H2
SO4
(конц.) при нагревании; г) H2
SO4
(конц.) при 160 °С (продукт – алкен); д) H2
SO4
(конц.) при 140 °С (продукт – простой эфир).
2. Алюминий реагирует со спиртами подобно натрию. При этом происходит замещение гидроксильного водорода на металл и выделение свободного водорода Н2
. Реакция протекает при нагревании около температуры кипения спирта. Составьте уравнения реакций металлического алюминия со спиртами: а) метанолом; б) этанолом.
3. Почему температуры кипения спиртов выше, чем у соответствующих по молекулярной массе углеводородов (С2
Н5
ОН, Мr
= 46, tкип
= 78 °С; С3
Н8
, Мr
= 44, tкип
= –42 °С)?
4.Напишите схему реакций, с помощью которых пропанол-1 можно превратить в пропанол-2.
Из спиртов ROH получают соединения многих других классов: алкилгалогениды RHal, алкены R'СН=СН2
, простые эфиры RОR', сложные эфиры R'СООR, альдегиды R'СНО, карбоновые кислоты R'СООН и т.д. Спирты используют в качестве растворителей при синтезе новых соединений, производстве лаков и красок, фармацевтических препаратов, душистых веществ, парфюмерно-косметической продукции. Этанол используют как дезинфицирующее средство, горючее в двигателях. Он идет также на изготовление алкогольных напитков.
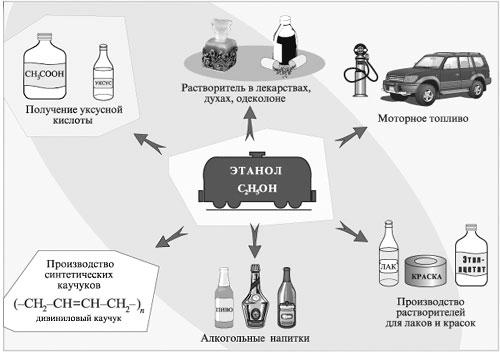
Применение этилового спирта
Для прочного усвоения знаний по химии надо овладеть умением составлять и решать цепочки химических превращений. Решить цепочку – это значит записать уравнения реакций, соответствующие каждой стрелке схемы. В результате удается из имеющихся в наличии веществ получать новые необходимые вещества. Для решения цепочек необходимо знать:
а) способы получения веществ и б) химические свойства веществ различных классов.
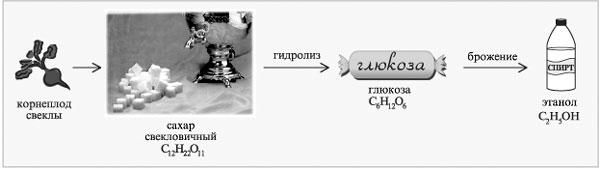
Пример цепочки химических превращений в производстве этанола
Задача. Составьте уравнения реакций для цепочки превращений:

Решение
Воспользуемся удобным способом, помогающим определять реагенты, требуемые для превращения одного вещества в другое: будем находить отличие в составе двух веществ, стоящих по разные стороны от стрелки, и из химической формулы с большим числом атомов вычитать формулу с меньшим числом атомов. Так, для первой стрелки схемы:
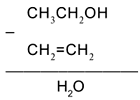
Следовательно, чтобы превратить спирт СН3
СН2
ОН в алкен СН2
=СН2
, надо отщепить молекулу воды от молекулы спирта:

Вторая реакция схемы состоит в присоединении водорода к алкену:

Третья стрелка схемы представляет реакцию замещения водорода в алкане СН3
–СН3
на хлор. Это достигается действием молекулярного хлора на алкан:

Четвертое превращение – замещение атома хлора в хлорэтане С2
Н5
Сl на гидроксильную группу ОН:
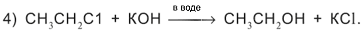
Пятая реакция заключается в отщеплении двух атомов водорода от молекулы спирта. На практике это означает окисление спирта кислородом [O] окислителя, т.е. связывание избыточных атомов Н в форме Н2
О:
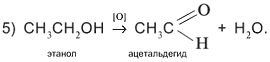
ЛИТЕРАТУРА
1. О.В. Байдалина. О прикладном аспекте химических знании // Химия в школе, 2005, № 5, с. 45-47.
2. Ахметов Н.С. Методика преподавания темы «Закономерности протекания химических реакций» // Химия в школе. 2002, № 3, с. 15 – 18.
3. Ахметов Н.С. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
4. Рудзитис Г.Е., Фельдман Р.Г. Учебник для 8 класса средней школы. М.: Просвещение, 1992.
5. Материалы сайта www.1september.ru
6. О.С. Габриелян, Н.П. Воскобойникова, А. В. Ящукова. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2003 г.
7. Малинин К.М. Технология серной кислоты и серы. М., Л., 1994.
8. Васильев Б.Г., Отвагина М.И. Технология серной кислоты. М., 1985.
9. Отвагина М.И., Явор В.И., Сретенская Н.С., Шарифов М.Ю. Промышленность минеральных удобрений и серной кислоты. М., НИИТЭХИМ. 1972. Выпуск № 4.
10. Резницкий И.Г. Возможности использования нитрозного способа для переработки газов автогенных процессов на серную кислоту / Цветные металлы. 1991. № 4.
11. Березина Л.Т., Борисова С.И. Утилизация фосфогипсов - важнейшая экологическая проблема // Химическая промышленность. 1999 г. № 12.
12. Громов А.П. Экологические аспекты производства серной кислоты // Экология и промышленность России. 2001, № 12.
13. Лидин Р.А. Химия: Руководство к экзаменам / Р. А. Лидин, В. Б. Маргулис. – М.: ООО Издательство «АСТ»: ООО «Издательство Астрель», 2003. с. 64 – 70.
14. Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия / А.А. Каверина, Д.Ю. Добротин, М.Г. Снастина и др.; М.: Просвещение, 2002. – с. 39 – 51.
15. Химия: Большой справочник для школьников и поступающих в вузы / Е.А. Алферова, Н.С. Ахметов, Н.В. Богомолова и др. М.: Дрофа, 1999. с. 430-438
16. Р.П. Суровцева, С.В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г.
|