Содержание
Введение
1. Сущность предмета и история развития
2. Очистка газов от SOx
2.1 Процесс с использованием CuO/CuS04
2.2 Катализаторы
2.3 Угольное топливо с добавками извести
2.4 Введение сухого сорбента
Литература
Введение
Тема реферата: Сущность предмета «Технология очистки и утилизации газовых выбросов» и история развития.
Цель дисциплины «Технология очистки и утилизации газовых выбросов»:
- изучение основных методов обезвреживания газовых выбросов и способов их утилизации, теоретических и практических основ используемых методов, выбор эффективных современных технологий
Задачидисциплины «Технология очистки и утилизации газовых выбросов»:
1. Методы очистки и обезвреживания отходящих газов.
2. Очистка отходящих газов от аэрозолей.
3. Абсорбционные методы очистки газов.
4. Адсорбционные и хемосорбционные методы очистки отходящих газов.
5. Методы каталитической и термической очистки отходящих газов.
1. Сущность предмета и история развития
газ очистка катализатор адсорбционный
До определенного этапа развития человеческого общества, в частности индустрии, в природе существовало экологическое равновесие, т.е. деятельность человека не нарушала основных природных процессов или очень незначительно влияла на них. Экологическое равновесие в природе с сохранением естественных экологических систем существовало миллионы лет и после появления человека на Земле. Так продолжалось до конца XIX в. Двадцатый век вошел в историю как век небывалого технического прогресса, бурного развития науки, промышленности, энергетики, сельского хозяйства. Одновременно как сопровождающий фактор росло и продолжает расти вредное воздействие индустриальной деятельности человека на окружающую среду. В результате происходит в значительной мере непредсказуемое изменение экосистем и всего облика планеты Земля.
В настоящее время с ростом и бурным развитием промышленности большое внимание уделяется ее экологической обоснованности, а именно проблеме очистке и утилизации отходов. В данном конспекте лекций рассматривается один из видов отходов промышленности – газовые выбросы предприятий. Впервые как проблему газовые выбросы можно рассматривать на примере лондонского «смога» (от англ. smoke
– дым), под которым первоначально понимали смесь сильного тумана и дыма. Такого типа смог наблюдался уже в Лондоне уже более 100 лет назад. В настоящее время это уже более широкий термин – над всеми большими и индустриально развитыми мегаполисами помимо дымотуманного смога выделяют и фотохимический смог. Если причиной смога первого типа является в основном сжигание угля и мазута, то причиной второго – выбросы автотранспорта. Конечно же, все это усугубляется некоторым кумулятивным действием большого количества примесей., при дымотуманном смоге сернистый газ дает аэрозоль серной кислоты (из ряда кислотных дождей) который, естественно, намного реактивней по своему действию.
Неудивительно, что в настоящее время пристальное внимание уделяется проблеме удаления первопричин возникновения таких нежелательных явлений, как выбросы в атмосферу. В данной работе тематика проблемы сознательно ограничена рамками промышленных газовых выбросов, так как именно промышленность является источником опасных и крайне опасных примесей и составляющих явлений типа «смога».
В газообразных промышленных выбросах вредные примеси можно разделить на две группы:
а) взвешенные частицы (аэрозоли) твердых веществ - пыль, дым; жидкостей - туман
б) газообразные и парообразные вещества.
К аэрозолям относятся взвешенные твердые частицы неорганического и органического происхождения, а также взвешенные частицы жидкости (тумана).
Пыль – это дисперсная малоустойчивая система, содержащая больше крупных частиц, чем дымы и туманы.
Счетная концентрация (число частиц в 1 см3
) мала по сравнению с дымами и туманами. Неорганическая пыль в промышленных газовых выбросах образуется при горных разработках, переработке руд, металлов, минеральных солей и удобрений, строительных материалов, карбидов и других неорганических веществ. Промышленная пыль органического происхождения – это, например, угольная, древесная, торфяная, сланцевая, сажа и др. К дымам относятся аэродисперсные системы с малой скоростью осаждения под действием силы тяжести. Дымы образуются при сжигании топлива и его деструктивной переработке, а также в результате химических реакций, например при взаимодействии аммиака и хлороводорода, при окислении паров металлов в электрической дуге и т.д. Размеры частиц в дымах много меньше, чем в пыли и туманах, и составляют от 5 мкм до субмикронных размеров, т.е. менее 0,1 мкм. Туманы состоят из капелек жидкости, образующихся при конденсации паров или распылении жидкости. В промышленных выхлопах туманы образуются главным образом из кислоты: серной, фосфорной и др. Вторая группа – газообразные и парообразные вещества, содержащиеся в промышленных газовых выхлопах, гораздо более многочисленна. К ней относятся кислоты, галогены и галогенопроизводные, газообразные оксиды, альдегиды, кетоны, спирты, углеводороды, амины, нитросоединения, пары металлов, пиридины, меркаптаны и многие другие компоненты газообразных промышленных отходов.
В настоящее время, когда безотходная технология находится в периоде становления и полностью безотходных предприятий еще нет, основной задачей газоочистки служит доведение содержания токсичных примесей в газовых примесях до предельно допустимых концентраций (ПДК), установленных санитарными нормами. В данной таблице выборочно приведены ПДК некоторых атмосферных загрязнителей.
При содержании в воздухе нескольких токсичных соединений их суммарная концентрация не должна превышать 1, т.е.
с1
/ПДК1
+ с2
/ПДК2
+... + сn
/ПДКn
= 1
где c1
, с2
,..., сn
– фактическая концентрация загрязнителей в воздухе, мг/м3
;
ПДК1
, ПДК2
,..., ПДКn
– предельно допустимая концентрация, мг/м3
.
При невозможности достигнуть ПДК очисткой иногда применяют многократное разбавление токсичных веществ или выброс газов через высокие дымовые трубы для рассеивания примесей в верхних слоях атмосферы. Теоретическое определение концентрации примесей в нижних слоях атмосферы в зависимости от высоты трубы и других факторов связано с законами турбулентной диффузии в атмосфере и пока разработано не полностью. Высоту трубы, необходимую, чтобы обеспечить ПДК токсичных веществ в нижних слоях атмосферы, на уровне дыхания, определяют по приближенным формулам.
| ВЕЩЕСТВА |
ПДК, мг/м3
|
| макс. разовая |
среднесуточная |
| Аммиак |
0,2 |
0,2 |
| Ацетальдегид |
0,1 |
0,1 |
| Ацетон |
0,35 |
0,35 |
| Бензол |
1,5 |
1,5 |
| Гексахлоран |
0,03 |
0,03 |
| Ксилолы |
0,2 |
0,2 |
| Марганец и его соединения |
- |
0,01 |
| Мышьяк и его соединения |
- |
0,003 |
| Метанол |
1,0 |
0,5 |
| Нитробензол |
0,008 |
0,008 |
| Оксид углерода (СО) |
3,0 |
1,0 |
| Оксиды азота (в пересчете на N2
O5
) |
0,085 |
0,085 |
| Оксиды фосфора (в пересчете на P2
O5
) |
0,15 |
0,05 |
| Ртуть |
0,0003 |
0,0003 |
| Свинец |
- |
0,0007 |
| Сероводород |
0,008 |
0,008 |
| Сероуглерод |
0,03 |
0,005 |
| Серы диоксид SO2
|
0,5 |
0,05 |
| Фенол |
0,01 |
0,01 |
| Формальдегид |
0,035 |
0,012 |
| Фтороводород |
0,05 |
0,005 |
| Хлор |
0,1 |
0,03 |
| Хлороводород |
0,2 |
0,2 |
| Тетрахлорид углерода |
4,0 |
2,0 |
Величина ПДВ для выброса нагретой газовоздушной смеси из одиночного источника с круглым устьем или группы таких близкорасположенных одинаковых источников в случае, когда фоновая концентрация рассматриваемой примеси установлена независимо от скорости и направления ветра, и постоянной на территории города, рассчитывается по формуле.
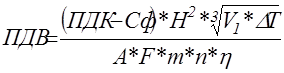
где, ПДК
– предельно допустимая концентрация загрязняющих веществ в атмосферном воздухе населенных мест, мг/м3
.
Сф
– фоновая концентрация примеси, определенная расчетным путем и не зависящая от скорости и направления ветра мг/м3
.
А
– коэффициент, зависящий от температуры стратификации атмосферы и определяющий условия горизонтального и вертикального рассеивания атмосферных примесей. На территории Украины А = 160.
F
– безразмерный коэффициент, учитывающий скорость оседания загрязняющих веществ в атмосфере. Для газообразных веществ и мелкодисперсных аэрозолей, скорость упорядоченного оседания которых не более 3–5 м/с F = 1. Для более крупнодисперсных пыли и золы при среднем эксплуатационном коэффициенте очистки не менее 90% F =2. При эксплуатационном коэффициенте очистки от75% до 90% F = 2,5, а менее 75% или при его отсутствии F = 3.
Н
– высота источника выброса.
∆Т
– разность между температурой газа и температурой воздуха.
ή
– коэффициент, учитывающий влияние рельефа на рассеивание примесей.
V1
– объем газовоздушной смеси, определяется по формуле.

П
= 3,14.
D
– диаметр устья источника выбросов.
ω0
– средняя скорость выхода смеси из источника.
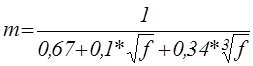

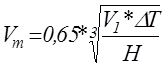
При Vm
< 0,3 n = 3
0,3 < Vm
≤ 2 n определяется по формуле (1)
Vm
> 2 n = 1
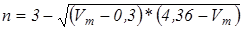 (1)
(1)
Максимальную приземную концентрацию загрязняющего вещества рассчитывают по формуле
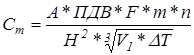
Необходимо соблюдать условие: Сm
< ПДК.
Метод достижения ПДК с помощью «высоких труб» служит лишь паллиативом, так как не предохраняет атмосферу, а лишь переносит загрязнения из одного района в другие.
В соответствии с характером вредных примесей различают методы очистки газов от аэрозолей и от газообразных и парообразных примесей. Все способы очистки газов определяются в первую очередь физико-химическими свойствами примесей, их агрегатным состоянием, дисперсностью, химическим составом и др. Разнообразие вредных примесей в промышленных газовых выбросах приводит к большому разнообразию методов очистки, применяемых реакторов и химических реагентов.
2. Очистка газов от
SOx
2.1 Процесс с использованием
CuO
/
CuS
04
В настоящее время существует несколько методов очистки топочных дымов от оксидов серы с использованием химических превращений. Все методы предполагают предварительную стадию адсорбции SO2
, тем не менее обсуждаются в данной главе, поскольку их основу составляет химическое превращение оксидов серы в новое химическое соединение, выделяемое из газового потока.
2.2 Катализаторы
Метод обеспечивает одновременную очистку газов от NOX
и SOX
в присутствии катализатора - оксида меди (CuO), нанесенного на оксид алюминия. Топочный газ подается в реактор с параллельным расположением каналов для прохождения газового потока, заполненных катализатором. Процесс с учетом последовательности операций может быть представлен брутто-уравнениями.
Поглощение оксидов:
CuO + ½O2
+ SO2
-* CuSO4
;
2NO + 2NH4
+ ½ O2
→2N2
+3H2
O
Регенерация:
CuS04
+ 2H2
→ Cu + SO2
+2H2
0;
Cu+½O2
→ CuO
Топочный газ при 390 °C подается в один из реакторов где оксид серы взаимодействует с CuO с образованием сульфата меди (CuSO4
). Сульфат меди и в меньшей степени оксид катализаторами процесса восстановления оксидов азота аммиаком. После насыщения реактора CuSO4
топочный газ переключается на новый реактор, в то время как отработанный подвергается регенерации. Молекулярный (Н2
) восстанавливает сульфат меди до меди, при этом из реактора поток содержит достаточное количество SО2.
Для получения серной или сернистой кислоты. После окисления в оксид меди (CuO) реактор снова готов к поглощению оксидов из потока. В промежутке между стадиями поглощения и генерации реактор продувается паром до полной отдувки топочного газа или водорода во избежание взрыва. Установка может пользоваться также только для выделения оксидов азота (при этом опускается стадия регенерации) или предназначаться для деления SOX
(при этом в газовый поток не вводится аммиак). В настоящее время в США создается проект городской котельной с одновременным 90 %-ным удалением оксидов азота и серы указанным способом.
2.3 Угольное топливо с добавками извести
В связи с необходимостью перевода топочных устройств на угольное топливо возникла потребность в разработке новых методов сжигания, обеспечивающих чистоту выбросов в атмосферу в соответствии с экологическими требованиями. Для уменьшения содержания SO2
разработаны два способа с применением извести: приготовление гранул из угольной крошки с добавкой извести для использования в колосниковых топках и добавление порошкообразной извести к угольной пыли для использования в топках с форсуночным распылением топлива. Проблема уменьшения количества оксидов серы в топочных газах должна решаться параллельно со снижением в них содержания NO. Лабораторные опыты показывают, что меры по снижению концентрации оксидов азота в отходящем дыме (повышенное время пребывания топочного дыма в зоне сгорания и снижение максимальной температуры пламени) также приводят к снижению концентрации SO2
при введении извести. Реакция связывания SO2
описывается брутто-уравнением
CaS03
+½O2
+ S02
→ CaS04
+ C02
.
Использование гранул с добавкой извести при отношении Ca : S = 3 : 5 уменьшает концентрацию оксидов серы на 70 % в лабораторных опытах и на 50 % при сжигании в колосниковых с небольшой мощности. Эти показатели несколько ниже, для традиционной очистки газов от SO2
методом промывки, однако если учесть простоту и широкое распространение угольных. топок, то этот метод имеет значительные перспективы. Дальнейшее развитие метода предполагает усовершенствование процесса приготовления гранул, повышение их механической прочности а также детальное изучение процесса их сгорания.
Хорошие результаты получены при добавках извести ной пыли в топках форсуночного типа. Данные, на пилотной установке, показали снижение на 80 % оксидов серы в топочном дыме при отношении Са : S = 3• 1. Высокий эффект обусловлен повышенной подачей топлива по отношению к воздуху и снижением максимальной температуры пламени, что одновременно обеспечило хороший показатель по содержанию оксидов азота в отходящем потоке.
Для двух приведенных методов введения в топку извести требуется получение более полной информации в следующих областях: эффективность связывания оксидов серы в зависимости типа угля, типа известковой добавки и ее количества; конструкциятопки и условия эксплуатации; вопросы шлакообразований засорение топки и забивка дымоходов, сбор твердых отходов и и утилизация. Перспективность этого метода во многом определяет его эффективностью при большей простоте и меньших капиталовложениях по сравнению с традиционной промывкой топочного газа в скрубберах.
2.4 Введение сухого сорбента
Сухой сорбент вводят методом, аналогичным изложенному в предыдущем разделе, при этом концентрацию SO2
в топочном газе можно снизить на 50 %. Сухой щелочной агент вдувается под давлением в магистраль отходящего топочного дыма и прореагировавшие твердые продукты отделяются от потока. Для отделения используют тканевые фильтры. Подбором сорбентов установлено, что натриевые соли гораздо эффективнее кальциевых соединений. Реакция с оксидами серы описывается уравнениями:
2NaHC03
+ S02
→ Na2
SO3
+ 2СО2
+ Н2
О;
Na2
C03
+ S02
→ Na2
S03
+ CO2
.
В качестве сорбента удобно использовать нахколит приpодный -минерал Na2
CO3
*NaHCO3
*2H2
O, который доступен, недорог хорошей реакционной способностью. Реакция протекает с достаточной скоростью при температурах 110 - 150°С; повышение температуры приводит к увеличению степени использования сорбента и снижает содержание SO2
в газовом потоке
Потенциально метод можно использовать во многих сжигающих устройствах, но в данное время опыт накоплен применительно к котельным небольшой мощности. Преимущества метода:
1) возможность практического использования;
2) низкие капиталовложения по сравнению с устройствами для обессеривания отходящих газов путем промывки;
3) более высокая производительность;
4) простота удаления отходов.
Основные недостатки:
1) более низкая степень удаления SO2
из газового потока по равнению с методом промывки в скрубберах;
2) нет данных об эффективности при использовании в топках высокой мощности;
3) твердые отходы вместе с золой растворимы в воде и при хранении представляют опасность с точки зрения загрязнения грунтовых вод.
Еще один метод удаления SO2
основан на реакции SO2
с известью/карбонатом натрия, однако здесь этот метод не рассматривается, поскольку, как и при промывании раствором извести или известняка, основным процессом является абсорбция, а не химическая реакция.
Литература
1. Родионов А.И. и др. Техника защиты окружающей среды. Учебник для вузов. - М.: Химия, 1989. - 512 с.
2. Защита атмосферы от промышленных загрязнений. Справочник в 2-х частях. Под ред. С. Калверта. - М.: Металлургия. - 1988. - 760 с.
3. Кузнецов И.Е., Троицкая Т.М. Защита воздушного бассейна от загрязнений вредными веществами химических предприятий. М.: Химия, 1979. 344 с.
4. Беспамятнов Г.П., Кротов Ю.А. Предельно допустимые концентрации химических веществ в окружающей среде. Справочник. Л.: Химия, 1985. 528 с.
|