Влияние микроконцентраций гербицида «Раундап» на развитие проростков озимого тритикале в лабораторном эксперименте
Введение
Использование пестицидов – практически обязательный элемент технологии возделывания основных сельскохозяйственных культур. Однако высокое насыщение их химическими средствами, характеризующимися различной персистентностью, метаболизмом в почвах и вегетирующих растениях, заметно сказывается на физиолого-биохимических процессах роста и развития возделываемых культур, качестве урожая, состоянии наземных и подземных вод, плодородии почвы. В тоже время оценка и выбор оптимального сочетания химических препаратов при их комплексном применении часто ограничены основным критерием – получаемой прибавкой урожая. Учитывая многообразие прямого воздействия и последействия различных средств химизации и их сочетание на отмеченные процессы, следует подчеркнуть, что комплексное применение химических, агрохимических, биохимических, биологических, токсикологических методов исследований в настоящее время становится насущной необходимостью.
Актуальность работы. В последние годы вопросу защиты окружающей среды от различных загрязнений уделяется серьезное внимание и на исследования в этой области затрачиваются большие средства, что вполне понятно, так как состояние окружающей среды определяет будущее человечества, в том числе здоровье и продолжительность жизни и активной деятельности человека. В связи с этим современные пестициды, прежде чем они будут допущены до практического использования, проходят очень тщательное изучение их поведения в окружающей среде и разрабатываются рекомендации по их безопасному использованию.
Систематическое применение ядохимикатов приводит к их аккумуляции в почве и, как следствие, к поступлению данных ксенобиотиков в продукцию растениеводства. В этих условиях необходим систематический контроль за содержанием остаточных количеств пестицидов в почве, а так же за их влиянием на развитие сельскохозяйственных растений.
Цель работы. Изучение влияния микроконцентраций гербицида «Раундап» на развитие проростков озимого тритикале в лабораторном эксперименте и на содержание в них хлорофилла.
Практическая значимость. Полученные в результате исследований данные могут быть использованы для оценки экологического риска от использования гербицида «Раундап».
Новизна полученных результатов. Был выявлен как стимулирующий, так и ингибирующий эффект различных концентраций изучаемого гербицида. Установлено, что для проростков озимого тритикале оптимальным параметром оценки воздействия данного гербицида является относительный прирост длины и вегетативной массы проростков.
пестицид растение раундап тритикале
1. Обзор литературы
1.1 Пестициды в интегрированной системе защиты растений
Возрастающие масштабы производства и потребления пестицидов, ставили вопросы о возможности загрязнения ими окружающей среды и о возникновении отдельных последствий, опасных для человека и полезных организмов. Такое положение привело к повышению требований к препаратам, рекомендуемым для широкого применения, а также к изучению условий их практического использования. Детальное изучение условий практического использования пестицидов привело к созданию, так называемой, «интегрированной» системы защиты растений [1–4], в которой учитываются экологические особенности вредных и полезных организмов. Химические препараты применяются с таким расчётом, чтобы сохранить полезные организмы, эффективно сочетать использование химических препаратов с биологической защитой растений, при этом учитывается экономическая эффективность того или иного метода защиты растений в конкретных условиях [5].
Интегрированная защита растений включает в себя агротехнические, биологические, биотехнические и химические методы. Интегрированная система защиты растений обычно разрабатывается не только для каждой культуры и для каждого региона, но и для каждого района применения препарата, так как в зависимости от микроклимата могут сильно изменяться и экологические условия. Большое значение для успешного применения химических средств защиты растений в интегрированной системе имеет хорошая организация краткосрочного прогнозирования и сигнализации.
Агротехнический метод борьбы основан на использовании организационно-хозяйственных и агротехнических мероприятий и направлен, с одной стороны, на усиление развития растений, что способствует повышению устойчивости их к повреждениям, с другой стороны, на снижение численности вредителей, болезней, сорняков путем создания неблагоприятных условий для их развития [6,7].
Из агротехнических приемов борьбы с вредными организмами наиболее эффективны обработка почвы, подготовка посевного и посадочного материала, удобрения и подкормка, сроки сева, система ухода за растениями, сроки и способы уборки.
Организационно-хозяйственные мероприятия включают в себя освоение целинных и залежных земель, орошение и обводнение полей, севообороты и размещение в них сельскохозяйственных культур, внедрение устойчивых сортов.
Биологический метод борьбы основан на использовании живых организмов или продуктов их жизнедеятельности для предотвращения или уменьшения вреда, причиняемого вредными организмами. Основным направлением данного метода является использование для защиты растений их естественных врагов – хищников, паразитов, гербифагов [8].
К числу наиболее прогрессивных методов борьбы с вредными насекомыми относится генетический метод, основанный на изменении функций размножения мутантов, так называемых «генетических уродов». Суть его – в пополнении природной популяции особями того же вида, полученными в искусственных условиях, но с измененными генетическими свойствами. Скрещивание указанных особей с нормальными насекомыми приводит к резкому сокращению потомства [9–11].
Возделывание устойчивых сортов в значительной степени снижает затраты на защиту их от вредителей и болезней. Устойчивость растений – это способность его противостоять вредному организму.
Устойчивые к вредным организмам сорта отличаются между собой анатомо-морфологическим строением, биологическими особенностями, способностью к защитной реакции, которая возникает в результате внедрения фитопатогена и направлена на его ограничение или подавление.
В борьбе с болезнями, вредителями и сорняками химические средства защиты растений – пестициды – играют особую роль. Пестициды – это химические вещества, используемые для борьбы с вредными организмами, повреждающими растения и вызывающими порчу сельскохозяйственной продукции. Они не могут заменить агротехнических и биологических мер борьбы, но в комплексе с ними достигают высокого эффекта. Применение пестицидов обеспечивает условия для механизации процессов ухода за растениями, облегчает проведение уборки урожая, позволяет избавиться от таких трудоемких операций, как ручная прополка [12].
Пестициды применяются путем опрыскивания, опыливания, протравливания семенного и посадочного материала, фумигации, аэрозолей, химической иммунизации, отравленных приманок.
Опрыскивание – это способ нанесения раствора пестицида (эмульсии или суспензии) в капельно-жидком состоянии на обрабатываемую поверхность для защиты растений от вредителей и возбудителей болезней, сорняков. Оно производится опрыскивателями – ручными, тракторными, авиационными.
Преимуществами опрыскивания перед другими способами являются равномерное распределение и хорошая удерживаемость на обрабатываемой поверхности, более высокая эффективность по сравнению с опыливанием, меньшая зависимость от метеорологических условий, возможность применения комбинированных пестицидов. Недостатки опрыскивания: сложность приготовления рабочих составов, большой расход жидкости.
Опыливание – это нанесение пестицида в пылевидном состоянии на обрабатываемую поверхность с помощью опыливателей. Опыливание проводится порошковидными препаратами (дустами). При опыливании на 1 га расходуется 10–30 кг дуста. Достоинством опыливания является то, что не нужно перед работой готовить специальных составов. Густые посевы и посадки хорошо пропыливаются. К недостаткам можно отнести: запыливание воздуха рабочей зоны; большой расход препарата по сравнению с опрыскиванием; снос препарата ветром на другие участки; слабую удерживаемость дуста на обрабатываемой поверхности [13,14].
Протравливание – способ нанесения пестицида на семенной материал для уничтожения наружной или внутренней инфекции растительного или животного происхождения. Различают полусухое с увлажнением и мокрое протравливание.
Полусухое протравливание – способ обработки семенного материала водной суспензией или раствором пестицида из расчета 20–30 л на 1 т с последующим томлением. Протравливание с увлажнением также считается полусухим способом протравливания водной суспензией (8–10 л на 1 т без последующей сушки). Для повышения качества протравливания добавляют прилипатели: сульфитно-спиртовую барду (0,7–1 кг/т), силикатный клей (150–200 г./т).
Мокрое протравливание проводят путем погружения семенного материала в раствор пестицида с последующим томлением во влажном состоянии в течение 3–4 ч в кучах под прикрытием брезента, а затем высушивают до нормальной влажности.
Выбор способа протравливания зависит от состава протравителей, биологии возбудителей заболеваний, степени зараженности семян, от обрабатываемой культуры и других условий.
Фумигация осуществляется путем введения пестицида в парообразном или газообразном состоянии в среду обитания вредного организма. Этот способ широко применяется в защитном грунте, для фумигации помещений (складов, элеваторов, зернохранилищ). Достоинство его в том, что пестицид хорошо проникает в пористые материалы, мельчайшие щели, где могут обитать вредные организмы. К недостаткам можно отнести: высокую токсичность для теплокровных животных и человека; способность воспламеняться или взрываться при определенной концентрации паров воздуха.
Введение пестицидов в высокодиспергированном твердом (аэрозоль) или жидком (дым, туман) состоянии в среду обитания вредного организма находит широкое применение в борьбе с вредителями садов, для дезинфекции теплиц, парников, складов и других объектов. Достоинство метода заключается в высокой его эффективности. К недостаткам аэрозолей относятся: слабое оседание мельчайших аэрозольных частиц; недостаточное проникновение частиц в пористые материалы и щели; сильное влияние метеорологических условий [15].
Химическая иммунизация предполагает использование пестицида, создающего неблагоприятные условия для развития в растениях паразитов и положительно влияющего на урожай, как в год применения пестицида, так и в репродукции.
Отравленная приманка – способ применения пестицида вместе с приманочным кормом или материалом для приманочного укрытия. Обычно используют зерно, жмыхи, отруби, мякину и другие приманки, которые хорошо поедаются грызунами.
Для каждой отдельной сельскохозяйственной культуры химические обработки проводят с учетом фенологии вредного объекта и совпадения сроков его самой агрессивной фазы со сроками наиболее чувствительной к повреждениям фазы развития растений, а также с учетом предупреждений, передаваемых службами прогнозов [16].
В интегрированной защите растений в XXI столетии наиболее перспективными остаются разработки, связанные с поиском и использованием гербицидов с новым механизмом действия: влияющие на биосинтез хлорофилла, каратиноидов, витаминов, кофакторов ферментов. Требованиями к ним являются слабая подвижность в окружающей среде, разрушаемость до нетоксичных остатков, безопасность для нецелевых объектов, организмов. Важным пунктом является экономический порог вредности, т.е. такой уровень заселенности вредителями, при котором стоимость убытков при недоборе урожая в отсутствии обработки выше, чем стоимость обработки. Этот подход в результате приводит к сокращению числа обработок по сравнению с прежней практикой «слепого», так называемого «календарного» опрыскивания [17–20].
Концепция ужесточения экологических требований безопасности к регистрируемым пестицидам, комплексной оценки коммулятивного действия и десятикратного фактора безопасности зарегистрированных препаратов более точных методов оценки побочных эффектов. Это тем более важно, что могут использоваться пестициды, утратившие срок патента, но по биологическим, экономическим параметрам отвечающие новым требованиям. Неблагоприятная ситуация складывается с разработкой ассортимента средств защиты растений для культур с небольшими площадями, так как фирмы не заинтересованы нести большие затраты на создание и регистрацию пестицидов, которые заведомо не будут окупаться при небольшом спросе и объемах продаж препаратов. Количество экспериментальных данных по вопросам эффективности и возможностях проявления нежелательных побочных эффектов недостаточно для регистрируемых пестицидов таких культур [21–23].
1.2 Влияние гербицидов на растения
В основе механизма действия гербицидов лежит их многостороннее влияние на рост и развитие целого растения, отдельных его органов, тканей и клеток, на клеточные структуры, органеллы клетки, физиологические и биохимические процессы, ферментативные реакции и белково-ферментные структуры.
Лишь комплексная оценка этих влияний позволяет выявить общий механизм действия гербицидов на растение. Первичное место действия гербицидов определяется его взаимодействием с чувствительными системами растения на молекулярном уровне.
Так как до настоящего времени еще не раскрыта молекулярная природа многих процессов жизнедеятельности, происходящих в растениях, то возникают трудности и с определением первичного механизма действия гербицидов.
Механизм действия гербицидов тесно связан с характером и поведением вещества-токсиканта в растении, с поглощением и перемещением его по растению и с непосредственным влиянием на жизненно важные процессы: основной, промежуточный и вторичный метаболизмы.
Действие гербицидов на основной метаболизм проявляется в нарушении процессов образования органических соединений в ходе фотосинтеза, процессов генерирования высокоэнергетических химических связей при дыхании и окислительном фосфорилировании, в ингибировании синтеза основных клеточных полимеров – белков, нуклеиновых кислот, крахмала и клетчатки. В результате действия гербицидов на промежуточный метаболизм нарушаются процессы распада и образования низкомолекулярных органических соединений, необходимых для нового синтеза; действие на вторичный метаболизм выражается в нарушении синтеза различных специфических компонентов растительных клеток типа алкалоидов, пектина, кумаринов, антоциана, фитогормонов, танинов [24].
Гербициды могут влиять на рост растений. Однако практический интерес представляют соединения, действующие на процессы основного и вторичного метаболизмов. Такие гербициды нетоксичны для теплокровных животных и человека. Более опасны и менее избирательны гербициды, нарушающие промежуточный метаболизм в растительных тканях, который в значительной степени сходен для всех живых клеток, содержащих ядра.
Механизм действия контактных гербицидов сводится к нарушению целостности клеточных мембран, увеличению их проницаемости и разрушению, ведущему к потере содержимого клеток и их отмиранию. В силу такого действия гербициды слабо или практически не перемещаются по флоэме. Однако они могут перемещаться с транспирационным током по клеткам ксилемы.
Системные гербициды действуют на один или несколько физиологических и (или) метаболических процессов в растении. Они вызывают гибель растения через несколько дней или недель после поглощения гербицида, то есть проявляют хроническое токсическое действие, в отличие от быстродействующих контактных гербицидов. Многие гербициды проявляют одновременно и контактное, и системное действия.
По характеру перемещения по растению гербициды делятся на перемещающиеся преимущественно с транспирационным током по ксилеме или с продуктами фотосинтеза по флоэме. Системные гербициды свободно перемещаются от клетки к клетке через плазмодесмы, проникая через мембраны и аккумулируясь в местах действия в токсичных количествах, не повреждая при своем движении живых, жизненно важных систем [25].
Устойчивость растений к гербицидам определяется совокупностью морфологических, физиологических и биохимических факторов, от которых зависит соотношение количеств попавшего на растение, поглощенного и разрушенного токсиканта. Если скорость детоксикации гербицида равна скорости его поступления в места действия, растение проявляет устойчивость.
Поступившие в растения и достигшие мест действия гербициды могут оказывать разностороннее влияние на важные процессы жизнедеятельности: деление клеток, развитие тканей, образование хлорофилла или пластид, фотосинтез и дыхание.
Гербициды, нарушающие процесс деления клеток (например, производные карбаматов и дитиокарбаматов), рассматриваются как митотические яды. Они прерывают нормальный процесс деления клеток (митоз) в период между метафазой и анафазой, препятствуют образованию перегородок в делящихся клетках, формирующихся после телафазы, что приводит к возникновению ненормальных многоядерных клеток [26].
Проводили сравнительные цитогенетические исследования количественных и качественных закономерностей действия гербицидов трефлан (2,6 – динитро-4 – (трифторметил) – N, N-дипропиланилин) и зенкор (4-амино-6-трет-бутил-3-метилтио – 1,2,4 – триазинон-5).
Выявлена цитогенетическая активность трефлана (рисунок 1): частота перестроек в опыте, где концентрация гербицида составляла 1 мг/л, была выше, чем в контроле более чем в 68 раз (32,37 и 0,47% соответственно).

Рисунок 1 – Влияние гербицидного препарата трефлан на частоту хромосомных аберраций и величину митотического индекса у Hordeum vulgare L. сорт «Визит»
Большинство изменений представляли собой различные типы нарушений ахроматинового веретена: наблюдалось полное его разрушение, разрыв части его нитей и многополюсность, вызывающие образование полиплоидных и полиядерных клеток, в том числе клеток с микроядрами, иными словами, клеток с нерегулярным числом хромосом.
В результате изучения действия зенкора на меристематические клетки ячменя установлено, что препарат негативно влияет на процесс образования клеточной перегородки при митозе. Наблюдали двуядерные интерфазные клетки, иногда в центре таких клеток имелась незавершенная межклеточная перегородка. В анафазе регистрировали нарушения расхождения хромосом: отставания хромосом, неравномерное расхождение хромосом к полюсам, многополюсность (рисунок 2). Зенкор также негативно влиял на пролиферативную активность клеток. Показатель митотического индекса для концентраций 250, 500, и 750 мг/л был достоверно ниже, чем в контроле.
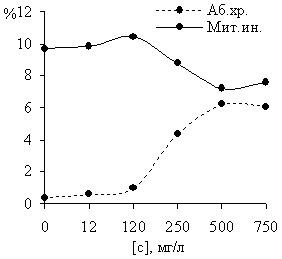
Рисунок 2 – Влияние гербицидного препарата зенкор на частоту хромосомных аберраций и величину митотического индекса у Hordeum vulgare L. Сорт «Гонар»
Гербициды типа регуляторов роста – арилоксиалканкарбоновые кислоты и их производные – нарушают рост и развитие клеток ксилемы и флоэмы, вызывая их деформацию.
Наиболее безопасными для человека и животных являются препараты, влияющие на структуры и процессы, свойственные растительным организмам и отсутствующие у теплокровных. Это прежде всего гербициды, воздействующие на процесс преобразования солнечной энергии в химическую – фотосинтез. Группа ингибиторов фотосинтеза многочисленна и включает половину препаратов, известных в настоящее время. Среди них соединения нарушающие биосинтез хлорофилла и других фотосинтетических пигментов. Фомезафен, например, ингибирует синтез каратиноидов на этапе фитоина.
К этой же группе относятся вещества, подавляющие сам процесс фотосинтеза на различных его этапах. При воздействии гербицида на фотосинтез на световой стадии I нарушается процесс восстановления метаболита Х, обладающего минимальным потенциалом, и окисления метаболита Р700, обладающего промежуточным потенциалом; действие на световой стадии II сказывается на процессе восстановления метаболита Y и одновременно протекающем процессе фотолиза воды и выделения кислорода.
Производные 4,4 – дипиридила, попав в растение, становятся посредниками при переносе электрона на световой стадии I, нарушают ее ход и «обесценивают» солнечную энергию, поглощаемую растением. Электронно-транспортная система при этом не блокируется, как в случае других гербицидов, подавляющих фотосинтез.
Большинство гербицидов – ингибиторов фотосинтеза – действуют на световую реакцию II, прерывая поток электронов к хлорофиллу и подавляя процесс фотолиза воды (реакция Хилла). Так проявляют себя нитрофенолы, производные карбаминовой кислоты, анилиды, гидроксибензонитрилы, производные мочевины, производные 1,2,5 – триазина, 1,2,4 – триазина, производные пиримидина, бензимидазолы, пиридазиноны, производные фурана (этофумезат) и производные тиадиазолов (бентазон) [28].
Перспективными являются гербициды, влияющие на синтез органических азотсодержащих веществ, в частности аминокислот в тканях растений. Сульфонилмочевины нарушают биосинтез валина и изолейцина, воздействуя на фермент ацетолактатсинтазу, катализирующую первый этап этого процесса. Аналогично действуют гербициды новой группы имидазолинонов (арсенал, АС 243997). Биосинтез ароматических аминокислот ингибирует раундап, гистидина – амитрол, глютамина – баста (фосфинотрицин).
Отсутствуют гербициды со специфичным действием на процесс дыхания растений. Некоторые препараты могут подавлять перенос электронов, блокируя отдельные этапы фосфорилирования, другие – разобщать фосфорилирование путем разрыва (гидролиза) высокоэнергетических молекул веществ, участвующих в переносе энергии, что приводит к непроизводительному расходованию энергии, освобождающейся при дыхании.
Ряд гербицидов изменяет активность клеточных ферментов, действуя на них прямо или косвенно. В первом случае молекулы гербицида взаимодействуют с веществами клеточных ядер, конкурируют с субстратом за активные места на молекулах ферментов, образуют комплексные соединения с ферментами или с их субстратами, что в одних условиях подавляет, а в других – стимулирует активность ферментов. Гербицид может конкурировать с кофакторами ферментативных белков: изменять состояние белкового кофактора и предотвращать активную связь кофактора с протеиновой частью фермента.
Косвенное действие гербицида на ферменты проявляется в торможении поступления в клетки энергии, необходимой для реакций образования АТФ, а также исходных материалов для синтеза коферментов и простетических групп, в изменении условий протекания ферментативных реакций [26].
1.3 Краткая характеристика и механизм действия глифосата (раундапа)
Глифосат является пестицидом широкого спектра действия, активно применяемым для уничтожения нежелательных растений, как в сельском хозяйстве, так и в несельскохозяйственных ландшафтах. Большинство продуктов, содержащих глифосат, либо изготовляется, либо используется вместе с поверхностно-активным веществом, помогающим глифосату проникнуть в клетки растений. Поверхностно-активное вещество, используемое в распространенном продукте на базе глифосата (известном под названием «Раундап»), более токсично, чем сам глифосат, а комбинация этих двух веществ еще более токсична [29].
Гербициды на базе глифосата, предлагаемые производителями как «мало токсичные и дружественные к окружающей среде», могут казаться панацеей при борьбе с нежелательными растениями. Между тем, продукты, содержащие глифосат, обладают острой токсичностью для животных, включая человека. Симптомы: раздражение глаз и кожи, головная боль, тошнота, оцепенение, повышенное кровяное давление и учащенное сердцебиение. Наблюдения за людьми (в основном фермерами), имеющими контакт с глифосатом, показали, что такой контакт ассоциируется с увеличением риска выкидышей, преждевременными родами и раковой лимфомой.
Препарат впервые был зарегистрирован в США в 1974 году и применяется для борьбы с сорняками в широком спектре сельскохозяйственных, городских, садово-парковых, водных и лесных ситуаций. Большинство гербицидов содержит изопропиламиновую соль глифосата [30].
Глифосат занимает место среди наиболее распространенных пестицидов в сельском хозяйстве. Наибольшее использование его отмечено при производстве соевых бобов, кукурузы, сена, на пастбищах и на землях под паром. Применение глифосата в настоящее время увеличивается, в основном вследствие недавней разработки с помощью генной инженерии и интродукции растений, толерантных к гербициду.
Глифосат, N – (фосфонометил) – глицин (рисунок 3) является неизбирательным гербицидом, действующим на весь организм, который используется для уничтожения широколиственных, травянистых и осоковых видов растений [31].
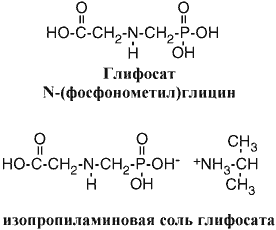
Рисунок 3 – Структурная формула глифосата
Глифосат хорошо поглощается надземными органами растений и передвигается в глубоко залегающие корни. К нему чувствительны однолетние и многолетние однодольные и двудольные растения, в том числе такие корневищные и корнеотпрысковые, как пырей, свинорой, гумай, острец, осот желтый, бодяк полевой, марь белая и другие. Передвигается глифосат с места нанесения медленно (7–10 дней), но на большие расстояния (на глубину до 2 м) и вызывает гибель корневищ в радиусе 30 см. Многолетние сорняки подавляются в течение всего вегетационного периода, однолетние – до повторного отрастания новых. Визуально наблюдаемый эффект проявляется на однолетних растениях через 2–4 дня, на многолетних – через 7–10 дней, а полная гибель сорняков наступает через 20 дней и более после применения препарата. Прохладная и облачная погода замедляет проявление фитотоксичности гербицида, а осадки, выпавшие менее чем через 2 часа после опрыскивания, могут снизить эффективность обработки.
Сорные растения сначала приобретают светло-зеленую окраску, затем желтеют, обесцвечиваются, теряют тургор, засыхают и через 14–20 дней погибают [16].
Механизм действия глифосата по данным EPA в настоящее время досконально не изучен. Но благодаря исследованиям установлено, что глифосат ингибирует ферментный путь с участием шихимовой кислоты, не позволяя растениям синтезировать три ароматических аминокислоты (триптофан, тирозин, фенилаланин). Ароматические аминокислоты выполняют важную роль в клеточном метаболизме. Они входят в состав белков и служат исходными соединениями для метаболизма фенилпропаноидов – «массовой продукции», образующейся в процессе роста растения. В их состав входят пигменты и полимер клеточных стенок – лигнин. Ключевой фермент, ингибируемый глифосатом, называется EPSP синтаза (5-енолпирувилшикимат-3-фосфатсинтаза).
Глифосат может оказывать воздействие на ферменты растения не связанные с участием шихимовой кислоты. У сахарного тростника он снижает активность фермента, участвующего в метаболизме сахара. Он также ингибирует главный детоксифицирующий фермент растений [31].
Фактически каждый пестицид, кроме так называемого «активного» вещества, предназначенного для уничтожения растений, содержит также другие ингредиенты. Эти ингредиенты неточно называют «инертными». «Инертные» составляющие предназначены для облегчения использования продукта и увеличения его эффективности. Как правило, эти составляющие не указываются на этикетках пестицидных продуктов.
Глифосат является представителем органофосфонатов с активированной прямой С-Р связью и составляет основу многих гербицидов. Их отличает высокая токсичность и устойчивость к разложению. C-P связь органофосфонатов трудно гидролизуема химическим путем, но может быть разорвана с помощью особых ферментных систем микроорганизмов-деструкторов. Высвобождающийся фосфор используется микроорганизмами в качестве единственного источника этого компонента в процессах биосинтеза и энергетического обмена [32].
Стойкость глифосата в почве изменяется в широких пределах, и нет однозначного ответа на вопрос, сколько времени глифосат остается в почве. Периоды полураспада (время, необходимое для распада или уноса половины исходного количества глифосата), определенные производителем глифосата, составили от 3 до 141 дня [33].
Считается, что глифосат образует прочные комплексы с большинством почв, и поэтому он исключительно иммобилен. Это означает, что маловероятно заражение глифосатом воды и почвы вне участка его применения. Однако эта связь с почвой является обратимой. Например, некоторые исследования показали, что глифосат легко связывается с разными видами почв. Однако десорбция, когда глифосат отсоединяется от частиц почвы, происходит также легко.
Глифосат был обнаружен как в поверхностных, так и в грунтовых водах. Стойкость глифосата в воде ниже, чем в почве [34].
Глифосат может нанести ущерб многим организмам, не являющимся мишенью для пестицида. Имеются также и другие серьезные эффекты, такие, как влияние на редкие виды растений, ухудшение качества семян, снижение способности фиксировать азот, увеличение подверженности растений болезням и уменьшение активности микоризных грибов [35].
Качество семян. Cублетальная обработка хлопка «Раундапом» сильно ухудшает всхожесть семян и развитие рассады в полевых условиях. При наименьших проверенных концентрациях глифосата всхожесть семян уменьшилась в пределах от 24 до 85%, а вес рассады – от 19 до 83% [36].
Фиксация азота. Большинство живых существ не способно усваивать азот в чистом виде и получают его в виде аммиака и нитратов. Аммиак и нитраты образуются в результате процессов, которые называются фиксацией азота и нитрификацией. Эти процессы осуществляются бактериями, живущими в почве и в клубеньках на корнях бобовых и некоторых других растений.
При концентрациях, соответствующих типичным дозировкам применения, глифосат снижает на 70% число азотфиксирующих клубеньков у клевера, посаженного через 120 дней после обработки; аналогичная концентрация гербицида с глифосатом снижает на 27% число клубеньков у клевера, выращиваемого на гидропонике. Сходная концентрация глифосата уменьшает на 20% процесс фиксации азота бактериями в почве. Обработка гербицидом с глифосатом при самой низкой проверенной концентрации (в 10 раз меньшей, чем при типичной дозировке его применения) уменьшает число клубеньков у клевера на 68–95%.
Микоризные грибы – это полезные грибы, живущие на корнях и вокруг корней растений. Они помогают растениям усваивать питательные вещества и влагу из почвы и могут защитить их от холода и засухи. Обнаруживают токсичность «Раундапа» по отношению к микоризным грибам, ассоциированным с хвойными деревьями, при концентрациях от 1 части на миллион, что ниже концентраций в почве при типичных дозировках применения. У орхидных обработка глифосатом меняла полезное взаимодействие между орхидными и их микоризой на паразитическое взаимодействие (не приносящее пользы растениям) [37].
Болезни растений. Обработка глифосатом увеличивает подверженность культурных сельскохозяйственных растений ряду болезней. Например, глифосат увеличил заболевание корней и стеблей помидоров; снизил способность бобовых растений защищать себя от антракноза; увеличил распространение неспецифических гнилей в почве пшеничного поля и снизил пропорцию почвенных грибов – антогонистов гнилевых грибов; увеличил содержание в почве двух возбудителей болезней корней гороха. Кроме того, обработка соснового питомника ослабила защитную способность саженцев противостоять голубой гнили [38].
Для получения максимального эффекта от применения глифосатсодержащих гербицидов необходимо соблюдать следующие правила:
– перед проведением опрыскивания тщательно и быстро убрать всю солому с поля;
– в момент обработки сорные растения должны активно вегетировать, так как препараты попадают в них через листья и другие зеленые органы. Пырей должен иметь 3–4 активно ассимилирующих листа (высота 10–20 см), осоты – 4–5 листьев (диаметр розетки 10–20 см). После сильной засухи можно для стимулирования отрастания осотов и однолетних сорняков провести дискование стерни, дождаться появления свежих розеток и после этого применить гербицид. Для лучшего отрастания пырея механические обработки, напротив, нежелательны;
– оптимальная температура воздуха для воздействия препаратов составляет от 15 до 25С. Хотя они работают и при температуре 5С, однако их действие замедляется. Глифосат можно применять за 1–2 недели до наступления первых заморозков. Даже после заморозков гербициды действуют, хоть медленно, но не менее эффективно, если к моменту опрыскивания побурение вегетативной массы сорняков вследствие холодов составляет менее 25%;
– в засушливых условиях, при низком срезе полегших зерновых культур, для стимулирования отрастания многолетников желательно провести дискование стерни, а через 2–3 недели после него – опрыскивание по отросшим сорнякам;
– так как глифосат передвигается по всей корневой системе сорняков, полная их гибель (пожелтение и засыхание) происходит в течение 14 – 21 дня;
– осадки, выпавшие через 4–6 ч после обработки, снижают гербицидный эффект;
– оптимальный расход рабочей жидкости – не более 100–200 л/га;
– нормы внесения раундапа зависят от видового состава сорняков. Против пырея применяют 3–4 л/га, видов полыни – 5 л/га, осотов – 5–6 л/га;
– обработки почвы возможны уже через 5–7 дней после опрыскивания, но лучше – через 15–21 день, после полного отмирания сорняков [39].
Особенно важно использование данных гербицидов под зерновые, в том числе и озимые. Озимые часто располагаются по пласту многолетних трав. Использование глифосатов после отрастания первого укоса трав и сорняков обеспечивает их полную гибель, соответственно, упрощается разделка пласта трав и запашка, снижаются на 25–30% затраты на выполнение этих операций, отсутствует дальнейшая вегетация растений трав в посевах озимых или других культур.
При оценке экономической эффективности применения гербицидов – производных глифосата важно учитывать, что при вспашке и подготовке поля экономится до 30% топлива, снижаются и другие затраты. Данное мероприятие является наиболее экологически безопасным способом подавления многолетних сорняков, так как в момент химпрополки сельскохозяйственные культуры не вегетируют, удобно работать механизатору, используется небольшой объем рабочей жидкости, гарантируется отсутствие многолетних сорняков на 2–3 года. В среднем один рубль, вложенный в осенний период, например, в звене севооборота «озимая пшеница после многолетних трав», окупается через два года после применения 10, а через три года – 16 рублями/га прибыли. На зерновых прибавка урожая составляет не менее 5 ц/гa зерна, на льне – не менее 1–3 ц/га семян и 5–10 ц/га соломы, на люпине – 5 ц/га зерна [40].
1.4 Биологическая индикация
Общие закономерности поведения загрязнителей пестицидов в почве достаточно хорошо изучены. Вместе с тем, последствия комплексного воздействия поллютантов на биоценозы и фитопопуляцию в реально встречающихся концентрациях исследованы недостаточно. Остатки агрохимикатов в почве и растениях вступают в сложные взаимодействия различного характера, включая антагонизм, синергизм, аддитивность.
Для получения объективной картины загрязнения агроценоза необходимы исследования в двух направлениях. Во-первых, должны совершенствоваться методы инструментального химического анализа, во-вторых, целесообразно более широкое использование биоиндикаторов.
Применение организмов, реагирующих на загрязнение среды обитания изменением визуальных признаков, имеет ряд преимуществ. Оно позволяет существенно сократить или даже исключить применение дорогостоящих и трудоемких физико-химических методов анализа. Биоиндикаторы интегрируют биологически значимые эффекты загрязнения. Они позволяют определять скорость происходящих изменений, пути и места скопления в экосистемах различных токсикантов, делать выводы о степени опасности для человека и полезной биоты конкретных веществ или их сочетаний [41–45].
В зависимости от скорости проявления биоиндикаторных реакций выделяют несколько различных типов чувствительности тест-организмов:
I тип – биоиндикатор проявляет внезапную и сильную реакцию, продолжающуюся некоторое время, после чего перестает реагировать на загрязнитель;
II тип – биоиндикатор в течение длительного времени линейно реагирует на воздействие возрастающей концентрации загрязнителя;
III тип – после немедленной, сильной реакции у биоиндикатора наблюдается ее затухание, сначала резкое, затем постепенное;
IV тип – под влиянием загрязнителя реакция биоиндикатора постепенно становится все более интенсивной, однако достигнув максимума постепенно затухает;
V тип – реакция и типы неоднократно повторяются, возникает осцилляция биоиндикаторных параметров [46].
Для экотоксикологического картирования агроландшафта можно использовать биоиндикаторы, аккумулирующие загрязнители по безбарьерному типу, т.е. прямопропорционально их концентрации во внешней среде. Например, покровные ткани растений (кора) и животных (шерсть) представляются малоактивными индикаторами для этого метода. Листья, цветки и другие органы растений накапливают поллютанты по фонобарьерному типу. Подобные органы и ткани приемлемы для биотестирования загрязнения почв, вод и атмосферы.
При биоиндикации агроценоза необходимо учитывать и тератогенный эффект загрязнителей, т.е. способность вызывать у тест-организмов различные пороки развития. Последствия действия тератогенных загрязнителей различны: в одних случаях тератогенез может охватывать лишь клеточные органеллы, отдельные клетки, в других – затрагивает ткани, органы и весь организм. Поэтому следует учитывать подобные изменения с помощью известных тест-систем, а также отрабатывать новые методы биоиндикации тератогенного действия загрязнителей [47].
Биоиндикация, как инструмент для проведения экологического контроля за состоянием агроэкосистемы, может входить в систему экологического нормирования, методической основой которого является биотестирование. Поэтому система биотестирования должна быть достаточно гибкой, т.к. норма реакции для каждого агроценоза будет индивидуальной.
Специальные биотесты для определения загрязнения фитопопуляции солями тяжелых металлов, остатками пестицидов, микотоксинами и другими агентами сводятся к оценке степени изменения морфометрических, физиологических и биохимических показателей биоты. Подобные нарушения проявляются в изменении энергии прорастания, всхожести семян, размеров корней, в повреждении растений под воздействием загрязнителей.
Классическим тест-объектом на загрязнители является одноклеточная зеленая водоросль хлорелла (Chlorella vulgaris). Ее преимущества для экспресс-анализа загрязнения агроценоза заключаются в коротком жизненном цикле и возможности проводить оценку по таким показателям, как пигментное секторирование, нарушение споруляции клеток и летальность.
Другой метод оценки химических веществ, основанный на эффекте замедленной флюоресценции. Этот эффект проявляется у растений при наличии сформированного фотосинтетического аппарата. Гербициды (ингибиторы фотосинтеза) способны изменять интенсивность флюоресценции. Этим способом можно выявить наличие гербицидов ингибиторов реакций Хилла, однако в случае других пестицидов метод малоэффективен.
Существуют достаточно надежные способы количественной регистрации воздействия загрязнителей, например, плазмолиз. Для определения количества погибших клеток пользуются методом витального окрашивания. Живые клетки сильно ограничивают проникновение в протоплазму органических веществ, и, будучи помещенными в раствор ряда красителей, практически не окрашиваются. В мертвые клетки краска проникает свободно, благодаря чему наличие погибших клеток легко поддается учету.
Метод индукции флюоресценции хлорофилла позволил исследовать активность фотосинтетического аппарата у ряда растений при изменении внешних условий среды. Эта особенность хлорофилла была предложена в качестве индикаторного признака нарушений, вызванных воздействием поллютантов [48].
Лишайники являются надежными индикаторами загрязнения воздуха и традиционно используются для целей биоиндикации. Лихенодиагностика позволяет осуществлять картирование территории по степени загрязненности атмосферного воздуха. Однако возможности лихеноиндикации ограничены чувствительностью нативных видов, поскольку многие лишайники, аккумулируя загрязнитель из атмосферы при его хроническом воздействии, гибнут от низких концентраций, зачастую не достигающих установленнных для человека и теплокровных животных нормативов.
Для биотестирования отработано немало методов на различных культурах: белой горчице (Sinapis alba L.), озимой и яровой пшенице (Triticum aestivum L.), овсе (Avena L.), гречихе (Fagopyrum L.), огурце (Cucumis L.), кресс-салате (Lepidium sativum L.), сое (Glycine L.), льне (Linum L.), еже сборной (Dactylis glomerata L.).
На горчице учитывают степень ингибирования первичного корешка проростка после обработки семян противодвудольным гербицидом. Определяют также увядание растений, торможение прироста листьев надземной массы проростков.
Овес и рис используют как индикаторы почвенных противозлаковых гербицидов, так как это наиболее чувствительные виды среди злаковых культур. При этом основным тестом является ингибирование роста зародышевого корня и листа.
Редис является традиционным биотестом при исследовании остатков пестицидов в почве и конечной продукции растениеводства, т. к. обладает по сравнению с другими объектами наиболее высокой чувствительностью к фитотоксичным препаратам, что обусловлено высокой энергией прорастания его семян и скороспелостью культуры.
На огурце и гречихе тестируют гербициды – производные мочевины и фенилкарбаматы. При этом у огурца учитывают рост первичного корня, у гречихи – утолщение стебля, деформацию зародышевых листьев, а также торможение роста. Кресс-салат используется как тест-объект для оценки загрязнения воздуха и почвы. Тест длится 10 дней. При наличии вредных веществ снижается процент всхожести и ингибируется рост зародышевых корешков.
Видимо, успешное решение проблем биоиндикации во многом будет определяться подбором, а иногда и направленным созданием сортов (линий) культурных растений, чувствительных к загрязнению. К сожалению, в настоящее время подобные сорта и линии отсутствуют. Поэтому усилия исследователей должны быть направлены на поиск перспективных форм и работу с ними [44].
2. Объект, программа и методика исследований
Объектом исследований являлись проростки озимого тритикале сорта «Михась».
Выбор данного сорта в качестве объекта исследований был связан с тем, что данный сорт является стандартом, районированным по всей республике. Из 350–400 тыс. га посевных площадей отводимых ежегодно под озимое тритикале до 56% занято посевами этого сорта.
Предметом наших исследований являлось изучение влияния глифосатсодержащего гербицида «Раундап» на развитие проростков озимого тритикале и на содержание в них хлорофилла.
Выбор препарата «Раундап» для изучения его влияния на развитие проростков озимого тритикале, был основан на том, что согласно отраслевому регламенту возделывания озимого тритикале (ОР МСХП РБ 0215–2005) данный гербицид может применяться на полях, предназначенных под посев тритикале после уборки предшественника по вегетирующим многолетним сорнякам. Учитывая, что период полураспада глифосата составляет от 3 до 141 дня, нами была выдвинуто предположение о возможности влияния остаточных количеств данного гербицида на развитие проростков исследуемой культуры. На основании этого и была составлена программа исследований.
В программу исследований входили следующие вопросы:
– Изучение влияния исследуемого гербицида на лабораторную всхожесть семян.
– Изучение влияния раундапа на развитие проростков.
– Изучение влияния раундапа на содержание в вегетативной массе проростков хлорофилла.
– Изучение влияния глифосатсодержащего гербицида «Раундап» на развитие проростков озимого тритикале в динамике.
Методика исследований
Для проведения исследований были отобраны относительно одинаковые по размеру неповрежденные семена озимого тритикале. Масса 1000 семян составляла 49,5 грамм. Семена (по 100 шт.) помещались в пластиковые контейнеры-растильни размером 150х150х110 мм. На дне контейнера находился слой стерильной ваты толщиной 0,5 см покрытый сверху фильтровальной бумагой. В каждый контейнер было внесено по 70 мл водной вытяжки из почвы. В почвенные вытяжки вносили гербицид «Раундап» в следующих концентрациях по действующему веществу: 5,0; 12,5; 25,0; 37,5; 50,0; 100,0; 150,0; 200,0; 250,0; 300,0; 350,0; 400,0; 450,0; 500,0; 550,0; 600,0; 650,0; 700,0; 750,0; 800,0; 850,0; 900,0; 950,0; 1000,0 мкг/л.
Через 7 дней определяли лабораторную всхожесть семян. После определения всхожести ростки отделяли от корешков и зерновки и проводили их взвешивание на аналитических весах ВЛР-200. Далее производили измерение длины ростков, а затем их высушивали до воздушно-сухого состояния и повторно взвешивали.
Весовой коэффициент определяли как отношение суммарной сырой массы проростков к их суммарной длине (мг/мм).
Экстракцию хлорофилла проводили 96%-м этанолом. Для экстрагирования отбирали по 100 мг сухих проростков, измельчали их с кварцевым песком в присутствии карбоната кальция. Полученную массу количественно переносили в бюксу с 20 мл этилового спирта. Через 24 часа проводили вакуумную фильтрацию вытяжки, а затем доводили ее объем до 50 мл. Оптическую плотность спиртовой вытяжки хлорофилла определяли на спектрофотометре «Solar PV 1251C» при l = 649 и 665 нм. Количество хлорофилла рассчитывали по формулам:
CХл а = 13,70´D665 – 5,76´D649
CХл в = 25,80´D649 – 7,60´D665 [49].
Статистическая обработка результатов исследований проводилась при помощи табличного редактора Excel и пакета статистического анализа STATISTICA 6.0 с использованием практического руководства Ю.М. Жученко [50].
В эксперименте по изучению влияния раундапа на проростки озимого тритикале в динамике, нами использовались следующие концентрации гербицида в почвенной вытяжке: 0,05; 0,25 и 0,50 мг/л.
3. Результаты исследований и их обсуждение
3.1 Влияние микроконцентраций гербицида «Раундап» на всхожесть семян озимого тритикале
На первом этапе наших исследований (2006–2007 гг.) было установлено, что препарат гербицидной активности «Раундап» оказывает некоторое влияние на энергию прорастания и лабораторную всхожесть семян озимого тритикале, но нам не удалось установить закономерности в этом влиянии. Были проведены эксперименты, в которых увеличили число повторностей и использовали большее разнообразие концентраций пестицида.
Результаты наших исследований по влиянию гербицида «Раундап» на всхожесть семян озимого тритикале представлены в таблице 1.
Таблица 1 – Влияние гербицида «Раундап» на всхожесть семян озимого тритикале
| Концентрация гербицида в питательной среде, мкг/л |
Всхожесть |
| в процентах |
относительная (контроль 100%) |
| 1 |
2 |
3 |
| Контроль (без гербицида) |
95 |
100,0 |
| 5,0 |
92 |
96,8 |
| 12,5 |
90 |
94,7 |
| 25,0 |
94 |
98,9 |
| 37,5 |
90 |
94,7 |
| 50,0 |
92 |
96,8 |
| 100,0 |
90 |
94,7 |
| 150,0 |
88 |
92,6 |
| 200,0 |
87 |
91,6 |
| 250,0 |
88 |
92,6 |
| 300,0 |
88 |
92,6 |
| 350,0 |
90 |
94,7 |
| 400,0 |
90 |
94,7 |
| 450,0 |
93 |
97,9 |
| 500,0 |
87 |
91,6 |
| 550,0 |
91 |
95,8 |
| 600,0 |
94 |
98,9 |
| 650,0 |
93 |
97,9 |
| 700,0 |
90 |
94,7 |
| 750,0 |
92 |
96,8 |
| 800,0 |
88 |
92,6 |
| 1 |
2 |
3 |
| 850,0 |
87 |
91,6 |
| 900,0 |
89 |
93,7 |
| 950,0 |
86 |
90,5 |
| 1000,0 |
93 |
97,9 |
Как видно из представленных данных, между всхожестью семян озимого тритикале и концентрацией изучаемого препарата зависимости не установлено (коэффициент корреляции r = – 0,21 при уровне значимости р = 0,31). Во всех случаях всхожесть семян культуры ниже контрольной, но не снижается более чем на 10%.
Таким образом, нами было установлено, что препарат гербицидной активности «Раундап» в микроконцентрациях оказывает незначительное влияние на начальные этапы развития проростков озимого тритикале сорта «Михась», тогда как в литературных источниках указывается отсутствие влияния данного гербицида на всхожесть семян культурных растений.
3.2 Влияние гербицида «Раундап» на развитие проростков озимого тритикале
Влияние раундапа на развитие проростков оценивалась по следующим показателям: сырая масса проростков, воздушно-сухая масса проростков, содержание воды в проростках, средняя длина проростков и весовой коэффициент развития проростков. Результаты наших исследований по влиянию гербицида на накопление вегетативной массы представлены в табл. 2.
Таблица 2 – Влияние раундапа на накопление проростками озимого тритикале вегетативной массы
| Концентра-ция гербицида, мкг/л |
Средняя сырая масса одного проростка |
Средняя воздушно-сухая масса одного проростка |
Содержание воды в проростках |
| мг |
относительная
(контроль 100%)
|
мг |
относительная
(контроль 100%)
|
% |
относительная (контроль 100%) |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
| Контроль |
66,47 |
100,0 |
6,64 |
100,0 |
90,01 |
100,00 |
| 5,0 |
59,84 |
90,0 |
5,99 |
90,2 |
89,99 |
99,98 |
| 12,5 |
56,39 |
84,8 |
5,74 |
86,5 |
89,81 |
99,78 |
| 25,0 |
62,45 |
93,9 |
6,44 |
96,9 |
89,69 |
99,65 |
| 37,5 |
60,00 |
90,3 |
6,21 |
93,5 |
89,65 |
99,60 |
| 50,0 |
60,98 |
91,7 |
6,18 |
93,1 |
89,86 |
99,83 |
| 100,0 |
63,00 |
94,8 |
6,11 |
92,0 |
90,30 |
100,32 |
| 150,0 |
63,52 |
95,6 |
6,40 |
96,3 |
89,93 |
99,91 |
| 200,0 |
60,92 |
91,6 |
5,89 |
88,6 |
90,34 |
100,37 |
| 250,0 |
71,25 |
107,2 |
7,03 |
105,9 |
90,13 |
100,13 |
| 300,0 |
60,51 |
91,0 |
6,10 |
91,9 |
89,92 |
99,90 |
| 350,0 |
58,56 |
88,1 |
5,47 |
82,3 |
90,66 |
100,73 |
| 400,0 |
61,44 |
92,4 |
6,19 |
93,2 |
89,93 |
99,91 |
| 450,0 |
60,54 |
91,1 |
6,12 |
92,1 |
89,89 |
99,87 |
| 500,0 |
64,37 |
96,8 |
6,37 |
95,9 |
90,11 |
100,11 |
| 550,0 |
64,84 |
97,5 |
6,55 |
98,6 |
89,90 |
99,88 |
| 600,0 |
56,76 |
85,4 |
5,73 |
86,3 |
89,90 |
99,88 |
| 650,0 |
59,78 |
89,9 |
5,87 |
88,4 |
90,18 |
100,19 |
| 700,0 |
62,67 |
94,3 |
6,56 |
98,7 |
89,54 |
99,48 |
| 750,0 |
64,18 |
96,6 |
6,33 |
95,2 |
90,14 |
100,15 |
| 800,0 |
64,20 |
96,6 |
6,81 |
102,5 |
89,40 |
99,32 |
| 850,0 |
64,48 |
97,0 |
6,83 |
102,8 |
89,41 |
99,34 |
| 900,0 |
66,52 |
100,1 |
6,76 |
101,8 |
89,83 |
99,80 |
| 950,0 |
70,99 |
106,8 |
7,33 |
110,3 |
89,68 |
99,64 |
| 1000,0 |
64,52 |
97,1 |
6,58 |
99,1 |
89,80 |
99,77 |
Из данных приведенных в таблице видно, что между концентрацией используемого гербицида и накоплением проростками озимого тритикале вегетативной массы зависимости установить не удалось. Отмечается как резкое снижение, так и следующее за ним увеличение сырой и сухой массы проростков. При этом в варианте опыта, где концентрация пестицида составляла 12,5 мкг/л, снижение массы проростков было максимально – 84,8% от контроля. Схожие величины снижения массы как сырой, так и воздушно-сухой отмечаются и для вариантов опыта, где концентрации пестицида составляли 350 и 600 мкг/л. Сухая масса проростков изменялась в несколько большем диапазоне, но существенных отличий от тенденций отмеченных в случае сырой массы не наблюдалось. Этот факт отражает и определенный для этих показателей коэффициент корреляции, который составил r = 0,92 при р<0,01. Кроме того, проведенные исследования показали, что на процентное содержание воды в растениях используемый гербицид не повлиял. Во всех вариантах опыта этот показатель отличался от контрольного менее чем на 1%.
Таким образом, при увеличении концентрации раундапа отмечается незакономерное колебательное изменение сырой и сухой массы проростков без влияния на обводненность побегов. Исходя из установленного механизма физиологического воздействия гербицида, природу подобного развития проростков мы объяснить не можем.
Результаты исследований по влиянию микроконцентраций гербицида «Раундап» на длину проростков представлены в таблице 3.
Таблица 3 – Влияние микроконцентраций препарата «Раундап» на длину проростков озимого тритикале
| Концентрация гербицида в питательной среде, мкг/л |
Длина проростков |
| средняя длина |
суммарная длина |
| мм |
относительная (контроль 100%) |
мм |
относительная (контроль 100%) |
| Контроль (без гербицида) |
89,17 ± 2,40 |
100,00 |
8471,00 |
100,00 |
| 5,0 |
83,00 ± 2,96 |
93,08 |
7636,00 |
90,14 |
| 12,5 |
80,29 ± 3,26 |
90,04
|
7226,00 |
85,30 |
| 25,0 |
86,06 ± 3,07 |
96,52 |
8090,00 |
95,50 |
| 37,5 |
83,14 ± 3,26 |
93,24 |
7483,00 |
88,34 |
| 50,0 |
85,98 ± 2,55 |
96,42 |
7910,00 |
93,38 |
| 100,0 |
88,31 ± 3,24 |
99,04 |
7948,00 |
93,83 |
| 150,0 |
86,49 ± 3,30 |
96,99 |
7611,00 |
89,85 |
| 200,0 |
84,22 ± 3,02 |
94,45 |
7327,00 |
86,50 |
| 250,0 |
96,11 ± 2,01 |
107,79
|
8458,00 |
99,85 |
| 300,0 |
82,84 ± 2,47 |
92,90 |
7290,00 |
86,06 |
| 350,0 |
80,09 ± 2,74 |
89,82
|
7208,00 |
85,09 |
| 400,0 |
83,64 ± 3,00 |
93,81 |
7528,00 |
88,87 |
| 450,0 |
85,59 ± 2,63 |
95,99 |
7960,00 |
93,97 |
| 500,0 |
86,98 ± 2,64 |
97,54 |
7567,00 |
89,33 |
| 550,0 |
88,16 ± 2,75 |
98,87 |
8023,00 |
94,71 |
| 600,0 |
75,17 ± 2,85 |
84,30
|
7066,00 |
83,41 |
| 650,0 |
79,95 ± 2,81 |
89,66
|
7435,00 |
87,77 |
| 700,0 |
83,10 ± 3,12 |
93,19 |
7479,00 |
88,29 |
| 750,0 |
85,78 ± 2,22 |
96,20 |
7892,00 |
93,16 |
| 800,0 |
85,43 ± 2,78 |
95,81 |
7518,00 |
88,75 |
| 850,0 |
87,10 ± 2,55 |
97,68 |
7578,00 |
89,46 |
| 900,0 |
87,74 ± 2,68 |
98,40 |
7809,00 |
92,19 |
| 950,0 |
89,22 ± 2,41 |
100,06 |
7673,00 |
90,58 |
| 1000,0 |
83,96 ± 2,94 |
94,16 |
7808,00 |
92,17 |
Как видно из представленных данных, достоверного влияния раундапа на проростки озимого тритикале не установлено. Как и в случае с накоплением проростками вегетативной массы, отмечается скачкообразное изменение средней длины проростков, как в сторону уменьшения, так и увеличения анализируемого показателя. Наименьшая средняя длина проростков зафиксирована при концентрации пестицида 600 мкг/л (84,3% к контролю), а наибольшая при 250 мкг/л (107,8% от контроля).
После предварительной статистической обработки результатов исследований нами был проведен однофакторный дисперсионный анализ для установления достоверности отличий выборок анализируемого показателя. Результаты этого анализа показали, что только при концентрациях 12,5; 250,0; 350,0; 600,0; 650,0 мкг/л анализируемые выборки длин проростков достоверно отличаются от контрольной. Именно к этим выборкам относятся минимальный и максимальный показатели средней длины. Только в указанных концентрациях гербицид достоверно стимулирует или ингибирует развитие проростков озимого тритикале.
Суммарная длина проростков во всех вариантах опыта оказалась ниже контроля, но, исходя из результатов дисперсионного анализа, мы можем оценивать этот показатель только в достоверно отличимых выборках.
Так как именно суммарная длина проростков является основным критерием при оценке токсичности, то можно констатировать наличие только ингибирующего влияния использованного гербицида на развитие проростков озимого тритикале. Это предположение основывается на том, что при концентрации пестицида 250 мкг/л суммарная длина проростков практически не отличается от таковой в контроле, хотя средняя длина проростков достоверно превышает контрольную почти на 8%.
Отмечаемые расхождения между двумя анализируемыми показателями (средняя и суммарная длина) дают возможность предположить, что для оценки влияния пестицидов на развитие проростков необходимо учитывать как среднюю, так и суммарную длину только после проведения дисперсионного анализа на достоверность отличий выборок.
Кроме приведенных выше характеристик развития проростков нами было введено понятие «весового коэффициента развития проростков», который, на наш взгляд, более полно отражает развитие вегетативной массы проростков (рисунок 4).
Как видно на рисунке, несмотря на существенный разброс в показателях весового коэффициента в зависимости от концентрации, прослеживается тенденция к увеличению анализируемого показателя. Этот факт является косвенным признаком стимулирующего влияния глифосатсодержащего гербицида «Раундап» на развитие проростков тритикале.

Рисунок 4 – Зависимость весового коэффициента от концентрации пестицида
3.3 Влияние гербицида «Раундап» на содержание в вегетативной массе проростков хлорофилла
Действие многих ксенобиотиков на высшие растения очень часто выражается в их влиянии на фотосинтетический аппарат. Это отражается на количественном и качественном содержании пигментов в растениях. В этой связи нами было проведено исследование влияния различных концентраций пестицида на содержание в проростках озимого тритикале хлорофиллов.
Результаты наших исследований по изучению влияния гербицида «Раундап» на содержание в проростках озимого тритикале хлорофиллов представлены в таблице 4.
Таблица 4 – Влияние гербицида на содержание в проростках хлорофилла
| Концентра-ция гербицида, мкг/л |
Содержание хлорофилла |
| хлорофилл a |
хлорофилл b |
Хл a + Хл b |
| мг/г |
относительное
(контроль 100%)
|
мг/г |
относительное
(контроль 100%)
|
мг/г |
относительное
(контроль 100%)
|
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
| Контроль |
1,77 |
100,00 |
0,82 |
100,00 |
2,59 |
100,00 |
| 5,0 |
1,71 |
96,61 |
0,79 |
96,34 |
2,50 |
96,53 |
| 12,5 |
1,99 |
112,43 |
0,90 |
109,76 |
2,89 |
111,58 |
| 25,0 |
2,05 |
115,82 |
0,93 |
113,41 |
2,98 |
115,06 |
| 37,5 |
1,77 |
100,00 |
0,83 |
101,22 |
2,60 |
100,39 |
| 50,0 |
1,85 |
104,52 |
0,83 |
101,22 |
2,68 |
103,47 |
| 100,0 |
1,95 |
110,17 |
0,91 |
110,98 |
2,86 |
110,42 |
| 150,0 |
1,87 |
105,65 |
0,79 |
96,34 |
2,66 |
102,70 |
| 200,0 |
1,58 |
89,27 |
0,77 |
93,90 |
2,35 |
90,73 |
| 250,0 |
1,88 |
106,21 |
0,87 |
106,10 |
2,75 |
106,18 |
| 300,0 |
1,79 |
101,13 |
0,81 |
98,78 |
2,60 |
100,39 |
| 350,0 |
1,76 |
99,44 |
0,82 |
100,00 |
2,58 |
99,61 |
| 400,0 |
1,52 |
85,88 |
0,70 |
85,37 |
2,22 |
85,71 |
| 450,0 |
1,83 |
103,39 |
0,89 |
108,54 |
2,72 |
105,02 |
| 500,0 |
1,93 |
109,04 |
0,89 |
108,54 |
2,82 |
108,88 |
| 550,0 |
1,70 |
96,05 |
0,82 |
100,00 |
2,52 |
97,30 |
| 600,0 |
1,85 |
104,52 |
0,83 |
101,22 |
2,68 |
103,47 |
| 650,0 |
1,88 |
106,21 |
0,81 |
98,78 |
2,69 |
103,86 |
| 700,0 |
1,66 |
93,79 |
0,78 |
95,12 |
2,44 |
94,21 |
| 750,0 |
1,69 |
95,48 |
0,64 |
78,05 |
2,33 |
89,96 |
| 800,0 |
1,48 |
83,62 |
0,69 |
84,15 |
2,17 |
83,78 |
| 850,0 |
1,57 |
88,70 |
0,77 |
93,90 |
2,34 |
90,35 |
| 900,0 |
1,81 |
102,26 |
0,89 |
108,54 |
2,70 |
104,25 |
| 950,0 |
1,61 |
90,96 |
0,84 |
102,44 |
2,45 |
94,59 |
| 1000,0 |
1,73 |
97,74 |
0,86 |
104,88 |
2,59 |
100,00 |
Результаты опытов по определению содержания хлорофилла показали, что также как и в предыдущих случаях зависимости между концентрацией пестицида в питательном растворе и содержанием хлорофилла в проростках нет.
Наблюдается скачкообразное незакономерное колебание содержания как хлорофилла а, так и хлорофилла b. Однако есть незначительный тренд снижения анализируемых показателей в зависимости от концентраций, но установить его достоверность пока не представляется возможности. Необходим более детальный анализ данных с учетом дополнительных серий экспериментов. Следует отметить, что максимальные концентрации хлорофилла фиксируются в вариантах опыта, где концентрация используемого гербицида составляла 12,5 и 25,0 мкг/л. В тоже время при концентрации 750 мкг/л отмечался максимум в соотношении концентраций хлорофиллов a и b (рисунок 5). Причину данного явления мы пока объяснить не можем.
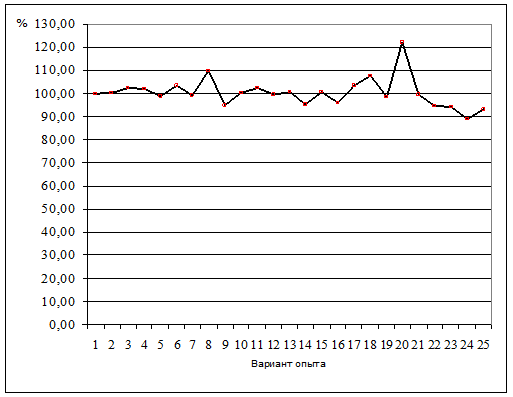
Рисунок 5 – Отношение концентрации хлорофиллов a и b (контроль 100%) 1 – контроль, 2–25 – варианты опытов с различной концентрацией
Таким образом, на данном этапе исследований мы не можем использовать содержание хлорофилла в качестве показателя влияния гербицида «Раундап» на проростки озимого тритикале.
В ходе проведенных экспериментов было установлено, что озимое тритикале сорта «Михась» является относительно устойчивым к действию микроколичеств глифосатсодержащего гербицида «Раундап». Однако развитие проростков идет неравномерно, особенно в первые дни развития. Следовательно можно предположить, что используемый глифосатсодержащий ксенобиотик в динамике оказывает несколько более выраженное влияние по сравнению с результатами экспериментов с выращиванием проростков в течение 7 дней.
3.4 Влияние гербицида «Раундап» на развитие проростков озимого тритикале в динамике
Развитие проростков озимого тритикале мы исследовали на 4-е, 5-е и 6-е сутки после закладки опыта. Результаты наших исследований по влиянию глифосатсодержащего гербицида «Раундап» на лабораторную всхожесть семян и накопление проростками вегетативной массы в динамике представлены в таблице 5.
Таблица 5 – Лабораторная всхожесть и вегетативная масса проростков в динамике эксперимента
| Вариант опыта |
Сроки отбора образцов |
Лабораторная всхожесть |
Средняя масса одного проростка, мг |
| сырая |
воздушно-сухая |
контроль
|
4 сутки |
80 |
55,69 |
5,70 |
| 5 сутки |
88 |
76,35 |
7,29 |
| 6 сутки |
92 |
88,28 |
7,96 |
0,05 мг/л
|
4 сутки |
84 |
51,00 |
5,06 |
| 5 сутки |
86 |
81,94 |
7,83 |
| 6 сутки |
83 |
93,58 |
8,89 |
0,25 мг/л
|
4 сутки |
83 |
56,86 |
5,75 |
| 5 сутки |
88 |
76,01 |
6,96 |
| 6 сутки |
81 |
95,70 |
8,86 |
0,50 мг/л
|
4 сутки |
78 |
54,03 |
5,28 |
| 5 сутки |
83 |
74,94 |
7,52 |
| 6 сутки |
86 |
95,03 |
8,92 |
Как видно из представленных данных, отмечается незначительное снижение лабораторной всхожести семян озимого тритикале под действием примененного гербицида, но мы не может утверждать, что это воздействие достоверно. Для подтверждения или опровержения этого предположения необходимо проведение многократных экспериментов с большим количеством повторностей.
Влияние пестицида на накопление проростками вегетативной массы на первый взгляд незначительно и не имеет определенной закономерности. В проростках отобранных на 4-е и 5-е сутки после начала эксперимента сырая и сухая массы незначительно отличались от контрольной как в сторону увеличения, так и уменьшения анализируемых показателей массы. Только у проростков отобранных на 6-е сутки зафиксировано превышение сухой и сырой массы по отношению к контролю. Это увеличение не зависит от концентрации пестицида в среде. Сырая масса проростков составила 107% от таковой в контроле, а сухая – 112%.
Однако нами был отмечен существенный момент в интенсивности накопления вегетативной массы проростками. Так при концентрации пестицида 0,05 мг/л прирост между первым и вторым отбором проростков составил 150% от контроля. На следующие сутки отмечалось резкое снижение прироста, и он составил 98% от прироста в контрольном варианте. В среднем за 2-е суток прирост в этом варианте опыта составлял около 130% от такового в контроле. В противоположность этому в варианте опыта, где концентрация пестицида составляла 0,25 мг/л, прирост между первым и вторым отбором был ниже контрольного (93%), а на следующие сутки резко возрос – до 165% по сравнению с контролем. В среднем за двое суток прирост составил 119% к контрольному. Аналогично с этим вариантом опыта проходило накопление вегетативной массы в опыте с концентрацией пестицида равной 0,50 мг/л. Здесь средний прирост фитомассы составил 126% (101 и 168% соответственно по отборам).
Еще более существенные различия мы отметили при накоплении проростками сухой массы. Относительные величины прироста составляют от 76 до 283% от контрольного варианта. Здесь отмечается та же закономерность, что и при накоплении сырой массы, но она более выражена. В варианте опыта с концентрацией гербицида 0,05 мг/л отмечается снижение суточного прироста со 174 до 159% (за 2-е суток – 170%) от контрольного варианта. То есть, в любом случае интенсивность увеличения сухой массы гораздо выше, чем в контроле, хоть и снижается на вторые сутки.
При концентрации пестицида 0,25 мг/л между первым и вторым отбором накопление сухой массы гораздо ниже, чем в контроле (76%), а в следующие сутки происходит резкое увеличение интенсивности накопления сухой массы – 283% от таковой в контроле. За 2-е суток прирост составил 137% по сравнению с контрольным вариантом. В опыте с концентрацией ксенобиотика 0,50 мг/л также отмечен более интенсивный относительный прирост сухой массы – 140 и 209% соответственно. За 2-е суток прирост составил 161% по сравнению с аналогичной величиной в контроле.
Следует отметить, что данные тенденции сохраняются и при использовании в сравнительном анализе отношения не к контрольному варианту, а к относительному приросту внутри самого варианта – в некоторых случаях относительный прирост имеет более широкий диапазон варьирования.
На основании этих данных можно сделать вывод о том, что пестицид влияет не на абсолютные величины масс проростков, а на интенсивность их накопления в динамике. Однако обнаруженный эффект нуждается в дальнейшем исследовании для его подтверждения и объяснения причин.
Наши исследования по влиянию раундапа на длину проростков представлены на рисунке 6.
Как видно на рисунке, внесение в питательный раствор микроконцентраций гербицида «Раундап» не оказало существенного влияния на длину проростков озимого тритикале. На 4-е сутки в вариантах опыта с добавлением 0,05 и 0,50 мг/л пестицида отмечалось некоторое снижение анализируемого показателя по сравнению с контролем, а при 0,25 мг/л показатель практически не отличается от контрольного.
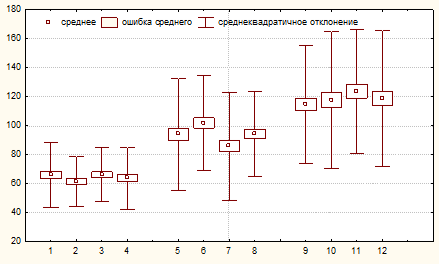
Рисунок 6 – Влияние препарата «Раундап» на длину проростков Примечание. 1,5,9 – длина проростков в контроле на 4,5,6 сутки; 2,6,10 – при концентрации 0,05 мг/л; 3,7,11 – при концентрации 0,25 мг/л; 4,8,12 – при концентрации 0,50 мг/л
Однако в течение следующих суток наблюдается некоторая диспропорция в интенсивности роста проростков (по аналогии с вегетативной массой). Наибольший прирост зафиксирован при концентрации пестицида 0,05 мг/л, а наименьший – при концентрации 0,25 мг/л. Существенным моментом отмеченного явления является то, что при концентрациях 0,05 и 0,25 мг/л зафиксированы противоположные тенденции прироста по суткам. Если у первого опыта первоначально прирост составлял около 145% от прироста в контрольном варианте, то затем происходило резкое снижение этого показателя до 77% от контроля. В среднем за 2-е суток прирост составил 115,7% по сравнению с аналогичным показателем в контроле. При использовании концентрации пестицида 0,25 мг/л наоборот – первоначальный прирост составлял всего 70,5% от контроля, а на следующий день – 183,0%. В среднем за двое суток анализируемый показатель составил 118,4% от контрольного. В опыте с концентрацией пестицида равной 0,50 мг/л был отмечен динамичный прирост, который составил соответственно 109,7 и 118,2% от такового в контроле. Средний прирост за 2-е суток составил 113,3% по сравнению с контрольным вариантом опыта.
Отмеченные изменения анализируемого показателя сказываются на весовом коэффициенте (рисунок 7).
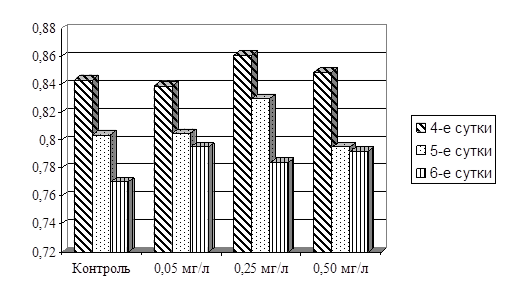
Рисунок 7 – Весовой коэффициент проростков озимого тритикале в динамическом эксперименте
Как видно из представленных данных, при первом измерении (на 4-е сутки) четко прослеживается увеличение весового коэффициента в концентрациях 0,25 и 0,50 мг/л. На 5-е сутки только в опыте, где концентрация гербицида составляла 0,25 мг/л, коэффициент был выше, чем в контроле. При концентрации 0,50 мг/л произошло снижение анализируемого показателя. Для концентрации 0,05 мг/л весовой коэффициент как на 4-е, так и на 5-е сутки от аналогичной величины в контроле практически не отличался. На 6-е сутки нами было зафиксировано увеличение весового коэффициента по отношению к контролю во всех вариантах опыта.
Таким образом, нами было отмечено что, несмотря на отсутствие достоверного закономерного влияния микроконцентраций глифосатсодержащего гербицида «Раундап» на длину проростков, он оказывает заметное влияние на прирост растений. Однако резкие колебания этого прироста за 2-е суток могут свидетельствовать о возможности каких-то нарушений в морфолого-физиологических процессах у проростков, несмотря на то, что указанный прирост выше, чем в контрольном варианте. Обнаруженный факт нуждается в дальнейшем подтверждении и изучении.
Наши исследования по изучению динамики влияния глифосатсодержащего гербицида «Раундап» на содержание хлорофиллов представлены в таблице 6.
Таблица 6 – Динамика влияния гербицида «Раундап» на содержание в проростках хлорофиллов
| Сроки отбора образцов |
Вариант опыта |
Содержание хлорофилла |
| хлорофилл a |
хлорофилл b |
| мг/г |
относительное
(контроль 100%)
|
мг/г |
относительное
(контроль 100%)
|
| 4-е сутки |
Контроль
|
2,273
|
100,0
|
0,490
|
100,0
|
| 0,05 мг/л |
2,334 |
102,7 |
0,443 |
90,4 |
| 0,25 мг/л |
2,602 |
114,5 |
0,608 |
124,0 |
| 0,50 мг/л |
2,353 |
103,5 |
0,763 |
155,6 |
| 5-е сутки |
Контроль
|
3,793
|
100,0
|
1,313
|
100,0
|
| 0,05 мг/л |
3,626 |
95,6 |
1,422 |
108,3 |
| 0,25 мг/л |
4,202 |
110,8 |
1,619 |
123,3 |
| 0,50 мг/л |
3,163 |
83,4 |
1,305 |
99,4 |
| 6-е сутки |
Контроль
|
3,934
|
100,0
|
1,577
|
100,0
|
| 0,05 мг/л |
4,558 |
115,9 |
1,763 |
111,8 |
| 0,25 мг/л |
4,675 |
118,8 |
1,756 |
111,3 |
| 0,50 мг/л |
4,262 |
108,3 |
1,776 |
112,6 |
Как видно из таблицы, раундап оказывает воздействие как на содержание хлорофилла а, так и хлорофилла b. При концентрации пестицида 0,05 мг/л нами отмечено незначительное снижение содержания хлорофилла а на 5-е сутки с последующим резким возрастанием на 6-е. Содержание же хлорофилла b изначально было ниже контрольного, но затем происходило постепенное увеличение его содержания в проростках.
При концентрации пестицида 0,25 мг/л нами отмечено повышенное содержание (по отношению к контролю) хлорофиллов на протяжении всего эксперимента, но на 6-е сутки произошло снижение относительного содержания хлорофилла b.
В опыте, где концентрация пестицида составляла 0,50 мг/л, отмечалось резкое колебание относительного содержания пигментов. В наибольшей степени это характерно для хлорофилла b. Если на 4-е сутки этот показатель почти в 1,5 раза превосходил таковой в контроле, то на 5-е от контроля не отличался, а к 6-м суткам относительное содержание его опять выросло. Следует отметить, что в этом варианте опыта зафиксировано и самое низкое относительное содержание хлорофилла а – на 5-е сутки оно составляло только 83,4% от контроля. Кроме того, на 6-е сутки во всех вариантах опыта отмечается повышенное относительное содержание хлорофиллов в проростках.
Указанные выше особенности содержания хлорофиллов в проростках отразились и на соотношении зеленых пигментов (рисунок 8).
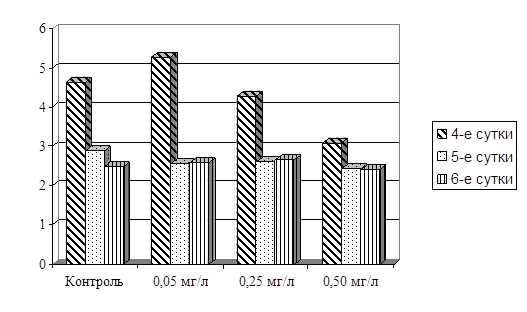
Рисунок 8 – Динамика индекса хлорофиллов в проростках озимого тритикале
Как видно на рисунке, влияние различных концентраций пестицида на соотношение хлорофиллов отмечается только на 4-е сутки. В дальнейшем хлорофилльный индекс практически не отличается от такового в контроле.
Таким образом, нами было установлено наличие влияния глифосатсодержащего гербицида «Раундап» на содержание в проростках озимого тритикале зеленых пигментов. Но установить четкой зависимости между содержанием хлорофиллов и концентрацией пестицида не удалось.
Заключение
В ходе проведенных экспериментов было установлено, что озимое тритикале сорта «Михась» является относительно устойчивым к действию микроколичеств глифосатсодержащего гербицида «Раундап».
Между всхожестью семян озимого тритикале и концентрацией изучаемого препарата зависимости не установлено. Во всех случаях всхожесть семян культуры ниже контрольной, но не снижается более чем на 10%.
При увеличении концентрации раундапа отмечается незакономерная тенденция к снижению сырой и сухой массы проростков озимого тритикале без влияния на обводненность побегов. Только в концентрациях 12,5; 250,0; 350,0; 600,0; 650,0 мкг/л гербицид достоверно стимулирует или ингибирует развитие проростков озимого тритикале.
Было отмечено, что, несмотря на отсутствие достоверного закономерного влияния микроконцентраций глифосатсодержащего гербицида «Раундап» на длину проростков, он оказывает заметное влияние на прирост растений. Однако резкие колебания этого прироста за 2-е суток могут свидетельствовать о возможности каких-то нарушений в морфолого-физиологических процессах у проростков, несмотря на то, что указанный прирост выше, чем в контрольном варианте. Указанное явление характерно и для накопления проростками вегетативной массы.
Было установлено наличие влияния глифосатсодержащего гербицида «Раундап» на содержание в проростках озимого тритикале зеленых пигментов. Но установить четкой зависимости между содержанием хлорофиллов и концентрацией пестицида не удалось.
Список источников
1 Захаренко, В.А. Защита растений в третьем тысячелетии. (Материалы XIV международного конгресса по защите растений) / В.А. Захаренко // Агрохимия. – 2000. – №4. – С. 84–93.
2 История развития и проблемы защиты растений / А.Ф. Ченкин [и др.]; под обш. ред. А.Ф. Ченкина. – М.: РАСХН, 1997. – 331 с.
3 Захаренко, В.А. Пестициды в интегрированной защите растений. Обзоры / В.А. Захаренко // Агрохимия. – 1992. – №12. – С. 92–105.
4 Зексер, Б. Интегрированная защита растений: в ногу со временем / Б. Зексер, А.А. Кириенко // Агрохимия. – 1992. – №11. – С. 8.
5 Данилишин, Б.М. Химизация земледелия: поиски новых альтернатив / Б.М. Данилишин // Вестник сельскохозяйственной науки. – 1992. – №5–6. – С. 157–162.
6 Буга, С.Ф. Защита растений: учебное пособие для средних специальных учебных заведений сельскохозяйственного профиля / С.Ф. Буга, Н.И. Протасов, В.Ф. Самерсов. – М.: Ураджай, 2001. – 307 с.
7 Ченкин, А.Ф. Справочник агронома по защите растений / А.Ф. Ченкин, В.А. Черкасов, В.А. Захаренко. – М.: Агропромиздат, 1990. – 367 с.
8 Иванов, В.В. Использование химических и биологических средств борьбы с вредителями леса / В.В. Иванов. – М.: Пушкин: ВНИИЛМЛХ, 1976. – 340 с.
9 Мельников, Н.Н. Поведение синтетических пиретроидов в объектах окружающей среды / Н.Н. Мельников, Н.И. Аронова // Агрохимия. – 1987. – №9. – С. 109–129.
10 Петрушов, А.З. Пиретроидные инсектициды / А.З. Петрушов // Агрохимия. – 1984. – №6. – С. 121–126.
11 Грапов, А.Ф. Успехи в области инсектицидов и акарицидов / А.Ф. Грапов, Л.В. Разводовская // Агрохимия. – 1990. – №7. – С. 126–147.
12 Спиридонов, Ю.Я. Проблемы засоренности посевов и борьбы с ней в условиях современного состояния сельского хозяйства России / Ю.Я. Спиридонов // Агрохимия. – 1996. – №10. – С. 75–83.
13 Мельников, М.М. Пестициды и окружающая среда / М.М. Мельников, А.И. Волков, О.А. Короткова. – М.: Химия, 1977. – 240 с.
14 Протасов, Н.И. Гербициды в интенсивном земледелии: учебное пособие / Н.И. Протасов. – Минск: Ураджай, 1988. – 232 с.
15 Амирханов, Д.В. Использование пиретроидов для борьбы с колорадским жуком / Д.В. Амирханов, Т.Л. Леонтьева, О.П. Черникова // Агрохимия. – 1990. – №6. – С. 91–97.
16 Зинченко, В.А. Химическая защита растений: средства, технология и экологическая безопасность: учебное пособие для вузов / В.А. Зинченко. – М.: КолосС, 2005. – 232 с.
17 Интегрированные системы защиты сельскохозяйственных культур от вредителей, болезней и сорняков: рекомендации / Нац. акад. наук Респ. Беларусь, Ин-т защиты растений НАН Беларуси; под общ. ред. С.В. Сороки. – Мн.: Бел. наука, 2005. – 462 с.
18 Жукова, П.С. Регуляторы роста и гербициды на овощных культурах и картофеле / П.С. Жукова, Н.А. Лобань. – Мн.: Беларускi кнiгазбор, 2000. – 483 с.
19 Никончик, П.И. Агроэкономические основы систем использования земли / П.И. Никончик. – Минск: Белорус. наука, 2007. – 532 с.
20 Рекомендации по борьбе с сорными растениями в посевах сельскохозяйственных культур: второе изд., испр. и доп. / С.В. Сорока [и др.]. – Минск: РУП «ИВЦ Минфина», 2005. – 104 с.
21 Голиков, Г.П. Методы и проблемы экотоксикологического моделирования и прогнозирования / Г.П. Голиков. – М.: Пущино, 1979. – 76 с.
22 Лунев, М.И. Пестициды и охрана агрофитоценоза / М.И. Лунев. – М.: Колос, 1992. – 270 с.
23 Венгорек, В. Влияние пестицидов на урожай и окружающую среду / В. Венгорек // Защита растений. – 1992. – №10. – С. 6–8.
24 Федке, К. Биохимия и физиология действия гербицидов / К. Федке / пер. с англ. – М.: Агропромиздат, 1985. – 224 с.
25 Голышин, Н.М. Механизм действия фунгицидов / Н.М. Голышин // Защита растений. – 1991. – №10. – С. 13–15.
26 Захаренко, В.А. Гербициды / В.А. Захаренко. – М.: Агропромиздат, 1990. – 240 с.
27 Кожуро, Ю.И. Анализ цитогенетического действия гербицидов трефлан и зенкор на растения ячменя / Ю.И. Кожуро, Н.П. Максимова // Белорусский государственный университет, г. Минск, Беларусь [Электронный ресурс]. – 2008. – Режим доступа: . – Дата доступа: 10.11.2009.
28 Каталог пестицидов и удобрений, разрешенных для применения в Республике Беларусь: Справочное издание / Р. А. Новицкий [и др.]; – Мн.: Инфофорум, 2005. – 378 с.
29 Применять глифосат правильно [Электронный ресурс]. – 2008. – Режим доступа: http://www.forest.ru/rus/bulletin/16/5full.html. – Дата доступа: 24.10.2009.
30 Лунев, М.И. Фитотоксическое последствие и побочное действие гербицидов / М.И. Лунев, Л.П. Кретова // Защита растений. – 1991. – №7. – С. 22–23.
31 Кокс, К. Глифосат («Раундап») / К. Кокс // Журнал пестицидной реформы [Электронный ресурс]. – 1998. – №3. – Режим доступа: http://www.pesticide.org/gly.pdf. – Дата доступа: 12.01.2009.
32 Берзин, В.Б. Механизм действия, метаболизм и деградация пиретроидов / В.Б. Берзин // Агрохимия. – 1985. – №2. – С. 126–135.
|