РАСЧЕТ КВАНТОВО – ХИМИЧЕСКИХ ПАРАМЕТРОВ ФАВ И ОПРЕДЕЛЕНИЕ ЗАВИСИМОСТИ «СТРУКТУРА – АКТИВНОСТЬ» НА ПРИМЕРЕ СУЛЬФАНИЛАМИДОВ
ОГЛАВЛЕНИЕ
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ
ВВЕДЕНИЕ
Глава 1. МАТЕМАТИЧЕСКИЕ МЕТОДЫ РАСЧЕТА КОНСТАНТ ОРГАНИЧЕСКИХ МОЛЕКУЛ И ВИДОВ ПРОЯВЛЯЕМОЙ ФИЗИОЛОГИЧЕСКОЙ АКТИВНОСТИ
1.1 История развития квантовохимических методов анализа «структура вещества – проявляемая физиологическая активность»
1.1.1 Различие неэмпирических и полуэмпирических методов
1.1.2 Метод Хартри - Фока
1.1.3 Метод Хэнча
1.1.4 Регрессионный анализ и статистические параметры
1.1.5 Аддитивная модель Фри – Вильсона
1.1.6 Метод Хюккеля, расширенный метод Хюккеля
1.2 Современные методы анализа «структура вещества – проявляемая физиологическая активность»
1.2.1 Принципы распознавания образов
1.2.2 Основные понятия методов распознавания образов
1.2.3 Методы кластеризации
1.2.4 Программа PASS C&T
1.3 Вывод
Глава 2. ВЫЧИСЛЕНИЕ ГЕОМЕТРИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
2.1 Квантовохимические методы расчета
2.1.1 Расчет потенциалов ионизации
2.1.2 Расчет индексов реакционной способности
2.1.3 Вычисление теплот образования
2.1.4 Расчет тепловых эффектов органических реакций
2.1.5 Расчет поверхностей потенциальной энергии
2.1.6 Силовые постоянные химических связей и частоты внутримолекулярных колебаний
2.2 Вывод
Глава 3. СУЛЬФАНИЛАМИДНЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
3.1 История открытия сульфаниламидов
3.2 Физические свойства сульфаниламидов
3.3 Механизм действия сульфаниламидов
3.4 Синтез сульфаниламидов
3.5 Расчитанные параметры молекул
3.5.1 Сульфаниламид
3.5.2 Сульгин
3.5.3 Сульфадимезин
3.5.4 Норсульфазол
3.5.4 Сульфафуразол
ЗАКЛЮЧЕНИЕ
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ
Приложение А
Приложение Б
Приложение В
Приложение Г
Приложение Д
Приложение Е
Приложение Ж
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ
В данной дипломной работе применены следующие сокращения:
АО - атомная орбиталь
МО - молекулярная орбиталь
ЛКАО - линейная комбинация атомных орбиталей
МО ЛКАО - молекулярные орбитали, представленные в виде линейных комбинаций атомных орбиталей
ССП - самосогласованное поле
ППЭ - поверхность потенциальной энергии
ППДП - полное пренебрежение дифференциальным перекрыванием (в зарубежной литературе CNDO)
ЧПДП - частичное пренебрежение дифференциальным перекрыванием (в зарубежной литературе INDO)
ПДДП - пренебрежение двухатомным дифференциальным перекрыванием (в зарубежной литературе NDDO)
ППДП/2 - полуэмперический метод, предложенный Пополом, Сантри и Сергалом, в котором использовано приближение ППДП, второй вариант
ЧПДП - аналогичный метод, в котором использовано приближение ППДП
ППДП/БУ - полуэмпирический метод, предложенный Бойдом и Уайтхедом, в котором использовано приближение ППДП
МПДП - полуэмпирический метод разработанный, Дьюаром и сотрудниками, в котором использовано приближение ПДДП
МПДП/Н - модифицированный вариант метода МПДП для расчетов параметров систем с водородными связями
АМ1 - новый вариант метода МПДП, разработанный Дьюаром с сотрудниками
ССП - самосогласованное поле
КВ – метод конфигурационного взаимодействия учета электронной корреляции
ПАБК – пара – аминобензойная кислота
ЖКХ – желудочно–кишечный тракт
PASS C&T - Prediction of Activity Spectra for Substances: Complex & Training
ВВЕДЕНИЕ
С давних лет человечество мечтает о лекарстве, которое при действии на организм обладало бы максимальной избирательностью, благодаря чему эффективно устраняется причина болезни, но не возникают нежелательные побочные эффекты. Наиболее ярко эта идея выражена в концепции "магической пули", выдвинутой основателем химиотерапии П. Эрлихом.
В то же время, весь накопленный к настоящему моменту опыт медицинской химии и фармакологии свидетельствует об отсутствии абсолютной специфичности действия известных лекарственных веществ: все они способны вызывать многообразные фармакологические эффекты, часть которых используется для терапии определенной патологии, а другие - являются причиной побочного действия и токсичности. Полный набор фармакологических эффектов, которые может проявить некое вещество в различных условиях эксперимента, называется спектром биологической активности данного
вещества.
В процессе исследования нового фармакологического вещества характеристики спектра его биологической активности выявляются не сразу: некоторые эффекты обнаруживаются уже при первом тестировании "в пробирке", другие - при изучении его действия на экспериментальных животных, третьи - при проведении клинических испытаний и последующем использовании препарата в медицинской практике. Нередко новое действие выявляется у вещества, применяемого в медицине в течение многих лет. Такое открытие может стать основой для использования препарата по новому назначению. Например:
1. вальпроат был первоначально предложен в качестве анксиолитика в 1961 г. и как противоэпилептическое средство - в 1989 г.;
2. левамизол - как антигельминтное средство в 1968 г. и как иммуностимулятор - в 1980 г.;
3. альпростадил - как антиагрегантное средство в 1988 г. и как препарат, стимулирующий эрекцию - в 1994 г.;
4. аспирин был предложен в качестве анальгетика в 1899 г., а его антиагрегантное действие было открыто лишь в 1971 г.; и т.д. [1].
5. талидомид, обладающий анксиолитическим и снотворным эффектами, был введен в медицинскую практику в 50-х годах [2]. В начале 60-х годов из-за наличия тератогенности он стал причиной врожденных дефектов у более чем 8000 новорожденных в Европе [3], что привело к запрету на его применение и ужесточению требований к исследованию безопасности лекарственных препаратов вообще. Теперь, сорок лет спустя, талидомид переживает "второе рождение". Он активно испытывается в клинике как потенциальное противоопухолевое и антиметастатическое средство, как препарат для симптоматической терапии СПИДа. Это обусловлено его недавно открытыми антиангиогенным эффектом [4] и антагонистическим действием по отношению к фактору некроза опухоли [5]. В сентябре 1997 года Администрация по лекарствам и пищевым продуктам США даже устроила специальное открытое совещание, посвященное современным оценкам соотношения "польза - риск" при использовании талидомида в медицинской практике.
Если бы можно было предсказать вероятность проявления веществом конкретных видов биологической активности заранее, то его дорогостоящее исследование в эксперименте и клинике проводилось бы более прицельно, и позволило бы выявить многие полезные и побочные эффекты на ранних стадиях изучения препарата.
Основа для такого предсказания известна достаточно давно, и она связана с утверждением: "Биологическая активность вещества является функцией его химической структуры ". Надо "всего лишь" выявить вид этой функции и в дальнейшем "подставить в уравнение" структурную формулу исследуемого вещества, получив в результате прогностическую оценку его биологической активности. В сущности, именно так и поступают в медицинской химии: анализируя химическое строение соединений с известной биологической активностью, выделяют элементы, "ответственные" за проявление/отсутствие того или иного эффектов, и далее "конструируют" молекулы более активных и менее токсичных аналогов. [6]
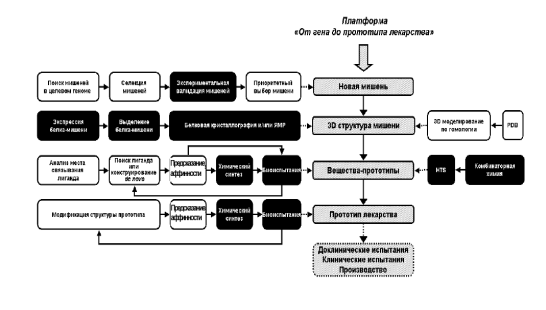
Рисунок 1.1 Общая структура платформы от гена до прототипа лекарства. Экспериментальные блоки показаны черным цветом, компьютерные – белым.
Это положение послужило основанием для выделения у химических соединений определенных факторов (дескрипторов) и установления связи, качественной (SAR) или количественной (QSAR), между ними и биологической активностью соединения. В качестве таких дескрипторов используются различные характеристики молекулы:
1. топологические – фрагменты структуры (подструктурные дескрипторы), индексы атомов и связей, каппа - индексы, описывающие форму молекулы, индексы молекулярных связей (MCI);
2. квантовые параметры – энергии HOMO (высшей занятой обитали) и LUMO (низшей незанятой обитали), заряды на различных атомах, электронные плотности, поляризуемости;
3. параметры, относящиеся к целой молекуле – молярная рефракция, коэффициент распределения октанол - вода.
В данной работе будет рассмотрена возможность проведения анализа «структура вещества – проявляемая физиологическая активность» на примере соединений сульфаниламидного ряда. Сульфаниламиды относятся к лекарственным веществам противостафилакоккового направления бактериостатического принципа действия. Так же они проявляют антидиабетические, диуретические и антисептические свойства. Более подробно сульфаниламиды рассмотрены в главе 3.

Рисунок 1.2 Общая схема стратегии компьютерного конструирования лекарств.
Квантовая механика и статистическая физика в принципе позволяют дать исчерпывающее объяснение любым экспериментальным данным о реакционной способности органических соединений и предсказать возможные направления реакций, а так же виды проявляемой физиологической активности.
В данной работе будет рассмотрена возможность не только расчета параметров соединения, что позволит химикам – синтетикам еще до получения конкретного соединения предсказать его физико – химические свойства, но и будет предложен метод для расчета физиологической активности соединения. Ни в зарубежной, ни в отечественной литературе эти методы ранее в совокупности не рассматривались, и возможности перехода от одного к другому не исследовались.
Глава 1 МАТЕМАТИЧЕСКИЕ МЕТОДЫ РАСЧЕТА КОНСТАНТ ОРГАНИЧЕСКИХ МОЛЕКУЛ И ВИДОВ ПРОЯВЛЯЕМОЙ ФИЗИОЛОГИЧЕСКОЙ АКТИВНОСТИ
1.1 История развития квантовохимических методов анализа «структура вещества – проявляемая физиологическая активность»
В основе квантовой механики лежит уравнение Шредингера, играющее в ней такую же важную роль, как и уравнения Ньютона в классической механике. Также как и уравнения Ньютона, уравнение Шредингера не выведено ни из какой физической теории, а является постулатом, полученным в результате обобщения опытных фактов.
Для совокупности Nвзаимодействующих частиц с потенциальной энергией U и массами mk в декартовой системе координат оно имеет вид
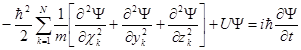
где Ψ(x, y, z, t) – волновая функция совокупности координат системы частиц и времени, U – оператор потенциальной энергии. Суммирование производится по всем частицам.
Стационарные состояния удовлетворяют не зависящему от времени уравнению Шредингера:
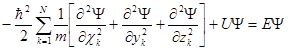
Параметр Е есть собственное значение стационарного уравнения Шредингера. В результате решения стационарного уравнения Шредингера находят собственные (возможные) значения параметра Е и соответствующие ему решения – собственные функции.
Для любого уравнения Шредингера, соответствующего конкретной системе, существует бесконечное множество значений параметра Е. Эти значения могут быть как непрерывными (для свободно движущейся частицы), так и дискретными, если частицы локализованы в малой области пространства. Дискретные значения Е называют уровнями энергии.
Пользуясь операторной символикой, можно записать уравнение Шредингера в сокращенной форме:

ĤΨ = ЕΨ,
где Ĥ = 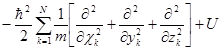 - оператор Гамильтона или гамильтониан системы частиц. - оператор Гамильтона или гамильтониан системы частиц.
1970 - 1980-е годы были временем очень быстрого развития вычислительных методов квантовой химии. В результате появилась возможность рассчитывать геометрию и оценивать стабильность промежуточных продуктов и переходных состояний, а также вычислять профили поверхности потенциальной энергии вдоль координаты реакции. Экспериментальное получение подобной информации для большинства реакций связано с преодолением значительных трудностей, вызванных многостадийным характером процессов, синхронным протеканием отдельных элементарных стадий и очень малым временем жизни промежуточных продуктов. Развитие вычислительных методов квантовой химии и появление быстродействующих ЭВМ позволили рассчитывать многие характеристики органических соединений, в том числе и нестабильных, а также переходных состояний. Точность этих расчетов получается вполне удовлетворительной по термохимическим стандартам. Поэтому квантовохимические расчеты в настоящее время используются в качестве одного из физико-химических методов исследования для получения данных, необходимых для установления механизмов сложных органических реакций.
Существующие методы математического моделирования "структура- активность" могут быть условно разделены на три группы.
Первая группа основана на использовании принципа линейности свободных энергий и включает в себя такие подходы, как метод Хэнча, метод Кубиньи и "диффузионный подход".
К этой же группе причисляют аддитивно- статистические методы Фри - Уилсона, Фуйита - Бана, Каммарата - Яу и им подобные. Для построения моделей, реализующих принцип линейности свободных энергий, используются методы регрессионного анализа.
Вторая группа объединяет методы, предназначенные для получения первоначальных представлений об изучаемом явлении посредством статистической обработки всей имеющейся информации, а также преобразования ее к виду, удобному для дальнейшего использования. Эта группа методов иногда называется методами "генерации гипотез". Она объединяет такие методы, как факторный анализ во всех его модификациях, методы линейного отображения, иногда к этой группе относят и аддитивно- статистические методы.
В третью группу включают методы, основанные на использовании алгоритмов теории распознавания образов, предназначенные для классификации объектов посредством разнообразных статистических и эвристических процедур. К этой группе относят различные методы дискриминантного анализа, порогового логического элемента и его модификации, методы теории алгебры логики.
1.1.1 Различие неэмпирических и полуэмпирических методов
На практике обычно пользуются как полуэмпирическими, так и неэмпирическими методами. Они различаются методикой вычисления матричных элементов, описывающих взаимодействие электронов между собой и электронов и атомных ядер в уравнениях. В полуэмпирических методах для этой цели используются приближенные эмпирические формулы и известные из эксперимента параметры атомов. В неэмпирических методах проводится непосредственный аналитический расчет матричных элементов.
Полуэмпирические расчеты в 80 - 90 годы чаще всего проводились в валентных приближениях ППДП, ЧПДП и ПДДП, ППДП/2, ППДП/БУ, МЧПДП, МПДП, АМ1 [6, 7, 8].
Характерными особенностями всех полуэмпирических методов являются следующие.
Некоторые группы электронов явным образом не рассматриваются. Например, в расчете могут учитываться только валентные электроны (валентное приближение) или только П - электроны (П- электронное приближение).
Некоторые члены гамильтониана не учитываются или выражаются через какие - либо эмпирические параметры.
Ряд интегралов, необходимых для расчета электронной энергии, либо принимается равным нулю, либо выражается через другие интегралы или эмпирические параметры.
Очевидно, что приближения полуэмпирических методов не могут быть произвольными. Основные положения, взаимодействия и эффекты, точно учитываемые в неэмпирических подходах, должны сохранятся и в полуэмпирических методах МО ЛКАО. С этой точки зрения возможен ряд уровней приближения.
Приближения, приводящие к тому, что результаты расчетов становятся неинвариантными относительно как вращения координатных осей, так и гибридизации АО.
Приближения, которые сохраняют инвариантность относительно вращения координатных осей, но нарушают инвариантность по гибридизации АО.
Приближения, инвариантные и относительно вращения координатных осей, и относительно гибридизации АО.
Приближения, сохраняющие инвариантность расчета при любых ортогональных преобразованиях базиса АО.
В неэмпирических методах все матричные элементы взаимодействия электронов и атомных ядер и электронов между собой вычисляются с помощью аналитического расчета необходимых интегралов в некотором базисе АО. Наиболее точно распределение электронной плотности в атомах можно передать с помощью слейтеровских АО, то есть функций типа exp(-αr), rexp(-αr), xexp(-αr), yexp(-αr). Однако со слейтеровскими орбиталями очень трудно вычислить интегралы, которые входят в фокиан для молекул. Поэтому в качестве базисных АО обычно берут гауссовы функции:
для s орбиталей: exp(-αr2);
для р орбиталей: xexp(-αr2), yexp(-αr2), zexp(-αr2);
для d орбиталей: x2exp(-αr2), y2exp(-αr2), z2exp(-αr2), xyexp(-αr2), xzexp(-αr2), yzexp(-αr2). [6, 7, 8].
Это так называемые примитивные гауссовые функции. С ними относительно легко вычислять матричные элементы, но, когда их мало, они плохо воспроизводят распределение электронной плотности в атомах и молекулах. В связи с этим гауссовых орбиталей приходится брать намного больше, чем слетеровских. Обычно используют так называемые сгруппированные базисы, в которых каждая базисная орбиталь представляет собой линейную комбинацию из нескольких примитивных гауссовых функций.
Для изучения реакционной способности и строения органических соединений наиболее широко используются базисы, предложенные Поплом и сотрудниками: минимальный базис ОСТ-3ГФ, валентно - расщепленные базисы 3-12ГФ, 4-31ГФ, 6-31 ГФ, валентно - расщепленные базисы с поляризационными орбиталями 6-31ГФ* и 6-31ГФ**, валентно - расщепленные базисы с диффузными s и р орбиталями 3-21+ГФ и 4-31+ГФ.
1.1.2 Метод Хартри - Фока
В основе современной квантовой химии лежит уравнение Шредингера для стационарных состояний. Его обычно решают в адиабатическом приближении, то есть в предположении, что ядерную и электронную волновые функции можно разделить и решать уравнения для движения ядер и электронов раздельно. В этом приближении уравнение Шредингера для электронной волновой функции записывается следующим образом:
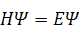 , где , где
Ĥ- гамильтониан системы, т.е. сумма операторов кинетической и потенциальной энергий,
Y = Y(x1, x2…xn)- волновая функция для системы из n частиц, которая зависит от их расположения в пространстве и спинов,
Е- полная электронная энергия.
Однако точно решить это уравнение удается лишь в случае одноэлектронных систем. Поэтому в квантовохимических расчетах используются приближенные методы. Среди них в 80- х годах наиболее широкое распространение получил метод Хартри - Фока, или метод самосогласованного поля (ССП). В этом методе полагается, что каждый электрон движется в поле атомных ядер, положение которых фиксировано в пространстве, и в эффективном (усредненном) поле других электронов.
Основной недостаток метода Хартри – Фока - вероятность найти электрон в некоторой точке пространства не зависит от местонахождения других электронов, распределение в пространстве которых задано одноэлектронными волновыми функциями. В результате двум электронам с одинаковыми спинами не запрещено занимать одну и ту же точку пространства. В действительности электроны с одинаковыми спинами стремятся избежать находится не только в одной точке пространства, но даже близко друг от друга. Пренебрежение этим эффектом, который принято называть электронной корреляцией, приводит к существенному завышению энергии взаимодействия электронов и, как следствие, завышению полной энергии молекулы.
1.1.3 Метод Хэнча
Основное содержание метода — эмпирическая модель биологической активности, основанная на линейной зависимости свободной энергии исследуемого процесса от физико - химических параметров соединения, рассматриваемых как независимые переменные. Поэтому метод Ханша также широко известен под наименованием «соотношения линейности свободной энергии». Метод основан на предположении о существовании корреляции между факторами, определяющими биологическую активность, и физико-химическими параметрами веществ в гомологических рядах химических соединений. Кроме того, оказывается, что все физико-химические факторы, связанные с транспортными свойствами и взаимодействиями активного центра, слагаются из трех составляющих — гидрофобной, электронной и стерической. Вклад каждой из этих составляющих характеризуется с помощью соответствующих констант заместителя, описывающих различие в свойствах между первым членом гомологического ряда и рассматриваемым соединением. Гидрофобность соединения описывается логарифмом коэффициента распределения соединения между водой и фазой, моделирующей липид, обычно нормальным октиловым спиртом.
В 1964 г. Ханш и Фуджита [10] путем сочетания двух гипотез с уравнением Гаммета [11] вывели соотношение, нашедшее наиболее широкое применение в исследованиях связи между структурой и активностью. Они постулировали, что скорость биологического отклика (БО) является произведением трех множителей. В их число входят: А — вероятность того, что биологически активная молекула достигнет в течение заданного интервала времени рецептора, С — молярная концентрация биологически активного вещества и КХ — скорость реакции биологически активного соединения с рецептором. Произведение параметров А и С получило наименование «эффективной концентрации» и представляет собой концентрацию вещества в зоне, прилегающей к рецептору.
Некоторые другие параметры
В исследованиях, связанных с соотношением линейности свободной энергии, был применен целый ряд других физико - химических параметров. Многие из этих параметров непосредственно дают информацию о молекулярной структуре соединения. К ним относятся, например, молекулярный вес и количество атомов определенного вида. В ряде исследований в качестве параметра использовалась молекулярная рефракция, характеризующая поляризуемость молекулы [12]. В последнем обзоре Ханша рассмотрены параметры различных типов, спектроскопические константы и индикаторные переменные. Индикаторные параметры - это параметры, указывающие на наличие в молекуле некоторой субструктурной группы [13]. Проводились также исследования, в которых экспериментальные параметры использовались вместе с субструктурными и индикаторными [14].
1.1.4 Регрессионный анализ и статистические параметры
Обычно данные биологических испытаний бывают определены со значительно меньшей точностью, чем физико-химические характеристики. Поэтому биологические данные выбирают в качестве зависимых, а физико-химические параметры - в качестве независимых переменных регрессии. Далее выполняется процедура метода наименьших квадратов, и рассчитываются статистические параметры, на основании которых можно судить об адекватности предложенной модели. Обычно регрессионный анализ осуществляется путем последовательного добавления независимых переменных и одновременной проверки характера изменения статистических критериев (метод прямого отбора). Цель такой процедуры — отыскание минимального числа переменных, достаточного для построения статистически значимой корреляционной зависимости. Автоматизированный вариант такой программы приведен в работе [15]. Метод работает таким образом, что на каждом шаге добавляется та переменная, которая обеспечивает максимальное улучшение качества модели. И так до тех пор, пока добавление новой переменной не перестанет давать существенного улучшения точности описания экспериментальной зависимости. Аналогичным образом на каждом шаге проводится проверка каждой переменной по отдельности и исключение ранее включенных в регрессию переменных. Вся процедура отбора переменных основывается на предположении, что переменные, идентифицированные по отдельности как наилучшие, и в совокупности будут образовывать наилучший набор переменных. Такое предположение не всегда оправдывается, особенно в тех случаях, когда между переменными, имеется сильная связь.
1.1.5 Аддитивная модель Фри – Вильсона
В аддитивной модели предполагается, что биологический отклик соединения может быть представлен как сумма активностей заместителей плюс некая общая средняя активность.
Эта модель основана на предположении о том, что вклад данного заместителя, находящегося в структуре в данном положении, всегда одинаков независимо от того, в каком соединении присутствует рассматриваемый заместитель. Величины вкладов заместителей рассчитываются с помощью множественного линейного регрессионного анализа. Для построения линии регрессии необходима только информация о молекулярной структуре и биологической активности соединений, никакие физико-химические параметры не используются.
При анализе данных методом Фри - Вильсона для каждого соединения составляется линейное уравнение, а параметры рассчитываются методом наименьших квадратов. Здесь применяются те же статистические критерии, что и при анализе методом Ханша. Если рассчитанные статистические критерии являются удовлетворительными и тем самым обоснована применимость аддитивной схемы, то с помощью полученных таким образом параметров линейного соотношения можно восстановить величины биологической активности соединений, составляющих исходную выборку. При этом отдельные сильные отклонения от линейной зависимости могут быть сразу же идентифицированы. И наконец, наиболее важный результат состоит в том, что с помощью рассчитанных значений параметров можно предсказать активность соединений, образованных путем всевозможных сочетаний и перестановок исходных заместителей. Относительные вклады в биологическую активность различных заместителей, расположенных в соединении в различных положениях, могут быть упорядочены
Главный недостаток метода Фри — Вильсона заключается в том, что для описания всех заместителей требуется очень большое число переменных. К тому же иногда приходится иметь дело с вырожденными матрицами. Таким образом, при использовании метода Фри — Вильсона исследователю приходится выбирать одну из двух возможностей: либо испытывать большое количество производных, либо ограничивать количество заместителей и их положений в структуре. Результат выбора, очевидно, определяется спецификой конкретной задачи.
1.1.6 Метод Хюккеля, расширенный метод Хюккеля
Исторически метод, предложенный Эрихом Хюккелем в 1931 г., являлся первым полуэмпирическим квантово - химическим методом. В настоящее время он используется лишь для качественного объяснения свойств главным образом π - сопряженных молекул. Для количественных расчетов используется вариант данного метода, введенный в практику в 1961 г. Р. Хоффманом и получивший название расширенного метода Хюккеля. Он является простейшим, наиболее быстрым и вместе с тем наименее точным полуэмпирическим квантово-химическим методом. Его использование ограничивается в основном анализом структуры молекулярных орбиталей — определением их формы и последовательности.
Электрон - электронное взаимодействие в этом методе в явном виде не учитывается, диагональные элементы матрицы Н аппроксимируются потенциалами ионизации, взятыми с обратным знаком, а для недиагональных членов используется одно из приближений.
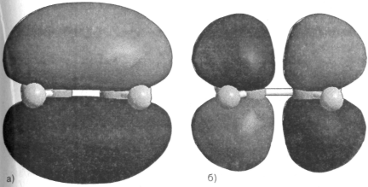
Рисунок 1.7.1. Вид молекулярных орбиталей HOMO (а) и LUMО (б) молекулы этилена, рассчитанных расширенным методом Хюккеля в программе HyperChem 7.0.
Подобный подход хорошо работает при расчете систем с относительно равномерным распределением заряда, например углеводородов, для которых он и был первоначально использован. Однако даже и в таких случаях бывают казусы. Например, в соответствии с предсказанием расчета, бензол должен распадаться на три молекулы ацетилена с выделением значительного количества теплоты. Что касается систем, содержащих гетероатомы, то для них более адекватным является интегративный расширенный метод Хюккеля. В этом методе уже учитывается зависимость гамильтониана от заряда на данном центре, причем зависимость полагается линейной.
1.2.1 Принципы распознавания образов
Одна из основных предпосылок методов конструирования лекарств — предположение о том, что соединения сходной структуры имеют сходные типы биологической активности. Очень трудно дать строгое определение понятия структурного сходства, о чем свидетельствует обилие и разнообразие параметров, используемых при выводе эмпирических соотношений, связывающих структуру соединений с их биологической активностью. До сих пор наиболее распространенным методом чтения координат и методом построения таких соотношений был регрессионный анализ. Целью этого подхода является построение эмпирических соотношений, связывающих различные сочетания физических, химических или структурных параметров с биологической реакцией соединения. Этот метод особенно эффективен при исследовании не слишком длинных гомологических рядов соединений.
Методам распознавания образов посвящено множество монографий [16]. Этот факт, несомненно, является отражением широкой применимости методов распознавания. Применение методов распознавания образов к химическим задачам началось в середине 1960-х годов в связи с масс-спектральными исследованиями. После этого аналогичные работы стали проводиться во многих других областях химии.
Одна из интересных особенностей этих методов заключается в том, что они могут иметь дело с многомерными данными, т. е. данными, в которых для представления каждого объекта используется более трех параметров. К тому же этими методами можно анализировать данные, полученные из разных источников, а также данные, связи между которыми имеют разрывный характер. При соответствующем подходе методы распознавания образов дают возможность установить критерий отбора из исходного множества данных тех параметров, которые существенны для описания исследуемых свойств. Далее с помощью этого набора наиболее значимых признаков могут быть получены указания о направлении дальнейших исследований.
1.2.2 Основные понятия методов распознавания образов
Прежде чем начать обсуждение методов распознавания образов, необходимо объяснить, что подразумевается под классификацией объекта или группы объектов. В процессе классификации формируется правило разделения группы объектов на несколько категорий, а при распознавании это классификационное правило используется для отнесения неизвестного объекта к одной из рассматриваемых категорий. Классификационное правило устанавливается в виде некоторой гипотезы, полученной в результате анализа экспериментальных данных. Проверка правильности этой гипотезы проводится путем ее испытания на объектах, не включенных в группу данных, с помощью которых было получено классификационное правило. В случае удачных испытаний гипотеза считается правильной. Процесс классификации заключается не только в выработке классификационного правила и его дальнейшего применения для распознавания. Ниже на простом примере будут продемонстрированы основные особенности задачи распознавания образов.
В качестве примера построения классификационного правила рассмотрим следующую воображаемую задачу. Предположим, что мы хотим автоматизировать процесс идентификации аномальных клеток при анализе крови в клинической лаборатории. Попробуем составить опытный проект оптической воспринимающей системы, способной отличить лейкимические клетки от здоровых на основе оптической проницаемости (рис. 2.1.1). Будем считать, что если прозрачность клетки превосходит некоторый уровень Хо, то она относится к лейкемическим клеткам.
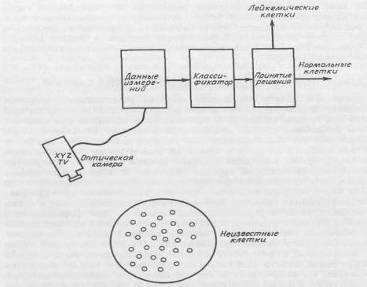
Рисунок 2.1.1 Схема оптической системы распознавания образов
Поскольку надежность такой классификации слишком низка, необходимо искать дополнительные признаки, которые могли бы оказаться полезными при различении разных типов клеток. Предположим, что лейкимические клетки имеют более ярко выраженную клеточную структуру, чем нормальные. В этом случае можно настроить камеру на измерение контрастности образцов и таким образом получить характеристику структурированности для каждой клетки эталонного набора образцов. В результате получим двумерную диаграмму, показанную на рис. 2.1.2
Цель методов отбора признаков — добиться наибольшего эффекта наименьшим числом признаков. Сокращение количества необходимых признаков облегчает процедуру классификации и в некоторых случаях увеличивает надежность результатов.
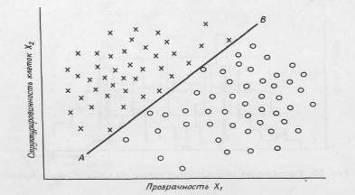
Рисунок 2.1.2 Разделение образов клеток на два класса в пространстве двух признаков — структурированности и прозрачности клеток.
Вся процедура распознавания образов складывается из трех последовательных операций: измерения, предварительной обработки и классификации. В результате применения этих операций последовательно формируются пространство измерений, пространство признаков и классификационное правило. Разделение всей процедуры распознавания образов на три стадии является несколько условным, поскольку приемы, используемые в одной из стадий, часто с успехом могут применяться и на других этапах обработки.
Предварительная обработка
С помощью методов предварительной обработки проводится преобразование исходных данных. К методам предварительной обработки относятся: масштабирование, нормализация, преобразования кластеризации, отбор признаков, многомерный скейлинг и нелинейное отображение.
Масштабирование и нормализация
Для преобразования данных, полученных разными датчиками, к виду, удобному для обработки, необходимо выбрать масштаб и выполнить нормализацию. Эти преобразования особенно важны, когда данные получены из разных источников. В этом случае они могут отличаться на несколько порядков величины, так что большие по величине дескрипторы будут подавлять малые. Этот недостаток может быть устранен путем автоматического выбора масштаба [17].
После преобразования масштаба желательно таким образом преобразовать данные, чтобы измерения, дающие больший вклад в кластеризацию, имели соответственно большие веса. Одним из простейших методов такого преобразования является метод дисперсионного взвешивания.
Хотя процедуры типа масштабирования могут уменьшить эффект разнородности исходных данных, а в методе дисперсионного взвешивания признаки получают веса, соответствующие их вкладу в кластеризацию, обе эти операции изменяют исходные данные одинаково.
Одним из недостатков методов предварительной обработки данных является то, что они учитывают все признаки, в том числе и те, которые могут не иметь отношения к рассматриваемой классификационной задаче. В результате возможно попадание в весьма неблагоприятную ситуацию, особенно в том случае, если несущественные признаки будут увеличивать ошибку процедуры классификации, не говоря уже о сложности и стоимости этих преобразований. Поскольку не все признаки существенны для решения рассматриваемой задачи, необходимо найти метод уменьшения их количества. Такой метод называется отбором признаков.
В результате выполнения этих преобразований мы переходим в новое пространство, в котором интересующий нас класс имеет минимальное внутриклассовое расстояние, а дисперсионная матрица выборки данных диагональная. Признаки, имеющие наименьшие значения дисперсии (диагональные элементы дисперсионной матрицы), считаются наиболее существенными для кластеризации. «Оптимальное» подмножество данных формируется из n признаков, имеющих наименьшие значения дисперсии.
Существуют еще несколько методов отбора наиболее информативных признаков. Такие критерии, как дивергенция помогают выделить наиболее существенные дескрипторы. Некоторые из этих методов основаны на гипотезе о виде распределения данных. Если такая гипотеза ошибочна, то результаты статистического анализа могут оказаться ненадежными. Еще одно затруднение заключается в том, что для выбора наилучшего набора дескрипторов должны быть проверены все возможные комбинации исходного набора дескрипторов. Такая проверка практически трудноосуществима в случае наборов признаков, объем которых n превышает 20, поскольку число вычислительных итераций возрастает как n!. Это приводит к дальнейшему снижению ценности рассматриваемых процедур. Требуются такие методы отбора признаков, которые, с одной стороны, были бы близки к оптимальным, а, с другой, не были бы сопряжены с большими объемами вычислений.
Часто необходимые сведения могут быть получены с помощью значительно более простых методов. Одним из таких методов является оценка прогнозирующей способности отдельных признаков. Прогнозирующие способности отдельных признаков могут быть рассчитаны с помощью следующего алгоритма:
1. Значения дескрипторов упорядочиваются по возрастанию.
2. Начиная с наименьшего значения, отмечают количество элементов на класс, превышающее и не достигающее этого значения.
3. Выбирают следующее по величине значение дескриптора и повторяют расчеты до тех пор, пока не будут перебраны все значения данного дескриптора.
4. Отмечают наибольший процент правильных предсказаний для всей выборки и для каждого класса.
При отборе отдельных признаков полезно сопоставить значения различных статистических характеристик системы. Так, для каждого класса без труда могут быть рассчитаны выборочное среднее, стандартное отклонение, наибольшее значение, наименьшее значение и общее количество отличных от нуля значений. Таким образом, можно составить представление об информативности анализируемых данных, а также решить вопрос о том, оправдано ли включение в систему данного дескриптора.
Еще одним полезным критерием является коэффициент корреляции. Сильно коррелированные дескрипторы могут содержать в сущности одну и ту же информацию. Если несколько дескрипторов сильно коррелированны, то можно оставить какой-либо один из них при условии, что после такого отбора общее количество информации не изменится.
Многомерный скейлинг и нелинейное отображение
Очень часто рассматриваемое преобразование приводит к тому, что множества векторов-образов, не пересекавшиеся в исходном пространстве, начинают пересекаться в пространстве меньшей размерности. Этот недостаток вызывает затруднения при объяснении структуры данных. Его можно преодолеть с помощью других, нелинейных методов понижения размерности.
К ним относятся методы нелинейного отображения и многомерного скейлинга. Основная идея заключается в отыскании такой проекции в дву- или трехмерном пространстве, которая походила бы на исходное изображение. Можно использовать различные критерии сходства, однако чаще всего для этой цели используют расстояние. Обычно расстояние измеряют в евклидовой метрике, но в случае необходимости можно применить и другие метрики. Ошибка такого преобразования будет измеряться разностью расстояний в новом и старом представлениях.
Удобно описывать разность между новым и старым расстояниями с помощью такой функции критерия, которая была бы инвариантной по отношению к искажениям конфигурационных многогранников, а также к растяжениям векторов.
Помимо всего прочего многомерный скейлинг дает удобный метод визуального представления структуры данных. Это часто помогает подобрать наиболее подходящий к данному случаю метод классификации. Сфера применения методов скейлинга не ограничивается только предварительной обработкой. Если при нелинейном отображении не возникает существенных искажений исходных данных, классификация может быть проведена самим исследователем путем визуального анализа отображений на пространство низкой размерности.
Классификация
Представление о кластеризации объектов в пространстве информативных измерений является центральным в приложениях методов распознавания образов. Нахождение такого преобразования, с помощью которого можно кластеризовать исследуемую выборку и в результате получить классы объектов, обладающих заданным свойством, является общей целью процедур измерения, предварительной обработки и априорного отбора признаков. По существу, распознавание образов является методом выявления сходства между исследуемыми объектами. В результате классификации отыскиваются некоторые соотношения, характеризующие это сходство. Существует много различных методов классификации, однако в фармакологических приложениях преимущественно используются непараметрические методы. Для понимания основ непараметрических методов необходимо небольшое введение в теорию параметрических методов.
Параметрические методы классификации основаны на байесовской статистике. Эти методы формируют классификационное правило непосредственно из вероятностного распределения данных. Вид вероятностного распределения данных зависит от типа и числа датчиков, методов предварительной обработки и отбора признаков. Цель классификации заключается в максимальном увеличении доли правильных классификаций путем построения функции, определяющей границы между различными классами.
Классификатор может быть построен непосредственно из формулы Байеса
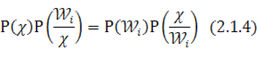
В этом соотношении X - вектор-образ, компоненты которого получены в результате работы различных датчиков. Численные значения этих компонент определяют распределение данных в N-мерном пространстве. Функция Р (Х) описывает распределение данных независимо от того, к какому классу они принадлежат. Р (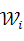 ) — вероятность наблюдения класса Wi. Р(W/X) - условная вероятность того, что вектор X принадлежит классу Wi. P(X/Wi) — условная вероятность того, что из класса Wi будет выбран объект, описываемый вектором-образом X. ) — вероятность наблюдения класса Wi. Р(W/X) - условная вероятность того, что вектор X принадлежит классу Wi. P(X/Wi) — условная вероятность того, что из класса Wi будет выбран объект, описываемый вектором-образом X.
1.2.3 Методы кластеризации
Понятие о кластеризации - одно из наиболее привлекательных в классификационной задаче. Этот подход естественным образом возникает из геометрической интерпретации задачи. Смысл метода кластеризации ясен из приведенного выше примера, в котором мы искали границу, отделяющую кластер нормальных клеток от кластера аномальных клеток. Поскольку в этой задаче мы имели дело с системой низкой размерности, то достаточно было ограничиться визуальными методами построения разделяющей поверхности. Следовательно, необходимо разработать систематический подход, позволяющий дать более строгое определение кластера.
Есть несколько алгоритмов разделения множества исходных данных на кластеры. В большинстве из этих алгоритмов при выполнении кластеризации в качестве меры близости объектов используются различные способы определения расстояний. Использование расстояния в качестве меры близости является естественным, если учесть, что исследуемые объекты изображаются точками в евклидовом пространстве. Однако критерии, основанные на том или ином способе определения расстояния, являются только одним из возможных способов определения кластеров. Хартиган [18] указал шесть типов алгоритмов кластеризации, отличающихся друг от друга способами выделения кластеров.
1.Сортировка
Объекты разделяются на кластеры в соответствии со значениями, которые принимает какой-либо существенный признак, характеризующий объекты. Затем внутри выделенных таким образом кластеров проводится дальнейшая сортировка путем анализа значений другого признака и т. д.
2.Перегруппировка
Задается некоторое начальное распределение объектов по кластерам. Далее объекты перемещают из одного кластера в другой в соответствии с каким-либо критерием, например величиной стандартного отклонения для данного кластера. Алгоритмы перегруппировки отличаются высокой скоростью, однако конечный результат иногда зависит от вида начального распределения.
3. Объединение
Сначала каждый объект исходной выборки данных выделяется в отдельный кластер. Далее отыскивается пара кластеров с наименьшим межкластерным расстоянием и объединяется в один кластер большего размера. Этот процесс продолжают до тех пор, пока не будет выполняться некоторое условие оптимальности или все объекты не окажутся в одном кластере. Для больших выборок, включающих более 1000 элементов, этот алгоритм неэкономичен, и определение оптимальных условий требует привлечения некоторых аппроксимаций.
4. Разбиение
Алгоритмы разбиения полностью противоположны алгоритмам объединения. В этих алгоритмах исходная выборка данных последовательно разбивается на все более мелкие кластеры в соответствии с некоторыми правилами (минимальный или максимальный размер, стандартное отклонение и т. д.). Трудности, возникающие при реализации этих алгоритмов, обычно связаны с выбором формы функций разбиения.
5. Добавление
Эти алгоритмы работают путем добавления элементов выборки в уже существующие кластеры. Ограниченность этих алгоритмов очевидна.
6. Поиск
Алгоритмы поиска обычно применяются к тем системам, для которых в результате математического анализа исключены многие из возможных способов разбиения на кластеры. С помощью этих алгоритмов производится такая оптимальная кластеризация системы, которая приводит к минимуму функции ошибок.
Существует много различных алгоритмов, однако ни один из них не приспособлен для решения любой из возникающих задач. Некоторые алгоритмы, например алгоритм ISODATA Болла и Холла [19,20] может осуществлять процедуры добавления, поиска, объединения и разбиения. Такие алгоритмы имеют более широкую область применения, однако ни один из них не является универсальным. К тому же многие алгоритмы являются эвристическими по своей природе, и поэтому успех их реализации, в конечном счете, зависит от мастерства исследователя. И наконец, последний недостаток методов кластеризации заключается в том, что иногда возникают трудности с отнесением неизвестного объекта к одному из уже имеющихся классов.
Несмотря на недостатки, методы кластеризации могут оказаться полезными для упорядочения систем, которые на первый взгляд кажутся совершенно неупорядоченными. Отметим также, что методы кластеризации необязательно требуют предварительной группировки объектов исследуемой выборки на классы. Алгоритмы кластеризации могут использоваться для выделения классов в выборках, способ классификации которых неочевиден. Как показано выше, алгоритмы кластеризации, основанные на различных способах определения расстояния, могут использоваться для расчета критериев подобия, для выделения существенных признаков и для преобразования исходных данных к виду, более удобному для дискриминантного анализа.
Знание известных биологически активных соединений и аналитические возможности даже самого лучшего из химиков - ограничены, и поэтому помощь специальной компьютерной системы в получении оценок по возможным видам биологической активности для различных классов соединений была бы полезной. Идея создания компьютерной системы прогноза биологической активности, на первый взгляд, выглядит достаточно просто: нужно собрать всю известную информацию о биологически активных соединениях, создать на этой основе обучающую выборку, провести анализ связей "структура-активность" для веществ из обучающей выборки и построить соответствующие зависимости. "Подставив" в эти зависимости данные о структуре нового вещества, можно получить в результате оценку его биологической активности.
Правда, традиционные подходы к анализу количественных соотношений "структура-активность" (КССА) применимы к соединениям одного и того же химического класса и, как правило, оперируют с одним видом биологической активности. Можно ли разработать подобные методы для веществ, гетерогенных как по химической структуре, так и по проявляемому ими биологическому действию?
Предложение предсказывать подобным образом спектр биологической активности вещества было впервые высказано в начале 70-х годов к.х.н. В.В. Авидоном c сотрудниками, работавшими тогда в НИИ по биологическим испытаниям химических соединений. В.В. Авидоном, совместно с к.х.н. В.Г. Блиновой, к.м.н. Е.М. Михайловским, Р.К. Казарян, к.ф.-м.н. В.С. Ароловичем и др., были разработаны оригинальные языки описания химической структуры, Тезаурус (структурированный словник) по биологической активности химических соединений, математические методы установления зависимостей "структура-активность" и прогноза свойств новых веществ; создан банк данных по биологически активным соединениям (обучающая выборка). На этой основе были осуществлены первые эксперименты по прогнозированию спектра биологической активности по структурной формуле вещества.
За истекшее двадцатилетие методы, первоначально предложенные для прогноза спектра биологической активности, претерпели существенные изменения. Эти изменения базируются как на теоретическом анализе методики прогнозирования, так и на имеющемся опыте ее применения для поиска веществ с требуемыми свойствами.
Современная версия компьютерной системы предсказания спектра биологической активности PASS C&T (Prediction of Activity Spectra for Substances: Complex & Training) реализована в 1998 году. Она включает в себя обучающую выборку, содержащую более 30000 биологически активных веществ с известной биологической активностью, и охватывает более 400 фармакологических эффектов, механизмов действия, а также мутагенность, канцерогенность, тератогенность и эмбриотоксичность.
Математический подход, используемый в PASS C&T, выбран Д.А. Филимоновым в результате сравнительного анализа 300 различных методов. Показано, что средняя точность прогноза с помощью PASS C&T при скользящем контроле с поочередным исключением по одному соединению из обучающей выборки составляет около 84%.
Результаты прогноза выдаются либо в виде текстового файла, который может в дальнейшем обрабатываться с помощью различных текстовых процессоров, либо в виде SDF файла, который может импортироваться в ISIS/Base и добавляться к имеющейся в базе данных информации о веществах. Далее обработка результатов прогноза осуществляется стандартными программными средствами, имеющимися в ISIS/Base.
Биологическая активность описывается в PASS C&T качественным образом ("да"/"нет"). Выдаваемые результаты прогноза помимо названий активности включают в себя оценки вероятностей наличия (Pa) и отсутствия каждой активности (Pi), имеющие значения от 0 до 1. Поскольку эти вероятности рассчитываются независимо, их сумма не равна единице.
Пример предсказания спектра биологической активности для препарата талидомид приведен ниже. Как видно из рисунка, известные для данного вещества виды активности (анксиолитическая, седативная, снотворная, тератогенная, модулятор цитокинов, ингибитор ангиогенеза, антагонист фактора некроза опухоли) содержатся в прогнозируемом спектре активности. Помимо этого, прогнозируется также ряд дополнительных видов активности – сердечно - сосудистый аналептик, антагонист нейрокинина, ингибитор кальпаина, и другие - которые указывают перспективные направления дальнейшего тестирования данного препарата.
Необходимо подчеркнуть, что для эффективного использования данные компьютерного прогноза должны рассматриваться специалистами с учетом имеющейся дополнительной информации.
Так, если целью исследования является поиск базовых структур лекарств, обладающих существенной, целесообразно отбирать из массива доступных веществ не те структуры, для которых величина Pa близка к единице (они могут оказаться близкими аналогами известных препаратов), а соединения с Pa<0.7. Риск получения отрицательного результата в эксперименте тем больше, чем меньше величина Pa, однако и новизна такой структуры (при подтверждении прогноза в эксперименте) будет более высокой.
Наоборот, если поставлена цель поиска близкого аналога известного препарата, то из массива имеющихся образцов следует отобрать вещества с наибольшими значениями Pa.
Кроме того, если, наряду с основным действием, известен перечень нежелательных побочных эффектов, то при отборе перспективных для исследований соединений можно руководствоваться комбинированным критерием:
- наличие в прогнозируемом спектре требуемых эффектов/механизмов;
- отсутствие нежелательных эффектов/механизмов.
Естественно, что при рассмотрении всего списка, включающего свыше 400 прогнозируемых видов активности, можно составить большое количество комбинаций из требуемых и нежелательных эффектов. Для их анализа сотрудник Лаборатории структурно-функционального конструирования лекарств НИИ Биомедхимии РАМН А.А. Лагунин разработал специальную компьютерную систему интерпретации спектров биологической активности веществ IBIAC, основанную на знаниях об известных взаимосвязях между фармакологическими эффектами и механизмом действия биологически активных веществ (более 2000 терминов, описывающих биологическую активность). С использованием системы IBIAC генерация перечня эффектов, соответствующих определенному механизму действия и, наоборот, списка вероятных механизмов, ответственных за проявление определенного эффекта, осуществляется автоматически.
Поскольку прогноз спектра биологической активности осуществляется на основе структурной формулы химического соединения, он может быть выполнен уже на этапе планирования синтеза. В итоге будут синтезированы лишь некоторые из теоретически возможных производных, в наибольшей степени удовлетворяющие критериям задачи.
Необходимо отметить, что прогноз спектра биологической активности возможен для низкомолекулярных органических соединений, структура которых не отличается принципиально от веществ обучающей выборки. Не имеет смысла прогноз для синтетических и биополимеров, для неорганических веществ и т.п.
Другое ограничение определяется необходимостью наличия не менее 5 веществ с известной активностью для формирования обучающей выборки. Очевидно, что в случае принципиально новых мишеней действия лекарственных препаратов, для которых имеются данные только об 1-2 лигандах, предсказание биологической активности таким методом не может быть реализовано.
Химическая структура и часть прогнозируемого спектра биологической активности для препарата талидомид (жирным шрифтом выделены активности, известные из эксперимента).
PASS CT 1.11 - Prediction of Activity Spectra for Substances
Copyright (c) 1998 V.V.Poroikov, D.A.Filimonov & Associates
Chemical Structure File: thalido.mol, <ACTIVITY_PREDICTION>
24 Substructure descriptors; 0 new, 84 Possible activities.
Pa Pi Activity
0.781 0.006 Cytokine modulator
0.713 0.019 Sedative
0.678 0.030 Cardiovascular analeptic
0.656 0.015 Angiogenesis inhibitor
0.439 0.007 Neurokinin antagonist
0.435 0.008 Calpain inhibitor
0.433 0.009 Oxytocin antagonist
0.443 0.024 Chemoprotective
0.421 0.011 Tumour necrosis factor antagonist
0.398 0.007 Hypnotic
0.439 0.050 NMDA agonist
0.407 0.028 Bronchodilator
0.430 0.059 Psychotropic
0.417 0.054 Anxiolytic
0.370 0.007 Protein kinase C inhibitor
0.428 0.068 Anticonvulsant
0.421 0.062 Teratogen
0.361 0.008 Antidiabetic symptomatic
0.377 0.035 Cardioprotectant
0.336 0.012 Benzodiazepine agonist partial
0.362 0.052 Spasmolytic, urinary
0.364 0.060 Analeptic
0.360 0.060 Nootropic
0.305 0.008 Uterine Relaxant
0.375 0.086 Septic shock treatment
0.385 0.102 Platelet adhesion inhibitor
В случае существенной по отношению к соединениям обучающей выборки новизны химической структуры прогнозируемого вещества (более 3-х дескрипторов ни разу не встретились в обучающей выборке) результаты прогноза могут иметь значительную погрешность. В этом случае целесообразно протестировать вещество на требуемые виды активности независимо от результатов прогноза, так как результатом может оказаться принципиально новая базовая структура.
В некоторых случаях вещество прогнозируется одновременно как агонист и антагонист (стимулятор и блокатор, активатор и ингибитор) по отношению к одним и тем же рецепторам (ферментам и т.п.). Это означает, что система не может дифференцировать внутреннюю активность вещества, а лишь указывает на его способность к связыванию с данным рецептором (ферментом).
И, наконец, необходимо иметь в виду, что система PASS C&T не может предсказать, станет ли конкретное вещество лекарственным препаратом, поскольку это будет зависеть также от многих других факторов (сравнительной оценки безопасности и клинической эффективности; наличия необходимых для разработки и внедрения инвестиций, и т.д.). Прогноз, однако, может помочь определить, какие тесты наиболее адекватны для изучения биологической активности конкретного химического вещества, и какие вещества из имеющихся в распоряжении исследователя наиболее вероятно проявят требуемые эффекты. [19]
1.3 Вывод
В этом и предыдущем разделах было дано краткое описание использовавшихся и используемых квантовохимических методов. Более детальное знакомство с ними практически не требуется для решения практических задач. Это связано с тем, что на основе анализа приближений, сделанных при разработке того или иного квановохимического метода, как правило, не удается установить область его применения и очертить круг задач, которые можно решить с его помощью. К сожалению, многие квантовохимические методы, которые лучше обоснованы с теоретической точки зрения, на практике дают плохие результаты и поэтому не применяются, а более грубые модели с удачно подобранными параметрами широко используются. Это связано с тем, что в любом квантовохимическом методе сделано достаточно много различных приближений. В некоторых методах ошибки, к которым приводят эти приближения, частично компенсируют друг друга и в результате получается хорошее согласие с экспериментом. Сказать заранее, будет или не будет иметь место такая компенсация нельзя, поэтому выяснить область применения и охарактеризовать точность конкретного метода можно лишь на основе численного эксперимента и систематизации опубликованного расчетного материала.
2.1 Квантовохимические методы расчета
Данные статистического анализа результатов квантовохимических расчетов геометрических параметров стабильных органических молекул небольшого размера, содержащих одинарные и кратные связи, приведены в таблице 1.1 приложения А, показано, с какой точностью можно рассчитать геометрию молекул неэмпирическим методом и как меняются результаты расчетов в зависимости от выбора базиса. Обращает на себя внимание хорошее согласие с экспериментом, которое получается при использовании минимального и валентно - расщепленных базисов.
Сложнее обстоит дело с расчетом валентных углов. Если у молекулы нет неподеленных электронных пар, то расчет в валентно - расщепленном базисе приводит к хорошему согласию с экспериментом, но для расчета валентных углов в молекулах с неподеленными электронными парами в базис необходимо включить поляризационные орбитали.
Наряду с неэмпирическими методами для вычисления геометрии органических молекул широко используются и полуэмпирические методы. Среди них наиболее точные результаты для большинства типов соединений дают методы АМ1, МПДП и МЧПДП/3. Методом МПДП получается хорошее согласие с экспериментом практически для всех геометрических параметров молекул (см. табл. 1.2 приложение А).
2.1.1 Расчет потенциалов ионизации
Потенциалы ионизации органических молекул обычно вычисляют по теореме Купманса, которая связывает ПИ электрона с энергией хартри – фоковской орбитали исходной молекулы с замкнутой оболочкой. Для большинства соединений расчеты в этом приближении дают удовлетворительное согласие с экспериментальными вертикальными ПИ и поэтому широко используются для интерпретации данных фотоэлектронной спектроскопии. Кроме того, расчеты ПИ оп теореме Купманса используются для изучения реакционной способности некоторых органических соединений.
Наибольшее количество опубликованных расчетов ПИ выполнено методами МЧПДП/3 и МПДП. В таблице 1.3 приложения А приведены результаты расчетов ПИ методом МПДП.
Основное правило при расчете ПИ: если верхняя занятая молекулярная орбиталь у молекулы вырождена или почти вырождена, то механические деформации, которые снижают симметрию молекулы и снимают вырождение, приводят к уменьшению ее ПИ.
2.1.2 Расчет индексов реакционной способности
Энергию межмолекулярного взаимодействия при сближении реагентов можно условно разбить на вклады трех типов: кулоновские, орбитальные и стерические. Энергия кулоновского взаимодействия зависит от распределения электронной плотности или от зарядов на атомах реагентов. Поэтому для некоторых реакций удается найти корреляцию между зарядами на атомах и выходом конечных продуктов реакции. Так, нуклеофильные реагенты присоединяются преимущественно к атомам, на которых локализованы большие положительные заряды, а электрофильные наоборот, - к атомам, на которых локализованы большие отрицательные заряды.
Корреляции между выходом конечных продуктов реакции и зарядами на атомах широко используются для объяснения экспериментальных данных. Обычно при вычислении заряда на атоме в квантовой химии пользуются анализом электронных заселенностей, предложенным Малликеном. В этом приближении заряд на атоме вычисляется по следующей формуле:
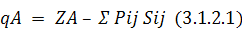
Здесь сумма берется по всем орбиталям i и j атома А; ZA – заряд ядра; Pij – матрица зарядов и порядков связей; Sij – матрица интегралов перекрывания. В полуэмпирических методах обычно пользуются упрощенной формулой:
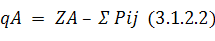
Величины зарядов на атомах, вычисленные в этом приближении, в неэмпирических расчетах очень сильно зависят от выбора базиса, а в полуэмпирических – от выбора метода. Заряды на атомах, вычисленные в разных базисах и разными методами, могут различаться в 1,5 – 2 раза, но качественные результаты (знак и относительная величина заряда) обычно остаются одинаковыми. В неэмпирических расчетах заряды на атомах при расширении базиса обычно увеличиваются по абсолютной величине.
2.1.3 Вычисление теплот образования
Теплоты образования молекул являются фундаментальными термохимическими величинами. Однако их значение для многих органических соединений неизвестны, поэтому квантовохимические расчеты этих величин представляют большой интерес с точки зрения органической химии.
Параметры полуэмпирических методов МЧПДП/3 и МПДП подобраны так, чтобы наилучшим образом воспроизвести экспериментальные теплоты образования органических соединений при нормальных условиях. Средняя ошибка при вычислении теплот образования молекул методом МЧПДП/3 составляет 38 кДж/моль, а методом МПДП – 25 кДж/моль.
Сложнее вычислить теплоты образования и теплоты атомизации молекул неэмпирическими методами. Даже для небольших молекул неэмпирический расчет в базисе 6-31ГФ* приводит к ошибкам в теплотах образования, превышающим 100 кДж/моль. Это связано с неполнотой использованного базиса и неучетом энергии электронной корреляции. С увеличением размера молекулы ошибки в неэмпирически вычисленных теплотах образования хотя и возрастают, но в значительной мере носят систематический характер. Поэтому их можно уменьшить с помощью коррекции конечных результатов по аддитивной схеме.
Расчеты с эмпирически подобранными значениями параметров показали, что с их помощью можно уменьшить ошибку при вычислении теплот образования органических молекул: при использовании базиса ОСТ-3ГФ – до 45 кДж/ моль, а при использовании базисов 3-21ГФ и 6-31ГФ* - соответственно до 29 и 25 кДж/моль (табл. 1.4 приложения А).
Такие поправки нельзя использовать при расчете поверхностей потенциальной энергии, так как в ходе реакции всегда образуются структуры, в которых одни связи частично разорваны, а другие частично образованы, и нельзя сказать, между какими атомами есть валентная связь, а между какими ее нет. Однако поправки такого типа можно использовать для расчета тепловых эффектов реакций и для решения многих других прикладных задач.
2.1.4 Расчет тепловых эффектов органических реакций
Величина теплового эффекта позволяет оценить термодинамическую возможность протекания химической реакции или отдельной элементарной стадии. В общем случае теплота реакции не коррелирует с ее скоростью. Поэтому данные о тепловых эффектах широко применяются для изучения реакционной способности органических соединений. Следует, однако, отметить, что расчет тепловых эффектов для квантовой химии является весьма сложной задачей, так как эту величину необходимо знать с точностью до 4 кДж/моль (химическая точность).
Из полуэмпирических методов наиболее широко используются схему МЧПДП/3 и МПДП, причем метод МПДП дает более точные результаты. В таблице 1.6 приложения А приведены результаты расчетов этим методом тепловых эффектов некоторых реакций изомеризации. Из этих данных видно, что для некоторых реакций согласие теории с экспериментом хорошее, но в отдельных случаях ошибка получается очень большой.
Результаты неэмпирических расчетов тепловых эффектов органических реакций очень сильно зависят от выбора метода. В валентно – расщепленных базисах для реакций с участием насыщенных молекул ошибки составляют около 40 кДж/моль, но, если в молекуле есть кратные связи или молекулы являются напряженными, ошибки обычно увеличиваются приблизительно в 2 раза.
Для получения наиболее полной информации о механизме реакции необходимо вычислить многомерную поверхность потенциальной энергии (ППЭ), то есть рассчитать зависимость полной энергии от координат атомных ядер. Наиболее интересными и важными при изучении механизма реакции являются так называемые стационарные точки на ППЭ. Под этим термином понимают минимумы и седловые точки на ППЭ (рисунок 3.1.5.1, 3.1.5.2) В стационарных точках производные полной энергии по всем независимым координатам равны нулю.
 
Рисунок 2.1.5.1 Стационарные точки
а — минимум локальный или глобальный;
б — седловая точка

Рисунок 2.1.5.2 Простейшая ППЭ
Темные кружки – исходные
реагенты и продукты реакции;
крестик — переходное состояние.
В точке минимума полной энергии матрица вторых производных имеет только положительные собственные значения, а в седловой точке – одно отрицательное собственное значение. Минимумы полной энергии соответствуют устойчивым структурам и интермедиатам, а седловые точки – переходным состояниям.
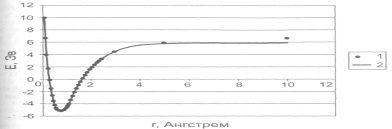
Рисунок 2.1.5.3. Зависимость потенциальной энергии молекулы водорода от расстояния между атомами: 1 — расчет полуэмпирическим методом РМЗ; 2 — аппроксимация потенциалом Морзе.
Типичный вид простейшей двумерной ППЭ показан на рисунке 2.1.5.2. Здесь минимумы соответствуют исходным реагентам и конечным продуктам реакции, а седловая точка – переходному состоянию. Минимумы на рисунке соединены пунктирной линией, которая проходит по дну долины на ППЭ через седловую точку. Эта линия показывает путь реакции в двумерном пространстве или траекторию движения реагентов в ходе реакции. Для большинства реакций ППЭ имеют более сложный вид.
В таблицах 1.7 и 1.8 приложения А сопоставлены данные расчета параметров переходных состояний для реакций, изображенных на схемах 1 - 5, методами МПДП и КМПДП (метод МПДП с учетом электронной корреляции), неэмпирическим методом в приближении Хартри – Фока без учета и с учетом электронной корреляции.
Схема I Схема II СхемaIII

Схема IV СхемaV
В таблицах неэмпирический расчет в приближении Хартри – Фока без учета электронной корреляции обозначен ХФ, с учетом электронной корреляции – КХФ. Для реакций, изображенных на схемах 1 – 3, расчеты с оптимизацией геометрии в приближении Хартри – Фока проведены в базисе 6-31ГФ*, для реакций, изображенных на схемах 4, 5, - в базисе 3-21ГФ или 4-31ГФ. Электронная корреляция учитывалась только при вычислении энергии активации.
Из этих данных видно, что геометрические параметры переходных состояний, вычисленные методами МПДП и КМПДП, находятся в хорошем согласии с данными неэмпирических расчетов без учета электронной корреляции.
Вопрос о влиянии электронной корреляции на геометрию переходных состояний был рассмотрен в работе Шредера [20]. В ней методом МПДП без учета и с учетом электронной корреляции была рассчитана геометрия переходных состояний для реакций, изображенных на схемах 1 – 5, и показана хорошая сходимость с экспериментом.
2.1.6 Силовые постоянные химических связей и частоты внутримолекулярных колебаний
Для расчета силовых постоянных довольно широко применяют как полуэмпирические, так и неэмпирические методы квантовой химии. В любом случае сначала оптимизируют геометрию, то есть определяют наиболее устойчивую конформацию, отвечающую минимуму полной энергии; затем вычисляют вторые производные полной энергии по естественным координатам, а при необходимости – кубичные и биквадратные члены.
При использовании минимального слейтеровского базиса согласие с экспериментом получается весьма посредственное. Для полуэмпирических методов характерно относительное занижение частот деформационных колебаний по сравнению с валентными. В связи с тем, что ошибки в большинстве случаев носят систематический характер, их удается значительно уменьшить введением эмпирически подобранных масштабных корректирующих множителей для определенных типов силовых постоянных или инкременентов, которые прибавляются к рассчитанным частотам.
Для расчетов методами МЧПДП/3 и МПДП Дьюар и Форд [23] подобрали систему инкрементов, специфичных для валентных, деформационных и торсионных колебаний определенных атомных групп или связей; на очень большом числе примеров продемонстрирована удовлетворительная точность результатов.
сульфаниламид квантовый химический органический молекула
Более логичным представляется корректирование значений силовых постоянных, и на этом пути достигнуты положительные результаты. В настоящее время используется несколько методик подбора корректирующих множителей. Наиболее распространенными являются следующие предложения:
1. Корректировка только диагональных силовых коэффициентов, а недиагональные оставлять без изменений.
2. Использование одного общего корректирующего множителя для всех недиагональных силовых постоянных.
Подбирать значения корректирующих множителей только для диагональных членов, а корректирующие множители для недиагональных коэффициентов вычислять как среднее геометрическое из соответствующих диагональных величин.
2.2 Вывод
В данной главе были рассмотрены возможности программы HyperChem для расчета геометрических и физико–химических параметров молекул и проведена сравнительная оценка используемых методов. Из приведенных выше данных видно, что наибольшей точностью обладают методы abinitio и АМ1. Этими методами и будет производиться расчет соединений сульфаниламидного ряда. Для сравнительной оценки также включен в расчет метод INDO.
В следующей главе будут представлены рассчитанные геометрические параметры молекул сульфаниламидного ряда и рассчитанная физиологическая активность этих соединений. Следует сказать, что вначале проводился расчет геометрии приведенных соединений, затем просчитанные соединения были проверены на наличие физиологической активности.
Глава 3 СУЛЬФАНИЛАМИДНЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
3.1 История открытия сульфаниламидов
Сульфаниламидными препаратами называются лекарственные вещества, содержащие сульфамидную группу, большей частью производные бензосульфамида (1). Простейшим из них является п – аминобензолсульфамид (2) сульфаниламид или амид сульфониловой кислоты. Он впервые синтезирован Гельмо в 1908 году среди других производных анилина. В 1909 году были сделаны попытки использования сульфаниламида в качестве диазосоставляющей азокрасителей (для шерсти).
 
1 2
В 1919 году был синтезирован производное сульфаниламида путем его диазотирования (3) и его последующего сочетания с дигидрокупреином (4), но обнаруженное противострептококковое действие было приписано купреновому ядру.
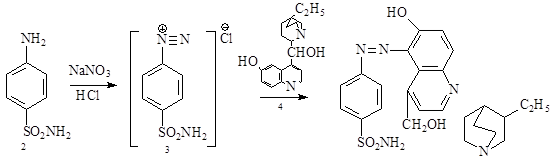
Клалер синтезировал несколько красителей этого типа, испытанных Домагком на проявление бактерицидных свойств, при этом было обнаружена эффективность действия их на белых мышей, зараженных вирулентным штаммом β – гемолитического стрептококка. Догмак установил ценные химиотерапевтические свойства сульфаниламидных азокрасителей, в том числе γ–амино-N- вторичноизопропилкарбинол-М-метилфенилсульфамида (5).

5
Выявленные бактерицидные свойства были впервые приписаны наличию сульфаниламидной группировки. Из синтезированных впоследствии более простых по структуре сульфаниламидных препаратов наибольшее внимание привлек сульфамид хризоидина (6), хлористоводородная соль, которого была названа пронтозилом.
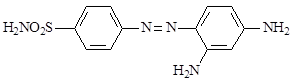
6
В СССР этот препарат синтезирован и внедрен в производство О.Ю. Магидсоном и М.В. Рубцовым в 1936 году под названием красного стрептоцида.
В отличие от незамещенного хризоидина, сульфамид оказался активным в отношении стрептококков invivo, но плохо растворялся в воде, что затрудняло его использование. Для увеличения растворимости сульфаниламидных красителей были синтезированы препараты, в которых азосоставляющая представляла сульфокислоты нафталинового ряда. Один из них был вскоре введен в медицину под названием растворимого пронтозила (7).
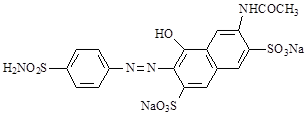
7
В СССР к этому времени было освоено производство красного растворимого стрептоцита (8) с азосоставляющей Н – кислотой.
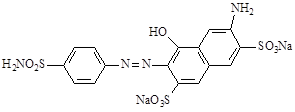
8
Получение пронтозилов явилось крупным событием в химиотерапии; впервые были получены вещества, пригодные для лечения различных септических процессов, вызываемых стрептококком, ранее часто кончавшихся летальным исходом.
Вскоре, однако, было установлено, что пронтозилы и сходные по структуре сульфаниламидные азокрасители не являются непосредственно противострептококковыми средствами и что проявлению химиотерапевтической активности таких красителей предшествует восстановление их в организме в сульфаниламиды:
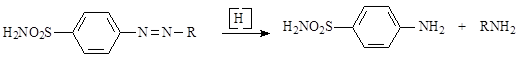
Образующийся одновременно с ним амин является либо излишним балластом, либо причиной токсического действия. Использованные впоследствии недиазотированные сульфаниламиды оказались более эффективными. Было выявлено, что в моче экспериментальных животных, подвергавшихся лечению сульфаниламидными азокрасителями, наряду с последними, выявлен сульфаниламид. Испытание последнего на больных стрептококковыми инфекциями показало высокие терапевтические свойства.
В СССР препарат был назван белым стрептоцидом. Ценные химикотерапевтические свойства сульфаниламида, обнаруженные спустя 27 лет после его открытия, побудили проверить ранее известные его производные. При изучении последних выявилось, что химиотерапевтическим эффектом обладают лишь производные пара - изомера. Ввиду специфического влияния сульфаниламидов, тесно связанного с ориентацией амино - и сульфамидной групп в их молекуле, для них принята следующая нумерация:
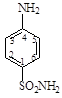
Изучение многочисленных соединений, в которых 1 – сульфамидная группа замещена на тиофенольную (9), сульфидную (10), дисульфидную (11), сульфоксидную (12) и сульфоновую (13) группы не привело к увеличению активности.
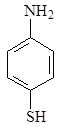 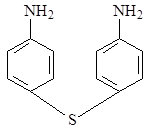 
9 10 11
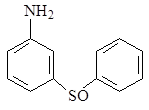 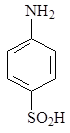
12 13
Испытание амидов сульфокислот различных ароматических и гетероциклических аминов, содержащих амино- и сульфамидную группы в параположении друг к другу, например амид нафталиновой кислоты (14), сульфамид амидопиридина (15), изохинолина (16) и других также не привело к созданию лекарственных препаратов, более активных, чем сульфаниламид.
14 15 16
В дальнейшем было выяснено, что сульфаниламиды не уничтожают болезнетворные микроорганизмы, а лишь тормозят их рост и развитие; такой эффект в отличие от действия дезинфицирующих веществ был назван бактериостатическим.
3.2 Физические свойства сульфаниламидов
Все сульфаниламиды — белые или слегка желтоватые порошки без запаха, некоторые — горького вкуса. Большинство из них плохо растворимы в воде, лучше — в разбавленных кислотах и водных растворах щелочей (кроме сульгина). Повышение температуры растворителя улучшает растворимость препаратов. Смесь двух или более сульфаниламидов растворяется несколько лучше, чем любой из ее компонентов в отдельности. Хорошей растворимостью обладает только сульфацил.
Сульфаниламиды амфотерны, они образуют соли с сильными щелочами (за исключением сульгина) и с сильными кислотами. Некоторые соли сульфаниламидов легко растворимы в воде, их можно применять для внутривенных инъекций, когда необходимо быстро создать высокую концентрацию препарата в крови и органах. В связи с тем, что натриевые солив водных растворах имеют сильную щелочную реакцию (рН 10,5—12,5), при подкожном и внутримышечном введении они оказывают сильное раздражающее действие. Инфильтрация места введения изотоническим раствором хлорида натрия может ослабить некроз тканей, а инфильтрация раствором новокаина значительно уменьшает болевую реакцию. По этой же причине неразведенные натриевые соли не следует давать внутрь.
В растворах сульфаниламиды диссоциируют на ионы. Фармакологическая активность связана с их константами диссоциации. Так, например, бактериостатическое действие сильнее выражено в щелочных растворах, так как в этих условиях больше образуется ионов. Хорошо диссоциируют норсульфазол, сульфацил, значительно хуже — стрептоцид. Соединения, более способные к кислотной диссоциации, лучше всасываются. Сульфаниламидные препараты хорошо растворимы в биологических жидкостях, в том числе в плазме крови.
3.3 Механизм действия сульфаниламидов
Препараты этой группы относятся к химиотерапевтическим средствам широкого антибактериального спектра действия, так как они подавляют жизнедеятельность многих видов бактерий: стрептококков, стафилококков, менингококков, гонококков, бактерий кишечно-тифозно-дизентерийной группы и многих других. Сульфаниламиды активны в отношении крупных вирусов (возбудителей трахомы, пахового лимфогранулематоза), кокцидий, плазмодий малярии и токсоплазм, актиномицет и т.д.
Сульфаниламидные препараты в небольших концентрациях задерживают рост и развитие бактерий, то есть действуют бактериостатически. Бактерицидное влияние они оказывают лишь при воздействии таких высоких концентраций, которые небезопасны для макроорганизма.
  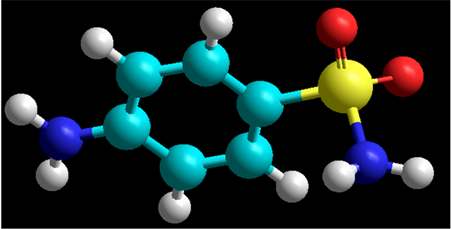
Рисунок 3.1.1 Реакционные центры сульфаниламида.
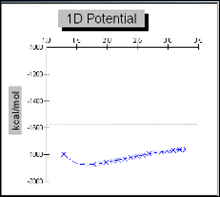
График 3.1.1 Поверхность потенциальной энергии для связи С-S в молекуле сульфаниламида

График 3.1.2 Поверхность потенциальной энергии для связи S-N в молекуле сульфаниламида
Важнейшая особенность сульфаниламидов — высокая активность in vivo при сравнительно более слабом действии in vitro. Под их воздействием микробы разбухают, перестают размножаться, продуцировать токсины, становятся более уязвимыми для защитных сил организма. Установлена избирательная способность отдельных препаратов в отношении определенных возбудителей инфекционных болезней. Так, норсульфазол и сульфазол более активны при стафилококковых инфекциях, стрептоцид. — при стрептококковых, а сульфапиридазин весьма эффективен при сепсисе, вызванном бактерией коли, сульфатиазол (17) в 70 – 80 раз активнее сульфаниламида, а сульфоидин (18) лишь в 8 раз.
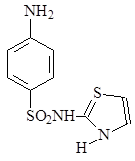 
17 18
Бактериостатический эффект зависит от химического строения препарата, степени и силы связывания с белками плазмы, реакции среды, константы диссоциации и других факторов. Большое значение имеет состояние нервной системы, защитных сил макроорганизма, которым принадлежит ведущая роль в. окончательной ликвидации инфекционного процесса.
В основе механизма действия сульфаниламидных препаратов лежит антагонизм между сульфаниламидами и парааминобензойной кислотой (ПАБК) В силу структурного сходства молекулы парааминобензойной кислоты и сульфаниламидов последние способны вытеснять ПАБК из ферментных систем микроорганизма. Сульфаниламиды нарушают процесс получения микробами необходимых для их развития "ростовых факторов" — фолиевой кислоты и других веществ, в молекулу которых входит ПАБК. Под действием препаратов в микробной клетке нарушается синтез метионина, пуриновых и пиримидиновых оснований, что в свою очередь приводит к нарушению синтеза нуклеиновых кислот и нуклеопротеидов.
Бактериостатическое действие сульфаниламидов проявляется только при определенной концентрации препаратов в окружающей микробов среде. Эта концентрация должна быть достаточна для предотвращения использования микроорганизмами парааминобензойной кислоты, содержащейся в тканях. Чем выше концентрация ПАБК, тем больше требуется сульфаниламидного препарата для наступления антимикробного эффекта. Установлено, что для нейтрализации одной части ПАБК требуется 1600 частей стрептоцида, 100 частей сульфазина и 36 частей норсульфазола.
Некоторые сульфаниламиды проявляют конкурентный антагонизм и в отношении других ферментных систем, в частности они нарушают процесс декарбоксилирования пировиноградной кислоты, окисления глюкозы
Механизм антимикробного действия сульфаниламидных препаратов определяется не только конкурентными взаимоотношениями между сульфаниламидами и парааминобензойной кислотой. Сульфаниламиды препятствуют синтезу дигидрофолиевой кислоты в микроорганизме из глютаминовой и парааминобензойной кислот. Белковые вещества (гной, мертвые ткани), содержащие большое количество ПАБК, а также некоторые лекарственные препараты, в молекулу которых входит остаток парааминобензойной кислоты (новокаин, анестезин), являются ингибиторами активности сульфаниламидов. В то же время присутствие мочевины повышает их бактериостатическую активность.
Микроорганизмы в процессе своего роста и развития синтезируют фолиевую кислоту, которая контролирует биосинтез аминокислот, пуриновых и пиримидиновых оснований. Структура нормальной фолиевой кислоты содержит фрагмент ПАБК. Сульфаниламиды, вследствие их структурной близости, способны аналогичным путем вступать во взаимодействие с таким – же коллоиднобелковым носителем. Образующийся при этом новый комплекс, в отличие от активного фермента, уже не обладает способностью стимулировать рост микроорганизмов.
Х – СО, фолиевая кислота
Х – SO2, псевдофолиевая кислота
ХR – COOH, SO2NH2
Воздействие малыми дозами или назначение сульфаниламидов с большими интервалами приводит к развитию приспособительной реакции у микробов, изменению пути образования нужных им для роста и размножения энзимных систем. Вследствие этого возникают сульфаниламидо - устойчивые расы микроорганизмов. Блокада ПАБК сульфаниламидами существенно не нарушает жизнедеятельности микробов.
Устойчивость микроорганизмов, приобретенная к одному сульфаниламидному препарату, распространяется и на другие препараты этой группы (полная перекрестная устойчивость). Приобретенная резистентность бактерий к сульфаниламидам, связанная с повышенной выработкой ими ПАБК, может быть генетически наследуемой.
Сульфаниламидные соединения обладают широким диапазоном действия на макроорганизм и должны рассматриваться как специфические нервные раздражители. Они снижают повышенную реактивность организма, оказывают жаропонижающий эффект. Сульфаниламидные препараты действуют противовоспалительно, вызывают угнетение процессов регенерации при местном применении; снижают активность нуклеофосфатазы печени, почек, селезенки, нарушают нормальные процессы ацетилирования, являясь специфическим ингибитором угольной ангидразы, уменьшают способность плазмы к связыванию углекислоты, тормозят газообмен, снижают активность других ферментных систем, стимулируют процесс фагоцитоза, повышают устойчивость организма к токсинам.
Благодаря сочетанию противоаллергических, антипиретических свойств с бактериостатическим действием сульфаниламиды можно использовать при различных заболеваниях, сопровождающихся воспалительными процессами. Воздействие их на микро - и макроорганизм дополняют друг друга, обеспечивая хорошо выраженный терапевтический эффект.
Сульфаниламидные препараты малотоксичны. Однако длительное применение их в завышенных дозах может привести к развитию токсических, эффектов. При недостаточной функции почек или при назначении больших доз препаратов могут возникать явления кристаллурии. Правильное назначение сульфаниламидов больным не вызывает побочных эффектов.
Большинство сульфаниламидов легко всасывается из ЖКХ (стрептоцид, норсульфазол, этазол, сульфазин, сульфадимезин, сульфапиридазин, сульфадиметоксин и др.) и быстро накапливается в крови, органах и тканях в бактериостатических концентрациях, проникает через гематоэнцефалический барьер. Основная масса препаратов всасывается в тонком отделе кишечника. Скорость всасывания зависит от степени кислотной диссоциации. Очень хорошо всасываются натриевые соли препаратов. Некоторые сульфаниламиды, такие, как фталазол, сульгин, фтазин, трудно всасываются, относительно долго находятся в кишечнике в высоких концентрациях и выделяются преимущественно с фекалиями, поэтому их применяют главным образом при заболеваниях ЖКХ.
В организме человека сульфаниламидные соединения, как и другие лекарственные вещества, подвергаются расщеплению, окислению, ацетилированию. Особенно большое значение для клинической практики имеет процесс ацетилирования. Он происходит главным образом в печени как за счет уксусной кислоты, поступающей извне, так и за счет кислоты, образующейся в организме из пировиноградной кислоты.
В здоровом организме степень ацетилирования несколько выше, чем в инфицированном. Кроме того, степень ацетилирования сульфаниламидов возрастает при их продолжительном применении, понижении диуреза, заболеваниях почек, сопровождающихся почечной недостаточностью.
Ацетилированные производные сульфаниламидов не действуют на микроорганизмы и значительно хуже растворяются в воде. Вследствие плохой растворимости, особенно в кислой моче, ацетопродукты выпадают в осадок с образованием конгломератов, закупоривающих просвет почечных канальцев с последующим нарушением диуреза.
В терапевтическом отношении особенно ценны препараты быстро всасывающиеся из желудочно-кишечного тракта и мед ленно выделяющиеся из организма. В зависимости от скорости элиминации сульфаниламидов из организма их подразделяю на три группы:
1) препараты быстрого действия (стрептоцид, норсульфазол этазол, сульфацил, уросульфан, сульфадимезин и др );
2) препараты средней продолжительности действия (сульфазин, метилсульфазин и др.),
3) препараты длительного и сверхдлительного действий (сульфапиридазин, сульфадиметоксин, сульфамонометоксин, сульфален и др). В приложении Б подробно рассмотрены сульфамиламидные лекарственные вещества.
Скорость выведения из организма в значительной мере определяет величину дозы и частоту приема препарата. Показателем скорости выведения служит величина Т50%, или T1/2, - период полувыведения, то есть время снижения максимальной концентрации в крови в 2 раза. У препаратов короткого действия T1/2 менее 8 ч, средней продолжительности действия - 8—16 ч и у препаратов длительного и сверхдлительного действия — 24—56 ч и более.
Сульфаниламидные препараты длительного действия хорошо всасываются из ЖКХ, создавая высокие концентрации в крови, а самое главное — длительна задерживаются в организме. Их можно назначать в значительно меньших дозах и через более продолжительные интервалы между введениями. Указанные свойства значительно расширяют перспективу применения соединений этой группы в ветеринарной практике.
Сульфаниламиды показаны для лечения инфекционных заболеваний дыхательных путей (трахеита, бронхита, пневмоний, гнойных плевритов и др.), желудочно – кишечных заболеваний различной этиологии (диспепсии, кокцидиоза, дизентерии, гастроэнтероколитов и т. д.); рожистого воспаления, мыта, послеродового сепсиса, пиелита, цистита, сальмонеллеза, колибактериоза, пастереллеза, раневых и других инфекций, вызванных микроорганизмами, чувствительными к сульфаниламидам.
Противопоказаний к применению сульфаниламидных препаратов больным немного: общий ацидоз, заболевания кроветворной системы, гепатиты.
3.4 Синтез сульфаниламидов
Исходным продуктом синтеза препаратов является анилин. Аминогруппу анилина замещают остатком уксусной кислоты и проводят сульфохлорирование. Далее проводят замену галогена в хлорангруппе замещенной сульфаниловой кислоты на аминогруппу и гидролизом удаляют защитную группу [24]:

Ниже представлена схема синтеза четырех лекарственных веществ сульфаниламидной серии: сульгина (19), сульфадимезина (20), норсульфазола (21) и сульфафуразола (22), получаемых типичной конденсацией ароматического сульфанилхлорида с различными аминными компонентами:
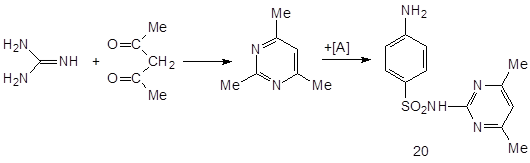
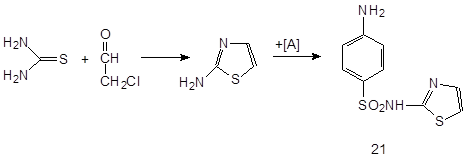
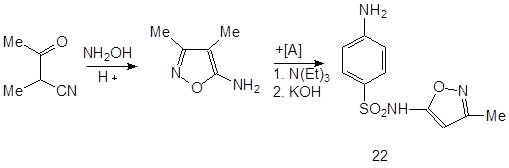
Ниже в данной работе будут представлены геометрические и физико - химические параметры данных молекул рассчитанные в программе HyperChem и проявляемая ими физиологическая активность, рассчитанная в программе PASSC&T.
3.5 Расчитанные параметры молекул
3.5.1 Сульфаниламид
В приложении В представлена молекула сульфаниламида (стрептоцита белого) с рассчитанными геометрическими параметрами молекулы и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность сульфаниламида в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как агонист Допамина Д4 (0,941), кардиовезикулярный аналептик (0,857), ингибитор циклооксагеназы 1 (0,847), диуретик (0,776), антиэпилептик (0,681) и другие;
предсказано несколько видов токсичности (гематоксичность (0,933) и эмбриотоксичность (0,495)).
3.5.2 Сульгин
В приложении Г представлена молекула сульгина с рассчитанными геометрическими параметрами молекулы и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность сульгин в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как ингибитор пируваткиназы (0,863), ингибитор катепсина G (0,769), антиэпилептик (0,617), агонист Допамина Д4 (0,692);
предсказана гематоксичность (0,947).
3.5.3 Сульфадимезин
В приложении Д представлена молекула сульфадимезина с рассчитанными геометрическими параметрами молекулы и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность сульфадимезина в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как агонист Допамина Д4 (0,708), антидиабетик (0,536);
предсказана гематоксичность (0,791).
3.5.4 Норсульфазол
В приложении Е представлена молекула норсульфазола рассчитанными геометрическими параметрами молекулы и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность норсульфазола в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как Antiobesity (0,885), агонист Допамина Д4 (0,785), агонист простагландина (0,549);
предсказана гематоксичность (0,791).
3.5.4 Сульфафуразол
В приложении Ж представлена молекула норсульфазола с рассчитанными геометрическими параметрами молекулы методами и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность сульфафуразола в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как антагонист простагландина Н2, антагонист эндотелинового рецептора (0,674), ингибитор тиолоксидазы (0,620) агонист Допамина Д4 (0,581);
предсказано несколько видов токсичности (гематоксичность (0,833) и эмбриотоксичность (0,339)).
ЗАКЛЮЧЕНИЕ
В ходе проведенной работы были рассчитаны геометрические параметры соединений сульфаниламидного ряда и предсказана вероятность проявления ими некоторых видов физиологической активности. Результатом работы стал прогноз ранее неизвестных видов активности у соединений сульфаниламидного ряда, к которым можно отнести агонист Допамина Д4 (проявляется у всех анализируемых веществ с вероятностью 0,581 – 0,941), гематоксичность (проявляется у всех соединений с вероятностью 0,791 – 0,947), эмбриотоксичность (проявляется у сульфафуразола и сульфаниламида с вероятностью 0,339 и 0,495) и другие. Вместе с тем была подтверждена уже известная проявляемая физиологическая активность (антагонист ПАБК), которая оценена на уровне 0,860 – 0,9, что является очень высоким показателем. Как показано в приложениях В – Ж, имеет смысл провести дополнительные доклинические испытания на пример использования их в качестве антиэпилептического назначения.
1ProusJ. DrugsYearsNews[Text] / Proc. Natl. Acad. Sci. USA. 1995. P 345
2 Djons A. Talidomid as anxiolitic [Text] / Brit. J. Pharmacol., 1960, 15, p.111-116
3 Am. J. Public Health, 1965, 55, p.703-707
4Sridhar B., Ravikumar K. Some interesting properties of talidomid [Text] / Proc. Natl. Acad. Sci. USA. 1994, Apr 26; 91 (9):4082-5
5 Clin. Immunol. Immunopathol. 1996, 81, p.219-223
6ИвановА.С., АрчаковА.И. Интегральнаяплатформа «Отгенадопрототипалекарства» in silico и in vivo [Текст] / ИвановА.С. АрачаковА.И. // РоссийскийхимическийжурналМ.: Наука №2, 2006. – с. 18-35
7 Жидомиров Г.М., Багатурьянц А.А. Прикладная квантовая химия.-М.: Химия, 1979.-295 с.
8 Бурштейн К.Я., Шорыгин П.П. Квантово- химические расчеты в органической химии и молекулярной спектроскопии.- М.: Наука, 1989.-310 с.
9 Кузнецов П.Е., Люлин Ю.Н., Щербаков А.А. Методы математического моделирования в приложении к проблеме биофизической химии. ДСП, 1985.-250 с.
10 Hansch C, Fujita Т., р-ст-л Analysis. A Method for the Correlation of Biological Activity and Chemical Structure, J. Am. Chem. Soc, 86, 1616 (1964).
11 Hammett L. P., Physical Organic Chemistry, McGraw-Hill, New York, 1940.
12 Cramer R. D., Quantitative Drug Design, in: Annual Reports in Medicinal Chemistry, Vol. 11, F. H. Clarke (Ed.), Academic, New York, 1976.
13 Silipo C, Hansch C, Correlation Analysis. Its Application to the Structure -Activity Relationship of Triazines Inhibiting Dihydrofolate Reductase, J. Am.Chem. Soc, 97, 6849 (1975).
14 Dixon W. J. (Ed.), BMD - Biomedical Computer Programs, 3rd ed., Universityof California Press, Berkeley, CA, 1973.
15 Furnival G. M., Wilson R. W., Jr., Regressions by Leaps and Bounds, Tech-nometrics, 16, 499 (1974).
16 Стьюпер Э., Брюггер У. Машинный анализ связи химической структуры и биологической активности. Пер. с англ. — М.: Мир, 1982.—235 с, ил.
17 Сборник программ расчета спектральных и квантовохимических параметров молекул. ДСП, 1983.-53 с.
18 Hartigan G. H., Clustering Algorithms, Wiley, New York, 1975.
19 Ball G. H., Hall J. P., ISODATA: A Novel Method of Data Analysis and Pattern Classification, NTIS Report AD699616, 1965.
20 Ball G. H., Hall J. P., ISODATA, An Iterative Method of Multivariate Analysis and Pattern Classification, Proceedings of the IFIPS Congress, 1965.
21 Поматериаламсайта ChemNet
22 Shroder S., Thiel W. //Ibid. Vol. 108, N 25. P. 7985 - 7989
23 Dewar M.J.S., Ford G.P. // J. Amer. Soc. 1977. Vol. 99, N6. P. 1685-1691
24 Вартанян Р.С. Синтез основных лекарственных средств. – М. Медицинское информационное агентство, 2004. – 845 с.
Приложение А
Таблица А.1 - Абсолютные ошибки, которые получаются при расчете длин валентных связей и значений валентных углов неэмпирическими методами.
| Неэмпирический расчет в базисе |
Ошибки |
| Длины валентных связей, нм |
Валентные углы, град |
| ОСТ-3ГФ |
0,002-0,003 |
3-4 |
| Валентно - расщепленные базисы, безэкспоненциальные базисы, расширенные базисы без поляризационных орбиталей |
0,001 |
Сильное завышение валентных углов у молекул типа Н2О, NН |
| Валентно - расщепленные и безэкспоненциальные базисы с поляризационными орбиталями |
0,0011 |
1-2 |
| Хартри- Фоковский предел |
0,005 |
1-2 |
| Большие базисы с учетом электронной корреляции |
Очень хорошее согласие с экспериментом |
Примечание 1 - вычисленные значения обычно меньше экспериментальных величин
Таблица А.2 - Абсолютные значения ошибок при расчете длин валентных связей и валентных углов методами МПДП и МЧПДП/3
| Геометрический параметр |
Количество расчетов |
Абсолютная ошибка |
| МПДП |
МЧПДП/3 |
| Валентная связь, нм |
| Все тины связей |
228 |
0,0014 |
0,0022 |
| С-Н |
56 |
0,0009 |
0,0019 |
| С-С |
96 |
0,0012 |
0,0016 |
| N-H |
9 |
0,0006 |
0,0019 |
| N-C |
17 |
0,0010 |
0,0029 |
| N-N |
9 |
0,0032 |
0,0074 |
| O-H |
7 |
0,0011 |
0,0010 |
| O-C |
22 |
0,0016 |
0,0025 |
| O-N |
8 |
0,0026 |
0,0026 |
| O-O |
3 |
0,0117 |
0,0043 |
| Валентный угол, град |
| Все типы углов |
91 |
2,8 |
5,6 |
| Углы при С |
62 |
2,0 |
4,4 |
| Углы при N |
15 |
3,2 |
7,1 |
| Углы при О |
9 |
8,5 |
10,7 |
| Углы между плоскостями в бициклических соединениях |
5 |
1,6 |
5,9 |
Таблица А.3 - Потенциалы ионизации, эВ
| Соединение |
МПДП |
Эксперимент |
Отнесение1 |
Соединение |
МПДП |
Эксперимент |
Отнесение1 |
| Метан |
13,9 |
14,0 |
1t2 |
Аммиак |
11,2 |
10,9 |
2a1 |
| 30,6 |
22,9 |
1a2 |
16,7 |
16,0 |
1e |
| Этан |
12,7 |
1eg |
32,9 |
27,0 |
1a1 |
| 13,3 |
12,1 |
2a1g |
Цитанистый
Водород
|
13,4 |
13,6 |
1π |
| 15,1 |
15,0 |
1eu |
14,3 |
14,0 |
3 |
| 24,8 |
20,4 |
1a2u |
21,6 |
20,0 |
2σ |
Этилен
Этилен
|
10,2 |
10,5 |
1b1u |
Азот
Азот
|
14,9 |
15,6 |
2σg |
| 12,6 |
12,8 |
1b1g |
16,2 |
17,0 |
1πu |
| 14,6 |
14,7 |
2ag |
21,1 |
18,8 |
1σu |
| 15,8 |
15,9 |
1b2u |
Вода |
12,2 |
12,6 |
1b1 |
| 14,5 |
14,7 |
2a1 |
| Ацетилен |
11,0 |
11,4 |
1π u |
19,1 |
19,1 |
1b2 |
| 15,9 |
16,4 |
2σg |
40,0 |
32,2 |
1a1 |
| 21,0 |
18,7 |
1σu |
Диоксид
Углерода
|
12,8 |
13,8 |
1π g |
| Бензол |
9,4 |
9,2 |
1e1g |
17,7 |
17,6 |
1π u |
| 12,5 |
11,5 |
2e2g |
17,8 |
18,1 |
2σu |
| 12,6 |
12,3 |
1a2g |
21,2 |
19,4 |
2σg |
| 14,4 |
13,8 |
2e1u |
Формаль
дегид
|
11,0 |
10,9 |
2b2 |
| 15,2 |
14,7 |
1b2u |
14,2 |
14,4 |
1b1 |
| 16,8 |
15,4 |
1b1u |
16,3 |
16,0 |
2a1 |
| 17,5 |
16,9 |
2a1u |
16,9 |
16,8 |
1b2 |
Примечание 1 - отнесение, сделанное на основе данных метода МПДП, для большинства всех перечисленных в таблице соединений совпадает с общепринятым
Таблица А.4 - Экспериментальные теплоты образования и ошибки при вычислении этих величин квантовохимическими методами.
| Молекула |
Экспериментальная величина НА |
Ошибка при вычислении методом1 |
| 3-21ГФ |
6-31ГФ* |
МПДП |
| 1 |
2 |
3 |
4 |
5 |
| Метан |
-75 |
-4 |
2 |
25 |
| Этан |
-85 |
1 |
8 |
2 |
| Пропан |
-104 |
2 |
8 |
0 |
| Этилен |
-52 |
-7 |
-10 |
12 |
| Пропилен |
21 |
8 |
-10 |
0 |
| цис - Бутен – 2 |
-8 |
- |
15 |
-9 |
| транс – Бутен - 2 |
-13 |
-13 |
13 |
-9 |
| H2C=CMe2 |
-18 |
-16 |
12 |
9 |
| H2C=C=CH2 |
192 |
-11 |
-29 |
-8 |
| H2C=CH-CH=CH2 |
109 |
-20 |
52 |
12 |
| C2H2 |
228 |
-7 |
-33 |
12 |
 |
186 |
2 |
-25 |
-15 |
 |
146 |
2 |
20 |
-44 |
 |
475 |
6 |
45 |
-46 |
| Циклопропан |
53 |
-35 |
-10 |
-6 |
| Циклопропен |
278 |
-77 |
-44 |
8 |
| Циклобутен |
158 |
-47 |
-34 |
-26 |
| Бензол |
83 |
-11 |
45 |
6 |
| H2O |
-243 |
-20 |
-11 |
-14 |
| H2O2 |
-136 |
77 |
13 |
-24 |
| CO |
-111 |
39 |
56 |
85 |
| CO2 |
-395 |
31 |
64 |
79 |
| CH3OH |
-202 |
22 |
-21 |
-39 |
| C2H5OH |
-236 |
23 |
-20 |
-29 |
| CH2O |
-109 |
15 |
33 |
-29 |
| HCOOH |
-381 |
47 |
-54 |
-8 |
| CH3CHO |
-167 |
15 |
83 |
-11 |
| CH3COCH3 |
-218 |
17 |
-32 |
10 |
| CH3OCH3 |
-185 |
48 |
-44 |
-30 |
| NH3 |
-46 |
-4 |
-17 |
20 |
| N2H4 |
96 |
32 |
-8 |
-36 |
| цис – HN=NH |
214 |
-33 |
-16 |
-72 |
| HN3 |
295 |
-72 |
44 |
11 |
| Продолжение таблицы А.4 |
| CH3NH2 |
-23 |
14 |
0 |
-8 |
| CH3NCH3 |
-18 |
22 |
8 |
-9 |
| HCN |
136 |
37 |
5 |
11 |
| CH3CN |
88 |
58 |
14 |
-8 |
| CH3NC |
150 |
34 |
- |
102 |
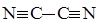 |
310 |
94 |
6 |
-33 |
| HNO2 |
-79 |
-15 |
- |
-92 |
| N2O |
80 |
-64 |
-16 |
47 |
| Средняя ошибка |
- |
29 |
25 |
26 |
Примечание 1 - при расчете теплот образования методами 3-21ГФ и 6-31ГФ* использованы корректирующие параметры из таблицы 1.5
Таблица А.5 - Корректирующие параметры для расчета теплот образования молекул неэмпирическими методами
| Атом |
Метод |
| ОСТ-3ГФ |
3-21ГФ |
6-31ГФ* |
| Н |
-0,57429 |
-0,56908 |
-0,56912 |
| С |
-37,40983 |
-37,67347 |
-37,88940 |
| N |
-53,74645 |
-54,14898 |
-54,46617 |
| O |
-73,77352 |
-74,36308 |
-74,78492 |
Таблица А.6 - Теплоты реакций изомеризации (кДж/моль)
| Реакция |
МПДП |
Эксперимент |
| СН3С≡H → СН2=С=CH2 |
12 |
6 |
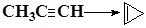 |
105 |
86 |
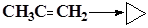 |
26 |
32 |
 |
2 |
2 |
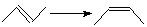 |
4 |
4 |
 |
23 |
12 |
 |
13 |
-5 |
 |
2 |
8 |
 |
31 |
31 |
 |
5 |
4 |
 |
42 |
-23 |
| С2Н5NH2 → (СН3)2NH |
27 |
30 |
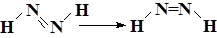 |
8 |
0 |
| СН3СN → СН3NС |
170 |
60 |
| С2Н5OH → СН3OСН3 |
48 |
49 |
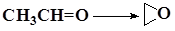 |
113 |
113 |
| СН3СOOН → НСOOСН3 |
67 |
87 |
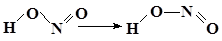 |
7 |
2 |
Таблица А.7 - Вычисленные энергии активации (кДж/моль) для реакций, приведенных на схемах 1 – 5.
| Реакция |
МПДП |
КМПДП |
ХФ |
КХФ1 |
| 1 |
400 |
331 |
344 |
327 |
| 2 |
523 |
420 |
483 |
419 |
| 3 |
627 |
589 |
638 |
559 |
| 4 |
343 |
316 |
315 |
286 |
| 5 |
396 |
271 |
212 |
202 |
| 6 |
458 |
390 |
437 |
402 |
| 7 |
405 |
299 |
455 |
361 |
| 8 |
84 |
96 |
119 |
131 |
| 9 |
538 |
502 |
550 |
- |
| 10 |
568 |
540 |
483 |
430 |
| 11 |
458 |
382 |
411 |
436 |
| 12 |
425 |
347 |
426 |
403 |
| 13 |
453 |
323 |
348 |
378 |
| 14 |
341 |
349 |
338 |
353 |
| 15 |
318 |
268 |
278 |
262 |
| 16 |
78 |
38 |
26 |
23 |
| 17 |
360 |
201 |
218 |
161 |
| 18 |
444 |
352 |
397 |
326 |
| 19 |
609 |
467 |
538 |
428 |
| 20 |
370 |
238 |
254 |
200 |
| 21 |
399 |
372 |
452 |
390 |
| 22 |
286 |
280 |
250 |
186 |
| 23 |
403 |
310 |
420 |
- |
| 24 |
437 |
275 |
319 |
259 |
Примечание 1 - при расчете энергии активации использована геометрия переходного состояния, предварительно вычисленная в приближении Хартри – Фока
Таблица А.8 - Статистический анализ результатов расчета геометрии переходных состояний и энергий активации методами МПДП и КМПДП
| Вычисленная величина |
Число расчетов |
Абсолютная ошибка1 |
| МПДП |
КМПДП |
Длинна валентных связей2, нм
Активных3
Пассивных3
|
112
70
42
|
0,0057
0,0078
0,0019
|
0,0056
0,0073
0,0025
|
| Валентный угол2 |
58 |
7,9 |
6,2 |
| Торсионный угол2, град |
20 |
11,6 |
7,9 |
| Энергия активации, кДж/моль |
24 |
55
904
|
45
364
|
Примечание 1 - по сравнению с данными неэмпирического расчета в приближении Хартри – Фока
Примечание 2 - для переходного состояния
Примечание 3 - активные связи разрываются или образуются в ходе реакции, пассивные связи в ходе реакции формально остаются неизменными
Примечание 4 - по сравнению с данными неэмпирических расчетов с учетом электронной корреляции
Приложение Б
СУЛЬФАНИЛАМИДЫ РЕЗОРБТИВНОГО ДЕЙСТВИЯ
Стрептоцид — Streptocidum. пара-Аминобензолсульфамид. Синонимы: пронтозил, стрептоцид белый, стрептамин, сульфаниламид, стрептозол и др.
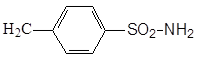
Белый кристаллический порошок без запаха и вкуса. Мало растворим в воде, легко — в кипящей воде, растворах кислот и щелочей; трудно растворим в этаноле. Водные растворы имеют нейтральную реакцию, весьма стойкие. Несовместим с новокаином, анестезином, барбитуратами и другими препаратами, легко отщепляющими серу.
Оказывает противомикробное действие на стрептококков, менингококков, пневмококков, кишечную палочку, возбудителя газовой гангрены и некоторые другие микробы, но почти неактивен в отношении стафилококков. Препарат нарушает течение обменных процессов и тормозит рост и размножение микроорганизмов.
Стрептоцид быстро всасывается из желудочно-кишечного тракта, подкожной клетчатки и с раневой поверхности. Особенно хорошо всасывается из тонкого отдела кишечника, несколько хуже — из желудка и толстого отдела кишечника. При местном применении не раздражает тканей.
После перорального применения максимальная концентрация препарата в крови устанавливается через 0,5—3 ч и удерживается примерно на этом уровне в течение 1—2 ч, а затем довольно быстро снижается. Всосавшийся препарат легко проникает через внутренние барьеры. Его обнаруживают во всех органах и тканях в достаточно высоких концентрациях. В организме стрептоцид связывается с белками до 20 % и подвергается различным превращениям, в том числе ацетилированию. Степень ацетилирования в крови составляет 20—25 %, в моче — 25—60 %. Продукты ацетилирования не обладают антимикробной активностью и значительно хуже растворяются в воде. При высокой концентрации препарата в моче они могут выпадать в осадок. Выделяется стрептоцид в свободной и связанной формах преимущественно почками (90—95 %).
Токсичность препарата незначительна, но при длительном употреблении в больших дозах в почках могут образовываться трудно растворимые соединения, уменьшается содержание гемоглобина, возникают цианоз, агранулоцитоз, лейкопения. Противопоказания к применению стрептоцида следующие: общий ацидоз, гепатит, гемолитическая анемия, агранулоцитоз, нефриты, нефрозы.
Стрептоцид применяют при ангинах, стрептококковых тонзиллярных абсцессах, мыте, бронхопневмонии, послеродовом сепсисе и других заболеваниях. Дозы внутрь: лошадям и крупному рогатому скоту 5-10 г, мелкому рогатому скоту и свиньям 0,5-2, собакам 0,5-1, песцам и лисицам 0,3-0,5 г. Препарат назначают в указанных разовых дозах 4-6 раз в сутки в течение 5-7 дн. Разовые дозы внутривенно: лошадям и крупному рогатому скоту 3-6, собакам 0,5-1 2—3 раза в сутки. Наружно стрептоцид используют для лечения инфицированных ран, язв, ожогов в форме присыпки, суспензии, линимента. Перевязки проводят через 1—2 дня, так как гной и продукты распада тканей снижают лечебное действие стрептоцида.
Выпускают в форме порошка, таблеток по 0,3 и 0,5 г, а также в форме 5-10%-ной мази, 5%-ной суспензии и 5%-ного линимента.
Порошок и таблетки стрептоцида хранят с предосторожностью по списку Б в хорошо укупоренной таре. Срок проверочного анализа 10 лет.
Мазь, суспензия и линимент стрептоцида хранят в прохладном, защищенном от света месте в тщательно закрытой упаковке. При появлении на поверхности линимента буроватой пленки ее следует удалить, после чего линимент пригоден к применению.
Стрептоцид растворимый — Streptocidum solubile. пара-Сульфамидо-бензоламинометансульфат натрия.
Белый кристаллический порошок. Растворим в воде, практически нерастворим в эфире и хлороформе. Водные растворы можно стерилизовать. Несовместим с новокаином, анестезином, барбитуратами.
По антпмикробному действию аналогичен стрептоциду. В связи с хорошей растворимостью в воде пригоден для парентерального введения. Фармакокинетика препарата сходна с фармакокинетикой стрептоцида.
Примрняют стрептоцид растворимый при септических стрептококковых процессах, ангинах, мыте, бронхопневмониях, маститах, циститах, пиелитах. Назначают внутримышечно и подкожно в форме 5%-ного раствора, приготовленного на воде для инъекций или изотоническом растворе хлорида натрия. Для внутривенного введения готовят 10%-ный раствор на изотоническом растворе хлорида натрия или 1—5 %-ном растворе глюкозы. Дозы внутривенно: лошадям и крупному рогатому скоту 2—6 г, мелкому рогатому скоту и свиньям 1—2, собакам 0,3—0,5 г. При маститах в пораженную долю вымени после сдаивания вводят 3—5 %-ный водный раствор препарата в объеме 25—40 мл 2—3 раза в сутки.
Растворимый стрептоцид можно назначать не только парентерально, но и внутрь, а также наружно в тех же дозах, что и стрептоцид.
Противопоказания к применению растворимого стрептоцида: болезни кроветворной системы, гепатиты, нефриты.
Выпускают растворимый стрептоцид в порошке. Хранят по списку Б в хорошо укупоренной таре. Срок проверочного анализа 10 лет.
Норсульфазол — Norsulfazolum. 2-(пара-Аминобензолсульфамидо)-тиазол. Синонимы: азосептал, пиросульфон, сульфатиазол, тиазамид, цибазол и др.
Белый или слегка желтоватый кристаллический порошок без запаха, очень мало растворим в воде (1 : 2000), мало — в этаноле, растворим в разбавленных неорганических кислотах, растворах едких и углекислых щелочей. Несовместим с новокаином, барбитуратами, ортоформом.
Норсульфазол обладает высокой антимикробной активностью в отношении стрептококков, менингококков, кишечной палочки, сальмонелл, пастерелл и других микроорганизмов. Это один из наиболее активных сульфаниламидных препаратов, но для создания бактериостатических концентраций его в крови требуются более высокие дозы. Токсичность норсульфазола выше, чем у стрептоцида, и может проявляться через 7—9 дн. после применения в форме гематурии и агранулоцитоза.
Препарат легко всасывается из желудочно-кишечного тракта и достигает максимальной концентрации в крови через 3—6 ч после введения. Терапевтическая концентрация удерживается в крови в течение 6—12 ч. Связывается с белками плазмы на 60—70 %, в результате чего затрудняется проникновение препарата в органы и ткани и замедляется его выведение. Ацетилируется незначительно и выделяется с мочой главным образом в свободной форме.
Норсульфазол применяют при катаральной бронхопневмонии, плевритах, стрептококковом и стафилококковом сепсисе, эндометритах, маститах, гастроэнтеритах, некробактериозе, диплококковой септицемии телят, пастереллезе птиц и других бактериальных инфекциях. Назначают внутрь 2—3 раза в сутки в следующих дозах: лошадям и крупному рогатому скоту 10—25 г, мелкому рогатому скоту и свиньям 2—5, курам 0,5 г. Начальная доза норсульфазола должна быть в 2 раза выше.
При катаральной бронхопневмонии телят норсульфазол применяют внутритрахеально в дозе 0,05 г/кг массы в форме 8-10%-ного раствора в течение 3—4 дн. Целесообразно одновременно назначать антибиотики. При диплококковой сепитцемии телят препарат вводят внутривенно по 0,01—0,02 г/кг массы.
При лечении ран норсульфазол используют в форме присыпок и мазей в различных комбинациях с пенициллином, грамицидином, йодом, а также другими сульфаниламидами. При этом необходимо очистить рану от гноя и некротизированных тканей.
Противопоказания к применению норсульфазола: нефриты, гепатиты, заболевания крови и кроветворной системы. В период назначения препарата прием воды не ограничивают.
Выпускают норсульфазол в порошке и таблетках по 0,25 и 0,5 г. Хранят с предосторожностью по списку Б в хорошо укупоренной таре. Срок проверочного анализа 5 лет.
Норсульфазол-натрий — Norsulfazolum - natrium. 2 - (пара -Аминобензолсульфамидо) - тиазол - натрий. Синонимы: норсульфазол растворимый, сульфатиазол - натрий.
Пластинчатые, блестящие, бесцветные или со слегка желтоватым оттенком кристаллы без запаха. Легко растворим в воде (1 : 2). Водные растворы имеют сильно щелочную реакцию, выдерживают стерилизацию при 100 °С в течение 30 мин.
Препарат имеет такую же химиотерапевтическую активность, как и норсульфазол. Благодаря хорошей растворимости в воде его можно применять не только внутрь, но и парентерально, а также в виде глазных капель.
Показания к применению те же, что и для норсульфазола. Используют при септических процессах, когда необходимо быстро создать высокую концентрацию препарата в крови, например, при диплококковой септицемии телят, некробактериозе, колибактериозе и т. д. Назначают норсульфазол-натрий главным образом внутривенно в форме 5-15%-ных растворов вводят медленно. Под кожу и внутримышечно препарат можно вводить в растворах не выше 0,5—1 %-ной концентрации. Попадание под кожу более крепких растворов вызывает раздражение тканей, вплоть до некроза. Дозы внутривенно: лошадям 6—12 г, крупному рогатому скоту 6—10, овцам 1—2, собакам 0,5—1 г 2 раза в сутки в течение 3—4 дн.
При пастереллезе птиц норсульфазол-натрий применяют в форме 20 %-ной масляной суспензии или водного раствора. Суспензию вводят однократно в область верхней трети шеи курам и уткам по 1 мл на 1 кг массы птицы. Водный раствор готовят непосредственно перед применением из расчета 0,5 сухого вещества для кур и 1 г для индеек на прием. Препарат дают птице с кормом 2 раза в сутки. При кокцидиозе цыплят дают с питьевой водой в форме 0,25 %-го водного раствора.
При маститах пораженную долю вымени сдаивают и вводят 3, 5 или 10%-ный раствор норсульфазол - натрия через молочный катетер в объеме 25—40 мл. Сосок зажимают на 10—15 минут. Лечение проводят 1—2 раза в сутки до выздоровления.
При конъюнктивитах, блефаритах и других инфекционных, заболеваниях глаз применяют 10%-ные растворы в виде глазных капель 3—4 раза в день.
Противопоказания к применению норсульфазол - натрия болезни кроветворной системы, нефриты, нефрозы.
Выпускают в форме порошка. Хранят с предосторожностью по списку Б в упаковке, предохраняющей от действия влаги и света. Срок проверочного анализа 3 года.
Этазол — Aethazolum. 2-(пара-Аминобензолсульфамидо)-5-этил-1,3,4-тиадиазол. Синонимы: берлофен, глобуцид, сетадил, сульфаэтидиол и др.

Белый или белый со слегка желтоватым оттенком порошок без запаха. Практически нерастворим в воде, трудно растворим в этаноле, мало растворим в разбавленных кислотах, легко растворим в растворах щелочей. Несовместим с пептоном, пара-аминобензойной кислотой, новокаином, барбитуратами, многими производными серы.
Этазол обладает высокой антимикробной активностью в отношении стрептококков, пневмококков, менингококков, патогенных анаэробов, кишечной палочки, возбудителей дизентерии, сальмонеллеза, пастереллеза и др. Этазол превосходит многие сульфаниламиды по антибактериальному действию против целого ряда микроорганизмов.
Препарат быстро всасывается из желудочно-кишечного тракта в кровь. Через 2—3 ч у собак и через 5—8 ч у крупного рогатого скота отмечают максимальную концентрацию в крови. Этазол относится к сульфаниламидным препаратам короткого действия, у которых максимальный уровень концентрации снижается на 50 % за 5—10 ч. Хорошо проникает через гематоэнцефалический барьер, распределяется в различных органах и тканях неравномерно: дольше всего задерживается в почках, желудочно-кишечном тракте, печени, легких. В организме собак препарат не ацетилируется, а у других животных подвергается ацетилированию в незначительной степени (5—10 %), поэтому его применение не приводит к образованию кристаллов в мочевых путях. Выделяется этазол наиболее быстро у собак, затем у кроликов и наиболее медленно — у крупного рогатого скота.
Применяют при бронхопневмонии, ангине, послеродовом сепсисе, эндометритах, дизентерии, диспепсии, роже свиней и других заболеваниях бактериальной этиологии, возбудители которых чувствительны к сульфаниламидам.
Дозы внутрь: лошадям 10—25 г, крупному рогатому скоту 15—25, мелкому рогатому скоту 2—3, свиньям 2—5, кроликам 1—1,5, птице 0,5, собакам 0,3—0,5 г 3—4 раза в сутки в течение 4—6 дн. подряд. При тяжелом течении болезни начальную дозу увеличивают вдвое. Дозы для молодняка составляют 2/3 от дозы для взрослого животного.
Для профилактики раневой инфекции этазол вводят в полость раны в форме пудры, 5 %-ной мази. Одновременно препарат назначают внутрь.
Противопоказания к применению: сильно выраженный ацидоз, острые гепатиты, гемолитическая анемия, агранулоцитоз.
Выпускают этазол в форме порошка и таблеток по 0,25 и 0,5 г. Хранят по списку Б в хорошо укупоренной таре. Срок проверочного анализа 3 года
Этазол-натрий — Aethazolum-natrium 2 (пара Аминобензол-сульфамидо) 5 Этил 1,3,4 тиадиазол натрий. Синонимы: этазол растворимый, сульфаэтидол натрий.
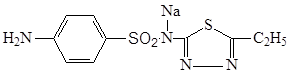
Белый кристаллический порошок. Легко растворим в воде; трудно растворим в этаноле. Водные растворы стабильны, можно стерилизовать кипячением в течение 30 мин. Несовместим к новокаином, анестезином, препаратами, легко отщепляющими серу.
Этазол-натрий легко всасывается при различных путях введения, быстро достигает максимального уровня концентрации в крови и активно проникает в различные органы и ткани. За счет хорошей растворимости в воде его можно применять не только внутрь, но внутримышечно и внутривенно. В организме циркулирует в основном в свободной форме, выделяется быстро.
Антибактериальная активность и показания к применению такие же, как и у этазола.
Применяют 10—20 %-ные растворы внутримышечно и внутривенно. Дозы: лошадям и крупному рогатому скоту 5—10 г, мелкому рогатому скоту 1—2, свиньям 2—3, собакам 0,1—0,3 г 2—3 раза в сутки.
Противопоказания к применению этазол-натрия те же, что и для этазола.
Этазол-натрий выпускают в порошке, а также в ампулах 3 в форме 10—20 %-ного раствора для инъекций.
Хранят с предосторожностью по списку Б в защищенном от света месте. Срок проверочного анализа 5 лет.
Сульфацил — Sulfacylum. пара-Аминобензолсульфацетамид. Синонимы: ацетоцид, ацетосульфамин, альбуцид, септурон, суламид, сульфацетамид и др.

Белый или белый с желтоватым оттенком кристаллический порошок без запаха, растворимый в 20 частях холодной воды (в горячей воде растворяется значительно легче), в 12 частях этанола, в растворах щелочей и кислот. Несовместим с новокаином, анестезином, препаратами, отщепляющими серу.
Сульфацил обладает сильным антимикробным действием в отношении стрептококков, стафилококков, пневмококков, возбудителей сальмонеллеза и колибактериоза.
Препарат быстро всасывается из желудочно-кишечного тракта животных. Максимальная концентрация в крови устанавливается через 2—5 ч с момента введения. За 6-12 ч максимальная концентрация снижается на 50 %. Ацетилируется в умеренной степени (10-15%). Незначительно связывается с белками плазмы, хорошо проникает в различные органы и ткани. Сравнительно быстро выделяется из организма, главным образом с мочой.
Применяют при ангинах, фарингитах, бронхопневмониях, послеродовом сепсисе, стрептококковых инфекциях, колибактериозе, сальмонеллезе, диспепсии, циститах и т. п. Местно назначают в форме присыпок и мазей при лечении гнойных ран, кожных стрептококковых и стафилококковых заболеваний, конъюнктивитов Дозы внутрь: лошадям 5—10 г, мелкому рогатому скоту 2—3, свиньям 1—2, собакам 0,5—1 г 3—4 раза в сутки. Начальная доза должна быть в 2—3 раза больше последующих.
Противопоказания к применению — аналогичные другим сульфаниламидам.
Выпускают сульфацил в порошке. Хранят по списку Б в хорошо укупоренной таре, предохраняющей от действия света. Срок проверочного анализа 5 лет.
Сульфацил-натрий — Sulfacylum-natrium. пара-Аминобен-золсульфацетамид-натрий — натриевая соль сульфацила. Синонимы: сульфацил растворимый, сульфацетамид-натрий, альбуцид-натрий и др.
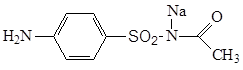
Белый кристаллический порошок без запаха. Легко растворим в воде, практически нерастворим в этаноле, эфире. Несовместимость — аналогично другим сульфаниламидам.
По антимикробному действию и особенностям фармакокинетики сходен с сульфацилом.
Применяют при пиелитах, циститах, колитах и послеродовом сепсисе. Назначают внутрь в дозах: лошадям и крупному рогатому скоту 3—10 г, мелкому рогатому скоту и свиньям 1—2, собакам 0,3—0,5 г 3—4 раза в сутки.
Наружно сульфацил-натрий применяют при лечении ран, язв роговицы, конъюнктивитов, маститов, эндометритов. Употребляют в форме присыпки, мази или растворов 10, 20 или 30 %-ной концентрации. Особенно хорошие результаты получены при применении сульфацил-натрия в глазной практике.
Противопоказания к применению: острый гепатит, агранулоцитоз, гемолитическая анемия.
Выпускают в порошке. Хранят по списку Б в упаковке, предохраняющей от действия света и влаги. Срок проверочного анализа 5 лет.
Сульфантрол — Sulfanthrolum. 2-(пара-Аминобензолсульфа-мидо)-бензоат, гидрат.
Белый или белый с желтоватым или розовым оттенком кристаллический порошок, хорошо растворим в воде (1 : 8), трудно растворим в этаноле. Водные растворы стойкие, их стерилизуют кипячением в течение 15 мин. Несовместим с препаратами, легко отщепляющими серу, новокаином, анестезином, барбитуратами.
Сульфантрол активен в отношении стрептококков, пневмококков и кишечной палочки. Препарат высоко токсичен для нутталий.
Применяют при нутталиозе и пироплазмозе лошадей, тейлериозе крупного рогатого скота, бронхопневмонии, сальмонеллезе, колибактериозе, гнильце пчел и других заболеваниях. При нутталиозе лошадей сульфантрол назначают внутривенно в форме 4 %-ного раствора в дозе 0,005—0,01 г чистого вещества на 1 кг массы животного. Препарат вводят 1—3 раза с интервалом 24—38 ч. При заболевании лошадей нутталиозом и пироплазмозом применяют смесь 4 %-ного раствора сульфантрола и 1 %-ного раствора трипанового синего. Вводят внутривенно в дозе 0,5 мл на 1 кг массы животного 1—2 раза с интервалом 24—48 ч.
При тейлериозе крупного рогатого скота сульфантрол назначают внутримышечно в форме 10 %-ного раствора из расчета 0,003 г на 1 кг массы животного.
При бронхопневмонии препарат вводят внутримышечно и внутривенно в дозе 0,008—0,01 г на 1 кг массы животного. При колибактериозе, сальмонеллезе и других желудочно-кишечных заболеваниях сульфантрол назначают внутрь в первый день 0,2 г, во второй — 0,15, в третий — 0,1 и в четвертый - 0,05 г на 1 кг массы животного в сутки. Суточную дозу дают 3—4 приема.
При гнильце пчел препарат добавляют к сахарному сиропу в дозе 2 г на 1 л сиропа и скармливают одной пчелиной семье.
Противопоказания к применению сульфантрола: агранулоцитоз, острый гепатит, нефриты и нефрозы
Выпускают в порошке. Хранят с предосторожностью по списку Б в хорошо укупоренной таре, предохраняющей от действия света и влаги. Срок проверочного анализа 8 лет.
Сульфадимезин — Sulfadimezinum. 2-(пара-Аминобензол-сульфамидо)-4,6-диметилпиримидин. Синонимы: диазил, диазол, диметазил, диметилсульфадиазин, диметилсульфапиримидин, суперсептил и др.
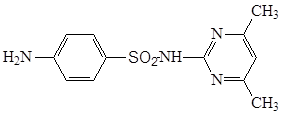
Белый или слегка желтоватый порошок без запаха. Практически нерастворим в воде, эфире и хлороформе, мало растворим в этаноле, легко растворим в разведенных минеральных кислотах и щелочах. Несовместим с новокаином, парааминобензойной кислотой, пептоном, барбитуратами.
Обладает широким антибактериальным спектром действия: активен по отношению к пневмококкам, стафилококкам, кишечной палочке, сальмонеллам, пастереллам, а также крупным вирусам. По активности близок к сульфазину и метилсульфазину. Действует бактериостатически, нарушает течение обменных процессов, тормозит рост и размножение микробов.
Сульфадимезин сравнительно быстро всасывается из желудочно-кишечного тракта. Максимальная концентрация препарата в крови устанавливается через 6—8 ч после введения. В крови животных он создает более высокие концентрации, чем любой другой. Из обычно применяемых сульфаниламидов, в такой же дозе. Препарат хорошо проникает через гематоэнцефалический барьер, создает высокие концентрации во многих органах и тканях. Связывается с белками на 75—85 %, ацетилируется в крови на 5—10%, моче — на 20—30%. Продукты ацетилирования сульфадимезина растворяются лучше, чем свободная форма препарата. Выделяется из организма медленно, главным образом почками. В связи с относительно небольшой скоростью элиминации он более безопасен по сравнению с норсульфазолом и другими быстро выделяющимися препаратами. Медленное выделение обеспечивает длительное (более 8 ч) поддержание терапевтического уровня в крови. Препарат хорошо переносят больные.
Сульфадимезин применяют при пневмониях, катаральной бронхопневмонии, бронхите, ларингите, ангине, мыте лошадей, сепсисах, эндометритах, инфекционных маститах, некробактериозе овец и северных оленей, диспепсии, гастроэнтеритах, инфекциях мочевых путей, сальмонеллезе, пастереллезе, респираторном микоплазмозе, кокцидиозе птицы и других заболеваниях. Назначают внутрь в дозах: лошадям 10—25 г, крупному рогатому скоту 15—20, мелкому рогатому скоту 2—3, свиньям 1—2, курам 0,3—0,5 г 1—2 раза в сутки. Начальную дозу необходимо увеличить в 2 раза
Для депонирования сульфадимезина его можно вводить свиньям, оленям, овцам под кожу или внутримышечно в форме 20 % ной суспензии на рыбьем жире, персиковом или рафинированном подсолнечном масле в дозе 1—1,2 мл на 1 кг массы животного. Одновременно назначают препарат внутрь в дозе 0,05 г на 1 кг массы.
При пастереллезе птицы сульфадимезин применяют с кормом из расчета 0,05 г на 1 кг массы животного 1—3 раза в день в течение 2—4 суток.
При лечении ран, язв, ожогов препарат употребляют наружно в форме мельчайшего порошка.
Противопоказания к применению сульфадимезина заболевания кроветворной системы, нефриты, нефрозы, гепатиты. При длительной терапии необходимо проводить исследования крови.
Сульфадимезин выпускают в порошке и таблетках по 0,25 и 0,5 г. Хранят по списку Б в защищенном от света месте в хорошо укупоренной таре. Срок проверочного анализа 10 лет.
Уросульфан — Urosulfanum. пара-Аминобензолсульфопил-мочевина. Синонимы: сульфакарбамид, сульфонилкарбамид, урамид и др.
Белый кристаллический порошок без запаха, кислого вкуса. Мало растворим в воде, трудно растворим в этаноле, легко растворим в разведенных кислотах и растворах едких щелочей. Несовместим с препаратами, отщепляющими серу, новокаином, анестезином, барбитуратами.
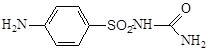
Уросульфан обладает высокой антибактериальной активностью по отношению к стафилококкам и кишечным палочкам.
1.2 Препараты средней продолжительности действия
Препарат быстро всасывается из желудочно-кишечного тракта, что обеспечивает создание высоких концентраций в крови. Максимальная концентрация устанавливается через 1—3 ч с момента введения. Уросульфан незначительно ацетилируется, циркулирует и выделяется в основном в свободной, форме. Быстрое выделение обеспечивает создание высоких концентраций свободной формы препарата в моче, что способствует проявлению его антимикробных свойств при инфекциях мочевых путей. Уросульфан малотоксичен, отложений в мочевых путях не отмечается.
Применяют при колибактериальных и стафилококковых заболеваниях: циститах, пиелитах, инфицированных гидронефрозах, а также других инфекциях мочевых путей. Особенно эффективно применение уросульфана при пиелитах и циститах без нарушения мочеотделения. Назначают внутрь в дозах лошадям 10—30 г, крупному рогатому скоту 10—35, мелкому рогатому скоту 2—5, свиньям 2—4, собакам 1—2 г 3—4 раза в сутки не менее четырех дней подряд. Для внутривенных инъекций используют растворимый уросульфан в форме 5, 10 и 20 %-ных растворов в дозе 0,02—0,03 г на 1 кг массы животного 1—2 раза в сутки. В мочевой пузырь вводят 25 %-ный раствор.
Противопоказания для применения: острый гепатит, агранулоцитоз, гемолитическая анемия.
Выпускают в порошке и таблетках по 0,5 г. Хранят с предосторожностью по списку Б в хорошо укупоренной таре. Срок проверочного анализа 2,5 года.
Сульфазин — Sulfazinum. 2-(пара Аминобензолсульфамидо)-пиримидин Синонимы, адиазин, дебенал, сульфадиазин, пиримал, сульфапиримидин и др.
Белый или желтый порошок без запаха. Практически нерастворим в воде, растворим в этаноле, растворах щелочей и минеральных кислот.
Обладает антибактериальной активностью по отношению к стрептококкам, стафилококкам, пневмококкам, менингококкам, кишечной палочке и другим грамположительным и грамотрицательным бактериям. По антибактериальной активности in vivo превосходит норсульфазол, стрептоцид и некоторые другие сульфаниламидные препараты.
Сульфазин всасывается из желудочно-кишечного тракта сравнительно медленно, максимальная концентрация препарата в крови устанавливается через 4—6 ч. Сульфазин меньше связывается с белками плазмы и медленнее выделяется из организма, чем норсульфазол, что обеспечивает более высокую концентрацию препарата в крови и органах. Ацетилируется незначительно (5-10%), продукты ацетилирования хорошо растворяются в воде и моче.
Применяют при бронхопневмонии, гастроэнтеритах, ларингите, ангине, пуллорозе (тифе), кокцидиозе и других заболеваниях. Дозы внутрь лошадям и крупному рогатому скоту 10—20 г, мелкому рогатому скоту 2—5, свиньям 2—4, собакам 0,5—1, курам 0,5 г 2—3 раза в сутки Для внутривенных инъекций выпускают натриевую соль сульфазина, которую вводят в форме 5—10 %-ного раствора из расчета 0,02—0,03 г на 1 кг массы животного.
Препарат относительно редко вызывает нарушения функций кроветворной системы. Однако могут быть осложнения со стороны мочевых путей гематурия, олигурия, анурия. Для предупреждения этих осложнений необходимо поддерживать усиленный диурез (обильное щелочное питье)
Противопоказания для применения, нефриты, нефрозы
Выпускают в порошке и таблетках по 0,5 г. Хранят по списку Б в хорошо укупоренной таре. Срок проверочного анализа 7 лет.
1.3 Препараты длительного действия
Сульфапиридазин — Sulfapyridazmum. 6 (пара-Аминобензолсульфамидо) 3 метоксипиридазин Синонимы асептилекс, деповернил, депосул, дурасульф, кинекс, ледеркин, лонгисульф, новосульфин, квиносептил, ретасульфин, спофадазин, сульфаметоксипиридазин и др.
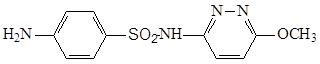
Светло-желтый кристаллический порошок без запаха, горького вкуса. Мало растворим в холодной воде, несколько лучше в горячей (1 : 70). Хорошо растворяется в разбавленных кислотах и щелочах.
Сульфапиридазин активен в отношении многих грамположмтельных и грамогрицательных микроорганизмов. По силе бактериостатического действия равен или несколько уступает этазолу и сульфазину. Установлена высокая чувствительность к препарату стрептококков, стафилококков, кишечной палочки, пастерелл и некоторых штаммов протея. Микроорганизмы, устойчивые к другим сульфаниламидам, резистентны к сульфа пиридазину.
Препарат относится к сульфаниламидам длительного действия. Быстро всасывается из желудочно-кишечного тракта и создает в крови, органах и тканях высокий уровень концентрации, который длительное время сохраняется в организме. Максимальная концентрация препарата у крупного рогатого скота и овец устанавливается через 5—12 ч, у кроликов через 2—8, у собак и кур через 2—5 ч с момента введения. Терапевтический уровень концентрации удерживается в течение 24—48 ч. Сульфапиридазин интенсивно связывается с белками плазмы (70— 95 %) и реабсорбируется в высокой степени (80—90 %) в дистальных отделах почечных канальцев. Препарат хорошо проникает в различные органы и ткани. Наибольшее количество его накапливается в почках, печени, стенках желудка и кишечника, легких.
Сульфапиридазин в организме животных в незначительной степени подвергается процессу ацетилирования. Содержание ацетопродуктов в крови составляет 5—15 %. Ацетилированные производные не обладают антимикробным действием.
Из организма препарат выделяется почками в свободной и ацетилированной форме. В связи с высокой степенью реабсорбции свободной формы в почечных канальцах содержание ацетилированных продуктов в моче достигает 60—80 %. Растворимость ацетопродуктов сульфапиридазина в моче хорошая.
Препарат применяют при различных заболеваниях дыхательных путей молодняка животных, желудочно-кишечных болезнях различной этиологии (гастроэнтеритах, диспепсии, дизентерии, кокцидиозе), сальмонеллезе, колибактериозе, пастереллезе, при респираторном микоплазмозе и пуллорозе-тифе птицы, при послеродовом сепсисе, эндометритах, маститах, инфекциях мочевыводящих путей и желчного пузыря, для профилактики послеоперационных инфекций. Дозы внутрь на 1 кг массы животного: крупному рогатому скоту 50—75 мг, поросятам 75—100, собакам 25—30, курам 100—120, кроликам 250—500 мг 1 раз в сутки. Начальная доза должна быть в 1,5—2 раза больше указанных поддерживающих доз.
При пастереллезе кур сульфапиридазин с лечебной целью назначают в дозах 200 мг (начальная) и 150 мг (поддерживающая) на 1 кг массы с 24-часовым интервалом между введениями. Препарат можно назначить групповым методом с кормом.
В целях предупреждения нежелательного влияния сульфапиридазина животным следует назначить обильное щелочное питье.
Противопоказания для применения: заболевания кроветворной системы, почек, печени, выраженные токсикоаллергические реакции.
Выпускают в порошке и таблетках по 0,5 г. Хранят с предосторожностью по списку Б в плотно укупоренной таре в защищенном от света месте. Срок проверочного анализа 2 года.
Сульфапиридазин-натрий — Sulfapyridazinum-natrium. (пара-Аминобензолсульфамидо)-3-метоксипиридазин-натрий.
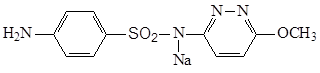
Белый или белый с желтовато-зеленым оттенком кристаллический порошок. Легко растворим в воде, трудно — в этаноле. Постепенно желтеет под действием света. Водные растворы можно стерилизовать при 100°С в течение 30 мин.
По антибактериальному спектру аналогичен сульфапиридазину.
Применяют при тяжело протекающих бронхопневмониях, сальмонеллезе, пастереллезе, роже свиней, послеродовом сепсисе, эндометритах и других инфекционных заболеваниях. Назначают внутривенно или внутримышечно в форме 5 %-ного. или 10 %-ного раствора. Дозы внутривенно на 1 кг массы животного: крупному рогатому скоту 25—50 мг, мелкому рогатому скоту 50—75 мг 1 раз в сутки.
При местной гнойной инфекции препарат используют для орошения ран в виде повязок и тампонов, смоченных 5—10 %-ным раствором. Растворы сульфапиридазин-натрия можно готовить на дистиллированной воде, изотоническом растворе хлорида натрия или на 2—5 %-ном растворе поливинилового спирта. При маститах, эндометритах растворы вводят в полость матки и молочную железу. При местном назначении можно сочетать с назначением сульфапиридазина внутрь.
При применении препарата возможны побочные явления: кожные высыпания, лейкопения. Противопоказания: заболевания кроветворной системы, почек, печени.
Выпускают в порошке и в виде 10 %-ного раствора на 7 %-ном поливиниловом спирте во флаконах по 10 и 100 мл. Хранят по списку Б в сухом, защищенном от света месте. Срок проверочного анализа 3 года.
Сульфадиметоксин — Sulfadimethoxinum. 6-(пара-Аминобензолсульфамидо)-2,6-диметоксипиримидин. Синонимы: депо-сульфамид, мадрибон, мадроксин, суперсульфа, ультрасульфан и др.
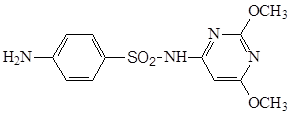
Белый кристаллический порошок без вкуса и запаха. Малорастворим в воде и этаноле, растворим в разбавленных кислотах и щелочах.
Сульфадиметоксин обладает широким спектром антимикробного действия. Наиболее чувствительны к нему менингококки, стрептококки, стафилококки, различные штаммы кишечной палочки, шигеллы, протей. Устойчивы большинство штаммов синегнойной палочки, листерии, некоторые штаммы пневмококка. Отмечены значительные колебания чувствительности штаммов к препарату в пределах одного и того же вида.
Сульфадиметоксин относится к сульфаниламидам длительного действия. Он сравнительно быстро всасывается из желу-дочно-кишечного тракта в кровь, однако интенсивность всасывания несколько ниже, чем у сульфапиридазина. Максимальная концентрация в крови крупного рогатого скота устанавливается через 8—12 ч, овец и коз — 5—8, свиней и собак — 2—5, кур — через 3—5 ч с момента введения. Снижается концентрация препарата в крови значительно медленнее, чем концентрация сульфапиридазина. Терапевтический уровень удерживается в течение 24—48 ч. Сульфадиметоксин несколько хуже сульфапиридазина и сульфамонометоксина проникает в различные органы и ткани. Исключение составляет желчь, где концентрация препарата может превышать его содержание в крови в 1,5—4 раза.
Сульфадиметоксин в крови в очень большой степени связывается с белками плазмы (90—98 %). По интенсивности связывания с белками плазмы животных можно расположить в следующем (убывающем) порядке: собаки, крупный рогатый скот, кролики, крысы. Ацетильное производство присутствует в крови в незначительных количествах (0—15 %).
Сульфадиметоксин выводится из организма очень медленно, в первую очередь за счет большой (93-97%) реабсорбции в канальцах свободной формы препарата, а также в связи со значительной степенью связывания с белками. Ацетильная форма выводится в 2 раза быстрее. В моче Сульфадиметоксин присутствует главным образом в виде глюкуронида, который хорошо растворяется в кислой среде, что практически исключает возможность развития кристаллурии.
Препарат мало токсичен для животных, обладает большой широтой терапевтического действия. Применяют при бронхо-пневмодил молодняка животных, при инфекциях носоглотки, острой форме дизентерии, пастереллезе, кокцидиозе, гастроэнтеритах, колитах, циститах и других заболеваниях. Назначают Сульфадиметоксин внутрь в дозах на 1 кг массы животного: крупному рогатому скоту 50—60 мг, мелкому рогатому скоту 75—100, свиньям 50—100, собакам 20—25, кроликам 250—500, курам 75—100 мг 1 раз в сутки. Начальная доза должна быть в 2 раза больше указанных поддерживающих доз.
При пастереллезе кур Сульфадиметоксин назначают с лечебной целью в дозах 200 мг (начальная) и 100 мг (поддерживающая) на 1 кг массы. С профилактической целью применяют дозы 100 мг (начальная) и 50 мг — (поддерживающая) 1 раз в сутки. Препарат можно употреблять групповым методом с кормом.
В целях предупреждения нежелательного влияния препарата больным животным рекомендуется назначать обильное питье. Сульфадиметоксин противопоказан при токсикоаллергических реакциях, болезнях кроветворной системы, почек, остром гепатите.
Выпускают в порошке и таблетках по 0,5 г. Хранят с предосторожностью по списку Б в хорошо укупоренной таре в защищенном от света месте. Срок проверочного анализа 4 года.
Сульфамонометоксин — Sulfamonomethoxinum. 6-(пара-Аминобензолсульфамидо)-6-метоксипиримидин. Синонимы: диаметон, ДС-36.

Белый или белый с желтоватым оттенком кристаллический порошок. Мало растворим в воде, лучше — в этаноле, легко растворим в разбавленных минеральных кислотах и водных растворах едких щелочей. Несовместим с новокаином, барбитуратами, препаратами, легко отщепляющими серу.
Сульфамонометоксин обладает высокой антибактериальной активностью в отношении стрептококков, менингококков, пастерелл, кишечной палочки, токсоплазм, палочки дизентерии и других микроорганизмов. Препарат оказывает не только высокий бактериостатический эффект in vitro, но и обладает исключительно высокой химиотерапевтической активностью в эксперименте на животных. При инфекциях, вызванных стрептококками, стафилококками, сальмонеллами, превышает по активности сульфапиридазин и сульфадиметоксин.
Препарат относится к сульфаниламидам длительного действия. Хорошо и быстро всасывается из желудочно-кишечного тракта в кровь. Максимальная концентрация в крови устанавливается у крупного рогатого скота через 5—8 ч, овец и коз — через 3—5, свиней — 2—5, собак — 1—3, кур — 2—5 ч с момента введения. Концентрация сульфамонометоксина в крови снижается несколько быстрее, чем при введении сульфапири-лазина и сульфадиметоксина. Препарат довольно хорошо диффундирует в органы и ткани. Более высокие концентрации останавливают в почках, легких, печени. Хорошо проникает через гематоэнцефалический барьер. В крови интенсивно связывается с белками (64,6—92,5 %), но образующая связь непрочная. Ацетильное производство в крови достигает 5—14 %, в моче 50—67 %. Выводится из организма медленно и главным образом почками. В моче содержится 50—70 % ацетильного производного, 20—30 % глюкуронида и 10—20 % свободного препарата. Ацетильная форма сульфамонометоксина более растворима, чем свободная.
Применяют при инфекциях дыхательных путей, гнойных инфекциях уха, горла, носа, дизентерии, энтероколитах, инфекциях желче- и мочевыводящих путей, гнойных менингитах. Препарат дают внутрь в дозах на 1 кг массы животного, крупному рогатому скоту 50—100 мг, мелкому рогатому скоту 75— 100, свиньям 50—100, собакам 25—50, кроликам 250—500, курам 100 мг 1 раз в сутки. Начальная доза должна быть увеличена вдвое.
Сульфамонометоксин противопоказан при повышенной чувствительности к сульфаниламидным препаратам, при гемолитической анемии, агранулоцитозе, остром гепатите, нефритах.
Выпускают в порошке и таблетках по 0,5 г. Хранят по списку Б в хорошо укупоренной таре в защищенном от света месте. Срок проверочного анализа 3 года.
Сульфален — Sulfalenum. 2-(пара-Аминобензолсульфамидо)-3-метоксипиразин. Синонимы: келфизин, сульфаметопиразин, сульфаметоксипиразин, сульфапиразинметоксин.
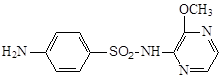
Белый кристаллический порошок. Мало растворим в воде, легко растворим в растворах щелочей. Несовместим с новокаином, барбитуратами, препаратами, легко отщепляющими серу.
По антибактериальному спектру действия близок к другим сульфаниламидным препаратам.
Сульфален относится к сульфаниламидам сверхдлительного действия. Быстро всасывается, и максимальная концентрация в крови устанавливается через 4—6 ч Терапевтические концентрации в организме животных и птиц могут удерживаться в печени 3—5 дн. Выводятся из организма очень медленно. Хорошо переносятся животными.
Применяют при бронхопневмонии молодняка, колибактериозе, сальмонеллезе, пастереллезе, токсоплазиозе, респираторном микоплазмозе, а также уретритах, маститах и других заболеваниях. Назначают внутрь в дозах на 1 кг массы животного - телятам молочникам 20—25 мг, поросятам сосунам 40—50, курам 100—150 мг 1 раз в сутки, повторно вводят через 5—7 дн. При тяжелом течении болезни препарат назначают повторно через 3—4 дня. Продолжительность лечения — не менее 10— 12 дн.
При бронхопневмонии телят 2—3-месячного возраста сульфален назначают внутрь по 50 мг (начальная доза), а затем ежедневно по 20 мг (поддерживающая доза) в течение 7—10 дн. Одновременно рекомендуется вводить витаминные препараты (группы А, В и С), а также проводить интенсивную симптоматическую терапию.
При колибактериозе и сальмонеллезе поросят до 2—4-месячного возраста сульфален назначают 1 раз в сутки из расчета на 1 кг массы животного: в первый день 100 мг, в последующие — по 20 мг.
Возможные побочные явления и меры их профилактики такие же, как и при применении других пролонгированных сульфаниламидов.
Выпускают в порошке и таблетках по 0,2, 0,5 и 2 г; во флаконах по 60 мл 5 %-ной суспензии. Хранят по списку Б в хорошо укупоренной таре. Срок проверочного анализа 5 лет.
Салазопиридазин — Salazopyridazinum. 5-napa-/N-(3-Meтоксипиридазинил-6)-сульфамидо/-фенилазосалициловая кислота.

Желтовато-оранжевый мелкокристаллический порошок без вкуса и запаха. Практически нерастворим в воде, растворим в растворах щелочей и гидрокарбонатов. Получают в результате азосочетания сульфапиридазина (65 %) и салициловой кислоты.
Антимикробное действие салазопиридазина проявляется только после его расщепления в желудочно-кишечном тракте с освобождением свободного сульфапиридазина и 5-аминоса-лициловой кислоты. Терапевтическое действие препарата определяется в первую очередь способностью салазосульфанилами-дов накапливаться в соединительной ткани толстого кишечника и оказывать прямое действие на воспалительный процесс. Продукты метаболизма салазопиридазина действуют антибактериально, противовоспалительно и иммунодепрессивно. Салазопиридазин более активен, чем салазопиридин, однако по степени химиотерапевтического действия уступает сульфапиридазину,
По мере расщепления препарата освобождающийся сульфапиридазин постепенно всасывается и достигает максимальной концентрации в крови и органах через 4—6 ч. Концентрация свободного сульфапиридазина в крови и органах не достигает высокого уровня, но длительно удерживается на терапевтическом и субтерапевтическом уровнях. Препарат малотоксичен. При длительном назначении в течение 30—40 дн. не вызывает изменений со стороны крови и мочи.
Рекомендован для лечения животных, больных различными формами колитов, энтероколитов и при тех же показаниях, что и сульфапиридазин. Дозы внутрь молодняку сельскохозяйственных животных 25—50 мг на 1 кг массы 2 раза в сутки.
При применении салазопиридазина возможны побочные явления, наблюдаемые иногда при употреблении сульфаниламидов и салициловой кислоты: аллергические реакции, лейкопения, диспептические расстройства При возникновении побочных реакций следует снизить суточную дозу или отменить препарат Салазопиридазип противопоказан при наличии выраженных токсикоаллергических реакций на сульфаниламиды.
Выпускают в порошке, таблетках по 0,5 г и в виде 5 %-ной суспензии. Хранят в плотно укупоренной таре в защищенном от света месте. Срок проверочного анализа 5 лет.
Салазодиметоксин — Salazodimethoxinum. 5-napa-/N-(2,4-диметоксипиримидинил-6) — сульфонамидо/-фенилазо-салициловая кислота.
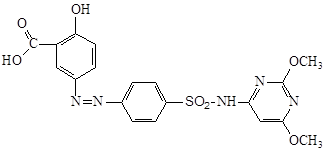
Порошок оранжевого цвета без вкуса и запаха. Нерастворим в воде, растворим в водных растворах щелочей и гидрокарбонатов. Салазодиметоксин — продукт азосочетания сульфадиметоксина (67,5 %) и салициловой кислоты.
Механизм действия, фармакокинетика, показания и противопоказания, схема применения салазодиметоксина аналогичны таковым салазопиридазина.
Выпускают в порошке и таблетках по 0,5 г. Хранят по списку Б в плотно закрытой упаковке в защищенном от света месте. Срок проверочного анализа 2 года.
СУЛЬФАНИЛАМИДЫ, ПЛОХО ВСАСЫВАЮЩИЕСЯ ИЗ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Сульгин — Sulginum. пара-Аминобензолсульфогуанидин. Синонимы абигуанил, асептилгуанидин, ганидан, нео-сульфонамид, сульфагуанидин и др.
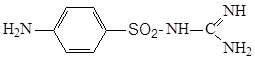
Белый кристаллический порошок без запаха. Очень мало растворим в воде, в разведенных минеральных кислотах (соляной, азотной), мало растворим в этаноле. Несовместим с новокаином, анестезином, барбитуратами, препаратами, отщепляющими серу.
Сульгин обладает достаточно высокой антимикробной активностью в отношении кишечной группы патогенных микроорганизмов и некоторых грамположительных форм.
Препарат медленно и в небольших количествах всасывается из желудочно-кишечного тракта. Его основная масса задерживается в кишечнике и создает там высокую концентрацию. В организме животных сульгин умеренно ацетилируется, выделяется главным образом с фекалиями. Большая концентрация препарата в пищеварительном тракте обеспечивает эффективное воздействие на кишечную микрофлору.
Применяют при бациллярной дизентерии, колитах, энтероколитах, для профилактики послеоперационных осложнений при операциях на кишечнике. Назначают внутрь в дозах лошадям 19—20 г, крупному рогатому скоту 15—25, мелкому рогатому скоту 2—5, свиньям 1—5, телятам молочникам 2—3, поросятам сосунам 0,3—0,5, курам 0,2—0,3 г 2 раза в сутки. Начальная доза должна быть вдвое больше указанных поддерживающих доз.
Для предупреждения выпадения кристаллов ацетилированного сульгина в почках следует назначать обильное питье.
Противопоказания к применению повышенная чувствительность к сульфаниламидам, заболевания кроветворных органов, острый гепатит и нефриты,
Выпускают в порошке и таблетках по 0,5 г. Хранят с предосторожностью по списку Б в хорошо укупоренной таре. Срок проверочного анализа 5 лет.
Фталазол — Phthalazolum. 2-пара-(орто-Карбоксибензами-до)-бензолсульфамидотиазол Синонимы: сульфатамидин, талазол, талазон, таледрон, талидин, талисталил, талисульфазол, фталилсульфатиазол.
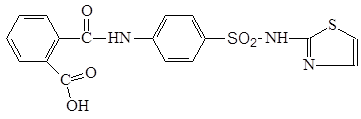
Белый или белый со слегка желтоватым оттенком порошок. Практически нерастворим в воде, эфире и хлороформе; очень мало растворим в этаноле; растворим в водном растворе карбоната натрия, легко растворим в водном растворе едкого натра. Несовместим с новокаином, анестезином, препаратами, отщепляющими серу.
Обладает антимикробной активностью по отношению к возбудителю дизентерии, сальмонеллеза, энтеропатогенным штаммам кишечной палочки и некоторым другим бактериям. Механизм противомикробного действия фталазола, как и других сульфаниламидов, заключается в нарушении процесса ассимиляции микробной клеткой “ростовых факторов” — фолиевой кислоты и близких к ней веществ, в состав которых входит парааминобензойная кислота
Фталазол очень медленно и в незначительных количествах всасывается из желудочно-кишечного тракта, в результате чего в крови практически не создается терапевтической концентрации. Основная масса препарата задерживается в желудочно-кишечном тракте, где постепенно происходит отщепление активной (сульфаниламидной) части молекулы фталазола. Высокая концентрация фталазола в пищеварительном тракте обеспечивает его эффективное воздействие на кишечную микрофлору. Препарат отличается малой токсичностью, хорошо переносится животными.
Применяют при дизентерии, гастроэнтеритах, колитах, диспепсии новорожденных, кокцидиозе. Назначают внутрь в дозах: лошадям 10—Г5 г, крупному рогатому скоту 10—20, мелкому рогатому скоту 2—5, свиньям 1—3, собакам 0,5—1, курам 0,1—0,2 г 2 раза в сутки. Начальная доза может быть вдвое больше последующих.
Побочных явлений фталазол обычно не вызывает. Противопоказание — повышенная чувствительность животных к сульфаниламидным препаратам
Выпускают в порошке и таблетках по 0,5 г. Хранят по списку Б в хорошо укупоренной таре. Срок проверочного анализа 10 лет.
Дисульформин — Disulformmum. 1,4,4 N-Триметилен-бис-(4-сульфанилил-сульфаниламид).
Белый или слегка желтоватый мелкокристаллический порошок. Нерастворим в воде и разбавленных минеральных кислотах, хорошо растворим в растворах едких и углекислых щелочей. При нагревании с водой гидролизуется с выделением формальдегида Несовместим с солями тяжелых металлов, новокаином, анестезином, барбитуратами и препаратами, легко отщепляющими серу
Дисульформин обладает антибактериальной активностью в отношении кишечной палочки, возбудителей дизентерии, сальмонеллеза, колибактериоза. Оказывает бактериостатическое действие — нарушает обмен веществ, тормозит рост и размножение микробов.
Препарат медленно всасывается из желудочно-кишечного тракта и не создает высоких концентрации в крови Его основная масса задерживается в кишечнике, где под влиянием щелочной среды происходит гидролиз дисульформина с отщеплением сульфаниламида (дисульфана) и формальдегида. В результате высокой концентрации препарата в пищеварительном тракте в сочетании с активностью дисульфана и формальдегида против кишечной микрофлоры эффективен при кишечных инфекциях.
Применяют при бациллярной дизентерии, гастроэнтеритах сальмонеллезной этиологии, остром колите и энтероколитах. Назначают внутрь в дозах: лошадям 5—10 г, крупному рогатому скоту 10—15, телятам молочникам 2—4, курам 0,2—0,3 г 2-3 раза в сутки.
Противопоказания к применению повышенная чувствительность животных к сульфаниламидам, острый гепатит, нефриты, нефрозы, агранулоцитоз
Выпускают в порошке и таблетках по 0,5 и 1 г. Хранят по списку Б в хорошо укупоренной таре, предохраняющей от действия света. Срок проверочного анализа 5 лет
Фтазин — Phtazmum 6 (пара Фталиламинобензоилсульфаниламидо) 3-метоксипиридазин.
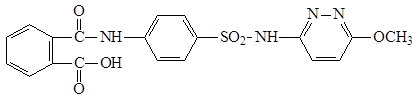
Белый или белый со слегка желтоватым оттенком кристаллический порошок без запаха. Практически нерастворим в воде и этаноле. Легко растворим в растворах щелочей и гидрокарбоната натрия. По химическому строению близок, с одной стороны, фталазолу, а с другой — сульфапиридазину
Фтазин обладает широким антибактериальным спектром действия, активен в отношении пневмококков, стафилококков, стрептококков, кишечной палочки, сальмонелл, пастерелл, возбудителей дизентерии и других микроорганизмов. По антибактериальному спектру близок к сульфапиридазину. Действует бактериостатически — нарушает обмен веществ, процессы роста и размножения микробных клеток. Бактериостатические концентрации фтазина в 30—300 раз выше, чем сульфапиридазина и в 2—5 раз ниже, чем фталазола.
Медленно всасывается из желудочно-кишечного тракта. В кишечнике постепенно расщепляется с выделением свободного сульфапиридазина, который по мере отщепления всасывается. В связи с медленным отщеплением сульфапиридазина в кишечнике поддерживается высокая концентрация препарата, что обеспечивает хорошую эффективность при лечении желудочно-кишечных заболеваний Всосавшийся сульфапиридазин создает значительные концентрации в крови и оказывает резорбтивное действие, что очень важно при тяжелых формах дизентерии и других желудочно-кишечных заболеваниях. Выводится из организма медленно.
Фтазин хорошо переносится животными, не вызывает заметных нарушений в общем состоянии даже в тех случаях, когда доза превышает лечебную.
Применяют с лечебной и профилактической целью при дизентерии, диспепсии новорожденных, энтероколитах, колитах, кокцидиозе Основное преимущество препарата — меньшая токсичность и более длительное пребывание в организме. Назначают индивидуально или групповым методом с кормом 2 раза в сутки Дозы на 1 кг массы животного: крупному и мелкому рогатому скоту 10—15 мг, телятам и ягнятам 15—20, свиньям 8—12, поросятам 12—16, цыплятам 30—50 мг. Начальною дозу увеличивают в 1,5—2 раза. При лечении кокцидиоза цыплят рекомендуют использовать смесь фтазина с неомицином в дозах: 100—150 мг фтазина и 500—750 мкг неомицина на цыпленка 2 раза в течение 6—7 дн.
Для профилактики заболеваний фтазин назначают в половинных от указанных доз размерах 2 раза в сутки в течение 4—5 дн.
Противопоказания к применению: повышенная чувствительность животных к сульфаниламидам, заболевания кроветворных органов, острый гепатит, нефриты, нефрозы.
Выпускают в порошке и таблетках по 0,5 г. Хранят по списку Б в хорошо укупоренной таре, предохраняющей от действия света и влаги. Срок проверочного анализа 2 года.
Рис. В.1 Молекула в ab initio
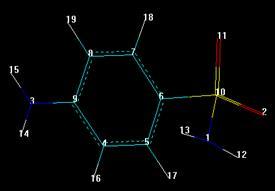
Рис. В.2 Молекула в AM1

Таблица В.1 Рассчитанные длины связей сульфаниламида
| Связь |
Abinitio (минимальный базис), А |
INDO |
АМ1, А |
Эксперимент |
| 15-3 |
0,99557 |
0,6831 |
1,06834 |
0,99560 |
| 14-3 |
0,995615 |
0,6815 |
1,06838 |
0,99563 |
| 3-9 |
1,36256 |
1,39392 |
1,39441 |
1,3626 |
| 9-8 |
1,3988 |
1,39925 |
1,39963 |
1,3999 |
| 8-7 |
1,37449 |
1,38508 |
1,38561 |
1,3756 |
| 7-6 |
1,37609 |
1,37786 |
1,37734 |
1,3765 |
| 6-5 |
1,37776 |
1,37691 |
1,37725 |
1,37787 |
| 5-4 |
1,37198 |
1,38617 |
1,3856 |
1,38009 |
| 4-9 |
1,40245 |
1,40045 |
1,39986 |
1,3998 |
| 6-10 |
1,78262 |
1,91442 |
1,91399 |
1,79526 |
| 10-11 |
1,57585 |
1,92634 |
1,92773 |
1,5765 |
| 10-2 |
1,57918 |
1,93018 |
1,92971 |
1,57815 |
| 10-1 |
1,70003 |
1,8435 |
1,84402 |
1,6995 |
| 13-1 |
1,00274 |
1,0716 |
1,07174 |
1,00125 |
| 13-2 |
1,00337 |
1,07176 |
1,07178 |
1,00569 |
Таблица В.2 Рассчитанные валентные углы сульфаниламида
| Угол |
Abinitio (минимальный базис), 0 |
INDO |
АМ1, 0 |
Эксперимент |
| 15-3-9 |
121,031 |
116,912 |
116,617 |
120,999 |
| 14-3-9 |
121,12 |
117,015 |
116,656 |
121,01 |
| 2-10-11 |
117,858 |
132,396 |
137,403 |
117,568 |
| 6-10-1 |
100,991 |
97,9199 |
98,0148 |
100,825 |
| 7-6-10 |
118,201 |
115,458 |
115,877 |
118,105 |
| 5-6-10 |
120,99 |
117,83 |
117,382 |
121,00 |
| 11-10-6 |
106,453 |
103,919 |
104,613 |
106,589 |
| 6-10-2 |
114,264 |
108,844 |
106,384 |
114,589 |
| 2-10-1 |
103,917 |
102,752 |
101,56 |
103,562 |
| 13-1-12 |
117,329 |
105,836 |
105,953 |
117,112 |
Рассчитанные молекулярные свойства сульфаниламида методом АМ1
Полнаяэнергия: -49060, 1875
Binding energy: -1904, 776245
Heat of formation: -51,102
Electronic energy: -229566
Nuclear energy: 180506
Дипольныймомент: 0
RMS градиент: 0,1158
Градиент X: 0,05363
Градиент Y: 0,07288
Градиент Z: 0,07220
| 20 Substructure descriptors; 0 new. |
| Antibacterial |
| Toxic |
| Embryotoxic |
| Teratogen |
| Antibiotic |
| Dihydropteroate synthase inhibitor |
| 66 Possible activities at Pa > 30% |
| Pa Pi Activity: |
| 0,964 0,003 Antiprotozoal (Toxoplasma)
|
| 0,951 0,003 Dopamine D4 agonist
|
| 0,933 0,013 Hematotoxic
|
| 0,870 0,004 Para amino benzoic acid antagonist
|
| 0,857 0,008 Cardiovascular analeptic |
| 0,846 0,004 Dihydropteroate synthase inhibitor |
| 0,847 0,005 Cyclooxygenase 1 inhibitor |
| 0,844 0,005 Thiol oxidase inhibitor |
| 0,804 0,003 Diuretic inhibitor |
| 0,781 0,007 Laccase inhibitor |
| 0,776 0,004 Diuretic
|
| 0,761 0,010 Indole-3-acetaldehyde oxidase inhibitor |
| 0,751 0,003 Antiviral (Trachoma) |
| 0,742 0,003 Saluretic |
| 0,726 0,007 Ophthalmic drug |
| 0,715 0,003 Electrolyte absorption antagonist |
| 0,726 0,016 Antiepileptic
|
| 0,720 0,019 Torsades de pointes |
| 0,706 0,005 CDK2/cyclin A inhibitor |
| 0,685 0,010 Indole 2,3-dioxygenase inhibitor |
| 0,708 0,035 Arrhythmogenic |
| 0,675 0,009 2,3-Dihydroxybenzoate 2,3-dioxygenase inhibitor |
| 0,681 0,016 Antiarthritic |
| 0,669 0,035 Oxidoreductase inhibitor |
| 0,668 0,037 Antineoplastic (colorectal cancer) |
| 0,633 0,004 Loop diuretic |
| 0,648 0,025 L-ascorbate oxidase inhibitor |
| 0,625 0,007 Cyclooxygenase inhibitor |
| 0,639 0,026 Cathepsin G inhibitor |
| 0,613 0,022 Diamine N-acetyltransferase inhibitor |
| 0,599 0,008 Uric acid excretion stimulant |
| 0,595 0,006 Antiglaucomic |
| 0,593 0,017 Ovulation inhibitor |
| 0,602 0,032 Gingipain K inhibitor |
| 0,565 0,006 O-aminophenol oxidase inhibitor |
| 0,584 0,025 CYP3A2 substrate |
| 0,602 0,044 3-Hydroxybenzoate 4-monooxygenase inhibitor |
| 0,576 0,020 Carcinogenic, female mice |
| 0,551 0,006 Gingipain R inhibitor |
| 0,536 0,002 Carbonic anhydrase I inhibitor |
| 0,560 0,029 Cholestanetriol 26-monooxygenase inhibitor |
| 0,537 0,007 CYP2C10 substrate |
| 0,537 0,008 Phosphoenolpyruvate carboxykinase (ATP) inhibitor |
| 0,554 0,028 Carcinogenic, male rats |
| 0,532 0,007 Iodide peroxidase inhibitor |
| 0,555 0,035 Antiinflammatory, intestinal |
| 0,541 0,022 Prostaglandin H2 antagonist |
| 0,548 0,033 Cytochrome P450 CYP2C9 inhibitor |
| 0,555 0,040 Antianemic |
| 0,511 0,001 Carbonic anhydrase V inhibitor |
| 0,510 0,007 CYP2B2 substrate |
| 0,517 0,014 Thiopurine S-methyltransferase inhibitor |
| 0,502 0,002 Carbonic anhydrase II inhibitor |
| 0,557 0,059 QT interval prolongation |
| 0,519 0,029 Nitrate reductase inhibitor |
| 0,510 0,024 Interleukin antagonist |
| 0,556 0,071 Antineoplastic (brain cancer) |
| 0,500 0,019 CYP4B substrate |
| 0,566 0,101 Integrin antagonist |
| 0,504 0,040 CYP2C9 substrate |
| 0,580 0,115 Arylalkyl acylamidase inhibitor |
| 0,571 0,109 Convulsant |
| 0,541 0,085 Arylacetonitrilase inhibitor |
| 0,540 0,085 Lysase inhibitor |
| 0,526 0,074 Teratogen |
Рис. Г.1 Молекула в abinitioРис. Г.2 Молекула в AM1


Таблица Г.1 Рассчитанные длины связей сульгина
| Связь |
Abinitio (минимальный базис), А |
INDO |
АМ1, А |
Эксперимент |
| 20-7 |
0,995426 |
1,06825 |
0,991165 |
0,99548 |
| 19-7 |
0,995417 |
1,0683 |
0,991166 |
0,99586 |
| 7-6 |
1,36396 |
1,39417 |
1,37849 |
1,37002 |
| 6-5 |
1,39981 |
1,39975 |
1,42075 |
1,40 |
| 5-4 |
1,37481 |
1,38573 |
1,38331 |
1,37521 |
| 4-3 |
1,37538 |
1,37808 |
1,40225 |
1,37259 |
| 3-2 |
1,37656 |
1,37816 |
1,40224 |
1,37625 |
| 2-1 |
1,37339 |
1,38541 |
1,38289 |
1,37589 |
| 3-8 |
1,79 |
1,91129 |
1,68362 |
1,758 |
| 8-10 |
1,57554 |
1,9285 |
1,39811 |
1,5758 |
| 8-9 |
1,57663 |
1,93046 |
1,40041 |
1,57569 |
| 8-11 |
1,71071 |
1,85252 |
1,65898 |
1,70 |
| 11-21 |
1,00056 |
0,7258 |
0,991014 |
1,0 |
| 11-12 |
1,40161 |
1,39326 |
1,4209 |
1,40589 |
| 12-13 |
1,37694 |
1,38905 |
1,42807 |
1,37521 |
| 3-23 |
0,996471 |
1,06773 |
0,994716 |
0,9954 |
| 13-22 |
0,996121 |
1,06789 |
0,995962 |
1,0 |
| 12-14 |
1,25155 |
1,29898 |
1,30964 |
1,25489 |
| 14-24 |
1,00643 |
1,0733 |
0,993793 |
1,00589 |
Таблица Г.2 Рассчитанные валентные углы сульгина
| Угол |
Abinitio (минимальный базис), 0 |
INDO, 0 |
АМ1, 0 |
Эксперимент |
| 23-13-22 |
117,425 |
109,843 |
112,842 |
117,582 |
| 23-13-12 |
120,172 |
117,345 |
116,154 |
120,547 |
| 24-14-12 |
117,522 |
116,284 |
116,731 |
117,365 |
| 14-12-11 |
118,567 |
123,237 |
115,637 |
118,359 |
| 3-8-11 |
97,213 |
94,305 |
97,6621 |
97,5 |
| 10-8-9 |
120,732 |
137,499 |
118,173 |
120,489 |
| 20-7-19 |
117,818 |
109,349 |
116,758 |
117,236 |
| 2-3-8 |
119,744 |
116,999 |
120,919 |
119,748 |
| 10-8-11 |
112,587 |
108,694 |
111,474 |
112,589 |
| 9-8-11 |
109 |
101,344 |
110,963 |
109,426 |
Рассчитанные молекулярные свойства сульгина методом АМ1
Полнаяэнергия: -62175,125
Binding energy: -2372,508
Heat of formation: -17,7407
Electronic energy: 328239,375
Nuclear energy: 266064,25
Дипольныймомент: 7,814
RMS градиент: 0,09855
Градиент X: 0,04252
Градиент Y: 0,05513
Градиент Z: 0,06976
| 25 Substructure descriptors; 2 new. |
| 38 Possible activities at Pa > 50% |
| Pa Pi Activity: |
| 0,947 0,008 Hematotoxic
|
| 0,930 0,005 Antiprotozoal (Toxoplasma)
|
| 0,926 0,003 Dihydropteroate synthase inhibitor |
| 0,900 0,003 Para amino benzoic acid antagonist
|
| 0,863 0,005 Pyruvate kinase inhibitor |
| 0,797 0,019 Integrin antagonist |
| 0,769 0,008 Cathepsin G inhibitor |
| 0,764 0,004 Adenylate kinase inhibitor |
| 0,759 0,007 Prostaglandin H2 antagonist |
| 0,751 0,006 Prostaglandin E1 antagonist |
| 0,751 0,018 Insulinotropin agonist |
| 0,738 0,007 Gingipain K inhibitor |
| 0,723 0,007 Antianginal |
| 0,695 0,006 6 Phosphofructokinase inhibitor |
| 0,679 0,008 Corticotropin releasing factor antagonist |
| 0,669 0,004 Gingipain R inhibitor |
| 0,692 0,046 Dopamine D4 agonist |
| 0,672 0,036 Antineoplastic (colorectal cancer) |
| 0,627 0,007 GABA aminotransferase inhibitor |
| 0,641 0,028 Thiol oxidase inhibitor |
| 0,622 0,019 Diamine N-acetyltransferase inhibitor |
| 0,617 0,018 Muscular dystrophy treatment |
| 0,623 0,026 Cyclooxygenase 1 inhibitor |
| 0,607 0,011 Channel-conductance-controlling ATPase inhibitor |
| 0,612 0,026 Insulysin inhibitor |
| 0,631 0,048 Antineoplastic (brain cancer) |
| 0,577 0,003 Sulfonylureas |
| 0,579 0,018 Legumain inhibitor |
| 0,575 0,021 Cytochrome P450 CYP2C9 inhibitor |
| 0,617 0,071 Antinephritic |
| 0,546 0,014 Gamma-glutamyltransferase inhibitor |
| 0,536 0,021 Platelet adhesion inhibitor |
| 0,520 0,007 Loop diuretic |
| 0,580 0,069 Laccase inhibitor |
| 0,514 0,018 Subtilisin inhibitor |
| 0,506 0,012 CYP2C10 substrate |
| 0,533 0,045 Antiinflammatory, intestinal |
Приложение Д
Рис. Д.1 Молекула в abinitioРис. Д.2 Молекула в AM1
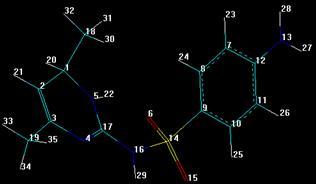

Таблица Д.1 Рассчитанные длины связей сульфадимезина
| Связь |
Abinitio (минимальный базис), А |
INDO, А |
АМ1, А |
Эксперимент |
| 13-28 |
0,995721 |
1,06838 |
0,990704 |
0,99428 |
| 13-27 |
0,995756 |
1,06829 |
0,990582 |
0,99568 |
| 13-12 |
1,36092 |
1,39286 |
1,37716 |
1,3546 |
| 12-11 |
1,40248 |
1,40007 |
1,42207 |
1,4058 |
| 11-10 |
1,37187 |
1,38653 |
1,38142 |
1,37259 |
| 10-9 |
1,3781 |
1,37635 |
1,40498 |
1,37126 |
| 9-8 |
1,37658 |
1,37697 |
1,40326 |
1,37658 |
| 8-7 |
1,37317 |
1,3858 |
1,38353 |
1,37248 |
| 7-12 |
1,40056 |
1,40006 |
1,42035 |
1,40 |
| 9-14 |
1,7833 |
1,91971 |
1,65908 |
1,7654 |
| 14-6 |
1,58452 |
1,90898 |
1,40135 |
1,58624 |
| 14-15 |
1,57749 |
1,93554 |
1,41607 |
1,5778 |
| 14-16 |
1,69873 |
1,85885 |
1,65696 |
1,70 |
| 16-17 |
1,3929 |
1,38514 |
1,0325 |
1,3944 |
| 17-5 |
1,34898 |
1,36903 |
1,3843 |
1,3426 |
| 5-1 |
1,47709 |
1,42733 |
1,35295 |
1,47256 |
| 1-2 |
1,51535 |
1,46651 |
1,41031 |
1,51248 |
| 2-3 |
1,32317 |
1,35116 |
1,41124 |
1,326 |
| 3-4 |
1,41485 |
1,4025 |
1,35223 |
1,418 |
| 4-17 |
1,27411 |
1,32434 |
1,38645 |
1,27562 |
| 1-18 |
1,54175 |
1,47571 |
1,49513 |
1,5487 |
| 3-19 |
1,50349 |
1,45993 |
1,49541 |
1,5032 |
Таблица Д.2 Рассчитанные валентные углы сульфадимезина
| Угол |
Abinitio (минимальный базис), 0 |
INDO, 0 |
АМ1, 0 |
Эксперимент |
| 28-13-27 |
117,792 |
109,473 |
117,054 |
117,268 |
| 1-5-17 |
120,779 |
121,345 |
116,376 |
120,236 |
| 3-4-17 |
116,995 |
112,797 |
116,189 |
116,154 |
| 4-17-16 |
116,952 |
113,257 |
118,041 |
117 |
| 6-14-15 |
120,536 |
135,83 |
115,761 |
120,125 |
| 9-14-6 |
107,391 |
101,842 |
110,818 |
107,487 |
| 9-14-15 |
109,827 |
105,593 |
108,935 |
109,625 |
| 18-1-5 |
110,248 |
112,22 |
118,79 |
110,587 |
| 19-3-4 |
113,301 |
112,277 |
118,769 |
113,246 |
| 8-9-14 |
119,532 |
115,273 |
121,676 |
119,326 |
Рассчитанные молекулярные свойства сульфадимезина методом АМ1
Полнаяэнергия: -78205,17969
Binding energy: 3420,6650
Heat of formation: -3,0390
Electronic energy: -497884,4375
Nuclear energy: 419679,25
Дипольныймомент: 7,099
RMS градиент: 0,09731
Градиент X: 0,05463
Градиент Y: 0,06094
Градиент Z: 0,05265
| 29 Substructure descriptors; 0 new. |
| Antibacterial |
| Teratogen |
| Carcinogenic |
| Antibiotic |
| Carcinogenic, group 3 |
| Carcinogenic, female rats |
| Carcinogenic, male rats |
| CYP2 substrate |
| Carcinogenic, female mice |
| Carcinogenic, male mice |
| CYP3A substrate |
| CYP2B substrate |
| CYP1A substrate |
| CYP1A1 substrate |
| CYP2C substrate |
| CYP2C11 substrate |
| Diamine N-acetyltransferase inhibitor |
| 28 Possible activities at Pa > 50% |
| Pa Pi Activity: |
| 0,970 0,002 Antiprotozoal (Toxoplasma)
|
| 0,938 0,002 Dihydropteroate synthase inhibitor |
| 0,881 0,004 Para amino benzoic acid antagonist
|
| 0,791 0,049 Hematotoxic |
| 0,758 0,018 Antineoplastic (colorectal cancer) |
| 0,795 0,073 Prolyl aminopeptidase inhibitor |
| 0,708 0,041 Dopamine D4 agonist |
| 0,699 0,032 Antineoplastic (brain cancer) |
| 0,677 0,029 Torsades de pointes |
| 0,656 0,041 Oxidoreductase inhibitor |
| 0,621 0,015 Prostaglandin H2 antagonist |
| 0,616 0,011 Cytochrome P450 CYP2C9 inhibitor |
| 0,651 0,055 Arrhythmogenic |
| 0,635 0,042 Laccase inhibitor |
| 0,598 0,020 Antiviral (Picornavirus) |
| 0,599 0,037 Thiol oxidase inhibitor |
| 0,575 0,048 Cathepsin G inhibitor |
| 0,569 0,044 Gingipain K inhibitor |
| 0,536 0,012 Antidiabetic
|
| 0,558 0,037 CYP3A2 substrate |
| 0,555 0,035 Antiinflammatory, intestinal |
| 0,506 0,006 HIV-1 integrase (3'-Processing) inhibitor |
| 0,505 0,025 Prostaglandin E1 antagonist |
| 0,514 0,036 Collagen inhibitor |
| 0,521 0,044 2,3-Dihydroxybenzoate 2,3-dioxygenase inhibitor |
| 0,529 0,059 Indole 2,3-dioxygenase inhibitor |
| 0,512 0,047 Cytochrome P450 inhibitor |
| 0,531 0,203 Antinephritic |
Приложение Е
Рис. Е.1 Молекула в abinitio Рис. Е.2 Молекула в AM1
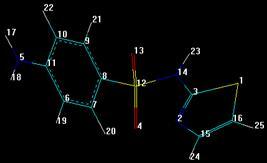 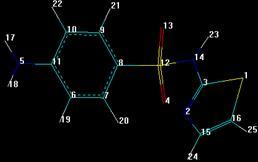
Таблица Е.1 Рассчитанные длины связей норсульфазола
| Связь |
Abinitio (минимальный базис), А |
INDO, А |
АМ1, А |
Эксперимент |
| 17-5 |
0,995612 |
1,06816 |
1,01 |
0,99548 |
| 18-5 |
0,995591 |
1,06802 |
0,990705 |
0,99256 |
| 5-11 |
1,3619 |
1,39326 |
1,3751 |
1,3678 |
| 11-10 |
1,40099 |
1,39976 |
1,42276 |
1,40 |
| 10-9 |
1,37268 |
1,38544 |
1,38203 |
1,37246 |
| 9-8 |
1,37763 |
1,37692 |
1,40647 |
1,3784 |
| 8-7 |
1,37757 |
1.37604 |
1,40339 |
1,37264 |
| 7-6 |
1,37246 |
1,38575 |
1,38213 |
1,37462 |
| 6-11 |
1,4015 |
1,40065 |
1,42028 |
1,40 |
| 8-12 |
1,78142 |
1,92024 |
1,65756 |
1,78154 |
| 12-13 |
1,57982 |
1,92757 |
1,41632 |
1,5793 |
| 12-4 |
1,56896 |
1,92859 |
1,39923 |
1,5624 |
| 12-14 |
1,72222 |
1,85325 |
1,66363 |
1,7236 |
| 14-23 |
1,00193 |
0,7051 |
0,996966 |
1,0 |
| 14-3 |
1,35648 |
1,36005 |
1,38039 |
1,3256 |
| 3-2 |
1,57071 |
1,29564 |
1,35162 |
1,5798 |
| 2-15 |
1,40382 |
1,39723 |
1.38194 |
1,4062 |
| 15-16 |
1,3282 |
1,32666 |
1,38272 |
1,3248 |
| 16-1 |
1,81343 |
1,86959 |
1,67758 |
1,8147 |
| 1-3 |
1,8234 |
1,89812 |
1,75158 |
1,8264 |
| 16-25 |
1,06327 |
1,10813 |
1,0868 |
1,048 |
| 15-24 |
1,06524 |
1,12019 |
1,09708 |
1,0367 |
Таблица Е.2 Рассчитанные валентные углы норсульфазола
| Угол |
Abinitio (минимальный базис), 0 |
INDO, 0 |
АМ1, 0 |
Эксперимент |
| 17-5-18 |
117,799 |
109,525 |
120,828 |
117,656 |
| 3-1-16 |
86,1528 |
83,1738 |
90,5661 |
86,236 |
| 1-16-15 |
110,184 |
110,015 |
110,73 |
110,489 |
| 1-3-2 |
114,61 |
116,952 |
113,303 |
114,324 |
| 13-12-4 |
119,801 |
134,681 |
116,045 |
119,648 |
| 8-12-13 |
108,518 |
104,832 |
109,187 |
108,659 |
| 8-12-4 |
110,647 |
107,433 |
111,139 |
110,487 |
| 12-14-3 |
124,669 |
114,056 |
127,536 |
124,357 |
| 14-3-2 |
125,248 |
134,195 |
124,775 |
125,2589 |
| 9-8-12 |
118,059 |
115,425 |
120,329 |
117,995 |
Рассчитанные молекулярные свойства норсульфазола методом АМ1
Полнаяэнергия: -67462,27344
Binding energy: -2596,3837
Heat of formation: 1,4622
Electronic energy: -381394,2813
Nuclear energy: 313932
Дипольныймомент: 0
RMS градиент: 0,30225
Градиент X: 0,17933
Градиент Y: 0,20430
Градиент Z: 0,13213
| 32 Substructure descriptors; 0 new. |
| Antibacterial |
| Antibiotic |
| Iodide peroxidase inhibitor |
| Dihydropteroate synthase inhibitor |
| 21 Possible activities at Pa > 50% |
| Pa Pi Activity: |
| 0,885 0,005 Antiobesity
|
| 0,867 0,009 Antiprotozoal (Toxoplasma)
|
| 0,834 0,006 Para amino benzoic acid antagonist
|
| 0,785 0,020 Dopamine D4 agonist |
| 0,732 0,006 Dihydropteroate synthase inhibitor |
| 0,745 0,020 Antineoplastic (colorectal cancer) |
| 0,710 0,006 Antidiabetic |
| 0,673 0,038 Antineoplastic (brain cancer) |
| 0,688 0,079 Hematotoxic |
| 0,641 0,043 Antinephritic |
| 0,613 0,029 Cyclooxygenase 1 inhibitor |
| 0,579 0,019 Cytochrome P450 CYP2C9 inhibitor |
| 0,562 0,006 Antiprotozoal (Coccidial) |
| 0,549 0,020 Prostaglandin E1 antagonist |
| 0,562 0,042 Diamine N-acetyltransferase inhibitor |
| 0,541 0,026 Prostaglandin antagonist |
| 0,617 0,107 Mucomembranous protector |
| 0,503 0,026 Prostaglandin H2 antagonist |
| 0,488 0,017 CYP2C10 substrate |
| 0,507 0,041 Collagen inhibitor |
| 0,505 0,059 Antiinflammatory, intestinal |
Приложение Ж
Рис. Ж.1 Молекула в abinitio
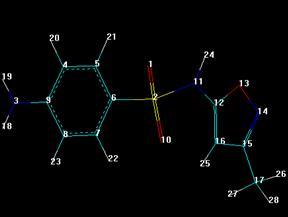
Рис. Ж.2 Молекула в AM1
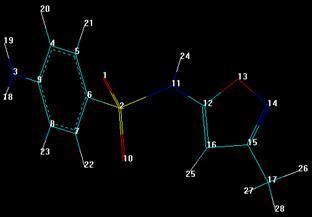
Таблица Ж.1 Рассчитанные длины связей сульфафуразола
| Связь |
Abinitio (минимальный базис) |
INDO |
АМ1 |
Эксперимент |
| 19-3 |
0,995713 |
1,06813 |
0,988826 |
0,99578 |
| 18-3 |
0,995799 |
1,06812 |
0,989007 |
0,99513 |
| 3-9 |
1,36031 |
1,39378 |
1,37068 |
1,36785 |
| 9-4 |
1,40349 |
1,39997 |
1,42381 |
1,4056 |
| 4-5 |
1,37086 |
1,38553 |
1,3803 |
1,36489 |
| 5-6 |
1,37873 |
1,37746 |
1,40582 |
1,3754 |
| 6-7 |
1,37603 |
1,37731 |
1,40561 |
1,3784 |
| 7-8 |
1,3736 |
1,38564 |
1,38112 |
1,37512 |
| 8-9 |
1,39962 |
1,39981 |
1,42272 |
1,40156 |
| 6-2 |
1,78301 |
1,91574 |
1,65036 |
1,79256 |
| 2-1 |
1,5765 |
1,9299 |
1,41248 |
1,57248 |
| 2-10 |
1,57623 |
1,92576 |
1,39964 |
1,56994 |
| 2-11 |
1,70772 |
1,85214 |
1,66775 |
1,6999 |
| 11-12 |
1,36175 |
1,38744 |
1,36843 |
1,35014 |
| 12-16 |
1,34753 |
1,36559 |
1,39192 |
1,3489 |
| 16-15 |
1,43043 |
1,42798 |
1,45902 |
1,4368 |
| 15-14 |
1,29511 |
1,3414 |
1,34867 |
1,2956 |
| 14-13 |
1,47147 |
1,28589 |
1,43062 |
1,479 |
| 13-12 |
1,34698 |
1,3693 |
1,32193 |
1,3462 |
| 15-17 |
1,4962 |
1,45422 |
1,47438 |
1,5012 |
| 11-24 |
1,00305 |
1,11064 |
0,999463 |
1,00452 |
Таблица Ж.2 Рассчитанные валентные углы сульфафуразол
| Угол |
Abinitio (минимальный базис), 0 |
INDO, 0 |
АМ1, 0 |
Эксперимент |
| 19-3-18 |
117,78 |
109,47 |
118,393 |
117,256 |
| 1-2-10 |
120,708 |
135,663 |
116,754 |
120,426 |
| 2-11-12 |
125,145 |
113,276 |
130,073 |
125,236 |
| 11-12-13 |
115,533 |
110,123 |
118,615 |
116,021 |
| 12-13-14 |
107,685 |
109,772 |
109,559 |
107,59 |
| 13-14-15 |
103,719 |
108,985 |
109,474 |
103,012 |
| 14-15-17 |
120,217 |
121,216 |
126,511 |
121,048 |
| 5-6-2 |
120,205 |
117,056 |
120,857 |
120,458 |
| 7-6-2 |
118,747 |
116,137 |
121,474 |
118,628 |
| 3-9-4 |
120,712 |
120,953 |
120,92 |
120,8426 |
Рассчитанные молекулярные свойства сульфафуразола методом АМ1
Полнаяэнергия: -73193,28906
Binding energy: -2867,604
Heat of formation: -1,505
Electronic energy: -428801,3438
Nuclear energy: 354888,0313
Дипольныймомент: 6,659
RMS градиент: 0,08928
Градиент X: 0,04212
Градиент Y: 0,06337
Градиент Z: 0,04669
| 31 Substructure descriptors; 1 new. |
| 26 Possible activities at Pa > 50% |
| Pa Pi Activity: |
| 0,886 0,007 Antiprotozoal (Toxoplasma)
|
| 0,860 0,005 Para amino benzoic acid antagonist
|
| 0,826 0,005 Dihydropteroate synthase inhibitor |
| 0,833 0,040 Hematotoxic
|
| 0,701 0,028 Antineoplastic (colorectal cancer) |
| 0,674 0,002 Endothelin receptor antagonist |
| 0,697 0,050 Integrin antagonist |
| 0,672 0,038 Antineoplastic (brain cancer) |
| 0,667 0,051 Neuroprotector |
| 0,623 0,019 Diamine N-acetyltransferase inhibitor |
| 0,607 0,016 Prostaglandin H2 antagonist |
| 0,620 0,032 Thiol oxidase inhibitor |
| 0,577 0,002 Endothelin A receptor antagonist |
| 0,575 0,021 Cytochrome P450 CYP2C9 inhibitor |
| 0,534 0,022 Antiinfective |
| 0,556 0,050 Gingipain K inhibitor |
| 0,581 0,084 Dopamine D4 agonist |
| 0,541 0,048 CYP3A2 substrate |
| 0,549 0,060 Cathepsin G inhibitor |
| 0,496 0,009 CYP2C6 substrate |
| 0,530 0,046 Antiinflammatory, intestinal |
| 0,535 0,061 Cyclooxygenase 1 inhibitor |
| 0,499 0,026 Prostaglandin E1 antagonist |
| 0,515 0,049 Antiinflammatory |
| 0,550 0,085 Laccase inhibitor |
|