Федеральное агентство по образованию Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
«Ярославский государственный университет им. П. Г. Демидова»
Кафедра общей и экспериментальной физики
Курсовая работа
Редкоземельные металлы и их полуторные оксиды
Научный руководитель
Доцент кафедры
Балабаева Р.Ф.
Студент группы Ф-51В
Туркина А.Н.
Ярославль 2009 г.
ОГЛАВЛЕНИЕ
1. Введение
2. Редкоземельные элементы
2.1 Европий
3. Влияние условий получения полуторных оксидов РЗЭ на их кристаллическое строение
3.1 Окисление металлов
4. Фазовые превращения полуторных оксидов РЗЭ
4.1 Необратимые или медленно протекающие фазовые превращения
4.2 Обратимые полиморфные превращения
4.3 Влияние давления на полиморфизм оксидов
5. Простые оксиды европия
6. Устойчивость полуторных оксидов РЗЭ
7. Стабилизация метастабильных форм полуторных оксидов РЗЭ
8. Заключение
9. Список литературы
1. ВВЕДЕНИЕ
Редкоземельные элементы (в минералогии — TR, от лат. terra rará), химические элементы побочной подгруппы III группы периодической системы Менделеева: скандий Sc (атомный номер Z = 21), иттрий Y (Z = 39), лантан La (Z = 57) и лантаноиды (14 элементов, Z от 58 до 71). Sc, однако, не всегда относят к редкоземельным элементам. В свободном виде — металлы. Название «редкоземельные» дано в связи с тем, что они, во-первых, сравнительно редко встречаются в земной коре и, во-вторых, образуют тугоплавкие, практически не растворимые в воде оксиды (такие оксиды в начале 19 в. и ранее назывались «землями»). Важная особенность редкоземельных элементов — их совместное нахождение в природе. Например, минерал монацит — один из основных источников этих элементов — содержит фосфаты Y, La и др. Подразделяются на иттриевую (Y, La, Gd-Lu) и цериевую (Се-Eu) подгруппы. Элементы Се-Eu называют легкими, a Cd-Lu-тяжелыми лантаноидами.
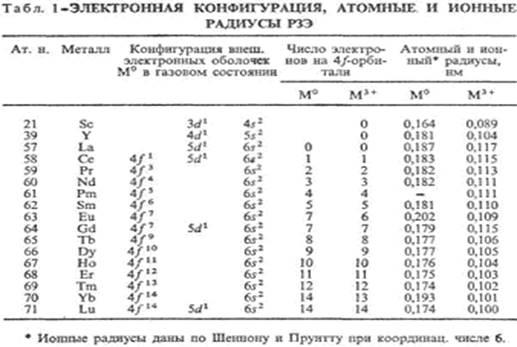
Электронная структура, лантаноидное сжатие, электронная конфигурация РЗЭ дана в табл. 1, у ионов М3+
(М = Sc, Y, La) устойчивая конфигурация инертных газов. У Sc, Y и La в образовании химической связи участвуют d-
и s
-электроны, у других РЗЭ могут участвовать также f
-электроны, однако близкие химические свойства РЗЭ определяются главным образом внешними d-
и s
-электронами. Поэтому эти элементы объединены в одну группу.
В состоянии М3+
РЗЭ имеют оболочку с 4f n
-электронами (кроме Sc), в газовом состоянии-4f n+
1
6s
2
(кроме La, Ce, Gd и Lu, имеющих оболочку 4f n
), в металлическом М°-4f n
(для Еu и Yb-4f n
+ 1
). Предполагается, что вакантная, заполненная наполовину и заполненная полностью f
-оболочки обладают повышенной устойчивостью. Поэтому Sc, Y, La, Gd и Lu образуют только ионы М3+
, для Се и Тb устойчиво также состояние М4+
, а для Еu и Yb-также М2+
. Помимо электронной структуры на устойчивость валентных состояний РЗЭ влияют и другие факторы: например, ионы Sm+
, Tm+
(конфигурации f
7
и f
14
),
Рr5+
(f
0
),
Dy5+
(f
7
) крайне неустойчивы.
2. Редкоземельные элементы
РЗЭ-элементы - металлы серебристо-белого цвета, некоторые с желтоватым оттенком (Рr, Nd). Они пластичны и электропроводны, легко поддаются механической обработке. Многие свойства простых веществ и соединений изменяются симбатно в рядах La-Eu и Gd-Yb. Особенно резко отличаются свойства, отражающие переход из связанного состояния в свободное и обратно.
Например, при переходе из металлического состояния в парообразное мерой является давление пара металлов. При 25 °С давления паров РЗЭ различаются более чем на 40 порядков, а при 1000 °С - примерно на 10 порядков (минимальное давление характерно для La, Gd и Lu, максимальное - для Еu и Yb). Это связано с большой разницей в энергии, необходимой для перехода 4 d
-электрона на 5d
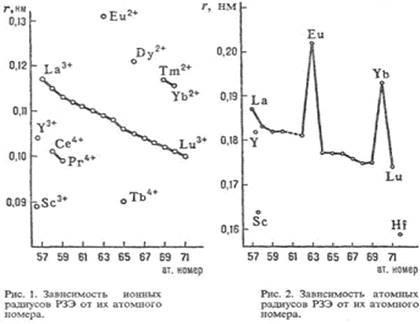
-уровень. С другой стороны, есть свойства, остающиеся примерно постоянными для всех РЗЭ. Вследствие лантаноидного сжатия при переходе от La к Lu ионные радиусы РЗЭ и их атомные радиусы (кроме Еu и Yb) плавно уменьшаются (рис. 1, 2), плотность простых веществ увеличивается [31].
2.1 Европий
Европий - это химический элемент, находящийся в третей группе периодической системы Менделеева и относящийся к лантаноидам. Его атомный номер 63, атомная масса 151.96. Мягкий металл, серебристо-белого цвета, плотностью 5.2456 г/см3, температура плавления = 8260
С. По твердости европий очень похож на свинец- такой же мягкий и пластичный.
Европий - самый легкий из лантаноидов, и самый неустойчивый среди редкоземельных элементов - в присутствии кислорода воздуха и влаги быстро окисляется (корродирует).
В природе европий - малораспространенный элемент, даже среди редкоземельных элементов европий - один из самых редких, а потому и наиболее дорогих. В свободном виде не встречается, входит в состав таких минералов, как монацит (обезвоженный фосфат редкоземельных элементов цериевой группы - (Ce,La,Y,Th)PO4
), бастнезит и других содержащих редкоземельные элементы минералов. В природные воды европий попадает в районах залегания пород, содержащих редкоземельные элементы, в результате его реакции с водой.
редкоземельный элемент металл европий оксид
3. ВЛИЯНИЕ УСЛОВИЙ
ПОЛУЧЕНИЯ ПОЛУТОРНЫХ ОКСИДОВРЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВНА ИХ КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ
3.1 Окисление металлов
В монографии Серебрянникова [9] имеется указание о том, что лёгкие редкоземельные металлы при нагревании в атмосфере кислорода воспламеняются: в результате горения образуются оксиды. Без нагревания металлическая поверхность в атмосфере сухого воздуха сохраняется довольно долго, во влажном воздухе она быстро покрывается слоем оксида.
Несколько более подробные данные находятся в работах Кремерса [10] и Лава [11]. Скорость атмосферной коррозии определялась Лавом на металлических образцах, вырезанных в виде пластин при температурах 35 и 950
. Опыты проводили при разной относительной влажностях. Испытания при температурах 200, 400 и 600° проводили в трубчатой печи, через которую продували слабый ток воздуха.
При атмосферном окислении редкоземельных металлов образуются гидратированные оксиды с большим объемным приростом. Это приводит к разрушению защитной оксидной пленки и обнажениюметаллической поверхности. Корродирующее воздействие воздуха на редкоземельные металлы сильно зависит от природы последних. Европий окисляется почти так же энергично, как и натрий. Лантан и неодим окисляются довольно быстро (в сухом воздухе при комнатной температуре со скоростью от 1 до 100 мг/дм2
в сутки). Скорость окисления сильно возрастает с умеренным нагревом, причем наличие паров воды (75%-я относительная влажность) увеличивает скорость окисления при любой температуре приблизительно на один порядок. Прочие редкоземельные металлы и нитрий гораздо устойчивее. Скорость их окисления в сухом воздухе при комнатной температуре очень мала, но она существенно возрастает с нагревом (при температурах выше 200°) или во влажных условиях при температурах около 1000
. Самарий отличается большой стойкостью в сухом воздухе, причем с повышением температуры от 200 до 6000
суточная коррозия возрастает от 35 мг/дм2
.
В работе Ли Линда и Грина [12] для исследования использовались металлы повышенной чистоты (99.9%). Скорость окисления образцов определялась в сухом и в насыщенном влагой воздухе. Полученные результаты хорошо согласуются с данными работы Лава[11] (несколько меньшие скорости коррозии в работе [12] объясняются большей чистотой используемых в этой работе материалов).
Механизм окисления металлов при высоких температурах по мнению Ворреса и Иринга [13], определяется диффузией кислорода через слой оксида. Такой механизм представляется вполне вероятным, поскольку во всех случаях образующиеся оксиды имели структуру флюорита, а миграция анионов в решетке типа флюорита, видимо, происходит настолько интенсивно, что почти подавляет движение катионов.
На основании рассмотренных данных о скорости окисления металлов можно прийти также к выводу, что скорость корродирования в сильной мере зависит от чистоты металлов.
Влияние влаги, сильно увеличивающее скорость корродирования, по мнению Лава [11], сводится прежде всего к изменению природы первоначально образовавшейся оксидной пленки. Однако как в работе Лава, так и в других работах [12,13] не приводятся данные о структуре оксидной пленки и составе образующихся фаз.
Изучение окисления металлов проводилось с использованием методики непрерывного взвешивания образцов.
Была сконструирована прецизионная установка для систематических исследований равновесия и кинетики в широком интервале давлений температуры. В ходе опыта можно было непрерывно следить за давлением газов, температурой и изменением веса образца.
Изменения веса регистрировались с помощью кварцевых пружинных весов с точностью до 1.5 · 10-5
г, то есть около 0,01%. Измельчение металлов происходило непосредственно перед опытом. Величина отдельных зерен колебалась от 0.1 до 0.5 мм.
Навеску порошкообразного металла в количестве 0.1-0.2 подвешивали в платиновой чашечке весом 0.04 г в печи. Установку подключали к наносу о создавали разрежение. Образец обезгаживали при слабом нагреве и непрерывной откачке выделяющихся газов. После этого его нагревали до требуемой температуры и в систему вводили воздух или кислород. Запись изменения веса проводили черезкаждые 5 минут.
Предварительно было проверено влияние давления кислорода на скорость реакции окисления. Оказалось, что при давлении кислорода в системе больше 10 мм рт. ст. скорость окисления не зависит от дальнейшего изменения давления. Следовательно, уже при этих давлениях скорость доставки кислорода к окисляемой поверхности, вследствие диффузии в газовой фазе, больше скорости реакции окисления на границе фаз металл—кислород и скорости диффузии кислорода через продукт реакции. Это позволило изучать окисление металлов при пониженном давлении, что увеличивало точность эксперимента за счет уменьшения конвекционных потоков в системе.
4. ФАЗОВЫЕ ПРЕВРАЩЕНИЯ ПОЛУТОРНЫХ ОКСИДОВ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ
4.1 Необратимые или медленно протекающие фазовые превращения
После появления в 1925— 1928 гг. работ Гольдшмидта с сотрудниками [2, 14, 15] стали общепризнанными представления, что полуторные оксиды редкоземельных элементов кристаллизуются в трех полиморфных структурных формах: кубической (С), моноклинной (В) и гексагональной (А), причем кристаллизация в той или иной структурной форме всецело определяется температурой и размером ионных радиусов редкоземельных элементов.
По мнению Гольдшмидта, гексагональная форма (А), устойчивая при самых высоких температурах, может быть получена для оксидов La, Се, Рг и Nd. Устойчивая при низких температурах кубическая форма (С) может быть получена для всех оксидов редкоземельных элементов, кроме названных четырех, обладающих наибольшими ионными радиусами. В интервале между А- и С-формами может образовываться менее симметричная В-форма. Так, оксиды элементов Рг, Nd, Sm, Eu, Gd и Dy были получены Гольдшмидтом в псевдотригональной структуре (Би-форма). Кроме того, для оксидов Sm, Gd и Nd наблюдалась также другая кристаллическая форма, обозначенная им В2
и относящаяся, вероятно, к тригональному типу структуры.
Было установлено, что область устойчивости отдельных структурных типов изменяется в ряду лантан—лютеций, таким образом, температуру превращения повышаются с увеличением атомного номера или, что то же самое, с уменьшением ионного радиуса элементов.Предполагалась также полная обратимость фазовых превращений при изменении температуры.
Однако уже в 1935 году появилась работа Лоберга, в которой сообщалось о получении С-формы La2
O3
и Nd2
O3
[3]. Вскоре была получена и С-форма для окиси празеодима [8], а также данные о возможности получения С-формы Ce2
O3
в сильно восстановительной среде. Таким образом, С-форма была получена для всех оксидов редкоземельных элементов. В более поздних работах не была обнаружена В-форма у оксидов неодима и празеодима, а также было подвергнуто сомнению существование двух различных низкосимметричных кристаллических структур (В1
и В2
) у оксидов самария и гадолиния [3, 7, 8, 16, 17, 18, 19]. Так, например, Куентерт и Моцци [17], для того, чтобы определить, существует ли В1
- и В2
-формы Gd2
O3
, изучали переход низкотемпературного кубического оксида гадолиния в высокотемпературную В-форму. Было показано, что С-форма непосредственно переходит в моноклинную, изоморфную В-форме Sm2
O3
, В2
-форма не была обнаружена.
В табл. 2 приведены температуры получения различных модификаций полуторных редкоземельных оксидов, по данным Яндели [8]. Время обжига составляло 96-120 часов при 5000
, 6-7 часов - при 10000
и 1-2 часа при более высокой температуре.
Таблица 2. Получение модификаций А, В и С полуторных оксидов [8]
| Оксид |
Температура получения, 0, С |
С- +А- La2O3
A - La2O3
C - Pr2O3
A - Pr2O3
C – Nd2O3
A - Nd2O3
C – Sm2O3
B - Sm2O3
C – Eu2O3
B - Eu2O3
C – Gd2O3
C – Tb2O3
C – Dy2O3
|
350, 450, 500
600, 1000
500, 600
700, 850, 1000, 1100
600, 700, 775
850, 1000, 1200
500, 1000, 1100
1200, 1300, 1400
500, 900, 1000, 1300
1400
500, 1000, 1300, 1500
500, 1000, 1400
500, 1000, 1400
|
В работах различных авторов было подвергнуто проверке положение Гольдшмидта об обратимости фазовых превращений в оксидах РЗЭ при изменении температуры. Яндели [8], Вольф и Бернигхаузен [7] не могли установить, несмотря на многочисленные повторения и длительные выдержки, ни в одном случае обратимого перехода модификаций С и А.
Выяснить устойчивость оксидов и гидрооксидов редкоземельных элементов пытались Шафер и Рой [6], изучая фазовые равновесия в системах оксид редкоземельного элемента—вода. Учитывая, что при низком парциальном давлении паров воды энергия активации образования новой структуры из структуры, полученной при высоких температурах, очень велика, что может проявиться в образовании аморфных или метастабильных фаз, а также в получении неправильных значений равновесных температур фазовых превращении, Шафер и Рой проводили свои опыты при высоком давлении водяных паров. Схема полиморфных превращений, по их данным, показана на рис. 3.
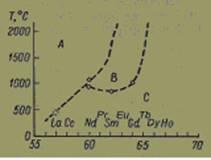
Рис. 3. Диаграмма фазовых превращений, по данным Шафера и Роя [6].
Следует, однако, помнить, что эти данные получены при равновесных и близким в к равновесным условиях и не могут быть сравнимы с результатами, полученными другими методами.
В работе Рота и Шнайдера [4] собран обширный материал об оксидах редкоземельных элементов, проведена ревизия предположений Гольдшмидта о механизме полиморфизма, а также подвергнуты сомнению выводы Лоберга, Роя и Шафера о существовании обратимых полиморфных превращений в рассматриваемых оксидах.
При проведении исследований Рот и Шнайдер использовали реактивы, содержащие 99.9% основного соединения, за исключением оксалата самария, в котором присутствовал 1% Еu, и окиси неодима, содержавшей около 2% различных примесей. До температуры опыта 1650° образцы помещали в печь в платиновом тигле (или подвешивали на платиновой проволоке), при температуре выше 1650° — в иридиевом тигле. После обжига образцы закаляли и подвергали рентгеновскому анализу при комнатной температуре. Отдельные опыты были проведены в вакууме (с оксидами церия и празеодима) и в гидротермальных условиях (с оксидом неодима).
Области устойчивости различных кристаллических форм, полученные в данной работе, приведены на рис. 4, из которого следует, что А-тип структуры оксидов редкоземельных элементов устойчив для больших ионов, В-тип — для промежуточных и С-тип — для малых ионов. Кроме этого, было установлено, что С-тип может встречаться как метастабильная форма при низких температурах для всех А- и В-типов оксидов.
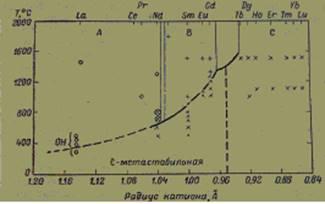
Рис. 4. Диаграмма фазовых превращений, по данным Рота и Шнайдера [4]
Гольдшмидт считал, что переходы из одного типа структуры в другой для оксидов редкоземельных элементов энантиотропны. Рот и Шнайдер не обнаружили никаких энантиотропных переходов. Они установили, что оксид неодима образует С-тип структуры при низких температурах и превращается необратимо в А-тип около 650°, оксиды Sm2
O3
, Еu2
O3
и Gd2
O3
также кристаллизуются при низких температурах в С-типе и превращаются непосредственно и необратимо в В-тип структуры при 950, 1075 ц 1225° соответственно.
Шафер и Рой делают вывод, что превращения в оксидах редкоземельных элементов представляют собой «полностью обратимые полиморфные превращения».
В-тип как стабильная кристаллическая фаза получен у оксидов самария, европия и гадолиния. Кроме этого, как показали Шнайдер и Рот [4], В-тип структуры часто встречается в бинарных системах оксидов редкоземельных элементов (например, в системах оксида неодима с оксидами самария, европия, гадолиния, диспрозия, гольмия, эрбия, тербия, иттербия и лютеция). Следовательно, введение или присутствие примесей в оксиде неодима может повысить устойчивость В-модификации.
Таким образом, если Гольдшмидт считал, что оксиды редкоземельных элементов кристаллизуются в трех типах структуры (А. В, С), устойчивость которых определяется температурой опыта с размером ионов РЗЭ, Шнайдер и Рот рассматривают только влияние размера иона. Они считают, что А-форма характерна для больших, В — промежуточных и С — малых катионов. Такая точна зрения основывается на том, что переходы С в А и С в В в этих оксидах необратимы и, возможно, монотропны, следовательно,
С модификации дли больших катионов не может рассматриваться как устойчивая фаза для этих оксидов.
В 1961 г. появилась работа Уоршау и Роя [5], целью которой была проверка и уточнение результатов, полученных как Шафером и Роем, так и Шнайдером и Ротом. Для экспериментов использовались закалочные печи сопротивления с нагревателем из Рt+40% Rh (до 1850°) и из иридия (до 2400°). При температурах ниже 1000° часто использовались гидротермальные условия, так как при этом увеличивается диффузия ионов, что приводит к более быстрому установлению равновесия. Во время опытов исследуемый образец находился в контакте с водой только при самой высокой температуре опыта: вода вводилась в автоклав после достижения нужной температуры и удалялась до быстрого охлаждения автоклава. После удаления паров воды образцы сушили при температуре опыта от получаса до 3 часов, после чего охлаждали быстро до комнатной температуры. В данной работе было обращено также внимание на чистоту реактивов: исследуемые оксиды содержали не более 0.1—0.2% примесей. Для определения равновесной температуры перехода одной формы в другую нагревали одновременно обе формы, после чего определяли изменения в каждой из них.
Согласно данным Уоршоу и Роя, оксиды редкоземельных элементов от Nd2
O3
до Dу2
O3
могут кристаллизоваться в двух полиморфных модификациях (рис. 14); при низких температурах устойчивой является С-форма, а при высоких температурах — А- или В-форма. Все переходы из одной модификации вдругую для этих оксидов обратимы. Температура превращения С↔В линейно возрастает с уменьшением радиуса иона редкоземельного элемента.
Сравнивая результаты, полученные Уоршау и Роем [5], с данными,опубликованными в более ранних работах, следует преждевсего обратить внимание на большое сходство диаграмм фазовыхпереходов, приведенных в работах Шнайдера и Рота и Уоршау и Роя.
Различие во взглядах данных авторов на природу фразовых превращений заключается в следующем. Шнайдер и Рот рассматривают С-формы оксидов от лантана до гадолиния как местабильные, переходящие при нагревании в устойчивые (А или В). Уоршау и Рой, наоборот, считают все переходы полностью обратимыми, а следовательно, С-формы этих оксидов термодинамически устойчивыми при низких температурах.
Уоршау и Рой наблюдали также превращение В-форм оксидов самария и европия в соответствующие С-формы, однако эти превращения были получены только в гидротермальных условиях. (Табл. 3) Длительное же нагревание В-формы оксида гадолиния (1182°, 35 часов) привело к образованию лишь следов С-формы Gd2
Оз.
Таблица 3. Изучение фазовых переходов по данным Уоршау и Роя [5]
| Оксид европия |
| Т, 0С |
Давление, кГ/см2 |
Время, часы |
Структура исходного продукта |
Структура полученного продукта |
974
1096
1105
1145
|
210
-
-
-
|
22
24
30
18
|
В
С
С
С
|
С
С
С + малые количества В
В
|
Результаты опытов различных авторов являются в значительной степени противоречивыми. Это относится как к установлению положения границ между областями существования А-, В- и С-форм, так, к вопросам обратимости фазовых превращений. Известно, что обратимые полиморфные превращения характеризуются наличием постоянной равновесной температуры превращения. Изменение температуры обратимого превращения может происходить только вследствие изменения состава вещества или давления, при котором наблюдается превращение. В то же время для оксидов редкоземельных элементов разные авторы приводят различные температуры перехода, даже для превращений, осуществляемых в одинаковых условиях. Такое несоответствие может указывать или на то, что наблюдаемые температуры не являются равновесными, или на то, что эти превращения необратимы (монотропны), и тогда для них вообще нет никакой равновесной температуры.
В работе Рота и Шнайдера [4] высказывалось предположение о зависимости верхней температуры устойчивости С-форм от исходных материалов. По их мнению, переход структуры из С-типа в А- или В-тип есть процесс, скорость которого должна завись от степени кристаллизации С-модификации.
Брауэр и Мюллер [22] исследовали влияние условий образования на полиморфизм полуторных оксидов самария, европия и гадолиния, а также пытались путем изменения температуры и продолжительности нагревания обратить В-тип структуры в С-тип. В ходе работы использовались реактивы высокой чистоты, содержащие 99.8—99.9% основного соединения. Исходными веществами служили гидрооксиды, нитраты, карбонаты и оксалаты указанных выше элементов. Их разлагали путем нагревания в высоком вакууме (10-5
атм.) при температуре 600°. В дальнейшем обжиги проводились при температурах вплоть до 1000° в вакуумной печи, при более высокой температуре — на воздухе. Выдержки при высоких температурах составляли 30—100 часов и при средних температурах 100—300 часов, а иногда даже более 1200 часов. Охлаждение образцов и дальнейшее их исследование проводилось в атмосфере сухого азота. В ходе исследования проводился рентгенографический анализ, определялись плотность и изменение веса. После этого образец снова подвергался нагреванию.
Было показано, что превращение С→В протекает очень медленно даже при относительно высоких температурах (1200°). Не было замечено никакого намека на обратное превращение В→С. Авторы пытались осуществить этот переход путем различных мероприятий. Например, пробу С-формы Gd2
O3
очень непродолжительное время нагревали при 1400°, с тем чтобы образовалось около 20% В-Gd2
O3
, затем образец прокаливали 200—500 часов при 1250, 1200 и 1000°, т. е. при температурах относительной устойчивости С-формы. Однако нагревание В-формы с зародышами С-формы не привело к какому-либо изменению в составе фаз. Никаких следов В→С-превращения не было обнаружено и после прокаливания в течение 250 часов при 1050° (в высоком вакууме) смеси В-формы Gd2
O3
с 10% СаС12
, использованного в качестве минерализатора.
Из опытов следует, что при нагревании на воздухе или в вакууме не существует строго определенной температуры превращения С-формы в В-форму, а наблюдается только интервал температур, в пределах которого происходит превращение. Ширина интервала и его положение сильно зависит от предыстории образца.
Шиес [1] обращал также внимание на то, что при превращении С-формы в В-форму происходит не только увеличение плотности образцов, но и изменение их веса. Так, оксид европия, полученныйпри 800° из оксалата, проявляет тенденцию к потере веса и увеличению плотности во время дальнейшего нагревания при 13000
как в кислороде, так и в водороде (таб. 4).
Таблица 4. Изменение веса и плотности окиси европия при нагревании
| Температура, °С |
Время, часы |
Атмосфера |
Потеря веса, % от веса сухого оксалата |
Плотность, г/см3 |
800
1300
1300
|
3
3
3
|
O2
O2
H2
|
45.9
46.8
46.4
|
7.45
8.03
7.98
|
Нами было проведено изучение поведения оксидов различных редкоземельных элементов, в том числе европия при их нагревании [20] (в том числе и термогравиметрические измерения при давлении кислорода около 0.1 мм рт. ст.).
Таблица 5. Влияние газовой среды на температуру фазовых переходов (Исходный материал — С-форма оксида, время нагревания — 2 часа)
| Т, °С |
Газовая |
| среда |
Nd2O3 |
Sm2О3 |
Еu203 |
Gd2O3 |
| 700 |
Водород |
C |
С |
C |
C |
| 800 |
Кислород |
C |
С |
C |
С |
| Водород |
А + С |
С |
C |
C |
| 900 |
Кислород |
А + С |
С |
C |
C |
| Водород Кислород |
А |
C |
C |
C |
| А |
C |
C |
C |
| 950 |
Водород |
А |
C |
C |
C |
| 1000 |
Кислород |
А |
C |
C |
C |
| Водород |
А |
C |
C |
C |
| Кислород |
А |
C |
C |
C |
| 1050 |
Водород |
А |
B |
C |
C |
| Кислород |
А |
B |
C |
C |
| 1100 |
Водород |
А |
B |
C |
C |
| Кислород |
А |
B |
C |
C |
| 1150 |
Водород |
А |
B |
В (С) |
C |
| Кислород |
А |
B |
B |
C |
| 1250 |
Водород |
А |
B |
B |
C>B |
| Кислород |
А |
B |
B |
C + B |
| 1300 |
Кислород |
А |
B |
B |
B |
Для выяснения влияния газовой среды на температуру фазовых переходов нами было изучено поведение оксидов неодима, самария, европия и гадолиния в атмосфере сухого водорода и кислорода. Опыты проводились в одной и той же печи, чтобы избежать ошибок, связанных с неточностью измерения температуры разными термопарами в различных печах. Исходный газ сначала тщательно очищали от примесей (пропусканием через систему поглотителей и нагретый до 400-5000
платинированный асбест), после чего высушивали, последовательно пропуская его через склянки с H2
SO4
, CaCl2
, KOH и P2
O5
. Очищенный сухой газ поступал в трубчатую печь с исследуемыми образцами. Нагревание образцов как в токе кислорода, так и в токе водорода происходило в идентичных условиях (одинаковыми были скорость подъема температуры, продолжительность обжига при максимальной температуре, одинаковым было и давление газа над образцами в ходе опыта (табл.5).
Было показано, что начало температуры фазового перехода и скорость превращения практически не зависят от состава газовой среды. Таким образом, доказана несостоятельность гипотезы о связи фазовых переходов в этих оксидах с их восстановлением.
В то же время можно прийти к следующему выводу: необратимый характер превращений в оксидах РЗЭ определенно связан с наблюдаемыми изменениями состава, происходящими при нагревании оксидов в области переходов.
4.2 Обратимые полиморфные превращения
Определение наличия быстро протекающих обратимых полиморфных превращений в полуторных оксидах редкоземельных элементов осуществлялось с помощью высокотемпературного рентгеновского анализа и точных термографических измерений на специально переоборудованном адиабатическом калориметре [20].
Прецизионный дифференциальный термоанализ проводился при нагреве навесок исследуемых оксидовв высоком вакууме (1 • 10 -5
мм рт. ст) со скоростью порядка 10
в 1 минуту. Количество исследуемого вещества при термоанализе составляло 0.5—1.0 г. Чувствительность обнаружения тепловых аномалий для быстропротекающих превращений составляла 0.02—0.05 кал./г. Термоанализ осуществлялся преимущественно в температурном интервале 50—1100°. При термоаналитических исследованиях оксидов редкоземельных элементов в качестве «эталонного» вещества использовался также один из оксидов редкоземельной группы, теплоемкость которого мало отличалась от теплоемкости исследуемого вещества и широком интервале температур.
Данные, полученные на калориметре при нагревании в вакууме сопоставлялась с результатами высокотемпературных рентгеновских исследований тех же оксидов, нагревание которых во время съемки рентгенограмм до температуры 15000
происходило на воздухе.
Термоаналитическими, а также рентгенографическими исследования было установлено, что для оксидов Y2
O3
, La2
O3
, Nd2
O3
, Sm2
O3
, Eu2
O3
, Gd2
O3
, Ho2
O3
, Er2
O3
, Dy2
O3
, Tm2
O3
и Yb2
O3
в области температур 50-15000
не существует быстрых обратимых полиморфных превращений.
В 1966 г. появилась серия работ, выполненных под руководством Фоекса [42]. В этих работах приводятся данные термографического и рентгенографического исследования большинства оксидов РЗЭ при различных температурах, вплоть до температур плавления этих оксидов. Удовлетворительное совпадение результатов, полученных при термоанализе на воздухе и при рентгенографических исследованиях, проводившихся в восстановительной (Н2
+Не) или нейтральной (Не) среде с использованием подложек из вольфрама, рения или иридия, исключает заметные изменения стехиометрии полуторных оксидов, даже при столь высоких температурах.
В результате исследования были обнаружены две новые модификации: гексагональной (Н-форма) и неизвестной (Х-форма) структур. Для оксидов самария и европия были обнаружены следующие обратимые превращения:
| В↔А |
А↔Н |
Н↔Х |
Sm2O3
Eu2O3
|
19000
2040
|
21000
2140
|
22500
2270
|
4.3 Влияние давления на полиморфизм оксидов
Хокстра и Гингерих [23] изучали влияние давления на полиморфизм оксидов редкоземельных элементов. С-формы оксидов прогревали несколько часов при 1000° на воздухе, оксид тербия восстанавливали в токе водорода. Образцы оксидов, помещенные в платиновые ампулы, прессовали под давлением 0.4 кбар. Несколько таблеток, разделенных между собой прокладками из пирофилита, помещали в пирофилитовую трубку, обогреваемую снаружи графитовым нагревателем. После обработки при высоком давлении и высокой температуре образцы охлаждали за несколько секунд до 50°, затем за 5—10 минут спускали давление. Вещество извлекали из автоклава и исследовали при атмосферном давлении и комнатной температуре.
Условия, при которых проводились опыты, приведены в табл. 6. Во всех случаях наблюдался переход С-формы в В-форму. Было обнаружено, что для оксидов Eu, Gd, Tb, Dy и Sm В-модифинация может быть получена и при атмосферном давлении, но при высоком давлении переход происходит при более низкой температуре; для всех остальных оксидов тяжелых РЗЭ для получения В-модификации нужно применять высокие давления.
Таблица 6. Условия получения В-формы полуторных оксидов редкоземельных элементов из С-формы [23]
| Оксид |
Давление,
кбар
|
Температура,
0С
|
Оксид |
Давление, кбар |
Температура,
0С
|
Y2O3
Sm2O3
Eu2O3
Gd2O3
Tb2O3
Dy2O3
|
25
30
25
30
25
30
|
1000
1020
905
1020
905
1020
|
Ho2O3
Er2O3
Tm2O3
Yb2O3
Lu2O3
|
25
30
40
40
40
|
1000
1020
1005
1000
1005
|
При отжиге на воздухе при 1000
С и атмосферном давлении в течение нескольких часов В-формы оксидов (всех, кроме Sm, Er и Gd) превращались обратно в С-формы. Это показывает, что В-модификации, полученные при высоком давлении, являются метастабильными при атмосферном давлении.
Кроме оксидов самария, европия и гадолиния, В-формы которых являются единственными устойчивыми для них фазами, исключение составляют также и оксиды тербия и диспрозия, претерпевающие при обычном давлении обратимый полиморфный переход В↔С при высоких температурах. Проведение обжигов при высоком давлении приводит для этих оксидов только к понижению температуры фазового превращения, не изменяя его природы.
Рассматривая влияние давления на полиморфизм оксидов, следует указать также, что при проведении обжига образцов при высоком давлении водорода или водяных паров (гидротермальный синтез) наблюдается снижение температур перехода из кубической формы в гексагональную или моноклинную.
Таким образом, работами ряда авторов было показано, что применение высоких давлений способствует переходу метастабильных С-форм оксидов в А- (неодим, празеодим) или В-формы (самарий, европий, гадолиний).
5. ПРОСТЫЕ ОКСИДЫ ЕВРОПИЯ
В системе европий-кислород образуются оксиды Eu2
O3
и Eu3
O4
, EuO1.31
(Eu16
O21
) и EuO.
Полуторный оксид E2
O3
обладает структурой С-типа, которая при 11000
С переходит в В-модификацию. Структура Eu3
O4
– ромбическая, EuO имеет структуру NaCl.
Восстановление водородом приводит к значительным отклонениям состава E2
O3
от стехиометрического [27] в результате восстановления в течение 2 ч при 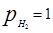 торр и температуре 6500
С образуется оксид с усредненным составом EuO1.4928
. Электропроводность такого оксида после обработки кислородом дегазациипри 800°С не изменяется. Исследование полупроводниковых свойств спеченных образцов при 200-350°С в атмосфере СО (760-5 торр) показало [28], электропроводность оксида увеличивается при понижении давления СО, а энергия активации проводимости уменьшается от 0,68 эВ при 760 торр до 0,43 эВ при 5 торр. Эти данные не позволяют сделать однозначные выводы о дефектной структуре и механизме проводимости. торр и температуре 6500
С образуется оксид с усредненным составом EuO1.4928
. Электропроводность такого оксида после обработки кислородом дегазациипри 800°С не изменяется. Исследование полупроводниковых свойств спеченных образцов при 200-350°С в атмосфере СО (760-5 торр) показало [28], электропроводность оксида увеличивается при понижении давления СО, а энергия активации проводимости уменьшается от 0,68 эВ при 760 торр до 0,43 эВ при 5 торр. Эти данные не позволяют сделать однозначные выводы о дефектной структуре и механизме проводимости.
Опубликованы также данные по электропроводности на постоянном токе спеченных образцов Eu2
03
(99,97%) [29]. Порошки оксида, имеющего структуру С-типа, спекались при 1000°С до плотности, составляющей приблизительно 50% от теоретической. Образцы моноклинной модификации (В-тип) готовились при 1400°С, и их плотность составляла 90% от теоретической.
Зависимость электропроводности С-модификации от парциально давления кислорода при 700°С показана на рис.11. Проводимость оксида соответствовала р
-типу при давлениях выше l0-7
атм и n-типу – ниже 10-20
атм. В области промежуточных давлений наблюдается минимум электропроводности. Полученные данные были объяснены на основе предположения, что при давлениях, близких к атмосферному, основными дефектами являются полностью ионизированные катионные вакансии. Однако совокупность полученных данных в принципе отражает преобладание дефектов различных типов при высоких и низких давлениях кислорода. В области промежуточных давлений состав оксида, по-видимому, близок к стехиометрическому. С другой стороны, зависимость электропроводности E2
O3
от давления кислорода характерна для внешней области, в которой свойства определяются содержанием примесей. Это означает, что в области промежуточных давлений доминирует ионная проводимость. Все это подтверждено результатами исследования оксидов РЗЭ методом ЭДС [30] и по аналогии с другими оксидами позволяет считать рассмотренный подход корректным и для анализа свойств E2
O3
.
Энергия активации проводимости С-модификации E2
O3
в кислороде и на воздухе равны 1,2 и 1,1 эВ (27,6 и 25,3 ккал/моль) соответственно.
Измерения электропроводности В-модификации на воздухе при 400-10000
С дали для энергии активации проводимости значение 1,18 эВ (27,2 ккал/моль). По данным работы [29] нельзя установить, сохраняется ли в какой-то степени моноклинная структура ниже температуры перехода.
6. УСТОЙЧИВОСТЬ ПОЛУТОРНЫХ ОКСИДОВ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ
В пятидесятых годах нашего века было налажено получение редкоземельных элементов высокой степени чистоты в достаточных для термохимических исследований количествах. К этому периоду относится появление целого ряда работ, посвященных определению теплот образования оксидов редкоземельных элементов.
Таблица 7. Термохимические константы для оксидов РЗЭ
| Оксид |
Структура |
ΔH0298,
ккал./моль
|
ΔS0298кал./моль • град. |
ΔF0298ккал./моль |
La2O3
Ce2O3
Рг2O3 . . . {
Nd2O3 . . . . {
Sm2O3
Eu2O3. . . . {
Gd2O3 . . . {
Tb2о3
Dy2O3
Ho2O3
Er2O3
Tm2O3
Yb2O3
Lu2O3
|
Гексагон.
»
»
Кубич.
Гексагон. Кубич.
Моноклин.
»
Кубич.
»
Моноклин. Кубич.
»
»
»
»
»
»
»
|
—428.57 [87-89] —434.93 [85],
—427.01 [90]
—435.8 [91]
—436.8 [91]
—432.15 [92]
—429.8
—433.89 [93]
—393.9 [94]
—389.6 [94]
—386.97 [95]
—433.94 [96]
—427.8
—436.8 [97]
—445.84 [98]
—449.55 [99]
— 453.59 [100]
—451.4(101]
—433.68 [98]
—448.9 1102]
|
70.4 [103]
70.4 [104]
(70.8)[104] (70.8)[104]
70.7 [103] (70.8)
70.6 [105]
-
-
-
69.0 [105]
71.6 [104]
73.4 [106]
71.7 [106]
71.9 [106]
71.4 [104]
69.0 [105]
71.2 [104]
|
—407.6
—414.0
(—414.8) (—415.6)
—411.1
-
—412.85
-
-
-
—413.37
—415.4
—424.0
—428.2
—432.2
—430.2
—412.31
—427.7
|
Было показано, что образование полуторных оксидов окислением редкоземельных металлов сопровождается большим выделением тепла. Образовавшиеся оксиды являются весьма устойчивыми. Они плавятся выше 2000° и не разлагаются до температуры плавления. Исключение составляют только оксиды самария и иттербия, которые в присутствии восстановителей или в глубоком вакууме при очень высоких температурах переходят в оксиды, менее богатые кислородом.
Таблица 8. Вклады, вносимые различными частицами в величину
S
реш
(ккал./моль·град.) [25]
О
О1.33
O1.5
O1.67
O2
|
- 2
- 1
0
+ 1
+ 2
|
La
Се
Pr
Nd
Sm
|
15.2
14.65
14.6
14.45
14.2
|
Eu
Gd
Tb
Dy
Ho
|
14.1
14.0
13.8
13.6
13.45
|
Er
Tm
Yb
Lu
|
13.3 13.2 13.1 13.0 |
В табл. 7 приведены теплоты образования полуторных оксидов редкоземельных элементов по данным различных авторов.
В работах Веструма [24-26, 32] были определены низкотемпературные теплоемкости и вычислены свободные энергии и энтропии большинства полуторных оксидов редкоземельных элементов при стандартных условиях (табл. 7). Полученные экспериментальные значения энтропии при 2980
К хорошо согласуются с вычисленными суммированием магнитной составляющейс энтропией решетки (Sреш
.) (
табл.8).
Таблица 9. Значение энтропии (кал./моль · град.) оксидов редкоземельныхэлементов при 298° К
| Данные работы [104] |
Данные |
работы [107] |
| Оксид |
Sреш |
Sмагн |
Вычисл.
S0298°
|
с S0298° - ST |
Т°, К |
Экстраполир.
ST – S0
|
Эксперим.
S0298°
|
| La2O3 |
30.4 |
0 |
30.4 |
30.43 |
5 |
0.002 |
30.43 |
| Ce2O3 |
29.3 |
7.12 |
36.4 |
- |
- |
- |
— |
| Pr2O3 |
29.2 |
8.72 |
37.9 |
- |
- |
- |
— |
| Nd2O3 |
28.9 |
9.14 |
38.0 |
35.05 |
5 |
2.8 |
37.9 |
| Sm2O3 |
28.4 |
7.12 |
35.4 |
33.22 |
10 |
2.9 |
36.-1 |
| Eu2O3 |
28.2 |
- |
- |
- |
- |
- |
— |
| Gd2O3 |
28.0 |
8.26 |
36.26 |
28.33 |
10 |
7.8 |
36.0 |
| Tb2O3 |
27.6 |
10.19 |
37.5 |
- |
- |
- |
—- |
Dy2O3
Ho2O3
|
27.2
26.9
|
11.02 11.26 |
38.1
38.2
|
33.06
32.38
|
10
10
|
2.7
-
|
35.8 37.8 |
Er2O3
Tm2O3
|
26.6 26.4 |
11.02 10.19 |
37.6
36.6
|
33.81
-
|
10
-
|
2.8
-
|
36.0 |
Yb2O3
Lu2O3
|
26.2 26.0 |
8.26
0
|
34.5
20.0
|
29.01
-
|
10
-
|
2.8
-
|
31.8 |
Для полуторных оксидов вклад, вносимый кислородом О1,5
близок к нулю, а вклад, вносимый катионом,
уменьшается с увеличением атомного номера редкоземельного элемента. В табл. 9 приведены значения энтропии оксидов, вычисленные на основании lанных табл. 8 и измеренные при низких температурах.
Изучение термохимических свойств при высоких температурах было проведено Кингом, Келли, Панкратцем [33-35], Цага-Ре
ашвили и Гвелесиани [36], Бломке и Цигелем [37] и др.

Рис.5. Энтальпия образования оксидов РЗЭ при высоких температурах.
1 — Ег2
О3
; 2 — Тm2
О3
; 3 — Но2
О3
; 4 — Dy2
O3
; 5 — Ce2
O3
; 6 — Yb2
О3
; 7 - Nd2
O3
; 8 — La2
О3;
9 - B-Eu2
O3
; 10 — C-Eu2
O3
.
На рис.4 приведены энтальпии образования оксидов при высоких температурах. На кривых теплоемкостей оксидов церия, диспрозия, тулия и иттербия в высокотемпературной области были замечены небольшие термические аномалии, не сопровождающиеся изменением кристаллической структуры оксидов. По мнению авторов, такиеаномалии могут быть вызваны лишь внутриатомные процессами и не могут быть следствием изменения микрокристаллической структуры.
Как уже было сказано, при термическом разложении кислородосодержащих солей или при окислении металлов обычно образуются кубические формы полуторных оксидов. Кубические формы оксидов редкоземельных элементов с малыми размерами ионных радиусов остаются устойчивыми вплоть до температур плавления.
При нагревании кубических форм оксидов (от La2
О3
до Gd2
О3
) наблюдается необратимое превращение их в гексагональные или моноклинные формы. Калориметрические измерения показали, чтопревращения кубических форм оксидов неодима, европия игадолиния в соответствующие гексагональные и моноклинные формы сопровождаются выделением тепла (кал./моль):
Тип перехода кал./моль
Nd3
О3
...... С→А 2350
Eu2
03
...... С→В 3430
Gd2
O3
...... С→В ~ 6000
Таким образом, экспериментально была доказана метастабильность С-форм этих оксидов.
Панкратц, Кинг и Келли [33], изучавшие термохимические свойства оксидов неодима, европия, самария и гадолиния при высоких температурах пришли к следующему выводу. По их данным, кубические формы оксидов самария, европия и гадолиния неустойчивы и превращаются необратимо в моноклинные В-формы.
Рассматривая полиморфизм оксидов редкоземельных элементов, нельзя не попытаться дать объяснение положению, что А-тип оксидов устойчив для больших катионов, а С-тип — для малых. В табл. 10 приведены данные, показывающие зависимость конфигурации координационной сферы от отношения радиуса катиона к радиусу аниона.
Таблица 10. Различные конфигурации координационной сферы
| Координационное число |
Конфигурации координа- [ ционной сферы |
Отношение радиусов |
3
4
4
6
8
12
|
Треугольник АХ3
Тетраэдр АХ4
Квадрат АХ4
Октаэдр AX6
Куб AX8
Плотнейшая кубическая или гексагональная упаковка АХ12
|
0.158 ≤А ≤ 0.225 0.225 ≤ к ≤ 0.415 0.415 ≤ к ≤ 0.732 0.415 ≤ к ≤ 0.732 0.732 ≤ А ≤1.00
k≈1.0
|
В настоящее время в физике твердого тела приводится следующее объяснение этой таблицы. Взаимодействие сферически симметричных ионов является ненаправленным и ненасыщенным. Ненасыщенность ионной связи проявляется в том, что каждый ион стремится приблизить к себе как можно больше противоположна заряженных ионов, т. е. образовать структуру с возможно более высокими координационными числами. Однако эти конфигурации неустойчивы в том случае, если катионы настолько малы, что свободно помещаются между анионами и могут «болтаться» в соответствующих пустотах. Если катион приблизится к части окружающих его анионов (к. ч. понизится), то электростатическая энергия системы ионов уменьшится, а, следовательно, устойчивость системы возрастет [38].
Структура А-типа (гексагональная) состоит из координационных полиэдров, расположенных вокруг ионов редкоземельного элемента. Каждый полиэдр образован семью ионами кислорода, три из которых расположены на более удаленном расстоянии и четыре – на более близком расстоянии. Например, для La3
О3
этирасстояния равны2.68—2.78 А и 2,28—2.48 А соответственно. При переходе от окиси лантана к оксидам редкоземельных элементов с меньшимиионными радиусами расстояния М . . .О соответственно уменьшаются. Однако если в оксидах от La2
O3
до Nd2
О3
сумма ионных радиусов металла и кислорода практически равна расстоянию М . . .О, то начиная с Sm3
03
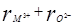 < dM
…
O
, что приводит к неустойчивости структуры А-формы для оксидов элементом с ионным радиусом, меньшим, чем у неодима.
< dM
…
O
, что приводит к неустойчивости структуры А-формы для оксидов элементом с ионным радиусом, меньшим, чем у неодима.
В структуре В-формы (моноклинной) имеется три типа координационных полиэдров. Общим для всех трех типов является то, что расстояния М. . .О для шести кислородных ионов несколько меньше, чем в соответствующей А-форме, в то время как седьмой ион значительно удален. Так, для окиси самария среднее значение М. . .О для шести кислородных атомов составляет 2.38—2.41 А, седьмой же кислородный атом находится от атома металла на расстоянии 2.71- 2.76 или 3.12 А в зависимости от типа полиэдра. Это позволяет некоторым авторам рассматривать структуру В-формы как состоящую из смеси МО6
- и МО7
- полиэдров, а следовательно, являющуюся промежуточной между А- и С-формами, структуры которых создаются из одного типа координационных полиэдров (МО7
— в гексагональном А-типе иМО6
— в кубической С-форме). Структура В-формы является устойчивой для оксидов самария, европия и гадолиния вплоть до температур 2000—2300°.
В кубической С-форме кристаллизуются оксиды редкоземельных элементов, имеющие меньший ионный радиус, чем гадолиний. Так как увеличение температуры равносильно увеличению «эффективного» радиуса катиона, можно наблюдать обратимый фазовый переход для оксидов, находящихся на границе устойчивости С- и В-форм или В- и А- форм. В предыдущих разделах было показано, что для оксидов диспрозия, тербия и гольмия в действительности наблюдается обратимый переход С ↔ В-типа, а для оксидов европия и самария — переход В ↔
А-типа, причем чем меньше ионный радиус элемента при стандартных условиях, тем до более высоких температур нужно нагреть оксид, чтобы осуществить превращение С ↔В или В ↔А. В работе Ладда и Ли [39] были рассчитаны энергии решеток оксидов редкоземельных элементов. Расчет проводился с использованием как формулы Борна—Габера
U
=
ΔH
— (
I
+
S
)
M
—  — E
0
+ 2RT — E
0
+ 2RT
где U
— энергия решетки, ΔH
— энтальпия образования оксида, (
I
+
S
)
M
—энергия ионизации и сублимации редкоземельного металла,  и ЕО
—
энергия диссоциации и сродство к электрону для кислорода, так и по формуле и ЕО
—
энергия диссоциации и сродство к электрону для кислорода, так и по формуле
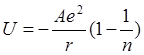
где А
— константа Маделунга, г — расстояние между ближайшими ионами противоположного знака, п —
степень потенциалf отталкивания. На рис. 46 представлены расчетные данные Лада и Ли для энергии А- и С-форм оксидов в зависимости от ионного радиуса редкоземельного элемента, а также ориентировочный ход кривой энергии решетки для В-формы оксидов.
Наблюдаемые области Стабильности различных структурных форм хорошо согласуются с предположением, что тип полуторной окиси, существующий при обычном давлении, всецело определяется температурой и размером катиона. Тем не менее иногда в процессе образования кристаллического вещества может образоваться структура, энергетически менее выгодная. Но в любом случае реальная кристаллическая решетка будет стабильна при условии абсолютного или относительного минимума свободной энергии. Практически это проявляется в том, что при образовании полуторных оксидов, независимо от размера катиона, сначала образуется С-форма оксида. Для больших катионов эта форма оксида является местабильной, однако переход ее в стабильную равновесную модификацию возможен вплоть до высоких температур.
Относительная устойчивость оксидов в метастабильной С-форме, т.е. оксидов элементов с ионным радиусом, большим, чем у тербия, повышается в ряду от La2
03
до Gd2
03
. Как видно из рис. 8, одновременно с уменьшением ионного радиуса катиона наблюдается увеличение энергии решетки, а следовательно, и энергии связи М. . .0 [40] (как для устойчивых форм, так и для метастабильной С-формы), что приводит к возрастанию энергии активации и температуры перехода С-формы в устойчивые А- или В-формы.
Кроме этого, уже было показано, что не существует строго определенной температуры фазового перехода, а наблюдается расширенный интервал температур, внутри которого происходит превращение. Так как энергия активации зависит от совершенства кристаллической решетки метастабильной фазы, ширина температурного интервала и его положение сильно зависят от предыстории образца и от дефектности его структуры.
Для обратимых фазовых превращений классическая теория требует наличия определенной температуры перехода кубической модификации в моноклинную. При этой температуре свободная энергия моноклинной фазы GM
равна свободной энергии кубической фазы Gk
; температура перехода, полученная при нагревании вещества, равна температуре перехода при охлаждении (рис. 6, а).
Однако, как было показано Убберхольдом [41], свободная энергия является функцией не только давления и температуры, но и параметров α и β, характеризующих энергию внутренних напряжений фазы и ее поверхностную энергию, зависящую от состояния соседней фазы. Эти параметры α и β определяются физическим состоянием фаз в системе и существенно различны для зарождающегося зародыша новой фазы и окружающей его матрицы старой фазы.
Таким образом, для оксидов тербия, диспрозия и гольмия вблизи температуры превращения мы имеем четыре функции свободной энергии.
Превращение при нагревании
1) Gk
=
fk
(
p
, Т,
αk
, βk
)—свободная энергия кубической матрицы,
2) GM
’
=fM
(
p
, Т,
α'М
, β' М
)— свободная энергия зародыша кубической фазы в кубической матрице.
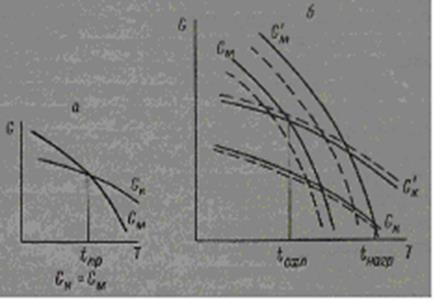
Рис.6. Изменение свободной энергии кубической и моноклинной форм оксидов в зависимости от температуры
а — превращение без гистерезиса; б — превращение с гистерезисом. Пунктиромпоказано смещение температур фазовых превращений при образовании твердых растворов.
Превращение при охлаждении
3) G
М
=
fM
(
p
, Т,
αM
, βM
)—свободная энергия моноклинной
матрицы,
4) Gk
’
=fk
(
p
, Т,
α'k
, β'k
)—свободная энергия зародыша кубической фазы в моноклинной матрице.
Изменение этих четырех функций Gk
,
G
'
M
,
GM
и G
’
k
представлено на рис. 9, б.Условием равновесия будет G
'
M
=
Gk
при нагревании и G
’
k
=GM
при охлаждении. Эта простая схема дает ясное представление о наблюдаемом у этих оксидов явлениигистерезиса: для Tb2
О3
Δ(tнагр
—
tохл
)=3000
и для Dy2
O3
Δ(tнагр
—
tохл
)=2000
[21]. Кроме этого, для обратимых превращений можно предположить наличие смещении кривых (показано на рис. 6, б пунктиром) свободной энергии в зависимости от совершенства кристаллической решетки каждой из фаз. Однако при высоких температурах и больших скоростях обратимых превращений этот фактор будет оказывать значительно меньшое влияние, чем в случае медленно протекающих необратимых фазовых превращений.
Для однотипных кристаллических веществ термодинамическое условие минимума свободной энергии во многих случаях с достаточной точностью можно заменить условием минимума объема. Критерием объемных изменений, происходящих при образовании соединений, может служить коэффициент компактности структуры q
, который равен отношению объема частиц, образующих кристалл, ко всему объему кристалла:
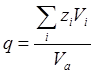
где zi
— число частиц сорта i
в элементарной ячейке, Vi
— объем частицы, Va
— объем элементарной ячейки. Из рисунка видно, что коэффициент q
изменяется симбатно с изменением — ΔН0
(исключение составляют только оксиды европия и иттербия, склонные к восстановлению при высоких температурах). А-тип структуры является наиболее устойчивым для оксидов элементов с ионным радиусом, большим чем 0.97 А, т. е. для La2
О3
, Ce2
О3
, Рr2
О3
, Nd2
О3
. Для элементов с меньшим ионным радиусом более устойчивым является В-тип структуры. С-тип структуры является наименее плотно упакованным. Поэтому возможно осуществить С → В-превращение воздействием высокого давления [23]. Однако В-формы оксидов от Но2
О3
до Lu2
О3
устойчивы только при высоком давлении и переходят обратно в С-формы при снижении давления.
7. СТАБИЛИЗАЦИЯ МЕТАСТАБИЛЬНЫХ ФОРМ ПОЛУТОРНЫХ ОКСИДОВ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ
На основании вышеприведенных данных, получить С-форму оксидов легких редкоземельных элементов в состоянии устойчивого равновесия можно только при условии введения в оксид примесей.
Так же как вакансии в кристаллической решетке, примеси оказывают различное влияние на ход полиморфных превращений как в кинетическом смысле (затормаживая или ускоряя переход метастабильных фаз в стабильные), так и в термохимическом (изменяя знак ΔF
для реакций перехода одной формы в другую). Вопрос стабилизации того или иного химического соединения сводится к выяснению влияния небольших добавок, не изменяющих типа структуры и характерных свойств данного соединения, но увеличивающих его устойчивость. Нахождение в решетке G-формы оксида гидроксильных групп стабилизирует решетку при низких температурах, малая устойчивость гидратов при высоких температурах практически не допускает повышения температуры перехода С → А-типа.
Другой метод стабилизации различных структурных типов основан на введении в оксид редкоземельного элемента таких добавок, твердые растворы которых с оксидами редкоземельных элементов кристаллизуются в том же типе структуры, но обладают более обширной областью существования. В данном случае термодинамическая устойчивость твердых растворов (или соединений переменного состава, например Рг01;б+ж
) определяется величиной изменения энтальпии и энтропии при их образовании.
Можно показать, что в первом приближении энтальпия образования соединения нестехиометрического состава и твердых распоров совпадает с энтальпией образования механической смеси соответствующих стехиометрических соединений, а энтропия их больше, чем у соответствующей механической смеси. Это приведет смещению кривых свободной энергии (рис. 9, б)
в зависимости от состава образующегося твердого раствора, а следовательно и к изменению температур фазовых переходов.
Существенным является также влияние метода приготовлена твердых растворов на их структуру. При получении твердых растворов методом соосаждения в аморфном состоянии или разложения легко разлагающихся солей в качестве промежуточного продукта образуются кубические твердые растворы, кристаллизующиеся, в зависимости от состава, в структуре типа флюорита или С-формы оксидов редкоземельных элементов. Относительная устойчивость этих метастабильных форм, а также пути их превращения в устойчивые равновесные фазы сильно зависят от состава твердого раствора. Так, небольшие количества добавок двуокиси циркония к окиси неодима повышают температуру перехода из метастабильной С-формы в А-форму; при больших же количествах двуокиси циркония в твердом растворе метастабильная С-форма сначала переходит в В-форму и только при более высоких температурах образуется равновесный продукт.
Таким образом, вводя в оксиды редкоземельных элементов добавки других оксидов, можно получить твердые растворы, обладающие нужными для практики свойствами и кристаллизующиеся в определенном типе структуры.
8. ЗАКЛЮЧЕНИЕ.
В настоящей работе рассмотрены структура и устойчивость различных форм полуторных оксидов редкоземельных элементов, в частности, европия, а также влияние метода приготовления оксида на его структуру и свойства. На основании изложенного материала можно предложить следующую схему фазовых превращений в окислах редкоземельных элементов (рис. 7).
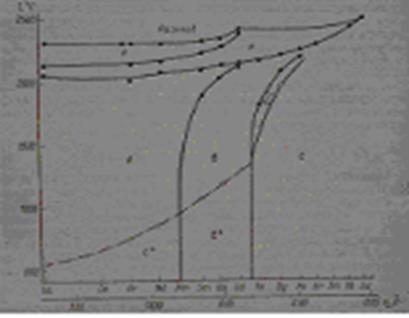
Рис. 7. Диаграмма фазовых превращений в оксидах РЗЭ.
Наблюдаемые на рис. 7 области стабильности различных структурных форм хорошо согласуются с положением, что тип полуторного оксида всецело определяется температурой, давлением и размером катиона.Применение высоких давлений способствует переходу метастабильных С-форм оксида европия В-форму. Температура переходаметастабильной С-формы в устойчивую В-формузависит от энергии решетки оксидов и возрастает от оксида лантана к оксиду гадолиния.
В дальнейшем необходимо продолжить исследования в области изучения условий получения и свойств твердых растворов на основе оксидов редкоземельных элементов. Кроме этого, необходимо уточнить границы областей существования новых полиморфных модификаций (Н- и Х-форм), присущих европию, а также более детально определить их структуру и механизм превращения.
Список литературы
1. E.S. Shears, Trans. Brit. Ceram. Soc., 61, 225 (1962)
2. W.W. Goldschmadt, Skr. Norsk vid.-akad. Oslo, №5 (1925), №7 (1927).
3. K. Löhberg, Z. phys. Chem., B-28, №5, 402 (1935)
4. R.S. Roth, S.J. Schneider, J.Res. NBS, 64A, 309 (1960)
5. J. Warschaw, R. Roy, J. phys. Chem. 65, №11, 2048 (1961)
6. M.V. Shafer, R. Roy, J. Amer. Ceram. Soc., 42, 563 (1959)
7. L. Wolf, H. Bärnighausen, J. prackt. Chem., 3(4), №3/4, 228 (1956)
8. A. Jandelli, Gazz. Chim. Ital., 77 №7/8, 312 (1947)
9. В.В. Серебренников. Химия редкоземельных элементов, т.1 Томск (1959)
10. Г.Э. Кремерс. В сб. «Редкоземельные металлы. Металлургия редкоземельных металлов», ИЛ, М., стр.7 (1962)
11. Б.Лав. В сб. «Редкоземельные металлы. Металлургия редкоземельных металлов», ИЛ, М., стр.76 (1962)
12. Lee Linda, N.D. Green «Corrosion», 20, №5, 145 (1964)
13. K.S. Vorres, Le Roy Eering, Rare Earth Research., ed. By Kleber, E.V. Macmillan Co. N. Y., S. 119 (1961)
14. W. H. Zachariasen, Z. phys. Chem., 123, 124 (1926)
15. L. Pauling, Z. cristallochem., 69, 415 (1928); 75, 128 (1930)
16. R. M. Douglass, Analyt. Chem., 28, №4, 551 (1956)
17. O. J. Guentert, R. J. Mozzi, Acta crystallogr., 11, №10, 746 (1958)
18. R. M. Douglass, E. Staritzky, Analyt. Chem., 28, №4, 552 (1956)
19. M. Foex, Bull. Soc.,chim. France, №1, 137 (1962)
20. В. Б. Глушкова, А. Г. Боганов, Изв. АН СССР, серю хим., №7, 1131 (1965)
21. А. Г. Боганов, В. С. Руденко, ДАН СССР, 161, №3, 611 (1963)
22. G. Brauer, R. Müller, Z. anogram. Allgem. Chem., 321, №5/6, 234 (1963)
23. H. R. Hockstra, K. A. Gingerich, Science, 146, 1163 (1964); Inorg. Chem. 5, 754, (1966)
24. B. H. Justice, E. F. Westrum, J. Phys. Chem.., 67, №2, 339 (1963)
25. E. F. Westrum. Progress in the Science and Technology of the rare earths, vol. 11, ed. Le Roy Eyring (1964)
26. B. H. Justice, E. F. Westrum, J. Phys. Chem.., 67, №2, 345 (1963)
27. Cimino A. , Marezio M., G. phys. Chem. Solids 17, 57 (1960)
28. Holland L., Siddal G., Vacuum, 3, 375 (1953)
29. Lapple F., Z. physic, 137, 380 (1954)
30. Fimkenrath H., Z. phys. 112, 158, 511 (1960)
31. Михайличенко А. И., Клименко М. А., в сб.: Итога науки -и техники. Металлургия цветных и редких металлов, т. 10, М., 1977, с. 5-36;
32. E. F. Westrum, B. H. Justice, J. Phys. Chem.., 67, №3, 659 (1963)
33. L. B. Pankratz, E.G. King, K. K. Kelly, U. S. Bur. Min. Rept. Invest. №6033 (1962)
34. L. B. Pankratz, E.G. King, U. S. Bur. Min. Rept. Invest. №6175 (1963)
35. L. B. Pankratz, K. K. Kelly, U. S. Bur. Min. Rept. Invest. №6248 (1963)
36. Д. Ш. Цагарейшвили, Г. Г. Гвелесиани, ЖНХ, 10, №2, 319 (1965)
37. J. O. Blomke, W. T. Ziegel, J. Amer. Chem.. Soc., 73, 5099 (1951)
38. Г. С. Жданов. Физика твердого тела. Изд. МГУ, 1962
39. M. F. Ladd, W. H. Lee, J. Inorg. Nucl. Chem.., 23, №3/4, 199 (1961)
40. А. А. Аппеи, В. Б. Глушкова, С. С. Каялова, Изв. АН СССР, сер. неорг. матер., 1, №4, 576 (1956)
41. A. R. Ubbelhode. IV Symposium International sur Reactivite des Solides Amsterdam (1960)
42. M. Foex, J. P. Traverse, J. P. Coutures, Compt. Rend., 260, №13, 3670 (1965); Rev. Hautes Temper. Et Refract., 3 №4, 408 (1939)
|