Зміст
Вступ
1. Завдання
2. Виконання завдання
2.1 Виробництво кальцинованої соди
2.2 Матеріальний розрахунок стадії очищення розсолу
2.3 Матеріальний баланс стадії очищення розсолу (на 1000 кг)
Список використаної літератури
Вступ
Тема контрольної роботи "Виробництво кальцинованої соди" з дисципліни "Основи екології у технології неорганічних речовин".
Сьогодні реконструкція існуючих технологій виробництв у багатьох випадках пов’язана з підвищенням їх екологічної безпеки. При створенні нових технологій однією з основних задач є також підвищення екологічної безпеки. Тому знання принципів створення безвідходних і маловідходних технологій, а також основних методів утилізації відходів є необхідним для інженерно-технічного персоналу підприємств, раціоналізаторів та адміністративно-управлінського персоналу. Необхідні ці знання студентам також для більш досконалого виконання курсових і дипломних проектів.
Дана дисципліна базується на знаннях, отриманих при вивченні курсів загальної та неорганічно хімії, органічної хімії, фізики, хімічної технології неорганічних речовин, теоретичних основ ТНР, основ екології, загальної хімічної технології, процесів і апаратів хімічної технології.
Задачею курсу є вивчення принципів і методів створення нових безвідходних і маловідходних виробництв, а також підвищення екологічної безпеки існуючих виробництв, найбільш розповсюджених методів утилізації відходів. Основна увага приділяється питанням класифікації відходів, джерелам їх утворення, методам утилізації, підбору основного типового устаткування.
При виконані завдання треба:
1. Привести принципову схему процесу.
2. Розрахувати матеріальний баланс процесу 1 т речовини (першої в рівнянні хімічної реакції) при відомих умовах. Визначити коефіцієнти витрати сировини, кількісний та якісний склади відходів.
3. Використовуючи навчальну і науково-технічну літературу, запропонувати методи зниження кількості відходів, що утворюються, або методи їх утилізації. Привести технологічну схему найбільш раціонального варіанта процесу утилізації відходів з описом, або схему основного виробництва з новими режимно-технологічними або апаратурно-конструктивними рішеннями, спрямованими на зниження кількості відходів, що утворюються. При виконанні завдання необхідно враховувати основний принцип екологізацїї техніки і технології – системний підхід. Він передбачає удосконалювання існуючих і розроблювальних природно-технічних систем на всіх рівнях ієрархії, починаючи з видобутку сировини і закінчуючи споживанням продукції з урахуванням взаємодії і взаємного впливу всіх складових. Саме системний підхід дозволяє забезпечити створення технічних систем з високими техніко-економічними характеристиками на кожнім окремо узятому ієрархічному рівні. В основу системної екологізації покладено наступні основні стратегічні принципи:
1. Економічні, технологічні та екологічні задачи необхідно вирішувати одночасно, підпорядковуючись єдиній стратегії екологізації економіки.
2. Екологізація економіки сьогодні звертає основну увагу та засоби не стільки на сферу споживання, скільки на удосконалення об’єктів, що являються фактичними або потенційними джерелами забруднення довкілля.
3. Успіх екологізації економіки здебільшого визначається наявністю достатньо підготовлених в області теорії та практики екологізації й екологічного менеджменту кадрів.
4. Створення цивілізованого екологічного ринку на регіональному рівні та у масштабах країни є необхідною умовою екологізації економіки.
Тактика реалізації цих стратегічних принципів базується на сполученні спеціальних підходів і організації технологічних процесів незалежно від галузі, до якої вони належать, з конкретними режимно-технологічними та апаратурно-конструктивними прийомами. Вивчення дисципліни "Основи екології у технології неорганічних речовин" та виконання контрольної роботи дозволяє реалізувати принцип "екологізація освіти".
1. Завдання
Технологічний процес, стадія
|
Умови проведення
|
| Виробництво кальцинованої соди,
стадія очищення розсолу
1) MgCl2
+Ca(OH)2
®CaCl2
+Mg(OH)2
2) CaCl2
+Na2
CO3
®CaCO3
+2NaCl
3) CaSO4
+Na2
CO3
®Na2
SO4
+CaCO3
4) Ca(OH)2
+Na2
CO3
®CaCO3
+2NaOH
|
Склад розсолу (% мас.):
NaCl – 20; MgCl2
– 0,6; CaSO4
– 6,7;
CaCl2
– 0,3.
Вміст Ca(OH)2
у вапняному молоці – 50% мас.
Надлишок Na2
CO3
– 5% від стехіометрично необхідної кількості. Надлишок Ca(OH)2
– 10% від стехіометрично необхідної кількості. Розрахунок вести на 1т розсолу.
|
2. Виконання завдання
2.1 Виробництво кальцинованої соди
На рис.1 [1] приведена технологічна схема очищення розсолу вапняно-содовим способом. У бак 1 подають содовий розчин, для готування якого використовуються кальцинована сода й очищений розсіл. З гасильного відділення цеху вапняних печей у бак 2 надходить вапняна суспензія. Для регулювання титру вапняної суспензії в мішалку-резервуар 2 підводять очищений розсіл. Далі реагенти надходять у змішувач 3. Процес очищення розсолу здійснюється безупинно. Сирий розсіл надходить з розсолопромислу в резервуари – сховища сирого розсолу 9. Основний потік сирого розсолу відцентровим насосом 10 через розширник 4 направляється по трубопроводу в реактор. У разі потреби частину сирого розсолу нагрівають за рахунок охолодження газу содових печей, після чого змішують з основним потоком у розширнику. Труба, що підводить рідину в реактор, має U-образну форму. Реактор не має мішалки. Необхідне перемішування досягається за рахунок великої швидкості надходження рідини з U-образних труб реактора.

Рис.1. Схема відділення очищення розсолу: 1 – бак содового розчину; 2 – бак вапняного молока; 3 – змішувач; 4 – розширник; 5 – реактор; 6 – відстійник; 7 – резервуар очищеного розсолу; 8 – збірник шламу; 9 – збірник неочищеного розсолу; 10 - насоси
розсол кальцинований сода утилізація меліорант
Для здійснення нормального перебігу процесу в реакторі температуру пульпи бажано підтримувати в межах 17±3о
с. Реактор з'єднаний трубопроводом з відстійником 6. Суспензія надходить зверху у відстійник і по центральній трубі, що не доходить до дна, опускається вниз. Потім розсіл піднімається нагору, відокремлюючись від твердої фази. Прояснений розчин видаляється з відстійника через переливний жолоб, розташований по периферії. Шлам з нижньої частини відстійника через спеціальні труби періодично спускається в збірник (шламову мішалку) 8; сюди ж надходить шлам з реактора 5. Прояснений розсіл з відстійника 6 направляється в збірник 7 і далі насосом 10 – на абсорбцію. У мішалці 8 шлам розбавляється водою і насосом 10 перекачується в шламопроводи дистилерної рідини.
2.2 Матеріальний розрахунок стадії очищення розсолу
У 1000 кг розсолу міститься:
NaCl: 1000×0,2=200 кг;
MgCl2
: 1000×0,006=6 кг;
CaSO4
: 1000×0,067=67 кг;
CaCl2
: 1000×0,003=3 кг;
інше вода: 1000-(200+6+67+3)=724 кг.
Витрата Ca(OH)2
100%-ого по реакції (1):  кг; кг;
при 10%-му надлишку Ca(OH)2
100%-ого: 4,66×1,1=5,13 кг;
розчину Ca(OH)2
: 5,13/0,5=10,26, у ньому води: 10,26-5,13=5,13 кг.
Витрата Na2
CO3
:
по реакції (1) утворилося СаCl2
: 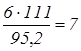 кг; кг;
по реакції (2) витрачається соди: 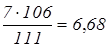 кг; кг;
по реакції (2) витрачається соди на вихідну кількість СаCl2
:  кг; кг;
по реакції (3) витрачається соди: 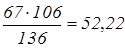 кг; кг;
по реакції (4) витрачається соди на надлишкову кількість Сa(OH)2
: 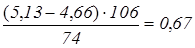 кг; кг;
Разом витрачається соди: 6,68+2,56+52,22+0,67=62,43 кг;
с урахуванням 5%-го надлишку: 62,43×1,05=65,55 кг.
По реакції (1) утворюється Mg(OH)2
:  кг. кг.
CaCO3
утворюється по реакції (2) із СaCl2
реакції (1): 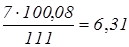 кг, кг,
по реакції (2) з вихідного СaCl2
:  кг, кг,
по реакції (3):  кг, кг,
по реакції (4) з надлишкового Ca(OH)2
: 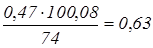 кг. кг.
Разом утворюється CaCO3
: 6,31+2,70+49,30+0,63=58,94 кг.
NaCl утворюється
по реакції (2) із СaCl2
реакції (1): 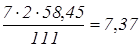 кг, кг,
по реакції (2) з вихідного СaCl2
:  кг. кг.
Разом утворюється NaCl: 7,37+3,16=10,53 кг.
Na2
SO4
утворюється по реакції (3):  кг. кг.
NaOH утворюється по реакції (4): 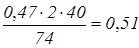 кг. кг.
2.3 Матеріальний баланс стадії очищення розсолу (на 1000 кг)
ПРИХІД
|
ВИТРАТА
|
| сировина
|
кг
|
%
|
продукт
|
кг
|
%
|
| 1) розсіл,
у т.ч.: NaCl
|
1000
200
|
92,95
20
|
NaCl
|
210,53
|
19,57
|
| MgCl2
|
6
|
0,6
|
Mg(OH)2
|
3,67
|
0,34
|
| CaSO4
|
67
|
6,7
|
CaCO3
|
58,94
|
5,48
|
| CaCl2
|
3
|
0,3
|
Na2
SO4
|
69,96
|
6,5
|
| вода
|
724
|
72,4
|
NaOH
|
0,51
|
0,05
|
| 2)вапняне молоко,
у т.ч.: Са(ОН)2
|
10,26
5,13
|
0,95
50
|
| вода
|
5,13
|
50
|
вода
|
729,13
|
67,77
|
| 3)Na2
CO3
|
65,55
|
6,1
|
Na2
CO3
|
3,12
|
0,29
|
| УСЬОГО
|
1075,81
|
100
|
УСЬОГО
|
1075,86
|
100
|
Розчин хлориду натрію (розсіл) – вихідну сировину для виробництва кальцинованої соди – одержують шляхом підземного вилужування кам'яної солі в свердловинах методом гідроврубу; розчиненням кам'яної солі, добутої в шахтах, а також шляхом осадження солі в спеціальних басейнах або в природних озерах з одержанням розсолу необхідної концентрації.
Через наявність домішок у сировині не вдається одержати чистий розсіл для безпосереднього використання у виробництві соди. Він містить домішки солей Са і Mg. Якщо їх не видалити, то на наступній стадії – абсорбції – при поглинанні аміаку і диоксида вуглецю з розсолу будуть випадати в осад погано розчинні у воді сполуки СаСО3
, Mg(OH)2
, NaCl×Na2
CO3
×MgCO3
і (NH4
)2
CO3
×MgCO3
, що приведе до забруднення апаратури, трубопроводів, а також до забруднення готової продукції – соди. Тому розсіл піддають очищенню від солей кальцію і магнію. На содових заводах розсіл очищають від домішок вапняно-содовим способом [1]: для осадження солей кальцію використовують соду, для осадження солей магнію – вапняну суспензію. У процесі очищення магній осаджується з розсолу у виді гидроксиду, а кальцій – у виді карбонату. Отримана суспензія відстоюється. З відстійника розсіл надходить у відділення абсорбції. Після відстоювання утворюється очищений розсіл з вмістом зважених часток на рівні слідів і шлам з вмістом твердих речовин СаСО3
і Mg(OH)2
250±20 г/л [2]. Щільність розсолу перед відстоюванням розрахуємо за принципом адитивності:
 , ,
де  - щільність і-го компонента; - щільність і-го компонента;
ni
– масова частка і-го компонента.
| Речовина
|
 , кг/дм3
[3] , кг/дм3
[3]
|
| NaCl
|
2,165
|
| Mg(OH)2
|
2,350
|
| CaCO3
|
2,930
|
| Na2
SO4
|
2,698
|
| NaOH
|
2,130
|
| H2
O
|
1,000
|
| Na2
CO3
|
2,533
|
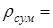 2,165 0,1957+2,35 0,0034 2,93 0,0548+2,698 0,065+2,13 0,0005+1 0,6777+2,533 0,0029=1,31 кг/дм3
. 2,165 0,1957+2,35 0,0034 2,93 0,0548+2,698 0,065+2,13 0,0005+1 0,6777+2,533 0,0029=1,31 кг/дм3
.
При такій щільності об’єм, що займає 1075,86 кг суспензії, складе
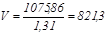 дм3
. дм3
.
Вміст у ньому зважених часток CaCO3
і Mg(OH)2
складає 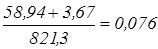 кг/дм3
=76 г/дм3
. кг/дм3
=76 г/дм3
.
За умови, що після відстоювання розсіл не містить зважених часток, а шлам містить (у середньому) 250 г/л зважених часток, то кількість шламу, що утворюється з неочищеного розсолу складе 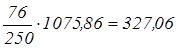 кг. кг.
Вміст твердих часток CaCO3
і Mg(OH)2
складає 62,61 кг або 62,61/327,06∙100=19,14%. Кількість розсолу, що міститься в шламі, складе:
327,06-62,61=264,45 кг або 264,45/327,06 100=80,86%.
Для визначення кількості NaCl, Na2
SO4
, NaOH і H2
O у шламі розрахуємо його склад у відсутності зважених часток. Маса розсолу без зважених часток складає:
1075,86-58,94-3,67=1013,25 кг.
Тоді вміст NaCl, Na2
SO4
, NaOH і H2
O відповідно складе:
 ; ;
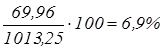 ; ;
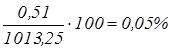 ; ;
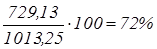 . .
Вміст цих речовин у шламі складе:
NaCl: 264,45 0,2078=55 кг;
Na2
SO4
: 264,45 0,069=18,3 кг;
NaOH: 264,45 0,0005=0,13 кг;
H2
O: 264,45∙0,726=190,3 кг.
Таким чином, при одержанні 1т очищеного і проясненого розчину утвориться шламу: 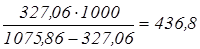 кг, кг,
з вмістом у ньому:
СaCO3
+Mg(OH)2
– 19
NaCl: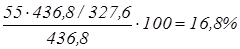 ; ;
Na2
SO4
: 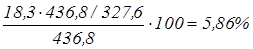 ; ;
NaOH: 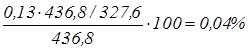 ; ;
H2
O: 
Шлам через шламопроводи дистилерної рідини направляють на виробництво меліоранта (або інших продуктів на основі карбонатної сировини, наприклад, хлориду кальцію). На рис.2 приведена схема виробництва меліоранта. Дистилерна суспензія надходить у відстійник 1, відкіля прояснена фаза направляється у виробництво хлориду кальцію, а згущена – у проміжну ємність 2 і потім у камерний фільтр-прес 3. Фільтрат зі збірника 4 направляється у виробництво хлориду кальцію. Промивний фільтрат, а також регенераційну рідину після промивання фільтрової тканини збирають у ємності 5 і направляють на гасіння вапна, готування вапняного молока й ін. технологічні потреби. Відфільтрований осад транспортером 6 подається в бункер-вібродозатор 7 і далі – у змішувач 8. У змішувач же надходить частина продукту в якості ретура (відношення 1:1,5). Після змішання вологого шламу і ретура матеріал завантажують у барабанну сушарку 10, де він висушується до вологості 8%. Після сушіння матеріал подрібнюється в молотковій дробарці 11 і надходить у пневмоустановку 9, а далі в силос 12. Із силосу 12 продукт направляється споживачеві.
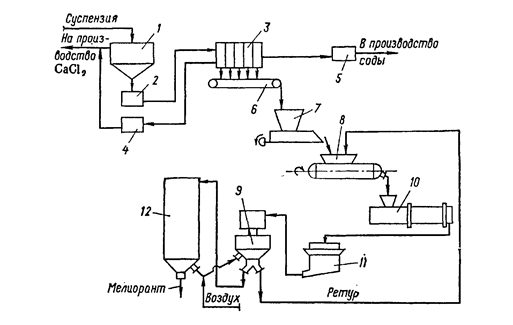
Рис.2. Схема виробництва меліоранта: 1 – відстійник; 2 – проміжна ємність; 3 – камерний фільтр-прес; 4 – збірник фільтрату; 5 – збірник промивних вод; 6 – транспортер; 7 – бункер-вібродозатор; 8 – змішувач; 9 – пневмоустановка; 10 – барабанна сушарка; 11 – молоткова дробарка; 12 – силос
Дистилерна суспензія, що надходить у цех хлориду кальцію [1], проходить попередню карбонізацію газом, що містить диоксид вуглецю, у карбонаторе 1, після чого направляється на відстій від зважених часток у відстійник 2. Шлам (тверда фаза) з відстійника направляють на подальшу переробку у виробництво вапняного меліоранта і кормових добавок, а прояснений розчин зливають у ємність 3. Сюди додають ініціювання з активного ангідриту CaSO4
для запобігання інкрустування теплопередаючих поверхонь випарної батареї.
Прояснена дистилерна рідина з ініціюванням з ємності 3 насосом 4 подається в трикорпусну прямоточну батарею 5, де рідина випарюється до вмісту 18% CaCl2
. З останнього корпуса випарної установки суспензія зливається у відстійник 7. Згущену суспензію, що представляє собою ініціювання, через ємність з мішалкою 8 насосом 9 повертають у ємність 3 для подальшого використання ініціювання.
Частково випарена і прояснена від ініціювання дистилерна рідина з бака 10 насосом 11 направляється на другу випарну трикорпусну прямоточну установку 12. Тут дистилерна рідина концентрується до 38% за хлоридом кальцію і виділяється основна маса хлориду натрію. Останні корпуси випарних установок 5 і 12 працюють під вакуумом. Вторинна пара з останніх корпусів направляється в конденсатори змішання 6 і 13. Повітря і пара, що нескондесувалася, з конденсаторів відсмоктуються вакуум-насосами. Конденсат, що утворився у випарних установках, направляється на розсолопромисел, що дозволяє відповідно зменшити витрату чистої води.
Суспензія хлориду натрію в 38%-ном розчині хлориду кальцію зливається у відстійник 14. Згущена частина з відстійника далі надходить на центрифугу 15, відкіля твердий хлорид натрію направляється споживачам або повертається у виробництво соди. Фугат через збірник фугата 16 насосом 17 повертається у відстійник 14. Прояснений 38%-ный розчин хлориду кальцію зливається в ємність 18, а потім насосом 19 подається на усмоктувальну лінію циркуляційного насоса вакуум-кристалізаційної установки. У вакуум-кристалізаторі 20 відбувається подальше концентрування розчину до вмісту 40% CaCl2
, причому у тверду фазу виділяється додаткова кількість хлориду натрію. Суспензія хлориду натрію в 40%-оум розчині хлориду кальцію з вакуум-кристалізатора направляється у відстійник солі 21; згущена соляна пульпа далі надходить у відстійник 14.
Прояснений 40%-ний розчин хлориду кальцію подається у випарний апарат 22, що працює при атмосферному тиску, де розчин випарюється до стану плаву (72% CaCl2
). Вторинна пара апарата 22 використовується для обігріву апарата-утилізатора 23, що працює (по струму рідини) паралельно випарній установці 5. Плав хлориду кальцію надходить у корито апарата лускування 24, а в барабан апарата подається охолоджена вода. "Сира" лусочка зрізується з барабана ножем і за допомогою транспортера 25 направляється в апарат для загартування 26.

Рис.3. Схема виробництва хлориду кальцію: 1 – карбонатор; 2,7,14,21 – відстійники; 3,8,18 – ємності; 4,9,11,17,19 – насоси; 5,12 – випарні установки; 6,13 – конденсатори змішання; 10 – бак; 15 – центрифуга; 16 – збірник фугата; 20 – вакуум-кристалізатор; 22 – апарат плаву; 23 – утилізатор; 24 – апарат лускування; 25,31 – транспортери; 26 – апарат загартування; 27 – топка; 28 – циклон; 29 – вентилятор; 30 – барабан для охолодження
Сушіння лусочки здійснюється топковими газами, що проходять протитоком до матеріалу, що висушується. Топкові гази в барабан для загартування надходять з топки 27, де згоряє суміш природного газу і повітря. Топкові гази після гартівного барабана, пройшовши циклон 28, вентилятором 29 викидаються в атмосферу.
Гаряча прожарена лусочка з вмістом основної речовини ≈78% CaCl2
пересипається в барабан для охолодження, стінки якого прохолоджуються водообіговою водою. Готову охолоджену лусочку транспортером 31 відправляють на затарювання і потім на склад готової продукції.
Якщо шлам розсолоочистки переробити окремо від дистилерної рідини, то його можна додатково розділити на твердий залишок, що містить СаСО3
, Mg(OH)2
і CaSO4
×2Н2
О и рідку фазу, що представляє собою близький до насичення розчин NaCl у воді. Рідку фазу доцільно повернути на розсолоочистку. Тверду фазу можна використовувати як сировину для одержання белітових в'язких речовин, або, наприклад, алебастру. Для цього необхідно СаСО3
і Mg(OH)2
перевести в сульфати, отримана суміш після термообробки і розмелу буде мати в'язкі властивості і може використовуватися в будівельній індустрії. Тверду фазу безпосередньо можна використовувати як добавку у виробництві цементу, як сировину для одержання Mg й ін. цілей.
Таким чином, повернення близького до насичення розчину NaCl на розсолоочистку і переробку твердої фази, що містить, в основному, СаСО3
, Mg(OH)2
і CaSO4
×2Н2
О в виробництві белітових в'язких як сировину, дозволить реалізувати два режимно-технологічних прийоми екологізації (рециркуляція і суміщення) і один апаратурно-конструктивний (замкнутість структури), а також принципи: локальне знешкодження викидів, рекуперація, утилізація відходів, ресурсозбереження, комплексність.
Список використаної літератури
1. Зайцев И.Д., Ткач Г.А., Стоев Н.Д. Производство соды. – М.:Химия, 1986. – 312с.
2. Шокин И.Н., Крашенинников С.А. Технология соды. – М.:Химия, 1975. – 288с.
|