Содержание
Обозначения и сокращения
Введение
1. Литературный обзор
1.1 Возможные последствия чрезвычайных ситуаций на объектах по хранению и уничтожению химического оружия
1.2 Трансформация фосфорорганических соединений в объектах окружающей среды
1.3 Процессы самоочищения почв
1.4 Микроорганизмы-деструкторы фосфорорганических соединений
2. Основная часть
2.1 Методика отбора штаммов микроорганизмов, способных растворять фосфорорганические соединения
2.2 Методика культивирования микроорганизмов
2.3 Методика проведения эксперимента по изучению возможности деструкции метилфосфоновой кислоты и её эфиров
2.4 Методика контроля роста микроорганизмов
2.5 Методика определения концентрации соединений с С-Р связью
3. Обсуждение результатов
3.1 Отбор штаммов микроорганизмов, способных растворять фосфорорганические соединения
3.2 Биодеструкция метилфосфоновой кислоты и её кислых эфиров.
3.3 Пути метаболизма органофосфонатов
Заключение
Список использованных источников
Обозначения и сокращения
ЗЗМ - зона защитных мероприятий
МФК - метилфосфоновая кислота
НИР - научно-исследовательская работа
ОВ - отравляющие вещества
ОДК - ориентировочная действующая концентрация
ОС - окружающая среда
ПДК - предельно-допустимая концентрация
ПДУ - предельно-допустимый уровень
ТХ - токсичный химикат
УХО - уничтожение химического оружия
ФОВ - фосфорорганические отравляющие вещества
ХО - химическое оружие
Введение
Обеспечение безопасности людей и защита окружающей среды (ОС) являются основополагающими требованиями Конвенции о запрещении разработки, производства, накопления и применения химического оружия и о его уничтожении [1]. Функционирование системы безопасности при проведении работ с химическим оружием (ХО) в России регламентируется нормативными правовыми актами [2,3] и федеральной целевой программой «Уничтожение запасов ХО в Российской Федерации» [4]. К актуальным задачам Программы [4] относятся:
- мероприятия по созданию государственной системы мер по охране ОС и обеспечению экологической безопасности при проведении работ по хранению и уничтожению ХО;
- проведение работ по санации загрязненных территорий после уничтожения ХО категории 1.
Разработка методов и средств реабилитации объектов ОС в районах расположения объектов по хранению и уничтожению ХО является приоритетным направлением исследований в области обеспечения экологической безопасности [5].
Анализ тенденций развития исследований в области защиты ОС показывает, что, наряду с совершенствованием существующих методов, большое внимание уделяется биотехнологии санации почв, за которыми признается несомненный приоритет по показателям эффективности и экономичности. Такие методы экологически безопасны и выгодно отличаются по сравнению с другими отсутствием вторичных отходов, т.е. возможностью полной минерализации химических соединений, выбрасываемых в окружающую среду в качестве промышленных отходов [6]. Биологические методы восстановления загрязненных территорий по оценкам экспертов требуют затрат для своего применения примерно в тысячу раз меньше, чем известные небиологические технологии.
Целью работы являлась оценка возможности микробиологической деструкции метилфосфоновой кислоты и её кислых эфиров.
Для достижения поставленной цели необходимо решение следующих задач:
- анализ литературных данных о существующих технологиях реабилитации загрязненных почв;
- скрининг микроорганизмов-деструкторов фосфорорганических соединений;
- изучение возможности биодеструкции продуктов разложения фосфорорганических отравляющих веществ.
1. Литературный обзор
1.1 Возможные последствия чрезвычайныхситуацийнаобъектах по
хранениюи уничтожениюхимическогооружия
Ключевым звеном в ликвидации ХО является безопасность процесса уничтожения. В п. 3 статьи VII Конвенции о запрещении ХО определено, что в ходе выполнения обязательств каждое государство-участник Конвенции «уделяет первостепенное внимание обеспечению безопасности людей и защите окружающей среды». В соответствии с Федеральной целевой программой «Уничтожение запасов химического оружия в Российской Федерации», утвержденной постановлением Правительства РФ № 969 от 29 декабря 2007 г., необходимо выполнение следующих мероприятий по обеспечению безопасности хранения и уничтожения ХО:
- организация и проведение государственной санитарно-гигиенической и экологической экспертиз предпроектных и проектных материалов по строительству объектов по УХО, а также технической и эксплуатационной документации на технологическое оборудование этих объектов;
- метрологическая аттестация технологического оборудования, используемого для мониторинга окружающей среды и контроля за состоянием здоровья граждан на объектах по хранению ХО, объектах по УХО, а также при уничтожении объектов по его производству и разработке;
- оснащение современными автоматическими системами охраны, сигнализации и видеонаблюдения объектов по хранению ХО и объектов по УХО;
- оснащение современными автоматизированными системами управления технологическими процессами объектов по УХО;
- внедрение технологий, безопасных в промышленном, пожарном и экологическом отношении, а также экономически приемлемых для УХО, полностью исключающих или в максимальной степени снижающих негативное воздействие на здоровье человека и окружающую среду;
- обеспечение промышленной (технологической), пожарной и экологической безопасности при проведении работ по хранению, перевозке и уничтожению ХО;
- проведение комплекса мероприятий по предотвращению возникновения аварий и пожаров на объектах по хранению ХО и объектах по УХО;
- использование современных систем мониторинга загрязнения окружающей среды химическими соединениями, образующимися в процессе эксплуатации объектов по хранению ХО и объектов по УХО;
- обеспечение социально-гигиенического и экологического мониторинга работ, связанных с хранением и уничтожением ХО;
- систематическая проверка технического состояния химических боеприпасов на объектах по хранению ХО и проведение необходимых работ для их поддержания в безопасном состоянии;
- своевременное выявление и уничтожение аварийных химических боеприпасов с использованием комплексов, специально предназначенных для этих целей, при соблюдении требований технологической и экологической безопасности;
- разработка комплекса мероприятий по локализации и ликвидации последствий аварий и пожаров на объектах по хранению ХО и объектах по УХО, а также при его перевозке;
- обеспечение персонала объектов по хранению ХО и объектов по УХО, а также граждан, проживающих и работающих в зонах защитных мероприятий, индивидуальными средствами защиты, антидотами и другими необходимыми медикаментозными препаратами на случай возникновения аварийных ситуаций;
- создание локальных систем оповещения при возникновении аварийных ситуаций на объектах по хранению ХО и объектах по УХО, а также в зонах защитных мероприятий.
Объект по УХО представляет собой сложный технологический комплекс, обеспечивающий уничтожение ТХ. В процессе уничтожения ТХ возможно несанкционированное высвобождение имеющихся на объекте факторов опасности. Субъекты, на которые действуют факторы опасности в случае проектных и запроектных аварий:
- производственный персонал объекта;
- основные производственные фонды объекта;
- окружающая среда.
Проектная авария – авария, масштабы и последствия которой учитываются при проектировании и создании объекта по УХО, рассчитываются и готовятся силы и средства, необходимые для ее локализации и ликвидации последствий. Запроектная авария – авария, масштабы и последствия которой можно только предполагать, готовность сил и средства для ликвидации последствий таких аварий на объекте может составлять часть от необходимого.
Распространение высвобождающегося при запроектной аварии ТХ зависит от состояния атмосферы. В условиях конвекции, когда почва нагрета сильнее воздуха, восходящие потоки вызывают быстрое «размывание» облака. Напротив, при инверсии (почва холоднее воздуха) наблюдаются наибольшие глубины распространения облаков. При слабом ветре облако зараженного воздуха затекает в лощины и обходит холмы, так как пары ТХ тяжелее воздуха и «стелются» по поверхности земли. Глубина распространен
ия значительно снижается при наличии лесного покрова (примерно в 1,5 раза) по сравнению с распространением над равнинной местностью. При инверсии глуби
на распространения облака увеличивается примерно в 1,7 раза по сравнению с изотермией, а при конвекции уменьшается, что является вполне естественным. Чем неустойчивее атмосфера, тем интенсивнее
идет переме
шивание воздуха и тем быстрее разбавляется в нем приме
сь ТХ, следовательно, тем меньше будет глубина распространения действующих концентраций ТХ в облаке, способных нане
сти ту или иную степень поражения.
При устойчивой атмосфере отсутствуют значительные верт
икальные перемешивания и движения, и температурный градиент атмосферы будет меньше, чем сухоадиабатический
вертикальный градиент. Температурный градиент атмосферы может отличаться от сухоадиабатического
в обе стороны и изменяться в широких пределах (до 20 °С/100 м) [7,8].
Одним из признаков инверсии является наличие нисходящих потоков
воздуха, и, следовательно, его сжатие и нагревание, как, например, в антициклонах. Этому сопутствуют по
вышение давления и установление ясной погоды. Состояние атмосферы в этом случае характеризуется как очень устойчивое. В зонах атмосферных фронтов температурная инверсия может создаться в результате натекания
теплого
воздуха на нижерасположенный
слой холодного. Другим типом инверсии яв
ляются
радиационные инверсии, образующиеся
ночью, после дневного прогрева земной поверхности. Ночью поверхность земли излучает тепло и быстро остывает. Одновременно остывает и прилегающий к ней слой воздуха – сверху он прикрывается более теплым инверсионным слоем. Радиационные инверсии создаются в том слое атмосферы, который содержит загрязнения, способствуя тому, что загрязняющие вещества не рассеиваются и надолго задерживаются в окружающем воздухе. Кроме того, они образуются как раз в то время, когда маловероятна очистка атмосферы осадками.
Вкачестве наиболеевероятныхпутейпоступления фосфорорганических ТХватмосферуможновыделить: высокотемпературныевыбросыватмосферу, которыемогутбытькратковременнымиилипродолжительными (взрывы, пожары); выливбольшихколичестввеществанаразличныеповерхностиспоследующимиспарением.
Масштабыпоследствийаварийзависятотразмероввозникшегоприавариях (разрушениях) ираспространяющегосяватмосфереоблаказараженноговоздуха.Так, результаты моделирования последствий пожара с вовлечением ФОВ свидетельствуют о поднятии перегретой примеси за счет действия архимедовой силы на большую высоту со значительной скоростью ветра и развитой турбулентностью. Это приводит к относительно быстрому формированию зоны заражения на значительном удалении от источника.
Расчеты зон заражения для разных вариантов возможных аварий с ФОВ на объекте 1205 в п. Марадыковский по методике [9 - 12] дали величины максимальной глубины зон заражения (токсодоз ОВ, равных или выше пороговых) от 0,9 до 3,8 км при авариях на объекте по УХО и от 1,3 до 17,7 км при более серьезных авариях (разлив 20 тонн зомана) на объекте по хранению ХО.
Расчет по методике [13] при значительно меньших количествах пролитого ОВ (2 т по сравнению с 20 т в примере выше) глубина распространения поражающих концентраций зарина достигает 40 км для пороговых концентраций или ~ 7 км для выводящих из строя концентраций ОВ. Для случая разлива зомана получены глубины распространения более 43 км и около 2,8 км, при которых возможно получение пороговых и выводящих из строя доз соответственно. Расчетная площадь очага поражения в этих случаях будет составлять: 770 км2
или 22 км2
для зарина и 944 км2
или 4,1 км2
для зомана.
Размеры зон защитных мероприятий (ЗЗМ) утверждены Постановлениями Правительства РФ [14] и, в частности, для п. Марадыковский Кировской области площадь ЗЗМ составляет 891,7 км2
.
Оценка возможного уровня токсического воздействия на население в случае реализации конкретного аварийного события осуществляется с использованием известных моделей распространения ОВ в различных природных средах [15-17]. В рамках этих моделей может быть проведен расчет размеров возможных зон для разных уровней вероятностей локального поражения. При прогнозировании последствий конкретной рассматриваемой аварийной ситуации в отличие от правил расчета локальных рисков не должны учитываться преимущественные направления ветров. Поскольку в момент аварии направление ветра может быть любым, а прогноз выполняется по наиболее тяжелым возможным последствиям, то и направление распространения зараженного первичного и вторичного облаков ОВ должны выбираться в сторону наиболее населенных территорий вблизи объекта. В качестве модельной аварии рассмотрим взрыв (например, установленной противотанковой мины) на складе, содержащем РБК-500, что привело к разрушению (пролому) крыши здания. При этой ситуации произошла детонация зарядов внутренних элементов в 100 изделиях РБК-500, в результате чего произошла разгерметизация корпусов РБК-500 и утечка из них 2370 кг вещества Vx в виде аэрозоля. Резкое увеличение давления внутри склада привело к выходу облака аэрозоля Vx через пролом в крыше склада в окружающую среду. Параметры модели взяты из работы [18]. В качестве условного направления распространения ОВ взято направление на северо-восток (юго-западный ветер), способное привести к наибольшему ущербу.
Расчетные оценки локального ущерба от чрезвычайной ситуации на объекте по УХО показывают, что при наиболее неблагоприятных метеоусловиях в зону смертельного поражения попадает целый ряд крупных населенных пунктов. В зависимости от направления ветра, это могут быть п. Мирный (расстояние 1-2 км, 5000 жителей), сёла Юрьево и Ленинская Искра Котельничского района (13 км), куст деревень вокруг с. Истобенск (8-16 км) и др. Зона, характеризующаяся высоким показателем локального ущерба (более 50%), при восточном ветре может достичь г. Котельнича, а при юго-западном ветре - г. Орлов (расстояние 24 км). В последнем случае при ингаляционном воздействии доля пораженного населения в кусте деревень в районе с. Истобенск будет достигать 100 % и свыше 50 % для г. Орлов.
Попадающий в зону воздействия выбросов г. Котельнич - районный центр Кировской области c населением около 28000 человек. Доля пораженного населения г. Котельнича при ингаляционном воздействии будет достигать 100% в восточной части города на расстоянии до 21км от источника.
Приведенные данные свидетельствуют о возможном обширном загрязнении территорий в районах хранения и УХО в случае запроектных аварий.
1.2 Трансформация фосфорорганических отравляющих веществ в
объектах окружающей среды
Под трансформацией токсичных химикатов в ОС понимают совокупность абиотических и биотических процессов, приводящих к образованию [19]:
- либо более токсичных продуктов, в том числе обладающих отдаленными эффектами или новыми свойствами;
- либо продуктов с более выраженными влиянием других критериев опасности;
- либо продуктов, токсичность которых близка к токсичности исходных химикатов;
- либо менее токсичных продуктов.
Основными компонентами объектов ОС, в которых возможно протекание химических реакций трансформации ФОВ под действием различных физико-химических факторов, являются почва, поверхностные и подземные воды, воздух, растительный и животный мир [20,21]. Загрязнение ОПС посредством распространения ОВ в атмосфере является сложным физико-химическим процессом, кинетика которого определяется следующими основными факторами:
- физико-химическими свойствами ОВ;
- типом источника поступления ОВ в ОС;
- процессами распространения ОВ в атмосфере, которые зависят от метеорологической ситуации в районе объекта хранения ОВ на момент аварии и физического состояния, в котором ОВ или продукты их фазовых и химических превращений присутствуют в атмосфере;
- процессами фазовых и химических превращений ОВ в атмосфере;
- процессами фазовых и химических превращений ОВ при их взаимодействии с почвой.
ТХ Vx, растворенный в воде, относительно стоек к гидролизу. Гидролиз протекает несколькими путями с образованием различных продуктов деструкции (рисунок 1).
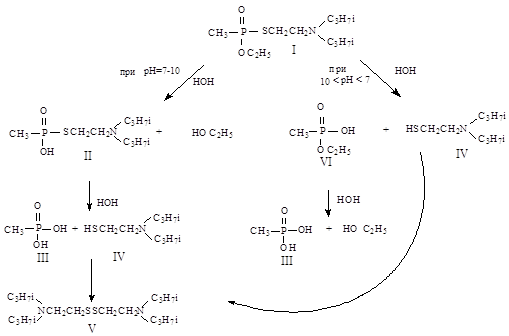
Рисунок 1 - Гидролиз Vx [22]
В нейтральной и слабощелочной среде происходит разрыв связи Р-О с образованием S-2-(N,N-диизопропиламино)этил тиоэфира МФК (II), который гидролизуется до МФК (III) и диизопропил-(2-меркаптоэтил)амина (IV). Данное соединение может быть окислено до бис-[2-(N,N-диизопропиламино)этил]дисульфида (V).
В кислой и щелочной среде вышеизложенный путь конкурирует с гидролизом по связи Р-S с образованием этилового эфира МФК (VI), который далее гидролизуется до МФК (III). При рН £ 7 и реальных зимних и летних температурах воды гидролиз Vx (таблица 1)может продолжаться длительное время [23], что совпадает с данными [22].
Таблица 1 – Зависимость скорости гидролиза Vx от величины рН при 25 °С
| Показатели |
Значения рН и τ50
|
| рН |
2-3 |
7 |
9,5 |
10 |
13 |
| τ50
, ч |
24000,0 |
8400,0 |
18,3 |
11,0 |
0,3 |
Однако, по данным [24] период полуразложения Vx при рН=7 при 25 °С составляет от 17 до 42 дней. Наряду с малотоксичными продуктами образуется около 10-20 % II, который не менее токсичен, чем исходный Vx, устойчив в ОПС и, к тому же, в отличие от вещества Vx, хорошо растворим в воде. Период полуразложения II составляет 57,3 часа. Следовательно, в случае серьезных аварий при попадании больших количеств Vx в водоемы в районе объекта по УХО вода и, в особенности, придонная часть водоемов будет заражена в течение длительного времени.
Гидролиз изомерного вещества типа Vx – О-изобутилового-S-[2-(N,N-диэтиламино)этил]тиолового эфира МФК- протекает аналогичным образом. В работе [25] изучен гидролиз этого вещества эквимольным количеством воды. На основании кинетических и спектральных данных установлено, что гидролиз вещества типа Vx с эквимольным количеством воды протекает преимущественно с разрывом связи P-S. Как показано в таблице 2, гидролиз на 99 % вещества типа Vx достигается за 144 ч. Основными продуктами реакции являются изобутиловый эфир МФК, диэтил-(2-меркаптоэтил)амин и бис-[2-(N,N-диэтиламино)этил]дисульфид [25].
Таблица 2 – Динамика изменения концентрации вещества типа Vxпри 40 °С (Со
=3,715 моль/л)
| Показатели |
Динамика изменения концентрации |
| Время, ч |
24 |
48 |
120 |
144 |
| Остаточное содержание вещества, моль/л |
3,075 |
2,137 |
0,187 |
0,075 |
Основными процессами, определяющими поведение ФОВ в почве, являются сорбция почвенными частицами, гидролиз, окислительно-восстановительные реакции и микробиологическая деструкция [26]. Типы почв, их свойства, присутствие почвенной влаги и микроорганизмов, по-видимому, могут оказывать влияние на скорость деструкции. Однако эти вопросы практически не изучены.
Период, в течение которого разлагается 50% Vx в почве (рН=5,3) составляет примерно 15 суток, и основным продуктом является VI [25]. Спустя день концентрация Vxс 0,2 мг/г уменьшилась на 22 % в песчаной почве и на 2 % - в суглинке и торфе. Только 0,1 % вещества оставалось в почве спустя 3 недели. VI достаточно стабилен, но в почве возможен его гидролиз до МФК. Период полураспада VI в почве составляет восемь суток. Приблизительно 40 % VI в почве гидролизуется в первый день и 60 % в течение последующих 12 дней.
Установлена константа скорости деструкции VI в воде и почве 2,4·10-10
ч-1
и 3,6·10-3
ч-1
(при температуре 25°С) соответственно. Данные таблицы 3 свидетельствуют о его высокой растворимости в воде и низкой летучести [25].
химический оружие микроорганизмы биодеструкция
Таблица 3 – Физические свойства продуктов деструкции Vx
| Соединение |
Растворимость в воде, мг/л |
lgKow
|
lgKoc
|
pKа
при 25 °С
|
Давление пара,
мм рт. ст.
|
| VI |
1,8·105
|
-1,15 |
0,75 |
2,00 |
3,6·10-4
|
| II |
неограниченно |
0,96 |
1,90 |
11,05 |
- |
| V |
9,5 |
3,48 |
3,28 |
- |
5,9·10-9
|
| III |
неограниченно |
-2,28 |
0,15 |
10,08 |
1,8 |
| IV |
1,2 |
-1,15 |
3,81 |
- |
2,7·10-7
|
Примечания:
1 lgKoc
- логарифм коэффициента распределения в системе «органический углерод-вода»;
2 lgKow
- логарифм коэффициента распределения в системе «октанол/вода»;
3 pKа
– десятичный логарифм константы диссоциации.
|
Другой продукт деструкции Vx - II стабилен в воде, но, как и вещество Vx, быстро разлагается в почве. II - белое твердое вещество при нормальных условиях, хорошо растворимое в воде, устойчивое к гидролизу при нейтральной и щелочной рН. В 0,1н растворе гидроксида натрия вещество остаётся в неизменном виде в течение 12 дней. lgKoc
=1,90 указывает на низкую возможность адсорбции почвой; Kow
указывает на небольшую возможность к биоаккумуляции.
МФК стабильна в ОПС, так как она стойка к гидролизу и термическому разложению. Это соединение было обнаружено спустя 10 лет после заражения сухой почвы на полигоне Дагуэй (США) [22,23, 25]. Скорость разложения МФК в ОПС определяется процессами биодеструкции и прочностью связи С-Р. Исходя из значения постоянной Генри, равной 1,22·10-11
атм·м3
/моль при 25°С, испарение кислоты из воды невозможно. В воде МФК может диссоциировать.
Скорость разложения зарина в атмосфере не установлена. Однако известно, что будут протекать реакции гидролиза, фотолиза и окисления. Зарин достаточно устойчив в атмосферном воздухе. Так, при относительной влажности воздуха 60-70% начальная концентрация зарина в течение 24 часов снижается в среднем на два порядка. Скорость гидролиза зарина в воде зависит от температуры, рН и состава воды. Гидролиз идет быстрее в кислой и щелочной среде. С повышением температуры на каждые 10°С скорость гидролиза в нейтральной среде увеличивается почти вдвое. Гидролиз зарина существенно зависит от рН. Так, по данным [25] при 20°С в обычной воде период полуразложения изменяется с 461 ч (рН=6,5) до 46 ч (рН=7,5). При 25°С период полуразложения уменьшается от 237 ч (рН=6,5) до 24 ч (рН=7,5). Период полуразложения, равный 8,3 часа при 0°С и рН=6,5, указывает на некоторую стойкость этого вещества при низких температурах. По данным [23] период полуразложения при 25°С и рН=7 составляет 54 часа.
Гидролиз зарина протекает в две стадии. На первой быстрой стадии образуется изопропиловый эфир МФК (VII). Вторая стадия идет медленнее с образованием МФК (III) и изопропанола (рисунок 2). Продукты гидролиза зарина малотоксичны.
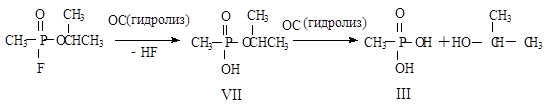
Рисунок 2 - Гидролиз зарина
Известно, что скорость трансформации зарина в почве обусловлена процессами гидролиза и микробиологической деструкции. По данным [25] более 90 % внесенного в почву зарина разлагается в течение 5 дней. Согласно [24] скорость разложения зарина в песке возрастает с увеличением влажности. Так, при 20°С и влажности песка 0,2 % разлагается 38 % вещества, а при влажности 5 - 50 % вещества.
Зарин более стоек при низких температурах. В статье [24] представлена информация о скорости разложения некоторых продуктов деструкции зарина. Зарин разлагается с образованием VII. Соединение VII достаточно устойчиво в ОПС. В результате гидролиза VII образуется МФК. Хорошая растворимость МФК в воде указывает на возможную миграцию МФК в грунтовые воды.
Зоман более устойчив к действию воды, чем зарин. Гидролиз зомана идет и в кислых, и в щелочных средах. Согласно [22] время 50 % -го гидролиза при 30 о
С и величинах рН, равных 2, 4 и 7, составляет 6,4; 250 и 41 час соответственно. Согласно [26] период полуразложения при 25 о
С и рН=6 составляет 60 часов. Время 50 % -го гидролиза при 20 о
С и рН=7 по данным [22] составляет 82,5 часа. Гидролиз протекает в две стадии. На первой стадии образуется пинаколиловый эфир МФК (VIII), который далее медленно гидролизуется до МФК. При рН>10 гидролиз VIII осуществляется за несколько минут с образованием III. В почве зоман также разлагается за счет реакции гидролиза до соединений VIII и III. Схема реакции гидролиза зомана представлена на рисунке 3:
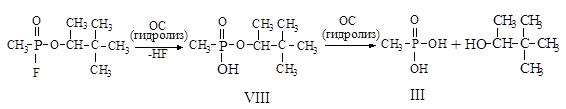
Рисунок 3 - Гидролиз зомана
Основные продукты трансформации ФОВ, появление которых возможно в ОС в процессе функционирования объекта по УХО, представлены в таблице 4.
Таблица 4 - Основные продукты трансформации ФОВ в ОС
ФОВ
|
Продукты трансформации ФОВ в ОС |
| атмосфера |
вода |
почва |
| Vx |
- |
II,III,IV,V,VI |
II,III,IV,V,VI |
| Зарин |
VII |
III, VII |
III, VII |
| Зоман |
- |
III,VIII |
III,VIII |
Следует отметить, что проблема трансформации ФОВ в объектах ОС исключительно сложна. Поэтому перечень продуктов трансформации ОВ, приведенный в таблице 4 на основании обобщения литературных данных, может корректироваться по мере обнаружения в ОС новых загрязняющих веществ и отработки методик их определения.
1.3 Самоочищение почв
Процессы перераспределения загрязнителей в почвах сопровождаются самоочищением экосистем, закономерности которого до конца еще не изучены. Познание этих процессов имеет весьма важное значение для их использования при разработке новых способов и технологий очистки загрязненных территорий, а также для выявления безопасных и предельно допустимых уровней (ПДУ) техногенных воздействий на ОС.
Под самоочищением ОС понимается совокупность самопроизвольных природных физических, геохимических и биологических процессов, происходящих в ее пределах и направленных на снижение в почвах, подземных и поверхностных водах и т.п. загрязнителей до уровней, безопасных для экосистем.
В основе процессов самоочищения, как известно [27], лежат процессы абиотического или биотического превращения химических веществ-загрязнителей:
- физические процессы массопереноса: разбавление (рассеивание, перемешивание), вынос загрязнителей за пределы экосистемы, испарение, сорбция;
- химическая трансформация: гидролиз, фотолиз, окисление и др.
- микробиологическая трансформация;
- бионакопление.
Особая роль в процессах самоочищения принадлежит автотрофныморганизмам. Весьма существенную роль в самоочищении ОС играют различные круговые и циклические процессы массо- и энергопереноса, включая глобальный круговорот воды, круговые процессы в биогеоценозах и т.п. Техногенное нарушение естественных круговых или циклических процессов в почвах и сопредельных средах приводит к нарушению функций «самоочищения».
К абиотическим превращениям загрязнителей в геологической среде относятся окислительные и восстановительные процессы, гидролиз, фотохимические реакции и т.п.
К биотическим превращениям относятся ферментативная детоксикация (например, тяжелых металлов), ферментативное окисление, разложение, восстановление и т.п. [28]. Органические токсиканты окончательно выводятся из ОС лишь в результате их минерализации, т.е. разложения до диоксида углерода, воды и других неорганических веществ (например, СО, НСl, NH3
и т.п.). Разные соединения обладают различной устойчивостью к минерализации.
Биологическая деструкция загрязнителей может вызываться различными организмами (энзимы, грибы, микроорганизмы и т.д.). При полной биологической деструкции образуются только вода, углекислый газ и появляются новые органические биотические образования. Однако чаще происходит неполная биологическая деструкция, при которой какой-либо вид организмов осуществляет лишь определенную стадию (ступень) процесса разложения. В итоге, для полного биологического разложения какого-либо загрязнителя на конечные продукты в большинстве случаев требуется совместная деятельность большого числа различных организмов, объединенных в данном биогеоценозе.
По этой же причине более богатые по видовому разнообразию биогеоценозы обладают большей устойчивостью к различным загрязнителям, большей способностью к самоочищению, чем бедные в видовом отношении биогеоценозы. В общем случае, чем сильнее молекулярное строение того или иного загрязнителя отклоняется от строения близких природных веществ, тем сложнее идет процесс его биологического разложения.
Процессы самоочищения в ОС ограниченны. Самоочищение может осуществляться лишь в определенных пределах загрязнения, не превышающих некоторых границ, уровень которых лимитируется механизмами указанных выше процессов самоочищения. Для каждого механизма, как и для каждого вещества-загрязнителя, существует свой ПДУ, превышение которого уже не позволяет системе самопроизвольно «справиться» с данным загрязнителем в конкретных геохимических условиях. Превышение этих уровней исключает самопроизвольное очищение системы. В этом случае система переходит уже в качественно иное состояние. Многообразие механизмов самоочищения в ОС, как и обилие различных веществ-загрязнителей, определяет чрезвычайную сложность этих процессов.
С термодинамической точки зрения, самоочищение ОС происходит вследствие стремления изолированной системы к равновесию (по всем термодинамическим потенциалам, включая и химические потенциалы компонентов-загрязнителей, которые (за исключением энтропии) в состоянии равновесия достигают минимальных значений). При этом энтропия такой системы возрастает в соответствии со вторым началом термодинамики. Хаотическое рассеивание загрязнителей, их разбавление, растворение и т.д. сопровождается возрастанием энтропии экосистемы и является самопроизвольным процессом. Этот процесс более вероятен, чем противоположный - самопроизвольное концентрирование, упорядочивание и локализация загрязнителей в каком-либо одном месте. Поэтому самоочищение ОС может осуществляться только за счет рассеивания загрязнителей или их деструкции.
С другой стороны, если считать, что любое техногенное загрязнение создает определенное возмущение в пределах экосистемы, нарушающее ее равновесие, то, согласно принципу Ле Шателье-Брауна, это воздействие вызывает в системе процессы, стремящиеся ослабить эффект данного воздействия. Самоочищение системы идет в соответствии с принципом Ле Шателье-Брауна, который позволяет определить направление смещения равновесия.
Допустимой считается такая нагрузка на экосистему, “под воздействием которой отклонение от нормального состояния системы не превышает естественных изменений и, следовательно, не вызывает нежелательных последствий у живых организмов и не ведет к ухудшению качества среды”. Практически идентичное определение дается А.П. Левичем для обозначения экологически допустимых уровней воздействия, которые “в отличие от предельно допустимых концентраций (ПДК) являются не потенциальными причинами экологического неблагополучия, а непосредственными его симптомами”. Допустимой считается любая нагрузка, не превышающая предельной (т.е. нормативной), которая, в свою очередь, равна критической нагрузке, умноженной на коэффициент запаса (в зависимости от степени "доверия" и потенциальной возможности кумулятивного действия этот коэффициент обычно варьируется от 0,2 до 0,5) [29].
К сожалению, как слишком часто случается в нашей жизни, написать закон или дать основополагающее определение оказывается значительно проще, чем разработать методику измерения частных показателей, закрепленных в законе. Например, кто может решиться хотя бы на, казалось бы, несложное определение, что такое “нормальное состояние экосистемы” и каков у нее “диапазон естественных изменений”? Поэтому, к настоящему времени известны лишь некоторые попытки обоснования "экологических ПДК" для растений суши и для сообществ водоемов рыбохозяйственного назначения.
Экологическое нормирование не является подменой санитарно-гигиеническому нормированию, а, в определенном смысле, дополняет его, ужесточая применяемые стандарты. Например, экологическая индикация может дать сведения о степени и характере загрязнения, распределении загрязнения в водоеме, возможном состоянии водной экосистемы в сезонном масштабе. Из этого следует, что вода, качество которой согласно экологическому контролю признано неудовлетворительным, вряд ли может использоваться для питьевых или хозяйственных целей, но экологически доброкачественная вода не всегда может быть признана пригодной с точки зрения здравоохранения. В последнем случае необходимы специфические микробиологические, токсикологические и химические тесты.
В мировой практике концепция критических нагрузок получила широкое развитие как необходимое руководство по рациональному ограничению антропогенных воздействий. На рабочем совещании ООН понятие “критическая нагрузка” было определено как “количественная оценка воздействия одного или нескольких загрязняющих веществ, ниже которой не происходит существенного вредного воздействия на специфические чувствительные элементы окружающей среды в соответствии с современными знаниями”. С учетом известных проблем кумуляции небольших воздействий и развитию хронических (отложенных) последствий величина критической нагрузки по В.Н. Башкину [28] может быть охарактеризована как “максимальное поступление загрязняющих веществ, которое не вызывает необратимых вредных изменений в структуре и функциях экосистем в течение длительного (50-100 лет) периода”.
Несмотря на глобальную аттрактивность концепции критических нагрузок, количественная оценка их величин до сих пор связана с целым рядом неопределенностей. Прежде всего это относится к самим основополагающим понятиям: например, до сих пор не вполне ясно, где обнаружить "специфические чувствительные элементы", что считать за "необратимые вредные изменения" (за 50-100 лет таковые могут произойти не только с природными компонентами, но и с самим человечеством) и, наконец, что есть “экологическая норма”.
Оценка критичности воздействий предполагает комплексное исследование изучаемого объекта и выявление двух основных интегральных составляющих в поведении экосистемы: фактора антропогенной нагрузки на окружающую среду и отклика, определяющего функциональную устойчивость, продуктивность и разнообразие биотических элементов:

Почва – биокосное тело природы. Располагаясь на границе соприкосновения литосферы, атмосферы и гидросферы, она формирует особую геосферу – педосферу, или почвенный покров Земли. Одновременно почва является одним из главных и сложных компонентов биосферы – области распространения жизни на Земле.
Любую почву можно рассматривать как гетерогенную, многофазную систему, состоящую из трех фаз: твердой, жидкой и газообразной. В твердой фазе преобладают минеральные образования (50…60 % от общего состава почвы), которые представлены первичными (кварц, полевые шпаты) и вторичными (глинистые минералы: каолинит, монтмориллонит, гидрослюды, смешанослойные минералы; минералы оксидов железа, алюминия, марганца, кремния; минералы – соли: доломит, сода, кальцит, магнезит, трона, гипс, ангидрит, мирабилит, галит, фосфаты, нитраты, сульфиды и др.) минералами. К этой же фазе относятся различные органические вещества (до 10 %), в том числе гумус или перегной, а также почвенные коллоиды, имеющие органическое, минеральное или органоминеральное происхождение.
Жидкую фазу почвы (почвенный раствор, 25…30 %) составляет вода с растворенными в ней органическими и минеральными соединениями, а также газами.
Газовую фазу почвы (15…25 %) составляет «почвенный воздух», включающий газы, заполняющие свободные от воды поры, а также газы, адсорбированные коллоидными частицами и растворенные в почвенном растворе.
Слоистая структура почвы возникает в результате взаимных перемещений в ней продуктов органического и неорганического происхождения. Почва состоит из нескольких горизонтов (слоев с одинаковыми признаками), возникающих в результате сложного взаимодействия материнских горных пород (подпочвы), климата, растительных и животных организмов (особенно бактерий), рельефа местности. Типичный почвенный профиль показан на рисунке 4.
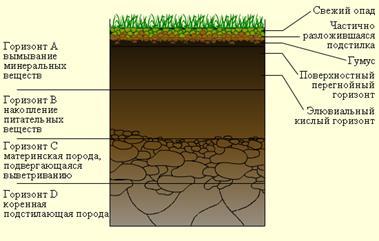
Рисунок 4 - Типичный почвенный профиль
Органическое вещество почв – это совокупность живой биомассы (эдафон), органических остатков растений, микроорганизмов и животных различной степени разложения, продуктов их метаболизма и гумуса. Наземные и внутренние почвенные организмы после своего отмирания в виде безжизненного органического вещества поступают в почву. В результате микробиологических и частично химических и физико-химических процессов это вещество подвергается сложным биохимическим преобразованиям.
Органические соединения, поступающие в почву в составе остатков растительных и животных организмов, либо разрушаются до простых неорганических соединений (углекислый газ, вода и др.), либо преобразуются в новые органические соединения. Комплекс новообразованных специфических почвенных органических соединений получил название почвенного перегноя, или гумуса. Таким образом, гумус – совокупность всех органических соединений, находящихся в почве, но не входящих в состав живых организмов или образований, сохраняющих анатомическое строение, не участвующих в построении тканей растительных и животных остатков. В состав гумуса входят гуминовые вещества, к которым относятся гуминовые кислоты, гумусовые кислоты, гиматомелановые кислоты, фульвокислоты, гумин, различного рода индивидуальные органические соединения биологического происхождения, а также техногенные органические соединения, попадающие в почву при внесении удобрений, пестицидов, обработке почвы и ее техногенном загрязнении (рисунок 5).
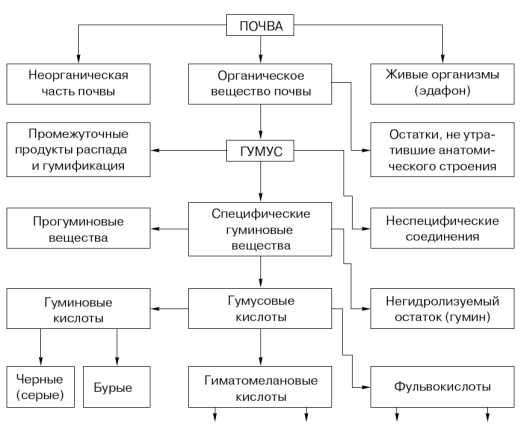
Рисунок 5 - Номенклатура (перечень) гуминовых веществ [30]
Неорганическая часть, органическое вещество и живые организмы принимают участие в процессах самоочищения почвы.
Классификацию почв по степени загрязнения проводят по ПДК химических веществ и их фоновому загрязнению [31]. По степени загрязнения почвы подразделяются на: сильнозагрязненные, среднезагрязненные, слабозагрязненные.
К сильнозагрязненным относят почвы, в которых содержание загрязняющих веществ в несколько раз превышает ПДК, имеющие низкую биологическую продуктивность, существенное изменение физико-химических, химических и биологических характеристик.
К среднезагрязненным относят почвы, в которых установлено превышение ПДК без существенных изменений в свойствах почв.
К слабозагрязненным относят почвы, в которых содержание химических веществ не превышает ПДК, но выше естественного фона.
Коэффициент концентрации загрязнения почвы НС
вычисляется по формуле:
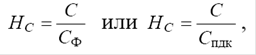
где С – общее содержание загрязняющих веществ;
Сф
– среднее фоновое содержание загрязняющих веществ;
Спдк
– предельно-допустимое содержание загрязняющих веществ.
Степень устойчивости почвы к химическим ЗВ оценивают по отношению к конкретному токсиканту или группе веществ, которыми загрязнена исследуемая почва. По степени устойчивости к химическим загрязняющим веществам и по характеру ответных реакций почвы подразделяют на: очень устойчивые; среднеустойчивые; малоустойчивые.
Степень устойчивости почвы к химическим загрязняющим веществам характеризуется следующими основными показателями: гумусного состояния почв, кислотно-основными свойствами; окислительно-восстановительными свойствами, катионно-обменными свойствами, биологической активности, уровня подземных вод, доли веществ в почве, находящихся в растворимой форме.
1.4 Микроорганизмы-деструкторы фосфорорганических соединений
Способность микроорганизмов использовать фосфорорганические соединения с С–Р связью в качестве единственного источника фосфора известна сравнительно давно [32]. Впервые доказательство биологического расщепления С–Р связи было получено на примере E. coli, которая в качестве единственного источника фосфора использовала метилфосфоновую или этилфосфоновую кислоты.
Анализ опубликованных к настоящему времени работ свидетельствует о наличии в природе широкого круга микроорганизмов – деструкторов фосфонатов, среди которых грам-положительные и грам-отрицательные бактерии, а также некоторые дрожжи и грибы [33-36]. Однако предполагается, что разлагать фосфонаты способны, скорее, только особые штаммы, но не определенные группы микроорганизмов [37]. Попытка проверить это была предпринята в ряде исследований [33]. Так, из пяти почвенных изолятов были выделены бактерии, способные деградировать широкую группу структурно различных фосфонатов. Прежде всего, это различные штаммы Pseudomonas и Bacillusmegaterium, разлагающие 14 из 15 исследованных субстратов, что сопоставимо с широкой субстратной специфичностью, выявленной ранее для Agrobacteriumradiobacter. В этой работе впервые было показано, что грам-положительные бактерии могут осуществлять прямое разложение связи С–Р. Способность расти на различных природных и ксенобиотических фосфонатах, как единственных источниках фосфора была проанализирована так же у микроорганизмов из семи экосистем и у 19 лабораторных микроорганизмов. Это исследование показало присутствие деструкторов фосфонатов среди различных бактериальных видов и систематических групп, выделенных как из загрязненных, так и из незагрязненных фосфонатами источников окружающей среды. Это свидетельствует о более широком их распространении, чем предполагалось ранее [34]. Было подтверждено отсутствие способности к деградации фосфонатов эукариотическими организмами. Впервые обнаружена такая способность у фотосинтетического организма Rhodobactercapsulatus. Недавно были выявлены галофильные бактерии Chromohalobactermarismortui, которые способны использовать для роста в качестве единственного источника фосфора фосфоноацетат, 2-аминоэтил-, 3-аминобутил-, метил- и этил- фосфонаты. При этом наблюдались различия в росте клеток на разных фосфонатах и их различная утилизация в зависимости от концентрации NaCl, что, возможно, является результатом использования клетками для этой цели различных транспортных систем. Термофильные бактерии GeobacilluscaldoxylosilyticusT20 способны также использовать некоторые фосфонаты в качестве единственного источника фосфора для роста при 600
С. Некоторые штаммы Streptomycetesспособны использовать в качестве единственного источника фосфора самые различные по структуре фосфонаты. Штамм StreptomycesmorookaensisDSM 40565 способен расщеплять 2-амино-4-фосфонобутират в качестве источника азота и фосфора способом, подобным стереоселективному. Эти результаты позволяют предположить наличие нового метаболического пути для расщепления С–Р связи.
Только микроорганизмы, разлагающие алкилфосфонаты с образованием алканов, можно с уверенностью отнести к микроорганизмам, содержащим С–Р лиазу, хотя их субстратная специфичность может и не ограничиваться алкилфосфонатами. Некоторые из указанных микроорганизмов способны разлагать и другие фосфонаты, в том числе глифосат и 2-АЕР (таблица 5).
Большинство бактерий, для которых точно установлено разложение фосфонатов по С–Р лиазному механизму, относится к грам-отрицательным бактериям, однако, известны и два представителя грам-положительных бактерий: Arthrobactersp. GLP-1 и B. megaterium. Среди почти сорока идентифицированных почвенных изолятов и коллекционных штаммов бактерий, проверенных на С–Р лиазную активность, только вышеупомянутые грам-положительные бактерии обладали ею. У других исследованных грам-положительных бактерий С–Р лиазную активность обнаружить не удалось. Еще одним представителем бактерий, разлагающим фосфонаты по С–Р лиазному механизму, является Rhodobactercapsulatus, фототрофная грам-отрицательная бактерия, способная разрушать С–Р связь при анаэробных условиях на свету. Поиск С–Р лиазной активности среди представителей грибов (Cladosporiumherbarum, Fusariumculmorum и Trichodermaviride /33/ не дал положительных результатов.
Таблица 5 - Микроорганизмы, разлагающие фосфонаты по С-Р лиазному механизму
| Микроорганизм |
Утилизируемый фосфонат |
| Pn |
2-AEP |
Ф-P |
глифосат |
| Agrobacterium radiobacter |
+ |
+ |
+ |
+ |
| Kluyvera ascorbata |
+ |
+ |
+ |
- |
| Kluyvera cryorescens |
+ |
+ |
+ |
- |
| Klebsiella oxytoca |
+ |
+ |
+ |
- |
| Klebsiella pneumoniae |
+ |
+ |
+ |
- |
| Bacillus megaterium 2BLW |
+ |
+ |
+ |
+ |
| Arthrobacter sp.GLP-1 |
+ |
+ |
+ |
+ |
| Rhizobium sp. |
+ |
+ |
+ |
- |
| Pseudomonas testosteroni DSM 1622 |
+ |
+ |
- |
- |
| Pseudomonas sp. 7NSK2 |
+ |
+ |
+ |
- |
| Pseudomonas sp. PG2982 |
+ |
+ |
+ |
+ |
| Escherichia coli DSM1576 |
+ |
+ |
- |
- |
| Alcaligenes eutrophus |
+ |
+ |
+ |
+ |
| Rhodobacter capsulatus |
+ |
+ |
+ |
- |
| Klebsiella aerogenes |
+ |
+ |
+ |
- |
| Enterobacteraerogenes |
+ |
+ |
+ |
слабо |
Таким образом, способность разлагать фосфонаты по С–Р лиазному механизму встречается среди грам-отрицательных бактерий гораздо чаще, чем среди грам-положительных бактерий. Это отдельные представители классов Arthrobacteriaceae, Bacillaceae, Rhodobacteriaceae, Alcaligenaceae,Pseudomonadaceae, Enterobacteriaceae (Escherichia, Enterobacter, Klebsiella, Kluyvera) и Rhizobiaceae (Rhizobium, Agrobacterium).
Наряду с вышеупомянутой классификацией бактерий, способных разлагать фосфонаты по С–Р лиазному пути, делящей все бактерии на грам-положительные и грам-отрицательные, имеет место и другая классификация. Согласно ей бактерии, способные расщеплять С–Р связь с помощью С–Р лиазы делят на три класса [38]. Первый класс бактерий представляет собой Escherichiacoli, способная разлагать алкил- и фенилфосфоновую кислоты, но не глифосат. Второй класс бактерий представляет Enterobacteraerogenes, способная эффективно разлагать алкил- и фенилфосфоновую кислоты, однако глифосат разлагает слабо. Третий класс бактерий представляет собой Pseudomonas-подобные организмы, способные разлагать алкил- и фенилфосфоновую кислоты и глифосат одинаково эффективно. Однако С–Р лиазную активность внеклеточных экстрактов как у Escherichiacoli так и у Pseudomonassp. PG2982 тестировать не удалось [39, 40].
2. Основная часть
2.1 Методика отбора штаммов микроорганизмов, способных
растворять фосфорорганические соединения
Отбор штаммов проводили по методике, представленной в [41].
Музейную культуру, хранящуюся в холодильнике при t 4-80
С на агаризованной среде, наносят на твердую минеральную среду с добавлением раствора глюкозы и метилфосфонатов кальция, железа и алюминия и выращивают посевной материал в течение 3-4 суток при t 28-290
С. Затем по образующимся ореолам прозрачности вокруг нанесенной культуры отбирают штаммы микроорганизмов, способные улучшать растворимость метилфосфонатов.
Состав питательной среды:
В состав среды входят следующие соли (г/л): NH4
Cl – 10,0; MgSO4
x7H2
O – 2,0; NaCl – 1,0; агар – 20г; трис(гидроксиметил)аминометан – 1,0.
Источник углерода – 40 % раствор глюкозы из расчета 1мл/л.
20 мл питательной среды переносят в пробирку и добавляют метилфосфонаты в виде взвеси концентрацией 1 г/мл.
2.2 Методика культивирования микроорганизмов
Используют стандартную методику культивирования с использованием органофосфонатов в качестве источников фосфора.
Для культивирования микроорганизмов используют среду MS1.
В состав минеральной части среды входят следующие соли (г/л): NH4
Cl – 2,0; MgSO4
x7H2
O – 0,2; K2
SO4
– 0,5 и микроэлементы (мг/л): FeSO4
x7H2
O – 2,5; CaCl2
x6H2
O – 10,0; CuSO4
x5H2
O – 2,0; H3
BO3
– 0,06; ZnSO4
x7H2
O – 20,0; MnSO4
xH2
O – 1,0; NiCl2
x6H2
O – 0,05; Na2
MoO4
x2H2
O – 0,3.
Источник углерода – глутамат Na 10 г/л.
Источник фосфора – МФК или метилфосфонаты в концентрации 0,3 г/л. Кислые эфиры – в концентрации 0,2 г/л.
Для приготовления минеральной среды MS1 по 10 мл стоковых растворов 1-5 последовательно вносят в 0,5 л дистиллированной воды, тщательно перемешивая после добавления каждого из них, доводят рН до 6,5 20% NaOH и добавляли дистллированную воду до 1 л. Среду разливают по 100 мл в колбы для культивирования и стерилизуют автоклавированием при 0,5 атм 30 мин. В стерильную среду перед засевом бактерий вносят 70 мл стерильного стокового раствора 1М глутамата Na, 300 мл МФК на 1 литр среды. Начальное значение рН среды должно составлять 7.0-7.5.
Для приготовления твердой среды MS1 добавляют к вышеописанной жидкой среде агар-агар 18 г/л, стерилизуют в подобных условиях. Глутамат и МФК вносят после расплавления среды перед разливом в чашки Петри.
Музейную культуру, хранящуюся в холодильнике при t 4-80
С на агаризованной среде MS1 с МФК, штрихом пересевают на твердую минеральную среду MS1 с теми же источниками фосфора и выращивают посевной материал в течение 2-3 суток при t 28-290
С.
Состав стоковых растворов:
Стоковый раствор 1. Растворить последовательно в 0,7л дистиллированной воды следующие навески (г): NH4
Cl – 200.0, MgSO4
x7H2
O – 20.0, CaCl2
x6H2
O – 1.0, довести объем до 1 л дистиллированной водой.
Стоковый раствор 2. Растворить в 0,5 л дистиллированной воды навеску (г): K2
SO4
– 50.0. Довести объем до 1 л дистиллированной водой.
Стоковый раствор 3. Растворить в 0,5 л дистиллированной воды навеску (г): FeSO4
x7H2
O – 0,25. Довести рН до 4.0 20% H2
SO4
. Довести объем до 1 л дистиллированной водой.
Стоковый раствор 4. Растворить последовательно в 0,5 л дистиллированной воды навески (г): CuSO4
x5H2
O – 0,2; ZnSO4
x7H2
O – 2,0; MnSO4
xH2
O – 0,1; NiCl2
x6H2
O – 0,005. Довести объем до 1 л дистиллированной водой.
Стоковый раствор 5. Растворить последовательно в 0,5 л дистиллированной воды навески (г): H3
BO3
– 0,006; Na2
MoO4
x2H2
O – 0,03. Довести объем до 1 л дистиллированной водой.
2.3 Методика проведения эксперимента по изучению возможности
деструкции метилфосфоновой кислоты и её эфиров
На поверхность чашки наносили 30-40 мл стерильной минеральной среды MS1 без источника углерода и фосфора, суспендируют клетки, собирают суспензию стерильной пипеткой и переносят в стерильную колбу. Туда же добавляют 7 мл стерильного стокового раствора 1М глутамата Na и инкубируют на качалке в течение 1-2 суток для получения клеток голодных по фосфору. Изменение значения рН в суспензии контролируют путем нанесения капли жидкости на полоску универсальной индикаторной бумаги. Это значение поддерживают на уровне 7.0 - 8.0 добавлением 20 % H2
SO4
.
Культивирование бактерий проводят в 750 мл колбах на качалке со 180-200 об/мин при t 28-290
С. Засев среды производят суспензией голодных по фосфору с исходной оптической плотностью 0,1-0,15 ед. Для этого определить исходную оптическую плотность суспензии бактерий и провести необходимое разбавление до плотности 0,1-0,15 ед. В колбы, содержащие 100 мл жидкой среды MS1 добавляют 7 мл стерильного стокового раствора 1М глутамата Na и МФК или метилфосфонатов кальция, железа и алюминия из расчета 0,3 г на 1 л смеси. Изопропилового, изобутилового и пинаколилового эфиров из расчета 0,2 г на 1 л смеси.
Отбор проб для анализов проводят через 12 часов с обязательным контролем значения рН культуральной жидкости. Поддержание оптимального для роста значения рН 7.0-8.0 осуществляют путем внесения 20% стерильного раствора H2
SO4
, либо 20% стерильного раствора NaОН.
Каждый опыт проводят минимум два раза, в опыте берут количество колб для культивирования также минимум в двух повторностях.
2.4 Методика контроля роста микроорганизмов
Рост культуры контролируют:
а) по изменению оптической плотности при длине волны 560 нм (ОП560
) в кювете 1 см. на спектрофотометре. Пересчет оптической плотности на вес сухой биомассы проводили согласно коэффициенту 0,5 (г сухих клеток/ед оптической плотности), полученному экспериментально для бактериальных культур, выделенных из почвы.
б) по числу колониеобразующих единиц (КОЕ) путем высева из разведений на агаризованную среду LB. Последовательно культуральную жидкость разводят до необходимого разведения (10-6
-10-8
клеток/мл). Для разведения использовали стерильный физ. раствор. Из пробирки с необходимым разведением берут 100 мкл культуральной жидкости, которую наносят на агаризованную среду LB и тщательно растирают шпателем. Чашки помещают в термальную комнату (t 28-290
С) на 2-3 суток. Затем подсчитывали количество колоний.
Состав среды LB: дистиллированная вода -1 литр, бакто-пептон – 10 г, дрожжевой экстракт – 5 г, NaCl –5 г, агар-агар – 18г, рН 7.0. Стерилизация: автоклавирование при 0,5 атм, 30 минут.
Для расчета скорости роста строят кривую роста, выраженную в логарифмах. По кривой роста определяли длину лаг-фазы и логарифмическую фазу роста.
Удельную скорость роста рассчитывают по формуле:
m = (ln ОП2
- ln ОП1
)/(t2
– t1
) час-1
Экономический коэффициент мг органофосфонатов/г биомассы рассчитывают по формуле:
Q = D/(A/2),
где Q - экономический коэффициент, мг органофосфонатов/г биомассы;
А - оптическая плотность в стационаре;
D - количество метаболизируемой МФК.
2.5 Методика определения концентрации соединений с С-Р связью
Метод определения фосфат-иона основан на образовании окрашенного комплексного соединения между фосфором, молибдатом аммония и малахитовым зеленым в сильно кислой среде. Количество фосфора рассчитывают по результатам измерения поглощения образующегося комплексного соединения при длине волны 645 нм на фотоколориметре.
Содержание соединений с С-Р связью определяют по разнице между количеством общего и неорганического фосфора. Концентрацию фосфора общего определяют на спектрофотометре по образованию комплекса фосфомолибдата с малахитовым зеленым при низких значениях рН после гидролиза с персульфатом аммония, в ходе которого происходит разрыв С-Р связи и высвобождение фосфат-иона. Соотношение предварительно разведенной культуральной жидкости и персульфата аммония было 1:1.
Пробы культуральной жидкости отбирали в эппендорфы для анализа, центрифугировали 10 тыс. об./мин - 2 мин, супернатант хранили в замороженном виде для разрыва С-Р связи ГФ в стеклянных пробирках проводили гидролиз проб с персульфатом аммония. Для приготовления раствора персульфата 8 г персульфата аммония растворяли в 20 мл дистиллированной Н2
О. Смешивали пробу и раствор персульфата аммония в соотношении 1:1 в стеклянных пробирках, которые закрывали фольгой и закрепляли ее резиновыми кольцами. Гидролиз проводили в течение 60 мин. при 900
C на водяной бане.
Вносили в эппендорфы компоненты реакции в соотношении: 130 мкл 1н H2
SO4-
,130 мкл пробы, 1300 мкл раствора С. Смесь тщательно перемешивали. Через 10-15 минут измеряли ОП при длине волны 645 нм (ОП645
) в кювете 1 см, в линейной области значений ОП от 0,2 до 0,5. В качестве контроля использовали образец культуральной жидкости без добавления персульфата аммония.
Приготовление растворов:
Раствор А: 90 мг малахитового зеленого растворяли в 200 мл дистилированной воды при перемешивании в течение 30 мин. на магнитной мешалке;
Раствор В: 8,4 г молибдата аммония растворяли в 60 мл HСl конц в течение 20 мин. при перемешивании стеклянной палочкой; после растворения молибдата аммония в HCl конц. добавляли полученный раствор к 138 мл дистиллированной Н2
О.
Раствор С: смешивали по 200 мл растворов А и В, перемешивали в пластиковой емкости на магнитной мешалке в течение 30 мин., фильтровали полученный раствор С через плотный бумажный фильтр в пластиковую посуду. Раствор С использовали для анализа. Хранили в холодильнике, в течение надели. Перед каждым употреблением фильтровали через бумажный фильтр.
3. Обсуждение результатов
3.1 Отбор штаммов микроорганизмов-деструкторов
фосфорорганических соединений
Для скрининга использовали коллекцию штаммов Pseudomonas и Alcaligenes лаборатории института биохимии и физиологии растений и микроорганизмов РАН. В качестве субстрата использовали МФК.
Образование зон «просветления» на среде, содержащей МФК, представлено на рисунке 6.
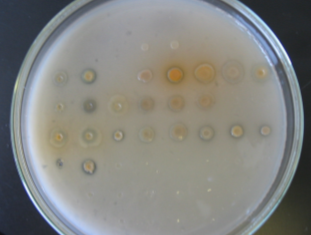
Рисунок 6 – Образование зон «просветления» различными штаммами
1 – KR31; 2 – Sm12; 3 – Km12; 4 – 2-79; 5 – Pf-5; 6 – Q2
– 87; 7 – CHAQ1;
8 – Sm11; 9 – UC 5; 10 – PCLB 91; 11 – 38а; 12 – 53a; 13 – 54; 14 – 1217;
15 – 7Н; 16 – 90Н; 17 – 70А; 18 – IG1; 19 – OV17; 20 – 1С7; 21 – IIД 5;
22 – VB1; 23 –OV9; 24 – 29; 25 – 19; 26 – 25р; 27 – AS15.
Как видно из рисунка 6, наибольшей способностью к усилению растворения МФК обладают штаммы 2-79, Pf-5, P54, 1C7, относящиеся к роду Pseudomonasfluorescens. Наилучшая способность к растворению метилфосфонатов отмечается у штамма Sm11 , относящегося к роду Alcaligenessp.
Таким образом, биодоступность МФК можно достичь внесением в почву штамма Sm11 бактерий рода Alcaligenessp. Поэтому для изучения эффективности биодеструкции фосфорорганических соединений выбран именно этот штамм.
3.2 Биодеструкция метилфосфоновой кислоты и её кислых эфиров
Из литературных данных известно, что неорганический фосфат ингибирует потребление органофосфонатов в качестве источника фосфора разложение МФК [33-35]. При выращивании посевного материала на агаризованной среде, по-видимому, возможна экстракция из агара и накопление в клетках более доступных, чем МФК, источников фосфора, которые могут попадать в экспериментальную среду вместе с посевным материалом. Более доступный фосфор может находиться на поверхности агара, образуясь в процессе жизнедеятельности культуры из МФК при наращивании биомассы. Поэтому, к тому времени, как биомасса на агаризованной среде нарастет до необходимого уровня, в клетках посевного материала могут быть запасные источники фосфора, за счет которых культура будет расти в среде с МФК, не разлагая его. Чтобы исключить все эти факторы необходимо иметь клетки посевного материала, голодные по фосфору. Для решения этой проблемы необходимо суспензию клеток, используемую в качестве посевного материала, инкубировать в среде с глутаматом (источником углерода), но без источника фосфора в течение трех суток. В это время можно считать клетки голодными по фосфору.
Подготовленный посевной материал использовали для засева опытных колб с концентрацией МФК (метилфосфонатов) 0,3 г/л. Рост культур контролировали по изменению оптической плотности и контролировали изменение содержания органического фосфора и значение рН. По данным измерений оптической плотности и концентрации загрязнителя строили кривые роста культур и потребления источника фосфора (рисунок 7 и 8).
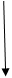
| оптическая плотность, отн.ед. |
|
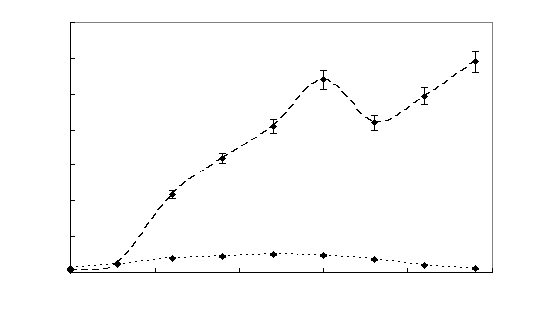  Рисунок 7 – Динамика роста штамма Sm11 в среде, содержащей МФК Рисунок 7 – Динамика роста штамма Sm11 в среде, содержащей МФК
 Рисунок 8 – Изменение концентрации МФК
В рассматриваемых системах различают следующие фазы размножения:
лаг-фаза – период между засевом и началом размножения;
экспоненциальная фаза – период размножения микроорганизмов с постоянной скоростью;
фаза гибели – период, в течение которого популяция погибает.
Как видно из рисунка 7, рост культуры на среде, содержащей МФК, начинался после непродолжительной лаг-фазы – не более 10 часов, затем наблюдался значительный рост микроорганизмов. Концентрация МФК уменьшается в 2 раза в течение 40 -45 часов (рисунок 8). После 58 – 62 часов рост культуры и потребление МФК прекращалось, что обусловлено недостатком в питательной среде источника углерода. При добавлении глутамата натрия рост клеток возобновлялся, и наблюдалось дальнейшее уменьшение концентрации МФК.
Для оценки возможности биодеструкции изопропилового, изобутилового и пинаколилового эфиров использовали отобранный ранее штамм Sm11 рода Alcaligenessp.
Начальная концентрация кислого эфира составляла 0,2 г/л. Рост культур контролировали по изменению оптической плотности. По данным измерений оптической плотности и концентрации загрязнителя строили кривые роста культур и потребления кислых эфиров.
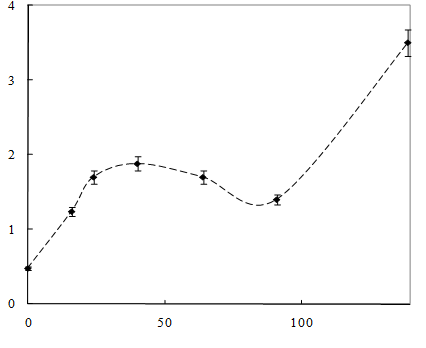
Динамика роста культуры и потребления изопропилового эфира представлена на рисунке 9 и 10.
 
| оптическая плотность, отн.ед. |
|
Рисунок 9 – Динамика роста штамма Sm11 в среде, содержащей изопропиловый эфир МФК
  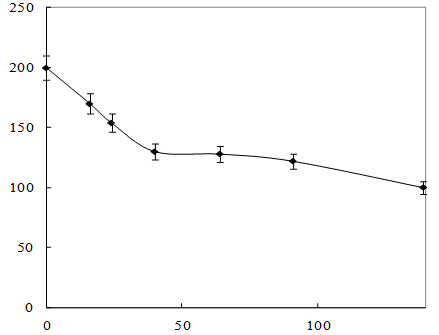 Рисунок 10 – Изменение концентрации изопропилового эфира МФК
Как видно из рисунка 9, рост культуры на среде, содержащей изопропиловый эфир, начинался практически без лаг-фазы, сразу наблюдался значительный рост микроорганизмов. При этом наблюдается уменьшение концентрации изопропилового эфира в 1,6 раза в течение 42 часов (рисунок 10). После 40-50 часов рост культуры прекращался, что обусловлено недостатком в питательной среде источника углерода. При добавлении глутамата натрия рост культуры возобновлялся.
Аналогичная тенденция выявлена и для изобутилового эфира (рисунок 11 и 12).
| оптическая плотность, отн.ед. |
|
  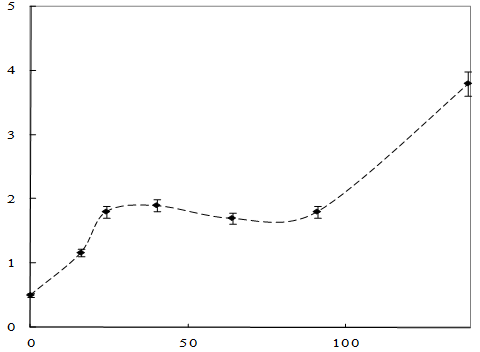 Рисунок 11 – Динамика роста штамма Sm11 в среде, содержащей изобутиловый эфир МФК
Как видно из рисунка 11, рост культуры среде, содержащей изобутиловый эфир МФК, начинается практически сразу, без лаг-фазы. После 80 часов рост штамма Sm11 прекращается, что обусловлено отсутствием в среде источника углерода. Затем рост культуры возобновляется. Изменение концентрации изобутилового эфира представлено на рисунке 12.


Рисунок 12 – Изменение концентрации изобутилового эфира МФК
Как показано на рисунке 12, концентрация изобутилового эфира МФК уменьшается в 1,7 раза в течение 70 – 90 часов.
Рост штамма Sm11 рода Alcaligenessp в среде, содержащей пинаколиловый эфир, и уменьшение концентрации загрязнителя представлены на рисунках 13 и 14 соответственно.
| оптическая плотность, отн.ед. |
|
 
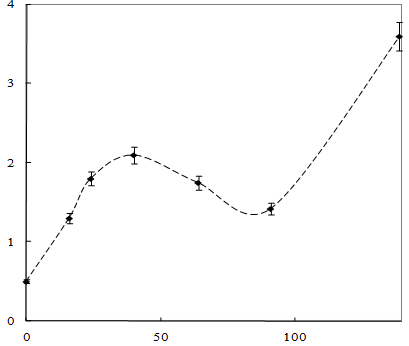 Рисунок 13 – Динамика роста штамма Sm11 бактерий рода Alcaligenessp


·


Рисунок 14 – Изменение концентрации пинаколилового эфира МФК
Как показано на рисунках 13 и 14, рост культуры на питательной среде, содержащей пинаколиловый эфир МФК, также характеризуется непродолжительной лаг-фазой, однако биодеструкция эфира происходит интенсивнее: концентрация пинаколилового эфира МФК уменьшается в 1,7 раза в течение 50 – 70 часов.
На основании полученных данных определяли вес сухой биомассы, удельная скорость роста, экономический коэффициент. Результаты представлены в таблице 6.
Таблица 6 – Основные параметры роста культуры в присутствии метилфосфоновой кислоты и ее кислых эфиров
| Параметр |
МФК |
изопропило-вый эфир |
изобутило-
вый эфир
|
пинаколило-вый эфир |
| Биомасса, г/л |
2,7 |
0,9 |
0,95 |
1,05 |
| Максимальная скорость роста, ч-1
|
0,16 |
0,05 |
0,04 |
0,05 |
| Количество метаболизируемого загрязнителя, мг |
лаг-фаза |
25 |
46 |
28 |
20 |
| весь период |
168 |
100 |
102 |
105 |
Экономический
коэффициент,
мг загрязнителя / г биомассы
|
лаг-фаза |
200 |
60,5 |
42,4 |
25,0 |
| весь период |
62 |
55,5 |
53,7 |
50,0 |
Как видно из таблицы 6, в присутствии кислых эфиров культура Sm11 характеризуется невысокой скоростью роста 0,04 – 0,06 ч-1
. Причем рост культуры начинается практически сразу, без лаг-фазы. Рост биомассы прекращался спустя 40-50 часов вследствие полного потребления источника углерода. Об этом свидетельствует тот факт, что после добавочного внесения глутамата натрия рост возобновлялся Для культуры Sm11 отмечается и высокая величина потребления метилфосфонатов в расчете на единицу биомассы. Следует отметить, что экономический коэффициент культуры в лаг-фазе и за весь период отличается незначительно: для изопропилового эфира составляет 60,5 и 55,5 мг загрязнителя/г биомассы соответственно. Однако для пинаколилового эфира данный показатель отличается в два раза и составляет
25,5 и 50,0 мг загрязнителя/г биомассы соответственно. Характерным отличием роста культуры на среде, содержащий пинаколиловый эфир, является более продолжительная лаг-фаза, на протяжении которой метабилизируется меньшее количество эфира – 20 мг по сравнению с 46 мг изопропилового эфира, однако количество поглощенного пинаколилового эфира за весь период выше - 105 мг.
По результатам количественной оценки культур – накоплению биомассы, удельной скорости роста и эффективности разложения соединений с С-Р связью был отобран наиболее активный штамм Sm11 рода Alcaligenessp.
3.3 Пути метаболизма органофосфонатов
Процессы биодеструкции любых соединений не могут быть оценены без изучения путей метаболизма и механизма их регуляции. Применительно к нашей работе проводится сравнительное изучение механизмов деструкции соединений с С-Р связью.
Штаммы-деструкторы МФК осуществляют расщепление С-Р связи посредством ферментной системы с участием С-Р лиазы, доказательством чему служит обнаружение метана в газовой фазе при культивировании в среде с МФК в количествах, эквимолярных потребленному источнику фосфора:
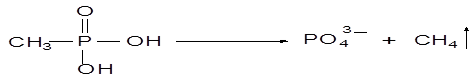
Глифосат метаболизируется через аминометилфосфоновую кислоту (АМФК). Об этом свидетельствует идентификация глиоксилата как продукта расщепления ГФ посредством глифосат-оксидоредуктазы. При реализации этого пути фосфат-ион отщепляется на последующих стадиях при участии фосфонатазы.

МФК и другие фосфонаты выступают в роли прекурсоров фосфат-иона в процессах биодеградации фосфорорганических соединений с участием широкого спектра природных микроорганизмов, находящихся в условиях фосфорного голодания.
Выводы
1 Проведен анализ литературных данных о существующих технологиях реабилитации загрязненных почв. Показано, что биологические методы санации территорий, загрязненных продуктами деструкции фосфорорганических отравляющих веществ, наиболее экологически безопасны, эффективны, экономичны и выгодно отличаются отсутствием вторичных отходов.
2 Проведен скрининг микроорганизмов-деструкторов фосфорорганических соединений. Наилучшая способность к растворению метилфосфонатов отмечается у штамма Sm11, относящегося к роду Alcaligenessp.
3 Изучена возможность биодеструкции продуктов разложения фосфорорганических отравляющих веществ: метилфосфоновой кислоты и её изопропилового, изобутилового, пинаколилового эфиров. Установлено, что штамм Sm11 рода Alcaligenessp является активным деструктором метилфосфоновой кислоты и её кислых эфиров: наблюдается уменьшение концентрации метилфосфоновой кислоты в 2 - 2,2 раза в течение 40 -45 часов, кислых эфиров – в 1,6 - 1,7 раза в течение 50 - 70 часов. Показано, что культура характеризуется высокой удельной скоростью роста 0,04 - 0,05 ч-1
как в присутствии метилфосфоновой кислоты, так и кислых эфиров.
Список использованных источников
1. Конвенция о запрещении разработки, производства, накопления и применения химического оружия и о его уничтожении. ООН, Женева, 1993. - 170 с.
2. Федеральный закон РФ № 76-ФЗ от 2 мая 1997 г. (с изменениями от 29 ноября 2001 г., 10 января 2003 г.) «Об уничтожении химического оружия».
3. Федеральный закон РФ № 136-ФЗ от 7 ноября 2000 г. «О социальной защите граждан, занятых на работах с химическим оружием».
4. Федеральная целевая программа «Уничтожение запасов химического оружия в Российской Федерации». Постановление Правительства РФ от № 969 от 29 декабря 2007 г. – М., 2008. – 28 с.
5.Холстов В.И., Тарасевич Ю.В., Григорьев С.Г. Пути решения проблемы безопасности объектов по уничтожению химического оружия // Ж. росс. хим. об-ва им. Д.И. Менделеева. - 1995. - Т.39. - №4. – С. 65-73.
6. Скоробогатова В.И., Щербаков А.А., Мандыч В.Г. Санация загрязненных территорий в районах хранения и уничтожения химического оружия. - Российский химический журнал им. Д.Менделеева. – 2007. – том LI – выпуск 2. – С.71-74.
7. Маршалл В. Основные опасности химических производств. – М.: Мир, 1989. – 672 с.
8. Горский В.Г., Моткин Г.А., Петрунин В.А. и др. Научно-методические аспекты анализа аварийного риска. – М.: Экономика и информатика, 2002. – 260 с.
9. Организация и осуществление санитарно-эпидемиологического надзора на объектах по уничтожению фосфорорганических отравляющих веществ: Методические указания (временные)// Сборник инструктивно-методических документов по проблеме уничтожения химического оружия: Часть II. Фосфорорганические отравляющие вещества: Том 1 / ФУМБЭП при МЗ РФ. – Москва, 2001. - С. 187-243.
10. Правила безопасности объектов по УХО на основе ФОВ. – М.: Российское агентство по боеприпасам, 2003. - С. 66.
11. Радилов А.С., Шкаева И.Е., Николаев А.И. и др. Экспресс-оценка особо опасных химических соединений в объектах окружающей среды// Научно-технические аспекты обеспечения безопасности при уничтожении, хранении и транспортировке химического оружия. Тез. докл. научно-практической конференции. – Москва, 2004. – С. 161-162.
12. Методика определения площади защитных мероприятий, устанавливаемой вокруг объектов по хранению ХО и ОУХО. - М.: МО РФ, 1999. – 98с.
13. Методика расчета концентраций в атмосферном воздухе вредных веществ, содержащихся в выбросах предприятий (ОНД-86). Л.: Гидрометео-издат, 1987. – 111 с.
14. Постановление Правительства РФ «Об утверждении площади ЗЗМ, устанавливаемой вокруг объекта по хранению химического оружия (пос. Марадыковский Кировской области) и перечня населенных пунктов, включаемых в указанную зону от 29.12.2004 № 867. – Москва, 2004. – 5 с.
15. Методика прогнозирования масштабов заражения сильнодейству-ющими ядовитыми веществами при авариях (разрушениях) на химически опасных объектах и транспорте. РД 52.04.253 – 90. Л.: Гидрометеоиздат, 1991. – 56 с.
16. Методика определения площади защитных мероприятий, устанавливаемой вокруг объектов по хранению ХО и ОУХО. - М.: МО РФ, 1999. – 84 с.
1.7 Мурин А.В. Математическое моделирование на параллельных системах последствий химических аварий. – Автореф. Дис. ... канд. физ.-мат. Наук /Ижевск - ИжГТУ, 2002 - 24 с.
18. Тронин С.Я., Мещеряков Е.М., Хромов М.Н. Организациязащитынаселенияприаварияхнаобъектаххраненияиуничтоженияхимическогооружия// Ж. росс. хим. об-ва им. Д.И. Менделеева. – 2002. - т. 36. - № 6. - С. 112-117.
19. Сильнодействующие ядовитые вещества и защита от них. Под ред. В.А. Владимирова. – М.: Воениздат, 1989. – 109 с.
20. Евстафьев И.Б., Холстов В.И., Григорьев С.Г. Методические основы оценки аварийной опасности объектов по хранению и уничтожению химического оружия // Ж. росс. хим. об-ва им. Д.И. Менделеева. - 1993. - Т. 37, №3. С.5 0-59.
21. Скоробогатова В.И, Кобцов С.Н., Щербакова Л.Ф., Мандыч В.Г., Сотников Н.В, Щербаков А.А. Особенности поведения фосфорорганических отравляющих веществ в воде и почве - Сборник №5 научных трудов СВИРХБЗ. – Саратов, 2005.- С.152-155.
22. Александров В.Н., Емельянов В.И. Отравляющие вещества. – М.: Воениздат, 1990. – 271 с.
23. Ашихмина Т.Я. Научно-методологические основы системы комплексного экологического мониторинга объектов хранения и уничтожения химического оружия. - Киров.: Вятка, 2001. – 473 с.
24. Савельева Е.И., Зенкевич И.Г., Кузнецова Т.А. и др. Исследование продуктов превращений фосфорорганических отравляющих веществ методом газовой хроматографии – масс-спектрометрии //Ж. росс. хим. об-ва им. Д.И. Менделеева. - 2002. - Т. 46. - №6. – С.89-92.
25. Савельева Е.И., Радилов А.С., Кузнецова Т.А. и др. Определение метилфосфоновой кислоты и ее эфиров как химических маркеров фосфорорганических отравляющих веществ - Журнал прикладной химии. 2001, Т. 74, № 10. - 1677 с.
26. Франке З., Франс П., Варнке В. Химия отравляющих веществ. Т. 1. - М.: Химия, 1973. – 270 с.
27. Скурлатов Ю.И., Дуга Г.Г. Введение в экологическую химию. – Учебное пособие. М.: Высш. Шк., 1994. – 400с.
28. Корте Ф., Бахадир М. и др. Экологическая химия / Пер. с нем. под ред.- Корте. М.: Мир, 1996. - 396 с.
29. Безопасность России: Правовые, социально-экономические и научно-технические аспекты. Региональные проблемы России с учетом риска и возникновения природных и техногенных катастроф// В.И. Осипов, Ю.А. Мамаев, В.А. Королев.- М.: МГФ «Знание», 1999. – 144 с.
30. Орлов Д.С. Химия и охрана почв. М.: Химия, 1996. – 175с.
31. Королёв В.А., Некрасова М.А. Экспериментальные исследования электрохимической миграции ионов металлов в дисперсных породах// Геохимия. 1998. № 12. С. 1277-1283.
32. Small M.J. Compounds formed from the chemical decontamination of HD, GB, and VX and their environmental fate. Tech Rpt8304; AD A149515. Fort Detrick, MD:U.S. Army Medical Bioengineering Research and Development Laboratory – 1984.
33. Schowanek D. and Verstraete W. Phosphonate utilization by bacterial cultures and enrichments from environmental samples / Schowanek D. and Verstraete W. //Appl.Environ.Microbiol – 1990.-V. 56.-P. 895-903.
34. Smith J.D. Metabolism of Phosphonates. – In: The role of phosphonates in living systems (Hilderbrand, R.L., ed.) CRC Press, Boca Raton – 1983.-P. 31-54.
35. Selvapandiyan A. and Bhatnagar Raj K. Isolation of glyphosate-metabolising Pseudomonas: detection, partial purification and localization of carbon-phosphorus lyase / Selvapandiyan A. and Bhatnagar Raj K. // Appl. Microbiol. Biotechnol – 1994.-V 40.-P. 876-882.
36. Shinabarger D.L. and Braymer H.D. Glyphosate catabolism by Pseudomonas sp. strain PG2982. / Shinabarger D.L. and Braymer H.D. // J Bacteriol – 1986.-V. 168.-P. 702-703.
37. Shames S.L. Fragmentative and stereochemical isomerisation probes for homolytic carbon to phosphorus bond scission catalysed by bacterial carbon-phosphorus lyase / Shames S.L., Wackett L.P., LaBarge M.S., Kuczkowski R.L. and Walsh C.T. // Bioorg.Chem. – 1987.-V 15.-P. 366-373.
38. Матыс С.В. Деградация метилфосфоната Е. coli: физиологические и биохимические аспекты / Матыс С.В. // Диссертация – 2003. – С. 56.
39. Нифантьев Э.Е. Химия фосфорганических соединений / Нифантьев Э.Е. - М.: 1971.
40. Кононова С.В. и Несмеянова М.А. Фосфонаты и их деградация микроорганизмами / Кононова С.В. и Несмеянова М.А. // Биохимия- 2002.- Т. 67.-С. 220-233.
41. Goldstein A.H., Liu S.T. Molecular cloning and regulation of a mineral phosphate solubilizing gene from Erwinia herbicola – Biotechnology, 1987, v.5 - Р. 72-74.
|