РЕФЕРАТ
«Бериллий и сплавы, содержащие бериллий. Свойства, применение в химической технологии»
Введение
Применяемые в промышленности и быту металлические изделия редко состоят из чистых металлов, примером является алюминиевая или медная проволока с процентным содержанием металла около 99,9%, в большинстве других случаев идет речь о сплавах. Сплавы – системы, состоящие из двух или нескольких металлов, а также из металлов и неметаллов, обладающие свойствами, присущими металлическому состоянию. Так, различные виды железа и стали содержат наряду с металлическими добавками незначительные количества углерода, которые оказывают решающее влияние на механическое и термическое поведение сплавов. Все сплавы имеют специальную маркировку, т. к. сплавы с одним названием (например, латунь) могут иметь разные массовые доли других металлов.
Для изготовления сплавов применяют различные металлы. Самое большое значение среди всех сплавов имеют стали различных составов. Для получения легированных сталей к железу, являющемуся главной составляющей сплава, добавляют кремний, медь, марганец, никель, хром, вольфрам, ванадий, молибден и другие компоненты.
В данной работе будут рассмотрены свойства и применение металла бериллия и содержащих бериллий сплавов.
Основные свойства и технологии получения бериллия
Бериллий – светло-серый металл второй группы Периодической системы элементов Д.И. Менделеева. Порядковый номер 4, атомная масса 9,013. Символ Be (лат. Beryllium). Имеет один стабильный изотоп 9
Be, известны также радиоактивные изотопы бериллия 7
Be и 10
Be с периодами полураспада 53,29 дней и 1,6·106
лет соответственно. Открыт в 1798 в виде окиси BeO, выделенной из минерала берилла Л. Вокленом. Металлический Ве впервые получили в 1828 Ф. Вёлер и А. Бюсси независимо друг от друга. Так как некоторые соли Ве сладкого вкуса, его вначале называли «глюциний» (от греч. glykys – сладкий) или «глиций». Название Glicinium (знак GI) употребляется (наряду с Ве) только во Франции. Применение Ве началось в 40-х гг. 20 в., хотя его ценные свойства как компонента сплавов были обнаружены ещё ранее, а замечательные ядерные – в начале 30-х гг. 20 в.
Ве может существовать в двух полиморфных модификациях. Низкотемпературная модификация (α-Ве), существующая до 1250 °С, имеет гексагональную плотноупакованную решетку, высокотемпературная (β-Ве) – решетку объемно-центрированного куба.
Нахождение в природе
Редкий металл – содержание Ве в земной коре 5 · 10-4
% (как и соседние с ним литий и бор, относительно мало распространен в земной коре). Типичный литофильный элемент, характерный для кислых, субщелочных и щелочных магм. Не является рассеянным, так как входит в состав поверхностных залежей берилла в пегматитовых породах, которые последними закристаллизовались в гранитных куполах. Есть сообщения о гигантских бериллах длиной до 1 м и массой до нескольких тонн.
Известно 54 собственно бериллиевых минерала – из них наибольшее практическое значение имеет берилл 3BeO·Al2
O3
·6SiO2
, который после обработки переводят в форму хлорида или фторида. Этот минерал имеет много окрашенных разновидностей: изумруд (около 2% Cr придают ему зеленый цвет), аквамарин (примесь Fe(II) обуславливает его голубую окраску), воробьевит (розового цвета из-за примесей соединений Mn(II)), а гелиодор (золотисто-желтый – ионы Fe(III)). Перспективны и частично используются фенакит 2BeO·SiO2
, гельвин (Mn, Fe, Zn)4
[BeSiO4
]3
S, хризоберилл BeAl2
O4
, бертрандит 4BeO·2SiO2
·H2
O.
Мировые природные ресурсы Ве оцениваются более чем в 80 тыс. т (по содержанию Ве), из которых около 65% сосредоточено в США (основное Ве сырье – бертрандитовая руда). Подтвержденные запасы – на месторождении Spur Mountain (шт. Юта), являющемся основным в мире источником Ве, на конец 2000 составили примерно 19 тыс. т (по содержанию металла). Из других стран наибольшими запасами Ве обладают Китай, Россия и Казахстан. Во времена СССР Ве на территории России добывался на Малышевском (Свердловская область), Завитинском (Читинская область), Ермаковском (Бурятия), Пограничном (Приморский край) месторождениях. В связи с сокращением ВПК и прекращением строительства атомных электростанций его добыча была прекращена на Малышевском и Ермаковском и значительно сокращена на Завитимском месторождениях. При этом значительная часть добываемого Ве продается за рубеж, в основном, в Европу и Японию.
Физические свойства –
по сравнению с другими легкими материалами бериллий обладает уникальным сочетанием физических и механических свойств.
Кристаллическая решётка Ве гексагональная плотноупакованная с периодами а = 2,855 Å и с= 3,5840 Å.
Плотность 1847,7 кг/м3
Температура плавления 1551 °С
Температура кипения 3243 о
С
Скрытая теплота плавления 250–275 кал/г (самая высокая среди всех металлов)
Коэффициент линейного расширения 10,3–131 (25–100 °С)
Модуль продольной упругости (модуль Юнга) 300ГН/м2
(3.104 кг•с/мм2
)
Предел прочности при растяжении 200–550 МН/м2
(20–55 кг•с/мм2
)
Предел текучести 250–600 МН/м2
(25–60 кг•с/мм2
)
Предел прочности в направлении вытяжки – до 400–800МН/м2
(40–80 кг•с/мм2
) Относительное удлинение – до 4–12%
Ударная вязкость 10–50 кДж/м2
(0,1 – 0,5 кгс.•м/см2
)
Температура перехода из хрупкого состояния в пластическое 200 – 400 °С
Твёрдость НВ 60–85 (для горячепрессованного Ве)
Теплоемкость для α-Ве 16,44 Дж/(моль•К), для β-Ве – 30,0 Дж/(моль•К)
Ве обладает:
наиболее высокой из всех металлов удельной теплоёмкостью – 1,80 кДж/(кг.•К) или 0,43 ккал/ (кг•°С)
высокой теплопроводностью – 178 Вт/(м•К) или 0,45 кал/см•сек•°С) (50 °С)
низким электросопротивлением – 3,6–4,5 мкОм•см (20 °С)
Сравним некоторые свойства Ве с характеристиками других материалов.
Удельная прочность и жесткость материалов
| Материал |
σв, МПа |
γ, (кг/м3) ∙10–3
|
σв /(γg), км |
E /(γg), км |
| Магниевый сплав МА10 |
430 |
1,8 |
24 |
2,3 |
| Алюминиевый сплав В95 |
700 |
2,9 |
21 |
2,4 |
| Титановый сплав ВТ6 |
1500 |
4,5 |
22 |
2,6 |
| Сталь 03Н18К9М5Т |
1750 |
7,8 |
23 |
2,6 |
| Бериллий |
680 |
1,8 |
38 |
16,1 |
Влияние температуры на удельный модуль упругости различных материалов
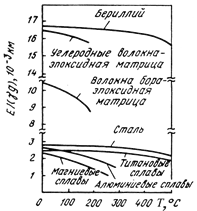
Свойства Ве зависят от качества и структуры металла и заметно меняются с температурой, механические – от чистоты металла, величины зерна и текстуры, определяемой характером обработки. Обработка давлением приводит к определённой ориентации кристаллов Ве, возникает анизотропия, становится возможным значительное улучшение свойств. Механические свойства в направлении, перпендикулярном вытяжке, почти не меняются. Ве – хрупкий металл (особенно литой) при комнатной температуре, что является главным препятствием к его широкому использованию в качестве конструкционного материала; к еще большей хрупкости материала приводит содержание даже незначительных примесей (например, введение в очищенный Ве всего 0,001% Si). Имеет низкую пластичность и хорошую коррозионную стойкость. Упругость паров Ве при температуре плавления очень мала.
Механические свойства Ве в литом и деформированном состояниях различаются в зависимости от направления проведения испытаний. Наилучшими механическими свойствами обладает Ве после тёплой обработки давлением, которая проводится при температурах ниже температуры рекристаллизации. Температура рекристаллизации Ве изменяется в пределах от 700 °С до 900 °С в зависимости от степени деформации и времени выдержки. Рекристаллизационный отжиг значительно повышает пластичность и уменьшает прочность Ве.
Отношение прочности к плотности у Be значительно выше, чем у авиационных сталей и сплавов на основе Ti и Al.
Важным специфическим свойством Ве является его высокая проницаемость для рентгеновских лучей, которая в 17 раз выше, чем у алюминия.
Высокие ядерные характеристики – самое низкое среди металлов эффективное поперечное сечение захвата тепловых нейтронов и самое высокое поперечное сечение их рассеяния.
Дает эвтектические сплавы с Al и Si. Растворимость примесных элементов в Ве чрезвычайно мала.
Химические свойства
Степени окисления +2 и +1 (последняя крайне неустойчива), конфигурация внешних электронов 2s2
.
По химическим свойствам Be подобен Al. Сходство между этими элементами привело к существенному заблуждению относительно валентности и атомной массы Ве – долгое время Ве считали трехвалентным с относительной атомной массой 14 (что примерно равно утроенной массе одного эквивалента Ве 3 × 4,7); лишь через 70 лет после открытия Ве русский ученый Д.И. Менделеев пришел к выводу, что в его периодической таблице места для такого элемента нет, а вот двухвалентный элемент с относительной атомной массой 9 (приблизительно равной удвоенной массе одного эквивалента Ве 2 × 4,7) легко размещается между Li и B.
Металлический Ве относительно мало реакционноспособен при комнатной температуре (например, устойчив к кислороду воздуха благодаря плёнке окиси, образующейся на его поверхности), в данных условиях взаимодействует с F2
. В компактном виде не реагирует с водой и водяным паром даже при температуре красного каления и не окисляется воздухом до 600° С. При 1200 °С металлический Ве горит, превращаясь в белый порошок ВеО. Галогены реагируют с Ве при температуре выше 600° С, а халькогены требуют еще более высокой температуры. Компактный Ве интенсивно реагирует с N2
при температурах более 1000 градусов, а в порошкообразном состоянии – при температурах более 500о
С. Аммиак взаимодействует с Ве при температуре выше 1200° С с образованием нитрида Be3
N2
, а углерод дает карбид Ве2
С при 1700° С. С Н2
Ве непосредственно не реагирует, и гидрид ВеН2
получают косвенным путем (получен при разложении бериллийорганических соединений, устойчив до 240 °С).
Ве легко растворяется в разбавленных водных растворах кислот (соляной, серной, азотной, плавиковой), слабо реагирует с концентрированной серной и разбавленной азотной кислотами, однако холодная концентрированная азотная кислота пассивирует металл. Реакция Ве с водными растворами щелочей сопровождается выделением Н2
и образованием гидроксобериллатов:
Be + 2NaOH(
р
)
+ 2H2
O = Na2
[Be(OH)4
] + H2
При проведении реакции с расплавом щелочи при 400–500° С образуются диоксобериллаты:
Be + 2NaOH(ж)
= Na2
BeO2
+ H2
Металлический Ве быстро растворяется в водном растворе NH4
HF2
. Эта реакция имеет технологическое значение для получения безводного BeF2
и очистки Ве: Be + 2NH4
HF2
= (NH4
)2
[BeF4
] + H2
Мелкодисперсный порошок Ве сгорает в парах S, Se, Te. Расплавленный Be взаимодействует с большинством окислов, нитридов, сульфидов и карбидов.
Соединения бериллия
У Ве, в отличие от других элементов 2 группы, нет соединений с преимущественно ионными связями, в то же время для него известны многочисленные координационные соединения, а также металлоорганические соединения, в которых часто образуются многоцентровые связи.
Вследствие малого размера атома Ве почти всегда проявляет координационное число 4, что важно для аналитической химии.
Соли Ве сильно гигроскопичны и за небольшим исключением (фосфат, карбонат) хорошо растворимы в воде, быстро гидролизуются с образованием ряда гидроксокомплексов неопределенной структуры, среда раствора кислая. Осаждение начинается при отношении OH–
:Be2+
> 1. Дальнейшее добавление щелочи приводит к растворению осадка.
Гидрид Ве ВеН2
был впервые получен в 1951 восстановлением ВеCl2
с помощью LiAlH4
. Аморфное белое вещество, при нагревании до 250° С гидрид ВеН2
выделять Н2
. Это соединение умеренно устойчиво в воздухе и воде, но быстро разлагается кислотами. ВеН2
полимеризован за счет трехцентровых связей ВеНВе.
BeHal
:
Безводные BeHalнельзя получить реакциями в водных растворах вследствие образования гидратов, таких как [Be(H2
O)4
] F2
, и гидролиза. Лучшим способом для получения BeF2
является термическое разложение (NH4
)2
[BeF4
], а BeCl2
удобно получать из оксида – для этого действуют Cl2
на смесь BeO и СО2
при 650–1000° С. BeCl2
можно также синтезировать прямым высокотемпературным хлорированием металлического Ве или его карбида. Эти же реакции используются для получения безводных бромида и иодида.
BeF
2
– стекловидный материал, его структура состоит из неупорядоченной сетки из атомов Ве (КЧ 4), связанных мостиками из атомов F, и похожа на структуру кварцевого стекла. Выше 270° С BeF2
самопроизвольно кристаллизуется. Подобно кварцу, он существует в низкотемпературной α-форме, которая при 227° С переходит в β-форму, кроме того, можно получить формы кристобалита и тридимита. Структурное сходство между BeF2
и SiO2
распространяется также на фторобериллаты (которые образуются при взаимодействии BeF2
с фторидами щелочных элементов и аммония) и силикаты.
BeF2
– компонент фторобериллатных стекол и солевой смеси, используемой в ядерных реакторах на расплавленных солях.
Хлорид и другие галогениды Ве можно рассматривать как полиядерные комплексные соединения, в которых координационное число Ве равно 4. В кристаллах BeCl2
есть бесконечные цепочки с мостиковыми атомами Cl:
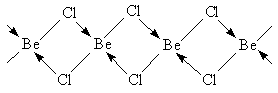
Даже при температуре кипения 550° С в газовой фазе содержится около 20% молекул димеров Be2
Cl4
.
Цепочечная структура BeCl2
легко разрушается слабыми лигандами, такими, как диэтиловый эфир, с образованием молекулярных комплексов [BeL2
Cl2
]:
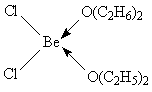
Более сильные доноры, такие, так вода или аммиак, дают ионные комплексы [BeL4
]2
+
(Cl–
)2
. В присутствии избытка галогенид-ионов образуются галогенидные комплексы, например [BeF4
]2–
.
Оксид Ве BeO
встречается в природе в виде редкого минерала бромеллита.
Непрокаленный ВеО гигроскопичен, адсорбирует до 34% воды, а прокаленный при 1500° С – лишь 0,18%. ВеО, прокаленный не выше 500° С, легко взаимодействует с кислотами, труднее – с растворами щелочей, а прокаленный выше 727° С – лишь HF, горячей концентрированной серной кислотой и расплавами щелочей. BeO устойчив к воздействию расплавленных Li, Na, K, Ni и Fe.
BeO получают термическим разложением сульфата или гидроксида Be выше 800° С. Продукт высокой чистоты образуется при разложении основного ацетата [Be4
O(OOCH3
)6
] выше 600° С.
BeO обладает очень высокой теплопроводностью – при 100° С она составляет 209,3 Вт/(м·К), что больше, чем у любых неметаллов и даже у некоторых металлов. ВеО сочетает высокую температуру плавления (2507° С) при с незначительным давлением пара при температуре ниже этой. Он служит в качестве химически стойкого и огнеупорного материала для изготовления тиглей, высокотемпературных изоляторов, труб, чехлов для термопар, специальной керамики. В инертной атмосфере или вакууме тигли из ВеО могут применяться при температурах до 2000° С.
Хотя оксид бериллия часто заменяют более дешевым и менее токсичным AlN, в этих случаях обычно наблюдается ухудшение рабочих характеристик оборудования. Ожидают, что в более отдаленной перспективе продолжится стабильный рост потребления ВеО, особенно в производстве компьютеров.
Гидроксид бериллия Be(OH)2
осаждают из водных растворов солей Ве аммиаком или NaOH. Его растворимость в воде при комнатной температуре намного ниже, чем у его соседей по Периодической системе и составляет всего лишь 3·10–4
г·л–1
. Be(OH)2
– слабое амфотерное основание, вступает в реакции как с кислотами, так и со щелочами с образованием солей, в которых Be входит в состав катиона или аниона, соответственно:
Be(OH)2
+ 2H3
O+
= Be2+
+ 2H2
O
Be(OH)2
+ 2OH–
= [Be(OH)4
]2–
(BeOH)2
CO3
– соединение переменного состава. Образуется при взаимодействии водных растворов солей Be с карбонатами натрия или аммония. При действии избытка растворимых карбонатов легко образует комплексные соединения, такие как (NH4
)2
[Be(CO3
)2
].
Карбоксилаты
Be
.
Уникальность Be проявляется в образовании устойчивых летучих молекулярных оксид-карбоксилатов с общей формулой [OBe4
(RCO2
)6
], где R = H, Me, Et, Pr, Ph и т.д. Эти белые кристаллические вещества, типичным представителем которых является основный ацетат бериллия (R =CH3
), хорошо растворимы в органических растворителях, включая алканы, и нерастворимы в воде и низших спиртах. Их можно получить простым кипячением гидроксида или оксида Be с карбоновой кислотой. Структура таких соединений содержит центральный атом O, тетраэдрически окруженный четырьмя атомами Be. На шести ребрах этого тетраэдра есть шесть мостиковых ацетатных групп, расположенных таким образом, что каждый атом Be имеет тетраэдрическое окружение из четырех атомов O. Ацетатное соединение [OBe4
(MeCO2
)6
] плавится при 285° С и кипит при 330° С. Оно устойчиво к нагреванию и окислению в нежестких условиях, медленно гидролизуется горячей водой, но быстро разлается минеральными кислотами с образованием соответствующей соли Be и свободной карбоновой кислоты.
Нитрат Be Be(NO3
)2
при обычных условиях существует в виде тетрагидрата. Он хорошо растворим в воде, гигроскопичен. При 60–100° С образуется гидроксонитрат переменного состава. При более высокой температуре он разлагается до BeO.
Основный нитрат [OBe4
(NO3
)6
] имеет аналогичную карбоксилатам структуру с мостиковыми нитрогруппами. Это соединение образуется при растворении BeCl2
в смеси N2
O4
и этилацетата с образованием кристаллического сольвата [Be(NO3
)2
·2N2
O4
], который затем нагревают до 50° С, чтобы получить безводный нитрат Be(NO3
)2
, быстро разлагающийся при 125° С на N2
O4
и [OBe4
(NO3
)6
].
Бериллийорганические соединения.
Для Ве известны многочисленные соединения, содержащие связи Ве-С. Соединения состава ВеR2
, где R – алкил, являются ковалентными и имеют полимерную структуру. Соединение (CH3
)2
Be имеет цепочное строение с тетраэдрическим расположением метильных групп вокруг атома Ве. Он легко возгоняется при нагревании. В парах существует в виде димера или тримера.
Соединения R2
Be самовоспламеняются на воздухе и в атмосфере СО2
, бурно реагируют (некоторые со взрывом) с водой и спиртами, дают устойчивые комплексы с аминами, фосфинами, эфирами.
Синтезируют R2
Be взаимодействием BeCl2
с магнийорганическими соединениями в эфире или Ве с R2
Hg. Для получения (C6
H5
)2
Be и (C5
H5
)2
Be используют реакцию BeCl2
с соответствующими производными щелочных элементов.
Предполагают, что соединения состава RBeX (Х – галоген, OR, NH2
, H) представляют собой R2
Be·BeX2
. Они менее реакционноспособны, в частности, на них не действует СО2
.
Получение, производство, обработка
В промышленности Ве и его соединения получают переработкой берилла в гидроокись Be(OH)2
или сульфат BeSO4
.
1) фторидный способ: измельченный берилл спекают с Na2
SiF6
и Na2
CO3
при 700–750° С, при этом образуется тетрафторобериллат натрия:
3BeO·Al2
O3
·6SiO2
+ 2Na2
[SiF6
] + Na2
CO3
= 3Na2
[BeF4
] + 8SiO2
+ Al2
O3
+ CO2
. Образующиеся фторбериллаты натрия Na2
BeF4
и NaBeF3
выщелачивают из смеси водой. При добавлении к этому раствору NaOH (рН = 12) в осадок выпадает Be(OH)2
.
2) сульфатный способ: берилл спекают при 750° С с известью или мелом (карбонатом Na или Ca), спек обрабатывают концентрированной горячей серной кислотой. На образовавшийся раствор BeSO4
, Al2
(SO4
)3
и других металлов действуют (NH4
)2
SO4
– это приводит к выделению большей части Al в виде KAl(SO4
)2
. Оставшийся раствор обрабатывают избытком NaOH, при этом образуется раствор, содержащий Na2
[Be(OH)4
] и алюминаты Na; при кипячении этого раствора в результате разложения гидроксобериллата осаждается Be(OH)2
(алюминаты остаются в растворе).
Известно также вскрытие берилла хлорированием или действием фосгена. Дальнейшая обработка ведётся с целью получения BeF2
или BeCl2
.
Металлический Ве получают восстановлением фторида магнием: BeF2
+ Mg = Be + MgF2
, –при высокой температуре (900–1300 °С) или электролизом его хлорида в смеси с хлоридом натрия (350 о
С). Полученный металл переплавляют в вакууме: металл высокой чистоты (до 99,98%.) получают дистилляцией, а в небольших количествах – зонной плавкой (пластичный бериллий, содержащий не более 10–4% примесей – многократное повторение зонной плавки (до 8 проходов) позволяет получать особо чистый Ве с чрезвычайно высокой пластичностью (δ = 140%)); применяют также электролитическое рафинирование. Из-за трудностей получения качественных отливок заготовки для изделий из Ве готовят методами порошковой металлургии. В безокислительной среде Ве измельчают в порошок и подвергают горячему прессованию в вакууме при 1140–1180 °С; чем мельче зерна порошка, тем выше прочностные и пластические свойства металла. Для предотвращения взаимодействия с воздухом горячепрессованные заготовки бериллия помещают в стальные оболочки, нагревают до температуры 800–1100 °С и в таком виде проводят обработку давлением. Прутки, трубы и др. профили получают выдавливанием при 800–1050 °С (горячее выдавливание) или при 400–500 °С (тёплое выдавливание). Листы из Ве (основной вид продукции, используемый в ракетной технике) получают прокаткой горячепрессованных заготовок или выдавленных полос при 760–840 °С. Степень обжатия при выдавливании 5:1 и более. Выдавливанием получают заготовки не только круглого или квадратного сечения, но и более сложного профиля.
Профили заготовок, выдавливаемых из бериллия
Свойства горячевыдавленного Ве значительно выше, чем свойства Ве после горячего прессования при исходной крупности порошка менее 70 мкм.
Применяют и др. виды обработки – ковку, штамповку, волочение. При механической обработке Ве пользуются твердосплавным инструментом (Ве плохо обрабатывается резанием).
Деформированные полуфабрикаты имеют развитую текстуру деформации, вызывающую сильную анизотропию свойств.
Получаемый Ве содержит в большом количестве кислород в виде окиси Ве (1–3%), а также другие примеси. Эти примеси, хотя и повышают прочность металла, но существенно снижают его пластичность, вызывая в сварных швах образование холодных трещин. Для обеспечения удовлетворительной свариваемости в техническом Ве ограничивается содержание вредных примесей до следующих количеств (в% по массе): ВеО до 0,3%; Fe до 0,04%; А1 до 0,02%; Si до 0,02%.
Увеличение содержания ВеО ухудшает формирование и повышает пористость швов. Однако и при наличии сравнительно небольшого количества примесей вследствие особенностей кристаллического строения (гексагональная решетка) Ве малопластичен, поскольку в его деформации участвует мало плоскостей скольжения. В этом отношении Ве уступает не только Al, но и Mg.
Для соединения деталей из Ве находит применение аргонодуговая сварка вольфрамовым электродом и электроннолучевая сварка. Предпочтительны соединения с отбортовкой кромок. При сварке стыковых соединений требуется введение в ванну присадочной проволоки.
Сварку неплавящимся электродом в инертных газах – Ar, He и их смесях производят преимущественно в камерах с контролируемой атмосферой вольфрамовым электродом на переменном токе. Техника и сварочная аппаратура те же, что и при сварке Al.
В процессе сварки заметно вырастает зерно в околошовной зоне, прочность сварного соединения составляет 0,5–0,6 прочности основного металла.
Техника электроннолучевой сварки также близка к технике сварки алюминиевых сплавов. Однако высокое давление паров Be создает определенные трудности в обеспечении устойчивого сварочного процесса.
Переработка Ве осложняется острой токсичностью летучих соединений, порошков, пыли и паров, содержащих Ве, поэтому при работе с Ве и его соединениями нужны специальные меры защиты – вместе с тем обработанные детали из бериллия вполне безопасны.
Биологическая роль
Ве присутствует в тканях многих растений и животных. Содержание в почвах – от 2•10-4
до 1•10-3
%, в золе растений – около 2•10-4
%. У животных Ве распределяется во всех органах и тканях, в золе костей содержится от 5,10-4
до 7.10-3
% Б. Около 50% усвоенного животным Ве выделяется с мочой, около 30% поглощается костями, 8% обнаружено в печени и почках. Плохо всасывается в желудочно-кишечном тракте, большинство его выводится через кишечник и в меньшей степени через почки. Из того количества Ве, которое усваивается организмом, существенная часть (до 30%) депонируется (откладывается) в костях, а остальное – в легких, лимфатических узлах, печени, сердечной мышце.
Биологическое значение Ве мало выяснено, оно определяется участием элемента в обмене Mg и Р в костной ткани (способность Be(II) замещать Mg в магниесодержащих ферментах за счет его более сильной координационной способности). Не относится к биологически важным, но повышенное содержание Ве опасно для здоровья. При избытке в рационе Ве, по-видимому, происходит связывание в кишечнике ионов фосфорной кислоты в неусвояемый фосфат Ве. Активность некоторых ферментов (щелочной фосфатазы, аденозинтрифосфатазы) тормозится малыми концентрациями Ве. Под влиянием Ве при недостатке фосфора развивается не излечиваемый витамином D бериллиевый рахит, встречаемый у животных в биогеохимических, богатых Ве.
Соединения Ве очень ядовиты, особенно в виде пыли и дыма, обладают аллергическим и канцерогенным действием, раздражают кожу и слизистые оболочки. При попадании в легкие могут вызвать хроническое заболевание – бериллиоз (легочная недостаточность). Заболевания легких, кожи и слизистых оболочек могут возникнуть через 10–15 лет после прекращения контакта с Ве.
Поступление Ве с пищей и водой незначительно. Предельно допустимые концентрации Ве в воздухе ≤0,001 мг/м3
.
бериллий элемент химический сплав
Сплавы бериллия, их свойства и применение
Главная сложность при легировании Ве состоит в малых размерах его атомов, в результате чего большинство элементов при растворении сильно искажают кристаллическую решетку, сообщая сплаву повышенную хрупкость. Легирование возможно лишь теми элементами, которые образуют с Ве механические смеси с минимальной взаимной растворимостью.
Серьезный недостаток Ве, заключающийся в низкой ударной вязкости и хладноломкости, может быть преодолен использованием сплавов с Al. Из диаграммы состояния Al–Be видно, что эти элементы практически взаимно нерастворимы.

Диаграмма состояния системы Al–Be
В таких сплавах эвтектического типа твердые частицы Be равномерно распределены в пластичной алюминиевой матрице. Сплавы содержат 24–43% Al, остальное – Be. Фирмой «Локхид» (США) разработан сплав, содержащий 62% Be, названный локеллоем. Сплавы Be–Al имеют структуру, состоящую из мягкой пластичной эвтектики и твердых хрупких включений первичного Be. Эти сплавы сочетают высокую жесткость, прочность и малую плотность, характерные для Be, с пластичностью Al.
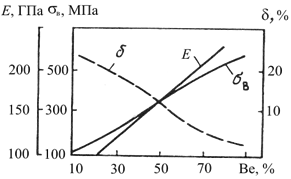
Зависимость механических свойств сплавов Al–Be от содержания
Be
Благодаря пластичности матрицы снижается концентрация напряжений у частиц Be фазы и уменьшается опасность образования трещин, что позволяет использовать сплавы в условиях более сложного напряженного состояния.
Для получения Be-Al сплавов также используют методы порошковой металлургии. Деформацию осуществляют выдавливанием с последующей ковкой и штамповкой в оболочках. Механические свойства труб из локеллоя (Be + 38% Al) при комнатной температуре: σв = 600 МПа, σ0,2 = 570 МПа, δ = 1%.
Для увеличения прочности сплавы Be–Al дополнительно легируют Mg и Ag– элементами, растворимыми в Al фазе. В этом случае матрица представляет собой более прочный и вязкий сплав Al–Mg или Al–Ag.
Al–Be, Al–Be–Mg сплавы удовлетворительно деформируются при 380 – 420о
С, имеют высокий модуль упругости, малую скорость роста усталостных трещин, высокий предел выносливости, износоустойчивы, высоко электро- и теплопроводны. Круг сфер их использования широк – от авиакосмической промышленности до производства компьютеров.
Пластичную матрицу можно получить, используя композицию Be–Ag, содержащую до 60% Ag. Сплавы с Ag дополнительно легируют Li и La.
За исключением сплавов с пластичной матрицей, легирование другими элементами не устраняет хладноломкость Be. Максимальную пластичность имеет Be высокой чистоты.
Широкое распространение получили сплавы Cu с 2–5% Be, так называемые Be бронзы. В России широко применяется Be бронза БрБ2 с 2% Be. Из диаграммы состояния видно, что этот сплав дисперсионно-твердеющий и может упрочняться закалкой с последующим старением.
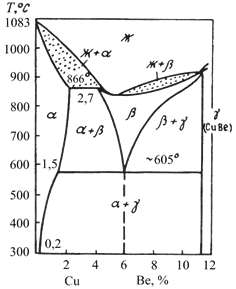
Диаграмма состояния системы Cu–Be
Закалка с 800 °С фиксирует пересыщенный α–твердый раствор, из которого в процессе старения при 300–350 °С выделяются дисперсные частицы CuBe, образуя регулярную, так называемую квазипериодическую структуру.

Электронно-микроскопическое изображение бериллиевой бронзы после сгорания (регулярное расположение выделений)
После закалки свойства Be бронзы БрБ2: σв = 500 МПа, δ = 30%, после старения – σв = 1200 МПа, δ = 4%.
Be бронзы обладают высокими упругими свойствами. Их используют для изготовления пружин, сохраняющих упругость в широком интервале температур, в том числе в криогенных условиях. Они хорошо сопротивляются усталости и коррозии.
Bе бронзы немагнитны и не искрят при ударе. Из них изготавливают инструменты для работы во взрывоопасных средах – шахтах, газовых заводах, где нельзя использовать обычные стали (например, ручной инструмент в нефтяной промышленности).

Неискрящие и немагнитные инструменты
Cu
-
Be
сплава
Литейные Be сплавы (ЛБС), состав которых приведен в таблице «Химические составы (%, остальное – Be) литейных Be сплавов, используют для деталей корпусов оснований, рам, кронштейнов и др. Be сплавы характеризуются высокими значениями теплоемкости, которые в 1,6 раза выше, чем у сплавов Al. Теплопроводность и температуропроводность сплавов лишь незначительно уступает литейным Al сплавам.
Совокупность теплофизических характеристик Be сплавов в целом выгодно отличает их от других материалов (например, силуминов) и определяет высокую размерную стабильность в условиях возникновения температурных градиентов при эксплуатации изделий.
Коррозионная стойкость Be сплавов находится на высоком уровне. Анодная оксидированная пленка на поверхности и лакокрасочные покрытия дополнительно обеспечивают надежную защиту сплавов ЛБС от коррозии. При этом Ве бронзам присуща также высокая электропроводность.
Механические свойства литейных Be сплавов при комнатной температуре приведены в таблице «Механические свойства литейных Be сплавов», а свойства при различных температурах испытания – в таблице «Механические свойства Be сплавов при различных температурах».
Химические составы (%, остальное – Be) литейных бериллиевых сплавов
| Сплав |
Al |
Ni |
Mg |
Cu |
Zr, Sc, Y, Gd, РЗМ |
Примеси, не более |
| Si |
Fe |
Mn |
Ti |
O2 |
| ЛБС-1 |
24–34 |
3–6 |
– |
– |
0,06–0,21* |
0,1 |
0,15 |
0,1 |
0,05 |
0,1 |
| ЛБС-2 |
36–24 |
3,5–4,5 |
0,6–0,8 |
– |
0,03–0,12** |
0,1 |
0,15 |
0,1 |
0,05 |
0,1 |
| ЛБС-3 |
30–34 |
– |
0,1–0,6 |
6–8 |
0,05–0,1 |
0,1 |
0,15 |
– |
– |
0,1 |
Механические свойства литейных бериллиевых сплавов
| Свойство |
ЛБС-1 |
ЛБС-2 |
ЛБС-3 |
| σв, МПа |
220–250 |
250–320 |
270–280 |
| σ0,2, МПа |
180–220 |
220–270 |
250–270 |
| δ, % |
2–3 |
2–3 |
1,1–1,3 |
| ψ, % |
2–3 |
2–3,5 |
– |
| KCU, МДж/м2 |
0,025–0,035 |
0,033–0,040 |
0,025–0,045 |
| E, ГПа |
200 |
200 |
200 |
Механические свойства бериллиевых сплавов при различных температурах
| Свойство |
Сплав |
Температура испытаний, °С |
| –100 |
0 |
100 |
200 |
300 |
400 |
| σв, МПа |
ЛБС-1 |
255 |
225 |
186 |
147 |
112 |
– |
| ЛБС-2 |
274 |
255 |
235 |
176 |
118 |
70 |
| σ0,2, МПа |
ЛБС-1 |
235 |
196 |
145 |
120 |
103 |
– |
| ЛБС-2 |
245 |
216 |
170 |
140 |
108 |
60 |
| δ, % |
ЛБС-1 |
2,8 |
2,4 |
2,5 |
2,5 |
1–2,4 |
– |
| ЛБС-2 |
2,0 |
2,1 |
2,1 |
2,2 |
3,0 |
4,0 |
Деформированные Be сплавы обладают высокой жесткостью и низкой плотностью. Эти сплавы являются перспективными для использования в некоторых элементах самолетных двигателей. Для повышения жаропрочных свойств Be используется сложное последовательное легирование.
На первом этапе выбирают оптимальный бинарный сплав.
Механические свойства двойных сплавов (остальное – Be)
| Содержаниелегирующих элементов, % |
Средний размер зерна, мкм |
σв, МПа |
Hμпри 20 °С |
| 20 °С |
500 °С |
| 6,7 Cu |
124 |
256 |
146 |
198 |
| 2,4 Ag |
186 |
282 |
209 |
215 |
| 5,8 Ni |
160 |
346 |
275 |
247 |
| 1,7 Co |
96 |
301 |
218 |
247 |
| 0,2 Fe |
347 |
307 |
125 |
180 |
Из рассмотренных двойных систем сплавы системы Be–Ni характеризуются наиболее высокими механическими свойствами как при комнатной температуре, так и при 500 °С. Ni сплав, содержащий 2% Ве, используется также для высокотемпературных пружин, зажимов, мехов и электрических контактов.
Дальнейшее упрочнение осуществляется введением Ti, образующего высокопрочные интерметаллиды TiBe12
.
Влияние Ti на прочность сплавов системы Be–Ni показано на графике.
бериллий элемент биологический сплав
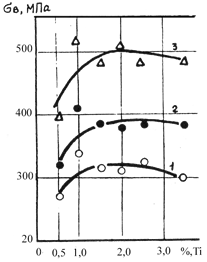
Влияние Ti на прочность сплавов системы Be–Ni–Ti при 20 °С и в зависимости от содержания Ni: 1 – 4%; 2 – 6%; 3 – 8% (по И.Н. Фридляндеру)
На основе системы Be–Ni разработан сплав, имеющий марку ВБД-1 при изготовлении из литой заготовки и ВБД-1П при изготовлении из порошков со следующим химическим составом: (7,5–8,5%) Ni; (0,8–1,2%) Ti; остальное – Be.
Механические свойства сплава ВБД-1П приведены в таблице.
Механические свойства сплава ВБД-1П
| Тисп
, °С |
Состояние |
σв, МПа |
σ0,2, МПа |
δ, % |
KCU, МДж/м2 |
| 20 |
Деформированное |
500–550 |
450–490 |
0,8–1,5 |
0,01 |
| 500 |
Отожженное |
350–370 |
290–310 |
2,5–6,0 |
0,03 |
| 700 |
То же |
150–170 |
100–120 |
14–18 |
– |
Предел выносливости сплава ВБД-1П при 500 °С в два раза выше, чем у Ве; удельная жесткость (E/γ) при 20 °С ниже, а при 500 °С – на 10% выше, чем у Ве. Модуль упругости составляет 250 ГПа. Высокая жесткость сохраняется при температурах до 700 °С. Предел ползучести и длительная жаропрочность сплава ВБД-1П при 400 °С такие же, как у деформированного Ве при 300 °С.
Интерметаллические соединения Ве с Ta, Nb, Zr, и др. могут использоваться до температур ≈ 1650o
С и имеют исключительно высокую твердость и стойкость против окисления.
Одна из важнейших областей применения Ве бронз – это изготовление пружин, мембран, сильфонов, применяемых в точном приборостроении. Стоит отметить, что из-за высокой стоимости Ве эти бронзы используют лишь в изделиях небольшого сечения, имеющих особое значение.
Комплекс физических, химических и механических свойств позволяет отнести Ве к наиболее ценным конструкционным материалам, несмотря на ряд недостатков (хрупкость, хладноломкость). Высокие прочностные характеристики в сочетании с малой плотностью, относительно высокой температурой плавления, хорошей коррозионной стойкостью делают Ве и его соединения с тугоплавкими металлами в ряде случаев незаменимым конструкционным материалом для нужд авиационной, ракетной техники и в приборостроении. Находит достаточно широкое применение в конструкциях, к которым предъявляются требования высокой жесткости и легкости.
Еще несколько примеров применения Ве и его сплавов и соединений
:
· Улучшение качества поверхности деталей машин и механизмов – для этого готовое изделие выдерживают в порошке Ве при 900–1000° С (бериллизация стали), и его поверхность делается тверже, чем у лучших сортов закаленной стали.
· Изготовление ядерных ректоров (Ве является одним из наиболее эффективных замедлителей и отражателей нейтронов из-за малого эффективного сечения захвата тепловых нейтронов и удовлетворительной стойкости в условиях радиации в сочетании с малой атомной массой), материал для окошек в рентгеновских трубках (Ве пропускает рентгеновские лучи в 17 раз лучше, чем Al и в 8 раз лучше, чем линдемановское стекло)
· Ве – интенсивный источник нейтронов при бомбардировке α-частицами, на этом свойстве основано использование Ве в нейтронных источниках на основе Ra, Po, Ac, Pu. Смесь соединений Ra и Ве долгое время использовалась как удобный лабораторный источник нейтронов, образующихся по ядерной реакции: 9Be + 4He = 12C + 1n. В 1932 при использовании именно этой смеси английским физиком Джеймсом Чедвиком был открыт нейтрон.
· Эффективный раскислитель в литейном деле.
· BeO обладает большой химической устойчивостью и теплопроводностью, сочетающейся с высоким электрическим сопротивлением и термостойкостью, что позволяет применять её в качестве огнеупорного материала для изготовления тиглей, футеровочных материалов, керамических покрытий и т.д.
· Бериллийорганические соединения используют как катализаторы димеризации и полимеризации олефинов, а также для получения металлического Ве высокой чистоты.
· Ве и некоторые его соединения рассматриваются как перспективное твёрдое ракетное топливо с наиболее высокими удельными импульсами.
Подготовка Ве и его сплавов под гальванопокрытия (травление)
Подготовка деталей ведется следующим образом:
1. Обработка абразивом;
2. Погружение в 10 –15%-ный раствор H2
SO4
на 5 –10 с и на 2 – 5 мин в раствор NaOH (450 – 500 г./л) и ZnO (100–150 г./л);
3. Промывка в холодной воде;
4. Стравливание Zn в 30 –35%-ном растворе HNO3;
5. Повторная промывка;
6. Цинкатная обработка и ударное меднение в электролите (в г/л): NaCu(CN)2
– 35–40; NaCN (свободный) – 3 – 5; Na2
CO3
– 7–10. В первую минуту iк = 2,5 ÷ 3 А/дм2
, в последующие 10 мин iк = 1,0 ÷1,5 А/дм2
. Детали загружают под током.
В большинстве случаев детали из Ве обезжиривают в органических растворителях, а затем в щелочи. Для Ве бериллия используют щелочи или кислоты, а для активирования – 1%-ный (по массе) раствор H2
SO4
. Температура комнатная, время выдержки 15 – 30 с.
С целью улучшения сцепления необходим отжиг Ве деталей в Ar или обработка в вакууме, но следует учитывать диффузию металлов внутрь Ве и его сплавов. Зона диффузии для Ni покрытия становится заметной после 18-часового нагрева при 350–400 °С, а для Fe– при 500 – 550 °С. Поэтому последние рекомендуются в качестве покрытий при работе Be при повышенных температурах.
Литература
1. Популярная библиотека химических элементов. Водород–хром. М., Наука, 1971
2. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М., Химия, 1992
3. Greenwood N.N., Earnshaw A. Chemistry of the Elements, Oxford: Butterworth, 1997
4. Технология электрической сварки металлов т сплавов плавлением. Под ред. акад. Б.Е. Патона. М., Машиностроение, 1974
5. П.С. Мельников. Справочник по гальванопокрытиям в машиностроении, 1979.
6. Ю.П. Солнцев. Материаловедение: учебник для вузов. СПб., Химиздат, 2004.
|