СОДЕРЖАНИЕ
Введение
1. Литературная часть
1.1 Физико-химические свойства меди (II)
1.2 Природа поверхности кремнезема1.3 Модифицированные кремнеземы1.4 Физико-химические свойства арсеназо I1.5 Физико-химические свойства полигексаметиленгуанидина2 Экспериментальная часть
2.1 Приборы, реактивы, посуда
2.2 Методика эксперимента
2.2.1 Методика синтеза сорбента
2.2.2 Методика сорбционного концентрирования меди (II)
использованием кремнезема, нековалентно-модифицированного арсеназо I
2.3 Влияние кислотности среды на степень сорбционного извлечения арсеназо I
2.4 Изотерма сорбции арсеназо Iна кремнеземах, модифицированных различными полигуанидинами
2.5 Влияние кислотности среды на степень сорбционного извлечения меди (II)
2.6 Изотерма сорбции меди (II) сорбентом, модифицированным арсеназо I, из хлоридных растворов
Выводы
Список литературы
ВВЕДЕНИЕ
В последнее время все большее значение в аналитической практике приобретают сорбционные методы концентрирования ионов металлов. Это обусловлено их высокой чувствительностью, селективностью и экологической безопасностью. Среди сорбентов наибольший интерес вызывают модифицированные высокодисперсные кремнеземы, что обусловлено их специфическими свойствами: высокой скоростью установления гетерогенного равновесия, ненабухаемостью, термической и химической стойкостью. Применение таких сорбентов позволяет объединять операции концентрирования и разделения определяемых веществ с последующим их детектированием непосредственно в фазе сорбента высокочувствительными спектроскопическим методами. Это дает возможность на несколько порядков снизить границу определения исследуемых компонентов, повысить экспрессность.
Использование сорбентов с закрепленными на поверхности аналитическими реагентами, разрешает определять в природных объектах различные ионы металлов. Поскольку твердофазный реагент практически не влияет на состояние химического равновесия в исследуемой системе, то такие методы незаменимыми при проведении экоанализа [1].
В данной работе в качестве исследуемого металла выбран ион меди. Присутствие меди в природных, сточных и водопроводных водах регламентируется на уровне ПДК (1 мг/л) [2].
Целями данной работы являлись: синтез сорбента нековалентно- модифицированного арсеназо I, исследование влияния природы и концентрации полигуанидинов на свойства сорбента, исследование сорбционного извлечения Cu (II) из хлоридных растворов.
Глава 1 ЛИТЕРАТУРНАЯ ЧАСТЬ
1.1 Физико-химические свойства меди (II)
Медь — вязкий, мягкий и ковкий металл, уступающий только серебру высокими теплопроводностью и электропроводностью. Эти качества, а также пластичность и сопротивление коррозии обусловили широкое применение меди в промышленности.Химическая активность меди невелика, при температурах ниже 185°С с сухим воздухом и кислородом не реагирует. Большинство соединений меди (I) очень легко окисляется в соединения двухвалентной меди, но дальнейшее окисление до меди (Ш) затруднено.Основным координационным полиэдром для двухвалентной меди является симметрично удлиненная квадратная бипирамида. Тетраэдрическая координация для меди (II) встречается довольно редко и в соединениях с тиолами, по-видимому, не реализуется. Большинство комплексов меди (II) имеет октаэдрическую структуру, в которой четыре координационных места заняты лигандами, расположенными к металлу ближе, чем два других лиганда, находящихся выше и ниже металла. Устойчивые комплексы меди (П) характеризуются, как правило, плоскоквадратной или октаэдрической конфигурацией. В предельных случаях деформации октаэдрическая конфигурация превращается в плоскоквадратную. Большое аналитическое применение имеют внешнесферные комплексы меди [2].Медь является хромогенным элементом и дает чувствительные цветные реакции со многими органическими реагентами. Для определения меди предложено большое число хелатообразующих органических соединений различных классов. Концентрирование меди с помощью химически модифицированных кремнеземов характеризуется высокими коэффициентами концентрирования и достаточной селективностью.Хромотроповая и п-нитробензолхромотроповая ("хромотроп 2В") кислоты образуют с медью (I) в области рН 6—11 окрашенные комплексы. Хромотроповая кислота образует два комплекса: CuR2-
(K= 13,45), в щелочной среде образуется CuROH3-
с рК=8,3 [3]. 1.2 Природа поверхности кремнезема Поверхности могут быть классифицированы следующим образом:1. Полностью гидроксилированная поверхность, когда поверхностная структура обрывается силанольными группами SiOH. Такая поверхность легко смачивается водой и водорастворимыми органическими молекулами. Все типы кремнеземов, у которых удалена вода путем их высушивания при температуре менее чем 150ºС, относятся к данному типу.2. Силоксановая поверхность состоит большей частью из атомов кислорода, причем каждый атом кислорода связывается с соседними атомами кремния. Обычно на такой поверхности также присутствует незначительная доля изолированных или парных групп SiOH. К данному типу относятся поригенные кремнеземы, сконденсированные из парообразного состояния. Кроме того, для гидроксилированных образцов кремнезема, которые подвергаются дегидратации при ~1000ºС, силоксановая поверхность формируется за счет удаления молекул воды, образуемых из смежных силанольных групп.3. Органическая поверхность формируется за счет химически или физически присоединенных органических молекул или радикалов. Образовавшаяся поверхность может проявлять следующие свойства:а) гидрофобное и сильно органофильное поведение, когда расположенные с наружи группы являются углеводородными;б) гидрофильное и олеофобное поведение, когда присоединенные органические группы содержат расположенные снаружи группы C – OH или другие сильно полярные группы;в) и гидрофобное и олеофобное поведение, когда поверхностными являются фторуглеводородные группы. 1.3 Модифицированные кремнеземыВ последние десятилетия происходит становление нового направления на стыке неорганической, органической и элементоорганической химий, катализа и химии сорбционных явлений. Это направление можно определить как химию соединений, гетерогенизированных на минеральных носителях. Система «вещество на носителе» зачастую представляет собой новый материал с рядом свойств, которыми не обладали ни носитель, ни сорбированное соединение. Фиксация активного компонента на поверхности носителя может осуществляться за счет физических или химических взаимодействий. Последнее предпочтительнее, так как оно позволяет добиться существенно большей устойчивости получаемых материалов к различным воздействиям внешней среды и, следовательно, большей стабильности действия. В качестве носителей для закрепления различных соединений используют как органополимерные, так и минеральные подложки. Особое место среди минеральных носителей занимает кремнезем. Причинами этого являются его детальная изученность, «мягкость» его гидроксильного покрова и возможность варьирования в широких пределах величины удельной поверхности, пористости, объема пор [5].
Кремнеземные сорбенты имеют ряд существенных преимуществ перед другими матрицами также в плане возможности целенаправленного изменения химико-аналитических свойств путем модификации их соответствующими реагентами, а именно: высокую емкость, легкость регенерации, наличие на поверхности активных групп, которые разрешают путем несложных преобразований на поверхности существенно изменить характеристики сорбента [6].
Для закрепления аналитических реагентов на поверхности кремнеземной матрицы используют два основных приема:
1) синтетический способ, или так называемую ковалентную прививку реагента на поверхности;
2) нековалентную иммобилизацию аналитических реагентов, которая включает: импрегнирование или пропитку матрицы раствором модификатора; иммобилизацию, или закрепление реагента на поверхности носителя за счет адсорбции, дисперсионного, электростатического, диполь-дипольного взаимодействия, а также образования водородных связей при участии силанольных групп кремнеземной матрицы; золь-гель технологию [7].
Сегодня существует уже значительный ассортимент сорбентов, полученных путем нековалентной иммобилизации на их поверхности аналитических реагентов. Такие сорбенты, сохраняя преимущества ковалентно-модифицированных матриц (химическая, механическая стойкость, и т.п.), удобно отличаются от них меньшей трудоемкостью операций модификации и регенерации. Импpегнирование (пропитку кремнеземной матрицы) осуществляют преимущественно концентрированным раствором модификатора в летучем органическом растворителе с последующим удалением последнего при комнатной или повышенной температуре [8].
Модифицированные, в частности, импрегнированием органическими аналитическими реагентами кремнеземы применяют для определения низких (до 10-6
моль/л) концентраций ионов тяжелых металлов в растворах. Сорбент используют для предварительного концентрирования ионов металлов, а далее применяют различные способы определения. Матрица сорбентовхарактеризуется механической прочностью частиц, отсутствием собственнойокраски и люминесценции. Химическое модифицирование, в отличие отфизической адсорбции, позволяет прочно закрепить молекулы реагента наповерхности силикагеля, но такой синтез чрезвычайно сложен. Физическаяадсорбция реагентов, при простоте выполнения, не всегда обеспечиваетдостаточно прочного их удерживания на поверхности твердых веществ [9].
1.4 Физико-химические свойства арсеназо I Арсеназо, органические реактивы, применяемые в аналитической химии. Различают арсеназо I (А-I), арсеназо II (A-II) и арсеназо III (A-III). Арсеназо — мелкокристаллические порошки тёмно-коричневого или бордового (арсеназо III) цвета, легко растворимые в воде. Все арсеназо являются производными хромотроповой кислоты и различных замещенных фениларсоновой кислоты (рисунок 1). А-II и А-III отличаются от А-I более сложным строением. 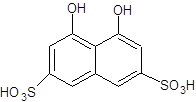 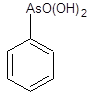 12 12 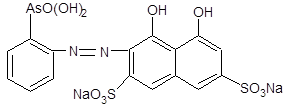 3(1) – хромотроповая кислота; (2) – фениларсоновая кислота; (3) – арсеназо IРисунок 1 – Структурные формулы веществ Наиболее известный реагент из серии моноазосоединений – арсеназо I (уранон, 3 - [(2 - арсонофенил)азо] - 4,5 – дигидрокси-2,7-нафталиндисульфо-кислота). Обычно применяют в виде смеси с динатриевой солью и NaCl. Одна из особенностей аналитического действия арсеназо I – возможность достижения хорошей избирательности в результате варьирования рН. Относительно не большая прочность комплексов элементов с арсеназо I позволяет использовать реагент в качестве металлоиндикатора при комплексонометрическом определении Pu, Th, РЗЭ, а также F¯. Чувствительность определения элементов достаточно высокая (0,05-0,1 мкг/мл). Арсеназо I применяется в качестве металлоиндикатора при определении некоторых пар элементов во взаимном присутствии, соосаждении элементов с органическими соосадителями, изучении комплексообразования и механизма реакций реагентов этой группы с различными элементами. 1.5 Физико-химические свойства полигексаметиленгуанидина В последние годы значительно возрос интерес к классу гуанидиновых соединений, особенно полимерных гуанидинов, обладающих комплексом свойств, важных для практического применения.Полигексаметиленгуанидин (метацид) – линейный или разветвленный полимер (рисунок 2). Прозрачная стеклообразная масса. Растворим в воде. В водных 10%-ных и более высокой концентрации растворах полигексаметиленгуанидина при комнатной температуре вследствие интенсивного образования водородных связей происходит студнеобразование. 3(1) – хромотроповая кислота; (2) – фениларсоновая кислота; (3) – арсеназо IРисунок 1 – Структурные формулы веществ Наиболее известный реагент из серии моноазосоединений – арсеназо I (уранон, 3 - [(2 - арсонофенил)азо] - 4,5 – дигидрокси-2,7-нафталиндисульфо-кислота). Обычно применяют в виде смеси с динатриевой солью и NaCl. Одна из особенностей аналитического действия арсеназо I – возможность достижения хорошей избирательности в результате варьирования рН. Относительно не большая прочность комплексов элементов с арсеназо I позволяет использовать реагент в качестве металлоиндикатора при комплексонометрическом определении Pu, Th, РЗЭ, а также F¯. Чувствительность определения элементов достаточно высокая (0,05-0,1 мкг/мл). Арсеназо I применяется в качестве металлоиндикатора при определении некоторых пар элементов во взаимном присутствии, соосаждении элементов с органическими соосадителями, изучении комплексообразования и механизма реакций реагентов этой группы с различными элементами. 1.5 Физико-химические свойства полигексаметиленгуанидина В последние годы значительно возрос интерес к классу гуанидиновых соединений, особенно полимерных гуанидинов, обладающих комплексом свойств, важных для практического применения.Полигексаметиленгуанидин (метацид) – линейный или разветвленный полимер (рисунок 2). Прозрачная стеклообразная масса. Растворим в воде. В водных 10%-ных и более высокой концентрации растворах полигексаметиленгуанидина при комнатной температуре вследствие интенсивного образования водородных связей происходит студнеобразование. 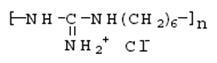 Рисунок 2 – Структурная формула полигексаметиленгуанидина гидрохлорид (ПГМГ)
Основными практически важными свойствами ПГМГ является широкий спектр микробиологической активности, низкая токсичность, полная растворимость в воде, биологическая разлагаемость, отсутствие цвета, запаха, коррозионной активности. Полимер и его водные растворы стабильны при хранении в обычных условиях. Полигексаметиленгуанидин относится к классу катионных полиэлектролитов, а в его химической формуле гуанидиновые группировки чередуются с шестью метиленовыми. Это обусловливает его дифильность, что проявляется в значительной поверхностной активности на границе раздела фаз воздух — вода. Установлено наличие комплексообразующих свойств ПГМГ по отношению к веществам различной химической и физической природы, за счет которых ПГМГ эффективно извлекает из воды растворенные органические и неорганические примеси, такие, как пестициды, тяжелые металлы, в том числе радиоактивные, и другие органические и неорганические примеси природного и антропогенного происхождения. Способность ПГМГ практически полностью извлекать водорастворимые соединения из очень разбавленных растворов создает перспективу его применения в экономически целесообразных и эффективных технологиях очистки питьевой воды, природных и сточных вод от тяжелых металлов, в том числе радиоактивных.
ПГМГ обладает низкой токсичностью, биологической разлагаемостью, нелетучестью, неагрессивностью по отношению к различным материалам и является экологически безопасным полимером.Перспективным является использование полигуанидинов для нековалентного закрепления различных органических реагентов на поверхности кремнеземов. Нековалентно-модифицированные сорбенты, сохраняя преимущества ковалентно-модифицированных матриц (химическая, механическая стойкость, и т.п.), отличаются от них меньшей трудоемкостью операций модификации и регенерации.Поэтому актуальным является синтез и исследование силикагелей с нековалентно-иммобилизованными на поверхности органическими реагентами, в частности арсеназо I.сорбционный арсеназо медь химический
Глава 2 Экспериментальная часть
2.1 Приборы, реактивы, посуда
- атомно-эмиссионный спектрометр с индуктивно связанной плазмой iCAP – 6500 ThermoScientificCorp.;
- атомно-абсорбционный спектрометр «МГА-915», «ЛЮМЭКС»;
- весы аналитические MettlerToledoXP 205 DR;
- рН meter s20 Mettler Toledo;
- анализатор влажности галогенный MettlerToledoHR 83;
- спектрометр PerkinElmerLambda 950;
- перистальтический насос MasterFlexL/S;
- секундомер;
- NaCl, ч.;
- NaOH, ч.д.а.;
- натрий додецилсульфат, ГСО8049-94 (фиксанал);
- натрий углекислый, ч.;
- натрий сернокислый, ч.д.а.;
- бромфеноловый синий (индикатор), ч;
- хлороформ, х.ч.;
- вода дистиллированная;
- вода деионизированная;
- хлороводородная кислота (ρ = 1,19 г/см3
), ос.ч.;
- силохром С-120;
- CuCl2
´2H2
O, ч.;
- арсеназо I, ч.д.а.;
- полигексаметиленгуанидин гидрохлорид (ПГМГ ГХ)
, ч.;
- поли-(4,9-диоксадодекан-1,12-гуанидин) хлорида (ПДДГ) – 52,4%-водный раствор;
- полигексаметиленгуанидин фосфат (ПГМГ Ф) – 52,4%-водный раствор;
- пипетки емкостью 1, 5, 10 мл;
- бюретка емкостью 25 мл;
- колбы емкостью 25, 50 и 100 мл;
- мерные стаканы емкостью 50 и 100 мл;
- фильтровальная бумага;
- воронки.
Исходные растворы ПГМГ ГХ готовили из навески сухого препарата ПГМГ растворением в дистиллированной воде.
Исходные растворы ПДДГ готовили из навески 52,4%-ого водного раствора ПДДГ растворением в дистиллированной воде.
Исходные растворы ПГМГ Ф готовили растворением его водного раствора в дистиллированной воде.
Исходный растворы CuCl2
, готовили растворением точной навески соответствующей соли в хлороводородной кислоте. Растворы с меньшими концентрациями металла готовили разбавлением исходного раствора хлороводородной кислотой.
Сорбент силохром С-120 фракция 0,1-0,2 мм, удельная поверхность 120 м2
/г, диаметр пор 45 нм.
2.2 Методика эксперимента
2.2.1 Методика синтеза сорбента
Сорбенты получали методом последовательного закрепления на поверхности силохрома С-120 полигексаметиленгуанидин гидрохлорида (ПГМГ ГХ) с концентрациями 0,1 и 1 г/л и органического реагента арсеназо I (рисунок 3).
Таким же методом были получены сорбенты с закрепленными на поверхности поли-(4,9-диоксадодекан-1,12-гуанидин) хлорида (ПДДГ), полигексаметиленгуанидин фосфата (ПГМГ Ф) и органического реагента арсеназо I.
Навеску силохрома С-120 (10 г) обрабатывали раствором щелочи рН 9-10 для активации поверхности (образование силанольных групп). Далее сорбент промывали дистиллированной водой до рН 7 раствора. С помощью перистальтического насоса MasterFlexL/S добавляли раствор полигуанидина (С = 0,1 г/л и 1 г/л). Концентрацию растворов гуанидинов до и после сорбции контролировали титриметрически с использованием додецилсульфата натрия и бромфенолового синего [12]. Сорбенты, модифицированные различными полигуанидинами (ПГ), промывали водой и высушивали в сушильном шкафу при 600
С.
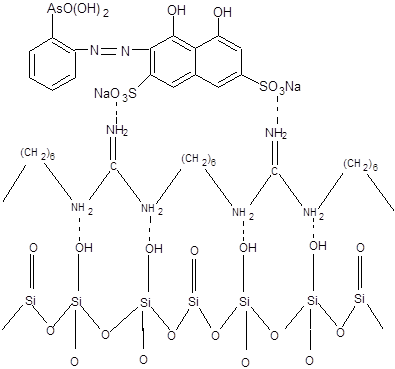
Рисунок 3 – Схематическое изображение модифицированного кремнезема
Для исследования сорбционной способности сорбента, обработанного полигуанидином, по отношению к реагенту арсеназо I в статическом режиме в градуированную пробирку с притертой пробкой вводили необходимое количество раствора арсеназо I. Затем добавляли HCl или NaOH для создания необходимой кислотности и доводили объем до 10 мл. pH контролировали на рН-метре s20 MettlerToledo. Вносили 0,1 г сорбента и встряхивали в течение 15 минут. Раствор отделяли от сорбента фильтрованием. Контроль за распределением органического реагента осуществляли по анализу водной фазы спектроскопически (λ=502 нм) на спектрометре PerkinElmerLambda 950.
Степень извлечения (R, %) исследуемого реагента рассчитывали по формуле 1.
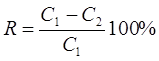 ,(1) ,(1)
где С1
– концентрация арсеназо I до сорбции (мкг/мл), С2
– концентрация после сорбции (мкг/мл), R – процентное извлечение.
Сорбционную ёмкость сорбента по отношению к органическому реагенту рассчитывали по формуле 2.
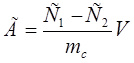 ,(2) ,(2)
где С1
– концентрация арсеназо I до сорбции (моль/л), С2
– концентрация после сорбции (ммоль/л), mc
– масса сорбента (г), V – объем аликвоты (л).
2.2.2 Методика сорбционного концентрирования меди (II) с использованием кремнезема, нековалентно-модифицированного арсеназо I
Для исследования сорбционной способности сорбента, модифицированного арсеназо I, по отношению к ионам меди (II) в статическом режиме в градуированную пробирку с притертой пробкой вводили необходимое количество раствора хлорида меди (II). Затем добавляли HCl или NaOH для создания необходимой кислотности и доводили объем до 10 мл. pH растворов контролировали на рН-метре s20 MettlerToledo. Вносили 0,1 г сорбента и встряхивали в течение 15 минут. Раствор отделяли от сорбента фильтрованием. Контроль за распределением металла осуществляли по анализу водной фазы атомно-эмиссионным методом на атомно-эмиссионном спектрометре с индуктивно связанной плазмой iCAP – 6500 фирмы ThemoScientificCorp и на атомно-абсорбционном спектрометре «МГА-915».
Степень извлечения (R, %) исследуемого металла рассчитывали по формуле 1, а сорбционную ёмкость сорбента, модифицированного арсеназо I, по отношению к раствору хлорида меди – по формуле 2.
2.3 Влияние кислотности среды на степень сорбционного извлечения арсеназо I
С целью определения оптимальной кислотности среды для максимального извлечения арсеназо Iв ряд мерных пробирок с притертыми пробками вносили 0,5 мл раствора арсеназо I(Сарсеназо
I
= 1 г/л). Далее проводили операции по методике, указанной в разделе 2.2.1. Кислотность среды варьировали от рН 1,5 до pH 7.
Рассчитывали степень извлечения (формула 1) и строили зависимость в координатах: степень извлечения (R, %) – кислотность среды (pH) (рисунок 4).
Из данного рисунка следует, что максимальная степень извлечения арсеназо I (80%), наблюдается для сорбента, обработанного ПГМГ ГХ при рН 3 – 4. Для сорбентов обработанных, ПДДГ и ПГМГ Ф, степень извлечения при рН 2 – 3 составила 50 и 20 % соответственно. В сильнокислой области и при переходе в область нейтрального pH степень извлечения монотонно убывает.
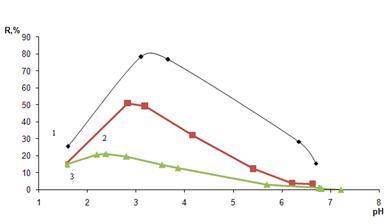
(1) – ПГМГ ГХ; (2) – ПДДГ; (3) – ПГМГ Ф; С(ПГ) = 0,1 г/л; С(арсеназо I)=1 г/л; mc
=0,1г; t=15 мин
Рисунок 4 – Зависимость степени сорбционного извлечения арсеназо I кремнеземом, модифицированным ПГ, от кислотности среды
2.4 Изотермы сорбции арсеназо Iна кремнеземах, модифицированных различными полигуанидинами
В экспериментально определенных оптимальных условиях строили изотермы сорбции арсеназо I на сорбентах, модифицированных полигуанидинами (ПГ) (рисунок 5,6). Время установления сорбционного равновесия во всех случаях не превышало 15 минут. Сорбционную емкость рассчитывали по формуле 2.
Из приведенных изотерм сорбции (рисунок 5), видно, что при равной концентрации всех полигуанидинов (0,1 г/л), которыми обрабатывали сорбенты, сорбционная емкость различается. И составляет для сорбента, обработанного ПГМГ ГХ – 2,5 мкмоль/г; ПДДГ – 1,7 мкмоль/г; ПГМГ Ф – 0,6 мкмоль/г. Скорее всего это связанно с тем, что в различных полигуанидинах, содержится различное количество олигомеров, которые прочно закрепляются на поверхности кремнезема. И при этом эти олигомеры занимают не всю поверхность сорбента.

(1) – ПГМГ ГХ; (2) – ПДДГ; (3) – ПГМГ Ф; С(ПГ) = 0,1 г/л; mc
=0,1 г; t=15 мин; (1) – рН 3-4; (2), (3) – рН 2 - 3
Рисунок 5 - Изотерма сорбции арсеназо Iкремнеземом, модифицированным ПГ
Как видно из ниже приведенного рисунка, при концентрации полигуанидинов 1 г/л, сорбционная емкость трех сорбентов практически одинакова и составляет 7 мкмоль/л. Вероятнее всего, это свидетельствует о том, что при данной концентрации полимеров, в растворах содержится достаточное количество олигомеров, прочно удерживаемых на сорбенте, и при этом они занимают всю поверхность сорбента.
Так же было установлено, что при пропускании через кремнезем, модифицированный арсеназо I, 25 мл раствора хлорида натрия (С = 10 г/л) либо 1 М раствора хлороводородной кислоты, органический реагент в незначительной степени десорбировался с поверхности кремнезема. Таким образом, при подборе оптимальных условий данный модифицированный сорбент можно использовать и в сильнокислых областях.
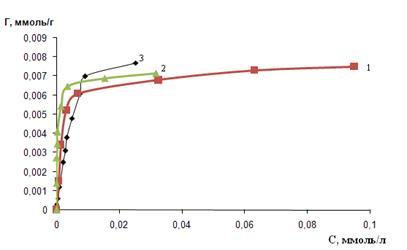
(1) – ПГМГ; (2) – ПДДГ; (3) – ПГМГ Ф; С(ПГ) = 1 г/л; mc
=0,1г; t=15 мин; (1) – рН 3-4; (2), (3) – рН 2 - 3
Рисунок 6 - Изотерма сорбции арсеназо I кремнеземом, модифицированным ПГ
2.5 Влияние кислотности среды на степень сорбционного извлечения меди (II)
С целью определения оптимальной кислотности среды для максимального извлечения Cu (II) в ряд мерных пробирок с притертыми пробками вносили 1 мл раствора (СCu
(
II
)
= 5 мкг/мл), добавляли HCl или NaOH для создания необходимой кислотности и дистиллированную воду до объема 10 мл. Кислотность среды варьировали от рН 2 до pH 7. Далее проводили операции по методике, указанной в разделе 2.2.2. Рассчитывали степень извлечения и строили зависимость в координатах: степень извлечения (R, %) – кислотность среды (pH) (рисунок 7).
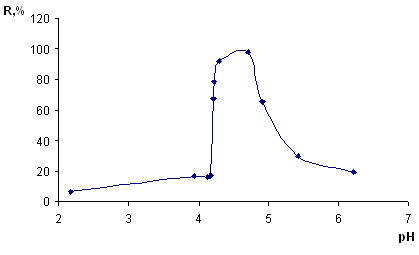
mc
=0,1г; t=15 мин; С(Сu (II))= 5 мкг/мл
Рисунок 7 – Зависимость степени сорбционного извлечения меди (II) кремнеземом, модифицированным арсеназо I, от кислотности среды
Из данного рисунка видно, что оптимальный диапазон извлечения меди (93-95%) pH 4,3 – 4,9.
2.6 Изотерма сорбции меди (II) сорбентом, модифицированным арсеназо I, из хлоридных растворов
Важной количественной характеристикой сорбента является сорбционная ёмкость. Она характеризует максимально возможное количество ионов металла, которое сорбент способен извлекать из раствора в оптимальных условиях.
В экспериментально определенных оптимальных условиях построена изотерма сорбции (рисунок 8). Время установления сорбционного равновесия не превышало 15 минут.
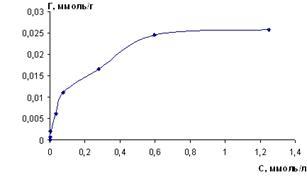
mc
=0,1г; t=15 мин; рН 4,5-5,0
Рисунок 8 – Изотерма сорбции меди (II) сорбентом из хлоридных растворов
Из горизонтального участка изотермы определена сорбционная емкость сорбента, которая составляет 0,025 ммоль/г.
ВЫВОДЫ
1. Проведен анализ литературных данных по способам модифицированния кремнезема и сорбционным свойствам таких сорбентов.
2. Исследовано влияние природы и концентрации полигуанидинов на сорбционные характеристики сорбента.
3. Определены оптимальные условия для максимального извлечения арсеназо I, кремнеземами, модифицированными полигуанидинами. Время установления сорбционного равновесия составило 15 мин; оптимальный диапазон pH для сорбента, модифицированного полигексаметиленгуанидин гидрохлоридом (ПГМГ ГХ) составил 3 – 4, для поли-(4,9-диоксадодекан-1,12-гуанидин) хлорида (ПДДГ) и полигексаметиленгуанидин фосфата (ПГМГ Ф) – 2-3.
4. Построены изотермы сорбции арсеназо I на кремнеземах, обработанных различными растворами полигуанидинов с концентрациями 0,1 и 1 г/л. Исходя из горизонтальных участков изотерм, определены сорбционные емкости, при концентрации растворов полигуанидинов 0,1 г/л они составили соответственно 2,5; 1,7; 0,6 мкмоль/г для ПГМГ ГХ, ПДДГ и ПГМГ Ф. Для сорбентов, обработанных растворами полигуанидинов с концентрацией 1 г/л сорбционная емкость примерно одинакова и составила 7 мкмоль/г.
5. Определены оптимальные условия для сорбционного концентрирования Cu (II) их хлоридных растворов кремнеземом последовательно модифицированным полигексаметиленгуанидин гидрохлоридом и арсеназо I. Время установления сорбционного равновесия составило 15 мин, максимальное извлечение меди (93 – 95%) достигается в диапазоне pH 4,3 – 4,9.
6. Построена изотерма сорбции Cu (II) из хлоридных растворов сорбентом нековалентно-модифицированным арсеназо I. Из горизонтального участка изотермы определена емкость сорбента по отношению к меди (II) и составляет 0,025 ммоль/г.
СПИСОК ЛИТЕРАТУРЫ
1. Зайцев, В.Н. Химически модифицированные кремнеземы/ В.Н.Зайцев. – Киев: Киевский университет, 2005. − 240 с.
2. Подчайнова, В.Н. Аналитическая химия элементов. Медь/ В.Н. Подчайнова, Л.Н. Симонова. – М.: Наука, 1990.— 279 с.
3. Золотов, Ю.А. Сорбционное концентрирование микрокомпонентов для целей химического анализа / Ю.А.Золотов, Г.И.Цизин, Е.И.Моросанова, С.Г.Дмитриенко// Успехи химии. – 2005. – Т.74, № 1. – С. 41–66.
4. Айлер, Р. Химия кремнезема: пер.с англ./ Р.Айлер. – М.: Мир, 1982.Ч.2. – 712 с.
5. Потапова, Н.О. Силикагели, химически модифицированные аминосоединениями/ Н.О.Потапова, А.С.Гурова, В.Е.Шредер. – Томск: ТГТУ, 2008. – С.74 – 76.
6. Jal, P.K. Chemical modification of silica by immobilization of functional groups for extractive concentration of metal ions/ P.K.Jal, S.Patel, B.K.Mishra // Talanta. – 2004. – Vol.62. – P. 1005–1028.
7. Лосев, С.С. Применение природного кремнезема – диатомита Celite 545 для количественного определения ионов Со2+
/ С.С.Лосев // Вестник УжНУ. Серия химия. – 2009. – вып. 22 – С.118-122.
8. Nahhal, I.M. Synthesis, characterization and applications of immobilized iminodiacetic acid-modified silica/ I.M.Nahhal, F.R.Zaggout, M.A.Nassar // J. Sol-Gel Sci. Techn. – 2003. – Vol.28. – P.255–265.
9. Лисичкин, Г.В. Химия привитых поверхностных соединений/ Г.В.Лисичкина, А.Ю.Фадеев, А.А.Сердан, П.Н.Нестеренко, П.Г.Мингалев,
Д.Б.Фурман. — М.: ФИЗМАТЛИТ, 2003. – 592 с.
10. Саввин, С.Б. Органические реагенты группы арсеназо III/ С.Б.Саввин. – М.: Атомиздат, 1971. – 352 с.
11. Нижник, Т.Ю. Полигуанидины как реагенты комплексного действия/ Т.Ю.Нижник, И.М.Астрелин, Н.М.Толстопалова. – Киев: Киевский политехнический институт, 2007. – 42 с.
12. Ложкина, О.В. Инструкция по применению дезинфицирующего средства (кожного антисептика) «Триосепт-Аква»/ О.В.Ложкина, Е.И.Воробьева, А.Г.Афиногенова, Г.Е.Афиногенов. – СПб.: ООО «НПО СпецСинтез», 2007. – С.5-6.
|