МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ
Кафедра «Прикладна екологія та охорона навколишнього середовища»
КУРСОВА РОБОТА
з дисципліни «ЗАГАЛЬНА ТА НЕОРГАНІЧНА ХІМІЯ»
на тему:
«Сірка та її сполуки»
Виконавець:
студент групи __________ ____________ _______________
Керівник:
__________________________________ _______________
Донецьк, 2009
РЕФЕРАТ
Курсова робота: ______________________________________
Метою роботи є вивчення фізичних та хімічних властивостей сірки, а також її сполук.
У роботі розглянутіосновні властивості елементу та його сполук. Описані їх фізичні властивості, а також хімічні властивості згідно відомої будови елементу, та його сполук. Наведені схеми отримання елементу у чистому вигляді, отримання сірчаної кислоти, як важливого продукту сучасного виробництва.
СІРКА, ОКСИДИ СІРКИ, ДІОКСИД СІРКИ, СІРЧАНА КИСЛОТА, СІРКОВОДЕНЬ, СУЛЬФІДИ, СІРКОВУГЛЕЦЬ
ЗМІСТ
Вступ…………………………………………………………………………………5
1. Історія відкриття елементу…………………………………………………..6-7
2. Находження елементу у природі
Характеристика природніх сполук (мінералів)………………………………..7-8
3. Засоби одержання елементів у чистому вигляді…………………………...8
4. Фізичні та хімічні властивості елементу…………………………………...9-12
5. Сполуки………………………………………………………………………13-18
6. Основні властивості елементу та його сполук……………………………..
7. Застосування простої речовини та сполук елемента………………………
Висновки…………………………………………………………………………….
Перелік посилань…………………………………………………………………...
ВСТУП
Сірка відома людству з якнайдавніших часів. Зустрічаючись в природі у вільному стані, вона звертала на себе увагу характерним жовтим забарвленням, а також тим різким запахом, яким супроводжувалося її горіння. Вважалося також, що запах і блакитне полум'я, що розповсюджується сіркою, що горить, відгонять демонів. Сірчистий ангідрид – задушливий газ, що утворюється при горінні сірки, ще в старовині використовувався для вибілювання тканин. При розкопках Помпеї знайшли картину, на якій зображено деко з сіркою і пристосування для підвішування над ним матерії. Відвіку уживалася сірка і її з'єднання для приготування косметичних засобів і для лікування шкірних захворювань. І дуже давно її почали використовувати для військових цілей. Так, в 670 році захисники Константинополя спалили арабський флот за допомогою “грецького вогню ”; це була суміш селітри, вугілля і сірки. Ті ж речовини входили до складу чорного пороху, що застосовувався в Європі в середні віки і до кінця XIX ст.
Сірчана кислота, одне з найважливіших сполук сірки, була відкрита, мабуть, до X в, починаючи з XVIII століття, її проводять в промислових масштабах і незабаром вона стає найважливішим хімічним продуктом, необхідним і в металургії, і в текстильній промисловості, і в інших, самих різних галузях. У зв'язку з цим почалися ще інтенсивніші пошуки родовищ сірки, вивчення хімічних властивостей сірки і її сполук і вдосконалення методів їх витягання з природної сировини.[6]
1. ІСТОРІЯ ВІДКРИТТЯ ЕЛЕМЕНТУ
Сірка (англ. Sulfur, франц. Sufre, нім. Schwefel) в самородному стані, а також у вигляді сірчистих сполук відома з самих якнайдавніших часів. Із запахом сірки, що горить, задушливою дією сірчистого газу і огидним запахом сірководня чоловік познайомився, ймовірно, ще в доісторичні часи. Саме через ці властивості сірка використовувалася жерцями у складі священних курінь при релігійних обрядах. Сірка вважалася твором надлюдських істот зі світу духів або підземних богів. Дуже давно сірка почала застосовуватися у складі різних горючих сумішей для військових цілей. Вже у Гомера описані "сірчисті випаровування", смертельна дія виділень сірки, що горить. Сірка, ймовірно, входила до складу "грецького вогню", що наводив жах на супротивників. Біля VIII ст. китайці почали використовувати її в піротехнічних сумішах, зокрема, в суміші типу пороху. Горючість сірки, легкість, з якою вона з'єднується з металами з утворенням сульфідів (наприклад, на поверхні шматків металу), пояснюють те, що її вважали "принципом горючості" і обов'язковою складовою частиною металевих руд. Пресвітер Теофіл (XI ст.) описує спосіб окислювального випалення сульфідної мідної руди, відомий, ймовірно, ще в давньому Єгипті. В період арабської алхімії виникла ртутно-сірчана теорія складу металів, згідно якої сірка почиталася обов'язковою складовою частиною (отцем) всіх металів. Надалі вона стала одним з трьох принципів алхіміків, а пізніше "принцип горючості" з'явився основою теорії флогістона. Елементарну природу сірки встановив Лавуазье в своїх дослідах по спалюванню. З введенням пороху в Європі почався розвиток здобичі природної сірки, а також розробка способу отримання її з піритів; останній був поширений в стародавній Русі. Вперше в літературі він описаний у Агріколи. У літературі алхімічного періоду сірка часто фігурує під різними таємними назвами. У Руланда можна знайти, наприклад, назви Zarnec (пояснення "яйця з вогнем"), Thucios (жива сірка), Terrafoetida, spiritusfoetens, Scorith, Pater і ін. Староруська назва "сірка" уживається вже дуже давно. Під ним малися на увазі різне пальне і погано пахнучі речовини, смоли, фізіологічні виділення (сіра у вухах та ін.). Мабуть, ця назва походить від санскритського сirа (ясно-жовтий). З ним пов'язано слово "сірий", тобто невизначеного кольору, що, зокрема, відноситься до смол. Друга староруська назва сірі - жупел (сіра горюча) - теж містить в собі поняття не тільки горючості, але і поганого запаху. Як пояснюють філологи, німий. Schwefel має санскритський корінь swep (спати, англо-саксонське sweblan - вбивати), що, можливо, повя’зано з отруйними властивостями сірчистого газу.[4]
2. НАХОДЖЕННЯ ЕЛЕМЕНТУ У ПРИРОДІ
ХАРАКТЕРИСТИКА ПРИРОДНИХ СПОЛУК (МІНЕРАЛІВ)
Сірка знаходиться в VI групі третього періоду періодичної системи.
Сірка - активний неметал. Серед металів тільки золото, платина і рутеній не взаємодіють з сіркою.
Сірка відноситься до вельми поширених елементів: земна кора містить 4,7*10% сірки по масі (15-е місце серед інших елементів), а Земля в цілому - багато більше
(0,7 %). Головна маса сірки знаходиться в глибинах землі, в її мантії-шарі, розташованому між земною корою і ядром Землі. Тут, на глибині приблизно 1200-3000 км. залягає могутній шар сульфідів і оксидів металів. У земній корі сірка зустрічається як у вільному стані, так і, головним чином, у вигляді з'єднань сульфідів і сульфатів. З сульфідів в земній корі найбільш поширені пірит FeS2
, халькопірит FeCuS2
, свинцевий блиск (галеніт) PbS, цинкова обманка (сфалерит) ZnS. Великі кількості сірки зустрічаються в земній корі у вигляді труднорастворимых сульфатів - гіпсу CaSO4
·2H2
O, бариту BaSO4
, в морській воді поширені сульфати магнію, натрію і калію.
Цікаво, що в стародавні часи геологічної історії Землі (близько 800 млн. років назад) сульфатів в природі не було. Вони утворилися як продукти окислення сульфідів, коли в результаті життєдіяльності рослин виникла киснева атмосфера. У вулканічних газах виявляють сірководень H2
S і сірчистий ангідрид SO2
. тому самородная сірка, що зустрічається в районах, близьких до вулканів (Сіцилія, Японія), що діють, могла утворитися при взаємодії цих двох газів:
2H2
S + SO2
=> 3S + 2H2
O.
Інші поклади самородної сірки пов'язані з життєдіяльністю мікроорганізмів.
Мікроорганізми беруть участь в багатьох хімічних процесах, які в цілому складають круговорот сірі в природі. При їх сприянні сульфіди окислюються до сульфатів, сульфати поглинаються живими організмами, де сірка відновлюється і входить до складу білків і інших життєво важливих речовин. При гнитті відмерлих залишків організмів білки руйнуються, і виділяється сірководень, який далі окислюється або до елементарної сірки (так і утворюються поклади сірі), або до сульфатів. Цікаво, що бактерії і водорості, що окисляють сірководень до сірки збирають її в своїх клітках. Клітки таких мікроорганізмів можуть на 95% складатися з чистої сірки.[1]
Встановити походження сірки можна по наявності в ній її аналога - селену: якщо в самородной сірці зустрічається селен, то сірка вулканічного походження, якщо немає - біогенного, оскільки мікроорганізми уникають включати селен в свій життєвий цикл. Природу сірки встановив А. Л. Лавуазье і включив її в список простих неметалічних тіл (1789). У 1822 Е. Мічерліх виявив алотропію сірки.
Мета моєї роботи полягає в тому, щоб показати вплив сірки і її з'єднань на екологію в цілому, на здоров'я людей, стан флори і фауни в умовах постійних або короткочасних викидів їх в навколишнє середовище. Дану тему я вважаю дуже актуальною, оскільки, в не такому благополучному в екологічному плані районі як наше місто не рідкісні викиди сірчистого газу, сірководня, метилмеркаптану, пилу та ін.[2]
3. ЗАСОБИ ОДЕРЖАННЯ ЕЛЕМЕНТІВ У ЧИСТОМУ ВИГЛЯДІ
Промислові способи отримання простих речовин залежать від того, в якому вигляді відповідний елемент знаходиться в природі, тобто що може бути сировиною для його отримання. Так, кисень, що є у вільному стані, одержують фізичним способом - виділенням з рідкого повітря. Самородна сірка містить сторонні речовини, для відділення яких користуються здатністю сірки легко плавитися. Проте сірка, отримана виплавкою з руди (комова сірка), зазвичай містить ще багато домішок. Подальше її очищення проводять перегонкою в рафінувальних печах, де сірка нагрівається до кипіння. Пари сірки поступають у викладену цеглиною камеру. Спочатку, поки камера холодна, сірка прямо переходить в твердий стан і осідає на стінках у вигляді ясно-жовтого порошку (сірчаний колір
). Коли камера нагріється вище 120°C, пари конденсуються в рідину, яку випускають з камери у форми, де вона і застигає у вигляді паличок. Отримана таким чином сірка називається живцевою
.
Важливим джерелом отримання сірки служить залізний колчедан
FeS2
, званий також піритом
, і поліметалічні руди, що містять сірчисті з'єднання міді, цинку і інших кольорових металів. Деяку кількість сірки (газова сірка) отримують з газів, що утворюються при коксуванні і газифікації вугілля.
4. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ ЕЛЕМЕНТУ
Будова атома
Розміщення електронів по рівнях і підрівнях
 |
1S2
2P2
2P6
3S2
3P4
|
Розміщення електронів по
орбіталях (останній шар) |
Ступінь
окислення |
Валентність |
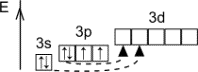 |
+2, -2
|
II |
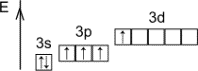 |
+4
|
IV |
 |
+
6 |
VI |
Фізичні властивості
.
Сірка — тверда крихка речовина жовтого кольору. У воді практично нерозчинна, але добре розчиняється в сірковуглеці, аніліні і деяких інших розчинниках. Погано проводить теплоту і електрику. Сірка утворює декілька алотропних модифікацій — сіра ромбічна, моноклінна, пластична.
Найбільш стійкою модифікацією є ромбічна сірка, в неї мимоволі через деякий час перетворюється решта всіх модифікацій.
При 444,6 °С сірка кипить, утворюючи пари темно-бурого кольору. Якщо їх швидко охолодити, то виходить тонкий порошок, що складається з найдрібніших кристалів сірки, званий сірчаним кольором.
Природна сірка складається з суміші чотирьох стійких ізотопів: Температура плавлення 112,8 °C. При плавленні сірка перетворюється на рухому жовту рідину, яка вище 160 °C буріє, а близько 190 °C стає в'язкою темно-коричневою масою. Вище 190°C в'язкість зменшується, а при 300 °C сірка знов стає жидкотекучей. Це обумовлено зміною будови молекул: при 160 °C кільця S8 починають розриватися, переходячи у відкриті ланцюги; подальше нагрівання вище 190 °C зменшує середню довжину таких ланцюгів.
Якщо розплавлену сірку, нагріту до 250-300 °C, влити тонким струменем в холодну воду, то виходить коричнево-жовта пружна маса (пластична сірка). Вона лише частково розчиняється в сірковуглеці, в осіданні залишається рихлий порошок.
У парах при температурі кипіння, окрім молекул S8, існують також S6, S4 і S2. При подальшому нагріванні крупні молекули розпадаються, і при 900°C залишаються лише S2, які приблизно при 1500°C помітно диссоціюють на атоми. При заморожуванні рідким азотом сильно нагрітої пари сірки виходить стійка нижче - 80°C пурпурна модифікація, утворена молекулами S2.
Сіра - поганий провідник тепла і електрики.
Конфігурація зовнішніх електронів атома S 3s23p4
. У з'єднаннях сірка проявляє ступені окислення -2, +4, +6.
Сірка хімічно активна і особливо легко при нагріванні з'єднується майже зі всіма елементами, за винятком N2
, I2
, Au, Pt і інертних газів.
Але вже на холоді сірка енергійно з'єднується з F2
з утворенням гексафторида сірки SF6
, при нагріванні реагує з Cl2
, з бромом сірка утворює тільки S2
Br2
, йодіди сірки нестійкі. При нагріванні (150 - 200 °C) наступає оборотна реакція з H2
з отриманням сульфіду водню. Сірка утворює також сульфани загальної формули H2
Sx, де х=1-23
. Всі сульфани є рідинами (за винятком H2
S1
) жовтого кольору із задушливим запахом. При тривалому зберіганні сульфани перетворюються в гомологи, багатші сіркою, а при нагріванні розкладаються з виділенням сірководня і сульфанів з меншим числом атомів сірки.
Пароподібна сірка реагує з вуглецем при температурі 800-900 °C, перетворюючись на сірковуглець, а при сплаві з фосфором утворює нестехіометричні сульфіди складу PnSx, де х=3-7
.
Хімічні властивості
1) Сірка реагує з лужними металами без нагрівання:
2Na + S=>Na2
S
з рештою металів (окрім Au, Pt) - при підвищеній t:
2Al + S => Al2
S3
Zn + S => ZnS
2) З деякими неметалами сірка утворює бінарні з'єднання:
H2
+ S =>H2
S
2P + 3S =>P2
S3
C + 2S =>CS2
Відновні властивості сірка проявляє в реакціях з сильними окислювачами:
(S – 2e => S+2
; S – 4e => S+4
; S – 6e => S+6
)
3) з киснем:
S + O2
=> S+4
O2
2S + 3O2
=> 2S+6
O3
4) з галогенами (окрім йоду):
S + Cl2
=> S+2
Cl2
5) з кислотами - окислювачами:
S + 2H2
SO4
(конц) => 3S+4
O2
+ 2H2
O
S + 6HNO3
(конц)=>H2
S+6
O4
+ 6NO2
+ 2H2
O
Реакції диспропорціонування:
6)
3S0
+ 6KOH =>K2S+4
O3 + 2K2
S-2
+ 3H2
O
7) сірка розчиняється в концентрованому розчині сульфіту натрію:
S0
+ Na2
S+4
O3
=>Na2
S2
O3
тиосульфат натрію
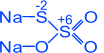
Застосування
Вулканізація каучуку, отримання ебоніту, виробництво сірників, пороху, в боротьбі з шкідниками сільського господарства, для медичних цілей (сірчані мазі для лікування шкірних захворювань), для отримання сірчаної кислоти і так далі.
5. СПОЛУКИ
Сполуки з киснем
Всі кисневі з'єднання сірки є екзотермічними.
Оксиди: відомі як вищі, так і нижчі оксиди сірки. До останніх
відносяться такі нестійкі оксиди, як S2
O3
і S2
O. Наприклад, S2
O утворюється в зоні електричного розряду, що проходить в атмосфері SO2
, і миттево розкладається:
2S2
O=>3S + SO2
аналогічно диспропорціонує і S2
O3
2S2
O3
=> S + 3SO2
.
З вищих оксидів сірки найбільш вивчені SO2
- оксид сірки IV (сірчистий ангідрид) і SO3
-оксид сірки VI (ангідрид сірчаної кислоти).
Діоксидом сірки є безбарвний газ з різким запахом, Тпл = -75 С, Ткип = -10 С. Він дуже термічно стійкий (розпадається на S і O2
при 2800 С). Діоксид сірки розчинимо у воді причому розчинність його під час переходу температури від 0 до кімнатної знижується. При розчиненні відбувається утворення гідрата SO2
· хН2
О, що нестехіометричного по складу, володіє властивостями слабкої кислоти:
SO2
· хН2
О + Н2
О => Н3
О+
+ НSО3
Ка= 1,54·10-2 (при 25є)
Абсолютно сухий діоксид сірки в звичайних умовах не взаємодіє з галогенами, H2
S, H2
, O2
і З. Реакція :
2SO2
+ O2
=> 2SO3
протікає тільки при високих температурах, у присутності каталізатора. Діоксид сірки у водному розчині взаємодіє HNO2
і N2
O3
:
2SO2
+ N2
O3
+ Н2
O => H2
SO4
+ 2NO
2HNO2
+ SO2
· хН2
О =>H2
SO4
+ 2NO + xH2
O
У більшості реакцій він проявляє відновні властивості:
2HNO3
+ SO2
=>H2
SO4
+ 2NO2
NO2
+ SO2
=>SO3
+ NO; Н2
O2
+ SO2
=>H2
SO4
Окислювальні властивості діоксиду сірки виявляються при взаємодії його з сірководнем і оксидом вуглецю (II):
2Н2
S + SO2
=> 3S + 2Н2
О;
2СО + SO2
=>S+ 2CO2
Сульфіди
Отримання
1) Багато сульфідів отримують нагріванням металу з сіркою:
Hg + S =>HgS
2) Розчинні сульфіди отримують дією сірководня на лузі:
H2
S + 2KOH =>K2
S + 2H2
O
3) Нерозчинні сульфіди отримують обмінними реакціями:
CdCl2
+ Na2
S =>2NaCl + CdS
Pb (NO3
)2
+ Na2
S => 2NaNO3
+ PbS
ZnSO4
+ Na2
S =>Na2
SO4
+ ZnS
MnSO4
+ Na2
S =>Na2
SO4
+ MnS
2SbCl3
+ 3Na2
S =>6NaCl + Sb2
S3
SnCl2
+ Na2
S => 2NaCl + SnS
Хімічні властивості
1) Розчинні сульфіди сильно гідролізовані, унаслідок чого їх водні розчини мають лужну реакцію:
K2
S + H2
O =>KHS + KOH
S2-
+ H2
O =>HS-
+ OH-
2) Сульфіди металів, що стоять у ряді напруги лівіше заліза (включно), розчиннів сильних кислотах:
ZnS + H2
SO4
=>ZnSO4
+ H2
S
Нерозчинні сульфіди можна перевести в розчинний стан дією концентрованої HNO3
:
FeS2
+ 8HNO3
Е Fe(NO3
)3
+ 2H2
SO4
+ 5NO + 2H2
O
3) Водорозчинні сульфіди розчиняють сірку з утворенням полісульфідів:
Na2
S + S =>Na2
S
Полісульфіди при окисленні перетворюються на тиосульфати, наприклад:
2Na2
S2
+ 3O2
=> 2Na2
S2
O3
Кислоти
Сірчана кислота є маслянистою рідиною з Тпл = 10 С і Ткип = 280 С. Її молекули представлені тетраедрами, зв'язаними між собою атомом кисню:
HO O
S
HO O
Сірчана кислота у водних розчинах є сильною двоосновною. Концентрована сірчана кислота є сильним окислювачем. Залежно від виду відновника реакції можуть закінчуватися виділенням SO2
, H2
S і елементарної сірки.
H2
SO4
(конц.) + H2
S => S + SO2
+ H2
O
H2
SO4
(конц.) + Cu => SO2
+CuSO4
+ H2
O
H2
SO4
(конц.) + Mg => MgSO4
+ H2
S + H2
O
Сірчана кислота проявляє дегідратуючі властивості:
C12
H22
O11
+ H2
SO4
(конц.) => 12C + H2
SO4
+ 11
H2
O.
Також вона може взаємодіяти з оксидами азоту NO2
і N2
O3
:
H2
SO4
+ 2NO2
=> (NO)HSO4
+ HNO3
2H2
SO4
+ N2
O3
=> 2(NO) HSO4
+ H2
O.
з утворенням нитразилгидросульфата.
У звичайних умовах H2
SO4
пасивує Fe, Cr, Co, Ni. Тому її зберігають і транспортують в цистернах із сталі. В основному її отримують каталітичним окисленням SO2
киснем повітря до SO3
з подальшою абсорбцією SO3
сірчаною кислотою щоб уникнути утворення туману. Окислення проводять при 500°С у присутності каталізатора V2
O5
з добавками K2
SO4
.
Дисіркова кислота H2
S2
O7
існує за звичайних умов у вигляді безбарвних прозорих кристалів (Tпл=35°С). При розчиненні у воді вона руйнується:
H2
S2
O7
+ H2
O => 2H2
SO4
Тому хімія її водних розчинів по суті є хімією сірчаної кислоти. Її отримують змішенням 100% H2
SO4
з розрахунковою кількістю SO3
, що відповідає реакції:
H2
SO4
+ SO3
=> 2H2
S2
O7
Динадсірчана кислота H2
S2
O8
виходить як проміжний продукт при електролізіH2
SO4
і використовується для отримання H2
O2
:
H2
S2
O8
+ H2
O =>H2
SO5
+ H2
SO4
H2
SO5
+ H2
O =>H2
O2
+ H2
SO4
Тиосірчана кислота H2
S2
O3
у вигляді безбарвної маслянистої рідини отримана тільки при температурах нижче -83°С у середовищі етилового ефіру за допомогою реакції приєднання:
H2
S + SO3
=>H2
S2
O3
коли окислювально-відновні процеси сильно загальмовані. Молекула її представляє спотворений тетраедр. У водних розчинах проявляє властивості сильної кислоти.
6. ОСНОВНІ ВЛАСТИВОСТІ ЕЛЕМЕНТУ ТА ЙОГО СПОЛУК
7. ЗАСТОСУВАННЯ ПРОСТОЇ РЕЧОВИНИ ТА СПОЛУК ЕЛЕМЕНТУ
Елементарну сірку одержують звичайно з природної самородної сірки. Для відокремлення сірки від сторонніх домішок її виплавляють в автоклавах. Автоклави — це залізні циліндри, в які завантажують руду і нагрівають перегрітим водяним паром до 150°С під тиском 6 атм.. Розплавлена сірка стікає вниз, а пуста порода залишається. Виплавлена з руди сірка ще містить певну кількість домішок.
Цілком чисту сірку одержують перегонкою у спеціальних печах, сполучених з великими камерами. Пари сірки в холодній камері відразу переходять в твердий стан і осідають на стінках у вигляді дуже тонкого порошку ясно-жовтого кольору. Коли ж камера нагрівається до 120°С, то пари сірки перетворюються в рідину. Розплавлену сірку розливають у дерев'яні циліндричні форми, де вона і застигає. Таку сірку називають черенковою.
Сірка широко застосовується у різних галузях народного господарства, переважно у хімічній промисловості для виробництва сульфатної кислоти H2SO4, сірковуглецю CS2, деяких барвників і інших хімічних продуктів. Значні кількості сірки споживає гумова промисловість для вулканізації каучуку, тобто для перетворення каучуку в гуму. Сірку використовують також у сірниковому виробництві, в піротехніці, у виробництві чорного пороху тощо. У медицині сірка йде для виготовлення сіркової мазі при лікуванні шкіряних хвороб. У сільському господарстві сірковий цвіт застосовують для боротьби з шкідниками бавовнику і виноградної лози.
ВИСНОВОК
Хотілося б відзначити значення найбільш важливих з'єднань сірки.
Сірчана кислота застосовується у виробництві мінеральних добрив: суперфосфату і сульфату амонія (так на виробництво 1 т. суперфосфату витрачається близько 350 кг сірчаної кислоти, а на виробництво 1 т. сульфату амонія – 750 кг). Крім того, її застосовують для отримання різноманітних мінеральних кислот і солей, всіляких органічних продуктів, фарбників, дымообразующих і вибухових речовин, в нафтовій, металургійній, текстильній, шкіряній і інших галузях промисловості. Неабиякою мірою сірчану кислоту споживає лісохімічна промисловість.
Сірчисту кислоту використовують для білення шерсті, шовку і інших матеріалів, що не витримують вибілювання сильнішими окислювачами.
Сірчисті фарбники – клас фарбників, отримуваних нагріванням різних органічних сполук з сіркою або полисульфидами натрію – застосовують для фарбування целюлозних матеріалів.
Сірководень в основному застосовується для отримання елементарної сірки і сірчаної кислоти, для отримання сульфідів, меркаптану і тиофенов.
SO3
знаходить своє застосування як сульфуючого агента у виробництві багатьох органічних продуктів, олеуму. Крім того його застосовують для отримання хлор- і фторсульфоновою кислот і сульфурилхлорида.
SO2
головним чином йде на отримання сірчаної кислоти, також його застосовують в холодильних установках, при вибілюванні, рідкими SO2
застосовують в целюлозній промисловості.
Багато сірковмісних солей використовуються в сільському господарстві (Ca(H2
PO4
)2
+ CuSO4
простий суперфосфат, CuSO4
мідний купорос, FeSO4
залізний купорос, (NH4)2
SO4
сульфат амонія та ін.) як добрива, а також як засоби захисту від комах – шкідників і хвороб рослин (полисульфидыCa і Ba).
Сульфіди застосовуються у виробництві сірчаної кислоти і її солей. Сульфіди лужних і лужно– земельних металів застосовуються в хімічній і легкій промисловості, наприклад Na2
S застосовується як відновник органічних нітросполук з'єднань, зокрема для приготування сірковмісних фарбників. Суміші полисульфидов і тиосульфатов калія використовують для лікування шкірних захворювань.
Сульфіди міді, кадмію, а також рідкоземельних елементів застосовують як напівпровідники.
Сірковуглець знаходить своє застосування у виробництві віскозного шовку (початковим продуктом є катогенат целюлоза, отримуваний взаємодією CS2
з лужною целюлозою), крім того, похідний сірковуглеця K2
CS2
тіокарбонат калія застосовується в боротьбі з сільськогосподарськими шкідниками. Також сірковуглець застосовується при вулканізації каучуку, як екстрагент і в ін.
Сульфаміновая кислота H2
NSO2
OH застосовується в аналітичній хімії як стандарт ацидометрії і для визначення нитрит-ионов; її солі використовують як вогнезахисні просочення для паперу і текстильних матеріалів.
Деякі органічні сполуки сірки при інфекційних захворюваннях (сульфантрол, Сульфапіридин).
Цей список можна продовжувати і далі, але всіх речовин тих, що містять сірку (особливо органічних) просто не перечитати. Причому актуальність застосування з'єднань сірки настільки велика, що сьогодні з чималою часткою упевненості можна сказати про неможливість існування людства без них.
В даний час особливо в промислових районах сірковмісні речовини у величезних кількостях викидаються в навколишнє середовище. Хоча на виробництвах і застосовують спеціальні уловлювачі, але часто їх ефективність виявляється дуже низькою. Сама по собі сірка токсикантом немає, але такі її з'єднання як SO2
, H2
S, CH3
-SH, аерозолі сірчаної кислоти і ін. можуть зробити істотний негативний вплив на здоров'я людини і майбутнього покоління, а також негативно позначитися на нормальному стані рослинних організмів. Тому я вважаю, що ще є немало приводів для дослідження впливу з'єднань сірки в цілому на навколишнє середовище, на генофонд населення і т.д, а також до розробки нових методів і спеціальних установок що дозволяють понизити викиди сірковмісних з'єднань в навколишнє середовище.
ПЕРЕЛІК ПОСИЛАНЬ
1. Введение в современную теорию кислот и оснований. Мискиджьян С. П., Гарновский А. Д. Киев, Издательское объединение «Вища школа», 1979, 152с.
2. Ахметов Н. С. Неорганическая химия. Учебное пособие для учащихся 8-9 кл. шк. с углублением изуч. Xимии. В 2ч. – 3-е изд. – М.: Просвещение. 1992. – 191 с., 4 л. ил: ил. – ISBN 5-09-004168-7
3. Глинка Н. Л. Общая химия: Учебное пособие для вузов. – 25-е изд., исправленное/Под ред. В. А. Рабиновича. – Л.: Химия, 1986. – 704 с.
4. Хомченко Г. П. Химия для поступающих в вузы: Учебное пособие – М.: Высш. шк., 1985. – 367 с.
5. Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов /Н. Е. Кузьменко, В. В. Еремин, В. А. Попков. — М.: Издательство «Экзамен»,2005.
6. Учебный справочник школьника. Учебное издание. - М.: Дрофа, 2001
|