| Биогенез мембран
Введение
Рассмотрим процесс образования мембран. Этот процесс начинается с синтеза белковых и липидных компонентов, которые затем должны быть доставлены к месту назначения. Принимая во внимание все разнообразие мембран, существующих в типичной эукариотической клетке, можно сделать вывод, что для осуществления этого процесса необходимы необычайно точные механизмы.
Обсудим вопросы биогенеза мембранных белков. В принципе имеются две главные проблемы, касающиеся сборки мембранных белков.
1. Все закодированные в ядре белки синтезируются общим пулом рибосом. В связи с этим возникает вопрос: как отдельные мембранные белки доставляются к месту назначения? Чем отличаются белки плазматической мембраны от белков внутренней митохон-дриальной мембраны или от белков мембран эндоплазматического ретикулума? Эту сложную проблему сортировки можно решить только при наличии определенных сигнальных последовательностей в каждом полипептиде, а также соответствующего аппарата узнавания.
2. Каков истинный механизм встраивания мембранных белков в мембрану и как при этом достигается правильная их ориентация относительно мембранного бислоя? Требуют ли механизмы встраивания и ориентации также наличия определенных сигнальных элементов и систем узнавания и если да, то каковы они? Какие свойства обеспечивают при встраивании мембранных белков формирование правильной третичной, а также червертичной структуры в случае мультисубъедииичных ансамблей?
За последнее десятилетие в поиске ответов на все эти вопросы достигнуты большие успехи, причем они становятся все более значительными. Это в большой мере обусловлено тем, что для выяснения роли специфических сигнальных полипептидных последовательностей в этих процессах стала использоваться рекомбинантная ДНК. Хотя не на все вопросы удалось найти ответы, полученные результаты все больше убеждают в том, что совершенно разные на первый взгляд системы в действительности обладают фундаментальным сходством. Например, не так давно было показано, что механизм секреции белков имеет много общего с механизмом синтеза белков плазматической мембраны. Совсем недавно достигнут большой прогресс в понимании общих принципов переноса белков через мембраны митохондрий, эндоплазматического ретикулу-ма и грамотрицательных бактерий. Эти экспериментальные системы изучались наиболее интенсивно. И хотя между соответствующими процессами есть значительные различия, они имеют ряд общих особенностей.
1. Существует идентифицируемая часть полипептидной последовательности, которая служит участком узнавания, или «сигналом», направляющим отдельный полипептид к мембране, в которую он встраивается. Эти сигнальные участки часто расположены на N-конце новосинтезированного полипептида и отщепляются специфическими сигнальными пептидазами после встраивания его в нужную мембрану или переноса через нее. Для обозначения N-концевого сигнала различными авторами использовались следующие термины: сигнальный пептид, сигнальная последовательность, транзитный пептид, лидирующий пептид, пре-последовательность.
2. Процессы трансляции и встраивания белков в мембрану можно разделить в эксперименте. Для сборки мембранных белков в большинстве случаев необходима энергия, отличающаяся по величине от той, которая требуется для их трансляции на рибосоме. Замечено, что in vivo трансляция и перенос часто бывают тесно сопряжены во времени.
3. Связавшийся с мембраной-мишенью полипептид должен, кроме того, находиться в конформации, в которой может осуществляться его перенос через мембрану или встраивание в нее. Во многих случаях перенос белков через мембраны происходит от N-конца к С-концу, при этом необходимо, чтобы белок был по крайней мере частично развернут или слабо свернут. Полипептид может транспонироваться в вытянутой форме в ходе энергозависимого процесса.
Первая группа вопросов, которые мы рассмотрим, связана с сортировкой белков во время биогенеза и сборки. На рис. 10.1 представлена схема., иллюстрирующая всю сложность этой проблемы и суммирующая данные по эукариотическим клеткам и грамот-рицательным бактериям. Доставка каждого белка к месту назначения обеспечивается иерархией сигналов, закодированных в каждом полипептиде. Например, большинство белков, предназначенных для эндоплазматического ретикулума или митохондрий, синтезируется в виде предшественников большей молекулярной массы; на N-конце у них имеется дополнительная последователь-

ность, которая отщепляется особыми протеолитическими ферментами, имеющимися в этих органеллах. Такие первичные сигналы весьма разнообразны и необходимы для того, чтобы полипептиды были узианы при транслокации специфическими рецепторами в этих органеллах. Связывание с митохондриями происходит сразу после завершения трансляции. Однако для большинства белков, направляемых в эндоплазматический ретикулум в клетках млекопитающих, наблюдается иная картина. Как видно из рис. 10.1, после связывания белков с соответствующей органеллой должна произойти дальнейшая сортировка. Для этого нужна дополнительная информация, которая также должна быть закодирована в каждой полипептидной последовательности и может рассматриваться как вторичные сигналы. В нескольких случаях их удалось идентифицировать как сигнальные последовательности, физически отделенные от первичных, хотя, возможно, так бывает не всегда. Позже мы рассмотрим характерные примеры использования этих сигналов при сортировке белков.
Особый интерес для нас представляет процесс сборки мембранных белков, который целесообразно рассмотреть в связи с их сортировкой. На рис. 2 схематически показаны три общих механизма проникновения пептидного предшественника в мембрану. Механизмы А к Б являются вариантами схемы линейного вытеснения, согласно которой сигнальная последовательность направляет полипептид к переносящему устройству, которое включает в себя заполненный водой канал. Сигнальная последовательность может проходить прямо сквозь канал или оставаться связанной с мембраной, образуя, как показано на рис. 10.2, петлю. В отсутствие какого-либо сигнала остановки процесса переноса полипептид будет транспортироваться через мембрану целиком. Однако, если внутри полипептида имеется второй сигнальный пептид, называемый стогмигналом переноса, то процесс останавливается и стоп-сигнал переноса становится трансмембранным сегментом зрелого мембранного белка. Фиксируя белок в мембране, стоп-сигнал переноса действует как сигнал сортировки. Если в белке имеются и другие сигналы начала и конца переноса, то будут образовываться следующие трансмембранные сегменты. Рис. 10.3 показывает, как сочетание нескольких видов сигналов может направлять последовательность реакций таким образом, чтобы создавалось широкое разнообразие типов упаковки встраиваемых в мембрану белков эндоплазматического ретикулума. Заметим, что сигнальные последовательности, которые не удаляются протеолитиче-ским путем, остаются в начале трансмембранных сегментов и могут использоваться для инициации транспорта фланкирующих полнпептидных доменов на N- или С-конце. К сожалению, эта простая схема не является исчерпывающей, известны примеры, когда сигналы изменяют свою функцию в зависимости от обстоятельств или когда в правильном включении в мембрану существенную роль играют взаимодействия между предполагаемыми сигналами внутри полипептида.
Схема В на рис. 10.2 иллюстрирует возможную роль самопроизвольного включения в мембрану гидрофобных элементов полипептидного предшественника. Этот механизм может реализовываться только тогда, когда включение в мембрану происходит после трансляции полипептида. Первым примером, подтверждающим существование этого механизма, является пробелок оболочки фага М13. Модель самопроизвольного включения может использоваться для объяснения механизма встраивания поперек мембраны амфифильных а-спиралей или 0-структур. Этот процесс может также, конечно, быть белокзависимым.
О координации биосинтеза мембранных липидов и белков в про карнотитеских или эукариотических клетках известно немного. Установлено, впрочем, что в нескольких случаях сверхпродукция отдельных мембранных белков приводит к разрастанию внутриклеточных мембран, содержащих липиды и в преобладающем количестве — сверхпродуцированный белок. То обстоятельство, что пипидный состав разнообразных мембран в эука-риотической клетке существенно различается, позволяет задаться вопросом, как эти композиции липидов создаются и поддерживаются. Мы остановимся, в частности, на скорости обмена разных видов липидов между мембранами и возможных механизмах, облегчающих перенос липидов от места их синтеза к месту назначения. Наконец, известно, что липидный состав мембран многочисленных организмов варьирует при изменении внешних условий.

2. Общие особенности экзоцитозного пути
Экзоцитозным в эукариотических клетках называется путь, с помощью которого осуществляется транспорт белков, секретируемых клеткой или включаемых в наружную мембрану. Секретируемые белки синтезируются на связанных с мембранами рибосомах на ци-топлазматической поверхности шероховатого эндоплазматического ретикулума и выводятся из клетки с помощью того же механизма, который используется для включения мембранных белков в эндо-плазматический ретикулум. Если водорастворимый белок не имеет вторичных сигналов сортировки, то он транспортируется к клеточной поверхности и секретируется с помощью «конститутивного» пути. Этот путь экзоцитоза изучался с привлечением разных цитохимических методов, генетических подходов и биохимических исследований бесклеточных систем. Белки, транспортируемые этим путем, перемещаются из эндоплазматического ретикулума последовательно через различные компартменты комплекса Гольджи и в конце концов попадают на поверхность клетки. Они могут становиться компонентами цитоплазматиче-ской мембраны или, при наличии вторичных сигналов сортировки, оставаться в эидоплазматическом ретикулуме или в комплексе Гольджи. В комплексе Гольджи в ходе дальнейшей сортировки отделяются белки, секретируемые конститутивным путем, от тех, которые направляются в лизосомы или концентрируются в секреторных гранулах, с помощью которых они затем секретируются при соответствующей стимуляции клетки. Кроме того, обнаружено, что в наружной мембране ядерной оболочки также могут синтезироваться мембранные глнкопротеины, которые затем транспортируются с помощью экзоцитоза.
Белки при транспортировке по экзоцитозному пути подвергаются посттрансляционным модификациям, в частности гликозилиро-ванию. Хорошо изучена компартментация процессинга N-связанного олигосахарида, что очень помогло определению различных компонентов комплекса Гольджи. Олигосахаридный предшественник с высоким содержанием маннозы присоединяется по местам гликозилирования в полипептиде, когда белок находится внутри эндоплазматического ретикулума, а затем с помощью нескольких расположенных в различных компарт-ментах ферментов осуществляется процесс созревания. Это позволяет следить за превращением белков, определяя состояние их гликозирования. На рис. 10.5 представлен

процессинг олитосахаридного предшественника с высоким содержанием маннозы.
В исследованиях экзоцитозного пути был достигнут значительный прогресс благодаря использованию вирусов с оболочкой, в частности вируса везикулярного стоматита. Гликопротеин шиловидной структуры вируса везикулярного стоматита, называемый G-бел-ком, — это трансмембраниый белок, который синтезируется на рибосомах, связанных с эндоплазматическим ретикулумом, после инфекции. С помощью экзоцитозного пути G-белок попадает на плазматическую мембрану, где он участвует в образовании отпочковывающегося вируса. Инфицируя клетки этим вирусом, можно проследить за процессингом кодируемого вирусным геномом G-белка, что позволит исследовать экзоцитозный путь. Этот подход используется для идентификации везикул, участвующих во внутриклеточном транспорте, для изу-
 чения влияния гликозирования на доставку белков к клеточной поверхности, для исследования энергетики экзоцитозного транспорта и, что наиболее важно, для создания бесклеточной системы везикулярного внутриклеточного транспорта.
Эти исследования выявили несколько замечательных особенностей системы экзоцитозного транспорта.
1. Транспорт между различными компартментами органеллы осуществляется с помощью везикул, которые отпочковываются от «донорной» мембраны и потом сливаются с «акцепторной». Показано, что везикулы, участвующие в транспорте между компартментами комплекса Гольджи, являются «окаймленными», но соответствующий белок отличается от клатрина, окаймляющего эндоци-тозные везикулы. Имеются веские данные в пользу того, что клатрин не является существенным компонентом экзоцитозного пути, хотя он, по-видимому, необходим для нормального роста некоторых штаммов дрожжей. Степень общности ком-
поиентов эидоцитозного и экзоцитозного путей неясна, хотя некоторые везикулы, вероятно, функционируют в обоих случаях.
2. Для внутриклеточного транспорта необходим АТР, а также белковые компоненты цитозоля. Показано, что для транспорта между цистернами Гольджи, осуществляющегося при участии везикул, необходимо жирнокислотное производное ацил-СоА. Какую именно функцию выполняют указанные соединения в отпочковывании и слиянии везикул, неизвестно.
3. Роль олигосахарида как сигнала сортировки новосинтезиро-ванных гликопротеинов, по-видимому, непостоянна. Известны случаи, когда процессинг N-концевого углевода не является необходимым для экспрессии белка плазматической мембраны на клеточной поверхности. В других системах гликозилирование существенно для доставки белка к клеточной поверхности, например, оно необходимо для включения опсина в мембрану наружного сегмента палочки сетчатки. Во многих клетках млекопитающих сигналом сортировки для белков, направляемых в лизосомы, является маннозо-6-фосфат, однако для дрожжей это не характерно. В тех клетках млекопитающих, где маннозо-фосфат функционирует как сигнал сортировки, обнаружены два мембранных рецептора с высоким сродством к гликопротеинам, содержащим маннозо-6-фосфат, и клонированы их гены. Они играют ключевую роль в процессе переноса конкретных полипептидов в лизосомы, а один из этих рецепторов существен как для эндоцитоза, так и для экзоцитоза.

Исследование бесклеточной системы, изображенной на рис. 10.6, показало, что для изучения таких сложных систем полезно использовать специфические мутанты. Выделено множество мутантных штаммов дрожжей, дефектных по разным стадиям экзоцитозного пути, и некоторые из них использовались при создании бесклеточной системы транспорта между органеллами. Оказалось, что системы дрожжей и млекопитающих весьма сходны, и для исследования последних можно с успехом использовать му-тантные штаммы дрожжей. Наконец, обнаружено, что многие вирусы с оболочкой способны отпочковываться не только от плазматических, но и от других мембран и, таким образом, могут быть полезны для изучения других аспектов внутриклеточной сортировки белков и мембранного транспорта.
Изучение внутриклеточного транспорта, осуществляемого с помощью везикул in vitro
На рис. 6 схематически представлен метод изучения транспорта вирусного G-белка между соседними компартментами комплекса Гольджи in vitro. Важной особенностью метода является то, что он позволяет определить биохимическим путем компоненты, необходимые для этого процесса. Из двух типов клеток, обозначаемых как «донор» и «акцептор», выделяют мембранные фракции, содержащие комплекс Гольджи. При этом донорную фракцию получают из мутантных клеток, у которых отсутствует фермент UDP-N-ацетилглюкозамингликозилтрансфераза I и которые были инфицированы вирусом везикулярного стоматита. Процессннг олигосаха-рида, связанного с G-белком, в этих клетках блокирован. Акцепторную фракцию получают из неинфицированных клеток дикого типа. Для присоединения Ы-ацетилглюкозамина к новосинтезирован-ному G-белку должен произойти перенос G-белка от донорной фракции к акцепторной, где необходимый фермент имеется. Количество включенного Ы-ацетилглюкозамина определяют после иммунопреципитации. Данная методика позволяет исследовать транспорт из t/uc-компартмента аппарата Гольджи в медиальный компартмент. Аналогичные работы, в которых наблюдали за присоединением сиаловой кислоты, выявили наличие транспорта in vitro между транс-элементами аппарата Гольджи.
3. Характерные особенности биосинтеза мембранных белков
Проблема сборки белков очень важна. Как мы увидим, этот процесс обычно не протекает самопроизвольно, лишь в результате взаимодействия между образующимися полипептидами и липид-ным бислоем. Напротив, он является энергозависимым и опосредуется белковыми структурами, которые пока не изучены в достаточной степени. Экспериментальные данные свидетельствуют о том, что перенос белков через мембрану и сборка интегральных мембранных белков — это тесно связанные стороны одного и того же процесса. Логично ожидать, что проблемы транспортировки белков через мембраны и их укладки должны решаться одинаковым образом. Прежде чем обсуждать общие особенности сборки молекул в различных системах, полезно остановиться на методах экспериментального исследования этого процесса.
Наиболее детально изучены бесклеточные системы, в которых гораздо легче количественно исследовать процессы переноса и про-теолитического процессинга белков. Во всех этих системах используются мембранные везикулы или препараты органелл, у которых поверхность, обращенная в цитоплазму, «смотрит» наружу, поскольку перенос белков осуществляется из цитоплазмы. Этому условию удовлетворяют микросомы, полученные из эндоплазматического ретикулума секретирующих клеток, митохондрий и хлоро-пластов. Вывернутые везикулы можно получить из клеток Е. coli; они представляют собой удобный объект для изучения переноса белков в бесклеточной системе.
Полипептид-предшественник, находящийся во внешней среде, при соответствующих условиях будет переноситься внутрь пузырька или по крайней мере через мембрану пузырька или органеллы. За этим процессом обычно следят, добавляя протеазы во внешнюю среду. Степень защиты от протеолиза является мерой количества полипептида, транспортированного внутрь везикулы или органеллы. Как показано схематически на рис. 10.7, за ходом протеолити-ческого процессинга, осуществляемого сигнальной пептидазой, следят с помощью электрофореза в полиакриламидиом геле в присутствии ДСН. Белки, встроившиеся в мембрану, можно идентифицировать с помощью щелочной экстракции; при этом предполагается, что белки, которые связаны с поверхностью мембран, при такой обработке удаляются. Однако так бывает не всегда, поэтому результаты, полученные с помощью щелочной экстракции, необходимо интерпретировать с осторожностью.
В таких бесклеточных системах можно изучать биохимические условия переноса белков и идентифицировать необходимые раство-

римые компоненты. Кроме того, при этом можно варьировать природу переносимого полипептидного «субстрата». Аналогичные исследования можно проводить in vivo с помощью метода импульсного мечения. При этом уменьшается вероятность появления артефактов, связанных с искусственностью бесклеточных систем. Убедительные данные на этот счет были получены для процесса переноса белков в хлоропласт ах и митохондриях, а также — после длительных дискуссий — для переноса через бак-
термальную мембрану. Долгое время считалось, что перенос белков в эндоплазматический ретикулум или через мембраны эндоплазматического ретикулума всегда осуществляется параллельно трансляции, однако в конце концов было четко показано, что такая параллельность не обязательна. По крайней мере в одном случае — для препро-а-фактора — наблюдался посттрансляционный транспорт в микросомы дрожжей, не зависящий от рибосом. Было также показано, что хотя у высших эукариот для переноса через эндоплазматический ретикулум элонгации белков не требуется, в большинстве случаев процесс переноса все же зависит от рибосом и происходит в то время, когда новосинтезиро-ванный полипептид еще удерживается рибосомой, Важный вывод состоит в том, что энергия, необходимая для переноса, не исходит от рибосомного биосинтетического аппарата.
Заметим, что эти данные лишь констатируют то, что процессы переноса и трансляции можно разграничить экспериментально. В клетке эти процессы тесно связаны, по крайней мере, в случае белков, транспортируемых в эндоплазматический ретикулум клеток млекопитающих, и многих белков Е. coli.
2. Энергетические требования к переносу. Как правило, перенос белков в мембраны или через них энергозависим. Необходимым условием переноса как для прокариотических, так и для эукариотиче-ских систем является гидролиз АТР. Это было показано для следующих процессов: а) переноса белков в строму хлоропластов; б) транспорта белков в митохондриальный матрикс, внутреннюю и наружную мембраны; в) переноса белков через эндоплазматический ретикулум дрожжей и пост-трансляционного встраивания мембранного белков в эндоплазматический ретикулум млекопитающих; г) переноса белков через цитоплазматическую мембрану E.coli. Ни в митохондриях, ни в мембранах Е. coli АТРазная активность не принадлежит АТРазе и ее роль не состоит в генерированнии трансмембранного потенциала.
Еще одним независимым условием переноса белков в матрикс митохондрий и во внутреннюю мембрану митохондрий является наличие на последней трансмембранного потенциала. Этот потенциал, очевидно, необходим на ранней стадии процесса, при связывании белка с митохондрией. Для транспорта по крайней мере некоторых белков в хлоропласт это условие не является обязательным. Однако для оптимизации переноса белков через плазматическую мембрану E.coli также нужна трансмембранная протондвижущая сила. Заметим, что направление переноса белков относительно полярности в Е. coli и митохондриях противоположно, а имеет ли мембрана эндоплазматического ретикулума трансмембранный потенциал — неизвестно.
3. Способность предшественника к переносу. Имеются веские доводы в пользу того, что ключевую роль в успешном переносе белка играет его четвертичная структура. Скорее всего это связано с тем, что сигнальная последовательность, узнаваемая аппаратом переноса, должна быть доступна для него. Следовательно, для осуществления переноса белок должен быть неплотно свернут или частично развернут. Кроме того, если белки переносятся через мембрану в вытянутой конформации, то аппарат переноса должен быть способен к их развертыванию во время самого процесса переноса. Если бы белки-предшественники обладали стабильной четвертичной структурой, то они с трудом развертывались бы и, следовательно, не были способны к переносу.
Наиболее четкие данные о том, что белки транспортируются в вытянутой конформации, получены в работе, авторам которой удалось идентифицировать интермедиаты при переносе двух разных белков в матрикс митохондрий. Было показано, что N-кон-цы этих интермеднатов погружены в матрикс, а основная их часть находится вне митохондрии. Таким образом, интермедиаты должны протянуться через внутреннюю и наружную мембраны; при этом полагают, что место их входа совпадает с местом слияния двух мембран.
Белки могут транспортироваться через мембрану только в развернутом виде
Шац и др. изучали перенос через мембрану тетраги-дрофолатредуктазы, к которой была искусственно присоединена митохондриальная сигнальная последовательность; без этой последовательности белок не мог проникать в митохондрию. После внедрения в матрикс митохондрии сигнальная последовательность удалялась сигнальной пептидазой. Чтобы выяснить, может ли проходить через мембраны митохондрий белок, находящийся в свернутой конформации, измеряли эффективность транспорта в присутствии метотрексата — ингибитора, который с высокой избирательностью связывается с нативной формой тетрагидрофолатредуктазы. Обнаружили, что связывание метотрексата приводит к прекращению транспорта, возможно вследствие того, что ингибитор стабилизирует фермент в компактной форме. Было показано также, что для проникновения в митохондриальный матрикс предшественника 0-субъединицы FiFo-АТРазы необходимо его развертывание.
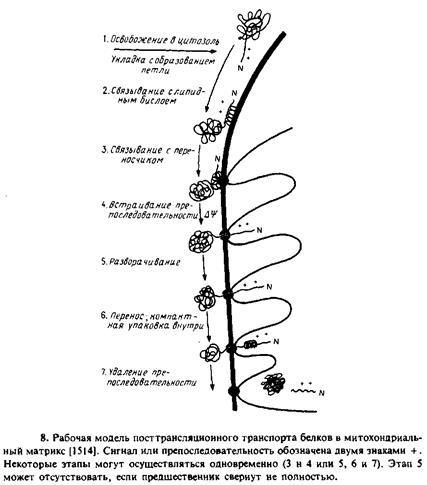
Изучался транспорт в митохондрии укороченных предшественников тетрагидрофолатредухтаэы. Они содержали митохои-дриальную сигнальную последовательность, но трансляция была прервана до завершения синтеза полипептида. Такие укороченные предшественники не связывали метотрексат, а возможно, и ие могли свертываться в конформацию, подобную нативной. Однако они проникали в митохондрии. Особый интерес представлял тот факт, что транспорт укороченных предшественников в отличие от транспорта полноразмерного белка мог осуществляться в отсутствие ATP. Это еще раз подтверждало тот факт, что ATP необходим для разворачивания полипептида. На рис. 10.8 схематически представлена модель процесса переноса белков в митохондрии с указанием стадий, протекающих лишь при наличии трансмембранного потенциала и АТР.
К аналогичным выводам о роли АТР привело исследование транспорта порина в наружную митохондриальную мембрану. Этот белок не имеет отщепляемой сигнальной последовательности, и вся необходимая для транспорта информация закодирована внутри молекулы зрелого белка. Белок был выделен в водорастворимой форме, вероятно частично денатурированной, но и в таком виде был способен к переносу. Перенос водорастворимого предшественника не требовал АТР. Этим он отличался от белка, который проникал в митохондрию сразу по завершении синтеза в системе in vitro. По-видимому, и в этом случае АТР требуется для активного процесса разворачивания белковой молекулы.
Перенос белка, связывающего мальтозу, через плазматическую мембрану £. coli в периплазматическое пространство тоже зависит от конформации предшественника. Так, мутаитный белок с измененной сигнальной последовательностью, ие способный к транспорту, менее чувствителен и к протеолитическому расщеплению, т. е. более плотно свернут. Белок же, в большей степени подверженный протеолизу, способен и к переносу. Это согласуется с данными по митохондриям. По-видимому, при наличии сигнального пептида на N-конце замедляется укладка полипептида. Интересен тот факт, что мутация в сигнальном пептиде, которая приводит к блокированию переноса, может супрессироваться второй мутацией в зрелом белке. Предшественник, несущий обе мутации, значительно менее стабилей в цитоплазме, чем молекулы с одной мутацией в сигнальной последовательности, возможно, из-за того, что он находится в более развернутой конформации.
Обсуждался и вопрос о том, что, по-видимому, для предотвращения свертывания предшественника в нативную конформацию необходим какой-то растворимый белковый кофактор. Так, был выделен в водорастворимой форме, сходной с порином митохондрий, предшественник белка наружной мембраны Е. coli OmpA, который был не способен к эффективному переносу через плазматическую мембрану, если в цитозоле отсутствовал белок, называемый «триггер-фактором». Давно известно, что для переноса белков через мембраны эндоплазматического ретикулума млекопитающих или в эндоплазматический ретикулум необходим растворимый кофактор, а именно — сигнал-распознающая частица. Возможно, роль этого фактора состоит в предотвращении сворачивания предшественника полипептида.
4. НУЖНЫ ЛИ ДЛЯ ПЕРЕНОСА БЕЛКОВ КАНАЛЫ?
Экспериментальные данные, которые однозначно свидетельствовали бы о существовании каналов, участвующих в сборке мембранных белков или в переносе белков через мембрану, отсутствуют. Известно, впрочем, что как на поверхности митохондрий, так и в эндоплазматическом ретикулуме имеются мембранные рецепторы, которые специфически узнают переносимые белки, и, возможно, именно они являются частью сложного аппарата, куда входит и канал, по которому перемещается белок.
Для того, чтобы перенос белков происходил со скоростью, близкой к скорости синтеза полипептида, энергетический барьер не должен превышать примерно 18 ккал/моль. По данным работы, две соседние спирали могут спонтанно встраиваться в бислой с образованием спиральной шпильки, и соответствующий выигрыш свободной энергии - 60 ккал/моль может стать движущей силой для частичного втягивания полярных и даже заряженных групп в липидный бислой. Однако для переноса ионизированных и полярных групп из водного окружения в липидный бислой необходимо большее количество свободной энергии, н вряд ли модель спонтанного встраивания будет применима всегда, поскольку при сборке многих мембранных белков необходимо транспортировать через мембрану длинные, часто сильно заряженные полнпептидные цепи.
Тем не менее было показано, что некоторые небольшие мембранные белки включаются в лнпидные бислон спонтанно. К ним относятся цитохром Ь$ с единственным гидрофобным якорем на С-конце и пробелок оболочки бактериофага М13, предположительно содержащий две трансмембранные спирали, которые, возможно, и встраиваются в бислой с образованием спиральной шпильки или петли. Пробелок оболочки содержит сигнальную последовательность из 23 остатков, обычно отщепляемую при сборке в цитоплазматической мембране Е. coli. Зрелый белок имеет кислый N-конец, обращенный в периплазматическое пространство, трансмембранный сегмент и основный С-конец, обращенный в цитоплазму. Он спонтанно встраивается в фосфолипидные липосомы, причем скорость его сборки in vivo сильно замедляется, если в трансмембранном участке или на С-конце зрелого белка имеются мутации, что согласуется с моделью, в рамках которой два гидрофобных сегмента могут спонтанно встраиваться в липидный бислой в виде шпильки или петли. На рис. 10.9 представлена схема встраивания этого белка в мембрану. Интересно, что сборка пробелка оболочки вируса М13 может осуществляться и с помощью микросом млекопитающих, причем этот процесс требует АТР, воз

можно, для поддержания необходимой для транспорта конформации. Следует отметить, что этот белок не типичен для белков, сборка которых осуществляется на плазматической мембране £. coli, поскольку он имеет отщепляемую сигнальную последовательность, и его сборка происходит независимо от функций генов secA, secY, необходимых для переноса белков внутрь плазматической мембраны или через нее.
Результаты исследования пробелка оболочки бактериофага М13 убедительно проиллюстрировали справедливость механизма самопроизвольного встраивания белков в мембрану без участия белков-посредников. Предполагается, что водорастворимый предшественник приобретает конформацию, обеспечивающую встраивание его в мембрану, при взаимодействии с бислоем. Эта обобщенная модель была предложена как часть «мембранной триггерной гипотезы». Сходный механизм был предложен для сборки по крайней мере каких-то участков более сложных мембранных белков, например переносчика глюкозы. Заметим, что механизмы самопроизвольного встраивания путем образования петли или спиральной шпильки могут рассматриваться только в тех случаях, когда нет тесного сопряжения между мембранным переносом и трансляцией.
Еще один пример, иллюстрирующий важную роль самопроизвольного встраивания в липидный бислой при переносе, — это апо-цитохром с, предшественник митохоидриальиого цитохрома с. Ои ие отличается по длине от зрелого цитохрома с, но лишен ковалентно связанного гема с, который присоединяется к молекуле только после переноса белка через наружную митохондриальную мембрану. Зрелый белок содержится в межмембранном пространстве митохондрий. Показано, что апоцитохром с, связываясь с анионными липидами в фосфолипидных везикулах, может проникать в липидный бислой и пересекать его. Механизм такой замечательной активности до конца неизвестен; возможно, при этом происходит существенная перегруппировка липидов. Удивительно, что в этом полипептиде нет протяженных гидрофобных участков и 40% аминокислотных остатков заряжены!
Применимы ли данные, полученные на искусственных фосфоли-пидных везикулах, к системам in vivo, неясно, но, согласно одной из моделей, апоцитохром с должен проникнуть в наружную мембрану достаточно глубоко для того, чтобы он мог связаться со специфическим белковым рецептором на внутренней поверхности мембраны. Впрочем, при этом не исключается наличие канала. In vivo ковалентное присоединение гема удерживает зрелый белок в межмембранном пространстве и, возможно, приводит к конфор-мационным изменениям, необходимым для дальнейшего переноса.
К самопроизвольному встраиванию в липидные бислой и биомембраны способны и многие другие водорастворимые белки, хотя механизм такого встраивания остается неизвестным. Основными представителями являются токсины и белки, образующие поры. Все построенные модели обычно предполагают, что в белке происходят конформационные изменения, в результате которых гидрофобные остатки, упрятанные внутри водорастворимой структуры, экспонируются в липидный бислой при включении в него белка. Примерами такого рода служат а-токсин из Staphylococcus aureus, компонент комплемента С9 и ко-лицин А. Во многих случаях для инициации конформационно-го перехода необходимо понизить рН. Вряд ли эти токсины и белки, образующие поры, могут служить модельными системами, пригодными для изучения сборки многих мембранных белков. Однако они четко показывают, что водорастворимые предшественники действительно могут самопроизвольно укладываться внутри бислоя, образуя сложные трансмембранные биохимически активные зрелые формы.
Таким образом, если речь идет о переносе линейно вытянутого полнпептида, то при энергетических расчетах необходимо основываться на наличии поры, заполненной водой, или канала, способного обеспечить гидрофильное окружение для заряженных или полярных групп. Эта модель приемлема для большинства белков, хотя имеются многочисленные примеры, когда происходит самопроизвольное включение отдельных спиралей или доменов в липидный бислой. Если специфические каналы для переноса белков действительно существуют, они должны быть очень хитро устроены, поскольку через них проходят практически любые полипептнды и задерживаются ионы и небольшие метаболиты. Исследование таких пор методом пэтч-клампа не проводилось.
5. ПОЛИПЕПТИДНЫЕ СИГНАЛЫ, ОТВЕЧАЮЩИЕ ЗА СОРТИРОВКУ БЕЛКОВ И ВСТРАИВАНИЕ ИХ В МЕМБРАНЫ
Об аппарате и механизме переноса мы не знаем почти ничего; немного больше известно о сигнальных последовательностях, присутствующих в полипептидах и направляющих каждый белок в нужное место. Успехов в этой области удалось достичь благодаря использованию техники рекомбинантных ДНК. С ее помощью были сконструированы гибридные полипептиды, в которые была включена тестируемая аминокислотная последовательность, принадлежащая другому белку. Таким образом можно было изучать влияние предполагаемой сигнальной последовательности на локализацию «белка-пассажира». Преимущества такого подхода удается использовать только в том случае, если вся информация, определяющая локализацию конечного продукта, заключена в первичной последовательности сигнала и если «белок-пассажир» является нейтральным участником процесса и, что существенно, подчиняется сигналу. Это условие выполняется во многих случаях, но известны и такие примеры, когда эффективность переноса или даже конечная локализация зависят от «белка-пассажира». Если «белок-пассажир» находится в конформации, не способной к переносу, то может происходить блокирование переноса химерного белка. Кроме того, функция некоторых сигнальных последовательностей зависит от их локализации в полипептиде или от взаимодействий с другими участками полипептидной цепи. Несмотря на все эти трудности, удалось получить много ценных данных о разнообразии сигнальных последовательностей.
Сигнальная последовательность, определяющая встраивание в эндоплазматический ретикулум
У большинства белков, встроенных в мембрану эндоплазматического ретикулума или пересекающих ее, на N-конце имеется «корот-коживущий» сигнальный пептид. Эта сигнальная последовательность непосредственно взаимодействует по крайней мере с двумя рецепторами, один из которых растворим, а другой находится в мембране. Можно было бы ожидать, что аминокислотная последовательность этого сигнального пептида будет очень консервативной и примерно одинаковой у всех переносимых белков, но ожидания эти не оправдались. Эти сигнальные участки не отличаются постоянством ни в отношении длины, ни в отношении аминокислотной последовательности, а многочисленные опыты по мутагенезу показали, что они могут претерпевать значительные структурные изменения. Данные о том, что сигнальные пептиды содержат всю информацию, необходимую для транспорта белков через мембраны эндоплазматического ретикулу-ма или внутрь их, были получены в опытах с химерными полипептидами. Присоединение N-концевой сигнальной последовательности к обычным цитоплазматическим белкам, например к глобину, приводило к тому, что они транспортировались в полость эндоплазматического ретикулума.
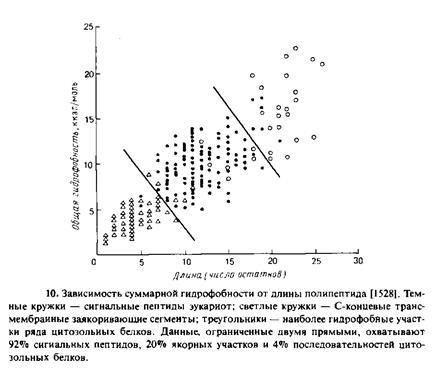
С точки зрения «сравнительной анатомии» N-концевых сигнальных последовательностей можно выделить три разных в структурном отношении участка: 1) положительно заряженный N-концевой участок; 2) центральное гидрофобное ядро из 7—15 остатков; 3) С-концевой участок, который является полярным и содержит сайт, узнаваемый сигнальной пепти-дазой, которая находится на стороне эндоплазматического ретикулума, обращенной в полость. Показано, что многочисленные случайные последовательности способны выполнять функцию нормального сигнального пептида у инвертазы дрожжей и детерминировать ее секрецию. Анализ этих случайных последовательностей показал, что решающим фактором является их гидрофобность. На рис. 10.10 приведены данные о гидрофобности и длине гидрофобных участков известных сигнальных пептидов эукариот и большинства гидрофобных участков, обнаруженных в цитозольных белках эукариот, а также известных трансмембранных якорных участков мембранных белков. Из этих данных видно, что h-область обладает свойствами, промежуточными между свойствами соответствующих участков цитозольных белков, с одной стороны, и типичных трансмембранных сегментов — с другой.
Очевидно, структурная специфичность для процесса узнавания не играет существенной роли. Однако необходимо помнить, что изменение свободной энергии менее чем на 5 ккал/моль соответствует изменению сродства в 1000 раз. Такое различие в сродстве вполне может быть обусловлено тонкими различиями между функциональными и нефункциональными сигнальными последовательностями. Моделью рецептора сигнального пептида может служить растворимый фрагмент антигена гист©совместимости класса I, а именно HLA-A2, трехмерная структура которого известна. Этот белок связывается с пептидами — компонентами чужеродных антигенов, что является
частью иммунного ответа. Область связывания пептида представляет собой большой желобок, открытый с одного конца и способный вмещать пептид из 20 аминокислотных остатков, если тот имеет форму а-спирали. О пептидах, которые могут связываться с HLA-A2, известно немного; показано, в частности, что близкородственный антиген гист©совместимости класса II проявляет высокое сродство к самым разным аминокислотным последовательностям. По-видимому, наиболее важными ббщими характеристиками пептидов, которые могут связываться с высоким сродством, являются вторичная структура и амфифильность. Стабилизации комплекса могут способствовать многочисленные взаимодействия в области связывания.
Известно, что относительно небольшие различия между сигнальными последовательностями порождают огромные различия в поведении белка. Например, если сигнальная последовательность не распознается сигнальной пептидазой, то белок чаще остается связанным с мембраной, чем секретируется, хотя есть и исключения из этого правила. Обычно сигнальные последовательности, которые служат также N-концевыми якорями,

имеют более протяженный гидрофобный h-участок длиной около 20 аминокислотных остатков; этот участок необходим для остановки переноса и/или образования стабильного якоря в мембранном бислое. Примером такой сигнальной/якорной последовательности служит трансферриновый рецептор. Заметим, что в этом случае сигнальная последовательность расположена не иа N-конце, а на расстоянии более чем 50 аминокислотных остатков от него.
Известны также случаи, когда сигнальная последовательность закрепляет зрелый белок в противоположной ориентации, т. е. N-конец оказывается обращенным наружу. В качестве примера можно привести цитохром Р450 микросом крысы, инвариантную церь антигенов гистосовместимости класса II мыши, несколько вирусных белков и Н-субъединицу реакционного центра R. viridis. Каким-то образом эти сигналь-ные/якориые последовательности «проталкивают» свой N-коиец через мембрану и останавливают трансляцию, так что основная часть белка остается в цитоплазме. Отмечалось, что в некоторых из этих случаев сигнальные последовательности «старт/стоп» несут, по крайней мере, одни отрицательный заряд в n-области. Однако для встраивания указанных мембранных белков, как и белков обычного типа, используется одинаковый аппарат переноса — СРЧ. Возможно, наличие отрицательного заряда облегчает самопроизвольный или опосредованный белком перенос N-концевых остатков через мембрану.
Как мы уже отмечали, сигнальные последовательности не обязательно находятся на N-конце белковой молекулы и могут направлять перенос обоих фланкирующих домеиов, по крайней мере в случае искусственных гибридных белков. Уникальным примером такого рода является овальбумин, секреция которого детерминируется неотщепляемой внутренней сигнальной последовательностью. У многих мембранных белков эндоплазматического ретикулума неотщепляемые сигнальные последовательности тоже расположены в средней части полипептидиой цепи и играют роль трансмембраниых якорей. В качестве примера можно привести асиалогликопротеиновый рецептор. Внутренняя сигнальная последовательность этого белка использует тот же аппарат переноса, что и N-концевая последовательность; и действительно, в искусственных гибридах эта внутренняя сигнальная последовательность функционирует как обычная N-концевая последовательность. Примерами белков с внутренней неотщепляемой сигнальной последовательностью, которые имеют многочисленные трансмембраниые сегменты и N-конец которых находится на внутренней стороне мембраны, служат переносчик глюкозы и анионный переносчик белок полосы 3. Напротив, у опсина, тоже содержащего внутренний неотщепляемый сигнальный пептид, N-конец находится с наружной стороны мембраны. Этот внутренний сигнал протягивает гидрофильный аминокислотный домеи через мембрану, и, таким образом, его ориентация противоположна той, которая наблюдается в более общем случае при переносе полипептида, начиная с С-конца. Причина такого поведения опсина неизвестна; возможно, важную роль играет природа N-концевого пептида.
Итак, от небольших изменений в сигнальных последовательностях зависит, будет ли «белок-пассажир» секретироваться в полость эндоплазматического ретикулума или ои останется прикрепленным к мембране, н какой будет ориентация N-конца мембранного белка. Было показано, что существуют все возможные топологические варианты. Важным моментом является то, что во всех случаях сборка осуществляется при помощи одного и того же аппарата.
Стоп-сигналы переноса
Для неотщепляемых сигнальных последовательностей, которые играют роль N-концевых якорей в образовавшемся мембранном белке, характерно наличие относительно длинных гидрофобных участков. Отсюда следует, что перенос может останавливаться просто при наличии протяженного гидрофобного участка, который способен образовать трансмембранную а-спираль. В пользу такого предположения свидетельствуют некоторые экспериментальные данные. Например, с помощью рекомбинантной ДНК в среднюю часть белка Е. coli, в норме секретирующегося через плазматическую мембрану, встраивали гидрофобные сегменты. Если их длина была не менее 16 аминокислотных остатков, то транспорт белка блокировался, и он оставался присоединенным к плазматической мембране. Можно возразить, что в данном случае речь идет о бактериальной системе, но, как мы увидим ниже, механизмы переноса в про- и эукари-отических системах, по-видимому, сходны. Далее были сконструированы варианты G-белка вируса везикулярного стоматита с измененными мембранными доменами. Длина гидрофобного сегмента могла составлять не 20, а 8 остатков, при этом полипептид оставался трансмембранным, хотя транспорт в плазматическую мембрану блокировался. Таким образом, природа стоп-сигнала переноса точно не известна. Необходимо выяснить два вопроса: 1) участвуют ли в остановке процесса специфические белки аппарата переноса; 2) определяется ли остановка переноса гидрофобиостью стоп-сигнала или какими-то более тонкими факторами? Было показано, что участки стоп-сигнальиой последовательности, ответственные за блокирование переноса через эндоплазматический ретикулум, могут никак не влиять на транспорт через мембрану хлоропласта. Это означает, что упомянутые два процесса могут существенно различаться.
Определение старт- и стоп-сигналов подразумевает линейную схему переноса, начинающегося с N-конца; об этом свидетельствует поведение простых систем. Однако оказалось, что последовательности, которые блокируют перенос в одном случае, могут инициировать его в другом. Следовательно, важна не только природа самих стоп- или старт-последовательностей, но и их окружение в полипептиде.
Вторичные сигналы экэоцитозной системы
Функция сигнального пептида состоит в направлении белков в эндоплазматический ретикулум и в инициации переноса. Из рис. 10.1 видно, что как мембранные белки, так и растворимые белки, которые попадают в полость эндоплазматического ретикулума, имеют несколько мест назначения. Информация, определяющая их локализацию, каким-то образом кодируется в зрелом полипептиде. В отсутствие вторичного сигнала водорастворимые белки секрети-руются с помощью «конститутивной» секретирующей системы. Достигнуты определенные успехи в идентификации сигналов, ответственных за направление растворимых белков в лизо-сомы или секреторные гранулы либо за удержание их в эндоплаз-матическом ретикулуме или пузырьках Гольджи. Возможно, участки этих полипептидов взаимодействуют с мембранными рецепторами, вызывая замедление их экспорта.
О сигналах, ответственных за локализацию интегральных мембранных белков в экэоцитозной системе, известно немного. По-видимому, за фиксацию белка Е19 аденовируса в мембране эндоплазматического ретикулума отвечает короткая последовательность на С-конце молекулы. Этот белок имеет единственный трансмембранный сегмент и цитоплазматический «хвост» из 15 остатков на С-конце. Уменьшение длины «хвоста» только на восемь аминокислотных остатков приводит к транспорту белка из эндоплазматического ретикулума. Возможно, сигнальный участок взаимодействует прямым или косвенным образом с некой цитоплазматической структурой, что обеспечивает заякоривание белка Е19 в эндоплаз-матическом ретикулуме. Исследования гликопротеина Е1 коронави-руса показали, что сигнальная последовательность, ответственная за его нахождение в аппарате Гольджи, локализована в одной из трех предполагаемых трансмембранных спиралей.
Сходная проблема сортировки возникает при выявлении вторичных сигналов, ответственных за направление мембранных белков в нужный домен плазматической мембраны в поляризованных эпителиальных клетках. В этой работе использовались в основном вирусы с оболочкой, которые отпочковываются либо от апикальной, либо от базолатеральной поверхности эпителиальных клеток в культуре. Так, G-белок вируса везикулярного стоматита локализован исключительно в базолатеральной области мембраны, от которой вирус и отпочковывается, а гликопротеин гемагглютинина транспортируется к апикальной области. Химерный гибрид,
Таблица 1. Сигналы для сортировки белков в эукариотических клетках
| нанты аминокислотной последовательности
|
| неизвестны
|
| 2.
|
Эндоплазматиче-
|
Короткая последовательность на С-
|
| ский ретикулум
|
коице отвечает за удерживание некоторых
|
| мембранных компонентов и компонентов
|
| просвета эндоплазматического ретикулума
|
| 3.
|
Аппарат Гольджи
|
Сигнальная последовательность находится
|
[899)
|
| в одном из трансмембраниых сегментов
|
| гликопротеииа Е1 короиавируса
|
| 4.
|
Апикальная или ба-
|
В некоторых случаях сигнал, определяю-
|
[937, 958,
|
| золатеральная об-
|
щий конечную локализацию, содержит
|
1186]
|
| ласть плазматиче-
|
внецитоплазматический домеи, но какую-
|
| ской мембраны
|
то роль может также играть цито-
|
| плазматический домен
|
| 5.
|
Секреторные
|
Сигнал для трипсиногеиа не требует нали-
|
(1249]
|
| гранулы
|
чия сигнального пептида (первичный сиг-
|
| нал) или первых 12 аминокислотных
|
| остатков на N-коице нативиого белка
|
| 6.
|
Конститутивная
|
Укороченный путь в отсутствие вторич-
|
| секреция
|
ных сигналов
|
состоящий из внецитоплазматического домена НА, а также мембранного сегмента и цитоплазматического «хвоста» G-белка, локализуется исключительно в апикальной области мембраны. Эти и другие эксперименты свидетельствуют о том, что решающее значение для локализации имеет внецитоплазматический домен. Однако существуют данные о том, что цитоплазматический домен тоже может содержать важные сортировочные детерминанты. По-видимому, сортировка белков плазматической мембраны в поляризованных эпителиальных клетках происходит в аппарате Гольджи. Однако в гепатоцитах крысы наблюдается иная картина: все белки плазматической мембраны, очевидно, направляются сначала в базолатериальную область.
Существенно, что вторичные сортирующие детерминанты содержатся в средней части зрелого полипептида и не являются родственными и даже не соседствуют с первичным сигнальным пептидом, ответственным за начальную локализацию в эндоплазматическом ретикулуме. Этим они отличаются от большинства вторичных сортирующих сигналов митохондрий и хлоропластов, а также, вероятно, бактерий.
Сигналы переноса и сортировки у бактерий
Большинство работ по сборке и переносу мембранных белков были выполнены на Е. coli. Белок, синтезируемый в цитоплазме, может направляться к цитоплазматической мембране, в периплаз-матическое пространство или в наружную мембрану. Перенос белков через внутреннюю мембрану в периплазматическое пространство или наружную мембрану часто называют экспортом. Кроме того, некоторые белки транспортируются через обе мембраны и секретируются во внешнюю среду или становятся компонентами пилей. В основном исследовался экспорт из бактериальных клеток, который имеет много общего с импортом в эндоплазматический ретикулум.
Как правило, белки, направляемые в периплазматическое пространство нли в наружную мембрану, имеют временные N-конце-вые сигнальные пептиды, весьма сходные с пептидами секретируе-мых белков, которые импортируются в эндоплазматический ретикулум эукариотических клеток. И в самом деле, сигнальные пептиды про- и эукариот до определенной степени взаимозаменяемы и узнаются в гетерологических системах. Например, сигнальный пептид липопротеина наружной мембраны Е. coli ускоряет перенос белков через микросомы животных клеток. Сигнальные пептиды эукариот и известные сигнальные пептиды прокариот негомологичны. За очень редким исключением, белки плазматической мембраны не содержат отщепляемого сигнального пептида. К таким исключениям относятся белок оболочки фага М13, не происходящий из Е. coli, и пенициллинсвязывающие белки, которые локализуются не только в цитоплазматической мембране. Генетические данные подтверждают, что в основе переноса экспортируемых белков и сборки белков плазматической мембраны лежат одинаковые биохимические механизмы и осуществляются эти процессы в соответствии со сходными механистическими принципами.
Напротив, механизм секреции белков через цитоплазматическую и наружную мембраны может быть совершенно иным. Например, у гемолизина сигнальная последовательность, определяющая секрецию, находится иа С-концевом участке длиной 27 аминокислот, а не на N-конце. Замечательно, что серекция токсина, продуцируемого грамотрицательной бактерией Vibrio cholerae, через наружную мембрану происходит только после свертывания полипептида с образованием третичной и четвертичной структуры в периплазма-тическом пространстве.
По данным генетического анализа, существует не менее четырех генов, продукты которых необходимы для переноса большинства белков оболочки через цитоплазматическую мембрану: secA, secB, secY и secD. Продукты генов secA и secY участвуют в сборке по крайней мере некоторых белков цитоплазмати-ческой мембраны, таких, как лидерная пептидаза. Функции продуктов этих генов неизвестны; возможно, они непосредственно участвуют в переносе белков. Биохимические исследования, проводимые в этой области, гораздо более трудоемки, чем генетические. Работы с использованием мутантов, дефектных по серекции белков, не выявили никаких механистических деталей; тем не менее полученные данные подтвердили наличие тесной связи между процессами секреции и трансляции белков in vivo. О такой связи свидетельствуют и биохимические данные, хотя в некоторых случаях in vivo белок включается в мембрану по завершении трансляции. Однако продукт гена secY способен к посттрансляционному функционированию. Возможно, он представляет собой мембраносвязанный рецептор или каналообразую-щий белок, взаимодействующий с сигнальным пептидом бактерий.
Дополнительные детерминанты первичного сигнала
В некоторых случаях наличие сигнального пептида у экспортируемых белков достаточно для переноса белков-пассажиров через ци-топлазматическую мембрану. Примером может служить сигнальная последовательность у ОтрА. С другой стороны, оказалось, что транспорт белка наружной мембраны LamB возможен лишь при наличии определенной части последовательности зрелого полипептида. Рэндолл и др. показали, что мальтозосвязываю-щий белок, синтезируясь на мембраносвязанных рибосомах, не переносится в периплазматическое пространство до тех пор, пока трансляция не пройдет примерно на 80%. Это указывает на определенную роль различных частей зрелой последовательности в инициации трансляции, хотя не исключаются и другие объяснения.
Исследования, проведенные на двух белках цитоплазматической мембраны, белке оболочки фага М13 и лидерной пептидазе, показывают, что для белков, кроме N-коицевой сигнальной последовательности, по-видимому, необходимы какие-то структурные детерминанты. Более характерным белком цитоплазматической Мембраны является лидер-пептидаза; ее предполагаемая топология представлена на рис. 10.12. Этот фермент ответствен за про-теолитическое отщепление сигнального пептида от большинства экспортируемых белков Е. coli; его активный центр локализован на периплазматической стороне цитоплазматической мембраны. Молекула этого белка имеет два транс

мембранных сегмента и большой С-концевой домен, экспонированный в периплазматическое пространство. Делеция остатков 142—323 блокирует перенос неполного полипептида через цитоплазматическую мембрану, что согласуется с представлением о важной роли в переносе карбоксильной части молекулы. Полипептид, лишенный остатков 4—50, которые образуют первый трансмембраиный сегмент, по-прежнему собирается в мембране, а второй трансмембранный сегмент играет роль сигнального пептида.
Таким образом, исследование некоторых белков Е. coli свидетельствует о том, что для переноса через цитоплазматическую мембрану необходима информация, закодированная в такой структуре, которая находится за пределами сигнальной последовательности. Возможно, это просто отражает тот факт, что искусственные полн-пептидные конструкции, используемые в данных исследованиях, имеют конформацию, не способствующую переносу. А может быть, это связано с наличием характерных детерминант, необходимых для взаимодействия с компонентами механизма переноса.
Вторичные сигналы
Что направляет белки во внутреннюю мембрану, периплазматическое пространство или наружную мембрану — неизвестно. Генетические исследования, а также данные по конкурентным взаимодействиям показывают, что многие из этих белков используют общий биохимический аппарат переноса. Результаты анализа сигнальных пептидов свидетельствуют о том, что небольшие изменения их гидрофобности и размера могут приводить к существенным изменениям в локализации переносимого белка. С другой стороны, сигнальная последовательность периплазматиче-ского белка может с успехом замещать сигнальную последовательность белка наружной мембраны; это означает, что информация о сборке заключена в зрелом белке наружной мембраны. Возможно, перемещение белка именно к плазматической мембране обусловлено просто наличием стоп-сигнала. Вспомним, что основные белки наружной мембраны, в том числе порины, лишены гидрофобных трансмембранных сегментов.
Использование синтетических сигнальных пептидов
Синтезированы пептиды, соответствующие сигнальной последовательности дикого типа, а также мутантные сигнальные пептиды белка LamB наружной мембраны и исследовано их взаимодействие с модельными фосфолипидными мембранами и везикулами Е, coli. Показано, что пептид, соответствующий сигнальной последовательности дикого типа, эффективно ингибирует in vitro перенос предшественников как периплазматического белка, так и белка наружной мембраны, а пептид, соответствующий мутантной сигнальной последовательности, дефектной по экспорту, не ингибирует перенос в бесклеточной системе. Это означает, что сигнальные пептиды узнают какой-то общий рецептор в цитозольной или мембранной фракции. Кроме того, эффективность связывания этих пептидов с модельными мембранами коррелирует с их способностью служить сигналом переноса. Корреляция между гидрофобностью сигнальной последовательности и способностью инициировать транслокацию обнаруживается и при использовании предшественника мальтозосвязывающего белка.
Эти данные согласуются с моделью, согласно которой первичная сигнальная последовательность определяет локализацию полипептидного предшественника в мембране путем неспецнфических взаимодействий с липидным бислоем, после чего осуществляется более специфическое связывание с белковым рецептором. Сходная модель была предложена для амфифильных пептидных гормонов. Заметим, однако, что сигнальный пептид в животных клетках до его связывания с мембраной взаимодействует с каким-то растворимым рецептором. Какое значение для сигнального пептида имеет его способность связываться с липида-ми — остается неясным.
Другие сигнальные последовательности бактерий
Имеются данные о том, что у бактерий существуют сигналы, отличные от сигналов у Е. coli. Особый интерес представляет уникальная сигнальная последовательность, содержащаяся в бактерио-родопсине Н. halobium. Этот белок синтезируется in vivo с N-концевым сигналом длиной 13 остатков, который в принципе может образовать амфифильную а-спираль. Он сильно отличается от сигнальной последовательности Е. coli, и о его функционировании почти ничего не известно.
Сигнальные проследовательности импорта и сортировки в митохондриях
Белки митохондрий и хлоропластов, информация о которых закодирована в ядре, синтезируются в виде водорастворимых предшественников на свободных рибосомах и in vivo переносятся к месту назначения после трансляции. В результате сортировки мито-хондриальные белки оказываются в наружной мембране, межмембранном пространстве, внутренней мембране или в матриксе. Эксперименты с использованием химерных полипептидов или полипептидов, полученных в результате делеций, показали, что, как правило, достаточная для импорта и сортировки информация содержится на N-конце. Большинство белков митохондрий и хлоропластов синтезируется с N-концевыми препоследовательностя-ми, которые удаляются сигнальными пептидазами во время или после переноса. Эти препоследовательности содержат информацию, необходимую для импорта и сортировки. Например, первые 22 аминокислоты IV субъединицы цитохром с-оксидазы, присоединенные к дигидрофолатредуктазе мыши, детерминируют импорт цито-зольного фермента в матрикс митохондрий. В общем случае в отсутствие дополнительных сигналов сигнал импорта направляет белок-пассажир в матрикс. Это «укороченный» путь, аналогичный конститутивной секреции белков, импортируемых в эндоплазматический ретикулум. Дополнительные сигналы сортировки, как правило, тоже находятся в препоследовательности, за сигналом импорта. Например, если препоследовательность цитохрома с присоединена к тетрагидрофолатредуктазе, то белок-пассажир локализуется в межмембранном пространстве. Даже в тех немногих случаях, когда отщепляемая сигнальная последовательность отсутствует, сигналы сортировки и импорта находятся на N-конце полипептида. Впрочем, в некоторых работах имеются указания на то, что какую-то роль в импорте митохондриальных белков играют последовательности, отличные от тех, которые расположены вблизи N-конца.
На рис. 10.13 суммированы данные о структуре сигнальных последовательностей типичных митохондриальных белков. У всех них на N-конце находится последовательность, определяющая транспорт белков в матрикс, а также при необходимости содержится дополнительная сигнальная информация.
Белки наружной мембраиы
Наиболее детально изучен белок наружной мембраны дрожжей с мол. массой 70 кДа. Как и другие белки наружной мембраны, он не содержит отщепляемого сигнального пептида, и сигнальной последовательностью, ответственной за его транспорт в матрикс, служит N-конец. Это было показано в опытах по присоединению первых 12 аминокислот исследуемого белка к цитозольному белку, в результате чего белок-пассажир оказывался в матриксе митохондрии. Сигнал сортировки, который определяет локализацию белка мол. массой 70 кДа в наружной мембране, по-видимому, представляет собой сегмент из 28 незаряженных аминокислот, примыкающий к сигнальной последовательности, ответственной за транспорт белка в матрикс. Деления лишь двух из этих незаряженных остатков приводит к транспорту белка в матрикс. Заметим, что митохондриальный импорт, по-видимому, осуществляется через каналы, находящиеся в местах соединения внутренней и наружной мембран. В отличие от примера, приведенного на рис. 10.8, сборка белка с мол. массой 70 кДа не требует наличия трансмембранного потенциала, что типично для белков наружной мембраны. Простейшая схема сборки белка с мол. массой 70 кДа состоит в том, что гидрофобный участок, закрепляющий белок в наружной мембране, играет роль стоп-сигнала переноса, в результате основная часть белка остается вне митохондрии. Сборка другого исследованного белка наружной мембраны, порина из Neurospora crassa, вероятно, осуществляется с,помощью другого механизма. Этот белок не содержит гидрофобного участка и, подобно поринам бактерий, по-видимому, представлен трансмембранной /3-структурой.
Межмембран нов пространство
Типичным представителем белков, содержащихся в межмембранном пространстве, является цитохром Ьг. Его пре-последовательность состоит из 80 остатков, составляющих два разных участка. N-концевая часть препоследовательности служит сигналом, направляющим целый полипептид в матрикс. Этот процесс зависит от наличия потенциала на внутренней мембране. В резуль-

тате протеолитического процессинга, осуществляемого сигнальной пептидазой в матриксе, N-концевой участок препоследовательности удаляется и освобождается вторая часть сигнала, которая направляет полипептид обратно через внутреннюю мембрану в межмембранное пространство. Этот этап не требует наличия мембранного потенциала. В результате второго акта протеолиза на наружной поверхности внутренней мембраны образуется водорастворимая зрелая форма белка. Сходным образом происходит импорт железосе-росодержащей себъединицы Риске bci-комплекса, но в этом случае весь протеолитический процессинг осуществляется внутри матрикса. Заметим, что процесс переноса белков из матрикса очень похож на процесс экспорта белков из бактерий.
Для объяснения импорта цитохрома с,, другой субъединицы Ьс\-комплекса, были предложены два механизма. Один из них сходен с механизмом, описанным выше для цитохрома bi, другой представлен на рис. 10.14. В этом случае препоследовательность весьма протяженная и очень похожа на таковую у цитохрома Ьг. Предполагается, что белок, направляемый N-концевой сигнальной последовательностью, транспортируется в матрикс до тех пор, пока перенос не блокируется гидрофобным сегментом из 19 незаряженных остатков на С-кон-це препоследовательности. Белок закрепляется на внутренней мембране, как это схематически показано на рис. 10.14. Как только перенос цитохрома С\ прекращается, две сигнальные пептидазы, одна в матриксе, а другая в межмембранном пространстве, отщепляют препоследовательность, в результате чего образуется зрелый белок, который собирается в мультисубъединичный Ьокомплекс. Зрелый белок, вероятно, фиксируется во внутренней мембране с помощью С-концевой гидрофобной спирали. Заметим, что механизм импорта цитохрома с в межмембранное пространство, по-видимому, уникален. В этом случае отщепляемая препоследовательность отсутствует; вероятно, белок имеет свой собственный специфический рецептор.
Внутренняя мембрана
По-видимому, сигнал сортировки у многих белков внутренней мембраны, импортируемых из цитоплазмы, может быть заменен соответствующей гидрофобной последовательностью, выполняющей функции стоп-сигнала переноса. Об этом свидетельствует, в частности, локализация гибридного белка, полученного путем присоединения к карбоксильной части G-белка везикулярного стоматита сигнальной последовательности, определяющей транспорт в матрикс. Гибридный белок импортировался в митохондрию in vitro и закреплялся во внутренней мембране с помощью трансмембранного домена G-белка. Сегмент N-концевой последовательности, функционирующий как стоп-сигнал переноса во внутреннюю, но не в наружную мембрану, содержится также в ADP/ATP-переносчике.
Сигнальные последовательности в хлоропластах
Первичные сигналы сортировки хлоропластных белков, закоди-ванных в ядре, сходны с сигналами, характерными для митохондри-альных белков. Так, было показано, что препоследовательность одного из хлоропластных белков направляет белки-пассажиры в митохондрию дрожжей. Каков механизм сортировки белков по разным органеллам при наличии как хлоропла-стов, так и митохондрий — неясно. Сортировка белков хлоропла-стов в самой органелле является даже более сложной проблемой, чем в случае митохондрий. Хлоропластные белки могут находиться в любой из двух мембран оболочки или в строме, они могут встраиваться в мембрану тилакоида или пересекать ее, проникая в полость тилакоида. Вторичные сигналы, по-видимому, локализованы внутри N-концеЕой препоследовательности в группах из отдельных доменов аналогично митохондриальным сигналам сортировки. Таким образом, для того чтобы белки, закодированные в ядре, могли попасть в полость тилакоида, необходимы по крайней мере два сигнала: один для прохождения белка через оболочку с последующим образованием растворимого предшественника в строме и второй для транспорта через мембрану тилакоида.
Структурные особенности последовательностей, ответственных за направление белков в матрикс
При сравнении сигнальных последовательностей, ответственных за транспорт белков в митохондрии, выявляется не какая-то специфическая последовательность, а скорее общая тенденция этих сигналов к образованию положительно заряженных амфифильных спиралей. Как правило, эти последовательности вообще не несут отрицательных зарядов или слабо заряжены, причем лизиновые н аргининовые остатки расположены таким образом, что при формировании а-спирали они оказываются в основном на одной из ее сторон, образуя область с четко выраженными гидрофобными свойствами. Такие амфифильные последовательности очень часто встречаются в растворимых белках. Показано, что внутренние последовательности из цитозольного фермента дигидрофолат-редуктазы, а также последовательности, образованные случайным образом из генома Е. coli, будучи присоединенными к белку-пассажиру, инициируют транспорт этого белка в митохондрию. Роль таких сигналов могут играть многие искусственные последовательности. Интересно отметить сходство между сигналом, ответственным за транспорт белка в митохондрию, и предполагаемой амфифильной спиралью, которая, по-видимому, образует «датчик напряжения» в ионных каналах. Очевидно, что для узнавания рецепторов, участвующих в импорте в митохондрию, существенны скорее некоторые особенности вторичной структуры, чем наличие характерных аминокислотных остатков. Как мы уже говорили, хорошую модель рецептора, способного связывать множество разнообразных пептидов, представляет антиген гистосовместимости HLA-A2.
Показано, что синтезированные химическим способом пептиды, соответствующие митохондриальным сигнальным последовательностям, связываются с липидными би- и монослоями и образуют спираль в присутствии некоторых фосфолипидов и детергентов. Кроме того, один из синтезированных пептидов блокирует импорт предшественников митохондриальных белков, возможно связываясь со специфическими рецепторами. Полагают, что сигнальная последовательность сначала вызывает концентрирование предшественника в мембранах, а затем связывание со специфическим рецептором в наружной мембране. Как видно из рис. 8, необходимым условием связывания является наличие трансмембранного потенциала на внутренней мембране. Исходя из предложенной модели амфнфильный сигнальный пептид сначала связывается с поверхностью мембраны, а затем продвигается внутрь ее под действием разности потенциалов. Такая промежуточная структура положительно заряженной спирали, погруженной в мембрану, конечно, нестабильна. Однако, если энергетический барьер перехода в это состояние меньше, чем примерно 18 ккал/моль, то пептид все же может пересекать мембрану с приемлемой скоростью. Впрочем, это маловероятно, особенно если учесть высокую плотность гидроксилированных аминокислот, обычно присутствующих в препоследовательностях помимо других положительно заряженных аминокислот. Согласно альтернативной модели, трансмембранный потенциал влияет на рецепторные белки или предполагаемый канал внутри мембраны, через который осуществляется перенос. Отметим, что для переноса в строму хлоропласта не требуется наличия трансмембранного потенциала, хотя сигналы, ответственные за транспорт белков в эти органеллы, сходны.
6. СИГНАЛЬНЫЕ ПЕПТИДАЗЫ
Для удаления временных N-концевых сигнальных пептидов необходимы специфические белки. Наиболее полно охарактеризованы сигнальные протеазы из Е. coli. Большинство экспортируемых белков Е. coli содержат сигнальный пептид, который отщепляется на периплазматической поверхности внутренней мембраны с помощью лидер-пептидазы; ее структура представлена на рис. 10.12. Для переноса белков через внутреннюю мембрану эта пептидаза не нужна, но она необходима для высвобождения экспортируемого белка из цитоплазматической мембраны. In vitro очищенный фермент мог функционировать, будучи включенным в липосомы. Специфичность расщепления весьма высока, но не определяется исключительно аминокислотной последовательностью вблизи сайта расщепления. Сигнальная пептидаза, функционирующая в эидоплазматическом ретикулуме, имеет ту же специфичность, что и соответствующий фермент Е. coli, что неудивительно, если учесть сходство сигнальных последовательностей. Была очищена сигнальная пептидаза из микросом эукариот. Показано, что она ассоциирована с другими полипептидами, возможно имеющими отношение к механизму переноса.
У Е. coli имеется вторая сигнальная пептидаза, участвующая в процессинге пролипопротеинов. Эти полипептидные компоненты оболочки Е. coli замечательны тем, что при созревании их N-конец модифицируется с помощью глицерида. Пролипопротеи-новая сигнальная пептидаза также находится в цитоплазматической мембране. После отщепления сигнальный пептид остается в цитоплазматической мембране и разрушается с помощью мембра-носвязанного фермента протеазы IV.
В митохондриях и хлоропластах должно присутствовать несколько сигнальных пептидаз, поскольку процессинг происходит более чем в одном компартменте. Растворимую пептидазу из митохондриального матрикса удалось частично очистить, но охарактеризована она не полностью.
7. РАСТВОРИМЫЕ И МЕМБРАНОСВЯЗАННЫЕ БЕЛКИ, НЕОБХОДИМЫЕ ДЛЯ ПЕРЕНОСА
Идентифицировано несколько цитозольных и мембраносвязан-ных белковых компонентов, необходимых для переноса. Наиболее детально охарактеризованы белковые факторы, участвующие во встраивании белков в эндоплазматический ретикулум млекопитающих.
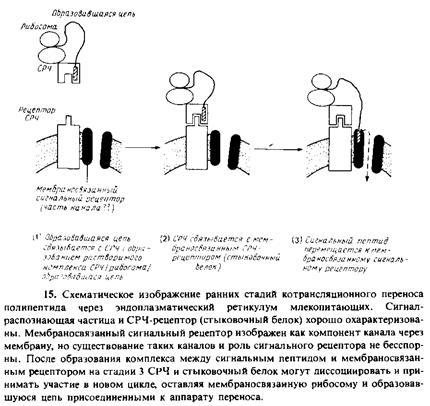
1. Сигнал-распознающая частица. Это растворимый рн-бонуклеопротеиновый комплекс, состоящий из шести разных белков и молекулы 7S-PHK. СРЧ необходима для инициации переноса. Она связывается с сигнальной последовательностью образующегося полипептида во время его синтеза на рибосоме. Для препролактина, например, константа диссоциации составляет 1 нМ. С помощью метода фотохимического сшивания был идентифицирован один из полнпептидов, непосредственно взаимодействующий с сигнальной последовательностью предшественника. По некоторым данным, полученным для бесклеточных систем, связывание СРЧ ингибирует трансляцию или вызывает ее задержку. Впрочем, не исключено, что этот феномен является артефактом; во всяком случае, как было показано на модельных опытах, его не обязательно привлекать для объяснения кинетики переноса белков in vivo. Одна из вероятных функций СРЧ состоит в предотвращении неправильного свертывания образующегося полипептида, которое может блокировать перенос. Задержка трансляции должна уменьшать вероятность такого ошибочного свертывания и, следовательно, увеличивать эффективность переноса белков.
Некоторые небольшие белки транспортируются в эн-доплазматический ретикулум независимо от СРЧ. В их число входят препропептид GLa лягушки, препромелиттин и пробелок оболочки фага М13. Во всех этих примерах конформация предшественника такова, что белки должны оставаться способными к переносу даже в отсутствие СРЧ и рибосом.
2. Рецептор СРЧ, или стыковочный белок. Комплекс СРЧ/ рибосома/образующаяся полипептидная цепь транспортируется в шероховатый эндоплазматический ретикулум, преодолевая энергию сильного взаимодействия между СРЧ и мембраносвязанным рецептором СРЧ, называемым также стыковочным белком. Рецептор СРЧ содержит субъединицу с мол. массой 73 кДа, присоединенную N-концом к мембране. Вероятно, рибосома также связывается со специфическими рецепторами, присутствующими в мембране.
3. Рецептор сигнальной последовательности. Сигнальная последовательность на образующейся полипептидной цепи перемещается от СРЧ ко второму рецептору, находящемуся в мембране и называемому рецептором сигнальной последовательности. Об этом свидетельствуют результаты опытов по фотохимическому сшиванию, в которых используется метка, связанная с сигнальной последовательностью препролактина. Предполагаемый мембраносвязанный рецептор представляет собой гликопротеин с мол. массой 35 кДа. Возможно, он образует часть канала, через который осуществляется перенос. С помощью такого же подхода с использованием поперечной сшивки и синтетического сигнального пептида был обнаружен еще один кандидат на роль рецептора сигнальной последовательности. Связь между этими двумя белками неизвестна и функции их до конца не установлены. Как только образовавшаяся полипептидная цепь связывается с мем-браносвязанным рецептором, СРЧ и ее рецептор могут освободиться от рибосомы и принять участие в новом цикле. О предполагаемом канале, участвующем в переносе, ничего не известно; очистка его является довольно сложной задачей.
Было показано, что для переноса белков через эндоплазматический ретикулум дрожжей необходимы растворимые факторы, однако их сходство с СРЧ не установлено. Перенос различных секретируемых белков в дрожжах может происходить после завершения трансляции, поэтому не исключается, что в этих случаях образующиеся полипептидные цепи взаимодействуют с мембрано-связанным рецептором сигнальной последовательности. По-видимому, растворимые белковые факторы необходимы и для экспорта белков в Е. coli, а также для импорта белков в митохондрию, но охарактеризовать их не удалось. Было показано, что продукт гена secY, необходимый для экспорта белков в Е. coli, является мембраносвязанным, но его функция остается неизвестной.
Определенные успехи были достигнуты при идентификации рецептора на наружной митохондриальной мембране, необходимого для импорта белков. Опыты по связыванию с порином показали, что на мембране имеется некий рецептор с высоким сродством, который участвует в импорте ADP/ATP-переносчика, белка внутренней мембраны. Идентифицированы два разных полипептида — компонента рецептора сигнальной последовательности наружной мембраны. При этом использовались два метода: блокирование импорта белков ан-тителами и химическое сшивание с синтетическим сигнальным пептидом. Интересно, что импорт в митохондрии, по-видимому, не связан с наружной мембраной, которая удаляется при образовании митопластов. Это наблюдение позволяет предполо-
жить, что другой рецептор сигнальной последовательности находится во внутренней мембране.
8. СБОРКА МУЛЬТИСУБЪЕДИНИЧНЫХ КОМПЛЕКСОВ И ОБНОВЛЕНИЕ МЕМБРАННЫЗ БЕЛКОВ
После встраивания мембранного полипептида в мембрану он еще должен приобрести правильную конформацию, обеспечивающую его биологическую активность, а если речь идет о мультнсубъ-единичных комплексах, то связаться с другими белками. В частности, у эукариот при этом должны произойти различные ковалент-ные модификации, например гликозилирование, ацилирование, сульфирование или образование днсульфидных связей. Даже когда такие модификации не являются необходимыми, процесс конформацион-ного созревания может быть медленным и отстоять по времени от встраивания в мембрану.
Например, у Е. coli четко наблюдается сборка стабильных три-меров обоих белков, LamB и OmpF, после включения соответствующих мономеров в наружную мембрану, при этом созревание LamB занимает около 5 мин. В эукариотнческих клетках гли-копротеин гемагглютннииа вируса гриппа, прежде чем попасть из эндоплазматического ретикулума в комплекс Гольджи, должен сформировать правильную четвертичную структуру, соответствующую зрелой форме. Несвериутые молекулы гемагглютинина остаются в эндоплазматическом ретикулуме. Образование тримеров занимает примерно 7—10 мии. Сходная олигомеризация наблюдается также для G-белка вируса везикулярного стоматита.
Сборка многих мультисубъединичных комплексов, содержащих разные субъединицы, тоже, по-видимому, происходит в эндоплазматическом ретикулуме. Примером служит никотиновый ацетилхо-линовый рецептор, который содержит две а-субъединицы и по одной /3-, у- и б-субъединице. С помощью антител можно различить отдельные формы а-субъединицы: 1) начальный продукт, встраивающийся в эндоплазматический ретикулум; эта форма не может связывать антагонист а-бунгаротоксин; 2) форма, способная связываться с а-бунгаротоксином и образующаяся через несколько минут после завершения трансляции в эндоплазматическом ретикулуме; 3) зрелый рецептор, содержащий все субъединицы, который обнаруживается через 15 мин после завершения трансляции в эндоплазматическом ретикулуме; 4) готовый рецептор на клеточной поверхности, появляющийся спустя примерно 2 ч после трансляции. Созревание включает образование днсульфидных связей, олигосахаридный процессинг и ацилирование при участии жирных кислот. Вероятно, определенную роль в сборке, происходящей в комплексе Гольджи, играет фосфорилирование субъединиц.
Решающим фактором процесса сборки является, вероятно, стабильность таких стехиометрических комплексов, как ацетилхолино-вый рецептор. По-видимому, в некоторых системах отдельные субъединицы синтезируются в значительном избытке и не образуют стабильных комплексов, а подвергаются протеолитическому расщеплению. Об этом свидетельствуют результаты, полученные при изучении некоторых мультисубъедииичных комплексов, в частности Т-клеточного рецептора антигена.
Изучался также процесс созревания и сборки структуры, образующей Na-канал. Необходимым условием созревания является образование дисульфидной связи между а- и /Зг-субъединицами, однако это событие происходит спустя примерно 1 ч после трансляции и транспорта субъединиц в аппарат Гольджи, а рецептор появляется на клеточной поверхности чере:> 4 ч после трансляции. В этом случае свободные а-субъединнцы не подвергаются быстрой деградации, а сохраняются в межклеточном пуле и, возможно, используются в дальнейшем в качестве предшественников для формирования канала в растущих нейронах.
Созревшие мембранные белки подвергаются непрерывному обновлению. Период полуобновления Na-канала составляет около 30 ч, что типично для поверхностных белков. Обновление большой субъединицы Na/K-АТРазы в растущих клетках в культуре происходит за время 20 — 40 ч. По-видимому, деградация по крайней мере некоторых белков происходит в лизосомах. В качестве примера можно привести цитохром Р450, содержащийся в эндоплазматическом ретикулуме.
Два интересных примера обновления мембранных белков
Стабильность белков в клетке определяется множеством различных факторов. Особенно интересным примером деградации мембранных белков является гидроксиметилглутарил-СоА-редуктаза. Этот фермент находится в гладком эндоплазматическом ретикулуме и регулирует эндогенный синтез холестеро-ла. Деградация его происходит довольно быстро и ускоряется при взаимодействии с холестеролом. Для ускорения процесса необходимо наличие мембраносвязанного домена фермента. При определенных условиях в культуре ооцитов китайского хомячка наблюдается сверхпродукция этого фермента. В результате образуются мембранные трубочки, занимающие 15% клеточного объема и содержащие другие мембранные белки, а также липиды. Добавление холестерола приводит к быстрой деградации избытка мембран, что говорит о координации синтеза и деградации мембранных компонентов.
Другим интересным примером селективного метаболизма мембранных белков является гербицидсвязывающий белок с мол. массой 32 кДа из тилакоидов хлоропластов. Этот белок синтезируется как предшественник, созревая внутри отдельных ламелл тилнкоида, не собранных в граны, и является частью фотосистемы II в ламеллах, входящих в граны. На свету скорость деградации этого полипептида в мембране намного выше, чем других белков. Причина этого явления неизвестна; возможно, оно связано с тем, что в фотосистеме II на свету происходят какие-то повреждения.
9. Биосинтез и распределение мембранных липидов
В мембранах эукариотических клеток обнаружено огромное количество разных липидов, причем они не распределены равномерно по разным клеточным мембранам. Эта неравномерность относится к распределению как полярных головок, так и ацильных хвостов. Например, степень ненасыщенное™ фосфолипидов в общем случае уменьшается при переходе от эндоплазматического ретикулума к комплексу Гольджи и затем к плазматической мембране. Для животной клетки среднее молярное отношение холестерол/фосфолипиды равно 0,3— 0,4, при этом для плазматической мембраны оно гораздо выше, чем для других мембран, таких, как шероховатый эндоп-лазматический ретикулум. Кроме того, для многих мембран характерно неравномерное распределение липидов и по разным половинам бислоя.
Вопрос о механизме создания и поддержания такой асимметрии очень интересен и сложен. Напомним, что многие мембраны эукариотических клеток участвуют в эндоцитозе и экзоцитозе, при которых от одних мембран везикулы отпочковываются, а с другими сливаются. Этот процесс селективен для белков, которые транспортируются с помощью везикул, но почему-то не приводит к идентичности липидного состава вовлекаемых в него мембран. Причина этого явления неизвестна, выяснены лишь некоторые его аспекты. Рассмотрим, где синтезируются мембранные липиды, а затем обсудим, как они могут транспортироваться к месту назначения.
10. ГДЕ СИНТЕЗИРУЮТСЯ МЕМБРАННЫЕ ЛИПИДЫ?
Прокариоты
У Е. coli весь синтез фосфолипидов протекает в плазматической мембране. В общих чертах этот процесс представлен на рис. 10.16. Жирные кислоты синтезируются в виде предшественников, ковалеитно связанных с белком — переносчиком ацила, а затем включаются в мембрану путем ацилирования с образованием CDP-диацилглицерола. Два ацилирующих фермента проявляют предпочтение к ненасыщенным жирнокислотным группам, находящимся в положении sn-2. На уровне CDP-диацилглицерола происходит разветвление процесса, после чего образуется фосфатидилсерин или фосфатидилглицерол.

Механизм регуляции равновесного соотношения между фосфолипи-дами почти не изучен. В штаммах, в которых фермент, необходимый для биосинтеза кардиолипина, синтезируется в количествах, в 10 раз превышающих норму, наблюдается лишь незначительное увеличение содержания этого фосфолипида в мембране. Аналогичные результаты были получены для фосфатидилсеринсинтазы и фосфатидилглицеролфосфатсинтазы. Сверхпродукция этих ферментов оказывает лишь небольшое влияние на фосфолипидный состав мембраны. С другой стороны, полное отсутствие фосфатидилглицеролфосфат-синтазы губительно для клетки, вероятно, потому, что кислые фос-фолипиды необходимы для обеспечения предшественниками других биосинтетических реакций или участвуют в регуляции. Получены мутанты, содержащие очень мало фосфатидилглицеролфос-фатсинтазы, у которых единственным основным фосфолипидом является фосфатидилэтаноламин. Очищены некоторые ферменты биосинтетического пути, в том числе CDP-диглицеридсинтаза и фосфатидилсеринсинтаза. Первый фермент, как и ожидалось, связан с мембранами, но фосфатидилсеринсинтаза связана с рибосомами в бесклеточных экстрактах Е. coli.
Эукариоты
На рис. 10.17 представлена более сложная суммарная схема биосинтеза фосфолипидов в эукариотических клетках. Синтез жирных кислот происходит как в эндоплазматическом ретикулуме, так и в митохондриях. В качестве субстрата используется ацил-СоА, поскольку животные клетки не содержат эквивалента белку — переносчику ацила. Большинство ферментов, участвующих в биосинтезе фосфолипидов, локализовано на цитоплазматической стороне мембраны эндоплазматического ретикулума, но есть и исключения. В эукариотических клетках, как и в Е. coli, синтез фосфатидилглицерола и кардиолипина может осуществляться через промежуточное образование CDP-диацилглицерола. Однако ферменты, необходимые для этого, содержатся во внутренней мембране митохондрий, и эти фосфолипиды обнаруживаются только в митохондриях. Низшие эукариоты тоже могут синтезировать фосфати-дилсерин с помощью механизма, используемого Е. coli, но соответствующий фермент обнаружен как в эндоплазматическом ретикулуме, так и в митохондриях. В дрожжах на долю фосфатидил-серина приходится только около 5% всех фосфолипидов, но он является предшественником фосфатидилэтаноламина и фосфатиднл-холина.

Эукариоты, в том числе и дрожжи, могут синтезировать фосфа-тидилэтаноламин и фосфатидилхолин в ходе реакции с участием 1,2-днацилглицерола. Это основной путь синтеза фос-фолипидов в животных клетках. Затем специальные ферменты, находящиеся в эидоплазматическом ретикулуме высших эука-риот, катализируют реакцию обмена полярных головок, в результате чего образуется фосфат идил серии. Эта реакция необходима высшим эукариотам для получения фосфатидилсерииа. После образования в эидоплазматическом ретикулуме фосфат идил-серии декарбоксилируется до фосфатидил этанол амина. Фермент, катализирующий эту реакцию, фосфат идил сериндека рбоксил аз а, находится в митохондриях. Следовательно, фосфатидилсерин может быть главным предшественником фосфатидилэтаноламина в клетке. Для осуществления этой последовательности реакций должен происходить перенос липидов между эндоплазматическим ретикулумом и митохондрией. Фосфатидилэтаноламин может превращаться в фосфати-дилхолин с помощью одной или двух метилаз, содержащихся в эндоплазматическом ретикулуме, но этот путь обычно не является главным.
Двумя липидными компонентами, которые локализуются в основном в плазматической мембране, являются сфингомиелин и холестерол. По-видимому, сфингомиелин образуется в некоторых клетках путем переноса фосфатидилхолиновой группы от фосфати-дилхолина на церамид с помощью какого-то фермента, присутствующего в плазматической мембране. Напротив, несмотря на то, что холестерол концентрируется в основном в плазматической мембране, он синтезируется при участии ферментов, содержащихся в гладком эндоплазматическом ретикулуме и, возможно, в пероксисо-мах.
11. ТРАНСПОРТ ЛИПИДОВ ОТ МЕСТА ИХ СИНТЕЗА
Перенос мембранных липидов от места их синтеза к месту назначения осуществляется при помощи двух процессов: 1) трансмембранного флип-флоп-перехода; 2) внутримембранного транспорта. Скорость флип-флоп-перехода фосфолипидов особенно велика для тех мембран, в которых происходит биосинтез липидов; ее характерное время составляет величину порядка нескольких минут. Имеются данные о том, что этот процесс осуществляется при участии белков и, возможно, требует гидролиза АТР. Было также показано, что холестерол способен к быстрому спонтанному флип-флоп-переходу. Следовательно, транспорт через мембрану эндоплазматического ретикулума из цитозоля в просвет происходит довольно быстро.
В транспорте липидов от одной клеточной мембраны к другой участвуют несколько процессов. В разных случаях наиболее важным может оказаться какой-то один из них.
1.Самопроизвольный перенос липидов путем диффузии мономерных липидных единиц через водную фазу.
2.Диффузия липидов через постоянные или временные места соединения двух контактирующих мембран.
3.Транспорт с участием белков, катализируемый или белками, облегчающими высвобождение липидов из донорной мембраны, или липидсвязывающими белками.
4.Транспорт с участием везикул, при котором липиды, как и мембранные белки, транспортируются в ходе непрерывного отпо-

чковывания и слияния с мембранами внутриклеточных везикул. Этот процесс может быть энергозавнсимым.
Рассмотрим вначале, что известно о самопроизвольной диффузии мембранных липидов между мембранами. Как показывают многочисленные исследования, липиды могут самопроизвольно перемещаться между моноламелляриыми везикулами или между фосфолипидными везикулами и биомембранамн. В большинстве случаев при этом происходит десорбция мономериых липидов с поверхности донорной мембраны и свободная диффузия через водную среду к акцепторной мембране. Лимитирующим этапом является высвобождение липидов из донорной мембраны. В этих условиях характерное время переноса зависит от величины свободной энергии десорбции. Ясно, что менее водорастворимые липиды должны преодолевать при десорбции более высокий энергетический барьер, а следовательно, их перенос должен осуществляться медленнее. Скорость переноса зависит не только от гидрофобности переносимого липнда, но и от состава и физического состояния донорного бислоя. Например, ганглиозид GMb
находясь в фосфатидилхолиновых везикулах, существует в монодисперсном состоянии. Благодаря наличию гидрофильных полярных групп он не совершает флип-флоп-переходов через мембрану везикул, но характерное время его переноса везикулами составляет около 40 ч при 45 °С. Напротив, нейтральные ганглиозиды, лишенные остатков сиаловой кислоты, образуют в везикулах гелеобразный кластер, и характерное время их переноса составляет около 500 ч. Смесь холестеро-ла и фосфолипидов в везикулах тоже образует сложные фазы, и это может влиять на кинетику переноса холестерола. Стабилизация холестерола в мембране могла бы происходить за счет благоприятных взаимодействий со специфическими фосфо-липидами, например со сфингомиелином.
В табл. 10.2 приведены характерные времена переноса некоторых мембранных липидов. На одном конце шкалы находятся эфи-ры холестерола, которые являются в высшей степени неполярными и не переносятся между мембранами с помощью диффузии мономеров. На другом конце — лизофосфолипиды, очень быстро мигрирующие между мембранами. Обычно характерное время переноса холестерола составляет 1 — 2 ч. Таким образом, возникает вопрос, как поддерживается уникальное распределение липидов в различных мембранах.
Перенос новосинтезированного холестерола из эндоплазматиче-ского ретикулума в плазматическую мембрану осуществляется всего за 10 мин. На процесс оказывают влияние агенты, блокирующие биоэнергетические реакции в клетке, например цианид. Эти и другие данные свидетельствуют о том, что внутриклеточный транспорт холестерола является энерогозависимым процессом и протекает при участии везикул. В принципе он может перевесить любой спонтанный перенос. Однако единого мнения на этот счет не выработано. Серьезной проблемой является то, что оценки доли холестерола, присутствующего в плазматической мембране, от общего его количества в клетке сильно варьируют. На первый взгляд кажется, что количество холестерола, поступающего в некоторые клетки и выходящего из них, можно оценить, используя данные о скорости самопроизвольной диффузии мономеров, однако неясно, пригодны ли в данном случае механизм спонтанного переноса и указанные скорости.
Характерное время переноса фосфолипидов из фосфолипидных везикул гораздо больше, чем холестерола. Например, для дипальмитоилфосфатидилхолина оно составляет 83 ч при 37° в случае везикул из димиристоилфосфатидилхолина. Скорость переноса фосфолипидов с помощью этого механизма слишком мала, чтобы соответствовать реальным скоростям межмембранного транспорта.

Прокариоты
Остановимся вначале на переносе фосфолипидов в случае грам-отрицательных бактерий. Это относительно простая система, поскольку в ней имеются только две мембраны. Фосфолипиды синтезируются в плазматической мембране и должны транспортироваться в наружную мембрану. Имеются данные о том, что между этими мембранами осуществляется быстрый обмен ли-п идами. Так, фосфатидил этанол амин достигает наружной мембраны за характерное время ~ 3 мин. В этом процессе не участвуют белки, липиды или АТР, ио ои каким-то образом зависит от протондвижущей силы. Липиды, внедрившиеся в наружную мембрану, могут также быстро перемещаться к внутренней мембране; это относится даже к фосфатидилхолину, который в норме не обнаруживается в Е. coli. Таким образом, процесс, по-видимому, не является специфическим. Тем не менее у мутантиого штамма с дефектной диацилглнцеролкиназой диацилглицерол накапливается в плазматической мембране и к наружной мембране не транспортируется.
Механизм липидиого обмена между этими двумя мембранами неизвестен, но обычно полагают, что внутренняя и наружная мембраны имеют места соединения или области адгезии. По-видимому, именно через эти участки и происходит диффузия липидов. Здесь же могут концентрироваться белки, экспортируемые к наружной мембране.
Эукариоты
Механизм распределения фосфолипидов в эукариотических клетках гораздо более сложен. Единственным фосфолипидом, который локализуется исключительно в месте своего синтеза, в митохондрии, является кардиолипин. Как показывают многочисленные эксперименты, внутриклеточный транспорт фосфолипидов осуществляется значительно быстрее, чем если бы он определялся самопроизвольной диффузией в водной среде. Например, перенос новосинтезированного фосфолипида от эндоплазматического рети-кулума к митохондриям в клетках печени крысы происходит всего за несколько минут. Поскольку декарбоксилаза, катализирующая превращение фосфатидилсерина в фосфатидилэтаноламин, содержится в митохондриях, данные о скорости этой реакции могут использоваться для контроля за переносом фосфатидилсерина из эндоплазматического ретикулума в митохондрию. Показано, что скорость переноса весьма высока и процесс ингибируется азидом и агентами, блокирующими биоэнергетические реакции. Обнаружено также, что новосинтезированный фосфолипид в течение нескольких минут транспортируется к плазматической мембране, хотя скорость переноса очень сильно зависит от самого липида и типа клетки. В некоторых случаях транспорт липидов блокируется ингибиторами биоэнергетических реакций и/или агентами, разрушающими цитоскелет. Общепринято, что скорость переноса липидов выше скорости диффузии.
Одним из способов, позволяющих облегчить перенос фосфолипидов между мембранами, является участие в этом процессе белков. Выделен целый ряд водорастворимых белков, участвующих в межмембранном переносе фосфолипидов in vitro. Все они имеют липидсвязывающие участки и образуют водорастворимые комплексы с фосфолипидами. Эти белки облегчают обмен липидов «один к одному» между мембранами путем переноса мономеров. В одних случаях связывание липндов происходит с высокой специфичностью и сродством, в других сродство и специфичность относительно низки. В принципе при низком сродстве способность белка катализировать перенос липидов от одной мембраны к другой должна повышаться, поскольку белок при этом может возвращаться к донорной мембране, имея незанятый липидсвязывающнй участок. Белки, переносящие фосфолипиды, были выделены не только из животных клеток, но и из бактерий и клеток растений. Очищены белки, связывающиеся с гликолипидами и длинноцепочечными жирными кислотами,
К сожалению, функция белков, переносящих фосфолипиды, до сих пор не продемонстрирована in vivo, поэтому неясно, играют ли они физиологическую роль во внутриклеточном переносе фосфолипидов. Не исключено, что этот перенос опосредуется везикулами, а возможно, функционируют оба механизма.
Важно понять, что так или иначе распределение фосфолипидов среди различных клеточных мембран детерминируется белками. Если распределение липидов равновесно, то оно определяется сродством белков, присутствующих в разных мембранах, к липидам. Смещение в распределении некоторых липидов из-за взаимодействия их с белками может влиять на распределение других липидов, например холестерола. Если распределение липидов неравновесно, то липидный состав разных мембран будет определяться скоростью транспортировки липидов к мембранам и от них, но и в этом случае кинетика процесса будет зависеть от участия в нем определенных белков.
12. ОБНОВЛЕНИЕ ФОСФОЛИПИДОВ
Данные о скорости обновления липидов весьма скудны, известно лишь, что она весьма велика. В животных клетках половина всех фосфолипидов обновляется на протяжении одного или двух клеточных делений. Скорость обновления полярной и неполярной частей фосфолипидной молекулы неодинакова. По-видимому, это связано с действием внелизосомных фосфолипаз и ацилтрансфераз, которые вызывают перестройку внутриклеточных фосфолипидов in situ. Сфинголипиды расщепляются в лизосомах, и когда процесс их деградации нарушается, возникает патологическое состояние. Например, при болезни Ниманна—Пика происходит накопление сфинго-миелина из-за недостатка лизосомного фермента сфннгомиелиназы. Деградация гликосфинголипндов in vivo также происходит в лизосомах, как полагают, с участием белков, которые специфически связываются с определенными липидами и, вероятно, растворяют их.
У Е. coli имеются по крайней мере 10 деградирующих ферментов, которые могут участвовать в процессе обновления фосфолипидов, однако об их функциях in vivo известно немного. При экспоненциальном росте скорость обновления глицерольного остова и жирнокислотных цепей мала; по-видимому, невелика и скорость обмена ацильных групп. Однако обновление глицеро-фосфатной головки фосфатидилглицерола происходит необычайно быстро. Это связано с использованием фосфатидилглицерола в качестве донора 5л-глицерол-1-фосфата для синтеза олигосахаридов мембранного происхождения. Эти олигосахариды содержатся в периплазматическом пространстве и играют роль в осмотической адаптации организма. В ходе реакции происходит превращение фос-фатидилглицерола в диацилглицерол, который затем превращается с помощью диацилглнцеролкиназы в фосфатидную кислоту.
13. Изменения липидного состава мембран в ответ на изменения условий окружающей среды
Из всего сказанного ясно, что о механизме контроля липидного состава клеточных мембран известно очень мало. Одно из минимальных требований состоит в том, что мембранные липиды должны образовывать стабильный бислой, находящийся в жидкокристаллическом состоянии. Механизмы, обеспечивающие изменение липидного состава мембран в ответ на изменения условий окружающей среды, имеют многие организмы. Лучше всего изучен механизм тепловой адаптации Е. coli.
1. Тепловая адаптация Е. coli. При выращивании Е. coli в условиях низких температур наблюдается изменение жирнокис-лотного состава в сторону большего содержания ненасыщенных жирных кислот. Это способствует поддержанию мембраны в текучем состоянии и позволяет клеткам выжить при экстремальных температурах. Преобладающими остатками жирных кислот в Е. coli являются пальмитоил, пальмитолеил и цис-ваксеноил. При низких температурах в бислой включается больше досваксеновой кислоты, а содержание пальмитолеиловой кислоты остается постоянным. Связано это с функционированием одного из двух ферментов, которые катализируют удлинение жирнокислотных цепей. При низких температурах фермент 3-кетоацил-АСР-синтаза II более активно превращает пальмитолеиловую кислоту в дос-ваксеновую, увеличивая пул ненасыщенных жнриых кислот, включаемых в фосфолипиды.
2. Адаптация к повышению давления. Жирнокнслотный состав барофильной морской бактерии NPT3 зависит от давления. При изменении давления в мембранах может также происходить фазовый переход, и эта адаптация, как и в предыдущем случае, позволяет организму выжить. При повышении давления содержание в мембранах ненасыщенных жирных кислот увеличивается, и благодаря особенностям их упаковки мембрана остается в жидкокристаллическом состоянии. Аналогичные результаты были получены при изучении фосфолипидов митохондрий из клеток печени глубоководных океанических рыб.
3. Исследования Acholeplasma laidlawii. Этот организм является микоплаэмой. У него нет клеточной стенки, а имеется единственная плазматическая мембрана. Эта особенность весьма ценна для лабораторных исследований, поскольку в мембрану могут включаться экзогенные жирные кислоты, которые легко выделять и изучать. Основными липидными компонентами являются монокглюкозилди-глицериды и диглюкозилдиглицериды. Из-за различий в размере полярной головки выделенные МГДГ образуют обратимую гексагональную фазу, а ДГДГ — стабильный бислой. Фазовые свойства мембран A. laidlawii зависят прежде всего от соотношения между МГДГ и ДГДГ. Липнд-ный состав определяли в условиях роста организма в присутствии отдельных жирных кислот и при разных температурах или в присутствии таких агентов, как спирты и детергенты. В этих случаях объяснить адаптивную реакцию только с помощью вязкостных свойств не удается, поскольку необходимо учитывать равновесие между ламеллярной и неламеллярной фазами. Вообще говоря, анализ можно проводить, основываясь на величине параметра упаковки липидов, поскольку от него зависит фазовое состояние смеси мембранных липидов. Механизмы, с помощью которых организм адаптируется к изменяющимся условиям окружающей среды путем изменения своего липидного состава, неизвестны.
Резюме
Клетки эукариот содержат много мембранных органелл и множество различных внутриклеточных мембран, каждая из которых обладает уникальным белковым и липидным составом. Любой мембранный белок, информация о синтезе которого заключена в ядре, должен безошибочно доставляться от места синтеза на риоо-соме, находящейся в цитоплазме, к месту назначения. Для этого используется сложная система сигнальных последовательностей, содержащихся в любой зрелой форме полипептида или предшественника, а также рецепторы внутри клетки, способные эти сигналы распознавать. Некоторые мембранные белки включаются в липидный бислой самопроизвольно, но в большинстве случаев правильная сборка белка внутри клеточной мембраны является энергозависимым процессом, который осуществляется с помощью специализированного аппарата. По-видимому, белки не могут включиться в клеточную мембрану до тех пор, пока они не приобретут частично развернутую конформацию. Разворачивание белков или поддержание их в развернутой конформацин, необходимой для переноса, возможно, осуществляются при участии АТР и специфических белков в цитоплазме.
В эукариотической клетке большинство липидов синтезируется в эидоплазматическом ретикулуме, и чтобы попасть к месту назначения, они должны пройти через соответствующие мембраны. Механизм транспорта липидов неизвестен, можно лишь предположить, что в нем участвуют везикулы и белки, связывающие липиды. Способ поддержания липидного состава различных внутриклеточных мембран тоже не установлен.
|