«Уфимский Государственный Нефтяной Технический Университет»
Кафедра: «Физическая и органическая химия»
Реферат
П
редельные углеводороды (алканы)
Ст.гр.БТП-09-01 Антипин А.
Доцент Калашников С.М.
Уфа 2010
Алка́ны
(также насыщенные углеводороды
, парафины
, алифатические соединения
) — ациклическиеуглеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой Cn
H2n+2
.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3
-гибридизации — все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм.
Названия алканов.
Слово «алкан» того же происхождения, что и «алкоголь» . Устаревший термин «парафин» произошел от латинских parum – мало, незначительно и affinis – родственный; парафины обладают малой реакционной способностью по отношению к большинству химических реагентов. Многие парафины являются гомологами; в гомологическом ряду алканов каждый последующий член отличается от предыдущего на одну метиленовую группу СН2
. Термин происходит от греческого homologos – соответственный, подобный.
Номенклатурные (от лат. nomenclatura
– роспись имен) названия алканов строятся по определенным правилам, которые не всегда однозначны. Так, если в молекуле алкана ecть различные заместители, то в названии алкана они перечисляются в алфавитном порядке. Однако в разных языках этот порядок может различаться. Например, углеводород СН3
–СН(СН3
)–СН(С2
Н5
)–СН2
–СН2
–СН3
в соответствии с этим правилом по-русски будет называться 2-метил-3-этилгексан, а по-английски 3-ethyl-2-methylhexane…
В соответствии с названием углеводорода называются и алкильные радикалы: метил (СН3
-), этил (С2
Н5
-), изопропил (СН3
)2
СН-, втор
-бутил С2
Н5
–СН(СН3
)-, трет
-бутил (СН3
)3
С- и т.д. Алкильные радикалы входят как целое в состав многих органических соединений; в свободном состоянии эти частицы с неспаренным электроном исключительно активны.
Некоторые изомеры алканов имеют и тривиальные названия, например, изобутан (2-метилпропан), изооктан (2,2,4-триметилпентан), неопентан (2,3-диметилпропан), сквалан (2,6,10,15,19,23-гексаметилтетракозан), название которого происходит от лат squalus
– акула (непредельное производное сквалана – сквален, важное для обмена веществ соединение, было впервые обнаружено в печени акулы). Часто используется и тривиальное название радикала пентила (С5
Н11
) – амил. Оно происходит от греч. amylon
– крахмал: когда-то изоамиловый спирт С5
Н11
ОН (3-метилбутанол-1) называли «амильным алкоголем брожения», так как он составляет основу сивушного масла, а оно образуется в результате брожения сахаристых веществ – продуктов гидролиза крахмала.
Систематическая номенклатура
ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан
путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающий радикал, затем название радикала и название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-. Если радикалы неодинаковые, то их названия перечисляются в алфавитном порядке.
Рациональная номенклатура
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название «алкил1алкил2алкил3а
Физические свойства предельных углеводородов (алканов) Алканы - бесцветные вещества, нерастворимые в воде. В обычных условиях они химически инертны, так как все связи в их молекулах образованы с участием sp3-гибридных орбиталей атома углерода и являются очень прочными. В реакции присоединения алканы не вступают: все связи атомов углерода полностью насыщены.
· Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
· При нормальных условиях неразветвлённые алканы с CH4
до C4
H10
— газы; с C5
H12
до C13
H28
— жидкости; после C14
H30
— твёрдые тела.
· Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
· газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Химические свойства предельных углеводородов (алканов)
Углеводороды ряда метана при обыкновенной температуре химически весьма инертны, почему они и получили название парафинов (от латинских слов parum affinis — обладающий малым сродством). С большинством химических реагентов эти углеводороды в указанных условиях или вовсе не реагируют, или реагируют чрезвычайно медленно. При сравнительно невысоких температурах протекает лишь небольшое число реакций, при которых происходит замена атомовводорода на различные атомы и группы (реакции металеп-cuu). Эти реакции ведут к получению производных соответствующих углеводородов.
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С — Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму то есть с образованием радикалов.
Реакции радикального замещения
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
1. CH4
+ Cl2
→ CH3
Cl + HCl (хлорметан)
2. CH3
Cl + Cl2
→ CH2
Cl2
+ HCl (дихлорметан)
3. CH2
Cl2
+ Cl2
→ CHCl3
+ HCl (трихлорметан)
4. CHCl3
+ Cl2
→ CCl4
+ HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, замещая у них атом водорода, в результате этого образуются метильные радикалы СН3
, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или растворителем.
Нитрование (реакция Коновалова)
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота N2
O4
в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных. Реакция также подчиняется правилу Марковникова.
RH + HNO3
= RNO2
+ H2
O
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4
+ 2O2
→ CO2
+ 2H2
O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
Сn
Н2n
+2
+(1,5n
+0,5)O2
= n
CO2
+ (n
+1)H2
O
Каталитическое окисление
Могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4
(катализатор, кислород, 200 °C) могут образоваться:
· метиловый спирт: СН4
+ О2
= СН3
ОН
· формальдегид: СН4
+ О2
= СН2
О + Н2
O
· муравьиная кислота: СН4
+ О2
= НСООН
Термические превращения алканов
Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH4
→ C + 2H2
(t > 1000 °C)
C2
H6
→ 2C + 3H2
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов углерода в углеродном скелете) и фракции солярового масла (12-20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
CH4
→ С + 2H2
— при 1000 °C
Частичный крекинг:
2CH4
→ C2
H2
+ 3H2
— при 1500 °C
Дегидрирование
Образование:
1)В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2
O3
, Cr2
O3
а)CH3
-CH3
→ CH2
=CH2
+ H2
(этан → этен)
б)CH3
-CH2
-CH3
→ CH2
=CH-CH3
+ H2
(пропан → пропен)
2)В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода:
в)CH3
-CH2
-CH2
-CH3
→ CH2
=CH-CH=CH2
+ H2
(бутан → бутадиен-1,3)
в')CH3
-CH2
-CH2
-CH3
→ CH2
=C=CH-CH3
+ H2
(бутан → бутадиен-1,2)
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
г) CH3
-CH2
-CH2
-CH2
CH2
-CH2
-CH2
-CH3
(октан) → П.-ксилол, параллельно М.-ксилол, параллельно этилбензол + 3H2
Изомеризация
Под действием катализатора (например, AlCl3
) происходит изомеризация алкана: например, бутан (C4
H10
), взаимодействуя с хлоридом алюминия (AlCl3
), превращается из н-бутана в 2-метилпропан.
Конверсия метана
В присутствии никелевого катализатора протекает реакция:
CH4
+ H2
O → CO + H2
Продукт этой реакции (смесь CO и H2
) называется «синтез-газом».
Получение
Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно.
Восстановление галогенпроизводных алканов
При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы:
R—CH2
Cl + H2
→ R—CH3
+ HCl
Восстановление йодалканов происходит при нагревании последних с йодоводородной кислотой:
R—CH2
I + HI → R—CH3
+ I2
Для восстановления галогеналканов пригодны также амальгама натрия, гидриды металлов, натрий в спирте, цинк в соляной кислоте или цинк в спирте
Восстановление
спиртов
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4
H9
OH), проходящую в присутствии LiAlH4
. При этом выделяется вода.
H3
C—CH2
—CH2
—CH2
OH → H3
C—CH2
—CH2
—CH3
+ H2
O
Восстановление карбонильных соединений
Реакция Кижнера—Вольфа
:
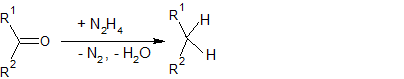
Реакцию проводят в избытке гидразина в высококипящем растворителе в присутствии KOH.
Реакция Клемменсена
:
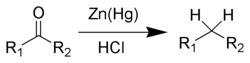
Гидрирование непредельных углеводородов
· Из алкенов
Cn
H2n
+ H2
→ Cn
H2n+2
· Из алкинов
Cn
H2n-2
+ 2H2
→ Cn
H2n+2
Катализатором реакции являются соединения никеля, платины или палладия.
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO−
перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R—R. Например:
2CH3
COO−
− 2e → 2[CH3
COO•] → 2CH3
• → C2
H6
2C3
H7
COOK → {электролиз} → C6
H14
Газификация твердого топлива
Проходит при повышенной температуре и давлении. Катализатор — Ni:
C+2H2
→ CH4
Реакция Вюрца
2R—Br + 2Na = R—R + 2NaBr
Реакция идёт в ТГФ при температуре −80 °C. При взаимодействии R и R` возможно образование смеси продуктов (R—R, R`—R`, R—R`)
Синтез Фишера — Тропша
nCO + (2n+1)H2
→ Cn
H2n+2
+ nH2
O
Список использованной литературы
· Активация и каталитические реакции алканов / Пер. с англ.; под ред. К. Хилла. — М.: Мир, 1992.
· Петров Ал. А.
Химия алканов
· Пэрэушану В.
Производство и использование углеводородов. — М.: Химия, 1987.
· Рудаков Е. С.
Реакции алканов с окислителями, металлокомплексами и радикалами в растворах. — Киев: Наукова думка, 1985.
· Хейнс А.
Методы окисления органических соединений. Алканы, алкены, алкины и арены. — М.: Мир, 1988.
|