Как новый класс психоактивных веществ антидепрессанты появились в конце 50-х годов, когда швейцарский психиатр R.Kuhn впервые сообщил о терапевтическом эффекте имипрамина, наблюдавшемся у депрессивных больных. Препарат, являющийся трициклическим производным иминодибензила, первоначально рассматривался как структурный аналог аминазина, однако он не показал какого-либо нейролептического эффекта. Несколько ранее появились данные о том, что противотуберкулезный препарат "Ипрониазид" оказывает благоприятное влияние на настроение, причем этот эффект не связан со специфическим противомикробным действием вещества. Таким образом, в распоряжении психиатров оказалось сразу два химически несходных между собой психотропных препарата с антидепрессивным действием.
Следует отметить, что появление антидепрессантов совпало по времени с интенсивным развитием функциональной нейрохимии и фармакологии нейромедиаторов мозга, прежде всего моноаминов, т.е. норадреналина (НА), и незадолго до того открытых дофамина и серотонина. Было также показано, что резерпин способен вызывать седативный эффект, напоминающий состояние психической депрессии, который хорошо коррелировал с истощением депо моноаминов в организме, в том числе в специфических структурах головного мозга. Клиницисты, применявшие резерпин для лечения артериальной гипертонии, у 15% больных наблюдали развитие симптомов психической депрессии. На основе этих данных возникли первые гипотезы о возможных механизмах действия антидепрессантов. Имипрамин стал рассматриваться как ингибитор обратного захвата моноаминовых нейромедиаторов, ипрониазид и его аналоги – как ингибиторы моноаминоксидазы, фермента, ответственного за метаболическую деградацию норадреналина, дофамина и серотонина. Оба воздействия влекут за собой усиление нейромедиаторной функции указанных моноаминов, что, как предполагалось, и лежит в основе антидепрессивного эффекта указанных веществ. Одновременно начались интенсивные поиски биохимических маркеров депрессий.
Вслед за этими первыми открытиями начались, с одной стороны, интенсивные поиски новых активных соединений с антидепрессивной активностью и с другой – глубокие исследования по нейрохимии депрессий и изучению возможных механизмов действия антидепрессантов. Поскольку ранние гипотезы о механизме действия антидепрессантов базировались на убедительных экспериментальных данных, они не утратили своего значения и в настоящее время.
Удалось обнаружить целый ряд нейрохимических изменений в характеристиках нейромедиаторных систем мозга у депрессивных больных. Важные результаты были получены при посмертном исследовании мозга больных депрессией. Так, были подробно описаны изменения таких характеристик системы нейромедиаторов-моноаминов, как содержание этих веществ в структурах мозга, плотность соответствующих рецепторов, их функциональная активность, параметры радиорецепторного связывания специфических лигандов с мембранами тромбоцитов и лейкоцитов, концентрация метаболитов моноаминов в ликворе, нейроэндокринные и другие показатели. Некоторые из этих характеристик стали использовать при оценке тяжести депрессии, характера ее течения, эффективности терапии антидепрессантами.
В настоящее время в практической медицине используется большое число антидепрессантов разного химического строения, отличающихся между собой по фармакологическому и нейрохимическому профилю, особенностям клинического применения. Согласно некоторым оценкам в 1997 г. на разных стадиях изучения находилось не менее 125 препаратов с антидепрессивной активностью, причем поиск новых перспективных соединений продолжается. Следует иметь в виду, что около 30% больных оказываются резистентными к терапии антидепрессантами, что постоянно стимулирует поиск новых препаратов этого класса.
Таблица 1. Классификация современных антидепрессантов
1. Трициклические (классические) антидепрессанты (ТЦА) и родственные им соединения
Представители: имипрамин, дезипрамин, амитриптилин, пиразидол
Механизм действия: неселективное угнетение обратного захвата НА и серотонина (5-HT) нервными окончаниями соответствующих структур мозга, обратимое ингибирование моноаминооксидазы - МАО
(пиразидол)
2. Селективные ингибиторы обратного захвата НА и серотонина
(СИОЗНС)
Представители: венлафаксин, милнаципран
Механизм действия: избирательное угнетение обратного захвата НА и серотонина нервными окончаниями
3. Селективные ингибиторы обратного захвата серотонина (СИОЗС)
Представители: флуоксетин, пароксетин, сертралин, циталопрам,
кломипрамин и др.
Механизм действия: избирательное угнетение обратного захвата
серотонина нервными окончаниями
4. Ингибиторы моноаминоксидазы
а) необратимые
Представители: фенелзин, транилципромин
б) обратимые
Представители: моклобемид, пиразидол
5. Активаторы обратного захвата серотонина
Представитель: тианептин (синоним - коаксил)
6. Антидепрессанты с рецепторным механизмом действия
Представители:
Миансерин - антагонист альфа2-адренорецепторов и 5-HT
постсинаптических рецепторов серотонина
Нафазодон - блокирует постсинаптические серотониновые рецепторы
5-HT2
-типа, проявляет умеренный аффинитет к мембранному
транспортеру серотонина
Миртазапин - а) блокирует пресинаптические альфа2-адренорецепторы, угнетающие высвобождение серотонина, в результате чего
серотонинергическая нейропередача усиливается; б) блокирует
постсинаптические 5-HT2
- и 5-HT3
-рецепторы, что ведет к модуляции серотонинергической нейропередачи
Таблица 2. Избирательность сродства антидепрессантов к специфическим мембранным переносчикам нейромедиаторов-моноаминов
| Антидепрессанты |
50% ингибиторная концентрация (мкМ) |
| 5-НТ |
НА |
ДА |
| Трициклические |
| имипрамин |
0,5 |
0,2 |
8,7 |
| дезипрамин |
0,2 |
0,03 |
50,0 |
| амитриптилин |
0,49 |
0,05 |
4,0 |
| хломипрамин |
0,04 |
0,3 |
12,0 |
| Нетрициклические |
| номифензин |
12,0 |
0,03 |
0,14 |
| мапротилин |
30,0 |
0,08 |
- |
| циталопрам |
0,014 |
32,0 |
- |
| флуоксетин |
0,06 |
10,0 |
- |
| зимелидин |
0,24 |
2,7 |
12,0 |
Таблица 3. Активность некоторых антидепрессантов по угнетению обратного захвата серотонина в сравнении с их средними терапевтическими дозами в клинике (по BE.Leonard. Fundamentals of Psychopharmacology, Wiley, 1997)
| Антидепрессант |
Активность |
Средняя |
| in vitro IC50(мкМ) |
in vivo доза (мг/кг) |
терапевтическая доза (мг в день) |
| Пароксетин |
0,01 |
1,9 |
20-50 |
| Сертралин |
0,06 |
2,9 |
50-200 |
| Флуоксетин |
0,27 |
7,0 |
20-40 |
| Флувоксамин |
0,54 |
7,4 |
100-200 |
| Кломипрамин |
0,10 |
17,0 |
75-150 |
| Имипрамин |
0,81 |
30,0 |
75-150 |
| Амитриптилин |
1,20 |
30,0 |
75-150 |
Таблица 4. Побочные эффекты ТЦА
• Антихолинергические:
сухость во рту, нечеткость зрения, затрудненное мочеиспускание, запоры, нарушения памяти, обострение краеугольной глаукомы
• Антигистаминные:
седативный эффект, увеличение массы тела
• Антагонизм альфа-адренорецепторов:
ортостатическая гипотензия
• Сердечно-сосудистые эффекты:
синусовая тахикардия, аритмии, замедление проводимости миокарда, внезапная смерть
• Прочие:
половая дисфункция, нарушение когнитивных и психомоторных процессов, судорожные состояния
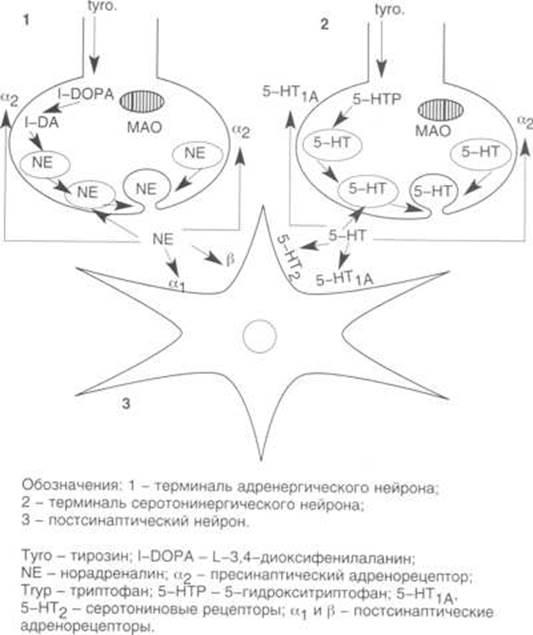
Эффекты хронического применения ТЦА на уровне взаимодействия норадренергических и серотонинергических нервных окончаний с постсинаптическим нейроном.
Общая характеристика и классификация антидепрессантов
Современная классификация антидепрессантов, основанная на особенностях механизма их действия, фармакологического и нейрохимического профиля, принятая в экспериментальной и клинической психофармакологии, представлена в табл. 1
. Наряду с трициклическими (классическими) антидепрессантами в настоящее время широкое применение находят препараты разного химического строения.
Для антидепрессантов разных групп, отличающихся по химической структуре, характерна различная степень селективности сродства к мембранным транспортерам моноаминов – НА, серотонина, дофамина (ДА), а также к отдельным рецепторам. Количественной характеристикой сродства (аффинитета) препарата к тому или иному макромолекулярному комплексу, т.е. рецептору или транспортному белку, является величина IC50, представляющая собой 50% ингибиторную концентрацию данного вещества. Характеристики сродства для ряда антидепрессантов представлены в табл. 2.
Из приведенных данных видно, что группа классических антидепрессантов (ТЦА) отличается значительной неоднородностью сродства к отдельным моноаминовым транспортерам. Так, имипрамин
, обладая практически одинаковым аффинитетом к переносчикам 5-НТ и НА, проявляет значительно меньшее сродство к системе захвата ДА.
Дезипрамин
, как и амитриптилин,
обладает более высоким сродством к переносчику НА. Обращает на себя внимание высокая степень селективности хломипрамина
(близкий структурный аналог имипрамина) по отношению к процессу захвата 5-HT. По существу этот препарат можно рассматривать как первый представитель СИОЗС. Для группы в целом характерно низкое сродство к переносчику ДА. Близки к хломипрамину по активности и избирательности сродства к переносчику серотонина циталопрам
и флуоксетин
, а также пароксетин
и сертралин
(в табл. 2
не представлены), относящиеся к группе СИОЗС. Эти вещества мало влияют на обратный захват катехоламинов – НА и ДА. Номифензин и мапротилин, напротив, проявляют свойства селективных ингибиторов обратного захвата НА.
Рассмотрим последовательно фармакологические свойства и особенности нейрохимического профиля основных групп антидепрессантов, представленных в табл. 1
. Прежде всего следует отметить, что, несмотря на появление большого числа новых препаратов с более избирательным действием на обратный захват НА/серотонина, классические антидепрессанты имипрамин и амитриптилин по-прежнему широко используются в лечении депрессивных состояний, представляя собой своего рода "золотой стандарт".
Главным отличием классических ТЦА является относительно широкий нейрохимический профиль, т.е. способность воздействовать не только на захват моноаминов, но и на центральные и периферические холинорецепторы мускаринового типа, альфа-адрено- и гистаминовые рецепторы. С этим свойством связано большинство побочных эффектов антидепрессантов (седативный эффект, ортостатическая гипотензия, аритмогенное действие, кардиотоксичность, нарушение аккомодации, дизурические расстройства и др.). Антидепрессанты II поколения, к числу которых относятся селективные ингибиторы захвата моноаминов, обладают более узким нейрохимическим профилем, не проявляют аффинитета к большинству рецепторов и в связи с этим лучше переносятся, у них меньше выражены отмеченные выше побочные эффекты. Вместе с тем, как показали широкие клинические исследования, новые антидепрессанты по терапевтической эффективности, как правило, не превосходят своих классических предшественников первой генерации.
Наиболее близкими к последним по механизму действия являются препараты группы СИОЗНС, избирательно ингибирующие захват НА и серотонина приблизительно в одном диапазоне концентраций и не оказывающие существенного влияния на другие нейромедиаторные системы. Представителями этой группы являются венлафаксин
и милнаципран
, показавшие антидепрессивный эффект при клинических испытаниях. Сообщается о более быстром наступлении терапевтического эффекта, наблюдавшегося в случае применения венлафаксина уже в течение первых 2 нед. Несмотря на кажущееся сходство нейрохимического действия НА/5-HT ингибиторов обратного захвата с механизмом, хорошо известным для антидепрессантов типа имипрамина, различие между ними состоит в отсутствии у препаратов группы СИОЗНС способности вызывать десенситизацию бета-адренорецепторов, характерную для действия ТЦА.
Серотонинергические антидепрессанты (группа СИОЗС) к настоящему времени достаточно полно изучены как в экспериментальных условиях, так и в клинике. Характерное для этих веществ высокоизбирательное угнетение обратного захвата серотонина принято рассматривать как один из ведущих компонентов механизма антидепрессивного эффекта. Получен ряд экспериментальных доказательств усиления серотонинергической функции при действии этих веществ. Показано, в частности, что при хроническом, но не однократном введении антидепрессантов группы СИОЗС наблюдается повышение внеклеточной концентрации серотонина в диализатах фронтальной коры мозга крыс, что согласуется с представлением об усилении центральной серотонинергической нейропередачи. Способность угнетать обратный захват серотонина проявляется не только в опытах in vitro, но и in vivo. Интересно, однако, отметить, что корреляции между этими показателями и средними терапевтическими дозами тех же антидепрессантов в клинических условиях не наблюдается (табл. 3
).
Так, нетрудно видеть, что флуоксетин, значительно уступая пароксетину по своей активности в эксперименте, в клинических условиях равноэффективен последнему. В целом наблюдается большее соответствие терапевтически эффективных доз в клинике данным экспериментов in vivo. Кломипрамин на порядок активнее имипрамина и амитриптилина, однако в клинике терапевтический эффект всех трех препаратов наблюдается в одном и том же диапазоне доз. Флуоксетин, наиболее известный препарат этой группы, отличается более продолжительным действием, а также способностью метаболизироваться с образованием фармакологически активного дезметильного производного. Период полужизни флуоксетина и его метаболита превышает 7 дней, что должно учитываться в случае отмены препарата и при переходе к другой терапии. Ингибиторы МАО, например, могут применяться не ранее чем через 5 нед после отмены флуоксетина. Широкое применение в последнее время получил пароксетин, один из наиболее мощных и селективных ингибиторов захвата серотонина. Препарат вызывает адаптивные изменения в состоянии соматодендритных (тип 5-HT1A
) и терминальных (HT1B/1D
) ауторецепторов серотонина, ингибирует активность NO-синтазы, фермента, катализирующего образование оксида азота. Пароксетин нетоксичен, хорошо переносится, эффективен не только при депрессии, но и при лечении тревожных состояний.
В группе ингибиторов МАО появились вещества, проявляющие способность к обратимому угнетению активности фермента – это отечественный 4-циклический антидепрессант пиразидол, созданный в Центре химии лекарственных средств ВНИХФИ, и моклобемид – производное бензамида, близкое по структуре к сульпириду. Моклобемид является ингибитором МАО-А изоформы фермента, его преимуществом по сравнению с ингибиторами типа фенелзина является возможность применения одновременно с пищевыми продуктами, содержащими тирозин (отсутствие "сырного" эффекта). Ингибиторы МАО-В в терапии депрессий не используются. Остается неясным, соответствуют ли ингибиторы МАО по своей терапевтической эффективности при лечении депрессий эталонным ТЦА.
Особое место в ряду антидепрессантов занимает трициклическое производное дибензотиазепина тианептин (синоним – коаксил), механизм действия которого связывают с активацией процессов обратного захвата серотонина, что в свете современных данных о роли серотонинергического дефицита как вероятной нейрохимической основы депрессивных состояний представляется парадоксом. Как известно, все клинически эффективные антидепрессанты вызывают увеличение концентрации нейротрансмиттеров, прежде всего серотонина, в синаптическом пространстве путем ингибирования их обратного захвата или замедления метаболической деградации. В этом смысле целью терапии антидепрессантами является усиление центральной серотонинергической нейропередачи. Клиническая эффективность препаратов из группы СИОЗС в целом подтверждает гипотезу серотонинового дефицита, о чем свидетельствуют результаты многочисленных исследований.
По экспериментальным данным, тианептин проявляет фармакологические свойства, характерные для типичных антидепрессантов. Клинические исследования, включая результаты европейских многоцентровых испытаний, указывают на эффективность тианептина, сравнимую с таковой имипрамина и амитриптилина. По экспериментальным данным, усиление захвата серотонина в структурах коры и гиппокампа достигало 28% при однократном и 71% при хроническом введении препарата. Сходные данные получены при регистрации аналогичного показателя на тромбоцитах больных, леченных тианептином.
Показано, что тианептин не увеличивает внеклеточную концентрацию серотонина, но повышает уровень ДА в nucleus accumbens при микродиализном исследовании и уменьшает вызванное стрессом повышение выброса НА во фронтальной коре. Известно также, что препарат обладает анксиолитической активностью. Парадокс заключается в том, что в основе антидепрессивного эффекта тианептина лежит воздействие на показатели серотонинергической нейропередачи, прямо противоположное тому, что характерно для представителей группы СИОЗС.
Родоначальником новой группы антидепрессантов с преимущественно рецепторным механизмом действия является миансерин, получивший название атипичного антидепрессанта в связи с отсутствием у него заметного влияния на обратный захват моноаминов и способности ингибировать МАО. Оказалось, что миансерин, как и его аналоги миртазапин и сетиптилин (4-циклические соединения, по структуре напоминающие пиразидол), являются блокаторами альфа2
-адренорецепторов, локализованных на пресинаптических окончаниях адрен- и серотонинергических нейронов (см. рисунок
). Рецепторы этого типа осуществляют тормозной контроль высвобождения нейромедиаторов, т.е. НА и серотонина, а их блокада ведет к усилению нейропередачи в соответствующих синапсах. В опытах in vitro и in vivo было показано, что миансерин вызывает увеличение пресинаптического выброса НА и устраняет эффект клонидина, агониста альфа2
-адренорецепторов. Кроме того, препарат угнетает постсинаптические 5-HT2
серотониновые рецепторы. Характерные побочные эффекты миансерина, такие как ортостатическая гипотензия и седативное действие, связывают с влиянием препарата на альфа1
-адрено- и Н1
-гистаминовые рецепторы мозга. Один из новых представителей этой группы – нафазодон – наряду с рецепторным действием обладает сродством к серотониновому мембранному транспортеру, что сближает его с веществами группы СИОЗС. Благодаря угнетающему влиянию на постсинаптические 5-HT2
-рецепторы препарат обладает анксиолитическим действием, что определяет возможность расширения показаний для его клинического применения при лечении тревожной депрессии. Интересной особенностью нафазодона оказалась его способность в отличие от большинства антидепрессантов увеличивать долю быстроволнового сна и оказывать нормализующее влияние на его структуру, часто нарушенную при депрессии.
Другой представитель антидепрессантов этой группы – миртазапин
, антагонист пресинаптических альфа-адренорецепторов – обладает, кроме того, угнетающим влиянием на постсинаптические рецепторы типа 5-HT2
и 5-HT3
. Суммарный эффект может определяться функциональным соотношением облегчающих и угнетающих воздействий в функционально неоднородных серотонинергических путях мозга. Высокая активность антидепрессантов, способных селективно модулировать нейропередачу в серотонинергических системах мозга, хорошо согласуется с представленями о роли серотонина в регуляции ряда важнейших функций организма.
Побочные эффекты антидепрессантов хорошо известны.
В краткой форме основные из них представлены в табл. 4
.
Как уже было отмечено, преимуществом антидепрессантов нового поколения являются низкая токсичность, значительно меньшее число побочных эффектов и лучшая переносимость.
Механизм действия антидепрессантов
На протяжении почти полувековой истории экпериментального и клинического изучения антидепрессантов представления о возможных механизмах их действия претерпели значительную эволюцию, для которой характерно несколько этапов. Как уже отмечалось, первые гипотезы, объясняющие антидепрессивный эффект имипрамина и ипрониазида, исходили из представления о нарушении в условиях депрессии функции моноаминергической нейропередачи в специфических структурах мозга, ответственных за регуляцию эмоциональной сферы. Было установлено, что ингибирование обратного захвата НА и серотонина, наблюдаемое при действии имипрамина и дезипрамина как in vitro, так и in vivo сопровождается усилением синаптического действия этих моноаминов за счет увеличения их внеклеточной концентрации. Аналогичный результат достигается в условиях ингибирования моноаминоксидазы, так как при этом замедляется метаболическая деградация нейромедиаторов-моноаминов, их внутриклеточное содержание и пресинаптическое высвобождение увеличиваются. Важно отметить, однако, что эффект ингибирования обратного захвата нейромедиаторов проявляется уже при однократном применении препаратов, в то время как для достижения клинического антидепрессивного эффекта требуется несколько недель. Кроме того, известно, что корреляции между ингибиторными (в отношении функции обратного захвата) концентрациями антидепрессантов и их средними терапевтическими дозами в клинике не существует (см. табл. 3
). В поисках молекулярной мишени для действия антидепрессантов были описаны центры специфического высокоаффинного связывания имипрамина на мембранах мозга и тромбоцитов, получившие название имипраминовых рецепторов. Позднее было показано, что эти участки представляют собой специфический белок, встроенный в пресинаптическую мембрану окончаний серотонинергических нейронов, так называемый мембранный транспортер серотонина, в настоящее время детально охарактеризованный молекулярно-биологическими методами. Тем самым способность антидепрессантов ингибировать обратный захват нейромедиаторов получила подтверждение на современном методическом уровне.
Основные элементы механизма действия антидепрессантов удобно рассмотреть на рисунке
. Как видно, на пре- и постсинаптическом уровне имеется несколько молекулярных "мишеней", на которые направлено действие антидепрессантов. Пресинаптическое звено адренергического синапса представлено: а) мембранным транспортером, обеспечивающим обратный захват НА (показан стрелкой); б) ферментом МАО, локализованном в митохондриях; в) альфа2
-адренорецептором, осуществляющим тормозный контроль пресинаптического высвобождения НА (соответственно блокада этого рецептора ведет к увеличению выброса нейротрансмиттера, усилению нейропередачи). На постсинаптической мембране локализованы альфа1- и бета-адренорецепторы.
Отличие нейрохимической организации серотонинергического нейрона состоит в том, что на уровне пресинапса помимо специфического транспортера 5-HT (показан стрелкой) функционируют два вида рецепторов: серотониновый ауторецептор 5-HT1A
и адренергический гетерорецептор типа альфа2
, которые обеспечивают двойной модулирующий контроль серотонинергической нейропередачи. На постсинаптическом нейроне локализованы два вида адрено- (альфа1
- и бета-) рецепторов и две разновидности рецепторов серотонина (5-HT1A
и 5-HT2
).
Блокада обратного захвата моноаминов сопровождается следующими изменениями синаптического баланса:
а) внеклеточная концентрация моноаминов (НА и 5-HT) возрастает;
б) ответы альфа2- и бета-адренорецепторов угнетаются;
в) ответы 5-HT1A и 5-HT2 рецепторов снижаются;
г) снижение чувствительности (десенситизация) альфа2
-адренорецепторов влечет за собой увеличение выброса НА и 5-HT и соответствующие изменения синаптической передачи;
д) суммарно постсинаптический поток информации ослабляется через бета-адрено- и 5-HT2
рецепторы, но усиливается за счет активации альфа1
- и 5-HT1A
-рецепторов.
Следует отметить, что в приведенной схеме, отражающей сложный характер изменений синаптического баланса при действии антидепрессантов, многое остается не вполне выясненным.
Аналогичные рассуждения приложимы к трактовке механизма действия селективных ингибиторов захвата НА и 5-HT с той разницей, что последние не связываются с рецепторами (для некоторых препаратов исключение составляет мускариновый холинорецептор). Антидепрессанты рецепторного действия, не влияя на процессы обратного захвата, проявляют свои эффекты за счет блокады пресинаптических альфа2
-адренорецепторов, результатом чего является усиление выброса нейротрансмиттеров (НА и 5-HT) в синаптическое пространство. Изучению механизмов действия антидепрессантов в последние годы уделяется большое внимание. Исследования в этом направлении позволили прийти к ряду новых представлений. Основным противоречием долгое время оставалось несоответствие между биохимическим эффектом однократного ("острого") применения антидепрессантов и следствием длительного введения тех же веществ. Стало очевидным, что гипотеза ингибирования обратного захвата моноаминов не пригодна в качестве нейрохимической основы стойкого антидепрессивного эффекта, наблюдаемого в условиях длительного применения антидепрессантов. Возникло представление об адаптивных перестройках моноаминергических систем мозга, развивающихся в процессе длительной терапии антидепрессантами и включающих такие звенья, как регуляция состояния рецепторов, их сопряжение со вторичными мессенджерами, внутриклеточная передача сигнала, эндокринные звенья регуляции, вовлечение систем интерлейкинов, простагландина Е2, циклооксигеназного каскада. Показано, что изменения этих систем имеют место при депрессии и подвергаются редукции в процессе терапии антидепрессантами.
В конце 70-х годов возникло представление о десенситизации бета-адренорецепторов мозга как об одном из механизмов действия ТЦА. Такой механизм, по-видимому, реализуется в условиях стойкого повышения внеклеточной концентрации НА. Развивается состояние пониженной регуляции бета-адренорецепторов (феномен downregulation), противоположное тому, что имеет место при депрессии. Ряд данных свидетельствует о возможном участии других нейротрансмиттерных систем, в частности глутаматергической, стероидных рецепторов мозга, изменений секреции гормона роста, вовлечении гормонов передней доли гипофиза в механизмы, лежащие в основе антидепрессивного эффекта. Приведенные данные при всей их фрагментарности свидетельствуют о сложности рассматриваемой проблемы, решение которой, принимая во внимание ее несомненную социальную значимость, потребует дальнейших разносторонних исследований.
Статья Г.Ю.Вицковой и В.Б.Наркевичу
|