- химический элемент I группы периодической системы, атомный номер 55, атомная масса 132,9054; относится к щелочным металлам.
История открытия
Открыт цезий сравнительно недавно, в 1860 г., в минеральных водах известных целебных источников Шварцвальда (Баден-Баден и др.). За короткий исторический срок прошел блистательный путь – от редкого, никому не ведомого химического элемента до стратегического металла. Принадлежит к семье редких щелочных легких металлов. Легко взаимодействует с другими элементами, образуя прочные связи. В настоящее время применяется одновременно в нескольких отраслях: в электронике и автоматике, в радиолокации и кино, в атомных реакторах и на космических кораблях.
Впервые он был обнаружен по двум ярким линиям в синей области спектра, и латинское слово «caesius», от которого произошло его название, означает небесно-голубой. Неоспоримо утверждение о том, что цезий практически последний в ряду щелочных металлов. Правда, еще Менделеев предусмотрительно оставил в своей таблице пустую клетку для «экацезия», который должен был следовать в I группе за цезием. И этот элемент (франций) в 1939 г. был открыт. Однако франций существует лишь в виде быстро распадающихся радиоактивных изотопов с периодами полураспада в несколько минут, секунд или даже тысячных долей секунды.
Цезий был первым элементом, открытым с помощью спектрального анализа. Ранее соли цезия ошибочно считали солями калия. Ученые, однако, имели возможность познакомиться с этим элементом еще до того, как Бунзен и Кирхгоф создали новый исследовательский метод. Речь идет о пропаже, которая долгие годы не давала покоя химикам. Еще в 1846 году немецкий ученый К. Платтнер занялся исследованием полуцита-минерала, найденного на острове Эльба. Выполнить полный химический анализ минерала было делом не хитрым, но вот загвоздка: как ни складывал Платтнер полученные им результаты, сумма всех составляющих оказывалась равной 93%. Куда же могли подеваться остальные 7%? Почти два десятка лет никто не мог ответить на этот вопрос. И лишь в 1864 году итальянец Пизани представил неопровержимые доказательства того, что виновником «недовеса» был цезий, ошибочно принятый Платтнером за калий – эти элементы состоят в довольно близком химическом родстве, однако цезий в два с лишним раза тяжелее.
Металлический цезий впервые был получен Сеттербергом в 1882 г. электролизом расплавленного цианида цезия. Производство соединений цезия возникло в конце прошлого столетия, а производство металлов цезия было организовано в двадцатых годах прошлого столетия. Однако и в настоящее время их получают в ограниченном количестве.
Описание
Блестящая поверхность металлического цезия имеет бледно-золотистый цвет. Это – один из самых легкоплавких металлов: он плавится при 28,5 °C, кипит при 705 °C в обычных условиях и при 330 °C в вакууме. Легкоплавкость цезия сочетается с большой легкостью. Несмотря на довольно большую атомную массу (132,905) элемента, его плотность при 20 °C всего 1,87. Цезий во много раз легче своих соседей по менделеевской таблице. Лантан, например, имеющий почти такую же атомную массу, по плотности превосходит цезий в три с лишним раза. Цезий всего вдвое тяжелее натрия, а их атомные массы относятся, как 6:1. По-видимому, причина этого кроется в своеобразной электронной структуре атомов цезия. Каждый его атом содержит 55 протонов, 78 нейтронов и 55 электронов, но все эти многочисленные электроны расположены относительно рыхло – ионный радиус цезия очень велик – 1,65 Ǻ*. Ионный радиус лантана, например, равен всего 1,22 Ǻ, хотя в состав его атома входят 57 протонов, 82 нейтрона и 57 электронов. Атомный радиус цезия равен 2,62 Ǻ.
Природный цезий состоит из стабильного нуклида 133
Cs. Поперечное сечение захвата тепловых нейтронов 2,9*10-27
м2
.
Конфигурация внешней электронной оболочки атома 6s1
, степень окисления +1; энергия ионизации при переходе Cs →Cs+
→Cs2+
соответствует 3,89397, 25,1 эВ; сродство к электрону 0,47 эВ; электроотрицательность по Полингу 0,7; работа
выхода электрона 1,81 эВ; металлический радиус 0,266 нм, ковалентный радиус 0.235 нм, ионный радиус Cs+
0,181 нм (координационное число 6), 0,188 нм (8), 0,192 нм (9), 0,195 нм (10), 0,202 нм (12).
Содержание цезия в земной коре 3,7·10-4
% по массе. Минералы цезия – поллуцит (Сs, Nа) [АlSi2
O6
] ·Н2
О (содержание Cs2
О 29,8–36,7% по массе) и редкий авогадрит (К, Сs) [ВF4
]. Цезий присутствует в виде примеси в богатых калием алюмосиликатах: лепидолите (0,1–0,5% СsО), флогопите (0,2–1,5%) и др., также в карналлите (0,0003–0,002% CsС1), трифилине, в термальных (до 5 мг/л Cs) и озерных (до 0,3 мг/л Cs) водах. Промышленный источники цезия – поллуцит и лепидолит.
Свойства цезия
Цезий – мягкий металл, который при комнатной температуре находится в полужидком состоянии. Пары окрашены в зеленовато-синий цвет. Кристаллизуется в кубической объемноцентрированной решетке: а = 0,6141 нм, z = 2, пространств, группа IтЗт\ т. пл. 28,44 °С, точка кипения 669,2 °С; плотность 1,904 г./см3
(20 °С); С0
р
32,21 Дж/(моль·К); Н0
пл
2,096 кДж/моль, ∆Н0
исп
65,62 кДж/моль, ∆Н0
возг
76,54 кДж/моль (298,15 К); S0
298
85,23 Дж/(моль·К); уравнения температурной зависимости давления пара: lg p (мм рт. ст.) = -4122/T + 5,228 – 1,514 lg T + 3977Т (100–301,59К), lg p (мм. рт. cт.)= -3822/Т + 4,940 – 0,746 lg T (301,59–897 К); теплопроводность, Вт/(м·К): 19,0 (298 К), 19,3 (373 К), 20,2 (473 К); ρ, мкОм·м: 0,1830 (273,15 К), 0,2142 (301,59 К, твердый), 0,3568 (301,59 К, жидкость), температурный коэффициент ρ 6,0–10-3
К-1
(273–291 К); парамагнетик, удельная магнитная восприимчивость +0,22·10-9
(293 К); η, мПа·с: 6,76 (301,59 К), 5,27 (350 К), 3,18 (500 К); γ 60,6 мН/м (301,59 К); температурный коэффициент линейного расширения 97·10-6
К-1
(273 К); твердость по Моосу 0,2; модуль упругости 1,7 ГПа (293 К); коэффициент. сжимаемости 71·10-11
Па-1
(323 К).
На воздухе цезий мгновенно окисляется с воспламенением и образованием перекиси и надперекиси. С водой цезий и рубидий бурно реагируют с образованием гидроокисей и выделением водорода. Эта реакция протекает даже при температуре –100° С.
Цезий растворяется в жидком аммиаке, со спиртом образуют алкоголяты, способные присоединить одну молекулу спирта. Из-за высокой реакционной способности цезий хранят в герметических стальных сосудах под слоем парафина.
Цезий, как натрий и калий, обладает единственным 5-электроном сверх конфигурации инертных газов. Структура электронных оболочек цезия определяет многие его физико-химические свойства. Конфигурация электронных оболочек следующая: КЬ – [Кг] криптон. 5s и Сз – [Хе] ксенон 6s. Вследствие небольшой разницы в энергиях атомных орбит – 5d и 6s для цезия атомы их легко возбуждаются. По этой причине металлы обладают низкими значениями ионизационных потенциалов, хорошей электропроводностью и явлением фотоэффекта. Способность световых лучей заряжать тела положительным электричеством или отнимать от них отрицательный заряд была названа фотоэффектом (от греческого слова «фотос» – свет и латинского – «эффект» – действие). Световые лучи «выбивают» из цезия электроны, которые образуют электрический ток. У цезия очень легко «выбить» электрон, так как на внешнем электронном слое он один. Чем дальше от ядра атома удален электрон, тем легче его оторвать. Так, у цезия шесть электронных слоев, а у натрия только три; между ядром и внешним электроном у цезия 54 электрона, а у натрия только 10. Следовательно, цезий легче всего отдает свой электрон, потому что он обладает наибольшим атомным радиусом и наименьшим ионизационным потенциалом. Цезий встречается в природе только в виде стабильного изотопа 135
Сз
Самое замечательное свойство цезия – его исключительно высокая активность. По чувствительности к свету он превосходит все другие металлы. Цезиевый катод испускает поток электронов даже под действием инфракрасных лучей с длиной волны 0,80 мкм. Кроме того, максимальная электронная эмиссия, превосходящая нормальный фотоэлектрический эффект в сотни раз, наступает у цезия при освещении зеленым светом, тогда как у других светочувствительных металлов этот максимум проявляется лишь при воздействии фиолетовых или ультрафиолетовых лучей.
Долгое время ученые надеялись найти радиоактивные изотопы цезия в природе, поскольку они есть у рубидия и калия. Но в природном цезии не удалось обнаружить каких-либо иных изотопов, кроме вполне стабильного 133
Cs. Правда, искусственным путем получено 22 радиоактивных изотопа цезия с атомными массами от 123 до 144. В большинстве случаев они недолговечны: периоды полураспада измеряются секундами и минутами, реже – несколькими часами или днями. Однако три из них распадаются не столь быстро – это 134
Cs, 137
Cs и 135
Cs, живущие 2,07; 26,6 и 3·106
лет. Все три изотопа образуются в атомных реакторах при распаде урана, тория и плутония; их удаление из реакторов довольно затруднительно.
Химическая активность цезия необычайна. Он очень быстро реагирует с кислородом и не только моментально воспламеняется на воздухе, но способен поглощать малейшие следы кислорода в условиях глубокого вакуума. Воду он бурно разлагает уже при обычной температуре; при этом выделяется много тепла, и вытесняемый из воды водород тут же воспламеняется. Цезий взаимодействует даже со льдом при –116 °C. Его хранение требует большой предосторожности.
Цезий взаимодействует и с углеродом. Только самая совершенная модификация углерода – алмаз – в состоянии противостоять его «натиску». Жидкий расплавленный цезий и его пары разрыхляют сажу, древесный уголь и даже графит, внедряясь между атомами углерода и образуя своеобразные, довольно прочные соединения золотисто-желтого цвета, которые в пределе, по-видимому, отвечают составу C8
Cs5
. Они воспламеняются на воздухе, вытесняют водород из воды, а при нагревании разлагаются и отдают весь поглощенный цезий.
Даже при обычной температуре реакции цезия с фтором, хлором и другими галогенами сопровождаются воспламенением, а с серой и фосфором – взрывом. При нагревании цезий соединяется с водородом, азотом и другими элементами, а при 300 °C разрушает стекло и фарфор. Гидриды и дейтериды цезия легко воспламеняются на воздухе, а также в атмосфере фтора и хлора. Неустойчивы, а иногда огнеопасны и взрывчаты соединения цезия с азотом, бором, кремнием и германием, а также с окисью углерода. Галоидные соединения цезия и цезиевые соли большинства кислот, напротив, очень прочны и устойчивы. Активность исходного цезия проявляется у них разве только в хорошей растворимости подавляющего большинства солей. Кроме того, они легко превращаются в более сложные комплексные соединения.
Все щелочные металлы сильно изменяются под действием высокого давления. Но именно цезий реагирует на него наиболее своеобразно и резко. При давлении в 100 тыс. атм. его объем уменьшается почти втрое – сильнее, чем у других щелочных металлов. Кроме того, именно в условиях высокого давления были обнаружены две новые модификации элементарного цезия. Электрическое сопротивление всех щелочных металлов с ростом давления увеличивается; у цезия это свойство выражено особенно сильно.
Сплавы и интерметаллические соединения цезия всегда сравнительно легкоплавки.
У цезия имеется еще одно весьма важное свойство, тесно связанное с его электронной структурой. Дело в том, что он теряет свой единственный валентный электрон легче, чем любой другой металл; для этого необходима очень незначительная энергия – всего 3,89 эВ. Поэтому получение плазмы из цезия требует гораздо меньших энергетических затрат, чем при использовании любого другого химического элемента.
Ядро атома цезия и его валентный электрон обладают собственными магнитными моментами. Эти моменты могут быть ориентированы двояко – параллельно или антипараллельно. Разница между энергиями обоих состояний постоянна, и, естественно, переход из одного состояния в другое сопровождается колебаниями со строго постоянными характеристиками (длина волны 3,26 см). Используя это свойство, ученые создали цезиевые «атомные часы» – едва ли не самые точные в мире.
Свойства и способы получения соединений цезия
Цезий химически очень активен, стандартный электродный потенциал составляет 2,923 В. на воздухе мгновенно окисляется с воспламенением, образуя надпероксид Сs02
с примесью пероксида Сs2
02.
При ограниченном доступеO2
Окисляется до оксида цезия Cs2
0; Сs02
переходит в озонид Cs03
в токе озонированного O2
при 40 °С. С водой цезий реагирует со взрывом с образованием гидроксида CsОН и выделением Н2
. Взаимодействует с сухим Н2
при 200–350 °С под давлением 5–10 МПа или в присутствии катализатора с образованием гидрида СsН.
Все многочисленные соединения цезия можно подразделить на две группы: простые и комплексные.
Простые соединения.
Оксид цезия Сs2
О, кристаллы, расплывающиеся на воздухе; в вакууме (10-3
Па) возгоняется при 350–450 °С, при 500 °С разлагается: 2Cs2
0 →Сs2
02
+ 2Cs; энергично реагирует с водой, давая CsОН, с влажным СО2
, при 150–200 °С – с Н2
, Р2
, С12
, а также с расплавленной серой; разлагается на свету; получают медленным окислением Cs кислородом (2/3 стехиометрического колличества), остаток Cs отгоняют в вакууме при 180–200 °С. При окислении Cs кислородом получают также его пероксид и надперокид.
Таблица 2
| Свойства оксида, пероксида и надпероксида |
| Показатель |
Cs2
O |
Cs2
O2
|
CsO2
|
| Цвет |
Коричнево-красный |
Бледно-желтый |
Золотисто-коричневый |
| Сингония |
Гексагональная |
Ромбическая |
Тетрагональная |
Кубическая |
| Параметры кристалической решетки, нм: |
| α |
0,674 |
0,4322 |
0,4477 |
0,662 |
| b |
- |
0,7517 |
- |
- |
| с |
1,882 |
0,6340 |
0,7350 |
- |
| Пространственная группа |
R3m |
/mmm |
14/mmm |
Fm3m |
| Температура плавления,˚С |
595˚ |
594˚ |
130˚ |
450˚ |
| Плотность, г/см3
|
4,36 |
4,47
(15˚С)
|
3,76
(19˚С)
|
- |
| С˚р
, Дж/(моль· К) |
76,0˚ |
95,0˚ |
79,1˚ |
- |
| ∆Н˚обр
, кДж/моль |
-346,4˚ |
-440˚ |
-286˚ |
- |
| ∆Н˚пл
, кДж/моль |
20˚ |
22˚ |
- |
18˚ |
| S˚298
, Дж/(моль· К) |
146,9˚ |
180˚ |
142˚ |
- |
Пероксид Сs2
02
– гигроскопичные кристаллы, выше 650 °С разлагается с выделением атомарного кислорода и активно окисляет Ni, Аg, Рt, Аu; давление диссоциации 2261 Па (1103 °С); растворяется в ледяной воде без разложения, при температуре выше 25° С протекает реакция с образованием гидроокисей:
2Ме2
02
+ 2Н2
0 = MеОН + О2
,
а в кислоте происходит выделение перекиси водорода:
Ме2
02
+ Н2
S04
= Ме2
S04
+ Н2
02
.
Гидриды цезия (СsН) – твердые кристаллические вещества, имеют кубическую гранецентрированную решетку типа хлорида натрия, СsН 3,4 г/см3
. Они относятся к солеобразным соединениям, в которых анион Н~ по физическим свойствам близок к ионам галогенида.
Гидриды воспламеняются на воздухе, содержащем следы влаги, самовоспламеняются в атмосфере хлора и фгора; бурно реагируют с водой, выделяя водород:
СsН+ Н2
0= СsОН+ Н2
Гидриды получаются путем гидрирования чистых металлов водородом.
Цезий очень энергично соединяеся с кислородом. Все соединения цезия, содержащие кислород, активно взаимодействуют с влагой и двуокисью углерода воздуха.
Из соединений цезия с более высоким содержанием кислорода известны четыре типа: перекиси (Ме2
0.2
), триокиси [Ме± (02
)3
], надперекиси (Ме02
) и озониды (Ме03
).
Окиси цезия представляют собой прозрачные иглы, расплывающиеся на воздухе. Под действием света окиси разлагаются, давая металл. В вакууме окись цезия возгоняется при температуре (350–450° С), а уже при 500° С образуется 0>2
02
, которая полностью сублимирует. Окиси цезия бурно реагируют с расплавленной серой по реакции:
4Ме2
0 + 7S = Мe2
S04
+ 6Mе.
Безводные гидроокиси цезия представляют собой кристаллические, очень гигроскопичные вещества, переходящие вследствие взаимодействия с Н2
0 и СО в карбонаты. Известно пять кристаллогидратов гидроокисей: МеОН-Н2
0; МеОН-2На
О; МeOН-ЗН, 0; МeOН-4Н2
0 и ЗМеОН-Н2
0. Отмечается, что кристаллизационная вода остается в образцах при температурах, значительно превышающих их температуры плавления.
Растворимость гидроокисей уменьшается с повышением температуры и составляет при 15° С 79,41% (по массе) CsОН. Гидроокиси хорошо растворяются в этаноле, жидком аммиаке и этиловом спирте. На воздухе они расплываются и постепенно переходят в карбонаты, а при 400 – 500° С образуют перекиси.
Расплавленные гидроокиси очень агрессивны: они взаимодействуют с железом, кобальтом, никелем, платиной, разрушают изделия из корунда и двуокиси циркония, растворяют серебро и золото.
Цезий горит в атмосфере галогенов, давая галогениды цезия. Галогениды цезия СsХ, где X = F, С1, Вr, I, – бесцветные кристаллы. Плавятся без разложения, выше температуры плавления летучи, давление пара повышается, а термическая устойчивость понижается при переходе от СsF к CsI; CsВr и CsI в парах частично разлагаются с выделением соответственно Вг2
и I2
. СsI легко окисляется при обычной температуре, на свету его водные растворы желтеют вследствие выделения I2
. Растворимость галогенидов цезия в воде (г в 100 г.): CsР – 530 (25 °С), 608 (50 °С); CsС1 – 162,3 (0,7 °С), 191,8 (25 °С), 229,4 (50 *С); СsВr – 123,5 (25 °
С); СU – 43,1 (0 °С), 85,6 (25 °
С), 160 (61 °С), Из водных растворов кристаллизуются безводные СsСl, CsВr, CsI, кристаллогидраты СsF·nН2
0, где n = 1, 1,5, 3.
Галогениды цезия хорошо растворимы в метаноле, этаноле, муравьиной кислоте, гидразине, плохо – в ацетоне, эфирах, пиридине, ацетонитриле, нитробензоле.
Таблица 3. Растворимость в галогеноводородных кислотах НХ:
| Вещество |
Концетрация в растворе HX и CsX, % по массе (25˚С) |
| HBr |
5,0 |
10,0 |
15,0 |
20,0 |
25,0 |
| CsBr |
49,0 |
40,6 |
33,3 |
27,9 |
23,4 |
| HCl |
4,2 |
11,0 |
15,4 |
20,2 |
22,4 |
| CsCl |
57,9 |
49,1 |
45,5 |
43,1 |
42,4 |
Растворы CsС1 в соляной кислоте используют для его первичного отделения от NaС1 и КС1.
Безводный CsF гигроскопичен, его водные растворы имеют щелочную среду: 2CsР + Н2
0  CsНF2
+ CsОН. Фторид образует гидрофториды: CsF·nНF, где n=1, 2, 3, 6, – бесцветные кристаллы, при п > 2 легко расплываются и разлагаются на воздухе; CsНF2
термически устойчив, отщепляет НF при 500–600 °С; хорошо растворим в воде. CsНF2
+ CsОН. Фторид образует гидрофториды: CsF·nНF, где n=1, 2, 3, 6, – бесцветные кристаллы, при п > 2 легко расплываются и разлагаются на воздухе; CsНF2
термически устойчив, отщепляет НF при 500–600 °С; хорошо растворим в воде.
Галогениды цезия образуют с соответствующими КХ и RbХ твердые раствворы, с NаХ – эвтектические смеси, с LiХ – аддукты, например LiCl·2CsС1. Комплексы CsХ с галогенидами многих элементов, например Cs3
[Sb2
С19
], используют для выделения и определения цезия.
Получают CsХ нейтрализацией Сs2
С03
соответствующей кислотой НХ либо взаимодействием СsSО4
с ВаХ2
в растворе. CsВr и CsI получают в горячем растворе по реакции:
6СsОН + ЗХ2
→5CsХ + СsХ03
+ ЗН2
0
Далее в раствор добавляют активированный уголь, упаривают досуха и прокаливают при 300–450 °С. СsВг и СsI можно получить из Сs2
СО3
или СsНС03
в присутствии восстановителей:
2Сs2
С03
+ 2Х2
+ N2
H 4
→4СsХ + N2
+ 2Н2
0 + 2С02
Галогениды CsВr и Cs1 обладают оптической прозрачностью в интервале длин волн от 500 до 6 • 104
нм, их используют для изготовления призм в ИК спектроскопии; пары CsВг – рабочее тело в плазменных СВЧ установках; монокристаллы Cs1, активированные Т1, используют в сцинтилляционных счетчиках. СsХ – компоненты люминофоров для флуоресцирующих экранов. СsF применяют при получении пьезоэлектрической. керамики, как компонент специальных стекол и эвтектических, композиций для аккумуляторов тепла, CsС1 – электролит в топливных элементах, флюс при сварке Мо.
Таблица 4
| Свойства галогенидов цезия |
| Показатель |
CsF |
CsHF2
|
CsCl |
CsBr |
Csl |
| Сингония |
Кубическая |
Тетрагоническая |
Кубическая |
Кубическая |
Кубическая |
Кубическая |
Кубическая |
Кубическая |
Кубическая |
Кубическая |
| Параметр кристалической решетки a, нм |
0,601 |
0,6146
|
0,412 |
– |
0,411 |
0,694 |
0,429 |
0,723 |
0,457 |
0,766 |
| Число формульных единиц в ячейке |
4 |
– |
1 |
– |
1 |
4 |
1 |
4 |
1 |
4 |
| Пространственная группа |
Fm3m |
14/mcm |
Pm3m |
– |
Pm3m |
Fm3m |
Pm3m |
Fm3m |
Pm3m |
Fm3m |
| Температура плавления,˚С |
703˚ |
58˚ |
177˚ |
180˚ |
470˚ |
646˚ |
– |
637˚ |
– |
632˚ |
| Температура кипения,˚С |
1253˚ |
– |
– |
– |
– |
1295˚ |
– |
1297˚ |
– |
1280˚ |
| Плотность (25˚С), г/см3
|
3,59 |
3,68 |
3,81 |
– |
3,983 |
– |
4,43 |
4,509 |
– |
| С˚р
, Дж/(моль·К) |
51,09 |
87,34 |
– |
– |
52,47 |
– |
52,93 |
– |
52,47 |
– |
| ∆Н˚обр
, кДж/ моль |
-557,1˚ |
-973,2˚ |
4,15˚ |
– |
-442,3˚ |
2,93˚ |
-405,6˚ |
– |
-348,1˚ |
| ∆Н˚пл
, кДж/моль |
21,7˚ |
2,43˚ |
– |
2,76˚ |
– |
20,38˚ |
– |
23,6˚ |
- |
25,65˚ |
| S˚298
, Дж/(моль·К) |
92,96 |
135,3 |
– |
– |
101,17 |
– |
112,94 |
– |
122,20 |
– |
| Показатель преломления прн 20˚С (λ 589 нм) |
1,480 |
– |
– |
– |
1,6397 |
– |
1,6984 |
– |
1,7876 |
– |
Фториды цезия выделяются из водных растворов в виде кристаллогидратов. Они довольно устойчивы; заметно возгоняются при температуре выше 800–900 °С. Фториды хорошо растворяются в воде; их получают нейтрализацией карбонатов цезия избытком плавиковой кислоты с последующим упариванием раствора досуха.
Хлориды цезия выделяются из водных растворов в виде негигроскопичных безводных кристаллов ромбической формы.
Хлориды цезия термически устойчивые соединения, плавящиеся без разложения; они хорошо растворяются в воде и в муравьиной кислоте. В соляной кислоте растворимость хлоридов уменьшается с повышением концентрации НС1. Это свойство широко используется в промышленности.
Бромиды цезия кристаллизуются в виде негигроскопичных безводных кубиков или ромбических додекаэдров. Термически это довольно устойчивые соединения. При нагревании выше температур плавления (682° С для КЬВг; 627° С для ОзВг) они частично разлагаются с выделением брома или бромистово-дородной кислоты.
Бромиды получают взаимодействием нагретого водного раствора гидроокиси цезия и брома:
6CsОН + ЗВг2
= 5СsВг + СsВrOз + ЗН2
0.
После окончания реакции в раствор вводят порошок активированного угля, смесь упаривают досуха, и остаток осторожно прокаливают с углеродом при 300–450° С:
2СsВr03
+ЗС= 2СsВг + ЗС02
.
Иодиды цезия выделяются из водных растворов в виде безводных хорошо выраженных кубических кристаллов, стабильных при нормальной температуре и 'хорошо растворимых в абсолютном спирте и эфире. Сг13
стабилен при нормальной температуре и начинает разлагаться с отделением при 115° С. С повышением температуры растворимость иодидов, как и бромидов цезия, возрастает.
Возгонка иодидов цезия на воздухе сопровождается их частичной диссоциацией с выделением элементарного йода. Иодиды цезия отличаются от других галогенидов повышенной окисляемостью и способностью к образованию продуктов типа MeI • 4S02
. Под действием окислителей иод легко выделяется из разбавленных растворов иодидов рубидия и цезия.
Иодиды цезия можно получить при взаимодействии либо гидроохиси с иодом при нагревании, либо карбонатов с иодом в присутствии восстановителя. В обоих случаях сухой остаток после выпаривания раствора прокаливают и выщелачивают водой. Для очистки иодидов цезияот калия кристаллизацию проводят в присутствии иодистоводородной кислоты при 30° С. При этом содержание примеси калия понижается до 1–10-30
% (по массе). Кристаллы иодидов промывают холодным сухим ацетоном и высушивают в вакууме при 75°С.
Сульфиды СsSn
, (n=1–6) получают взаимодействием металла с S в жидком NН3
.
Сульфаты цезия изоморфны и кристаллизуются в виде бесцветных ромбических кристаллов. Сульфаты и цезия характеризуются сравнительно высокими температурами плавления и летучестью (температура плавления сульфата цезия 1019 °С). Заметное улетучивание сульфатов происходит выше 1400 °С без изменения состава.
При прокаливании в токе водорода или аммиака сульфаты цезия (620–770° С) переходят в сравнительно легкоиспаряющиеся сульфиды. Сульфаты цезия хорошо растворимы в воде, во много раз: лучше, чем сульфат калия. Ниже приведены растворимости сульфатов в воде в зависимости от температуры:
Таблица 5
| Температура, ˚С |
0 |
20 |
40 |
60 |
80 |
100 |
| Растворимость, г/100 г. воды |
| K2SO4 |
7,33 |
11,15 |
14,79 |
18,2 |
21,29 |
24,1 |
| Rb2SO4 |
36,4 |
48,2 |
58,5 |
67,4 |
75 |
81,8 |
| Cs2SO4 |
167,1 |
178,7 |
189,9 |
199,9 |
210,3 |
220,3 |
Сульфаты легко получают взаимодействием серной кислоты с карбонатами цезия или их хлоридами, а также из квасцов, осаждая алюминий квасцов избытком аммиака.
Известны также гидросульфаты (МеНS04
), дисульфаты (Ме2
S2
О7
), пероксосульфаты (Ме2
S2
О8
) цезия. Для получения гидросульфатов сульфаты, карбонаты или хлориды нагревают с избытком серной кислоты при 400–500° С до получения сухого остатка, который растворяют в минимальном количестве воды; раствор упаривают досуха, остаток промывают абсолютным этанолом, затем эфиром.
Шениты цезия Ме2SO4·Ме'SO4·6Н20, где Ме–Сз, а Ме' – Сu, Со, Мg, Мn, Сd, Ni, образуют изоморфные бесцветные или ярко окрашенные кристаллы моноклинной сингонии. При нагревании шениты сначала переходят в дигидраты (70–100° С), а затем полностью обезвоживаются (140 – 200° С). Безводные соли не разлагаются даже при нагревании до 1000° С. В ряду шенитов рубидиевые соли обладают наименьшей растворимостью, что благоприятно при получении чистых препаратов рубидия методом фракционной кристаллизации.
Цезиевыми квасцами называют соединения, общая формула которых Ме-Э (S04
)· 12На
О, где Ме – Cs, а Э – один из следующих трехвалентных катионов: А1, Сr, Fе, Тi, V, Мn, Gа, In, Со. Наибольшее значение в технологии цезия имеют алюмоцезиевые квасцы кристаллизующиеся в виде больших блестящих и прозрачных изотропных октаэдрическнх кристаллов, имеющих кубическую гранецентрировакную решетку типа NaCl.
В ряду щелочных металлов: Na К, Rb и Cs растворимость квасцов понижается с увеличением атомной массы. Например, растворимость разных квасцов в пересчете на безводную соль при 15° С такова, %:
Натриевые 27,9
Калиевые 4,8
Рубидиевые 0,25
Цезиевые 0,35
На рис. 1, где показано влияние температуры на растворимость различных квасцов, видно, что алюмоцезиевые квасцы обладают наименьшей растворимостью по сравнению с другими квасцами
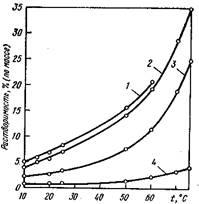
Рис. 1 Растворимость алюмоквасцов аммония (1), калия(2), рубидия(3) и цезия (4) в воде
Алюмоквасцы – это один из первых промежуточных продуктов производства рубидий и цезия из лепидолитов, которые представляют собой изоморфную смесь калиевых, рубидиевых и це-зиевых квасиов. Последующее разделение этих квасцов основано на различной их растворимости и осуществляется многократной фракционной кристаллизацией.
При нагревании алюмоцезиевые квасцы сначала плавятся (при 109 и 122° С соответственно), а затем постепенно теряют гидратную воду. Полное обезвоживание для СsА1 (S04
)·12Н2
0 температуры равны соответственно 235 и 780° С.
Железоцезиевые квасцы имеют достаточно высокий температурный коэффициент растворимости и резко отличаются по растворимости и устойчивости от квасцов щелочных металлов. Этим можно воспользоваться для эффективного отделения цезия от других щелочных металлов.
Для получения квасцов железный купорос сначала окисляют в водном растворе азотной кислотой, а затем смешивают с сернокислым раствором сульфата цезия и упаривают до начала кристаллизации.
Среди марганцевых квасцов наиболее устойчивыми являются цезиево-марганцевые СзМн (304
)г
-12Н2
0. В воде эти квасны гидролизуются с выделением гидратированной трехокиси марганца, плавятся они при 40° С.
Нитраты цезия(МеNОз) представляют собой бесцветные гигроскопичные иглы и призмы. У нитрата цезия известны четыре две модификации.
Термическое разложение нитратов цезияс выделением кислорода
происходит по реакции: 2МеNОз = 2МеNО2 + О2
, при 490° С для цезия.
Как видно на рис. 2 растворимость нитратов в воде с повышением температуры возрастает, но в органических растворителях они нерастворимы.
Нитраты цезия легко получают взаимодействием азотной кислоты с их карбонатами, хлоридами или гидроокисями. Растворимость нитратов в азотной кислоте возрастает в ряду щелочных металлов и не подчиняется правилу периодичности свойств:
NaNОз< RbNОз<СsNОз< КNОз
Карбонаты цезия представляют собой белые очень гигроскопичные непрозрачные ромбические кристаллы, расплывающиеся на воздухе и переходящие вследствие поглощения С02
в соответствующие гидрокарбонаты МеНСО3
·К2
С03
с выделением тепла, для Сs2
С03
11,87 ккал / моль. В атмосфере двуокиси углерода он плавится без заметного разложения при 873° С, но при нагревании их выше температур плавления (особенно в вакууме) наблюдается диссоциация с отщеплением СО2
.
В отличие от карбоната лития карбонаты цезия легко раство
ряются в воде (при 25° С растворимость карбонатов калия, цезия на
100 г. воды соответственно следующая, г: 111,8; 223,0 н 308,3). Карбонат цезия (в отличие от карбонатов рубидия и калия) растворим в абсолютном спирте до 10% при 20° С. На этом свойстве карбоната цезия основана очистка цезия рубидия и калия.
Карбонаты цезия образуют целый ряд кристаллогидратов, точный состав которых до сих пор окончательно не установлен. Для карбоната цезия известны кристаллогидраты: Сs2
С03
·8Н2
O и Сs2
С08
·5Н2
О при низких температурах и 2Сs2
С03
·7Н20 – стабильный при обычной температуре. Полная дегидратация Сs5
С03
проходит при 150° С.
Основной метод получения карбонатов цезия – прокаливание:их тетраоксалатов или кислых тартратов]
Гидрокарбонаты (бикарбонаты) цезияMеНСО3
выделяются в виде безводных призм или игл ромбической сингонии из 13–20%-ных растворов карбонатов при пропускании двуокиси углерода. При нагревании выше 170–180˚
С. гидрокарбонаты разлагаются с выделением двуокиси углерода.
Комплексные соединения цезия. Гетерополисоединения цезия представляют собой соли с комплексными анионами сложного строения.
Крeмнемолибдаты цезия Ме3
Н6
[Si(Мо2
О7
)6
]·Н2
0 сравнительно мало растворимы в воде, серной, азотной и щавелевой кислотах. Растворимость почти не зависит от температуры и при 25° С составляет 0,48г на 100 г. воды. В соляной кислоте растворимость еще меньше.

Рис. 2. Растворимость нитратов цезия (1), калия(2) и рубидия
Кремневольфраматы цезия состава (Сs)8
Si(W8
O7
)8
·nН2
О Плохо растворимы в воде, нерастворимы в спирте и разбавленной соляной кислоте. Обычным методом получения кремнсвольфраматов является взаимодействие кремневольфрамовой кислоты и хлоридов цезия.
Фосфоромолибдаты цезия состава Ме3H4 [Р(Мо3
O7
)6
)]·nН2
О выпадают при взаимодействии фосформолибденовой кислоты и 1%-ных водного раствора CsCl. Растворимость фосфоромолибдатов К RЬ и Сs при 20° С равна 3,8·10-9
, 6,2–10-4
; 5,6–10-4 г в 100 г. воды соответственно; в 0,1н. азотной кислоте растворимость этих солей К, КЬ и Сs составляет соответственно 8,02; 1,7–10-9
и 9,4–10-4 г в 100 г. растворителя. Эннеахлордиарсенаты цезия Ме
9
[As2
С19
] мало растворимы в концентрированной соляной кислоте, растворимость их при 20° С в 100 г. воды 36%-ной НС1 составляет 2,935 и 0,429 г. соответственно. Аналогичной соли калия не обнаружено.
Эннеахлордистнблаты цезияМе3
[SЬ2
С19
] – довольно устойчивые на воздухе соединения, разлагающиеся с выделением SbС18
только при нагревании до 450° С в вакууме. В воде Cs3
[Sb2 С19
] подвергаются сильному гидролизу.
Селенид Сs2
Sе и теллурид Cs2
Te синтезируют сплавлением цезий соответственно с Sе и Те в вакууме. CsN2
в обычных условиях цезий не взаимодействует, с жидким N2
при электрическом разряде между электродами, изготовленными из цезия, образует нитрид Cs3
N. Цезий растворяется в жидком NH3
, алкиламинах и полиэфирах, образуя синие растворы, обладающие электронной проводимостью; в аммиачном растворе цезий медленно реагирует с NH3
с выделением Н2
и образованием амида СsNH2
. С газообразным NH3
при 120 °С образует Cs NH2
, с красным Р в вакууме при 400–430 °С – фосфид Cs2
P, с порошком графита при 200–500 °С – карбид С8
Cs, а при более высоких температурах – С24
Cs, Cs36
Cs и др. карбиды, с ацетиленом при 300 °С в вакууме – ацетиленид Cs2
C2
, с Si и Gе в атмосфере Аr при 600 °С – соответственно силицид CsSi и германид CsСе. Цезий, взаимодействуя с С02
, ССl4
со взрывом. Выше 300 ˚
С разрушает стекло, восстанавливая Si из SiO2
и силикатов. Цезий реагирует со всеми компонентами с образованием соответствующих солей, со спиртами дает алкоголяты.
Цезий образует твердые растворы с К и КЬ, эвтектическая смесь с Nа, не смешивается с Li, Со многими металлами дает интерметаллады, например CsАu, CsSn4.
Распространенность цезия в природе и его производство
В литературе нет точных данных о том, сколько цезия имеется на земном шаре. Известно лишь, что он относится к числу редких химических элементов. Полагают, что его содержание в земной коре во всяком случае в несколько сот раз меньше, чем рубидия, и не превышает 7·10–4
%.
Цезий встречается в крайне рассеянном состоянии (порядка тысячных долей процента) во многих горных породах; ничтожные количества этого металла были обнаружены и в морской воде. В большей концентрации (до нескольких десятых процента) он содержится в некоторых калиевых и литиевых минералах, главным образом в лепидолите. Но особенно существенно то, что, в отличие от рубидия и большинства других редких элементов, цезий образует собственные минералы – поллуцит, авогадрит и родицит. Родицит крайне редок, притом некоторые авторы причисляют его к литиевым минералам, так как в его состав (R2
O · 2Al2
O3
· 3B2
O3
, где R2
O – сумма окисей щелочных металлов) входит обычно больше лития, чем цезия. Авогадрит (K, Cs) [BF4
] тоже редок, да и поллуциты встречаются нечасто; их залежи маломощны, зато цезия они содержат не менее 20, а иногда и до 35%. Наибольшее практическое значение имеют поллуциты США (Южная Дакота и Мэн), Юго-Западной Африки, Швеции и Советского Союза (Казахстан и др.).
Поллуциты – это алюмосиликаты, сложные и весьма прочные соединения. Их состав определяют формулой (Cs, Na) [AlSi2
O6
] · n
H2
O, и хотя цезия в них много, извлечь его не так просто. Чтобы «вскрыть» минерал и перевести в растворимую форму ценные компоненты, его обрабатывают при нагревании концентрированными минеральными кислотами – плавиковой или соляной и серной. Затем освобождают раствор от всех тяжелых и легких металлов и, что особенно трудно, от постоянных спутников цезия – щелочных металлов: калия, натрия и рубидия.
Для извлечения цезия из поллуцита используют следующие методы: кислотные, спекание и сплавление, прямое получение металлического цезия в кислотных методах применяют галогеноводородные кислоты (чаще соляную) или Н2
S04
. Поллуцит разлагают концентрированной соляной кислотой. При разложении поллуцита серной кислотой получают алюмоцезиевые квасцы CsАl(SO4
)2
∙12H2
O
Из методов спекания и сплавления наиболее, распространен метод Аревда: поллуцит спекают со смесью СаО и СаС12
, спек выщелачивают в автоклаве горячей водой, раствор упаривают досуха с Н2
S04
для отделения СаS504
, остаток обрабатывают горячей водой; из полученного раствора осаждают Сs3
[Sb2
С19
]. Прямое извлечение металлического цезия осуществляют путем нагревания до 900 °С в вакууме смеси (1:3) измельченного поллуцита и Са (или А1).
Цезий из лепидолита получают попутно при его переработке на соединения лития. Цезий осаждают из маточных растворов после выделения Li2
СОз или LiОН в виде смеси алюмоцезиевых, алюморубидиевых и алюмокалиевых квасцов.
Для разделения Cs, RЬ и К и получения чистых соединений цезия применяют методы фракционированной кристаллизации квасцов и нитратов, осаждения и перекристаллизации Сs3
[Sb2
Cl9
], Сs2
[SnCl6
]. Используют также ионообменную хроматографию на синтетических смолах и неорганических ионитах (клиноптилолит и другие), экстракцию производными фенола [4-фтор-бутил-2 – (агметилбензил) фенол, алкилфенолы С7-С9 и др.]. Для получения соединений цезия высокой чистоты применяют его полигалогениды.
Извлечение радиоактивного изотопа 137
Cs из растворов, полученных при переработке радиоактивных отходов ядерных реакторов, осуществляют методами соосаждения с гексацианоферратами Fе, Ni, Zn или фосфоровальфраматом аммония, ионного обмена на гексацианоферрате Ni, фосфоровольфрамате аммония и др., экстракционным.
Металлический цезий получают в основном металлотермическим восстановлением СsС1 (кальцием или магнием, 0,1–10 Па, 700–800 °С) с послед, очисткой от примесей ректификацией и вакуумной дистиляцией. По другому способу проводят электролиз расплава CsНа1 с жидким свинцовым катодом и получают сплав Cs-РЪ, из которого выделяют металлический цезий дистилляцией в вакууме. Цезий высокой чистоты получают медленным термическим разложением CsNз в вакууме (менее 10 Па, 390–395 °С).
Определение. Качественно цезий обнаруживают по характерным линиям спектра 894,35 нм и 852,11 нм. Дня микрохимического обнаружения используют осаждение С^З^СЬ], Cs3
[В12
19
], Cs[3п15] и др. менее избирательные реакцииции. Наиболее распространенные методы определения микроколичеств цезия – эмиссионная пламенная фотометрия и атомно-абсорбционная спектрометрия. Применяют также радиохимический метод изотопного разбавления и нейтронно-активационный анализ.
При высоком содержании цезия в пробе его определяют гравиметрически в виде Сs [В(С6
Н5
)4
], СsBi2
I9
, СsТеI6
и некоторыхрых других солей. В гораздо меньшей степени используют тигриметрические и спекгрофотометрические методы.
Современные методы извлечения цезия из поллуцитов основаны на предварительном сплавлении концентратов с избытком извести и небольшим количеством плавикового шпата. Если вести процесс при 1200 °C, то почти весь цезий возгоняется в виде окиси Cs2
O. Этот возгон, конечно, загрязнен примесью других щелочных металлов, но он растворим в минеральных кислотах, что упрощает дальнейшие операции.
Из лепидолитов цезий извлекается вместе с рубидием попутно, как побочный продукт производства лития. Лепидолиты предварительно сплавляют (или спекают) при температуре около 1000 °C с гипсом или сульфатом калия и карбонатом бария. В этих условиях все щелочные металлы превращаются в легкорастворимые соединения – их можно выщелачивать горячей водой. После выделения лития остается переработать полученные фильтраты, и здесь самая трудная операция – отделение цезия от рубидия и громадного избытка калия. В результате ее получают какую-либо соль цезия – хлорид, сульфат или карбонат. Но это еще только часть дела, так как цезиевую соль надо превратить в металлический цезий. Чтобы понять всю сложность последнего этапа, достаточно указать, что первооткрывателю цезия – крупнейшему немецкому химику Бунзену – так и не удалось получить элемент №55 в свободном состоянии. Все способы, пригодные для восстановления других металлов, не давали желаемых результатов. Металлический цезий был впервые получен только через 20 лет, в 1882 г., шведским химиком Сеттербергом в процессе электролиза расплавленной смеси цианидов цезия и бария, взятых в отношении 4:1. Цианид бария добавляли для снижения температуры плавления. Однако барий загрязнял конечный продукт, а работать с цианидами было трудно ввиду их крайней токсичности, да и выход цезия был весьма мал. Вол ее рациональный способ найден в 1890 г. известным русским химиком Н.Н. Бекетовым, предложившим восстанавливать гидроокись цезия металлическим магнием в токе водорода при повышенной температуре. Водород заполняет прибор и препятствует окислению цезия, который отгоняется в специальный приемник. Однако и в этом случае выход цезия не превышает 50% теоретического.
Наилучшее решение трудной задачи получения металлического цезия было найдено в 1911 г. французским химиком Акспилем. При методе Акспиля, до сих пор остающемся наиболее распространенным, хлорид цезия восстанавливают металлическим кальцием в вакууме, причем реакция
2CsCl + Ca → CaCl2
+ 2Cs
идет практически до конца. Процесс ведут в специальном приборе (в лабораторных условиях – из кварца или тугоплавкого стекла), снабженном отростком. Если давление в приборе не больше 0,001 мм рт. ст., температура процесса может не превышать 675 °C. Выделяющийся цезий испаряется и отгоняется в отросток, а хлористый кальций полностью остается в реакторе, так как в этих условиях летучесть соли ничтожна (температура плавления CaCl2
равна 773 °C, т.е. на 100 °C выше температуры процесса). В результате повторной дистилляции в вакууме получается абсолютно чистый металлический цезий.
В литературе описаны еще многие другие способы получения металлического цезия из его соединений, но, как правило, они не сулят особых преимуществ. Так, при замене металлического кальция его карбидом температуру реакции приходится повышать до 800 °C, и конечный продукт загрязняется дополнительными примесями. Можно разлагать азид цезия или восстанавливать цирконием его бихромат, но эти реакции взрывоопасны. Впрочем, при замене бихромата хроматом цезия процесс восстановления протекает спокойно, и, хотя выход не превышает 50%, отгоняется очень чистый металлический цезий. Этот способ применим для получения небольших количеств металла в специальном вакуумном приборе.
Мировое производство цезия сравнительно невелико, но в последнее время оно постоянно растет. О масштабах этого роста можно только догадываться – цифры не публикуются.
Сырьевые источники
Содержание цезия в земной коре а примерно 7–10%. Цезий занимает 49-е место, содержание его в земной коре (по массе) больше, чем кадмия, мышьяка, ртути, сурьмы и ниобия. Поскольку и цезий в минералах (за исключением поллуцита) является компонентными примесями, то обнаружить их в руде можно только аналитическими методами.
Поскольку в настоящее время извлечение цезия из полевых шпатов и слюд (кроме лепидолита) практически еще не освоено, балансовыми являются только запасы цезия в поллуците.
Для цезия в настоящее время известно два минерала: поллуцит и авогадрит. Впервые поллуцит был найден в 1846 г., в миаролито-вых пустотах среди гранитов на о. Эльба (Италия), а в 1891 г. он был найден в Геброне (США) в ассоциации с кварцем и цезий-содержащим бериллом. Поллуцит обычно ассоциируется с полевым шпатом, петалитом, лепидолитом, кварцем, амблигонитом, сподуменом, турмалином, белым и розовым бериллом. Поллуцит является водным алюмосиликатом цезия.
По мере понижения содержания цезия в поллуците (в результате выветривания) в нем увеличивается содержание натрия (1,7–3,9% NaО) и воды (1,5–2,6 не более 4,0%), что объясняется объемным изоморфизмом (замещением Сs+
на Na+
с вхождением в решетку минерала Н2
0).
Важнейшие месторождения поллуцита найдены в Юго-Западной Африке, США, Швеции, Южной Родезии, Канаде, Китае. В виде побочного продукта при обогащении литиевых руд в Южной Родезии и Юго-Западной Африке ежегодно добывается около 100–150 т поллуцита. Мировые запасы этого минерала оцениваются в 300 тыс. т.
Авогадрит-борофторид калия (К, Сs) [ВР4
], в котором калий частично изоморфно замещен цезием. Авогадрит назван в честь итальянского физика Амедо Авогадро. Состав минерала непостоянен, содержание СзВР4
в нем достигает 20%. Авогадрит найден с сасолином Ве(ОН)3
и другими солями на Везувии.
К минералам, в которых содержание рубидия и цезия достигает относительно высоких концентраций, относится также лепидолит, который служит литиевым сырьем. Рубидия в нем содержится от 3 до 4%, цезия до 0,5%. Это самый богатый по содержанию рубидия минерал. Лепидолит встречается исключительно в пегматитах. Важнейшие зарубежные месторождения лепидолита промышленного значения находятся в Юго-Западной Африке, Южной Родезии, США и Канаде.
Основное значение для получения соединений цезия имеет в настоящее время поллуцит, однако цезий извлекают попутно из карналлита. Карналлит – двойной хлорид калия и магния КС1-МgС12
-6Н2
0 – является минеральным образованием и представляет собой типичный продукт последних стадий усыхания морских бассейнов. Рубидий и цезий присутствуют в карналлите как изоморфные заменители калия в кристаллической решетке минерала. Среднее содержание рубидия, в карналлите составляет 0,015–0,04% в пересчете на хлориды, а цезия в десятки раз меньше, чем рубидия.
Всемирно известны месторождения карналлита Соликамское и Стасфуртское. Запасы карналлитов огромны.
В таких же количествах, как в карналлитах, цезий и рубидий содержатся в кионите (КС1 Мб504-ЗН2
0), который также имеется в соляных месторождениях. Гигантские запасы карналлита являются перспективными источниками извлечения рубидия и
цезия. Во многих горных породах соотношение К: КЬ остается постоянным, равным 90,
Цезий поглощаются такими растениями, как чай, кофе и особенно табак. В золе табачных листьев содержание цезия, по исследованиям японских авторов, достигает 0,4–10-2
% КЬ и 0,17–10-4
% Сs.
Обычно основное количество поллуцита отделяют от пегматитовой породы вручную. Исходную руду измельчают до крупности не менее 0,15 мм, обрабатывают серной кислотой до рН = 1,4–2,7, затем добавляют соляную кислоту, небольшое количество сульфата алюминия и катионного реагента – аминоацетата коксового масла. Флотацию проводят с тремя перечистками, при этом из руды, содержащей 8% Сs, получают концентрат, содержащий более 20% Сs. Извлечение цезия составляет 87%.
Все способы разложения поллуцита можно объединить в три группы: кислотные, способы спекания и способы прямого получения цезия. Выбор способа определяется составом и качеством конечного продукта, а также экономическими соображениями.
Кислотные способы.
Для разложения поллуцита используются кислоты: соляная, плавиковая, серная и бромистоводородная. Сущность солянокислого способа заключается в обработке поллуцита при нагревании соляной кислотой с последующим обезвоживанием для удаления Si02
и осаждения цезия в виде комплексной соли Сs3
. Очистка хлорида цезия через эту соль сразу позволяет получать препараты чистотой 99,9%.
Разложение комплексной соли осуществляется следующими способами: 1) гидролизом при нагревании соли с избыточным количеством воды; 2) нейтрализацией раствором аммиака; 3) нагревом в вакууме.
Реакция взаимодействия поллуцита с концентрированной соляной кислотой протекает при нагревании по реакции:
Сs2
0-А12
03
.4SiO2
.nН2
0 + 8НС1 = 2СsС1 + 2А1С13
+ 4Si02
+ (n+4) Н2
0.
Лучшим режимом разложения поллуцита соляной кислотой (температура 100° С, НС1 8,8 н., время 6 ч) можно обеспечить переход в раствор до 95–98% Cs, содержащегося в поллуците.
Наиболее прогрессивен способ разложения двойного хлорида цезия и сурьмы в вакууме при 450° С. Так как SbС18
кипит при 220° С, а СsС1 лишь плавится при 646° С, то SbС13
в условиях процесса легко отгоняется, а хлорид цезия остается в твердой фазе.
Так как по всем указанным вариантам некоторое количество хлорида сурьмы остается в хлориде цезия, то его удаляют с помощью сероводорода после растворения в малом объеме воды. К раствору после отделения сурьмы сероводородом добавляют НС104
(избыток до 100%) для осаждения СsClO4
. Последний после отделения медленно и осторожно нагревают до плавления, получая СsС1 с содержанием суммы примесей ~0,001%.
Для разложения поллуцитового концентрата плавиковой кислотой его измельчают до размера частиц 0,20–0,25 мм, помещают в чугунные реакторы, смешивают с водой и обрабатывают технической (50–60%) плавиковой кислотой, взятой с большим избытком (из расчета 2–2,2 кг кислоты на 1 кг поллуцитового концентрата), при нагревании до температуры кипения и выдерживают при этой температуре в течение 1 ч для удаления кремния в виде SiР4
.
Для получения чистых солей цезия из квасцов их растворяют в кипящей воде, и в раствор добавляют гидрат окиси бария. Алюминий при этом выделяется в осадок в виде А1 (ОН)3
, а сульфат-ионы образуются в виде ВаS04
.
Разложение поллуцита бромистоводородной кислотой получило распространение в связи с возросшей потребностью в бромиде цезия для специальных оптических стекол. Для разложения поллуцита бромистоводородной кислотой его измельчают до 0,074 мм, а затем смешивают с 50%-ной технической кислотой и кипятят в течение 3–4 ч, после чего, раствор отфильтровывают от остатка, состоящего из кремнезема и неразложенных силикатов. Из полученного фильтрата с помощью 30%-ного раствора SbВг3
в 20%-ной бромистоводородной кислоте осаждают малорэствори-мую ярко-желтую комплексную соль состава Сs3
[Sb2
Вг9
]. После отделения маточника проводят двукратную перекристаллизацию соли из 10%-ной бромистоводородной кислоты. Растворимость соли Сs3
[Sb2
Вг9
] в 10%-ной бромистоводородной кислоте при 20° С равна 0,2% (по массе). Высушенную соль нагревают при 450–480˚ С в вакууме, и бромид сурьмы сублимируется, а бромид цезия остается в твердой фазе. Поведение этой соли при нагревании аналогично поведению хлористой комплексной соли Сs3
[Sb2
Вг9
].
Кислотные способы требуют применения больших избытков реагентов, они длительны и сложны в аппаратурном оформлении. Кроме того, разложение кислотами приводит к переходу в растворимое состояние не только цезия, но и алюминия и других примесей. Все это затрудняет применение кислотных способов в промышленности, однако они продолжают совершенствоваться.
Способы спекания.
Способы спекания разработаны менее детально, чем кислотные, но в настоящее время они получили всеобщее признание. В качестве флюсов были опробованы: карбонат кальция, смесь карбонатов натрия и калия, окись и хлорид кальция, смесь карбоната и хлорида натрия.
Хорошие показатели были достигнуты по способу, предложенному Арендой В его основе лежит спекание поллуцита с СаО и СаС12
. Взаимодействие.протекает по следующей суммарной реакции:
Сs2
О-А12
Оа
-4SiO2
-Н2
О + СаС12
+ 5СаО –
=2СsС1 + СаО.А12
03
.2SiO2
+ ЗСаО-SO2
+ 2СаО-SO2
+ Н2
0.
Отсутствие кремния и алюминия в растворах после выщелачивания спеков – большое достоинство метода Аренда. При оптимальных условиях всегда можно добиться практически полного разложения минерала (не менее 98%) и высокой степени чистоты этой соли (99,9%). Метод экономичен и сравнительно прост. Все другие методы переработки поллуцита не обеспечивают в настоящее время столь высоких показателей.
Исследования показали, что основным реагентом при спекании является хлорид кальция, который в расплавленном состоянии действует энергичнее соляной кислоты. Окись же кальция нужна для связывания кремнезема и глинозема. Полученный спек охлаждают, измельчают и обрабатывают горячей водой. Полученную пульпу фильтруют, остаток от фильтрации направляют в отвал. Фильтрат, содержащий сульфаты цезия, рубидия и других щелочных металлов, обрабатывают соляной кислотой и цезий осаждают в виде комплексной соли Сs3
[Sb2
С19
] по способу, описанному ранее. Для получения соли более высокой чистоты проводят ее перекристаллизацию.
Известны также исследования по разложению поллуцитового концентрата путем спекания его с известью без добавок хлористого кальция. Вещественный состав полученного спека следующий, %:
10,5 С52
0-А12
Оя
; 74,3 2СаО-5Ю2
; 7,5СаО-А18
03
; 7,5% суммы Ме2
0-А12
03
.
В промышленности также нашел применение вариант сублимирующего обжига. При этом состав шихты следующий: на 1 ч. по массе концентрата, 2 ч. известняка, 0,23 ч. хлористого кальция. Температуру повышают до 1300° С. Все щелочные металлы возгоняются; при улавливании их образуется конденсат следующего состава, %: 60 Cs; 1,8 Кd; 3,4 К; 2,5 Nа; 25,3 – С13
.
Если добавку хлорида кальция заменить фторидом кальция в количестве 2,5% к массе шихты, температуру спекания можно снизить до 1200˚ С. Извлечение цезия в сублимат в обоих случаях составляет 98%. Для получения из него цезия применяют один из описанных способов очистки от щелочей. Например, возгон окисей щелочных металлов вымывают из конденсата водой и нейтрализуют полученный раствор соляной кислотой. Из этого раствора цезий осаждают концентрированной соляной кислотой и хлоридом сурьмы, получая осадок соли состава Сs3
Sb4
С19
).
Цезий, находящийся в возгонах, можно отделить от других щелочей жидким бромом, в котором растворим только бромистый цезий. Из бромистого цезия можно получить другие нужные соли цезия.
Преимущество способов с возгонкой щелочей перед изложенными ранее – сокращение числа переделов и отсутствие громоздкой гидрометаллургической аппаратуры.
На извлечение цезия из лепидолитового концентрата поступает не сам концентрат, а остаток после извлечения из него лития. Примером может служить способ, предложенный Е.С. Бурксером в 1935 г. По этому методу лепидолит спекают с К2
504
при 1090° С, и спек обрабатывают водой; в раствор при этом переходит литий и частично рубидий, цезий и калий. Основная же часть цезия остается в осадке, который разлагают при 100° С серной кислотой. Далее осадок обрабатывают водой, а затем из концентрированного раствора при охлаждении выкристаллизовывают смесь квасцов калия, рубидия и цезия.
При любом, способе разложения лепидолитового концентрата рубидий и цезий на определенной стадии процесса осаждаются в виде квасцов. При многократной фракционной перекристаллизации квасцов цезий и рубидий отделяются как один от другого, так и от сопутствующего калия. Фракционная перекристаллизация основана на различной растворимости, компонентов. Процесс перекристаллизации длителен и кропотлив. Эмпирическим путем найдено, что для освобождения цезиевых и рубидиевых квасцов от калия необходимо шесть перекристаллизации, а окончательное разделение цезия достигается через 22 перекристаллизации. Существует мнение, что путем перекристаллизации можно получить 90–95%-ную цезиевую соль, затем после растворения в воде вести дальнейшую очистку другими способами.
Применение
Цезий – один из редчайших элементов, но все же следы его можно найти во многих горных породах, в морской воде, а его «связи» с минеральной водой вам уже известны (правда, чтобы получить несколько граммов цезиевых солей, Бунзену пришлось выпарить «всего-навсего» 40 тонн целебного напитка). Любопытно, что «крохи» цезия обнаружены в сахарной свекле, зернах кофе, чайных листьях. Знаком с ним и каждый курильщик: об этом свидетельствуют две голубые линии в спектре табачного пепла. Если бы металлы, подобно спортсменам, могли рассчитывать на приз «За активность», то судейская коллегия из самых авторитетных химиков без колебаний присудила бы его цезию. И дело не только в том, что этот элемент занимает самое «металлическое» место в периодической системе (если не считать франция, которого практически нет в природе), но и в том, что он полностью оправдывает свое «особое положение». Действительно, чистый цезий чрезвычайно активный металл. Оказавшись на воздухе, он немедленно воспламеняется и сгорает. Попадая в компанию с серой или фосфором (не говоря уже об «идейных противниках» всех металлов-галогенах), он тут же начинает бурно «возмущаться», и это всегда приводит к взрыву. Общение цезия с водой также чревато конфликтной ситуацией, сопровождающейся взрывом и пожаром – горит выделяющийся в ходе реакции водород. Даже скромный и смирный (в химическом отношении) лед, который весьма индифферентен к окружающей действительности, не выдерживает нападок цезия и вступает с ним в шумную «перепалку», причем разнять их не может и лютый холод (до -1160
С) – известный «укротитель» химических реакций. Немудрено, что при таком буйном нраве цезия получить его в чистом виде очень сложно.
Сейчас для этой цели используют обычно способ, предложенный еще в 1911 году французским химиком А. Акспилем: цезий вытесняется из его хлорида металлическим кальцием в вакууме при температуре около 7000
С (как видно, кальций-не из робкого десятка). Но вот чистый цезий получен. А как его хранить? Вопрос этот, как вы понимаете, далеко не праздный, а ответ на него – просто парадоксален: чистый цезий нужно… загрязнить, т.е. сплавить с другими металлами. Сплавы цезия не столь «задиристы», как он сам, и хранятся тихо и спокойно, сколько требуется. Выделить же из них цезий помогает отгонка в вакууме. «Свежеприготовленный» цезий – блестящий светлый металл с бледно-золотистым оттенком; он мягкий, как воск, и легкий, как магний или бериллий. Всем известно, что самый легкоплавкий металл – ртуть; в этом отношении у нее нет соперников. Но из всех прочих металлов наиболее «покладист» цезий: он легко переходит в жидкое состояние, так как температура плавления его всего 28,5˚С. Чтобы он растаял, достаточно теплоты человеческих ладоней (надеемся, что помня об опасном характере этого металла, вы не будете проводить такой эксперимент, поскольку он может иметь печальные последствия). Само собой разумеется, изготовлять из цезия детали или изделия, которые должны подвергаться механическим нагрузкам, работать в жарких условиях или находиться в контакте с химическими «агрессорами», занятие, мягко выражаясь, неблагодарное. Так, может быть, этот недотрога «голубых кровей» вообще ни на что не пригоден и представляет интерес лишь сугубо с научной точки зрения? Железу, титану, алюминию он и впрямь не конкурент, зато у него есть такие свойства, какими, кроме него, не обладает ни один металл. А чтобы стало понятно, о чем идет речь, снова совершим небольшой экскурс в прошлый век. В 1887 году известный немецкий физик Генрих Герц открыл явление внешнего фотоэффекта, т.е. «испарения» электронов с поверхности металлов под действием света.
Вскоре профессор Московского университета А.Г. Столетов, заинтересовавшийся этим явлением, провел ряд опытов и на их основе сформулировал теоретические законы фотоэффекта. В чем же его суть? Оказывается, невесомый луч несет с собой энергию, вполне достаточную для того, чтобы выбить из атомов некоторых металлов наиболее удаленный от ядра электрон. Если в разрыв электрической цепи направить вереницу вырвавшихся на волю «узников», то их поток способен замкнуть цепь и в ней появится ток. Говорят, сколько людей – столько мнений. Так и у каждого металла есть свое «мнение» в отношении фотоэффекта. Одни не считают нужным идти на поводу у света: их хоть прожектором «обстреливай», но электронов из них не выбьешь Другие, напротив, без сожаления расстаются с ними, как только на них попадает едва заметный луч. Самый щедрый на электроны металл – цезий, и эта щедрость отнюдь не случайна. У всех щелочных металлов, а цезий – их типичный представитель, на внешней орбите «разгуливает» всего один электрон. Но один в поле не воин, и свет расправляется с ним без особого труда. У цезия к тому же этот одинокий скиталец находится дальше от ядра, чем у его родственников по «щелочной линии». Поэтому работа выхода электрона (так называется тот «труд», который должен затратить световой луч, чтобы отнять у атома электрон) у цезия минимальна, а это значит, что он – самый подходящий материал для фотоэлементов – приборов, превращающих лучи света в электрический ток. Службу в фотоэлементах цезий несет не в одиночку, а, например, в сплаве с сурьмой, причем толщина светочувствительного слоя настолько мала, что одним граммом сплава можно покрыть поверхность примерно в 10 квадратных метров.
Все, кто пользуется услугами метрополитена, каждый день проходят мимо фотоэлементов. Они вмонтированы в контрольные турникеты, устроенные очень просто: с одной стороны – фотоэлемент, с другой – источник света, направляющий луч на своего «визави». Стоит вам, не опустив предварительно пятака, пересечь луч, фотоэлемент включит механизм рычагов и они с грозным лязгом преградят вам путь. Если же вы дадите турникету пятикопеечную «взятку», он сделает вид, что вас не заметил: механизм автоматически отключается, и рычаги не срабатывают. Фотоэлемент – прибор несложный, но очень способный: его можно обучить любой работе. Как только в городе стемнеет, фотоэлемент включает фонари. Если рука рабочего окажется в опасной зоне, этот контролер тут же остановит станок. Фотоэлемент умеет сортировать сигареты, подсчитывать число деталей, проплывающих мимо него на конвейере, проверять, достаточно ли хорошо отшлифована поверхность шариков для подшипников, читать запись на звуковой дорожке киноленты. Надежнее любого сторожа эти чуткие приборы охраняют ночью магазины, банки, склады.
Без фотоэлементов немыслима была бы сама идея передачи изображения на сотни и тысячи километров. Если вы вчера с интересом смотрели по телевизору хоккейный матч, концерт или очередную «порцию» захватывающего многосерийного фильма, то не грех поблагодарить за это цезий: без него ваш телевизор имел бы не больше шансов на передачу изображения, чем ящик из-под макарон. С помощью фотоэлементов удалось «снять копию» обратной стороны Луны. А разве можно было бы передать по проводам чертежи, схемы, портреты, письма, если бы фототелеграфная связь не пользовалась услугами не равнодушных к свету электронов? Конечно, нет. Фотоэлектрические свойства цезия позволили создать интроскоп – прибор, позволяющий заглянуть внутрь непрозрачных тел и заметить в них возможные дефекты.
Чувствительность цезия к инфракрасным лучам лежит в основе конструкции «ночезрительных труб» – так М.В. Ломоносов называл приборы, о которых он мог только мечтать. А сегодня оптический «глаз», способный видеть в темноте, помогает человеку ночью вести автомобиль, прицельно стрелять, обнаруживать различные объекты. До сих пор речь шла о фотоэлектрическом эффекте, но цезий готов поделиться своими электронами «по просьбе» не только света, но и тепла. Благодаря этому свойству он охотнее многих других химических элементов переходит в состояние ионизированного газа – плазмы. Цезиевая плазма представляет огромный научный и практический интерес. В космическом пространстве, например, где степень разрежения очень высока, поток электронов, выделяемых атомами цезия, способен создавать мощную реактивную тягу и придавать ракетам колоссальную скорость – по расчетам некоторых зарубежных ученых, до 44 километров в секунду! Возможно, недалек уже тот час, когда межпланетные корабли на цезиевом «топливе» будут заходить в самые далекие порты и гавани Вселенной. Но цезиевая плазма не теряет времени даром и уже вовсю трудится на Земле. С ее помощью магнитогидродинамические генераторы (МГД-генераторы) преобразуют тепловую энергию в электрическую. Одно из многих достоинств этих генераторов – их простота: единственная движущаяся «часть» в них – поток ионизированного газа, как бы исполняющего обязанности вращающегося ротора. Без цезия не обходятся и термоэмиссионные преобразователи (ТЭП), в которых тепловая энергия ядерного реактора без задержки превращается в электрический ток. Первая мощная установка такого типа – «Топаз» действует в нашей стране.
Цезий отнюдь не обделен вниманием науки: ученые различных стран проводят множество исследований, главный объект которых – цезий. Несколько лет назад физики Билефельдского университета (ФРГ) проделали любопытный эксперимент. Длился он всего десятую долю секунды, а на его подготовку понадобилось… два года. В чем же он заключался? На специальной установке атом цезия был подвергнут бомбардировке сфокусированным импульсом мощного лазера. В результате такого обстрела атом цезия пришел в состояние «крайнего возбуждения»: орбиты электронов растянулись и размеры атома увеличились в десятки тысяч раз. Группа американских физиков из Ок-Риджа (одного из важнейших центров атомной промышленности США) разработала методику, позволяющую пересчитать поштучно атомы некоторых элементов. В основе этой методики также лежит возбуждение атомов с помощью мощных лазерных импульсов. При первой демонстрации нового способа подсчитывались атомы цезия. Ученые из индийского Института геофизических исследований, изучившие воду 60 горячих источников в Гималаях, пришли к выводу, что высокая концентрация цезия в воде может быть признаком магматической активности недр.
Повышенная концентрация радиоактивного изотопа цезия-137 обнаружена в деревьях, сохранившихся в районе знаменитого Тунгусского взрыва, причем химическая аномалия характерна как раз для тех слоев ствола, которые относятся к 1908 году, когда произошло это событие. Нельзя не упомянуть еще об одном очень важном «амплуа» этого элемента. В 1967 году Международная генеральная конференция по мерам и весам установила: «Секунда – время, равное 9192631770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133». Коротко и ясно! Хотите отсчитать секунду, так это проще пареной репы: нужно только подождать, пока электрон цезия перепрыгнет с одной своей орбиты на другую указанное число раз. Конечно, человеку такой подсчет проделать, мягко выражаясь, трудновато, а вот атомные часы на этом принципе уже работают и, надо сказать, неплохо: за три тысячелетия точность их хода может измениться всего на одну секунду. Это возможно благодаря необыкновенной стабильности основных свойств атомов цезия.
О цезии можно рассказывать тысячу и одну ночь: о его каталитических способностях и умении создавать вакуум в радиолампах, о его изотопах, применяемых в медицине, дефектоскопии, измерительной технике, о получении с помощью этого элемента сцинтилляционных монокристаллов, способных светиться холодным голубоватым или зеленоватым светом под действием любого излучения – рентгеновского, ультрафиолетового, радиоактивного. Словом, областям применения цезия, как говорится, несть числа. А перспективы его поистине безграничны!
Сколько цезия в наших продуктах
Ягоды и грибы из чернобыльской зоны, рыбу, выловленную в реке Припять, и много других «даров» чернобыльской природы сегодня можно без проблем приобрести в столице. Издание 24.ua захотело проверить, сколько стронция и цезия содержится в купленной рыбе, колбасе, молоке и твороге. Сделать это было нетрудно: столичная СЭС бесплатно проверяет купленные вами продукты, а за 205 гривен – стройматериалы.
Инженер радиологического отдела рассказал, что «как-то мы проверяли сосиски, и, представьте, количество цезия-137 и стронция-90 в них в несколько раз превышало норму». «Хорошо, что сосиски еще до проверки изъяли из продажи», – отметил он.
Летом торговые точки санитарные врачи проверяют не реже трех раз в неделю. Говорят, что иногда приходится ходить с милицией, поскольку добровольно ни один продавец на рынке не хочет отдавать даже чуть-чуть своего товара на проверку. Больше всего радионуклидов медики находят в грибах и чернике. Но бывают они и в мясе. По данным издания, недавно в СЭС привезли тушу подстреленного на охоте кабана. Вердикт проверки: есть свинину строго запрещено. В прошлом году СЭС вместе с управлением ветеринарной медицины взяла немногим более 576 тысяч проб. В 19 из них цезий и стронций просто зашкаливал. Это были ягоды из пгт Малина и города Овруча Житомирской области, сел Немишаево Киевской области, Киверцы Волынской области, а также грибы и дичь из Вышгородского и Полесского районов Киевщины.
Инженер радиологического отдела по собственному опыту знает, что среди тех даров леса, которые вскоре наполнят рынки и супермаркеты, будут радиоактивные продукты. Именно поэтому врачи призывают горожан проверять купленное – особенно на стихийных рынках. Тем более что все анализы в СЭС сделают абсолютно бесплатно. Для этого нужно только взять килограмм или литр продукции и написать заявление на имя главного санитарного врача Киева.
Поэтому корреспонденты рано утром отправились на стихийные рынки за покупками (им врачи посоветовали брать домашнее мясо и молоко, речную рыбу, свеклу, редиску, лесные ягоды и грибы – именно в этих продуктах может быть повышенное содержание радиоактивных изотопов). Первая покупка была сделана недалеко от метро «Позняки» – купили домашнее молоко. Бабушка-продавец уверяла в его экологической чистоте. Товар она привезла из села Рожев Макаровского района, в пятидесяти километрах от столицы. Далее возле Дарницкого вокзала журналисты взяли килограмм свежего творога из поселка Бабинцы Бородянского района – около тридцати километров на северо-запад от Киева. Продавец никак не могла понять, почему мы решили брать ее товар не попробовав. Женщина даже обиделась и отказалась продавать, пока мы не попробуем кусочек и не похвалим. Пришлось уступить. Возле станции метро «Лесная» купили две палки подозрительно дешевой колбасы якобы из Хмельницкой области – полкило всего 10 грн. На стихийном рынке возле станции «Лукьяновская» взяли три свеклы, выращенные в Мотижине, – село в тридцати километрах от Киева в западном направлении. Возле метро «Нивки» купили редиску, привезенную с огорода возле Броваров. А вот найти свежую рыбу на стихийных рынках не удалось – пришлось брать на стационарном базаре на улице Щербакова. Покупки обошлись в 100 гривен и все продукты отправили в городскую СЭС.
Газета пишет, что лаборатория, где проверяют продукты, – это небольшая комната, заставленная старыми компьютерами и различными устройствами. Тестирование начали с творога. В первую очередь его взвесили: продавец не обманула – продала ровно килограмм. Потом продукт высыпали в специальный лоток, который установили в гамма-спектрометр – аппарат для измерения спектра гамма-излучения. Попутно поинтересовались, можно ли ходить с дозиметром в руках по рынку и сразу на месте проверять продукты. Посмеявшись, Журавлев объяснил, что это бессмысленно – дозиметр не в состоянии уловить такую слабую активность, которую могут проявлять продукты. На компьютере лаборант запустил специальную программу, которая расшифровывает сигналы со спектрометра. Через пятьдесят минут Журавлев показывает результаты – образец содержит только естественный радионуклид калий-40, который есть во всех продуктах. В молоке также не оказалось радиоактивных добавок, хотя именно молоко – основной показатель радиационной зараженности местности.
По словам специалиста, «коровы пасутся на большой территории, если хоть где-то трава содержит цезий-137 и стронций-90, то они обязательно проявятся». «Если с молоком из Рожева все нормально, то, скорее всего, и в других продуктах из села Рожев не будет отклонений», – отметил он.
В подозрительно дешевой колбасе и свекле техногенных радионуклидов также не оказалось. Зато, как только изрубленные тушки судака попали в спектрометр, компьютер выдал наличие цезия-137 – 16,1 Бк/кг. Эта доза в девять раз меньше максимально допустимой, но ведь и норма в Украине – понятие относительное. По словам Журавлева, у нас никто никогда не изучал влияния небольших доз техногенных радионуклидов на человека. Поэтому не исключено, что после того как вы съедите эту рыбу, в организме начнутся необратимые процессы. Хотя выход есть – перед приготовлением рыбу можно замочить на полчаса в уксусе, это поможет очистить ее от части опасных радионуклидов.
Цезий и стронций – радиоактивные изотопы. Попав в организм, они повреждают костную ткань, приводят к химическим нарушениям в клетках, а потом – к раку крови и костей.
|